PENCEMARAN BAHAN PAKAN OLEH Aspergillus flavus
YANG MAMPU MEMPRODUKSI AFLATOKSIN DI
WILAYAH CIANJUR, DEPOK DAN BEKASI TAHUN 2009
(Feed Contamination by Aspergillus flavus Producing Aflatoxin
in Region of Cianjur, Depok and Bekasi in 2009)
ENI KUSUMANINGTYAS danR.MARYAM
Balai Besar Penelitian Veteriner, Jl RE Martadinata No. 30 Bogor 16114
ABSTRACT
Aspergillus flavus and aflatoxin, as its secondary metabolite, are often found in feed. Aflatoxin production of each isolate was different, therefore in this research aflatoxin produced by A. flavus isolate contaminating feed was measured. Samples were taken from three regions of Jabodetabek i.e. Cianjur, Depok, and Bekasi. Assay of ability to produce aflatoxin was conducted by growing A. flavus isolates from samples on to Potato dextrose broth and were incubated at 28oC for 9 days, and then their aflatoxin production were measured. Aspergillus flavus contaminations in feed were from 101 to 105 CFU/g. The ability
to produce aflatoxin varied from not detected to 1212,28 g/ml. Aspergillus flavus isolated from corn sample from Bekasi produced the highest aflatoxin (1212,28 g/ml). It was higher than aflatoxin produced by A. flavus from BBalitvet Culture Collection (BCC) or Japan Collection of Microorganisms (JCM) for 84.48 and 809.43 g/ml respectively. Based on the result, it was concluded that A. flavus isolated from feed samples potentially produced high level of aflatoxin, therefore it might become a thread for animal health.
Key Words: A. Flavus, Aflatoxin, Feed
ABSTRAK
Aspergillus flavus dan aflatoksin sebagai metabolit sekundernya sering ditemukan dalam bahan pakan. Produksi aflatoksin masing-masing isolat berbeda sehingga pada penelitian ini diukur kandungan aflatoksin dari isolat A. flavus yang ditemukan mencemari bahan pakan. Sampel diambil di tiga wilayah Jabodetabek yaitu Cianjur, Depok dan Bekasi. Uji kemampuan menghasilkan aflatoksin dilakukan dengan menumbuhkan isolat A. flavus dari sampel ke dalam media Potato dextrose broth dan diinkubasi pada suhu 28oC selama 9 hari, kemudian diukur produksi aflatoksinnya. Pencemaran A. flavus pada bahan pakan antara 101 sampai 105 CFU/g. Kemampuan menghasilkan aflatoksin bervariasi antara tidak terdeteksi sampai 1212,28 g/ml. Isolat
A. flavus dari sampel jagung asal Bekasi menghasilkan aflatoksin paling tinggi yaitu 1212,28 g/ml. Hasil ini lebih tinggi dari hasil produksi aflatoksin A. flavus isolat BBalitvet Culture Collection (BCC) maupun Japan Collection of Microorganisms (JCM) yaitu 84, 48 dan 809,43 g/ml . Berdasarkan hasil tersebut maka disimpulkan bahwa isolat A. flavus yang diisolasi dari sampel bahan pakan berpotensi menghasilkan aflatoksin dengan kadar tinggi dan berbahaya bagi kesehatan ternak.
Kata Kunci:A. Flavus, Aflatoksin, Bahan Pakan
PENDAHULUAN
Aflatoksin merupakan mikotoksin yang dihasilkan oleh kapang Aspergillus flavus dan
Aspergillus parasiticus. Kapang tersebut banyak ditemukan pada bahan pangan dan pakan di Indonesia yang berasal dari produk pertanian yang digunakan sebagai bahan baku pangan/pakan. Kerugian ekonomi yang
disebabkan oleh cemaran mikotoksin terutama aflatoksin di Asia mencapai 400 juta dolar per tahun (ZANELLI, 2000). Dampak aflatoksin terhadap kesahatan manusia dan hewan telah banyak dilaporkan, dan masalah keamanan pangan semakin menjadi perhatian negara-negara di dunia.
Meskipun belum ada laporan terinci mengenai kerugian ekonomi, namun telah
banyak data penelitian yang menunjukkan adanya kontaminasi aflatoksin pada produksi pertanian dan peternakan yang pada akhirnya berdampak pada perekonomian di Indonesia (BAHRI et al., 2003/2004; BAHRI dan MARYAM, 2003/2004; PRIOSOERYANTO et al., 2002). Selain kerugian ekonomi, kontaminasi aflatoksin pada bahan pangan dan pakan menyebabkan adanya residu dalam tubuh yang dapat mengakibatkan gangguan kesehatan pada manusia dan hewan ternak (DEVEGOWDA et al., 1998; MARYAM et al., 1995; MARYAM, 1996; MARYAMet al., 2003; VAN EIJKERENet al., 2006; DIAZ dan ESPITIA, 2006). PITT dan HOCKING (1997) memperkirakan bahwa setiap tahun kematian 20.000 orang penderita kanker hati di Indonesia disebabkan oleh aflatoksin.
Aflatoksin dikategorikan sebagai mikotoksin utama yang termasuk ke dalam 5 mikotoksin terpenting di dunia. Aflatoksin B1
diklasifikasikan sebagai senyawa karsinogenik Grup IA (WHO-IARC, 1993), dan batas maksimumnya dalam bahan pangan/pakan telah ditentukan oleh sebagian besar negara-negara di dunia termasuk Indonesia (BPOM, 2004). Batas maksimum residu aflatoksin di Indonesia adalah 20 ppb untuk bahan pangan dan 300 ppb untuk pakan/bahan pakan (RUSTOM, 1997), sedangkan WHO/FAO menentukan batas maksimum aflatoksin M1 yang merupakan metabolit aflatoksin B1 dalam susu sebesar 0,5 ppb.
Perubahan iklim dinilai juga berdampak pada kapang penghasil aflatoksin, termasuk perubahan kuantitas kapang di dalam lingkungan dan perubahan terhadap struktur komunitas kapang. Fluktuasi iklim juga mempengaruhi predisposisi inang terhadap kontaminasi dengan perkembangan hasil panen dan pengaruh iklim terhadap serangga yang menginfeksi bahan pakan yang kemudian memudahkan kapang untuk berkembang (COTTY danGRACIA, 2007).
MATERI DAN METODE Isolasi kapang
Isolasi kapang dilakukan terhadap 27 sampel pakan dan bahan pakan berupa kacang tanah, jagung, dan pakan yang diperoleh dari
Jabodetabek. Isolasi dilakukan dengan menggunakan metode biakan berpengenceran. Isolat yang teridentifikasi sebagai A. flavus
selanjutnya dimurnikan dan dikultur kembali untuk persiapan uji produksi aflatoksin.
Uji produksi aflatoksin
Spora A. flavus hasil subkultur dipanen dan dibuat suspensi dengan melarutkan pada air suling steril kemudian dimasukkan ke dalam 20 ml media potato dextrose broth (PDB) pada erlenmeyer 125 ml sehingga tercapai konsentrasi akhir spora 106 CFU/ml. Selanjutnya, suspensi diinkubasi pada suhu 28°C selama 9 hari. A. flavus yang tumbuh dimatikan dengan menggunakan autoclave pada suhu 121°C selama 30 menit. Cairan media diambil 2 ml untuk pemeriksaan aflatoksin.
Pengujian produksi aflatoksin
Pengujian dilakukan dengan menggunakan metode ELISA. Sebanyak 100 µl larutan sampel dipipet dan dicampur dengan konjugat, lalu dipipet kembali sebanyak 75 µl dimasukkan ke dalam lubang mikro plat yang sudah dilapisi dengan antibodi, diinkubasi dan dibiarkan selama 10 menit. Larutan dibuang dan plat dicuci dengan aquadest 3 kali. Tambahkan 100 µl larutan campuran substrat A (asetat buffer) dan substrat B (larutan tetrametilbenzidin/TMB). Diperlukan substrat B 330 µl untuk 11 ml larutan substrat A. Selanjutnya, plat yang sudah ditambahkan substrat dibiarkan selma 10 menit sampai terbentuk warna hijau. Selanjutnya, ditambahkan 50 µl larutan penghenti (1,25 M H2SO4) dan warna larutan menjadi kuning,
kemudian intensitas warna dibaca pada Enzyme linked ELISA reader panjang gelombang 450 nm.
HASIL DAN PEMBAHASAN Kontaminasi A. flavus
Pada penelitian lapang telah dikumpulkan sampel kacang tanah, jagung dan pakan ayam
wilayah Jabodetabek. Sampel diambil dari daerah Cianjur, Depok dan Bekasi. Cianjur dipilih sebagai perwakilan untuk dataran tinggi, sedangkan Depok dan Bekasi dari dataran rendah untuk melihat perbedaan tingkat kontaminasi A. flavus per gram sampel dan kemampuan produksi aflatoksin A. flavus
dari daerah-daerah tersebut. Tabel 1 menunjukkan jumlah koloni kapang A. flavus
dan kapang lain hasil pengenceran sampel-sampel tersebut.
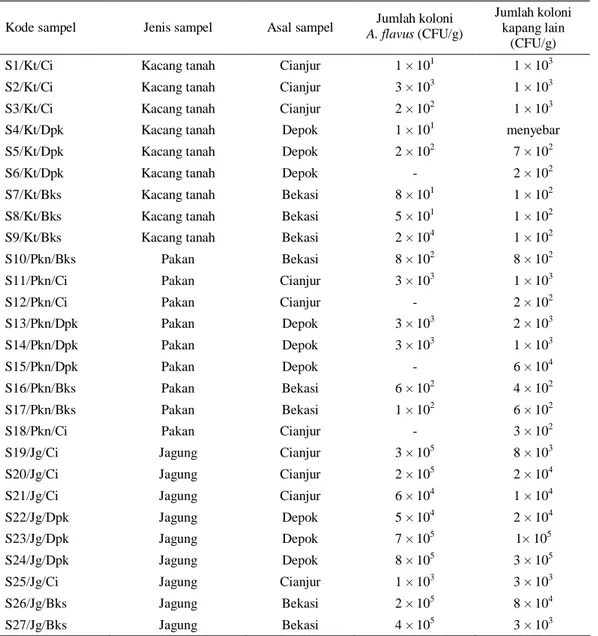
Koloni A. flavus pada sampel yang dikumpulkan berkisar sangat bervariasi yaitu berkisar antara 1×101 - 8×105 koloni per gram, dengan koloni terbanyak ditemukan pada sampel jagung. Hasil ini menunjukkan bahwa jagung merupakan media yang baik untuk pertumbuhan kapang A. flavus, seperti telah banyak dilaporkan sebelumnya (WIDIASTUTIet al., 1988; PITT et al., 1998). Jagung yang diambil adalah jagung pipil yang sudah dipecah sebagai bahan pakan ternak.
Tabel 1. Jumlah koloni kapang per gram sampel yang diperoleh dari wilayah Jabodetabek
Kode sampel Jenis sampel Asal sampel A. flavus Jumlah koloni (CFU/g)
Jumlah koloni kapang lain
(CFU/g) S1/Kt/Ci Kacang tanah Cianjur 1 × 101 1 × 103 S2/Kt/Ci Kacang tanah Cianjur 3 × 103 1 × 103 S3/Kt/Ci Kacang tanah Cianjur 2 × 102 1 × 103 S4/Kt/Dpk Kacang tanah Depok 1 × 101 menyebar S5/Kt/Dpk Kacang tanah Depok 2 × 102 7 × 102
S6/Kt/Dpk Kacang tanah Depok - 2 × 102
S7/Kt/Bks Kacang tanah Bekasi 8 × 101 1 × 102 S8/Kt/Bks Kacang tanah Bekasi 5 × 101 1 × 102 S9/Kt/Bks Kacang tanah Bekasi 2 × 104 1 × 102
S10/Pkn/Bks Pakan Bekasi 8 × 102 8 × 102
S11/Pkn/Ci Pakan Cianjur 3 × 103 1 × 103
S12/Pkn/Ci Pakan Cianjur - 2 × 102
S13/Pkn/Dpk Pakan Depok 3 × 103 2 × 103
S14/Pkn/Dpk Pakan Depok 3 × 103 1 × 103
S15/Pkn/Dpk Pakan Depok - 6 × 104
S16/Pkn/Bks Pakan Bekasi 6 × 102 4 × 102
S17/Pkn/Bks Pakan Bekasi 1 × 102 6 × 102
S18/Pkn/Ci Pakan Cianjur - 3 × 102
S19/Jg/Ci Jagung Cianjur 3 × 105 8 × 103
S20/Jg/Ci Jagung Cianjur 2 × 105 2 × 104
S21/Jg/Ci Jagung Cianjur 6 × 104 1 × 104
S22/Jg/Dpk Jagung Depok 5 × 104 2 × 104
S23/Jg/Dpk Jagung Depok 7 × 105 1× 105
S24/Jg/Dpk Jagung Depok 8 × 105 3 × 105
S25/Jg/Ci Jagung Cianjur 1 × 103 3 × 103
S26/Jg/Bks Jagung Bekasi 2 × 105 8 × 104
Pemecahan biji jagung akan meningkatkan resiko kontaminasi kapang. Biji bagian dalam mengandung banyak karbohidrat sebagai sumber makanan bagi kapang kontaminan terutama A. flavus. Kelembaban yang tinggi dengan ketersediaan karbohidrat sebagai bahan makanan menyebabkan kapang tumbuh dengan cepat.
Seperti terlihat pada Tabel 1, A. flavus
terlihat dominan dan ada di semua sampel yang diambil. Kemampuan A. flavus untuk menghasilkan aflatoksin yang toksik dan karsinigenik sangat berbahaya terhadap hewan ternak dan dapat terdeposit dalam produk ternak yang akan dihasilkan seperti daging dan telor untuk unggas.
Kapang lain yang tumbuh antara lain A. niger, A. fumigatus, A. tereus, Mucor sp, Rhizopus sp, Penicillium sp, Paecylomyce. sp, Mycelia sterilata dengan jumlah total koloni rata-rata yang lebih sedikit dibandingkan dengan A. flavus. Beberapa khamir juga tumbuh tetapi hanya beberapa sampel yang terkontaminasi dan bukan dari spesies yang berbahaya. Kapang lain tersebut tumbuh bersama dengan A. flavus dan memungkinkan adanya sinergi maupun kompetisi sehingga dapat menyuburkan atau menghambat pertumbuhan A. flavus sebagai pencemar utama. Kompetisi dengan kapang yang lain dapat saja tidak mempengaruhi pertumbuhan
A. flavus tetapi mampu menghambat produksi aflatoksin (KUSUMANINGTYASet al., 2006)
Kemampuan produksi aflatoksin
A. flavus hasil isolasi selanjutnya diuji kemampuan untuk memproduksi aflatoksin. Dengan mengetahui kemampuan produksi aflatoksinnya, dapat diperkirakan tingkat pencemaran yang disebabkan oleh A. flavus dan diketahui pula tingkat bahayanya. Produksi aflatoksin dari beberapa isolat yang ditemukan seperti tercantum pada Tabel 2.
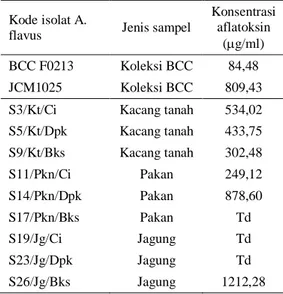
Dari Tabel 2 diketahui bahwa kemampuan untuk memproduksi aflatoksin masing-masing isolat berbeda-beda. A. flavus isolat koleksi Bbalitvet, BCC F0213 dan isolat reference dari
Japan Culture Microorganisms JCM 1025 digunakan sebagai pembanding. Dari Tabel 2 diketahui bahwa isolat asal Bekasi dengan
Tabel 2. Kemampuan produksi aflatoksin dari A. flavus isolat lapang dan perbandingannya dengan A. flavus BCC 213, JCM 1025 Kode isolat A.
flavus Jenis sampel
Konsentrasi aflatoksin
(g/ml) BCC F0213 Koleksi BCC 84,48 JCM1025 Koleksi BCC 809,43 S3/Kt/Ci Kacang tanah 534,02 S5/Kt/Dpk Kacang tanah 433,75 S9/Kt/Bks Kacang tanah 302,48 S11/Pkn/Ci Pakan 249,12 S14/Pkn/Dpk Pakan 878,60 S17/Pkn/Bks Pakan Td S19/Jg/Ci Jagung Td S23/Jg/Dpk Jagung Td S26/Jg/Bks Jagung 1212,28 Td: tidak terdeteksi/tidak ada
kemampuan untuk memproduksi aflatoksin paling tinggi bahkan lebih tinggi dari isolat BCC F0213 dan JCM1025. Hasil tersebut apabila dihubungkan dengan Tabel 1 yaitu jumlah koloni per gram sampel juga lebih tinggi dibandingkan yang lain yaitu 2 × 105 CFU/gram maka perlu diwaspadai. Tingkat pencemaran A. flavus yang tinggi dan kemampuan A. flavus-nya untuk memproduksi aflatoksin juga tinggi akan menambah tingkat pencemaran dan tingkat bahaya bahan pakan tersebut.
BAHRI et al. (2003/2004) menyatakan bahwa lebih dari 80% pakan unggas komersial terkontaminasi aflatoksin. Metabolit sekunder kapang Aspergillus flavus dan Aspergillus parasiticus ini tidak hanya berpengaruh terhadap kesehatan dan produktivitas ternak, tetapi juga menyebabkan residu pada produk peternakan seperti daging, hati, telur dan susu yang dapat membahayakan kesehatan konsumen (MARYAM et al., 1995; MARYAM, 1996; MARYAM, et al., 2003).
Aflatoksin bersifat hepatokarsinogenik, mutagenik, teratogenik dan imunosupresif pada hewan. Ikatan kimia antara aflatoksin dan sitokrom P450 pada hati mengaktifkan AFB1-guanidin dalam DNA yang menyebabkan kanker hati pada hewan tertentu. Hewan ternak
mengkonsumsi pakan terkontaminasi aflatoksin pada dosis subletal menyebabkan kerusakan hati. Hampir semua jenis unggas sensitif terhadap aflatoksin, terutama hewan muda. Hewan muda cenderung lebih rentan terhadap pengaruh aflatoksin dibandingkan dengan hewan yang lebih dewasa (BALL, 1998). Ransum yang mengandung 20 μg aflatoksin menurunkan resistensi ayam terhadap serangan penyakit dan menyebabkan stres (COELHO, 1990). Di alam terdapat 4 jenis aflatoksin, yaitu aflatoksin B1 (AFB1), B2 (AFB2), G1 (AFG1) dan G2 (AFG2). Di antara jenis-jenis aflatoksin tersebut, AFB1 merupakan senyawa yang paling berbahaya bagi hewan dan manusia dan dikategorikan sebagai senyawa karsinogenik grup IA.
Hasil pemeriksaan aflatoksin pada Tabel 2 merupakan aflatoksin total, belum dibedakan aflatoksin B1, B2, G1 atau G2. Pada isolat S26/jg/Bks yang mampu menghasilkan aflatoksin tinggi, selain resiko bahaya, isolat ini dapat digunakan sebagai kandidat untuk produksi aflatoksin sebagai bahan standar deteksi aflatoksin.
KESIMPULAN
Kontaminasi pakan dan bahan pakan oleh
A. flavus dan aflatoksin harus diwaspadai mengingat aflatoksin merupakan zat yang bersifat toksik dan karsinogenik. Hasil pemeriksaan sampel pakan dan bahan pakan di tiga wilayah Jabodetabek yaitu Cianjur, Depok dan Bekasi menunjukkan tingkat kontaminasi
A. flavus ringan sampai sedang yaitu 101 sampai 105 CFU per gram sampel dengan kemampuan produksi aflatoksin antara tidak terdeteksi sampai 1212, 28 g/ml media cair. Hal ini menunjukkan bahwa A. flavus dalam jumlah terbatas sudah dapat membahayakan kesehatan hewan dan berisiko menimbulkan residu pada produknya.
DAFTAR PUSTAKA
BAHRI, S. dan R. MARYAM 2003/2004. Mikotoksin berbahaya dan pengaruhnya terhadap kesehatan hewan dan manusia. J. Mikologi Kedokteran Indonesia 4 – 5(1 – 2): 31 – 34.
BAHRI, S., R. MARYAM dan R. WIDIASTUTI. 2003/2004. Tinjauan efek mikotoksin terhadap performan unggas. J. Mikologi Kedokteran Indonesia 4 – 5(1 – 2): 53 – 64.
BALL, J. 1998. Understanding and preventing aflatoksin poisoning. The Samuel Roberts Noble Foundation, Inc.
BPOM (BADAN PENGAWAS OBAT dan MAKANAN). 2004. Keputusan Kepala Badan Pengawas Obat dan Makanan Republik Indonesia No. HK.00.05.1.4057 tentang Batas Maksimum Aflatoksin dalam Produk Pangan.
COELHO,M.B. 1990. Molds, Mycotoxins and Feed
Preservatives in the Feed Industry. BASF Corporation, Cherry Hill Road, Parsippany, pp. 159.
COTTY,P.J. and R. JAIME-GARCIA . 2007. Influences
of climate on aflatoxin producing fungi and aflatoxin contamination. Int. J. Food Microbiol. 119(1 – 2):109 – 15.
DEVEGOWDA G.,MVLN.RAJU,N.AFZALI and HVLN. SWAMY. 1998. Mycotoxin picture worldwide: Novel solutions for their counteraction. Passport to the Year 2000: Biotechnology in Feed Industry. Proceedings of Alltech’s 14th Annual Symposium. pp. 241 – 255.
DIAZ, GJ. and E. ESPITIA 2006. Occurence of aflatoxin M1 in retail milk samples from Bogota, Columbia. Food Additives and Contaminants 23(8): 811 – 815.
KUSUMANINGTYAS E, R. WIDIASTUTI and R. MARYAM. 2006. Reduction of aflatoxin B1 in chicken feed by using Saccharomyces cerevisiae, Rhizopus oligosporus and their combination. Mycopathologia. 162(4): 307 – 311.
MARYAM, R., BAHRI, S. dan ZAHARI, P. 1995.
Deteksi aflatoksin B1, M1 dan aflatoksikol
dalam telur ayam ras dengan kromatografi cair kinerja tinggi. Pros. Seminar Nasional Teknologi Veteriner untuk Meningkatkan Kesehatan Hewan dan Keamanan Bahan Pangan Asal Ternak. Cisarua, Bogor 22 – 24 Maret 1994. Puslitbang Peternakan. hlm: 412 – 416.
MARYAM R. 1996. Residu aflatoksin dan metabolitnya dalam daging dan hati ayam. Pros. Temu Ilmiah Nasional Bidang Veteriner. Bogor 12 – 13 Maret 1996. hlm: 336 – 338.
MARYAM,R.,Y.SANI,S.DJUARIAH,R.FIRMANSYAH
dan MIHARJA. 2003. Efektivitas ekstrak bawang putih (Allium sativum linn.) dalam penanggulangan aflatoksikosis pada ayam petelur. JITV8(4): 239 – 246.
PITT,J.I. and A.D. HOCKING.1997. Fungi and Food Spoilage 2nd Edition. Blackie Academic & Professional. An Imprint of Chapman & Hall. pp. 593.
PITT, J.I., A.D. HOCKING, B.F. MISCAMBLE, O.S. DARMAPUTRA,K.R.KUSWANTO,E.S. RAHAYU
and SARDJONO. 1998. The mycoflora of food commodities from Indonesia. J. Food Mycology 1(1): 41 – 60.
PRIOSOEYANTO,B.P.,H.HUMINTO,S.ESTUNINGSIH,
E. HARLINA and R. TIURIA. 2002. J. Mikologi Kedokteran 3(1 – 2): 24 – 27.
RUSTOM I.Y.S. 1997. Aflatoxin in food and feed: Occurrence, legislation and inactivation by physical methods. Food Chemistry 59: 57 – 67.
VAN EIJKEREN, J.C.H., M.I. BAKKER and M.J. ZEILMAKER. 2006. A simple steady-state model for carry-over of aflatoxins from feed to cow’s milk. Food Additives and Contaminants 23(8): 833 – 838.
WHO-International Agency for Research on Cancer.
1993. IARC Monographs on Evaluation of Carcinogenic Risks to Humans.
WIDIASTUTI,R.,R.MARYAM,BJ.BLANEY,SALFINA
and D.R.STOLTZ. 1988. Corn as a source of mycotoxins in Indonesia Pultry Feeds and the Effectiveness of Visual Examination Methods for Detecting Contaminations. Mycopathologia 102: 45 – 49.
ZANELLI, L. 2000. Moulds, bacteria and solutions.
Feed Industry Service FIS- Italy.
DISKUSI Pertanyaan:
Faktor apa yang menyebabkan perbedaan hasil aflatoksin dari isolat lapang yang berbeda. Sampel dari Bekasi lebih tinggi alfalfanya.
Jawaban:
Yang menyebabkan perbedaan produksi aflatoksin adalah:
1. Isolat Aspergilus flavusnya: Masing-masing isolat secara genetis memiliki kemampuan untuk menghasilkan aflatoksin yang berbeda, sebagai contoh ada A. flavus yang memang tidak bisa menghasilkan aflatoksin.
2. Substrat tempat hidup: A. flavus yang sama apabila ditumbuhkan dalam substrat yang berbeda misalnya di jagung dengan kacang menghasilkan konsentrasi aflatoksin yang berbeda.
3 Faktor lain misalnya pH.
Karena pada uji produksi aflatoksin, perlakuan terhadap semua isolat sama maka diduga A. flavus dari Bekasi secara genetis memang mampu menghasilkan aflatoksin yang tinggi.