BAB 2
TINJAUAN PUSTAKA
2.1 Tumbuhan Benalu
Benalu (Loranthus) merupakan jenis tumbuhan yang hidupnya tidak memerlukan media tanah. Ia hidup sebagai parasit (parasiet=Belanda), menempel pada dahan-dahan pohon kayu lain dan menghisap mineral yang larut dalam pohon kayu yang ditempelinya sehingga bisa mati. Bunga benalu berkelamin tunggal biji buahnya mengandung getah. Pengembangbiakannya melalui binatang atau burung yang memakan biji buah benalu tersebut. Proses pengembangbiakannya sangat sederhana, biji benalu yang bergetah itu dimakan binatang atau burung. Kemudian biji benalu tersebut melekat di dahan bersama dengan kotoran burung yang memakannya, dan tumbuh di dahan tersebut. (Arisandi, 2008).
Tanaman benalu selama ini telah digunakan sebagai tanaman obat, seperti obat batuk, kanker, diuretik, dan pengobatan setelah melahirkan. Bagian dari benalu yang berkhasiat sebagai tanaman obat adalah bagian daun benalu, seperti pada benalu teh, mangga, dan duku. Potensi benalu sebagai tanaman obat apabila terus dikembangkan maka akan menghasilkan manfaat yang besar, yaitu mengurangi biaya pengobatan sekaligus meningkatkan devisa negara (Handayani, 2011).
Aktivitas benalu dikarenakan adanya senyawa marker keluarga Loranthaceae berupa flavonoid kuersetin (Ikawati et al. 2008). Kuersetin merupakan suatu aglikon flavonoid yang mempunyai gugus polifenol, sehingga komponen fenoliknya yang sangat reaktif dapat menstabilkan senyawa dan sebagai antioksidan.
Senyawa aktif dalam daun benalu mengandung quersetin, alkaloida,saponin, flavonoid, dan tanin. Setiap kandungan ini memang sangat bergantung dari jenis pohon induk yang dia tumpangi.
Senyawa flavonoida merupakan senyawa yang dapat mencegah tumbuhnya sel kanker, sedangkan senyawa antioksidan dapat menangkal adanya radikal bebas dan mencegah penuaan dini (Tyas, 2011).
2.2 Tumbuhan Benalu Nangka
Macrosolen cochinchinensis(benalu nangka) berbentuk perdu bercabang banyak. Ranting dengan buku-buku yang membesar. Daun seperti kulit, mengkilat. Pada pangkal setiap bunga terdapat tiga daun kecil. Mahkota berlima. Buah bulat peluru, yang masak coklat lembayung tua (Semangun, 1996).
Sistematika tumbuhan benalu nangkamenurut Herbarium Medanense USU adalah sebagai berikut :
Kingdom : Plantae
Divisi : Spermatophyta
Class : Dycotyledoneae
Ordo : Santalales
Famili : Loranthaceae
Genus : Macrosolen
Spesies : (Macrosolen cochinchinensis
(Lour). Van Tiegh)
Nama Lokal : Benalu Nangka
2.3 Senyawa Flavonoida
Flavonoid mencakup banyak pigmen yang paling umum dan terdapat pada seluruh dunia tumbuhan mulai dari fungus sampai angiospermae. Pada tumbuhan tinggi, flavonoid terdapat baik dalam bagian vegetatif maupun dalam bunga. Sebagai pigmen bunga, flavonoid berperan jelas dalam menarik burung dan serangga penyerbuk bunga. Efek flavonoid terhadap macam-macam organisme sangat banyak macamnya dan dapat menjelaskan mengapa tumbuhan yang mengandung flavonoid dipakai dalam pengobatan tradisional. Flavonoid dapat bekerja sebagai inhibitor kuat pernapasan juga bertindak sebagai penangkal yang baik terhadap radikal hidroksi dan superoksida, maka dengan demikian dapat melindungi lipid membran terhadap reaksi-reaksi yang merusak. Beberapa flavonoid dapat menghambat fosfodiesterase. Aktivitas antioksidannya mungkin dapat menjelaskan mengapa flavonoid tertentu merupakan komponen aktif tumbuhan yang digunakan secara tradisional untuk mengobati fungsi hati (Robinson, 1995).
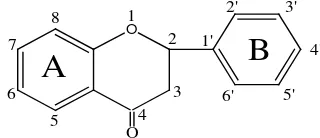
2.3.1 Struktur Dasar Senyawa Flavonoida
Golongan flavonoid dapat digambarkan sebagai deretan senyawa C6-C3-C6(Gambar
2.1). Artinya, kerangka karbonnya terdiri atas dua gugus C6
Gambar 2.1 Struktur Dasar Flavonoid(Manitto, 1981)
(cincin benzena tersubstitusi) yang disambungkan oleh rantai alifatik tiga-karbon: (Robinson, 1995).
Sistem penomoran untuk turunan flavonoid diberikan di bawah:
2.3.2 Klasifikasi Senyawa Flavonoida
a. Flavonoid O-glikosida
Flavonoid biasanya terdapat sebagai flavonoid O-glikosida; pada senyawa tersebut satu gugus hidroksil flavonoid (atau lebih) terikat pada satu gula (atau lebih) dengan ikatan hemiasetal yang tak tahan asam. Pengaruh glikosilasi menyebabkan flavonoid menjadi kurang reaktif dan lebih mudah larut dalam air (cairan); sifat terakhir ini memungkinkan penyimpanan flavonoid di dalam vakuol sel (di sinilah biasanya flavonoid berada).
Glukosa merupakan gula yang paling umum terlibat, walaupun galaktosa, ramnosa, xilosa, dan arabinosa sering juga terdapat.
b. Flavonoid C-glikosida
Gula dapat juga terikat pada atom karbon flavonoid dan dalam hal ini gula tersebut terikat langsung pada inti benzena dengan suatu ikatan karbon-karbon yang tahan asam (bandingkan dengan O-glikosida). Glikosida yang demikian disebut C -glikosida.
Sekarang gula yang terikat pada atom C hanya ditemukan pada atom C nomor 6 dan 8 dalam inti flavonoid. Jenis gula yang terlibat jauh lebih sedikit ketimbang jenis gula pada O-glikosida, biasanya dari jenis glukosa yang paling umum (misalnya viteksin, orientin), dan juga galaktosa, ramnosa, xilosa, dan arabonisa. Jenis aglikon flavonoid yang terlibat pun sangat terbatas. Jadi, walaupun isoflavon, flavanon, dan flavonol kadang-kadang terdapat dalam bentuk C-glikosida, sebegitu jauh hanya flavon C-glikosida yang paling lazim ditemukan (Markham, 1988).
Ikatan karbon-karbon sangat tahan terhadap hidrolisis asam sehingga membedakan C-glikosida dengan O-glikosida yang lebih mudah terhidrolisis menjadi nisbi mudah
c. Flavonoid Sulfat
Golongan flavonoid lain yang mudah larut dalam air yang mungkin ditemukan hanya flavonoid sulfat. Senyawa ini mengandung satu ion sulfat, atau lebih, yang terikat pada hidroksil fenol atau gula. Secara teknis senyawa ini sebenarnya bisulfat karena terdapat sebagai garam, yaitu flavon-O-SO3 K.
d. Biflavonoid
Biflavonoid adalah flavonoid dimer, walapun prosianidin dimer (satuannya katekin) biasanya tidak dimasukkan ke dalam golongan ini. Flavonoid yang biasanya terlibat ialah flavon dan flavanon yang secara biosintesis mempunyai pola oksigenasi yang sederhana 5,7,4’ atau kadang-kadang 5,7,3’ , 4’) dan ikatan antar-flavonoid berupa ikatan karbon-karbon atau (kadang-kadang) ikatan eter. Monomer flavonoid yang digabungkan menjadi biflavonoid dapat berjenis sama atau berbeda, dan letak ikatannya berbeda-beda. Banyak sifat fisika dan kimia biflavonoid menyerupai sifat monomer pembentuknya dan akibatnya, kadang-kadang biflavonoid sukar dikenali. Biflavonoid jarang ditemukan sebagai glikosida, dan penyebarannya terbatas, terdapat terutama pada gimnospermae.
e. Aglikon flavonoid yang optis-aktif
Aglikon flavonoid mempunyai atom karbon asimetrik dan dengan demikian menunjukkan keaktifan optik (yaitu memutar cahaya terpolarisasi-datar). Yang termasuk dalam golongan flavonoid ini ialah flavanon, dihidroflavonol, katekin, pterokarpan, rotenoid, dan beberapa biflavonoid(Markham, 1988).
Robinson (1995)menggolongkanflavonoida berdasarkan tahanan oksidasi dan keragaman lain pada rantai C3
1. Flavonol
yaitu :
Flavonol (Gambar 2.3) sangat tersebar luas dalam tumbuhan, baik sebagai kopigmen antosianin dalam daun bunga maupun dalam daun tumbuhan tinggi. Seperti antosianin, mereka paling sering terdapat sebagai glikosida. Walaupun telah dikenal dua atau tiga ratus aglikon flavonol, yang umumnya hanya tiga saja: kamferol, kuersetin, dan mirisetin (Harborne, 1973).
O O
OH
Gambar 2.3Struktur Flavonol (Crozier et al. 2006)
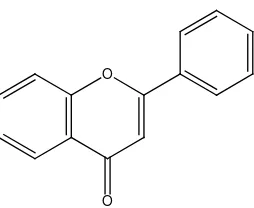
2. Flavon (Dihidroflavonol)
Flavon memiliki struktur (Gambar 2.4) yang sangat mirip dengan flavonol. Namun flavon tidak tersebar secara luas seperti flavonol. Hanya ada dua flavon umum, yaitu apigenin dan luteolin (Crozier et al. 2006). Flavon terdapat juga sebagai glikosida tetapi jenis glikosidanya lebih sedikit daripada jenis glikosida flavonol. Tidak seperti flavonol, pada flavon sungguh ajaib, terdapat juga terikat pada gula melalui ikatan karbon-karbon (Harborne, 1987).
O O
3. Isoflavon
Senyawa-senyawa isoflavon berlainan dengan flavonoid pada kedudukan dari cincin aromatik B pada rantai propana sentral (Manitto, 1981). Isoflavon tidak begitu menonjol, tetapi senyawa ini penting sebagai fitoaleksin (Robinson, 1995). Fitoaleksin yaitu senyawa pelindung yang terbentuk dalam tumbuhan sebagai tanggapan terhadap serangan penyakit (Harborne, 1978). Isoflavon lebih baik dikarakterisasi melalui cincin B yang terikat pada C3 daripada posisi C2 (Gambar 2.5). Isoflavon ditemukan hanya pada tanaman Legumonasae, dengan konsentrasi tertinggi pada kacang kedelai (Glycine max) (Crozier et al. 2006).
O O
Gambar 2.5 Struktur Isoflavon (Crozier et al. 2006) 4. Flavanon (Dihidroflavon)
Flavanon dikarakterisasi dengan tidak adanya ikatan rangkap pada C2 dan C3 dan dengan adanya pusat atom kiral pada C2 (strukturnya dapat dilihat pada Gambar 2.6) (Crozier et al. 2006). Flavanon sering ditemukan sebagai aglikon, tetapi ada beberapa glikosidanya yang terkenal, misalnya hesperidin dan naringin dari kulit buah jeruk (aglikonnya hesperitin dan naringenin).
Semua senyawa flavanon yang ditemukan di alam mempunyai konfigurasi (2S) dan memutar bidang polarisasi ke kiri (Manitto, 1981). Flavanon terkonsentrasitinggi dalam buah jeruk (Crozier et al. 2006).
O O
5. Flavanonol
Flavanonol (atau dihidroflavonol) (Gambar 2.7) barangkali merupakan flavonoid yang paling kurang dikenal, dan tidak diketahui apakah senyawa ini terdapat sebagai glikosida. Beberapa senyawa yang diasetilasi dikenal karena rasanya yang sangat manis. Tidak seperti leukoantosianidin, senyawa ini stabil dalam asam klorida panas, tetapi terurai oleh basa hangat menjadi kalkon. Satuan jenis barangkali terdapat dalam lignin ampas. Satuan monomer lignin ini disebut ‘flavonolignan’ (Robinson, 1995).
O
OH
O
Gambar 2.7 Struktur Flavanonol (Robinson, 1995)
6. Antosianin
Antosianin ialah pigmen daun merupakan pewarna yang paling penting dan paling tersebar luas dalam tumbuhan. Pigmen yang berwarna kuat dan larut dalam air ini adalah penyebab hampir semua warna merah jambu, merah marak, merah, merah senduduk, ungu, dan biru dalam daun, bunga, dan buah pada tumbuhan tinggi (Harborne, 1973).Tidak seperti golongan flavonoid lainnya, antosianin selalu terdapat sebagai glikosida, seperti yang terlihat pada Gambar 2.8 (Robinson, 1995).
O+
O
Glikosida
7. Antosianidin
Antosianidin (Gambar 2.9) merupakan aglikon antosianin yang terbentuk bila antosianin dihidrolisis dengan asam (Harborne, 1987). Seperti halnya turunan terkonjugasinya, antosianin, antosianidin tersebar luas pada tumbuhan, secara khusus pada jaringan bunga dan buah, yang merupakan pemberi warna merah, ungu dan biru jaringan tersebut. Senyawa ini juga ditemukan pada jaringan daun, batang, biji dan akar. Antosianidin terlibat dalam melindungi tanaman dari cahaya yang berlebihan dengan ‘meneduhkan’ sel mesofil daun dan juga berperan penting dalam menarik serangga dalam penyerbukan (Crozier et al. 1995). Antosianidin yang paling umum sampai saat ini ialah sianidin, yang berwarna merah lembayung (Harborne, 1987).
O+
OH
Gambar 2.9Struktur Antosianidin (Crozier et al. 2006) 8. Auron
Auron (atau 2-benzilidena-kumaran-3-on) (Manitto, 1981) berupa pigmen kuning emas terdapat dalam bunga tertentu dan bryofita. Dikenal hanya lima aglikon, tetapi pola hidroksilasi senyawa ini umumnya serupa dengan pola pada flavonoid lain begitu pula dengan bentuk yang dijumpai ialah bentuk glikosida dan eter metil. Dalam larutan basa senyawa ini menjadi merah ros. Beberapa contoh auron dan glikosidanya adalah leptosin, aureusidin, sernosida, dan sulfuretin (Robinson, 1995). Struktur umum auron dapat dilihat pada Gambar 2.10 dibawah:
9. Kalkon dan Dihidrokalkon
Kalkon (Gambar 2.11) merupakan ‘antoklor’ yaitu pigmen kuning yang dapat dideteksi bila daun bunga yang berwarna kuning diasapi dengan asap basa dari sebatang cerutu, atau diuapi dengan uap amonia, warnanya berubah mejadi jingga atau merah. Senyawa ini khasnya terdapat pada Compositae (terutama Corcopsis) dan lebih dari 10 suku lain. Salah satu contoh kalkon adalah lutein, yang terdapat di alam sebagai glikosida.
Pola penyebaran dihidrokalkon berbeda dengan pola penyebaran kalkon, yaitu terbatas hanya pada Rosaceae dan Ericaceae. Floridzin, senyawa dihidrokalkon yang diisolasi dari apel, berperan dalam ketahanan tumbuhan tersebut terhadap penyakit (Harbone, 1987).
Gambar 2.11 Struktur Kalkon (Robinson, 1995)
10.Leukoantosianidin (Flavan-3,4-diol)
Tidak seperti flavon, flaovonol, isoflavon dan antosianidin yang molekulnya planar, leukoantosianidin mempunyai C3 yang tak jenuh pada cincin heterosikliknya, yang menyebabkannya tidak planar (Gambar 2.12). Dua atom pusat kiral pada C2 dan C3-nya menghasilkan empat isomer untuk tiap tingkatan hidroksilasi cincin-B, dua diantaranya (+)-katekin dan (-)-epikatekin, yang tersebar luas di alam, sedangkan (-)-katekin dan (+)-epikatekin cenderung jarang (Heinrich et al.2006).
O
OH OH HO
2.3.3 Sifat Kelarutan Flavonoid
Aglikon flavonoid adalah polifenol dan karena itu mempunyai sifat kimia senyawa fenol, yaitu bersifat agak asam sehingga dapat larut dalam basa. Tetapi harus diingat, bila dibiarkan dalam larutan basa, dan disamping itu terdapat oksigen, banyak yang akan terurai. Karena mempunyai sejumlah gugus hidroksil yang tak tersulih, atau suatu gula, flavonoid merupakan senyawa polar, dan sepetri kata pepatah lama ‘suatu golongan akan melarutkan golongannya sendiri’ , maka umumnya flavonoid larut cukupan dalam pelarut polar seperti etanol, metanol, butanol, aseton, dimetilsulfoksida (DMSO), dimetilformamida (DMF), air dan lain-lain. Adanya gula yang terikat pada flavonoid (bentuk umum yang ditemukan) cenderung menyebabkan flavonoid lebih mudah larut dalam air dan dengan demikian campuran pelarut di atas dengan air merupakan pelarut yang lebih baik untuk glikosida. Sebaliknya, aglikon yang kurang polar seperti isoflavon, flavanon, dan flavon serta flavonol yang termetoksilasi cenderung lebih mudah larut dalam pelarut seperti eter dan kloroform (Markham, 1988).
2.4 Hidrolisa
Glikosida merupakan senyawa organik yang ada dalam dunia tumbuhan. Glikosida terdiri atas dua bagian yaitu molekul gula (sakarida) dan aglikon. Gugus gula bisa berikatan dengan gugus aglikon dengan berbagai cara. Yang paling umum dijembatani oleh atom oksigen (O-glikon), tetapi bisa juga sulfur (S-glikosida), Nitrogen (N-glikosida) atau karbon (C-(N-glikosida). Glikosida umumnya berupa padatan. Cukup larut dalam air dan alkohol tetapi sedikit larut dalam eter. Ikatan glikosidik resisten terhadap hidrolisis oleh alkali tetapi mudah pecah oleh reaksi enzimatik glikosida atau asam mineral encer (Supriyatna dkk, 2014).
Waktu yang diperlukan untuk memutuskan ikatan suatu gula dari suatu flavonoid O-glikosida dengan hidrolisis asam tidak ditentukan hanya oleh kekuatan asam, tetapi
2.5 Teknik Pemisahan
2.5.1 Ekstraksi
Ekstraksi adalah suatu proses pemisahan dari bahan padat maupun cair dengan bantuan pelarut. Pelarut yang digunakan harus dapat mengekstraksi substansi yang diinginkan tanpa melarutkan material lainnya (Bintang, 2010).
Sampel (biomassa) tanaman, setelah diidentifikasi dan digolongkan oleh ahli botani lapangan menjadi spesies dan famili, kemudian dikumpulkan dari bagian aerialnya (daun, batang, dan kulit kayu pada batang), kulit batang dan akar, atau jika dari pohon besar, galihnya (kayu), dikeringkan dengan cara diangin-anginkan. Jika telah dikeringkan, biomassa digiling menjadi partikel-partikel kecil menggunakan blender atau penggilingan. Proses penggilingan ini penting karena ekstraksi yang efektif tergantung pada ukuran partikel biomassa; partikel besar akan sulit diekstraksi, sedangkan partikel kecil memiliki luas permukaan yang lebih besar sehingga dapat diekstraksi secara lebih efisien. Pemilihan pelarut ekstraksi sangat penting. Kegagalan mengekstraksi biomassa dapat menyebabkan kehilangan akses untuk mendapatkan zat aktif. Selain itu, penggunaan metode ekstraksi yang tidak tepat, seperti pemanasan kuat terhadap biomassa dengan suatu pelarut, dapat menyebabkan penguraian bahan alam yang berakibat aktivitas biologisnya menjadi hilang (Heinrich et al. 2005).
2.5.2 Partisi
2.5.3 Kromatografi
Kromatografi adalah kaedah pemisahan yang sangat penting. Penggunaan kromatografi pertama kali telah dilakukan oleh seorang ahli botani Rusia bernama M. Tswett, pada 1903 ia telah melaporkan pemisahan sampel pigmen berwarna dengan pori-pori padat dengan butir-butir kalsium karbonat yang halus (Sanagi, 2001).
Dengan menggunakan metode kromatografi, dalam banyak kasus pemisahan dituntaskan jauh lebih cepat dan lebih efektif daripada sebelumnya, dan banyak pemisahan-pemisahan yang tak pernah dilakukan dengan teknik-teknik lainnya telah berhasil (Underwood, 2002).
Kromatografi didefinisikan sebagai prosedur pemisahan zat terlarut oleh suatu proses migrasi diferensial dinamis dalam sistem yang terdiri atas dua fase atau lebih. Salah satu fase bergerak secara bersinambungan dalam arah tertentu dan didalamnya, zat-zat terlarut menunjukkan perbedaan mobilitas yang disebabkan oleh perbedaan adsorpsi, partisi, kelarutan, tekanan uap, ukuran molekul, atau kerapatan muatan ion. Dengan demikian, masing-masing zat dapat diidentifikasi atau ditetapkan dengan metode analitik.
2.5.3.1 Kromatografi Lapis Tipis
KLT merupakan metode pemisahan komponen-komponen atas dasar perbedaan adsorpsi atau partisi oleh fase diam di bawah gerakan pelarut pengembang atau pelarut pengembang campur.
Perlu diperhatikan bahwa ukuran partikel dibuat pada rentang kehalusan tertentu 1-25 μ dalam keadaan uniform. Keadaan uniform fase diam ini untuk tujuan didapatnya pemisahan yang baik, laju aliran pelarut pengembangan yang cepat dan merata.
Kromatogram pada KLT merupakan noda-noda yang terpisah setelah visualisasi dengan cara fisika atau kimia. Visualisasi cara fisika yaitu dengan melihat noda kromatogram yang mengabsorpsi radiasi ultraviolet atau berfluoresensi dengan radiasi
ultraviolet pada π = 254 nm atau π = 365 nm.
Pada adsorban yang berfluoresensi dengan radiasi ultra violet karena telah dicampur dengan zat kimia yang befluoresensi maka noda akan tampak sebagai pemadainan fluoresensi (quenching fluorescensi).
Pada kromatogram KLT dikenal istilah atau pengertian faktor retardasi (RF
R
) untuk tiap-tiap noda kromatogram yang didefinisikan sebagai :
F = ���������� �������������� ����������������� = ���
� =
ℎ��
100
2.5.3.2 Kromatografi Kolom
Kromatografi kolom klasik merupakan yang tertua dari cara kromatografi yang banyak itu, dan seperti yang dipraktekkan secara tradisional, merupakan bentuk kromatografi cair. Fase diam, baik bahkan yang jerap (KCP) atau film zat cair pada penyangga (KCC), ditempatkan di dalam tabung kaca berbentuk silinder, pada bagian bawah tertutup dengan katup atau keran, dan fase gerak dibiarkan mengalir ke bawah melaluinya karena gaya berat (Gritter, 1991).
Pada kromatografi kolom, fase diam yang digunakan berupa padatan dengan permukaan yang aktif (misalnya alumina, silika gel atau arang aktif) yang dikemas ke dalam sebuah kolom, dan fase geraknya berupa pelarut yang tersusun dari satu atau lebih pelarut organik. Interaksi molekul yang terjadi dalam adsorpsi dapat tergantung pada sifat (polaritas) permukaan, penyerapan solut, dan pelarut : gaya dispersi London, ikatan hidrogen, gaya elektrostatis, dan gaya transfer muatan (Adnan, 1997).
Pada kromatografi kolom, campuran yang akan dipisahkan diletakkan berupa pita pada bagian atas kolom penjerap yang berada dalam tabung kaca, tabung logam atau bahkan tabung plastik. Pelarut (fase gerak) dibiarkan mengalir melalui kolom karena aliran yang disebabkan oleh gaya berat atau didorong dengan tekanan. Pita senyawa linarut bergerak melalui kolom dengan laju yang berbeda, memisah, dan dikumpulkan berupa fraksi ketika keluar dari alas kolom. Metode ini merupakan contoh kromatografi elusi karena linarut dielusi dari kolom (Gritter, 1991) .
Prosedur yang dilakukan dalam kromatografi kolom yaitu 1. Penyiapan kolom
2. Pemasukan sampel ke dalam kolom
Kolom dicuci dengan eluen, kemudian sampel yang telah dilarutkan dengan sejumlah kecil volume eluen dimasukkan, kemudian kran dibuka dengan hati-hati. Perbandingan berat adsorben dengan sampel yaitu 30:1 dan perbandingan panjang dan diameter kolom yaitu 10-15:1.
3. Elusi atau pemisahan komponen-komponen sampel
Elusi diteruskan hingga komponen-komponen terpisah atau hingga tiap-tiap komponen keluar dari kolom. Untuk senyawa yang tidak berwarna, eluat dipisahkan dalam beberapa fraksi, yang masing-masing dengan volume yang kecil dan penetapan tiap-tiap fraksi.
4. Deteksi atau penetapan kadar masing-masing komponen
Senyawa kemudian ditetapkan dan ditimbang setelah fraksi diuapkan dengan uji bercak, KKt atau KLT atau dengan spektrofotometri (Harmita, 2009).
2.5.3.3 Kromatografi Lapis Tipis Preparatif
KLTP pada lapisan setebal 1 mm telah dilaporkan oleh Ritter dan Meyer pada 1962.Tebal lapisan KLTP yang paling umum adalah 0,5-2,0 mm (500-2000μm), dan ukuran plat umumnya 5×20, 10×20, 20×20, 20×40, atau bahkan 20×100 cm. Faktor-faktor keberhasilan pemisahan pada KLTP meliputi kehomogenan plat, penotolan sampel, dan penjenuhan chamber dengan baik. Faktor yang terakhir ini penting karena zat berpindah pada plat dengan perubahan kecepatan berdasarkan laju penguapan pelarut. Zat berpindah lebih cepat pada permukaan plat dan lebih lambat pada bagian plat yang dekat dengan plat penyangga. Efek ini dapat diminimalisir pada chamber yang dijenuhkan dengan baik.
2.6 Teknik Spektroskopi
Metode spektroskopi merupakan cara yang terbaik saat ini untuk penentuan struktur senyawa organik karena dapat dilakukan dalam waktu singkat dan jumlah sampel yang
sedikit (mg atau μg).
Penentuan struktur kimia senyawa organik secara spektroskopi dapat dilakukan jika senyawa organik tersebut diperoleh dalam keadaan murni, adanya pengotor akan menyebabkan dihasilkannya spektra yang lebih kompleks sehingga akan menyulitkan dalam interpretasi spektra. Selanjutnya dari spektra massa dan NMR akan diperoleh formula (CxHyOz) dan derajat ketidakjenuhan (degrees of unsaturation) atau juga
dikenal dengan ekivalanesi ikatan rangkap (double bond equivalent). Spektra NMR, infra merah dan UV/Vis akan memberikan informasi adanya gugus fungsional, selain itu dari spektra NMR akan memberikan informasi adanya bagian-bagian struktur pembentuk senyawa tersebut. Dengan demikian berdasarkan data-data spektroskopi di atas dapat didefinisikan dengan senyawa yang telah diperoleh sebelumnya (known compound). Untuk senyawa organik yang belum diketahui struktur kimia sebelumnya (new compound) data-data spektroskopi tersebut belum cukup untuk menjelaskan struktur kimianya, dengan demikian diperlukan data-data spektra tambahan meliputi spektra 2D-NMR (meliputi COSY, HMQC, NOESY, dan HMBC), optical rotation density (ORD), dan pembuktian dengan sintesis total. Jika suatu senyawa berupa kristalin, penentuan struktur kimia dapat dilakukan dengan difraksi sinar-X.
Spektroskopi molekuler adalah ilmu yang mempelajari interaksi antara gelombang elektromagnetik dan benda. Gelombang elektromagnetik atau sering pula disebut radiasi elektromagnetik (REM) adalah sejenis energi yang disebarkan oleh suatu sumber cahaya dan bergerak lurus ke depan (kecuali jika dibiaskan atau dipantulkan) dengan kecepatan yang sangat tinggi. Gelombang elektromagnetik dapat berupa cahaya tampak, panas radiasi, sinar X, sinar UV, gelombang mikro, dan gelombang radio (Harmita, 2009).
2.6.1 Spektroskopi Inframerah (FT-IR)
Spektrum inframerah suatu molekul adalah hasil transisi antara tingkatan energi getaran (vibrasi) yang berlainan. Inti-inti atom yang terikat oleh ikatan kovalen mengalami getaran (vibrasi) atau osilasi (oscillation), dengan cara serupa dengan dua bandul yang terikat oleh suatu pegas.
Bila molekul menyerap radiasi inframerah, energi yang diserap menyebabkan kenaikan dalam amplitudo getaran atom-atom yang terikat itu. Jadi molekul ini berada dalam keadaan vibrasi tereksitasi(excited vibrational state); energi yang diserap akan dibuang dalam bentuk panas bila molekul itu kembali ke keadaan dasar. Panjang gelombang eksak dari absorpsi oleh suatu jenis ikatan bergantung pada macam getaran dari ikatan tersebut. Oleh karena itu, jenis ikatan yang berlainan (C-H, C-C, C=O, C=C, O-H, dan sebagainya) menyerap radiasi inframerah pada panjang gelombang yang berlainan. Dengan demikian spektrometri infarmerah dapat digunakan untuk mengidentifikasi gugus fungsi dalam suatu molekul.
Banyaknya energi yang diserap juga beraneka ragam dari ikatan ke ikatan disebabkan sebagian oleh perubahan dalam momen dipol (μ ≠ 0) pada saat energi
Intensitas absorpsi infamerah jarang dijelaskan secara kuantitatif, kecuali untuk klasifikasi umum s (kuat), m (medium), atau w (lemah).
Transisi bertanggungjawab untuk pita IR berdasarkan vibrasi molekul, misalnya gerak periodik yang melibatkan ikatan streching atau bending. Ikatan polar berhubungan kuat dengan absorpsi IR sedangkan ikatan simetris mungkin tidak diserap seluruhnya.
Jelasnya, frekuensi vibrasi, misalnya posisi pita IR dalam spektrum, bergantung pada sifat ikatan. Ikatan yang lebih pendek dan panjang memiliki vibrasi strechingnya pada energi akhir yang lebih tinggi (panjang gelombang lebih pendek) daripada ikatan yang lebih lemah dan kuat. Sama halnya dengan ikatan dengan atom-atom yang lebih ringan (misalnya hidrogen), bervibrasi pada energi yang lebih tinggi daripada ikatan dengan atom-atom yang lebih berat (Field et al. 2008).
2.6.2 Spektroskopi Ultraviolet
Spektrum UV-Visibel merupakan hasil interaksi antara radiasi elektromagnetik (REM) dan molekul. REM merupakan bentuk energi radiasi yang mempunyai sifat gelombang dan partikel (foton) (Harmita, 2009).
Istilah “spektroskopi UV” umumnya ditujukan untuk transisi elektronik yang
terjadi pada wilayah spektrum elektromagnetik (λ = 200-380 nm). Transisi elektronik juga bertanggungjawab pada absorpsi dalam daerah tampak (sekitar 380-800 nm) yang mudah diakses secara instrumen tetapi yang kurang penting dalam pemecahan masalah struktur, karena kebanyakan senyawa organik merupakan tidak berwarna.
Spektra UV digunakan dalam penentuan struktur yang beragam selalu dapat diselesaikan (Field et al. 2008).
Spektrum khas flavonoid terdiri atas dua maksima, pada rentang 240-285 nm (pita II) dan 300-550 (pita I). Kedudukan yang tepat dan kekuatan nisbi maksima tersebut memberikan informasi yang berharga mengenai sifat flavonoid dan pola oksigenasinya (Markham, 1988).
2.6.3 Spektroskopi Resonansi Magnet Inti Proton (1
Spektroskopi resonansi magnet proton dapat digunakan untuk menentukan jenis lingkungan atom yang berbeda yang ada dalam molekul; jumlah atom hidrogen pada masing-masing jenis lingkungan hidrogen; dan jumlah atom hidrogen pada atom karbon tetangga.
Sinyal-sinyal resonansi muncul dengan letak yang terpisah karena adanya geseran kimia (chemical shift). Tidak semua sinyal berpola sederhana (berupa garis tunggal atau singlet), beberapa sinyal mengikuti pola pemecahan (splitting) yang karakteristik, seperti doublet, triplet, kuartet. Pemecahan disebabkan oleh penggandengan spin-spin (spin-spin coupling), yaitu interaksi magentik suatu inti dengan inti yang lain.
Jenis lingkungan kimia proton dapat diketahui dari geseran kimia. Dengan integrasi, dapat diketahui jumlah relatif proton dapat diketahui dari geseran kimia dan jumlah relatif proton yang ada. Hubungan posisi antara inti-inti yang saling berintegrasi dapat diketahui dari penggandengan spin-spin karena besarnya interaksi, yang disebut konstanta penggandengan atau couplingconstant (J), bergantung pada jumlah dan jenis ikatan yang memisahkan inti-inti tersebut. Fenomena
H-NMR)
1
Untuk 1H-NMR, standar pembanding yang direkomendasikan adalah tetrametilsilan [(CH3)4 Si/TMS)]. TMS juga dapat digunakan untuk 13
1. Stabil secara kimia, simetris, dan beresonansi pada medan atas (upper field). C-NMR. Mengapa TMS dipilih sebagai senyawa pembanding? Berikut ini alasannya.
2. Proton pada gugus metil senyawa ini lebih terperisai dibandingkan proton senyawa lain.
3. TMS memberikan sinyal yang tajam (singlet), 12 proton. 4. Bersifat inert.