BAB II
TINJAUAN PUSTAKA
2.1 Rancangan Analisis
Dalam sintesis suatu senyawa kimia atau senyawa obat yang baik, diperlukan beberapa persiapan. Persiapan tersebut antara lain berupa bahan dasar
sintesis, pereaksi, pengertian yang mendalam mengenai mekanisme reaksi yang akan berlangsung selama sintesis, serta alat-alat yang diperlukan untuk sintesis. Untuk dapat memperoleh hasil sintesis yang baik serta hasil sampingan sedikit
mungkin sehingga memudahkan pada waktu pemurnian perlu dipakai bahan dasar sintesis yang tepat, mudah didapat, maka diperlukan suatu rancangan atau pola
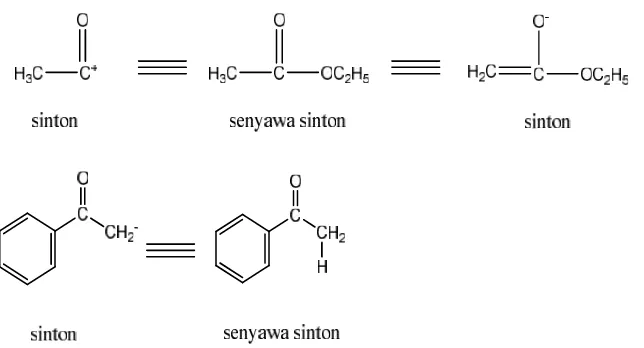
analisis, yang dikenal dengan nama analisis desain. Rancangan atau pola analisis ini didasarkan pada pemecahan bagian-bagian tertentu dari senyawa yang disintesis menjadi bagian yang lebih kecil yang disebut sinton. Sehingga senyawa
yang lebih kecil hasil pemecahan senyawa yang disintesis disebut senyawa sinton. Sinton dan senyawa sinton seperti Gambar 2.1.
Senyawa sinton hasil pemecahan ini mungkin masih belum sederhana atau
belum terdapat dalam laboratorium maupun belum diperdagangkan. Kalapun ada, harganya sangat mahal, maka perlu diadakan pemecahan lebih lanjut sehingga didapatkan senyawa sinton yang lebih sederhana dan mudah didapat. Karena
rancangan atau pola analisis ini berdasarkan pemecahan senyawa besar menjadi senyawa sinton yang lebih kecil, maka cara analisis ini dikenal dengan nama
diskoneksi. Tanda atau simbol dilakukannya diskoneksi adalah . Untuk
dapat mengadakan diskoneksi sehingga mendapatkan bahan-bahan dasar yang tepat di atas, serta pereaksi yang tepat untuk katalisator, diperlukan pendalaman mekanisme reaksi kimia, sehingga dalam sintesis senyawa kimia atau obat, setelah
didapatkan bahan dasar atau senyawa sinton, perlu diadakan penulisan kembali mekanisme reaksi pembentukan senyawa yang akan disintesis, untuk mengetahui
suasana selama sintesis, reagen-reagen dan alat-alat yang diperlukan (Warren, 1981).
Retrosintetik adalah proses pembelahan molekul target ke dalam bahan
awal. Proses ini dapat terjadi melaui 2 cara, yaitu melalui proses Interkonversi Gugus Fungsional (IGF) dan diskoneksi. Diskoneksi adalah proses analisis, yaitu
pemecahan sebuah ikatan dan mengkonversikannya menjadi sebuah molekul yang dapat digunakan sebagai bahan awal. Diskoneksi ini adalah kebalikan dari mekanisme reaksi. Interkonversi gugus fungsi adalah proses pengubahan suatu
gugus fungsional kedalam gugus yang lain dengan substitusi, eliminasi, oksidasi dan reduksi serta operasi balik yang digunakan dalam analisis. Sinton adalah
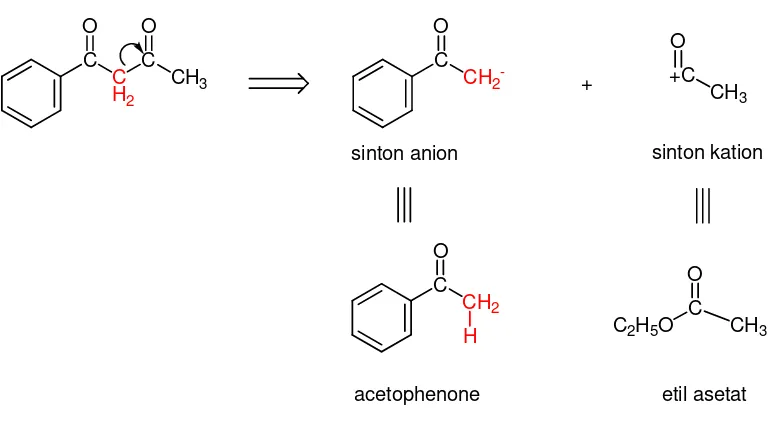
Parfum disintesis berdasarkan analisis retrosintetik terhadap senyawa
1-fenil-1,3-butanadione yaitu melalui pendekatan diskoneksi. Retrosintetik senyawa parfum dapat dilihat pada Gambar 2.2.
C O
C H2
C CH3
O
C O
CH2- + +C
O CH3
sinton anion sinton kation
C O
CH2
H
C O
CH3
C2H5O
acetophenone etil asetat
Gambar 2.2Retrosintetik parfum
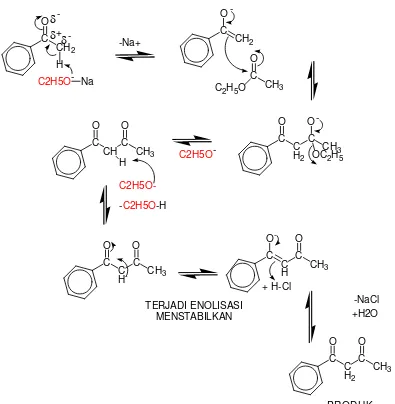
Dari analisis retrosintetik tersebut diperoleh starting material berupa
C
Gambar 2.3Mekanisme reaksi sintesis parfum 2.2 Elektronegativitas dan Polaritas
Kebanyakan reaksi organik tergantung pada interaksi molekul yang mempunyai muatan fraksi positif dengan molekul yang mempunyai muatan fraksi
negatif. Dalam senyawa organik netral (tanpa muatan), keberadaan muatan dapat terjadi akibat adanya perbedaan elektronegativitas. Nilai elektronegativitas ditemukan oleh Linus Pauling. Semakin besar nilai elektronegativitas akan
Kemampuan suatu atom yang terikat dalam suatu molekul untuk menarik
elektron dinyatakan dalam aturan elektronegativitas. Dengan nilai elektronegativitas yang tinggi, maka suatu atom akan semakin mudah untuk menangkap elektron. Ikatan yang dibentuk oleh atom-atom yang mempunyai
keelektronegatifan yang berbeda disebut ikatan polar. Ikatan nonpolar dibentuk oleh atom-atom yang mempunyai perbedaan elektronegativitas yang kecil atau
bahkan nol. Atom yang mempunyai keelektronegatifan yang lebih besar dalam suatu ikatan kovalen akan bermuatan negatif, sedangkan atom yang lain bermuatan positif (Meislich, et al., 1980).
2.3 Elektofilik dan nukleofilik
Secara umum reaksi terjadi pada gugus yang reaktif dari suatu molekul
atau ion. Gugus yang dimaksud dibagi dalam dua kategori. Yang pertama, gugus yang mengandung banyak elektron. Hal ini bisa disebabkan oleh: (a) memiliki pasangan elektron bebas (b) bermuatan parsial negatif pada ikatan polar (c)
memiliki elektron phi. Gugus yang kaya elektron bersifat nukleofilik disebut nukleofil atau donor elektron. Yang kedua (a) kemampuan menarik elektron (b)
bermuatan parsial positif pada ikatan polar. Gugus yang kehilangan elektron bersifat elekrofilik disebut elektrofil atau akseptor elektron (Meislich, et al., 1980).
2.4 Karbokation dan Karbanion
Karbokation merupakan perantara pada beberapa jenis reaksi. Stablitas
menarik sebuah proton,maka secara langsung diubah menjadi konjugat asam.
Stabilitas karbanion berhubungan dengan kekuatan konjugat asam. Asam lemah yang kekuatan basanya tinggi mempunyai stabilitas karbokation yang lemah. Stabilitas yang dimaksud di sini adalah stabilitas ke arah elektron donor (March,
1992).
2.5 Reaksi Organik
Reaksi kimia organik dapat terjadi dalam dua cara, yaitu berdasarkan jenis reaksi apa yang terjadi dan bagaimana reaksinya terjadi. Ada 4 jenis reaksi organik: adisi, eliminasi, substitusi dan penataan ulang, reaksi oksidasi reduksi.
Reaksi adisi terjadi ketika dua reaktan dicampurkan bersama-sama unutk membentuk produk tunggal tanpa ada hasil samping. Reaksi eliminasi adalah
kebalikan dari reaksi adisi. Eliminasi terjadi ketika reaktan tunggal dipecah menjadi dua produk. Reaksi substitusi terjadi ketika dua reaktan berpindah posisi untuk menghasilkan 2 produk baru. Reaksi penataan ulang terjadi ketika reaktan
tunggal mengalami perubahan ikatan untuk menghasilkan produk yang isomer (McMurry, 1992).
2.6 Sintesis Organik
Sintesis senyawa organik dari prekursor sederhana di laboratorium dapat terjadi karena beberapa alasan. Dalam industri farmasi, senyawa organik baru
dirancang dan kemudian disintesis dengan harapan akan menghasilkan sebagian obat baru yang berguna. Dalam industri kimia, sintesis sering dilakukan untuk
2.7 Reaksi Umum dari Senyawa Karbonil
Aldehid keton, dan ester merupakan senyawa karbonil, yaitu senyawa dimana atom karbon (C) membentuk ikatan rangkap dengan atom oksigen (O).
Rumus senyawa karbonil dapat dilihat pada Gambar 2.4.
Gambar 2.4Rumus umum senyawa karbonil
Senyawa karbonil pada golongan aldehid diikat oleh minimal satu atom H,
sedangkan pada golongan keton diikat oleh 2 atom karbon. Rumus umum untuk senyawa golongan aldehid dan keton adalah dapat dilihat pada Gambar 2.5.
Gambar 2.5Rumus umum senyawa aldehid dan keton 2.8 Reaksi adisi nukleofilik
Nukleofil adalah spesies yang reaktif yang menyerang spesies yang kekurangan elektron. Nukleofil ini memiliki atom dengan muatan parsial negatif
dan atom ini disebut sebagai atom nukleofilik. Spesies reaktif yang kekurangan elektron disebut elektrofil. Elektrofil ini memiliki atom yang bermuatan parsial
positif (Miller dan Solomon, 1985).
R C
O
R
R C
O
H
C O
Reaksi dari senyawa karbonil dapat terjadi dalam 4 mekanisme umum
yaiut adisi nukleofilik, substitusi asil nukleofilik, substitusi alfa, dan kondensasi karbonil (McMurry, 1992).
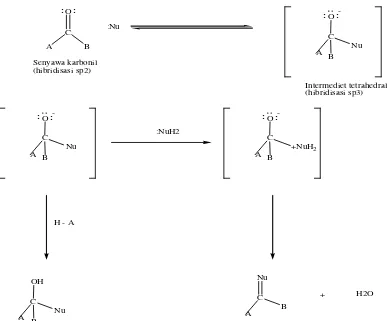
Reaksi umum dari aldehid dan keton adalah reaksi adisi nukleofilik, di
mana nukleofil ditambahkan ke karbon elektrofil dari gugus karbonil. Karena nukleofil menggunakan pasangan elektron bebas unutk membentuk ikatan karbon
baru, dua elektron dari ikatan rangkap karbon-oksigen harus berpindah ke atom oksigen yang elektronegatifnya lebih besar, yang kemudian akan distabilkan oleh anion alkoksida. Karbon karbonil akan terhibridisasi darisp2kesp3selama proses
berlangsung dan menghasilkan intermediet geometri tetrahedral. Setelah terbentuk, intermediet tetrahedral dapat mengalami berbagai jenis reaksi.
Intermediet tetrahedral dapat terprotonasi oleh air atau asam untuk membentuk alkohol, seperti pada reaksi adisi Grignard. Dan juga intermediet tetrahedral dapat mengusir oksigen untuk membentuk ikatan rangkap antara senyawa karbonil.
Gambar 2.6Reaksi adisi nukleofilik (McMurry, 1992) 2.9 Spektrometri Massa
Spektrometri massa, salah satu aplikasi dari alat analisis, menyajikan informasi kualitatif dan kuantitatif tentang atom atau komposisi molekular dari
senyawa organik ataupun anorganik. Spektrometer massa pertama kali digunakan oleh Thompson pada tahun 1912 dan Aston tahun 1919. Spectrometer massa
menghasilkan data berupa muatan partikel yang terdiri dari fragmentasi ionik dari molekul awal, dan urutan-urutannya berdasarkan perbandingan massanya (Silverstein, et al., 1981).
Keuntungan utama yang diperoleh dari spektrometri massa ini sebagai