STUDI AWAL DESAIN AKI BASAH DENGAN MENGGUNAKAN EKSTRAK LARUTAN PEPAYA (Carica Papaya L.) SEBAGAI SUMBER ENERGI LISTRIK ALTERNATIF
1Reynold A. Barus, 2Ir. H. Hairul Alwani HA, MT,
1Mahasiswa Jurusan Teknik Elektro Fakultas Teknik Universitas Sriwijaya 2Staf Pengajar Jurusan Teknik Elektro Fakultas Teknik Universitas Sriwijaya
Email : augustbarus@gmail.com
Persediaan sumber energi yang cukup besar sangatlah dibutuhkan dengan seiringnya perkembangan industri di zaman modern ini. Ketersediaan sumber energi itu sendiri semakin menipis dan lama -kelamaan akan habis karena terus menerus digunakan. Oleh karena itu diharapkan akan dapat solusinya melalui pemanfaatan energi alternative yang berasal dari bahan-bahan yang tersedia dan belum dimanfaatkan secara luas. Pemanfaatan limbah organik yang berasal dari buah-buahan dapat dijadikan sebagai energi alternatif yang ramah lingkungan dan energi yang dapat diperbaharu.
Sel Volta adalah sel elektrokimia yang menghasilkan arus listrik dari reaksi kimia berupa reaksi redoks spontan. Dengan memanfaatkan kandungan kimia yang ada pada buah dapat didapatkan energi listrik melalui proses sel volta. Dengan memanfaatkan energi ini diharapkan dapat menghemat energi yang sudah ada selama ini. Pada sel volta akan terjadi proses pelepasan elektron (oksidasi) dan penangkapan elektron (reduksi). Hal ini akan mengakibatkan adanya aliran elektron yang dapat menghasilkan arus listrik..
Dari hasil penelitian ini maka dapat disimpulkan bahwa AKI ekstrak buah pepaya dari hasil penelitian dapat bertahan sampai 744 jam, sampai lampunya padam, dan Aki yang sudah dibuat dapat dikategorikan menjadi aki basah electrochemical.
Kata kunci :energi alternatif, buah, sel volta / sel galvani, buah pepaya
ABSTRACT
Supply of energy sources is needed is large enough to seiringnya industrial development in modern times. The availability of energy sources themselves dwindling and eventually will be depleted due to continuous use. Therefore, the solution is expected from the use of alternative ener gy that is derived from available materials and have not been widely utilized. The utilization of organic waste from fruits can be used as eco friendly alternative and renewable energy.
Voltaic cells are electrochemical cells that generate electrical curr ent from chemical reactions in the form of a spontaneous redox reaction. By utilizing the existing chemical constituents in the fruit can be obtained an electrical energy through the process of voltaic cells. This utilization energy is expected to save ava ilable energy during this time. There will be the release of electrons (oxidation) and electron capture (reduction) in voltaic cells. It will cause the flow of electro ns that can produce an electric current.
From these research results, it can be concluded that the papaya extracts of battery can last up to 744 hours, until the lights went out, and this battery can be categorized into wet electrochemical battery.
▸ Baca selengkapnya: anode pada sel aki berupa
(2)1. PENDAHULUAN
1.1 Latar belakang
Persediaan sumber energi yang cukup besar sangatlah dibutuhkan dengan seiringnya perkembangan industri di zaman modern ini. Kemampuan alam menyediakan sumber energi masih banyak yang belum dimaksimalkan. Ketersediaan sumber energi itu sendiri semakin menipis dan lama-kelamaan akan habis karena terus menerus digunakan. Ada banyak sumber energi alternatif lain yang masih belum dimaksimalkan. Kebijakan yang harus dilakukan adalah menemukan sumber energi alternatif baru untuk dimaksimalkan. Dimana dengan ditemukannya sumber energi alternatif baru ini bisa menggantikan sedikit demi sedikit sumber energi mineral yg akan habis tersebut, walaupun kemampuan sumber energi alternatif tidak seoptimal sumber energi mineral, tetapi dengan terus melakukan penelitian atau riset dapat mengoptimalkan energi alternatif menjadi lebih efektif, murah atau terjangkau dan ramah terhadap lingkungan.
Energi altenatif adalah sumber energi yang memanfaatkan bahan-bahan yang alami dan bersumber dari alam yang mudah di dapat dan melimpah hasilnya. Salah satu bahan yang dapat diguanakan sebagai sumber energi alternatif adalah dengan menggunakan buah-buahan.Buah-buahan dapat digunakan sebagai bahan energi alternatif karena mudah di dapat, banyak, dan mudah dalam pengolahannya. Contoh buah-buahan yang dapat dijadikan energi alternatif adalah buah jeruk, sawo, tomat, dan masih banyak yang lagi walau energi yang dihasilkan masih sangat kecil. Buah papaya (Carica papaya L) adalah salah satu jenis buah yang dapat di jadikan sebagai energi alternatif.
Dengan memanfaatkan kandungan kimia dalam buah pepaya tersebut peneliti akan membuat desain aki yang berfungsi untuk membangkitkan tegangan. Sumber tegangan skala kecil ini akan sangat bermanfaat bagi basah untuk wadah ekstrak buah pepaya. 2. Mendapatkan nilai tegangan dari aki basah diharapkan lebih ramah lingkungan .
1.3 Perumusan Masalah
1. Bagaimana membuat Ekstrak buah pepaya bisa menjadi energi alternatif yang ramah lingkungan.
2. Bagaimana memanfaatkan buah pepaya yang rusak di Kabupaten Ogan Ilir, Sumatera selatan sebagai energy alternatif.
1.4 Pembatasan Masalah
Membuat dan mendesain seperti aki basah sebanyak 5 skat untuk wadah ekstrak pepaya, mengetahui proses pepaya menghasilkan arus listrik, dan melakukan pengukuran arus dan tegangan yang di hasilkan.
2. TINJAUAN PUSTAKA
2.1 Buah Pepaya (Carica Papaya L.) 2.1.1 Sejarah Singkat Pepaya 15)
Pepaya merupakan tanaman buah berupa herbal dari famili Caricaceae yang berasal dari Amerika Tengah dan Hindia Barat bahkan kawasan sekitar Mexsiko dan Coasta Rica. Tanaman pepaya banyak ditanam orang, baik di daeah tropis maupun sub tropis, di daerah-daerah basah dan kering atau di daerah-daerah dataran dan pegunungan (sampai 1000 m dpl).
2.1.2 Kandungan Larutan Pepaya
Berdasarkan kandungan nutriennya,tanaman pepaya memiliki kandungan yang sangat kaya akan vitamin, kalsium, fosfor, besi, kalsium, lemak, protein, dan kandungan-kandungan lainnya yang sangat bermanfaat bagi tubuh manusia. Kondisi kandungan papaya juga berbeda beda kandungannya. Jika dalam keadaan buah pepaya masak memiliki kandungan yang sangat berbeda dengan pepaya muda, begitu juga dengan kandungan daun papaya sangat berbeda dengan daun pepaya.
2.2 Sel Elektrokimia3)
pada sel elektroda kimia, kedua setengah reaksi dipisahkan dengan maksud agar aliran listrik (elektron) yang ditimbulkan dapat dipergunakan. Salah satu sebuah faktor yang menunjukan sebuah sel adalah gaya gerak listrik (GGL) atau perbedaan potensial listrik antara anoda dan katoda.
2.2.1 Reaksi oksidasi-reduksi7)
Oksidasi ialah perubahan kimia dimana suatu atom atau kelompok atom melepaskan elektron, dan reduksi ialah perubahan kimia dimana suatu atom atau kelompok atom menerima elektron. Transformasi yang mengubah atom netral menjadi ion positif berlangsung dengan melepaskan elektron yang disebut dengan proses oksidasi. Demikian pula, transformasi unsur netral menjadi anion harus diikuti oleh pertambahan elektron yang disebut proses reduksi.
2.2.2 Sel Volta Atau Sel Galvani13)
Batt Volta berhasil merancang alat berupa tumpukan dari lempengan logam seng dan perak yang dipisahkan oleh kain basah dari larutan garam yang menghasilkan arus listrik. Rangkaian alat yang dapat menghasilkan arus listrik dari reaksi kimia rancangan volta disebut sel volta. 2.2.3 Jenis-Jenis Sel Volta9)
Sel volta dibagi menjadi tiga bagian, yaitu Sel Volta Primer, Sel Volta Sekunder, Sel Bahan Bakar. Ketiga bagian tersebut juga memiliki contoh masing-masing lagi. Berikut ini macam-macam dari sel volta :
A. Sel Volta Primer
Sel volta primer dibagi menjadi 4, antara lain:
1. Sel Kering Seng-Karbon
Sel kering juga dapat disebut sel Lenchanche atau baterai. Baterai kering ini mendapatkan hak paten penemuan di tahun 1866. Sel Lanchache ini terdiri atas suatu silinder zink berisi pasta dari campuran batu kawi (MnO2), salmiak (NH4Cl), karbon (C), dan sedikit air. Dengan adanya air jadi baterai kering ini tidak 100% kering.
Sel ini biasanya digunakan sebagai sumber tenaga atau energi pada lampu, senter, radio, jam dinding, dan masih banyak lagi. Penggunaan logam seng adalah sebagai anoda sedangkan katoda digunakan elektroda inert, yaitu grafit, yang dicelupkan ditengah-tengah pasta. Pasta ini bertujuan sebagai oksidator. 2. Baterai Merkuri
Baterai merkuri ini merupakan satu dari baterai kecil yang dikembangkan untuk usaha perdagangan atau komersial. Anoda seng dan katoda merkuri (II)
oksida (HgO) adalah penyusun dari baterai merkuri ini yang dihubungkan dengan larutan elektrolit kalium hidroksida (KOH). Sel ini mempunyai beda potensial ± 1,4V.
3. Baterai Perak Oksida
Baterai perak oksida tergolong tipis dan harganya yang relatif lebih mahal dari baterai-baterai yang lainnya. Baterai ini sangat populer digunakan pada jam, kamera, dan kalkulator elektronik. Perak oksida (Ag2O) sebagai katoda dan seng sebagai anodanya. Reaksi elektrodanya terjadi dalam elektrolit yang bersifat basa dan mempunyai beda potensial sama seperti pada baterai alkaline sebesar 1,5V.
4. Baterai Litium
Terdiri atas litium sebagai anoda dan MnO2 sebagai oksidator (seperti pada baterai alkaline). Baterai Litium ini dapat menghasilkan arus listrik yang lebih besar dan daya tahannya lebih lama dibandingkan baterai kering yang berukuran sama. dapat digunakan untuk kendaran bermotor atau automobil. Aki timbal mempunyai tegangan 6V atau 12V, tergantung jumlah sel yang digunakan dalam konstruksi aki timbal tersebut. Aki timbal ini terdiri atas katoda PbO2 (timbel IV oksida) dan anodanya Pb (timbel=timah hitam).
2. Baterai Nikel Kadmium
Baterai nikel-kadmium merupakan baterai kering yang dapat diisi ulang. Sel ini biasanya disebut nicad atau bateray nickel-cadmium.
Baterai nikel-kadmium merupakan zat padat yang melekat pada kedua elektrodenya. Baterai nikel-kadmium memiliki tegangan sekitar 1,4V. Dengan membalik arah aliran elektron, zat-zat tersebut dapat diubah kembali seperti zat semula.
3. Sel Perak Seng
seng dibuat lebih ringan dibandingkan dengan sel timbal seng.
4. Sel Natrium Belerang
Sel natrium belerang ini dapat menghasilkan energi listrik yang lebih besar dari sel perak seng. Elektrodanya adalah Na (natrium) dan S (sulfur). C. Sel Bahan Bakar
Sel bahan bakar adalah sel yang menggunakan bahan bakar seperti campuran hidrogen dengan oksigen atau campuran gas alam dengan oksigen. Yang berperan sebagai katoda adalah gas oksigen dan anodanya gas hidrogen.
2.2.4 Prinsip Kerja Sel Volta 9)
Pada reaksi ini terjadi serah terima elektron, logam seng (Zn) melepaskan elektron dan membentuk Zn2+. Ion Cu2+ dalam larutan CuSO4 menerima elektron dan membentuk endapan Cu. Peristiwa ini berjalan terus-menerus hingga semua ion Cu2+ mengendap sebagai logam Cu, sehingga larutan CuSO4 semakin berkurang konsentrasinya. Sebaliknya, endapan Cu pada katode semakin bertambah massanya dalam reaksi tersebut tidak terjadi arus listrik, karena elektron berpindah secara langsung dari logam Zn ke larutan CuSO4. Reaksi redoks spontan akan menghasilkan arus listrik apabila dirangkaikan pada suatu sel volta.
Dalam rangkaian sel volta tersebut logam tembaga (Cu) berfungsi sebagai katode (kutub positif), tempat penerimaan elektron dan logam seng (Zn) berfungsi sebagai anode (kutub negatif), tempat pelepasan elektron. Proses yang berlangsung pada sel volta adalah sebagai berikut: mengalir melalui kawat penghantar menuju ke logam Cu.
b. Larutan CuSO4 terdiri atas ion Cu2+ dan SO4 dengan jumlah yang seimbang. Ion Cu2+akan menerima elektron dari logam CU dan kemudian mengendap pada katode. Ion Cu2+mengalami reaksi reduksi menurut persamaan “setengah reaksi” yaitu:
Cu2+(aq) + 2e- à Cu(s)
c. Terjadi peristiwa aliran elektron (serah terima elektron) dari logam Zn sebagai anode ke logam Cu sebagai katode yang menghasilkan potensial listrik. Besarnya
potensial listrik tersebut dapat diukur menggunakan voltmeter.
d. Peristiwa searah terima elektron terus berlangsung, sehingga dalam wadah katode larutan CuSO4 semakin berkurang konsentrasinya. Hal tersebut disebabkan ion Cu2+ dalam larutan tereduksi menjadi Cu, yang menyebabkan massa logam Cu yang berfungsi sebagai katode semakin bertambah. e. Massa logam Zn sebagai anode berkurang
karena terlarut sebagai ion Zn2+, sehingga ion Zn2+ dalam ZnSO4 semakin bertambah. f. Jumlah ion Zn2+ yang berlebihan menyebabkan
larutan pada anode, ZnSO4(aq) semakin bermuatan positif, sebaliknya larutan dalam katode yaitu CuSO4 semakin bermuatan negatif.
g. Jembatan garam terdiri atas larutan elektrolit seperti KCl atau NH4NO3 yang dilarutkan dalam agar-agar. Elektrolit yang digunakan pada jembatan garam harus bersifat inert supaya tidak bereaksi dengan kedua electrode. Apabila jembatan garam terbuat dari larutan KCl, maka ion K+ akan bergerak ke larutan yang lebih bermuatan negatif (ke arah katode), sebaliknya ion negatif Cl- akan bergerak ke larutan yang bermuatan positif (ke arah anode).
2.2.5 Sel Elektrolisis5)
Elektrolisis adalah peristiwa penguraian elektrolit oleh arus listrik searah dengan menggunakan dua macam elektroda. Elektroda tersebut adalah katoda (elektroda yang dihubungkan dengan kutub negatif) dan anoda (elektroda yang dihubungkan dengan kutub positif). Pada anoda terjadi reaksi oksidasi, yaitu anion (ion negatif) ditarik oleh anoda dan jumlah elektronnya berkurang sehingga bilangan oksidasinya bertambah.
2.2.6Prinsip Perhitungan Elektrolisis5) 1. Hukum Faraday I
"Massa zat yang terbentuk pada masing-masing elektroda sebanding dengan kuat arus/arus listrik yang mengalir pada elektrolisis tersebut".
Rumus:
� =9.�.� ……….(2.1)
q = i .t ………..(2.2)
Dimana :
m= massa zat yang dihasilkan (gram)
e = berat ekivalen = massa atom (Ar)/ Valensi I = kuat arus listrik (ampere)
t = waktu (detik)
2. Hukum Faraday II
"Massa dari macam-macam zat yang diendapkan pada masing-masing elektroda (terbentuk pada masing-masing elektroda) oleh sejumlah arus listrik yang sama banyaknya akan sebanding dengan berat ekivalen masing-masing zat tersebut."
Hukum Faraday erat kaitanya dengan muatan listrik. Muatan listrik, Q, adalah pengukuran muatan dasar yang dimiliki suatu benda. Satuan Q adalah coulomb, yang merupakan 6.24 x 1018 muatan dasar. Q adalah sifat dasar yang dimiliki oleh materi baik itu berupa proton (muatan positif) maupun elektron (muatan negatif). Muatan listrik total suatu atom atau materi ini bisa positif, jika atomnya kekurangan elektron. Sementara atom yang kelebihan elektron akan bermuatan negatif. Besarnya muatan tergantung dari kelebihan atau kekurangan elektron ini, oleh karena itu muatan materi/atom merupakan kelipatan dari satuan Q dasar.
2.3 Aki (Accumulator)2)
Akumulator (accu, aki) adalah sebuah alat yang dapat menyimpan energi (umumnya energi listrik) dalam bentuk energi kimia. Contoh-contoh akumulator adalah baterai dan kapasitor. Aki atau baterai basah adalah sebuah sel atau elemen sekunder dan merupakan sumber arus listrik searah yang dapat mengubah energi kimia menjadi energi listrik. Aki termasuk elemen elektrokimia yang dapat mempengaruhi zat pereaksinya, sehingga disebut elemen sekunder. Kutub positif aki menggunakan lempeng oksida dan kutub negatifnya menggunakan lempeng timbal sedangkan larutan elektrolitnya adalah larutan asam sulfat.
Ketika aki dipakai, terjadi reaksi kimia yang mengakibatkan endapan pada anoda (reduksi) dan katoda (oksidasi). Akibatnya, dalam waktu tertentu antara anoda dan katoda tidak ada beda potensial, artinya aki menjadi kosong. Supaya aki dapat dipakai lagi, harus diisi dengan cara mengalirkan arus listrik ke arah yang berlawanan dengan arus listrik yang dikeluarkan aki itu. Ketika aki diisi akan terjadi pengumpulan muatan listrik.
.
2.3.1 Elemen-Elemen Aki Basah10)
Akumulator (aki) adalah sebuah alat yang dapat menyimpan energi, umumnya energi listrik dalam bentuk energi kimia. Aki basah memiliki bagian-bagian di dalamnya sebagai berikut:
Gambar 2.3 Komponen-komponen AKI Sumber : http://idkf.bogor.net
1. Kotak aki
Berfungsi sebagai rumah atau wadah dari komponen aki yang terdiri atas cairan aki, pelat positif dan pelat negatif berikut separatornya.
2. Tutup aki
Berada di atas, tutup aki berfungsi sebagai penutup lubang pengisian air aki kedalam wadahnya, sehingga tidak tumpah. Di aki kering tentu tidak ada komponen ini, kalaupun ada tidak boleh di buka. 3. Lubang ventilasi
Untuk tipe konvensional ada di samping atas dan ada selangnya. Berfungsi untuk memisahkan gas hydrogen dari asam sulfat serta sebagai saluran penguapan air aki, sedang tipe MF, gas hydrogen dikondisikan lagi menjadi cairan sehingga tidak dibutuhkan lubang ventilasi.
4. Plat logam
Terdiri dari pelat positif dan plat negatif, untuk plat positif dibuat dari timbal Preoksida (PbO2), Sedangkan pelat negatif hanya dibuat dari logam separator bertugas untuk memisahkan atau menyekat plat positif dan negatif agar tidak saling bersinggungan yang dapat menimbulkan short alias hubungan arus pendek listrik.
7. Sel
Merupakan ruangan dalam wadah bentuknya kotak-kotak yang berisi cairan aki, plat positif dan negatif berikut separatornya.
8. Terminal aki
2.3.2 Reaksi kimia pada aki basah7)
Pada saat aki digunakan, tiap molekul asam sulfat (H2S04) pecah menjadi dua ion hidrogen yang bermuatan positif (2H+) dan ion sulfat yang bermuatan negatif (S04-). Tiap ion S04 yang berada dekat lempeng Pb akan bersatu dengan satu atom timbal murni (Pb) menjadi timbal sulfat (PbS04) sambil melepaskan dua elektron. Sedang sepasang ion hidrogen tadi akan ditarik lempeng timbal dioksida (PbO2), mengambil dua elektron dan bersatu dengan satu atom oksigen membentuk molekul air (H2O). Dari proses ini terjadi pengambilan elektron dari timbal dioksida (sehingga menjadi positif) dan memberikan elektron itu pada timbal murni (sehingga menjadi negatif), yang mengakibatkan adanya beda potensial listrik di antara dua kutub tersebut. Proses tersebut terjadi secara simultan.
2.4 Jembatan Garam1)
Jembatan garam biasanya berupa tabung berbentuk U yang diisi dengan agar-agar yang dijenuhkan dengan KCl. Jembatan garam berfungsi untuk menjaga kenetralan muatan listrik pada larutan. Karena konsentrasi larutan elektrolit pada jembatan garam lebih tinggi daripada konsentrasi elektrolit di kedua bagian elektroda, maka ion negatif dari jembatan garam masuk ke salah satu setengah sel yang kelebihan muatan positif dan ion positif dari jembatan garam berdifusi ke bagian lain yang kelebihan muatan negatif. Dengan adanya jembatan garam dapat terjadi penetralan muatan listrik di setiap elektroda melalui difusi ion-ion, akan tetapi kedua larutan elektroda tetap dapat dijaga untuk tidak saling bercampur secara bebas, sebab kalau dibiarkan bercampur maka ion-ion Cu2+ akan bereaksi langsung dengan elektroda Zn, dan elektron tidak akan mengalir melalui kawat pada rangkaian luar.
Penggunaan agar-agar mempunyai keuntungan, diantaranya menjaga agar larutan elektrolit di satu bagian elektroda tidak mengalir ke bagian elektroda lainnya saat permukaan kedua larutan elektrolit di kedua elektrolit berbeda.Adanya jembatan garam menyebabkan adanya pertemuan cairan elektrolit. Hal ini menyebabkan munculnya potensial perbatasan di kedua cairan, tapi potensial cairan-perbatasan (Ej) antara larutan KCl (pekat dalam agar-agar) dengan larutan encer pada setengah sel sangat kecil. Hal ini terjadi karena larutan KCl yang digunakan pekat sehingga potensial perbatasan terutama ditentukan oleh ion-ion dari larutan tersebut, sementara ion-ion dari larutan encer memberikan kontribusi yang dapat diabaikan terhadap potensial perbatasan.
Karena mobilitas ion K+ dan Cl- dalam air hampir sama, maka ion-ion ini berdifusi keluar dari jembatan garam ke dalamlarutan encer pada kecepatan yang hampir sama dan oleh karena itu potensil perbatasannya juga sangat kecil.
2.5 Elektroda12)
Elektroda adalah konduktor yang melewati arus listrik dari satu medium ke lainnya, biasanya dari sumber listrik ke perangkat atau materi atau elektroda adalah konduktor yang digunakan untuk bersentuhan dengan bagian atau media non-logam dari sebuah sirkuit (misal semikonduktor, elektrolit atau vakum).
2.5.1 Jenis-jenis elektroda
Berdasarkan jenisnya, elektroda dapat digolongkan menjadi :
1. Elektroda logam - ion logam
Yaitu elektroda yang berisi logam yang berada dalam kesetimbangan dengan larutan ionnya, contohnya elektroda Cu | Cu2+.
2. Elektroda amalgam
Elektroda amalgam adalah larutan logam dalam Hg cair. Pada elektroda ini, amalgam logam M akan berada dalam kesetimbangan dengan ionnya (M2+). Logam - logam aktif seperti Na dan Ca dapat digunakan sebagai elektroda amalgam.
3. Elektroda redoks
Yaitu elektroda yang melibatkan reaksi reduksi - oksidasi di dalamnya, contohnya elektroda Pt | Fe3+, Fe2+.
4. Elektroda logam - garam tak larut
Elektroda ini berisi logam M yang berada dalam kesetimbangan dengan garam sangat sedikit larutnya Mυ+Xυ- dan larutan yang jenuh dengan Mυ+Xυ- serta mengandung garam atau asam terlarut dengan anion Xz-. Contoh : elektroda Ag
– AgCl yang terdiri dari logam Ag, padatan AgCl, dan larutan yang mengandung ion Cl- dari KCl atau HCl.
5. Elektroda gas
Yaitu elektroda yang berisi gas yang berda dalam kesetimbangan dengan ion - ion dalam larutan, misalnya elektroda Pt | H2(g) | H+(aq).
6. Elektroda non logam non gas
Yaitu elektroda yang berisi unsur selain logam dan gas, misalnya elektroda brom dan yodium.
7. Elektroda membran
Yaitu elektroda yang mengandung membran semi permiabel
2.5.2 Bentuk-bentuk elektroda8)
Elektroda terdiri dari beberapa jenis bahan, bentuk dan ukuran. Bahan-bahan lempengan atau plat yang dipakai untuk elektroda adalah nikel, besi, tembaga, seng dan titanium.
b. Silinder
c. Spiral
Gambar2.4 Bentuk elektroda persegi panjang, silinder, dan spiral
Sumber:staff.undip.ac.id/fisika/ekohidayanto/.../master-thesis-eko-hidayanto.pdf
2.5.3 Tembaga13)
Tembaga dengan nama kimia Cupprum dilambangkan dengan Cu, unsur logam ini berbentuk kristal dengan warna kemerahan. Dalam tabel periodik unsur-unsur kimia tembaga menempati posisi dengan nomor atom (NA) 29 dan mempunyai bobot atom (BA) 63,546.
Gambar 2.5 Tembaga Sumber : www.id.wikipedia.org
1. Penggunaan Tembaga
a. Sebagai bahan untuk kabel listrik dan kumparan dinamo
b. Paduan logam. Paduan tembaga 70% dengan seng 30% disebut kuningan, sedangkan paduan tembaga 80% dengan timah putih
20% disebut perunggu. Perunggu yang mengandung sejumlah fosfor digunakan dalam industri arloji dan galvanometer.
2. Senyawa tembaga
Tembaga di alam memiliki tingkat oksidasi +1 dan +2. Tembaga dengan bilangan oksidasi +2 merupakan tembaga yang sering ditemukan sedangkan tembaga dengan bilangan oksidasi +1 jarang ditemukan, karena senyawaan tembaga ini hanya stabil jika dalam bentuk senyawa kompleks.
2.5.4 Seng10)
Seng (bahasa Belanda: zink) adalah unsur kimia dengan lambang kimia Zn, nomor atom 30, dan massa atom relatif 65,39. Ia merupakan unsur pertama golongan 12 pada tabel periodik.. Bijih seng yang paling banyak ditambang adalah sfalerit (seng sulfida).
Gambar 2.6 Sfalerit (ZnS) Sumber : www.id.wikipedia.org
1. Sifat fisik seng
Logam ini keras dan rapuh pada kebanyakan suhu, namun menjadi dapat ditempa antara 100 sampai dengan 150 °C.
2 . Kegunaan Seng (Zn)
Dalam bahasa sehari-hari, seng juga dimaksudkan sebagai plat seng yang digunakan sebagai bahan bangunan.
Dalam industri zink mempunyai arti penting:
a). Melapisi besi atau baja untuk mencegah proses karat. b). Digunakan untuk bahan baterai.
c). Zink dan alinasenya digunakan untuk cetakan logam, penyepuhan listrik dan metalurgi bubuk.
d). Digunakan untuk industri kosmetik (mencegah kulit agar tidak kering dan tidak terbakar sinar matahari), plastik, karet, sabun, pigmen warna putih dalam cat dan tinta (ZnO).
e). Sebagai pigmen fosfor serta untuk industri tabung televisi dan lampu.
g). Untuk mordan (pewarnaan), stiptik (untuk mencegah pendarahan).
h). Sebagai supply seng dalam makanan hewan serta pupuk.
2.6 Potensial Elektroda Standar (Eo)6)
Potensial elektroda standar suatu elektroda adalah daya gerak listrik yang timbul karena pelepasan elektron dari reaksi reduksi.Karena itu, potensial elektroda standar sering juga disebut potensial reduksi standar.Potensial ini relatif karena dibandingkan dengan elektroda hidrogen sebagai standar.Nilai potensial elektroda standar dinyatakan dalam satuan Volt (V). Untuk elektroda hidrogen, Eo nya adalah 0,00 V.
Potensial elektroda standar dapat dihitung dengan menggunakan:
EoSel = EoKatoda - EoAnoda
2.7 Besaran listrik6) 2.7.1 Arus Listrik
Apabila muatan listrik dalam keadaan bergerak, disebut arus listrik mengalir. Kuat arus didefinisikan sebagai kuantitas muatan melalui penampang penghantar setiap detik.
I = � �
Dimana :
I = Arus listrik (Ampere)
Q = Muatan listrik (Couloumb)
t = Waktu (second)
George Simon Ohm (1789-1854) mengemukakan adanya hubungan antara kuat arus yang mengalir dalam penghantar dengan selisih potensial kedua ujung penghantar itu, yang dinyatakan sebagai :
R = �
dimana :
R = Hambatan penghantar (Ohm)
V = Tegangan Listrik (Volt)
I = Arus listrik (Ampere)
2.7.2 Beda Potensial Listrik
Dalam arus listrik yang mengalir di suatu penghantar, ada dua hal yang perlu diketahui. Pertama, ada selisih potensial yang menyebabkan muatan dibawa melalui penghantar. Kedua, muatan yang lewat melalui penghantar harus kontinu dan kembali ke titik awal ketika muatan itu mulai bergerak sehingga melalui penghantar dan seterusnya. Diantara keduanya selisih potensial-lah yang membuat muatan bergerak. Muatan bergerak dari satu titik ke titik lain melakukan suatu usaha (Wab). Jika Wab adalah usaha yang dikerjakan oleh sebuah partikel bermuatan Q dari titik a ke titik b, maka perbedaan potensial listrik antara titik a dan b, Vab , didefinisikan sebagai :
Vab =
Dimana :
Vab = Potensial listrik antara titik a dan b (volt)
W = Usaha (Joule)
Q = Muatan listrik (couloumb)
dengan Vab adalah beda potensial listrik antara titik a dan titik b. Karena potensial listrik adalah energi potensial elektrostatik per-satuan muatan, satuan SI untuk potensial dan beda potensial adalah joule per coulomb volt (V).
2.8 Kapasitansi13)
Kapasitansi adalah ukuran jumlah muatan listrik yang disimpan (atau dipisahkan) untuk sebuah potensial listrik yang telah ditentukan. Bentuk paling umum dari piranti penyimpanan muatan adalah sebuah kapasitor dua
lempeng/pelat/keping.Jika muatan di
lempeng/pelat/keping adalah +Q dan –Q, dan V adalah tegangan listrik antar lempeng/pelat/keping, maka rumus kapasitansi adalah:
C = � ...……….……(2.7)
Dimana : C = kapasitansi yang diukur dalam Farad
Q = muatan yang diukur dalam coulomb
V = voltase yang diukur dalam volt Unit SI dari kapasitansi adalah farad; 1 farad = 1 coulomb per volt.
Hubungan Kapasitansi dengan arus listrik dan tegangan adalah sebagai berikut
� = � � atau
� = � . Maka:
C = i .tV………(2.8)
Dimana : i : arus listrik dalam Ampere t : Waktu dalam jam
Kapasitansi bisa dikalkulasi dengan mengetahui geometri konduktor dan sifat dielektriknya penyekat di antara konduktor. Sebagai contoh, besar kapasitansi dari sebuah
kapasitor “pelat-sejajar” yang tersusun dari dua lempeng sejajarnya seluas A yang dipisahkan oleh jarak d adalah sebagai berikut:
C = εr ε0�……….………..………..(2.9)
Dimana :
C = kapasitansi dalam farad, F
A = luas setiap lempeng, diukur dalam meter persegi
εr = konstanta dielektrik (yang juga disebut permitivitas listrik relatif) dari bahan di antara lempeng, (vakum =1)
ε0 = permitivitas vakum atau konstanta listrik dimana ε0 = 8.854×10-12 F/m
d = jarak antar lempeng, diukur dalam meter
3. METODELOGI PENELITIAN 3.1 Prosedur Penelitian
3.2 Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah sebagai berikut :
Gambar 3.2 Buah Cermai
3.3 Alat Penelitian
Adapun alat-alat yang digunakan dalam penelitian tugas akhir ini adalah :
START
Persiapan alat dan bahan
Proses sel galvani/sel volta
Pengujian daya tahan sampel
Hasil pengujian
Gambar 3.3 Lampu LED Gambar 3.4. Multimeter
Gambar 3.5 Seng Gambar 3.6 Tembaga
Gambar 3.7 Kaca Gambar 3.8 Kabel
Gambar 3.9 Gelas ukur Gambar 3.10 Blender
3.4 Prosedur Penelitian
Prosedur penelitian pada penelitian kali ini yaitu : 1. Buah pepaya sebagai larutan pada aki basah
diperas dan kemudian di endapkan. 2. Larutan yang didapatkan dari hasil perasan
tersebut disaring dengan menggunakan saringan kain supaya biji buah pepaya tidak ikut dalam wadah aki.
3. Siapkan wadah/baterai yang sudah dirancang yang sudah dibuat skat-skatnya. 4. Larutan ekstrak pepaya yang sudah disaring
diukur masing-masing 360 mL untuk dimasukkan ke dalam 5 sekat pada wadah aki yang sudah dibuat.
5. Masukan larutan buah pepaya tersebut ke dalam sekat-sekat yang telah dibuat Masing masing setiap sekat sebanyak 360 mL. 6. Buat rangkaian elektroda dengan
menyambungkan antara lempeng tembaga dan lempeng seng menggunakan kabel. 7. Susun rangkaian elektroda tersebut ke dalam
wadah/tempat yang telah disiapkan sebelumnya, dengan susunan lempeng tembaga - lempeng seng - lempeng tembaga dan begitu seterusnya.
8. Siapkan dua rangkaian elektroda dengan kabel yang lebih panjang dan hanya menggunakan satu lempeng saja, satu tembaga dan satu seng. Ujung dari dua kabel rangkaian terakhir inilah yang akan disambungkan dengan lampu yang akan dinyalakan.
9. Terakhir tutup baterai sehingga udara tidak dapat masuk kedalam baterai.
4. ANALISA DATA DAN PEMBAHASAN
4.1 Data Hasil Penelitian
Pada pengukuran aki dari ekstrak buah pepaya dilakukan dengan dua kondisi yaitu kondisi saat tidak diberi beban dan diberi beban. Pengukuran dilakukan terhadap nilai tegangan dan arus yang dihasilkan oleh aki.
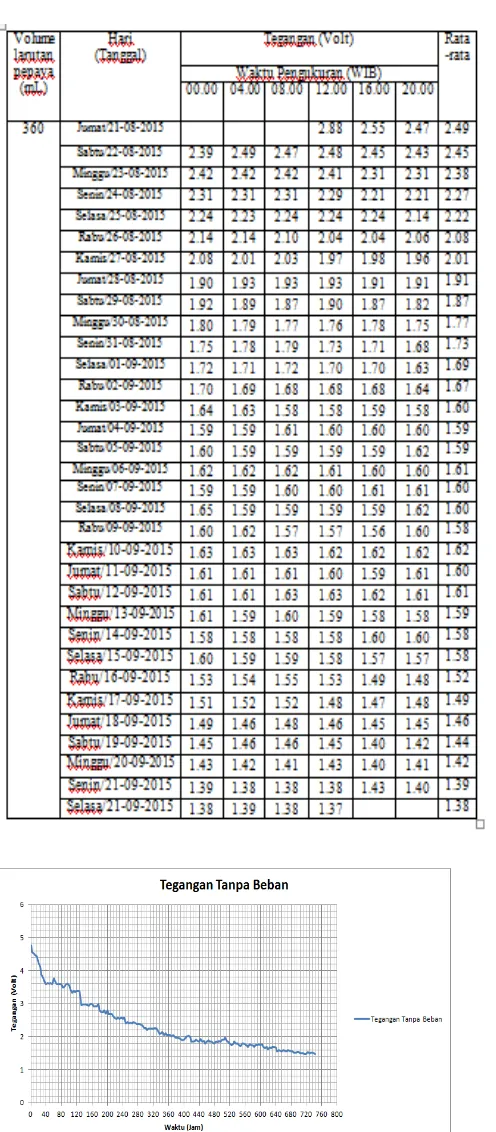
4.1.1 Data Hasil Pengujian Tegangan 1. Nilai Tegangan Tanpa Beban
Gambar 4.2 Grafik tegangan tanpa beban
2. Nilai Tegangan Saat Diberi Beban
Tabel 4.2. Data Hasil Pengujian Tegangan saat diberi beban
4.1.2 Data Hasil Pengujian Arus Listrik
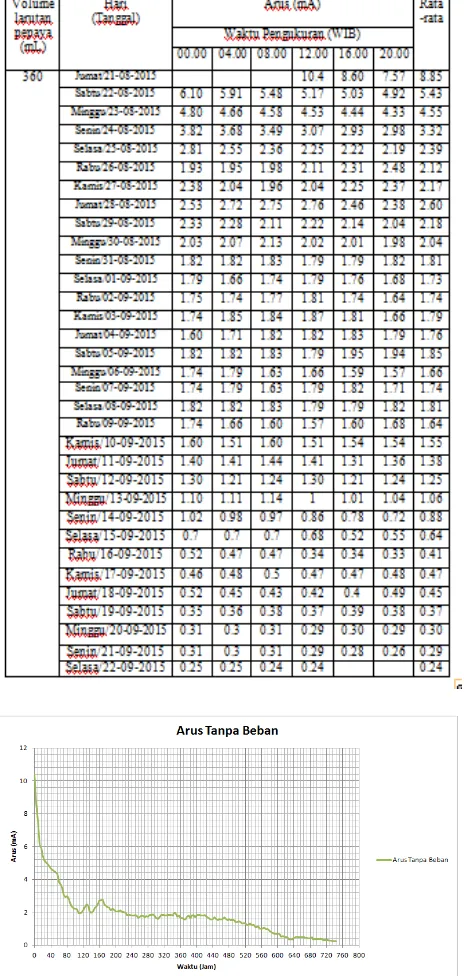
1. Nilai Arus Listrik Tanpa Beban
TABEL 4.3. Tabel Hasil Pengujian Arus Listrik
Gambar 4.4 Grafik Arus Tanpa beban
2. Nilai Arus Saat Diberi Beban
TABEL 4.4. Tabel Hasil Pengujian Arus Listrik dengan diberi beban
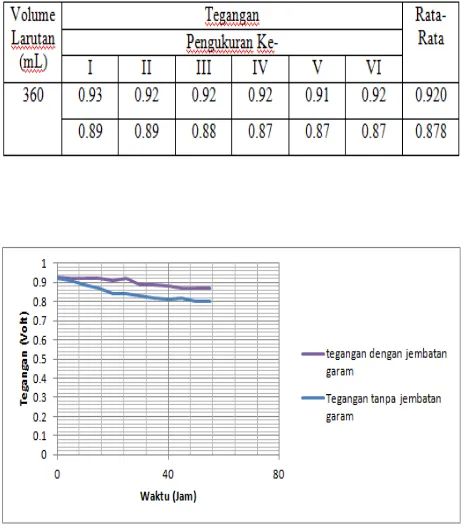
4.1.3 Data Hasil Pengujian Jembatan Garam 1. Tanpa Jembatan Garam
Tabel 4.6 Tabel Data tegangan tanpa jembatan garam
2. Ada Jembatan Garam
Tabel 4.7 Tabel data tegangan saat ada jembatan garam
Gambar 4.6 Grafik perbandingan tegangan
dengan dan tanpa jembatan garam
4.2 Analisa Hasil Penelitian
Penelitian ini dilakukan pada buah pepaya sebagai bahan untuk menghasilkan energi alternatif dengan menggunakan prinsip kerja sel volta / sel galvani dimana sel volta merupakan perubahan energi kimia menjadi energi listrik. Pada penelitian ini larutan ekstrak buah pepaya digunakan sebagai larutan elektrolit yaitu sebagai
penghubung antara elektroda tembaga dengan elektroda seng. Larutan ekstrak buah pepaya akan dimasukkan ke dalam wadah aki yang sudah didesain dari kaca dengan memiliki 5 sel. Pada aki yang telah dibuat ini menghasilkan tegangan sebesar 4,77 volt dan arus sebesar 10,4 mA.
Pada aki basah ini memiliki 5 buah sel yang di dalamnya terdiri atas elektroda seng dan tembaga. Pada penilitian ini aki basah dihubungkan pada satu buah lampu LED.Pada penelitian ini dilakukan beberapa pengukuran dengan kondisi yang berbeda. Pada desain aki basah dengan 5 sel di lakukukan pengukuran dengan 4 bagian yaitu :
1. Pengukuran tegangan tanpa beban 2. Pengukuran tegangan saat ada beban 3. Pengukuran arus listrik tanpa beban 4. Pengukuran arus listrik saat ada beban
Pada penelitian yang dilakukan dapat dilihat pada grafik bahwa semakin bertambahnya waktu semakin turunnya nilai tegangan maupun arusnya. Hal ini terjadi karena adanya perubahan konsentrasi keasaman larutan pepaya yang berkurang. Pada grafik arus dan tegangan dapat juga kita lihat bahwa pada saat diberi beban nilainya lebih cepat menurun dibandingkan dengan yang tidak diberi beban karena nilai arusnya terbuang yaitu melalui gelembung-gelembung yang mengendap pada elektroda.
Nilai tegangan dapat didapatkan dengan E0Sel yaitu dilihat dari elektroda yang digunakan. Pada penilitian yang dilakukan elektroda yang berperan sebagai katoda adalah tembaga karena sifatnya yang berfungsi sebagai menangkap elektron. Sedangkan elektroda seng berperan sebagai anoda karena elektroda ini melepas elektron. Jika dilihat dari rumus di atas nilai tegangan yang dapat dihasilkan melalui kedua elektroda adalah sebagai berikut:
E0sel = 0,339 – (-0,763) = 1,102 Volt.
E0sel yang didapat dari rumus elektrokimia diatas sebesar 1,102 volt sedangkan tegangan Aki basah yang di dapat sebesar 4,77 volt dengan menggunakan 5 sekat.
Tegangan yang di hasilkan pada aki basah hanya bertahan selama 744 jam, hal ini di karenakan karena salah satu elektroda mengalami penurunan mutu logam yang mengakibatkan elektroda tersebut patah. Elektroda yang patah tersebut adalah lempengan seng.
4.3 Nilai Kapasitansi
Kapasitansi yang di hasilkan adalah sebesar
4.4 Diskusi Jembatan Garam
Pada penelitian ini dibuat jembatan garam yang terbuat dari agar-agar dengan garam NaCl. Jembatan garam sangat berpengaruh dalam menjaga kenetralan pada larutan jeruk pada aki basah. Karena konsentrasi larutan elektrolit pada jembatan garam lebih tinggi daripada konsentrasi elektrolit di kedua bagian elektroda, maka ion negatif dari jembatan garam masuk ke salah satu setengah sel yang kelebihan kation dan ion positif dari jembatan garam berdifusi ke bagian lain yang kelebihan anion. Kation-kation di dalam jembatan garam berpindah ke wadah yang mengandung elektroda tembaga untuk menggantikan ion tembaga yang semakin habis. Sebaliknya, anion-anion pada jembatan garam berpindah ke sisi elektroda seng, yang menjaga agar larutan yang mengandung ion Zn2+ tetap bermuatan listrik netral. Adanya jembatan garam membuat lampu yang dihubungkan dengan aki bertahan hingga 744 jam.
Pada gambar perbandingan grafik tegangan saat diberi jembatan garam dan saat tidak diberi jembatan garam dapat kita lihat bahwa jatuh tegangan masing-masing aki berbeda. Dimana tegangan aki dengan tanpa jembatan garam berkurang nilainya dibandingkan dengan aki yang diberi jembatan garam.
5. KESIMPULAN DAN SARAN 5.1 Kesimpulan
1. Dengan menggunakan ekstrak buah pepaya sebagai pengganti larutan aki basah dapat menghasilkan nyala lampu LED. Maka dapat disimpulkan bahwa ekstrak buah pepaya memiliki potensi sebagai energi alternatif walaupun masih dalam kapasitas yang kecil dibandingkan energi yang dapat dihasilkan oleh aki basah yang ada saat ini. 2. Nilai tegangan maksimum pada desain aki basah dengan 5 sekat adalah 4,77 volt dan nilai arus sebesar 10,4 mA. Nilai Arus dan tegangan akan berkurang seiring waktu hal ini disebabkan karena arus dan tegangan yang hilang menjadi gelembung-gelembung yang menempel pada elektroda.
3. Elektroda seng yang berfungsi sebagai anoda lama-kelamaan mengalami penurunan mutu logam yang sering disebut dengan korosi (karat) yang menyebabkan seng menjadi patah sehingga elektoda seng hanya dapat digunakan sekali. Hal ini salah satu yang menyebakan aki tidak lagi menghasilkan tegangan dan arus.
4. Elektroda tembaga dapat digunakan berkali-kali, karena pada percobaan sel
volta tembaga mengalami reaksi reduksi (proses penerimaan elektron).
5. Tegangan aki dengan tanpa jembatan garam berkurang nilainya dibandingkan dengan aki yang diberi jembatan garam.
5.2 Saran
1. Mengganti lempengan seng menjadi lempengan yang lebih memiliki daya tahan terhadap korosi (karat), agar tegangan dan arus yang dihasilkan lebih tahan lama.
2. Melakukan penelitian di tempat yang lebih tertutup agar partikel-partikel kecil tidak bisa masuk ke dalam wadah aki.
DAFTAR PUSTAKA
1. Ade . 2011. Jembatan Garam.
http://kimia.upi.edu/ jembatan garam.htm. Diakses 15 Februari 2014.
2. Adityawan, aurino.2009. Sistem Pengisian Baterai Lead Acid secara Adaptif. Jurusan Teknik Elektronika, Politeknik Elektronika Negeri Surabaya.
3. Andy. 2009. General Chemistry for Senior Highschool Students. Jakarta
4. Anonim,A. 2012. Elektroda.
www.ut.ac.id/html/suplemen/elektroda.ht ml. Diakses 15 Februari 2014.
5. Azhar, Saleh. 2014. Dasar-Dasar Teknik Pelapisan Logam dengan Elektrolisis. Bandung: Yrama Wydia.
6. Englewoods, Cliff. 1978. Electronic Instrument and Measurements Techniques. USA. Prentice Hall inc
7. Etna,Rufiati.2011. Reaksi Redoks pada Sel Volta. Bandung
8. Hidayanto, Eko.2004. Respon Berbagai Bentuk Ukuran dan Bahan Elektroda pada Pengayaan Elektrolisis Tritium pada Sampel Air. Bandung. Institut Teknologi Bandung.
9. Karo-karo, Alexander. 2014. Desain Aki Kering Menggunakan Kulit Pisang Kepok (Musa Paradisiaca). Skripsi diterbitkan. Palembang: Universitas Sriwijaya. 10. Muhaimin, Drs. 2008. Bahan-Bahan Listrik.
11. N.Madison, Riddel Phil. 2014. What it an Electrode?. www.wisegeek.org. Diakses tanggal 20 Juli 2015.
12. Ralph H.Petrucci dan Suminar. 1987. Bagian-Bagian Aki Kering dan Aki Basah. www.yayansukayan.wordpress.com. Diakses 20 Juli 2015
13. Simbolon, Sabam. 2013. Desain Kapasitor Elektrochemical dengan Menggunakan Larutan Ekstrak Buah Sawo (Archas Zapota. L). Skripsi diterbitkan. Palembang: Universitas Sriwijaya. 14. Sitepu, Ray. 2014. Desain Aki Basah
Elektrochemical dengan Menggunakan Larutan Ekstrak Buah Jeruk Manis (Citrus Sinensis Linn). Skripsi diterbitkan. Palembang: Universitas Sriwijaya. 15. Syamsuhidayat, S.S dan Hutapea, J.R, 1991,