PEMBENTUKAN SENYAWA DIMER ANETOL DENGAN BIOKATALIS ENZIM LAKASE DARI JAMUR TIRAM PUTIH
SKRIPSI
SITI ZAINATUR RAHMAH
PROGRAM STUDI S1-KIMIA DEPARTEMEN KIMIA
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
SURABAYA
PEMBENTUKAN SENYAWA DIMER ANETOL DENGAN BIOKATALIS ENZIM LAKASE DARI JAMUR TIRAM PUTIH
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Bidang Kimia pada Fakultas Sains dan Teknologi Universitas Airlangga.
Oleh :
SITI ZAINATUR RAHMAH 080810514
Tanggal Lulus : 10 Agustus 2012
Disetujui Oleh :
Pembimbing I
Dr. Alfinda Novi Kristanti, DEA NIP. 196711151991022001
Pembimbing II
LEMBAR PENGESAHAN SKRIPSI
Judul : PEMBENTUKAN SENYAWA DIMER ANETOL
DENGAN BIOKATALIS ENZIM LAKASE DARI JAMUR
TIRAM PUTIH
Penyusun : Siti Zainatur Rahmah
NIM : 080810514
Pembimbing I : Dr. Alfinda Novi Kristanti, DEA
Pembimbing II : Dr. Sri Sumarsih, M. Si
Disetujui oleh :
Pembimbing I
Dr. Alfinda Novi Kristanti, DEA
NIP. 196711151991022001
Pembimbing II
Dr. Sri Sumarsih, M. Si
NIP. 196001019881002001
Mengetahui:
Ketua Program Studi Kimia
Fakulatas Sains dan Teknologi Universitas Airlangga
Dr. Alfinda Novi Kristanti, DEA
KATA PENGANTAR
Alhamdulillahirabbil ‘alamin, puji syukur kehadirat Allah SWT atas limpahan rahmat, taufiq dan hidayah-Nya sehingga penyusun dapat
menyelesaikan penulisan skripsi yang berjudul “Pembentukan Senyawa Dimer
Anetol dengan Biokatalis Enzim Lakase dari Jamur Tiram Putih”.
Pada kesempatan ini penyusun menyampaikan terima kasih yang
sebesar-besarnya kepada :
1. Ibu Dr. Alfinda Novi Kristanti, DEA selaku dosen pembimbing I atas
bimbingan, bantuan dan masukan yang sangat bermanfaat bagi
penyusun selama penyusunan skripsi ini.
2. Ibu Dr. Sri Sumarsih, M.Si selaku pembimbing II atas bantuan dan
kesabaran dalam memberikan bimbingan kepada penyusun.
3. Ibu Dra. Aning Purwaningsih, M.Si selaku dosen wali yang telah
memberikan pendampingan selama studi penyusun.
4. Para dosen program studi Kimia, Fakultas Sains dan Teknologi,
Universitas Airlangga. Semoga Allah selalu merahmati beliau semua.
5. Ayah, bunda, dan kakak tercinta atas hangatnya kasih sayang,
dukungan moral, material, dan spiritual.
6. Teman-teman angkatan 2008 Kimia, Fakultas Sains dan Teknologi,
Universitas Airlangga atas kebersamaan, kekompakan, kerjasama dan
7. Adik-adik mentoring 2009 (sinta dan lia), adik-adik mentoring 2010
(fisika, matematika, dan teknobiomedik), dan adik-adik mentoring
kimia 2011 (group RnB (Rombongan Ngaji Bareng)).
8. Teman seperjuangan Pipit Dwi N, Muhimmatus Sa’diyah, dan Dwi
Setya (lanjutkan perjuangan).
Penyusun menyadari bahwa naskah skripsi ini masih sangat banyak
kekurangan, oleh karena itu kritik dan saran yang membangun sangat penyusun
harapkan. Semoga skripsi ini dapat bermanfaat bagi perkembangan ilmu
pengetahuan.
Surabaya, 30 Agustus 2012
Penyusun,
Siti Zainatur Rahmah, 2012, Pembentukan Senyawa Dimer Anetol dengan Biokatalis Enzim Lakase dari Jamur Tiram Putih . Skripsi ini di bawah bimbingan Dr. Alfinda Novi Kristanti, DEA dan Dr. Sri Sumarsih, M.Si. Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga.
ABSTRAK
Penggunaan enzim sebagai biokatalis telah banyak digunakan untuk melakukan sintesis senyawa organik. Hal ini dikarenakan enzim bersifat spesifik dan ramah terhadap lingkungan. Salah satu enzim yang banyak digunakan adalah lakase yang merupakan golongan oksireduktase. Penelitian ini dilakukan dengan tujuan mensintesis dimer anetol dengan mengunakan biokatalis enzim lakase. Pada penelitian ini digunakan minyak anis yang mengandung 90% anetol, enzim lakase sebagai biokatalis, dan hidrokuinon sebagai mediator. Enzim lakase yang digunakan merupakan hasil isolasi dari jamur tiram putih (Pleurotus ostreatus) yang memiliki aktivitas sebesar 712,758 U/L. Reaksi pembentukan dimer anetol dilakukan dalam medium bifasa (etil asetat : buffer fosfat = 4:1) yang dilakukan selama 24 jam dan 48 jam. Hasil reaksi kemudian diekstraksi dengan etil asetat dan menghasilkan cairan kental berwarna kecoklatan dengan intensitas warna yang lebih pekat pada reaksi 48 jam. Perbandingan hasil uji GC terhadap minyak anis, reaksi 24 jam, dan reaksi 48 jam menunjukan adanya penambahan peak dan perubahan tinggi puncak pada reaksi 48 jam. Senyawa anetol dan p-anisaldehid memiliki %area yang lebih kecil dibanding pada reaksi 24 jam. Diduga pada reaksi 48 jam dihasilkan senyawa baru yang berasal dari hasil reaksi oksidasi yaitu kariofilena oksida, namun belum teridentifikasi senyawa yang merupakan dimer anetol.
Siti Zainatur Rahmah, 2012, Formation of Dimer Anethol Compounds by Biocatalys Laccase Enzyme from White Oyster Mushroom.This scription under guidance Dr. Alfinda Novi Kristanti, DEA and Dr. Sri Sumarsih, M.Si.Chemical Departemen, Faculty of Science and Technology, Airlangga University.
ABSTRACT
Enzymes as biocatalyst has been much used to perform synthesis of organic compounds. This is because the enzyme is specific and friendly to the environment. The purpose this research is synthesis dimer anethol using laccase enzyme biocatalyst. Laccase enzyme that is widely used is that a group oxireductase. In this study use anise oil containing 90% anethole, the laccase enzyme as a biocatalyst, and hydroquinone as a mediator. Laccase enzyme used is the isolation of the white oyster mushroom (Pleurotus ostreatus) which has the activity of 712,758 U/L. Anetol dimerization performed in medium bifase (ethyl acetate : phosphate buffer = 4:1) is carried out for 24 hours and 48 hours. The reaction was extracted with ethyl acetate and produce a brownish viscous liquid with a more color intensity in the reaction 48 hours. Comparison of GC assay results of anise oil, reaction 24 hours, and 48 hours showed the reaction to the addition of high-peak and peak changes in the reaction 48 hours. Anethole compound and p-anisaldehyde %area smaller than in the reaction 24 hours. Identification of 48 hours reaction estimed there are new compounds from of the oxidation reaction is caryophyllene oxide, but has not identifed a dimer anethole compound.
DAFTAR ISI
BAB II TINJAUAN PUSTAKA ... 5
2.1 Jamur tiram putih ... 5
2.2 Enzim ... 5
2.2.1 Penggolongan enzim ... 6
2.2.2 Kespesifikan enzim ... 6
2.2.3 Mekanisme kerja enzim ... 7
2.3Metalloenzyme... 8
2.4 Enzim lakase ... 8
2.5 Minyak atsiri ... 10
2.6 Senyawa fenolik ... 11
2.7 Anetol... 13
2.8 Dimerisasi dengan kopling oksidatif fenolik ... 15
2.9 Kromatografi ... 17
2.9.1 Kromatografi lapis tipis (KLT) ... 17
2.10 Spektroskopi... 19
2.10.1 Spektroskopi ultraviolet visibel... 19
2.10.2 GC-MS Spektrometri ... 19
BAB III METODE PENELITIAN ... 20
3.1 Tempat penelitian ... 20
3.2 Bahan dan alat penelitian ... 20
3.2.1 Bahan penelitian ... 20
3.2.2 Bahan kimia ... 20
3.2.4 Alat penelitian ... 20
3.3 Prosedur kerja ... 21
3.3.1 Isolasi enzim lakase dari jamur tiram putih ... 21
3.3.2 Penentuan aktivitas enzim lakase... 21
3.3.3 Reaksi dimerisasi anetol dengan katalis enzim lakase... 22
BAB IV HASIL DAN PEMBAHASAN ... 26
4.1 Isolasi enzim lakase dari jamur tiram putih ... 26
4.2 Pengendapan ekstrak kasar enzim lakase ... 27
4.3 Penentuan aktivitas enzim lakase... 29
4.4 Reaksi dimerisasi anetol dengan katalis enzim lakase... 31
4.5 Analisis produk reaksi... 35
4.5.1 Analisis GC-MS ... 36
BAB V KESIMPULAN DAN SARAN ... 43
5.1 Kesimpulan ... 43
4.2 Saran ... 43
DAFTAR TABEL
Nomor Judul Tabel Halaman
4.1 Penggolongan enzim... 6
4.2 Kadar minyak atsiri, anetol, fencon dan estragol dalam adas dan
anis ... 14
4.3 Data kandungan senyawa pada reaksi 24 jam... 39
DAFTAR GAMBAR
Nomor Judul Gambar Halaman
2.1 Jamur tiram putih (Pleurotus ostreatus)... 5
2.2 Struktur enzim lakase yang diisolasi dariM. albomyces... 8
2.3 3-Hydroxyanthranilic acid(HAA) dan 2,2′-azino-bis -(3-ethylbenzothiazoline-6-sulphonicacid)(ABTS) ... 9
2.4 Mekanisme kopling oksidatif eugenol dengan mediator hidroquinon... 10
2.5 Struktur anetol... 13
2.6 Struktur kimia cis-anetol (a), trans-anetol (b)... 14
2.7 Biosintesis propenilfenol dari jalur shikimat. ... 15
2.8 Pembentukan senyawa dimer fenolik ... 16
2.9 . Pembentukan kopling dehidrodieugenol (orto-orto). ... 17
2.10 Instrumentasi GC-MS ... 20
2.11 Agregasi protein akibat interaksi muatan berlawanan dari protein satu dengan protein lain ... 28
2.12 Denaturasi protein akibat pelarut organik... 29
2.13 Proses pengendapan protein dengan aseton ... 30
2.14 Reaksi oksidasi asam2,2’ -Azinobis-di-(3-ethylbenzthiazoline-6-sulfonate)(ABTS) ... 31
2.15 Grafik hubungan absorbansi radikal kation ABTS terhadap waktu... 31
2.16 Skema sistem mediator lakase ... 33
2.17 Mekanisme kerja Cu pada enzim lakase ... 34
2.18 Hasil pengamatan reaksi dimerisasi anetol dan kontrol... 35
2.19 Proses ekstraksi dan produk hasil reaksi dengan enzim lakase ... 36
2.20 Hasil KLT (a) minyak anis (b) produk reaksi 24 jam (c) produk reaksi 48 jam... 37
2.21 Kromatogram minyak atsiri anis... 38
2.23 Kromatogram hasil reaksi minyak anis selama 24 jam ... 39
2.24 Kromatogram hasil reaksi minyak anis selama 48 jam ... 40
2.25 Mekanisme reaksi oksidasi kariofilena dengan oksigen menjadi
kariofilena oksida... 42
2.26 Spektrum massa senyawa kariofilena oksida... 42
2.27 Spektrum massa senyawa
1-(4-Metoksi-fenil)-2-fenil-eten-1,2-dion ... 43
BAB I PENDAHULUAN
1.1 Latar Belakang Masalah
Indonesia adalah suatu negara kepulauan yang memiliki hutan tropika
terbesar kedua di dunia, kaya dengan keanekaragaman hayati dan dikenal sebagai
salah satu dari 7 (tujuh) negara megabiodiversity setelah Brazilia. Distribusi
tumbuhan tingkat tinggi yang terdapat di hutan tropika Indonesia lebih dari 12 %
(30.000) dari yang terdapat di muka bumi (250.000) (Ersam, 2004). Dengan fakta
ini, menjadikan Indonesia sebagai negara yang berperan dalam memenuhi
kebutuhan dunia akan minyak kelapa sawit, rempah-rempah, dan minyak atsiri.
Dewasa ini minyak atsiri merupakan komoditas ekspor Indonesia yang
meningkat signifikan sejak 2005 (Anonim, 2006). Minyak atsiri ini biasanya
digunakan dalam industri farmasi, kosmetik, parfum, maupun makanan dan
minuman. Minyak atsiri merupakan metabolit sekunder tumbuhan yang berfungsi
sebagai pertahanan diri dan sarana yang merupakan daya tarik bagi lawan
jenisnya (Guenther dan Ketaren, 2006).
Di antara sekian banyak produk minyak atsiri yang dihasilkan, Indonesia
dikenal sebagai penghasil minyak adas dan minyak anis yang sebagaian besar
terdapat di Yogyakarta, Boyolali, dan Sumatera (Handayani, 2001). Minyak atsiri
anis diketahui mengandung senyawa golongan propenil fenol, yaitu anetol sebesar
80-90% (Rostiana, 2007). Anetol biasanya digunakan sebagai salah satu bahan
dasar dari minyak telon dan obat-obatan. Selain itu anetol juga memiliki aktivitas
Senyawa metabolit sekunder dalam minyak atsiri diantanya merupakan
golongan terpenoid, fenolik, dan aril propanoid (Verpoorte,et al., 2000). Di alam,
senyawa aril propanoid ditemukan dalam beberapa kelompok berdasarkan
strukturnya yaitu lignan, alil fenol, propenil fenol, dan sinamat. Lignan sebagai
senyawa yang lebih kompleks dapat disintesis dari kelompok senyawa aril
propanoid yang lebih sederhana seperti kelompok propenil fenol (Lenny, 2006).
Dewasa ini banyak penelitian dilakukan untuk mentransformasi senyawa
aril propanoid menjadi senyawa lain yang memiliki aktivitas biologis yang lebih
tinggi. Salah satu cara yang dilakukan yaitu dengan mensintesis senyawa dimer
propenil fenol. Hal ini telah dilakukan oleh Arifin (2008) yang mensintesis
senyawa dimer dari eugenol. Senyawa dimer eugenol ini kemudian diuji
aktivitasnya sebagai antioksidan. Hasil uji aktivitas menunjukkan senyawa
eugenol memiliki nilai IC50 yang lebih rendah dibandingkan senyawa dimernya.
Dengan demikian pembentukan senyawa dimer eugenol dapat meningkatkan
aktivitas antioksidan.
Reaksi penggabungan (kopling) senyawa propenil fenol untuk membentuk
senyawa dimer dapat dilakukan dengan menggunakan katalis asam seperti HCl
(Ngadiwiyana, dkk., 2002), maupun melalui pembentukan radikal dengan UV.
Namun cara yang terakhir ini memiliki kekurangan yaitu produk yang dihasilkan
merupakan produk campuran lebih dari 5 senyawa (Castro, et al., 2010).
Penggunaan katalis dalam reaksi kopling cukup mahal dan kurang ramah terhadap
lingkungan sehingga banyak penelitian yang dilakukan untuk menemukan katalis
Reaksi dimerisasi senyawa turunan propenil fenol juga dapat dilakukan
dengan menggunakan biokatalis enzim oksireduktase, seperti enzim lakase (Zille,
2005). Berdasarkan penelitian sebelumnya, enzim lakase dapat diisolasi dari
jamur pelapuk kayu (Risdianto, dkk., 2008), kapang dari tandan kosong kelapa
sawit (Dewi, 2011), dan jamur tiram putih (Arifin, 2008). Enzim lakase yang
disolasi dari jamur tiram putih memiliki aktivitas spesifik sebesar 0,56 unit/mg
protein (Arifin, 2008). Dalam proses katalitiknya, enzim lakase menggunakan
oksigen dan hanya menghasilkan air sebagai produk samping, sehingga enzim ini
merupakan katalis yang ramah lingkungan (Riva, 2006).
Mengacu dari keberhasilan pada penelitian sebelumnya, telah dihasilkan
produk senyawa dimer golongan propenil fenol yang bersifat bioaktif, antara lain
senyawa dimer dari guaiakol (Andrian, 2007), etil ferulat (Junaedi, 2007), dan
asam ferulat (Permatasari, 2007). Oleh karena itu, pada penelitian ini akan
dilakukan reaksi dimerisasi terhadap golongan propenil fenol, yaitu anetol dengan
katalis enzim lakase dari jamur tiram putih. Proses ini diharapkan dapat menjadi
alternatif dalam penyediaan senyawa dimer propenil fenol dengan rendemen yang
besar, bioaktivitas yang tinggi serta prosesnya bersifat ramah lingkungan. Produk
yang terbentuk dari hasil sintesis akan diidentifikasi menggunakan metode
spektroskopi GC-MS.
1.2 Rumusan Masalah
1. Berapa besar aktivitas unit enzim lakase yang diisolasi dari jamur tiram putih?
2. Apakah enzim lakase yang diisolasi dari jamur tiram putih dapat digunakan
1.3 Tujuan
1. Mengetahui aktivitas unit enzim lakase yang diisolasi dari jamur tiram pitih.
2. Mengetahui apakah enzim lakase yang diisolasi dari jamur tiram putih dapat
digunakan dalam mensintesis senyawa aktif dimer anetol dari minyak anis.
1.3 Manfaat
Hasil penelitian ini diharapkan dapat menghasilkan pengetahuan baru tentang
pembentukan senyawa dimer anetol dengan menggunakan biokatalis enzim lakase
BAB II
TINJAUAN PUSTAKA
2.1 Jamur Tiram Putih
Jamur adalah organisme yang tidak berklorofil sehingga jamur tidak dapat
menyediakan makanan sendiri dengan cara fotosintesis seperti pada tanaman yang
berklorofil. Salah satu contoh golongan jamur yang banyak dikonsumsi
masyarakat adalah jamur tiram (Pleurotus ostreatus). Secara alamiah golongan
jamur ini menempel pada pohon di daerah bersuhu antara 10-32 oC dengan
pertumbuhan optimum pada suhu 25-26 oC. Suhu pertumbuhan jamur tiram pada
saat inkubasi lebih tinggi dibandingkan suhu pada saat pertumbuhan
(pembentukan tubuh buah jamur). Suhu inkubasi jamur tiram berkisar antara
22-28 oC dengan kelembaban 60-80 %, sedangkan suhu pada pembentukan tubuh
buah berkisar antara 16-22oC (Dewi, 2009).
Taksonomi jamur tiram putih
2.2 Enzim
Enzim merupakan suatu protein yang dapat mengkatalisis suatu reaksi
kimia dalam makhluk hidup. Sama seperti protein, enzim tersusun dari rantai
lurus asam amino yang kemudian mengalami proses pelipatan membentuk suatu
struktur tiga dimensi.
2.2.1 Penggolongan enzim
Enzim mempunyai nama yang kompleks berdasarkan sistem
penggolongan yang didasarkan pada jenis reaksi yang dikatalisisnya. Golongan
enzim utama diringkas dalam tabel 1.1 dibawah ini.
Tabel 4.1 Penggolongan Enzim (Stryer,et al., 2007)
No Golongan Enzim Jenis reaksi yang dikatalisis
1 Oksireduktase Oksidasi-reduksi. Donor hidrogen atau donor
elektron
2 Transferase Transfer gugus kimia dengan bentuk umum
3 Hidrolase Pemutusan secara hidrolitik pada ikatan C,
C-N, C-O, dan ikatan lainnya.
4 Liase Pemutusan (bukan hidrolitik) pada ikatan C-C,
C-O, dan ikatan lainnya, menyisakan ikatan
rangkap; atau, penambahan gugus pada ikatan
rangkap dua.
5 Isomerase Perubahan susunan geometris pada suatu
molekul
2.2.2 Kespesifikan enzim
Sifat khusus enzim yang paling utama adalah spesifisitas dan aktivitas
katalitik. Spesifisitas enzim sangat tinggi baik terhadap reaksi yang dikatalisisnya
ataupun terhadap substrat yang dilibatkan dalam reaksi (Horton, et al., 2002).
Secara umum terdapat empat jenis enzim yang berbeda spesifisitasnya, yaitu :
Absolute specificity: enzim mengenali satu jenis substrat
Group specificity : enzim yang bertindak pada molekul yang spesifik
gugus fungsionalnya
Linkage specifity: Enzim bertindak pada jenis ikatan kimia tertentu
Stereochemical specifity : enzim bertindak pada isomer sterik atau optik
tertentu
2.2.3 Mekanisme kerja enzim
Dalam proses kerjanya, enzim tidaklah merubah konstanta kesetimbangan,
tetapi dengan enzim dibutuhkan energi yang lebih rendah untuk mengkonversi
substrat menjadi produk. Proses katalisis dimulai dengan diikatnya substrat pada
daerah sisi aktif enzim sehingga membentuk kompleks enzim substrat dan terjadi
reaksi kimia diakhiri dengan pelepasan enzim dan produk (Stryer, et al, 2007).
E + S
Kompleks ES
EP
E + P
Mekanisme katalisis enzim melibatkan gugus fungsi yang terdapat pada
sisi aktif enzim. Sisi aktif enzim adalah tempat pengikatan substrat yang
mengandung residu asam amino yang berperan dalam pembuatan dan pemutusan
ikatan selama proses katalisis. Ikatan – ikatan yang terjadi antara enzim dan
substrat adalah ikatan elektrostatik, ikatan hidrogen, gaya Van Der Walls ataupun
gugus pengikat (binding group). Gugus yang terlibat dalam proses katalitik antara
enzim dan substrat disebut gugus katalitik (catalytic group). Gugus katalitik
terletak pada gugus samping enzim (Horton,et al. 2002).
2.3Metalloenzyme
Metalloenzymeadalah sebuah protein enzimatik yang memiliki hubungan
kuat antara bagian protein dan logam, dimana logam tertanam di dalam molekul
enzim ini. Logam yang terdapat pada enzim ini biasanya dalam bentuk ion dan
peran utamanya adalah berfungsi dalam reaksi enzimatik. Logam memainkan
peran langsung dalam pengikatan atom yang bekerja untuk membantu
menstabilkan protein setelah reaksi enzimatik.
Logam juga membantu dalam proses transfer elektron. Logam ini berada
di sisi aktif dari enzim, dimana mereka bertindak sebagai elektrofil yang menarik
elektron dari zat lain untuk membentuk sebuah ikatan (Cynthia,et al., 2004)
2.4 Enzim lakase
Lakase (EC 1.10.3.2; benzendiol: oksigen oksidoreduktase) sebagian besar
merupakan glikoprotein ekstraseluler yang mengandung atom tembaga dengan
bobot molekul 60-80 kDa. Lakase merupakan enzim multy-copper (mangandung
banyak ion tembaga) sehingga dapat membantu katalisis reaksi oksidasi beberapa
substrat seperti polifenol, substituen fenol, dan diamin. Enzim ini pertama kali
ditemukan dalam getah pohon pernis Jepang (Rhus vernicifera), pada tahun 1988
Gambar 2.2 Struktur enzim lakase yang diisolasi dariM. albomyces (Skalova,et al.,2007)
Enzim lakase merupakan salah satu enzim yang banyak diteliti sejak abad
ke 19. Enzim lakase banyak terdapat pada jamur dan tanaman tingkat tinggi. Pada
kelompok jamur, enzim lakase telah diisolasi dari jamur golongan Ascomycetes,
Deuteromycetes, Basidiomycetes. Enzim ini termasuk ke dalam kelompok
oksidoreduktase, yang dapat mengkatalis reaksi oksidasi dan reduksi. Enzim
lakase dapat mengkatalis proses oksidasi senyawa golongan fenolik menjadi
radikal, yang selanjutnya dapat membentuk dimer, oligomer, maupun polimerasi.
Dalam mekanismenya, enzim lakase menggunakan oksigen, dan hanya
menghasilkan air sebagai produk samping. Oleh karena itu, enzim ini merupakan
enzim yang sangat ramah lingkungan.
Lakase telah banyak diteliti karena sifat spesivitasnya yang rendah
terhadap substrat. Hidrokuinon, guaiakol, 2,6-dimetoksifenol, dan p-fenildiamin
merupakan substrat-substrat yang sering digunakan. Substrat seperti
2,2-azinobis-3-etilbenzethiazolin-6-sulfonat (ABTS) berperan sebagai mediator yang
dioksidasi oleh lakase sendiri. Senyawa-senyawa yang telah digunakan sebagai
mediator dalam industri antara lain, HAA dan ABTS.
Gambar 2.3 Struktur senyawa (a). 3-Hydroxyanthranilic acid (HAA) (b). 2,2′-azino-bis-(3-ethylbenzothiazoline-6-sulphonicacid)(ABTS)
Mekanisme reaksi enzimatis oleh lakase adalah reaksi oksidasi satu
elektron. Oksigen dibutuhkan sebagai penerima elektron dan kemudian
membentuk air. Ketika reaksi oksidasi berlangsung, substrat kehilangan satu
elektronnya dan membentuk radikal fenoksi bebas yang berperan sebagai senyawa
perantara. Radikal bebas yang terbentuk tersebut dapat melangsungkan reaksi
oksidatif enzimatik selanjutnya atau reaksi non-enzimatik seperti hidrasi dan
polimerisasi (Rochefort, et al., 2004). Salah satu contohnya adalah dalam
pembentukan dimer eugenol, berikut :
2.5 Minyak atsiri
Secara biologis, minyak atsiri merupakan metabolit sekunder yang
biasanya berperan sebagai alat pertahanan diri agar tidak dimakan oleh hewan
(hama) ataupun sebagai agen untuk bersaing dengan tumbuhan lain dalam
mempertahankan ruang hidup. Pada mulanya istilah “minyak atsiri” atau minyak
eteris adalah istilah yang digunakan untuk minyak mudah menguap dan diperoleh
dari tanaman dengan cara penyulingan uap. Definisi ini dimaksudkan untuk
membedakan minyak/lemak dengan minyak atsiri yang berbeda tanaman
penghasilnya (Agusta, 2002).
Intensitas suatu bau (harum yang dihasilkan, dengan kekecualian pada
kondisi tertentu) merupakan manifestasi dari sifat mudah menguap persenyawaan
yang menghasilkan bau harum tersebut (Guenther, 2006). Minyak atsiri yang
mudah menguap terdapat di dalam kelenjar minyak khusus di dalam kantung
minyak atau di dalam ruang antar sel dalam jaringan tanaman. Minyak atsiri
tersebut harus dibebaskan sebelum disuling yaitu dengan merajang/memotong
jaringan tanaman dan membuka kelenjar minyak sebanyak mungkin, sehingga
minyak dapat dengan mudah diuapkan (Guenther, 2006).
Minyak atsiri yang bagian utamanya terpenoid terdapat pada fraksi atsiri
yang tersuling uap. Zat inilah penyebab harum, wangi dan bau yang khas pada
banyak tumbuhan (Harborne, 2000). Ditinjau dari segi kimia fisika, minyak atsiri
hanya mengandung dua golongan senyawa yaitu oleopyna dan strearopyena.
Oleopyna adalah bagian hidrokarbon di dalam minyak atsiri dan berwujud cairan.
Sedangkan strearopyena adalah senyawa hidrokarbon teroksigenasi yang
2.6 Senyawa fenolik
Senyawa fenolik adalah senyawa yang terbentuk atas cincin aromatik yang
sekurang-kurangnya tersubtitusi oleh satu gugus hidroksil. Contoh yang paling
sederhana adalah fenol. Senyawa fenolik merupakan metabolit sekunder yang ada
di alam dan biasanya berada dalam bentuk polimernya ataupun terikat pada
beberapa gugus fungsi membentuk eter, ester, dan glikosida. Sebagian besar
senyawa fenolik termasuk ke dalam golongan oligostilbenoid, flavonoid, fenil
propanoid, dan turunan asam fenolat (Saroyobudiyono dan Aisyah, 2006).
Aktivitas fisiologis senyawa fenolik yang terdapat pada tumbuhan sangat
beragam. Beberapa senyawa tertentu yang tergolong flavanoid, berperan dalam
merangsang atau menarik serangga untuk penyerbukan bunga. Selain itu, senyawa
fenolik tertentu juga dapat dimanfaatkan manusia sebagai antikanker,
antioksidan, antimikroba, herbisida dan lain-lain (Andrian, 2007).
Menurut Lenny (2006) senyawa fenolik dapat dibedakan menjadi dua
golongan berdasarkan biogenetiknya, yaitu senyawa yang berasal dari jalur
shikimat dan asetat malonat. Namun ada juga senyawa-senyawa yang berasal dari
kombinasi antara kedua jalur biosintesa ini yaitu senyawa-senyawa flavonoida.
Senyawa fenolik yang berasal dari jalur shikimat yang utama adalah
fenilpropanoid. Senyawa fenol ini memiliki kerangka dasar karbon yang terdiri
atas cincin benzen (C6) yang terikat pada ujung rantai karbon propan (C3).
Kelompok senyawa fenol ini banyak ditemukan dalam tumbuhan tingkat tinggi.
Beberapa jenis senyawa yang termasuk fenil propanoid adalah turunan asam
Senyawa fenol yang bersal dari jalur asetat malonat disebut senyawa
poliketida. Senyawa poliketida dapat diklasifikasikan berdasarkan pola struktur
tertentu yang berkaitan dengan jalur biogenetiknya diantaranya turunan kromon,
antraquinon, dan turunan benzokuinon. Senyawa poliketida memiliki kerangka
dasar aromatik yang disusun oleh beberapa unit dua atom karbon dan membentuk
suatu rantai karbon yang linier yakni asam poli β-ketokarboksilat yang disebut
rantai poliasetil (Manitto, 1999).
2.7 Anetol
Anetol memiliki nama lain sebagai para-anisaldehid, para-metoksi
propenil benzen atau “anise champor”, mempunyai rumus kimia C10H12O, berat
molekul 148,20 g/mol dan memiliki struktur kimia seperti pada gambar 2.7
(Kusumaningsih, 2000). Kandungan anetol dalam minyak adas maupun minyak
anis mengeluarkan aroma yang khas anetol (Sastrohamidjojo, 2004).
Gambar 2.5 Struktur anetol
Struktur kimia anetol terdiri dari cincin aromatis dengan dua rantai
samping berupa alil dan metoksi. Hal ini memungkinkan anetol untuk dikonversi
menjadi senyawa lain dengan tingkat kemanfaatan yang lebih tinggi. Gugus alil
yang dimiliki anetol ini sama dengan gugus yang dimiliki oleh eugenol sehingga
dapat mengalami polimerisasi kationik dengan menggunakan katalis Friedel
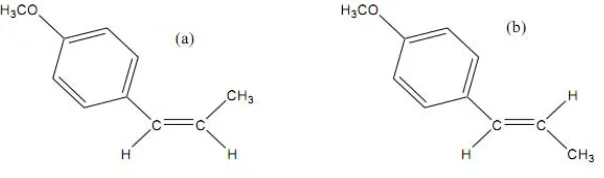
cisdantrans.cis-Anetol memiliki titik didih 70-70,5 oC/2,3 mmHg. trans-Anetol
memiliki titik didih 81-81,5oC/2,3 mmHg (Kusumaningsih, 2000). Struktur kimia
cisdantransanetol ditunjukkan pada gambar 2.6.
Gambar 2.6 Struktur kimiacis-anetol (a),trans-anetol (b)
Anetol berwujud cair tak berwarna pada suhu 22,5 0C dan bersifat optis
inaktif, berbau anis dan rasanya manis. Anetol tidak dapat mengkristal, berwarna
kuning dan agak pahit dengan disertai kenaikan berat jenis di atas 1 jika terkena
cahaya, udara, air atau kalor. Kelarutan anetol dalam air kurang baik karena anetol
mempunyai sifat polaritas rendah. Dalam industri, anetol biasanya digunakan
sebagai bahan dasar minyak telon dan obat batuk (Freire,et al., 2005).
Sebagian besar anetol dapat diperoleh dari hasil isolasi minyak atsiri anis
dan sebagian adas. Anis (Pimpinella anisum L.) merupakan salah satu
tanaman yang tergolong famili Apiaceae, berasal dari Asia, Yunani dan Mesir.
Bagian tanaman yang digunakan adalah buahnya yang mengandung minyak
atsiri yang terdiri dari anetol (80-90%), pinen, fencon, metil kavikol,
anisaldehid, kamfen, dan felandren (Rostiana, 2007). Berikut perbandingan kadar
anetol yang terdapat dalam beberapa tanaman adas dan anis.
Tabel 4.2 Kadar minyak atsiri, anetol, fencon dan estragol dalam adas dan anis (Anonim, 2006)
Barat
Anetol merupakan senyawa golongan fenilpropanoid yang merupakan
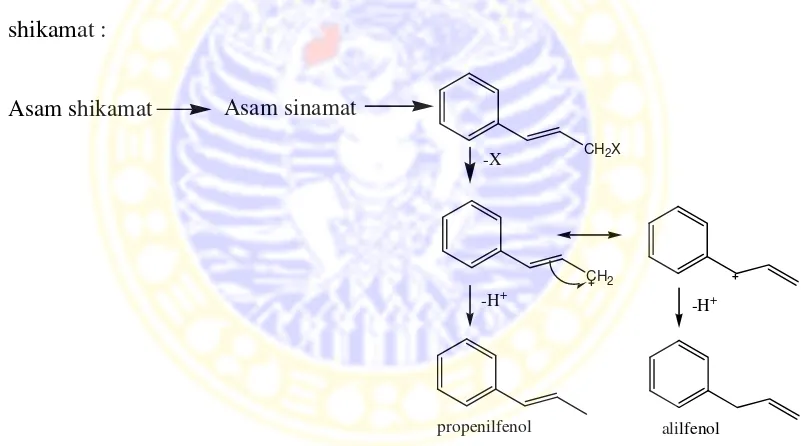
senyawa turunan propenilfenol. Propenilfenol ini merupakan senyawa yang
bertalian satu sama lain dengan alilfenol. Berikut proses biosintesisnya dari jalur
shikamat :
Gambar 2.7 Biosintesis propenilfenol dari jalur shikimat
2.8 Dimerisasi melalui kopling oksidatif fenolik
Pembentukan senyawa dimer dapat dilakukan melalui reaksi kopling
oksidatif. Reaksi kopling oksidatif sendiri merupakan suatu reaksi penggabungan
antara dua molekul atau lebih, yang telah teroksidasi dalam bentuk radikalnya.
peroksidase dan lakase (Dewick, 1997) Radikal yang terbentuk akan mengalami
resonansi dan menghasilkan intermediet radikal yang selanjutnya akan mengalami
penggabungan. Berikut mekanisme penggabungan serta kemungkinan produk
yang dihasilkan (Eickhoff,et al., 2000).
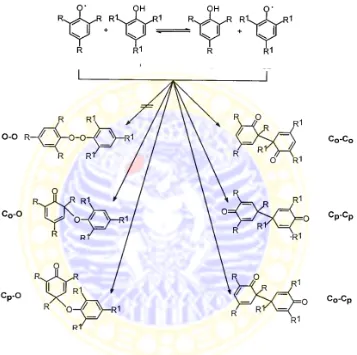
Gambar 2.8 Pembentukan senyawa dimer fenolik
Seperti yang terlihat pada gambar di atas bahwasanya hasil kopling radikal
fenoksi dapat membentuk dimer fenolik, baik pada orto-orto, para-para, maupun
orto-para. Selain itu juga terdapat kemungkinan penggabungan O-para, O-orto,
dan O-O, bergantung pada kestabilan peroduk kopling oksidatif.
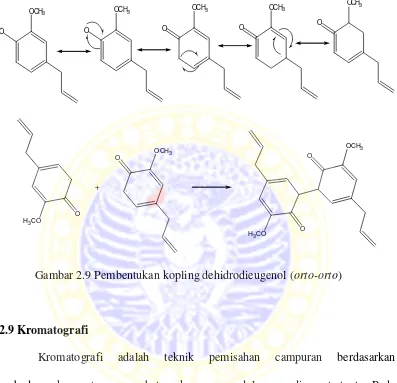
dihasilkan produk dimer dari kopling posisi orto-orto yang dominan. Hal ini
dikarenakan kestabilan radikalnya lebih tinggi dibandingkan pada posisi lainnya
dan juga halangan steriknya yang lebih kecil. Berikut proses pembentukannya :
OCH3
Gambar 2.9 Pembentukan kopling dehidrodieugenol (orto-orto)
2.9 Kromatografi
Kromatografi adalah teknik pemisahan campuran berdasarkan
perbedaan kecepatan perambatan komponen dalam medium tertentu. Pada
kromatografi, komponen-komponennya akan dipisahkan antara dua buah fase
yaitu fase diam dan fase gerak. Fase diam akan menahan komponen
campuran sedangkan fase gerak akan melarutkan komponen campuran.
Komponen yang mudah tertahan pada fase diam akan tertinggal, sedangkan
komponen yang mudah larut dalam fase gerak akan bergerak lebih cepat
2.9.1 Kromatografi lapis tipis (KLT)
Fenomena yang terjadi pada KLT adalah berdasarkan pada prinsip
adsorpsi. Setelah sampel ditotolkan di atas fasa diam, senyawa-senyawa dalam
sampel akan terelusi dengan kecepatan yang sangat bergantung pada sifat-sifat
kemampuan terikat pada fasa diam dan kemampuan larut dalam fasa gerak, sifat
kekuatan elektrolisis yang menarik senyawa di atas fasa diam kemampuan
melarutkan senyawa. Pada KLT, secara umum senyawa yang memiliki kepolaran
rendah akan terelusi lebih cepat daripada senyawa polar karena senyawa polar
terikat lebih kuat pada bahan silika yang mengandung silanol (SiOH2) yang pada
dasarnya memiliki avinitas yang kuat terhadap senyawa polar (Gritter, dkk.,
1999).
Karena prosesnya yang mudah dan cepat, KLT banyak digunakan untuk
melihat kemurnian senyawa organik. Biasanya analisis dilakukan dengan
mengubah pelarut beberapa kali (minimal 3 macam) dan hasil elusi tetap
menampakkan satu noda maka akan dapat dikatakan bahwa sampel yang
ditotolkan adalah murni. Selain itu, karena KLT juga dapat menampakkan jumlah
senyawa dalam campuran sampel (menurut noda yang muncul), maka KLT dapat
digunakan untuk mengikuti atau mengontrol jalannya reaksi organik maupun
untuk mengontrol proses pemisahan campuran yang dilakukan menggunakan
kromatografi kolom, kromatografi preparatif, dan kromatotron. KLT ini juga
merupakan suatu cara yang umum dilakukan untuk memilih pelarut yang sesuai
sebelum dilakukan pemisahan menggunakan berbagai jenis kromatografi .
dilihat secara visual, tetapi untuk noda yang tidak berwarna dapat diamati dengan
cara menggunakan sinar lampu UV, uap iodium dan pereaksi penampak noda.
Noda yang telah didapat diberi tanda, dan dihitung harga Rf (Rizvi, 2008).
Jarak titik pusat bercak dari titik awal Rf = ---Jarak garis depan dengan titik awal
2.10 Spektroskopi
Metode spektoskopi berguna dalam penentuan struktur molekul. Terdapat
banyak teknik spektroskopi yang sering digunakan dalam penentuan struktur
molekul dan berat molekul. Salah satunya adalah spektroskopi ultraviolet visible.
2.10.1 Spektroskopi ultraviolet visibel
Spektroskopi ulatraviolet Visible (UV-Vis) adalah analisis yang
didasarkan pada interaksi sinar dengan panjang gelombang tertentu dengan suatu
materi. Materi atau zat tersebut menyerap (absorbsi) sinar, kemudian ditransfer ke
atom atau molekul dalam sampel. Dalam hal ini, elektron terluar dipromosikan
dari tingkat energi yang lebih rendah ke energi yang lebih tinggi (Underwood,
1998).
Spektrum serapan kandungan tumbuhan dapat diukur dalam larutan yang
sangat encer dengan blanko pelarut analit tersebut. Pelarut yang sering digunakan
yaitu etanol 95%, hal ini dikarenakan sebagian besar senyawa larut dalam pelarut
tersebut. Pelarut lain yang umum digunakan antara lain air, metanol, n-heksana,
petroleum eter, dan eter. Senyawa yang tidak berwarna diukur pada panjang
gelombang 200-400 nm. Sedangkan senyawa berwarna diukur pada panjang
2.10.3 GC-MS Spektrometri
Kromatografi Gas–Spektrometri Massa merupakan suatu instrumen
gabungan kromatografi dan spektroskopi. Instrumen ini terdiri dari kromatografi
gas (GC) yang merupakan alat pemisah berbagai komponen dalam analit dan
spektrometer massa (MS) untuk mendeteksi struktur tiap komponen yang telah
dipisahkan. Banyak campuran senyawa kimia yang dapat dipisahkan,
diidentifikasi, dan dihitung kadarnya dengan GC-MS.
Senyawa yang akan dianalisis dengan GC-MS harus bersifat volatil dan
stabil terhadap suhu. Selain itu komponen campuran harus mempunyai kelarutan
yang baik di dalam fasa gerak. Untuk senyawa yang kurang volatil atau bahkan
tak volatil harus diubah dulu menjadi turunan yang volatil dan lebih stabil
(Gritter,et al., 1999).
Komponen pada instrumen GC antara lain adalah: tangki gas pembawa
dengan pengatur tekanan dan pengontrol aliran gas, kolom, fase diam, sistem
injeksi, detektor, pengontrol temperatur oven, sistem ionisasi, dan perekam
kromatogram (Skoog,et al., 1997). Berikut instrumen GC-MS :
G
BAB III
METODE PENELITIAN
3.1 Tempat penelitian
Penelitian dilaksanakan pada bulan Februari-Juni 2012, di Laboratorium
Kimia Organik dan Biokimia Departemen Kimia Fakultas Sain dan Teknologi
Universitas Airlangga Surabaya.
3.2 Bahan dan alat penelitian 3.2.1 Bahan penelitian
Bahan yang digunakan dalam penelitian ini berupa jamur tiram putih dan
minyak anis
3.2.2 Bahan kimia
Bahan-bahan kimia yang digunakan dalam penelitian ini adalah buffer
fosfat, aseton, aquadem, hidroquinon, n-heksan, etilasetat, etanol, dan ABTS.
3.2.3 Alat penelitian
Alat-alat penelitian yang digunakan dalam penelitian ini meliputi blender,
labu erlenmeyer, corong pisah, rotary vacum evaporator, kertas saring,
sentrifuga, GC-MS, UV-Vis, plat KLT, kromatotron, mikropipet, alumunium foil,
pendingin, pH-meter, termometer, lemari pendingin, serta peralatan gelas yang
3.3 Prosedur kerja
3.3.1 Isolasi enzim lakase dari jamur tiram putih
Sebanyak 300 gram jamur tiram putih diblender dalam larutan buffer
fosfat 0,2 M, pH 6,0, kemudian dihomogenkan dengan homogenizer pada suhu
0-5oC selama 15 menit. Setelah itu, homogenat disaring menggunakan kain
penyaring dan filtrat yang diperoleh disentrifugasi dengan kecepatan 3500 rpm
selama 20 menit. Supernatan yang dihasilkan merupakan ekstrak kasar enzim dan
didinginkan pada suhu 0-20C.
Enzim kasar yang diperoleh kemudian dimurnikan dengan aseton untuk
meningkatkan aktivitasnya. Pemurnian dengan pelarut organik (aseton) yang
didinginkan hingga suhunya di bawah -100C. Lalu ekstrak enzim kasar yang telah
diperoleh dicampurkan dengan perbandingan aseton:enzim kasar (1:3). Larutan
distirer 7-12 menit, didiamkan sampai mengendap pada suhu -10-00C. Campuran
disentrifugasi dan endapan yang diperoleh dipisahkan dari filtratnya. Endapan
tersebut lalu disuspensikan dalam buffer fosfat pH 6,0 (Mustafa, et al., 2005).
Suspensi dari enzim ini kemudian disebut ekstrak enzim. Ekstrak enzim ini
kemudian ditentukan aktivitasnya.
3.3.2 Penentuan aktivitas enzim lakase
Uji aktivitas lakase ditentukan berdasarkan metode Bourbonnais dan Paice
(1990). Prinsip uji ini adalah sebagai berikut : pewarna non-fenol asam 2,2’
-Azinobis-di-(3-ethylbenzthiazoline-6-sulfonate) (ABTS) dioksidasi oleh lakase
menjadi radikal kation (ABTS+) yang lebih stabil. Konsentrasi radikal kation yang
Pengukuran aktivitas lakase dilakukan sebagai berikut : larutan 0,4 mM
ABTS dalam buffer fosfat (pH 6) sebanyak 160 µl dimasukkan ke dalam kuvet
1,5 ml. Selanjutnya ke dalam kuvet dimasukkan 40 µl enzim dan dikocok agar
tercampur homogen. Kemudian absorbansi radikal kation diamati pada panjang
gelombang 420 nm (εmM = 36 M-1 cm-1) selama 5 menit menggunakan
spektrofotometer UV-Vis. Perubahan absorbansi radikal kation diamati setiap
menit. Aktivitas lakase dinyatakan sebagai Internasional Unit (IU) per liter,
dengan 1 IU didefinisikan sebagai jumlah enzim yang dapat mengoksidasi 1 µmol
ABTS tiap menit. Aktivitas lakase ditentukan dengan menggunakan persamaan
berikut :
Aktivitas
V = volum total reaksi (ml)
v = volum enzim (ml)
ε = extinction coefficient ABTS pada 420 nm = 36 mM-1cm-1
∆A.min-1= perubahan absorbansi tiap menit pada 420 nm
d = perubahan absorbansi tiap menit pada 420 nm
3.3.3 Reaksi dimerisasi anetol dengan katalis enzim lakase
Reaksi dimerisasi dengan katalis enzim lakase dilakukan dengan
menggunkan medium bifasa. Adanya medium bifasa ini dapat meningkatkan
kestabilan produk dan produk akan terekstraksi lebih banyak pada fasa organik
jika dibandingkan dengan penggunaan medium monofasa (Mustafa,et al., 2005).
Medium bifasa dibuat dari campuran etil asetat dan buffer fosfat dengan
perbandingan (4:1). Medium ini dimasukkan ke dalam 2 tabung masing-masing 5
Selanjutnya, ke dalam masing-masing tabung ditambahkan 1ml larutan
anetol. Tabung pertama diisi dengan 1ml hidroquinon (0,5 mg/ml) dan 4 ml
ekstrak enzim. Sedangkan pada tabung kedua digunakan sebagai larutan kontrol
untuk mengetahui adanya reaksi, sehingga tidak ditambahkan ekstrak enzim dan
mediator hidroquinon (Johannes, 2000). Kemudian larutan tabung 1 dan 2 diaduk
dan dibiarkan hingga membentuk dua lapisan. Diamati adanya reaksi dengan
perubahan warna pada medium bifasa.
3.3.4 Isolasi produk reaksi
Tahap pertama dilakukan reaksi dimerisasi dalam skala yang lebih besar
agar produk yang diperoleh lebih banyak. Media reaksi dibuat dengan
mencampurkan buffer fosfat dan etil asetat dengan perbandingan buffer fosfat :
etil asetat (1:4). Larutan ekstrak enzim sebanyak 20 ml, anetol 5 ml, hidroquinon
20 ml ditambahkan dalam campuran tersebut.
Kemudian campuran diaduk selama 30 menit dan dibiarkan 24 jam dan 48
jam. Endapan yang terbentuk dipisahkan dari larutannya dengan ekstraksi
menggunakan etil asetat. Selanjutnya dipekatkan dengan cara menguapkan
pelarutnya pada suhu 50-600C.
3.3.5 Analisis produk reaksi
Uji kromatografi lapis tipis (KLT) digunakan untuk mengidentifikasi
komponen-komponen senyawa yang terdapat pada campuran produk kasar.
Pelarut pengembang yang digunakan berupa campuran n-heksana : etil setat
dengan variasi perbandingan 1:1, 2:1, 3:2, 4:1, dan 5:1. Dari varasi tersebut dicari
3.4. Skema kerja
3.4.1 Isolasi enzim lakase dari jamur tiram putih
Jamur Tiram Putih
Endapan Filtrat
Enzim Kasar Endapan
Supernatan Estrak Enzim
Bentuk Endapan
Uji Aktivitas Enzim
- Diblender + buffer fosfat pH 6,0 (0-5oC)
- Homogenat disaring
-Ditambahkan aseton
3.4.2 Reaksi dimerisasi anetol dengan mediator enzim lakase
Produk reaksi
Uji KLT
Uji GC-MS Enzim lakase + anetol
+hidroquinon
Produk reaksi
Distirer selama 2 jam
Dibiarkan selama 24 jam dan 48 jam
Diekstraksi
Fasa organik Fasa air
27
BAB IV
HASIL DAN PEMBAHASAN
4.1 Isolasi enzim lakase dari jamur tiram putih
Enzim lakase banyak dihasilkan oleh jamur dan tanaman tingkat tinggi.
Enzim lakase telah diisolasi dari jamur golongan Ascomycetes, Deuteromycetes,
Basidiomycetes. Dalam penelitian ini, enzim lakase diisolasi dari jamur tiram putih
(Pleurotus ostreatus) yang termasuk dalam golongan Basidiomycetes. Pada jamur
tiram putih, lakase berperan dalam proses degradasi lignin dan beberapa fungsi lain
diantaranya adalah pigmentasi, pembentukan badan buah, pembentukan spora, dan
pertahanan (Gianfreda,et al., 1999).
Tahap isolasi enzim lakase dari jamur tiram putih dimulai dengan
menghaluskan jamur tiram putih dalam larutan buffer fosfat 0,2 M pH 6,0.
Penggunaan buffer fosfat 0,2 M pH 6 ini berfungsi untuk menjaga kondisi sekitar pH
6, karena pH optimum enzim lakase dari jamur tiram putih berada pada jangkauan
tersebut (Mustafa, et al., 2005). Kemudian jamur yang telah halus dihomogenkan
dengan menjaga suhu 0-50C. Kondisi ini dipertahankan untuk mencegah
kemungkinan terjadinya denaturasi protein enzim jika suhu lebih tinggi. Selain itu
juga menjaga enzim agar tidak aktif sebelum dipakai pada saat reaksi.
Setelah itu dilakukan pemisahan ekstrak enzim lakase dari debris sel.
Penyaringan dilakukan dengan kain katun dan sentrifuge pada 3500 rpm sehingga
28
kuning kecoklatan. Agar tidak terjadi denaturasi maka enzim ini disimpan pada suhu
0-20C.
4.2 Pengendapan ekstrak kasar enzim lakase
Untuk meningkatkan aktivitas enzim maka perlu dilakukan pemurnian. Ada
beberapa macam metode pemurnian enzim yaitu dengan pengendapkan protein
dengan amonium sulfat atau pelarut organik dan kromatografi. Adapun metode
kromatografi terdapat beberapa macam, diantaranya kromatografi penukar ion,
afinitas, filtrasi, dan hidrofob (Scopes, 1994). Pada penelitian ini pengendapan
protein dilakukan dengan menggunakan metode pengendapan protein dengan aseton.
Pemurnian parsial dengan aseton prinsipnya adalah molekul hidrofobik pada
enzim akan berkurang pada saat penambahan aseton. Molekul air di sekitar
permukaan hidrofobik protein digantikan oleh molekul aseton, sehingga interaksi
hidrofob hilang.
Gambar 2.11 Agregasi protein akibat interaksi muatan berlawanan dari protein satu dengan protein lain (Scopes, 1994)
29
Faktor utama penyebab agregasi molekul protein oleh aseton adalah ikatan
elektrostatik dan kekuatan dipolar. Keberadaan aseton dalam larutan protein
menyebabkan agregasi antara muatan yang berlawanan dari permukaan molekul
protein satu dan protein yang lain. Proses presipitasi dengan pelarut organik terjadi
pada keadaan elektrostatik protein. Molekul protein besar akan lebih mudah
beragregasi karena memiliki perbedaan muatan yang tinggi. Molekul yang besar akan
segera teragregasi karena terjadi perubahan yang besar dari muatan permukaan
protein satu dengan protein yang lain.
Dalam proses pemurnian dengan aseton suhu harus di bawah -10oC. Pada saat
temperatur tinggi, molekul dari pelarut organik masuk ke dalam protein melalui
permukaannya, kemudian berinteraksi dengan residu hidrofobik dari protein.
Interaksi tersebut menyebabkan protein mengalami denaturasi (Scopes, 1994).
Gambar 2.12 Denaturasi protein akibat pelarut organik
30
Pengendapan protein dilakukan dengan menambahkan aseton dalam ekstrak
enzim dengan perbandingan aseton : ekstrak enzim (3:1). Perbandingan ini
merupakan hasil dari penelitian yang dilakukan Mustafa, et al. (2005) untuk
pemurnian enzim lakase pada fraksi atau sebanding dengan perbandingan aseton :
ekstrak enzim (3:1). Campuran ini kemudian distirer hingga mengendap. Setelah
melalui tahap pengendapan, maka didapatkan endapan yang berwarna keputihan yang
selanjutnya disentrifuge untuk memisahkan enzim dengan pelarut organik dan
disuspensikan dalam buffer fosfat pH 6, seperti pada gambar berikut :
Gambar 2.13 Proses pengendapan protein dengan aseton
4.3 Penentuan aktivitas enzim lakase
Pada penelitian ini aktivitas enzim lakase ditentukan dengan metode
Bourbonnais dan Paice (1990). Prinsip uji ini adalah sebagai berikut : pewarna
non-fenol asam 2,2’-Azinobis-di-(3-ethylbenzthiazoline-6-sulfonate) (ABTS) dioksidasi
oleh lakase menjadi radikal kation (ABTS+) yang lebih stabil. Konsentrasi radikal
kation yang berwarna biru kehijauan (dibaca pada panjang gelombang 420 nm)
berkolerasi dengan aktivitas lakase (Bar, 2001). Berikut adalah reaksi perubahan
31
Gambar 2.14 Reaksi asam oksidasi2,2’
-Azinobis-di-(3-ethylbenzthiazoline-6-sulfonate)(ABTS)
Perubahan absorbansi radikal kation diamati tiap menit selama 5 menit.
Aktivitas lakase dinyatakan sebagai Internasional Unit (IU) per liter, dengan 1 IU
didefinisikan sebagai jumlah enzim yang dapat mengoksidasi 1 µmol ABTS tiap
menit pada suhu kamar dan pH 6. Berikut grafik hubungan absorbansi radikal kation
ABTS terhadap waktu.
32
Dari grafik diatas terlihat bahwa gradien maksimum dapat diperoleh dari dari
titik 0-1. Dari hasil perhitungan, aktivitas enzim lakase yang diperoleh adalah
712,758 U/L . Nilai aktivitas enzim lakase ini termasuk dalam kategori yang dapat
bertindak sebagai biokatalisator dalam reaksi senyawa organik membentuk senyawa
dimer, trimer, maupun polimer. Hal ini berdasarkan atas perbandingan nilai dari
beberapa hasil isolasi enzim dari berbagai sumber yang digunakan sebagai
biokatalisator dalam reaksi organik. Untuk melakukan reaksi pembentukan senyawa
dimer, trimer, dan polimer dibutuhkan aktivitas minimum sebesar 68 U/L sedangkan
aktivitas maksimum yang pernah dilakukan sebesar 2200 U/L (Kunamneni, et al.
2008).
4.4 Reaksi dimerisasi anetol dengan katalis enzim lakase
Enzim lakase yang digunakan dalam penelitian ini merupakan enzim
oksidoreduktase, yang dapat mengkatalis reaksi oksidasi dan reduksi. Enzim lakase
dapat mengkatalisis proses oksidasi senyawa golongan fenolik menjadi radikal, yang
selanjutnya dapat membentuk dimer, oligomer, maupun polimerasi.
Dalam reaksi katalisis senyawa fenolik, enzim lakase memerlukan senyawa
lain yang bertindak sebagai mediator. Senyawa yang dapat bertindak sebagai
mediator adalah senyawa golongan fenolik yang strukturnya lebih sederhana
dibandingkan dengan substrat (Adinaraya, 2007). Dalam penelitian ini mediator yang
digunakan adalah hidroquinon. Mediator hidrokuinon dapat bertindak sebagai
electron shuttle, dimana akan mengalami oksidasi oleh enzim lakase. Setelah itu,
33
Gambar 2.16 Skema sistem mediator lakase
Berdasarkan Johannes (2000) hidrokuinon dapat meningkatkan oksidasi
hingga 13% lebih tinggi dibandingkan tanpa menggunkan mediator. Mediator
hidroquinon yang kecil memungkinkan untuk berinteraksi dengan enzim lebih mudah
dibandingkan substrat. Radikal hidrokuinon yang reaktif ini kemudian dapat
mengoksidasi substrat fenolik seperti anetol menjadi radikal anetol. Sementara itu O2
bertindak sebagai akseptor hidrogen dan tereduksi menjadi H2O.
Enzim lakase sebagai biokatalis merupakan metaloenzyme yaitu sebuah
protein enzimatik yang memiliki hubungan kuat antara bagian protein dan logam,
dimana logam tertanam di dalam molekul enzim. Logam pada enzim dapat bekerja
dalam proses transfer elektron, transfer muatan, substrat transfer, oksigenasi dan
detoksifikasi. Pada haloenzim lakase dapat terdiri dari monomer, dimer, dan trimer.
Pada masing-masing monomer terdapat 4 atom Cu yang terdistribusi ke dalam 3
lokasi redoks dan dibagi menjadi 3 tipe. Masing-masing tipe, mempunyai peranan
tersendiri(D’souza-ticlo, 2008).
Adanya logam Cu pada lakase membantu terjadinya transfer elektron dari
substrat yang telah tereduksi kepada molekul oksigen tanpa melepaskan peroksida
34
utama yaitu : reduksi pada atommononuclearCu kepada trinuclearCu dan akhirnya
terjadi reduksi pada O2olehtrinuclearCu menjadi H2O (Baldrian & Gabriel, 2006).
Gambar 2.17 Mekanisme kerja Cu pada enzim lakase (Baldrian & Gabriel, 2006)
Reaksi dimerisasi anetol dilakukan pada medium bifasa. Penggunaan medium
bifasa dapat meningkatkan kestabilan produk dan terekstraksi lebih banyak pada fasa
organik jika dibandingkan dengan medium monofasa (Mustafa, et al., 2005)
Berdasarkan Adelakun,et al. (2001), medium bifasa dalam sintesis senyawa organik
melalui biokatalis lakase dapat dilakukan dengan mencampurkan buffer dan pelarut
organik. Adapun pelarut organik yang telah digunakan yaitu aseton, etil asetat, etanol,
dioksan, dan metanol. Berdasarkan hasil penelitian tersebut etil asetat merupakan
35
pelarut organik yang dapat menghasilkan produk dengan rendemen terbesar, sehingga
pada penelitian ini medium bifasa yang digunakan merupakan campuran etil asetat
dan buffer fosfat dengan perbandingan (4:1).
Uji kualitatif dengan membandingkan senyawa reaksi pada tabung reaksi II
dan kontrol tabung reaksi I menunjukkan adanya perbedaan secara fisik. Pada tabung
II dengan komposisi larutan bifasa, enzim lakase, hidroquinon, dan minyak anis
menghasilkan warna kecoklatan di lapisan bawah jauh lebih pekat dibandingkan pada
tabung I dengan komposisi sama namun tanpa penambahan enzim lakase. Hal ini
dapat dikatakan telah terjadi perubahan, yang kemungkinan karena terbentuknya
terbentuk suatu senyawa baru dalam tabung II.
Tabung I Tabung II
Gambar 2.18 Hasil pengamatan uji kualitatif reaksi dimerisasi anetol (tabung II) dan kontrol (tabung I)
Untuk mengisolasi produk yang terbentuk, reaksi dilakukan dalam skala yang
lebih besar yaitu dengan 5 ml minyak anis pada medium bifasa (etil asetat : buffer
fosfat = 4:1). Campuran distirer selama 2 jam dan dibiarkan selama 24 jam dan 48
36
dan fasa airnya. Pemisahan yang terjadi didasarkan adanya perbedaan kepolaran
antara masing-masing komponen dalam larutan.
Fasa organik yang berhasil diekstrak, diuapkan untuk menghilangkan
pelarutnya. Dari hasil penguapan dihasilkan cairan kecoklatan kental. Reaksi pada 48
jam menghasilkan intensitas kepekatan yang lebih tinggi dibandingkan reaksi pada 24
jam, seperti gambar dibawah ini :
Gambar 2.19 Proses ekstraksi dan produk hasil reaksi dengan enzim lakase
4.5 Analisis produk reaksi
Pembentukan produk reaksi secara kualitatif dapat dilihat dari perubahan
warna dan aroma. Selain itu dapat juga diidentifikasi dengan kromatografi lapis tipis
(KLT). Cara ini juga dapat menunjukan jumlah komponen senyawa dalam produk
reaksi. Proses pemisahannya berdasarkan perbedaan distribusi masing-masing
komponen dalam suatu campuran, kedalam fasa gerak dan fasa diamnya.
Reaksi 24 jam
37
Pada penelitian ini, larutan pengembang (fasa gerak) yang digunakan adalah
campuran n-heksan dan etil asaetat dengan beberapa perbandingan komposisi. Secara
umum dari hasil uji KLT ini tidak dapat menunjukkan adanya perubahan reaksi yang
signifikan. Hal ini dimungkinkan karena jumlah produk reaksi yang kecil dan jumlah
campuran yang banyak, sehingga produk reaksi tidak dapat teridentifikasi.
Gambar 2.20 Hasil KLT (a) minyak anis (b) produk reaksi 24 jam (c) produk reaksi 48 jam
4.5.1 Analisis GC-MS
Analisis minyak atsiri anis dengan menggunkan GC-MS menghasilkan
kromatogram dengan 5 puncak senyawa seperti yang ditunjukkan pada gambar 2.21
sebagai berikut:
38
Gambar 2.21 Kromatogram minyak atsiri anis
Berdasarkan kromatogram di atas diketahui bahwa puncak tertinggi muncul pada
waktu retensi 18,96 menit dengan %area 65,71. Dari hasil analisis MS, puncak
tertinggi tersebut memiliki m/z 148 yang merupakan senyawa anetol. Sedangkan
puncak no 1 merupakan pelarut yaitu klroform. Untuk puncak yang lain secara
berurutan 2-4 adalah anetol, p-anisaldehid, dan p-metoksibenzil metil ketone.
Adapun spectrum MS anetol tertera pada gambar 2.21.
Gambar 2.22 Spektrum massa senyawa anetol
Pada penelitian ini minyak anis direaksikan dalam medium bifasa,
menggunakan biokatalis enzim lakase, dan hidroquinon sebagai mediator. Hal ini
39
24 jam dan 48 jam. Berikut hasil dari analisis GC-MS reaksi minyak anis selama 24
jam.
Gambar 2.23 Kromatogram hasil reaksi minyak anis selama 24 jam
Hasil kromatogram senyawa hasil reaksi minyak anis selama 24 jam memiliki
puncak tertinggi pada waktu retensi 18,958 menit dengan luas area 77,68% dan
dideteksi dengan MS sebagai anetol. Berikut data senyawa yang dihasilkan dari
reaksi 24 jam.
Tabel 4.3 Data kandungan senyawa pada reaksi 24 jam
No Peak Waktu Retensi (menit) Nama Senyawa % Area
1 18,056 Anetol 1,59
2 18.960 Anetol 77,68
3 21,379 p-Anisaldehis 17,25
4 22,992 Anisil aseton 3,47
Analisis GC-MS untuk reaksi minyak atsiri anis selama 48 jam dapat dilihat
40
Gambar 2.24 Kromatogram hasil reaksi minyak anis selama 48 jam
Kromatogran analisis GC untuk reaksi 48 jam memiliki jumlah puncak yang lebih
banyak dibandingkan reaksi 24 jam sehingga dapat disimpulkan terdapat senyawa
baru. Berikut perbedaan yang dihasilkan :
Waktu Retensi (menit)
Nama Senyawa % Area
Reaksi 24 jam Reaksi 48 jam
18,958 Anetol 77,68 37,42
21,347 p-anisaldehid 17,25 27,27
Senyawa anetol dan p-anisaldehid pada reaksi 24 jam memiliki %area yang
lebih besar dibandingkan reaksi 48 jam. Hal ini menunjukan berkurangnya jumlah
anetol pada reaksi 48 jam yang dimungkinkan mengalami reaksi membentuk senyawa
41
Tabel 4.4 Data kandungan senyawa pada reaksi 48 jam
No
Peak
Waktu Retensi (menit) Nama Senyawa % Area
1 16.897 Anetol 0.86
2 18.024 Estragol 3.82
3 18.958 Anetol dan Estragol 37.42
4 19.009 Anetol dan Estragol 19.30
5 21.080 Kariofilena 0.42
Data di atas menunjukan adanya senyawa yang berbeda dari produk reaksi 24
jam. Dari keenam senyawa tersebut terdapat tiga senyawa yang merupakan hasil
reaksi oksidasi yaitu pada waktu retensi 21,083 dengan %area 0,42 merupakan
senyawa kariofilena oksida. Senyawa ini dapat disintesis dari kariofilena secara
oksidatif dengan pereaksi H2O2 (Kadarohman, dkk., 1999 ). Terbentuknya senyawa
ini pada reaksi 48 jam diperkirakan adanya reaksi oksidasi yang dilakukan oleh enzim
42
Gambar 2.25 Mekanisme reaksi oksidasi kariofilena dengan oksigen menjadi kariofilena oksida.
Berikut adalah spektrum senyawa kariofilena oksida.
Gambar 2.26 Spektrum massa senyawa kariofilena oksida
Kemudian pada waktu retensi 23,86 dengan %area 1,39 yang diduga dapat dihasilkan
43
Gambar 2.27 Spektrum massa senyawa 1-(4-Metoksi-fenil)-2-fenil-eten-1,2-dion
Dugaan ini berasal dari data spectrum MS senyawa yang memiliki kemiripan
86% dengan senyawa 1-(4-Metoksi-fenil)-2-fenil-eten-1,2-dion yang terdapat pada
library. Struktur senyawa pembanding tertera pada gambar berikut :
Gambar 2.28 Struktur senyawa 1-(4-Metoksi-fenil)-2-fenil-eten-1,2-dion
Adanya dua gugus fenil pada senyawa tersebut menunjukkan terjadi reaksi kopling
antara dua senyawa yang masing-masing memiliki gugus fenil seperti halnya anetol.
Oleh karena analisis hanya menggunakan data MS, senyawa hasil sintesis belum
dapat ditentukan strukturnya. Walaupun senyawa anetol memiliki persentasi yang
besar dalam minyak anis namun senyawa ini termasuk kurang reaktif dibandingkan
senyawa golongan fenol yang memiliki gugus hidroksi. Hal ini menyebabkan anetol
lebih sulit bereaksi dibandingkan senyawa eugenol yang berhasil disintesis senyawa
44
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Kesimpulan dari penelitian ini adalah sebagai berikut:
1. Aktivitas unit enzim lakase yang diisolasi dari jamur tiram putih sebesar
712,758 U/L dengan definisi 1 U yaitu jumlah enzim yang dapat
mengoksidasi 1 µmol ABTS tiap menit pada suhu kamar dan pH 6.
2. Enzim lakase yang diisolasi dari jamur tiram putih belum dapat digunakan
untuk mensintesis senyawa dimer anetol namun dapat digunakan untuk
mensintesis senyawa kariofilena oksida dari kariofilena dengan proses
oksidasi oleh enzim lakase.
5.2 Saran
Berdasarkan hasil penelitian yang telah dilakukan maka disarankan untuk
melakukan reaksi pembentukan dimer anetol dengan biokatalis enzim yang lain.
Selain itu, enzim lakase kasar yang dihasilkan dari penelitian ini dapat digunkan
untuk mensintesis kariofilena oksida tanpa menggunkan H2O2 sehingga lebih ramah
45
Daftar Pustaka
Adinaraya, k. 2007. Fugal Laccase-a Versatile Enzyme for Biotechnolohical
Application.J. Trends in App. Microbiol. 4 : 233-245
Adelakun, O.E., Kuduga T., Parker A., Green I.R., Roes-Hill M., Burton S.G., 2011,
Laccase Catalyzed Dimerization of Feluric Acid Amplifies Antioxidant Activity.Journal of Molecular Catalysis B: Enzymetic74 : 29-35
Agusta, A. 2002. Minyak Atsiri Tumbuhan Tropika Indonesia. Penerbit ITB.
Bandung.
Andrian, H. 2007. Identifikasi Produk Oxidative Coupling Etil Ferulat oleh
Enzim Peroksidase dan Uji Aktifitas Biologis. Skripsi. Departemen Kimia FMIPA UI
Anonim. 2006. Strategi Pengembangan Minyak Atsiri Indonesia. BALITRO.
Warta Penelitian dan Pengembangan PertanianVol. 28, No. 5 : 13-14
Arifin, Z. S. 2008. Pembentukan Dimer Eugenol dengan Katalis Enzim Lakase
dan Uji Aktivitasnya sebagai Antioksidan. Skripsi. Departemen Kimia FMIPA UI.
Baldrian, P., Gabriel, J., 2006, Cooper and Cadnium Increas Laccase Activity in
Pleuorotus ostreatus,FEMS Microbiology Letters, p. 69-74
Bar, M. 2001. Kinetics and Physico-chemical Properties of White-Rot Fungal
Laccase.Thesis. University of The Free State, Bloemfontein.
Castro, H. T., Jairo, R. M., and Elena, S. 2010. Anethole Isomerization and
Dimerization Induced by Acid Sites or UV Irradiation. Molecules, No. 5 : 5012-5030
Couto, S.R. dan Toca, Jose LH. 2006.Industrial and biotechnological applications
of laccases: A review.Tarragona Spain, No. 28: 500-513
D’ souza-ticlo, D.T., 2008, The Lignin-Degrading Enzyme, Laccase from Marine
Fungi ; Biochemical and Molecular Approaches. Goa University, p. 28-33
Darmawan, A., Hanafi, M., Broto, S K., Umar, A J. 2003.Pengembangan Pangkalan
Data Struktur Kimia di LIPI Berbasis Data Resonansi Magnetik Inti. Serpong :
46
Dewi, G. F. D. 2011.Isolasi dan Karakterisasi Ekstrak Kasar Enzim Lakase dari
Kapang. Skripsi.Departemen Kimia FST Universitas Airlangga.
Dewi, I. K. 2009.Efektifitas Pemberian Blotong Kering terhadap Pertumbuhan
Jamur Tiram Putih (Pleurotus ostreatus) pada Media Serbuk Kayu. Skripsi. Jurusan Biologi Universitas Muhammadiyah Surakarta
Dewick, P. 1997. Medicinal Natural Products : A Biosynthetic. Approach. John
Wiley dan Sons ltd : Inggis.
Eickhoff H., Jung, Gu E., Rieker A. 2000. Oxidative Phenol Coupling Tyrosine
Dimers and Libraries Containing Tyrosyl Peptide Dimers. Tetrahedron, 57, 353-364
Ersam, T. 2004. Keunggulan Biodiversitas Hutan Tropika Indonesia dalam
Merekayasa Model Molekul Alami. Makalah Seminar Nasional Kimia VI . Jurusan Kimia, FMIPA, ITS
Fessenden, R.J, Fessenden, J.S. 1999. Kimia Organik. A.H. Pudjaatmaka
(Penerjemah). Jakarta : Penerbit Erlangga.
Freire, R S., Selene M. Morais, Francisco E A., dan Diana C. S. N. Pinheirob. 2005.
Synthesis and Antioxidant, Anti-inflammatory and Gastroprotector Activities of Anethole and Related Compounds. Bioorganic & Medicinal Chemistry,13 : 4353–4358
Gandjar, Gholib I., Rohman A., 2008,Kimia Farmasi Analisis. Pustaka Pelajar.
Guenther E, Ketaren S. 2006.Minyak Atsiri Jilid 1.Jakarta : UI-Press.
Handayani, W. 2001. Sintesis Polieugenol dengan Katalis Asam Sulfat. Jurnal
Ilmu Dasar, Vol.2, No. 2 : 1-13
Harborne, J. B., 2000, Metode Fitokimia, Penentuan Cara Modern Menganalisis
Tumbuhan, Terjemahan oleh K. Padmawinata dan Iwang Soediro, Bandung : Penerbit ITB
Horton, R; Moran, L; Ocsh, R; Rawn, J; Scringeour, K., 2002, Principles of
47
Johannes, C. 2000. Natural Mediators in the Oxidation of Polycyclic Aromatic
Hydrocarbons by Laccase Mediator System.Microbiol. 66 (2): 524-528
Junaidi, Y. 2007. Uji Aktifitas Biologi Senyawa Hasil Reaksi Guaiacol Oleh
Enzim Lakase dari Jamur Tiram (Pleurotus Ostreatus). Skripsi. Jakarta: Departemen Kimia FMIPA UI
Kadarohman A., Sastrohamidjojo H., Muchalal M., 1999,Sintesis Klovanadiol dari
Kariofilena.Karya ilmiah. Kimia FPMIPA UPI dan Kimia FMIPA UGM
Kartikawati, N.G. 2007. Pemisahan Logam Berat Dengan Polieugenol Sebagai
Carrier Menggunakan Teknik BLM (Bulk Liquid Membrane). Skripsi Jurusan Kimia FMIPA UNDIP
Kristanti, A. N., Aminah, N.S., Tanjung, M., Kurniadi, B., 2008. Buku Ajar
Fitokimia. Surabaya : Airlangga University Press
Kunamneni, A., Francisco J. Plou, Antonio, B., and Miguel, A. 2008.Laccases and
their applications: A patent review.CSIC: 28049.
Kusumaningsih, T., Sastrohamidjojo, H., Dwi, R. S. 2000.Derivatisasi Anetol Hasil
Isolasi Minyak Adas.Tesis. Pascasarjana Universitas Gajah Mada
Lenny, S. 2006.Senyawa Flavonoid, Fenilpropanoid, dan Alkaloid.Karya Ilmiah.
Jurusan Kimia, FMIPA, Universitas Sumatra Utara.
Manitto P, 1999. Biosíntesis Produk Alami, terjemahan oleh Koensoemardiyah.
Semarang : IKIP Semarang Press
Merly, S. 2005. Dimersiasi Senyawa Eugenol oleh Enzim Peroksidase dan Uji
Aktivitasnya sebagai Antioksidan. Skripsi. Jakarta: Departemen Kimia FMIPA UI.
Mustafa, R., Muniglia, L., Rovel, B., Girardin, M. 2005. Phenolic Colorants
Obtained by Enzymatic Synthesis Using a Fungal Laccase in Hydro-organic Biphasic Syistem.J. Food Res. Inter, No. 38 : 995-1000.
Ngadiwiyana, Soelistyowati, Sastrohamidjojo, H., 2002.Dimerisasi Metilisoeugenol
dengan Katalis HCl.JKSA.Volume 5, No. 3 : 3-14
Permatasari, N. 2007.Pembentukan Senyawa Dehidrodiferulat Melalui Oksidasi
Kopling Asam Ferulat Dengan Biokatalis Peroksidase Dan Uji aktivitas Allelopati.Skripsi. Departemen Kimia FMIPA UI
Risdianto, H., Suhardi, Niloperbowo, W., Setiadi, T. 2008. Produksi Lakase dan