PENGARUH PENAMBAHAN TiO2 TERHADAP LUAS PERMUKAAN DAN UKURAN PORI DARI SILIKA ABU VULKANIK GUNUNG SINABUNG
SKRIPSI
MELVA LESTARI PURBA 150822018
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2018
PENGARUH PENAMBAHAN TiO2 TERHADAP LUAS PERMUKAAN DAN UKURAN PORI DARI SILIKA ABU VULKANIK GUNUNG SINABUNG
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
MELVA LESTARI PURBA 150822018
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2018
PERSETUJUAN
Judul : Pengaruh Penambahan TiO2 Terhadap Luas Permukaan dan Ukuran Pori dari Silika Abu Vulkanik Gunung Sinabung
Kategori : Skripsi
Nama : Melva Lestari Purba
NomorIndukMahasiswa : 150822018
Program Studi : S1 Kimia Ekstensi
Dapartemen : Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui di Medan, Maret 2018 Komisi Pembimbing :
Pembimbing 2 : Pembimbing 1 :
Dr. Andriayani, M.Si Dra. Saur Lumbaraja , M.Si
NIP.19690302199932001 NIP.195506231986012002
Disetujui Oleh :
Dapetemen Kimia FMIPA USU Ketua,
Dr. Cut Fatimah Zuhra, M S.i 197404051999032001
PERNYATAAN
PENGARUH PENAMBAHAN TiO2 TERHADAP UKURAN PORI DARI SILIKA ABU VULKANIK GUNUNG SINABAUNG
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri,kecualibeberapa kutipan dan ringkasan yang masing-masing di sebutkan sumbernya.
Medan, Januari 2018
Melva Lestari Purba 150822018
PENGHARGAAN
Puji dan syukur penulis panjtkan kepada Tuhan Yang Maha Esa atas berkat dan Kasih Karunia Nya Penulis dapat menyelesaikan penyusunan Skripsi Ini dengan baik.
Dengan rasa Hormat, Penulis Menyampaikan Terima Kasih Kepadaa Ibu Dra.
Saur Lumbanraja, M.Si selaku pembimbin 1 dan Ibu Dr. Andriayani M,Si selaku pembimbing 2 yang telah banyak membimbing dan memberi arahan selama penyusunan skripsi ini. Terima Kasih Kepada Ibu Dr. Cut Fatimah Zuhra, M.Si selaku Ketua Dapertemen dan Ibu Dr Sovia Lenny selaku Sekretaris Dapertemen Kimia FMIPA USU Medan. Terima Kasih Juga Kepada Bapak Dr. Firman Sabayang MS Selaku Ketua Prodi Kimia Ektensi
Terima Kasih yang sangat mendalam juga penulis ucapkan kepada orangtua tercinta Bapak G. Purba dan Ibu M. Gultom yang tak henti henti memberikan dukungan moril maupun materi serta mengiringi penulis dalam doa, juga Kepada abang Albert Purba dan Adik Hadi Purbayang selalu senantiasa mendoakan penulis.
Penulis menyadari bahwa isi Skripsi ini masih jauh dari kata Sempurna, namun kiranya dapat memberikan informasi dan menfaat bagi ilmu Pengetahuan Khusus nya dalam bidang kimia.
Penulis
PENGARUH PENAMBAHAN TiO2 TERHADAP UKURAN PORI DARI SILIKA ABU VULKANIK GUNUNG SINABUNG
ABSTRAK .
Telah dilakukan penelitian mengenai pengaruh penambahan TiO2 pada ekstraksi silika dari abu vulkanik Gunung Sinabung.Ektraksi ini di lakukan dengan metode alkalis menggunakan NaOH 3 N kemudian silika yang diperoleh dikarekterisasi oleh analisa FT-IR, XRD dan BET. Silika yang di peroleh di larutkan kembali dengan NaOH 10 % kemudian ditambahkan TiO2. Titanium silikat yang di peroleh kemudian di kalsinasi pada suhu 900 oC selama 4 jam lalu ditentukan karakterisasi menggunakan analisa FT- IR,XRD dan BET Untuk analisa FT-IR diperoleh ada nya gugus Si-O-Si dan Si-OH yang mengindikasikan material silika dan titanium silikat. Difraktogram XRD menunjukkan adanya puncak yang tajam pada daerah masing-masing 21.9o dan 25.2o yang berbentuk kristalin sedangkan untuk analisa adsorpsi desorpsi nitrogen ketika penambahan titanium dioksida mengalami penurunan pada ukuran pori dari 51.2 nm menjadi 29.2 nm untuk luas permukaan mengalami peningkatan dari 10.18 m2/g menjadi 109.54 m2/g sedangkan untuk volume pori yang diperoleh 0.08 cc/g menjadi 0.52 cc/gg. Perubahan ini terjadi dikarenakan tidak adanya pemanasan yang seragam terhadap silika dan titanium silikat.
EFFECT OF ADDITIONAL TiO2 TO PORIZE SIZE FROM SILICA ABU VULKANIK MOUNTAIN SINABUNG
ABSTRACT
Research on the effect of TiO2 on silica extraction from volcanic ash of Mount Sinabung has been conducted. This calculation was performed by alkali method using 3 N NaOH then the silica obtained was electrarized by FT-IR, XRD and BET analysis.
The resulting silica was reconstituted with 10% NaOH and TiO2 was added. The resulting titanium silicate was then calcined at 900 ° C for 4 hours and then characterized using FT-IR, XRD and BET analysis. For the existing FT-IR analysis of Si-O-Si and Si-OH groups containing silica material and titanium silicate.
Diffractogram XRD shows an accurate index of 21.9o and 25.2o each of the crystalline form while for the adsorption analysis of nitrogen desorption compounded titanium dioxide. Comparison of pore size from 51.2 nm to 29.2 nm for surface area increased from 10.18 m2/g to 109.54 m2 /g for pore volume obtained 0.08 cc/g to 0.52 cc/gg. This change occurs because of the absence of a uniform heating of silica and titanium silicate
DAFTAR ISI
Halaman
Persetujuan i
Pernyataan ii
Penghargaan iii
Abstrak iv
Abstract v
Daftar Isi vi
Daftar Tabel viii
Daftar Gambar ix
Daftar Lampiran x
BAB 1 PENDAHULUAN
1.1. Latar Belakang 1
1.2. Permasalahan 3
1.3. Tujuan Penelitian 3
1.4. Manfaat Penelitian 3
1.5. Lokasi Penelitian 3
1.6. Metodologi Penelitian 4
BAB 2 TINJAUAN PUSTAKA
2.1.Abu Vulkanik Gunung Sinabung 5
2.2.Silika 6
2.2.1. SifatFisikadan Kimia Silika 8
2.2.1.1. Sifat Fisika Silika 8 2.2.1.2. Sifat Kimia Silika 9
2.3. Titanium Dioksida 10
2.3.LuasPermukaandanPorositas 11
2.4.MetodePenentuanLuasPermukaandanMikroporositas 15 2.4.1. MetodeAdsorbsiBrunauer-Emmet-Teller (BET) 15 2.4.2. MetodeBarret-Joyner-Halenda (BJH) 17
2.5. SpektroskopiDiffraksiSinar-X (XRD) 18
2.6. SpektroskopiInframerah (FT-IR) 19
BAB 3 METODE PENELITIAN
3.1. Alat 21
3.2. Bahan 21
3.3. Prosedur Penelitian 22
3.3.1.Kalsinasi Abu Vulkanik Gunung Sinabung 22
3.3.2.Pembuatan Larutan Natrium Silikat 22
3.3.3.Pembuatan Titanium Sulfat 3.3.4. Pembuatan Titanium Silikat
22 22
3.4. Bagan Penelitian 23 3.4.1Kalsinasi Abu Vulkanik Gunung Sinabung 23 3.4.2. Pembuatan Larutan Natrium Silikat 24 3.4.3 Pembuatan Titanium Silikat 25 BAB 4 HASIL DAN PEMBAHASAN
4.1.Pembuatan Silika 26
4.1.1Karakterisasi Silika 4.1.1.1 Spektrum FT-IR
4.1.1.2 Difraksi Sinar-X (XRD)
4.1.1.3 Adsorpsi-Desorpsi Isotherm Nitrogen BET 4.2. Pembuatan Titanium Silikat
4.2.1 Karakterisasi Titanium Silikat 4.2.1.1 Spektrum FT-IR
4.2.1.2 Difraksi Sinar-X (XRD)
4.2.1.3 Adsorpsi-Desorpsi Isotherm Nitrogen BET
27 27 28 29 31 32 32 33 34 BAB 5 KESIMPULAN DAN SARAN
5.1.Kesimpulan 38
5.2 Saran 38
DAFTAR PUSTAKA 39
LAMPIRAN 42
DAFTAR TABEL
Nomor Judul Halaman
Tabel
2.1. Komposisikimiadariabuvulkanik gunung sinabung 6
2.2. SifatFisika TiO2 11
2.3 Istilah yang digunakandalamkarakterisasiporipadatan 12
4.1 Daftar peak XRD Silika 28
4.2 Daftar peak XRD Titanium Silikat 34
4.3 Data Summary Report Silika 30
4.4 Data Summary Report Titanium Silikat 36
DAFTAR GAMBAR
Nomor Gambar
Judul Halaman
2.1 Perubahan Polimorf dari silika 8
2.2 Perbedaan jenis pori 12
2.3 Skema adsorbsi gas pada permukaan pori material dengan perbedaan ukuran molekul gas
14 2.4 KlasifikasiIsotherAdsorbsimenurutInternational Union
Of Pure and Applied Chemistry (IUPAC)
14
2.5 Refleksisinar X padaHukum Bragg 19
4.1 Spektrum FT-IR Silika 27
4.2 Difraktogram XRD dari Silika 28
4.3 Kurva Adsorpsi Desorpsi Silika 29
4.4 Grafik Distribusi Ukuran Pori Silika 30
4.5 Grafik DA Analisi Mikropori Silika 31
4.6 Gambar Spektrum FT-IR Titanium Silikat 32
4.7 Difraktogram XRD dari Titanium Silikat 33 4.8 Kurva Adsorpsi Desorpsi Titanium Silikat 35 4.9 Grafik Distribusi Ukuran Pori Titanium Silikat 36 4.10 Grafik DA Analisi Mikropori Titanium Silikat 37
DAFTAR LAMPIRAN
Nomor Lampiran
Judul Halaman
1. Spekturum FT-IR Silika 42
2. Spektrum FT-IR Titanium Silikat 43
3. Difraktogram XRD Silika 44
4. Difraktogram XRD Titanium Silikat 46
5. Hasil BET Pada silika 48
6. Hasil BET Pada Titanium Silikat 52
7. Data JCPDS SiO2 56
8. Data JCPDS TiO2 Anatase 57
9. Daftar Lampiran Gambar Penelitian 56
BAB 1 PENDAHULUAN 1.1 Latar Belakang
Indonesia dikenal dengan negara yang mempunyai gunung berapi akif sebanyak 30% di dunia. Hal ini menunjukan bahwa daerah di Indonesia rentan terhadap gempa bumi dan letusan gunung api ( Fiantis 2006 ). Gunung Sinabung merupakan salah satu gunung aktif yang terdapat di wilayah Indonesia yang terletak di Provinsi Sumatera Utara. Data Badan Nasional Penanggulan Bencana (BNPB) menyebutkan semenjak letusan akhir Agustus tahun 2010, gunung Sinabung meletus beberapa kali yang termasuk salah satu letusan terbesar hingga saat ini, Gunung Sinabung terus menerus mengalami erupsi yang mengeluarkan material dan abu vulkanik dari letusan gunung tersebut timbul kabut asap yang tebal berwarna hitam di sertai hujan pasir ( Barasa, dkk, 2010 ).
Berdasarkan hasil penelitian Lisnawaty ( 2016 ) menyatakan bahwa kandungan silika dalam abu vulkanik gunung Sinabung sebesar 58.10 %. Tinggi nya kandungan silika dalam abu vulkanik gunung Sinabung merupakan suatu hal yang menarik untuk diteliti lebih lanjut.
Penelitian tentang silika dari abu vulkanik gunung Sinabung telah dilakukan seperti pemanfaatan abu vulkanik gunung Sinabung sebagai bahan dasar pembuatan adsorben beserta karakterisasi nya, yang pernah di lakukan sebelumnya oleh Siti Ramadani ( 2015 ). Pada peneltian tersebut abu vulkanik diaktivasi dengan menggunakan asam nitrat pekat. Hasil penelitian tersebut menunjukan tidak ada peningkatan kadar silika sebelum dan setelah di aktivasi.
Saputra ( 2015 ) telah mensistesis moleculer sieve titanium silika dari (tetraethyl orthosilicate ) TEOS sebagai sumber silika dan (cetiltrimethyl
ammonium bromide CTAB) sebagai template. Proses ini dibuat dengan proses hidrotermal pada suhu 100 o C dan proses ini menghasilkan titanium silika heksagonal moleculer sieve.
Lenza (2002) melakukan sintesis Titanium silikat dengan menggunakan (tetraethyl ortosilicate) TEOS sebagai sumber silika dan TiCl4 sebagai sumber titanium yang kemudian sampel dikalsinasi pada suhu 800 o C.
Silika dapat dimanfaakan sesuai dengan sifat dan karakteristiknya. Hal ini berhubungan dengan kemurnian, luas permukaan, dan ukuran pori. Di mana silika yang diperoleh dari abu vulkanik gunung Sinabung telah berhasil di aplikasikan sebagai adsorben terhadap penurunan kadar Pb (II) (Lisnawaty, 2006).
Untuk meningkatkan kualitas dari silika maka silika dapat di modifikasi menjadi silika nanopartikel yang sangat baik digunakan dalam aplikasi industri, seperti obat- obatan dan kosmetik (Nabeshi dkk, 2011). Selain itu juga dapat digunakan sebagai penyokong katalis yang menggunakan silika dari sekam padi (Pahlepi,R.2013).Serta(Zawrah dkk, 2009).Dan juga menyatakan bahwa nanopartikel dapat di aplikasikan sebagai katalis dan bahan dielektrik.
Proses sintesis silika mesopori telah dilakukan menggunakan natrium silikat dari ampas tebu yang dikalsinasi menjadi abu, dengan menggunakan polietilen glikol.
Sehingga dihasilkan ruang pada silika setelah dilakukan kalsinasi pada suhu 600 oC yang berukuran mesopori (Rahman, N. A., 2015)
Dari uraian diatas, peneliti tertarik melakukan penelitian mengenai silika dari abu vulkanik gunung Sinabung yang menggunakan titanium dioksida sebagai pengubah ukuran pori, luas permukaan dan volume pori.
Hal inilah yang menjadi ketertarikan bagi penulis untuk melakukan penelitian tentang silika dari abu vulkanik gunung Sinabung, Silika yang di peroleh ditambahkan TiO2 dan terlebih dahulu TiO2 dilarutkan dengan H2SO4(P) sehingga membentuk titanium silikat yang berfungsi sebagai pengubah ukuran pori silika.
1.2 Permasalahan
1. Apakah titanium silikat dapat dibuat dari silika abu vulkanik gunung Sinabung dengan cara penambahan TiO2
2. Bagaimana karekteristik pada titanium silikat yang dapat dibuat dari silika abu vulkanik gunung Sinabung dengan cara penambahan TiO2
1.3 Tujuan Penelitian
1. Untuk mengetahui titanium silikat dapat dibuat dari silika abu vulkanik gunung Sinabung dengan cara penambahan TiO2
2. Untuk mengetahui karekteristik titanium silikat yang dapat dibuat dari silika abu vulkanik gunung Sinabung dengan cara penambahan TiO2
1.4 Manfaat Penelitian
1. Dapat meningkatkan pemanfaatan abu vulkanik gunung Sinabung yang terbuang sebagai sumber bahan baku silika sehingga menjadi produk yang bernilai tinggi.
2. Untuk mengetahui pengaruh penambahan TiO2 terhadap luas permukaan dan ukuran pori silika yang dihasilkan dari abu vulkanik gunung Sinabung
1.5 Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Kimia Anorganik FMIPA USU dan Laboratorium Kimia Dasar USU Medan. Analisa XRD dilakukan di Universitas Negeri Yogyakarta. Analisa FTIR dilakukan di Universitas Gajah Mada, Yogyakarta.Analisa BET dilakukan di BATAN, Banten
1.6 Metodologi Penelitian
Abu vulkanik gunung Sinabung diayak dengan ukuran 100 mesh. Kemudian dimurnikan menggunakan HCl 6 N dan dipanaskan, lalu disaring dan dicuci hingga filtrat bening. Abu hasil pencucian dikeringkan dengan oven lalu dikalsinasi pada suhu 900 °C selama 6 jam. Abu hasil kalsinasi ditambahkan NaOH 3 N sambil dididihkan selama 4 jam dan disaring. Filtrat yang dihasilkan kemudian ditambahkan HCl 2 N sampai pH 7 hingga terbentuk gel silika lalu didiamkan.
Kemudian dipanaskan selama 20 menit, lalu di saring sambil dicuci menggunakan aquadest panas. Kemudian dipanaskan sampai kering hingga terbentuk silika kemudian silika diekstraksi dengan NaOH 10 % hingga terbentuk natrium silikat yang kemudian ditambahkan dangan TiO2 yang sebelumnya di larutkan dengan H2SO4(P) selanjutnya distirer selam 4 jam dan menghasilkan suspensi putih yang kemudian di cuci sampai pH netral. Hasil pencucian ini selanjutnya dikeringkan pada suhu 110 0C sehingga terbentuk padatan putih kemudian dikalsinasi pada suhu 900 0C selama 4 jam.Hasil kalsinasi di karekaterisasi dengan analisa FT-IR,XRD dan BET.
BAB 2
TINJAUAN PUSTAKA
2.1 Abu Vulkanik Gunung Sinabung
Gunung Sinabung puncak tertinggi di Sumatera Utara. Gunung ini belum pernah tercatat meletus sejak tahun 1600 (Global Volcanism Program, 2008).
Erupsi gunung berapi, mengeluarkanbahan vulkanik (lahar, pasir dan abu) yang kemudian terakumulasi di bagian puncak ,lereng, bagian kaki dan daerah sekitar nya.
Pada tahap awal bahan-bahan yang relatif baru tersebut membentuk tanah yang disebut regosol (entisols). Dengan bertambahnya waktu abu vulkanik kemudian berkembang menjadi tanah-tanah yang terdeteksi mengandung mineral non kristalin (short-range- orer) berwarna gelap yang mengandung karbon organik tinggi, gembur,berat dan terasa licin, (smeary ) memiliki permukaan mineral liat yang luas dan mengandung banyak gelas vulkanik ( Dudal dan Soepraptohardjo, 1960 ).
Abu vulkanik adalah fragmen berukuran dari 2 mm hingga ukuran debu. Abu vulkanik atau pasir vulkanik adalah bahan material vulkanik jatuhan yang di semburkan ke udara saat terjadi suatu letusan. Abu maupun pasir vulkanik terdiri dari batuan berukuran besar sampai berukuran halus. Berukuran besar biasa nya jatuh sekitar radius 5-7 km dari kawah, sedangkan yang berukuran halus dapat jatuh pada jarak mencapai ratusan hingga ribuan kilometer ( Sudaryo dan Sucipto, 2009 ).
Jenis – jenis mineral dalam abu vulkanik tergantung pada kimia magmanya.
Unsur yang paling berlimpah ditemukan dalam magma adalah silika
( SiO2) dan Oksigen ( O2 ). Letusan basal energi rendah ( basal : batuan beku berwarna gelap, berbutir halus merupakan pembekuan lava dari gunung api ) menghasilkan abu berwarna gelap khas yang mengandung 45-55 % silika yang umum nya kaya akan zat besi ( Fe ) dan Magnesium ( Mg ). Letusan riolit paling eksplosif menghasilkan abu felsic yang tinggi silika ( > 69 % ) sedangkan abu jenis lain dengan komposisi menengah ( misal nya, andesit atau dasit ) memiliki kandungan silika anatara 55- 69 %.
Untuk mengetahui komposisi kimia total berbagai unsur makro dan mikro dalam abu
segar letusan gunung berapi biasa nya menggunakan sinar X Glour ( X-Ray Flourescence, XRF ). Data yang di sajikan umum nya dalam bentuk oksida, baik makro maupun unsur mikro.
Tabel 2.1 Komposisi kimia abu vulkanik Gunung Sinabung ( Lisnawaty, 2016 ) Kandungan Abu vulkanik Jumlah ( % )
Si 91.4 ± 0.1
K 3.09 ± 0.02
Ca 2.60 ± 0.02
Cr 0.086 ± 0.003
Mn 0.19 ± 0.3
Fe 0.54 ± 0.01
Ni 1.09 ± 0.02
Cu 0.18 ± 0.003
Zn 0.32 ± 0.01
Ca 0.090 ± 0.003
Eu 0.2 ± 0.02
Re 0.3 ± 0.03
Hasil analisis komposisi kimia abu vulkanik Gunung Sinabung dengan metode XRF (Tabel 2.1) menyatakan bahwa abu ini mengandung komponen yang heterogen dengan komponen utama (mayor) yakni 58,10% SiO2; 18,30% Al2O3; 7,09% Fe2O3 dan 8,05% CaO. Hasil analisis kandungan abu vulkanik ini menunjukkan bahwa material ini termasuk material pozzolan yakni mempunyai kandungan SiO2 dan Al2O3 yang tinggi(
Lisnawaty, 2016 ).
2.2 Silika (SiO2)
Silika (Silicon Dioxide) merupakan senyawa kimia dengan rumus molekul SiO2yang dapat diperoleh dari silika mineral dan sintesis kristal. Mineral silika adalah senyawa yang banyak mengandung SiO2 yang ditemukan dalam bahan tambang dan bahan galian yang berupa mineral seperti pasir kuarsa, granit, dan fledsfar (Kalapathy, 1999).
Selain terbentuk secara alami, silika juga dapat diperoleh dengan cara memanaskan pasir kuarsa pada suhu 870oC sehingga terbentuk silika dengan struktur tridimit , dan bila pemanasan dilakukan pada suhu 1470oC dapat diperoleh silika dengan struktur kristobalit. Silika dapat dibentuk dengan mereaksikan silikon dengan oksigen atau udara pada suhu tinggi (Iler, 1979).
Silika merupakan senyawa biner yang paling umum dari silikon dan oksigen yang merupakan dua elemen paling banyak tersedia di bumi yaitu sekitar 60% dari kerak bumi. Silika tersedia melimpah di bumi berupa senyawa murni maupun terikat pada oksida membentuk silikat.Dalam variasi bentuk amorf, silika sering digunakan sebagai desiccant, adsorben, filler, dan komponen katalis. Silika merupakan bahan baku utama pada industri glass, keramik, dan industri refraktori dan bahan baku yang penting untuk produksi larutan silikat, silikon dan alloy (Kirk-Othmer, 1967).
Silika ditemukan sedikitnya dalam dua belas bentuk yang berbeda. Bentuk kristal silika yang umum yakni quartz, trydimit, cristobalit, sedangkan bentuk silika amorf berupa endapan silika, silika gel, koloidal sol silika dan silika pyrogenik. Silika amorf sangat berperan penting pada berbagai bidang seperti digunakan sebagai adsorben dan untuk sintesis ultrafiltrasi membran, katalis dan bidang permukaan yang aplikasinya berhubungan dengan porositas (Rouqe-Malherbe, 2007).
Ketiga bentuk umum dari kristal silika tersebut ditinjau berdasarkan kestabilannya terhadap kenaikan suhu tinggi (McColm, 1983), yaitu:
a. Quartz, sampai pada suhu 870oC
b. Trydimit, pada suhu 870oC sampai 1470oC c. Cristobalit, pada suhu 1470oC sampai 1730oC
Masing-masing dari ketiga bentuk diatas memiliki perubahan pada suhu tinggi dan rendah dimana strukturnya hanya sedikit berubah oleh perubahan yang sederhana pada orientasi dari SiO4 yang relatif tetrahedral satu sama lain. Perubahan bentuk pada suhu tinggi memiliki simetri yang lebih tinggi atau memiliki unit sel yang lebih kecil daripada perubahan bentuk pada suhu yang rendah (McColm, 1983).
Kuarsa tinggi
Tridimit
tinggi Kristobalit
tinggi
Kuarsa rendah
Tridimit
sedang Kistobalit
rendah
Tridimit rendah Perubahan
struktur 573oC
Perubahan struktur 160oC
Perubahan struktur 200-270oC
Perubahan struktur 160oC
867oC 1470oC
Perubahan bentuk Perubahan bentuk
Gambar 2.1. Perubahan Polimorf dari silika (Barsoum,1997) .
2.2.1 Sifat Fisika dan Kimia Silika 2.2.1.1 Sifat Fisika Silika
Silika dalam bentuk amorf memiliki densitas sebesar 2,21 grcm-3 dengan modulus elastisitas sebesar 10 x 106 psi. Kandungan unsur silikon (Si) dan oksigen (O) pada silika jenis ini, adalah 46,7 persen dan 53,3 persen. Nilai kekerasan material ini pada pembebanan tegak lurus dengan menggunakan indentor intan (metode vickers atau knoop) sebesar 710 kgmm-2 sedangkan pada arah pembebanan dengan sudut elevasi diketahui nilai kekerasannya mencapai 790 kgmm-2 (Mantell, 1958).
Silika dari sekam padi memiliki luas permukaan yang sangat kecil, yaitu mencapai 66 m2g-1 apabila tanpa melakukan perlakuan khusus terhadap silika yang diperoleh. Hal ini disebabkan jumlah pori-pori dari sekam padi sedikit sehingga permukaan silika menyempit. Selain itu hal ini disebabkan ukuran diameter silika yang sangat kecil bahkan tidak dapat ditentukan (Yalcin, N. 2000).
2.2.1.2 Sifat Kimia Silika
Senyawa silika mempunyai berbagai sifat kimia antara lain sebagai berikut:
2.2.1.2.1 Reaksi dengan Asam
Silika relatif tidak reaktif terhadap asam kecuali asam hidrofluorida seperti reaksi berikut(Basset,J. 1989) :
SiO2(s) + 4HF(aq) SiF4(aq) + 2H2O(l)
Dalam asam hidrofluorida berlebih reaksinya menjadi:
SiO2(s) + 6HF(aq) H2[SiF6](aq) + 2H2O(l)
2.2.1.2.2 Reaksi dengan Basa
Silika dapat bereaksi dengan basa, terutama dengan basa kuat, seperti dengan hidroksida alkali(Basset,J. 1989) :
SiO2(s) + 2NaOH(aq) Na2SiO3(aq) + H2O(l)
Secara komersial, silika dibuat dengan mencampurkan larutan natrium silikat dengan suatu asam mineral. Reaksi ini menghasilkan suatu dispersi peka yang akhirnya memisahkan partikel dari silika terhidrat, yang dikenal dengan silika hydrosol atau asam silikat yang kemudian dikeringkan pada suhu 110oC agar terbentuk silika gel. Reaksi yang terjadi(Bakri, R. 2008) :
Na2SiO3(aq) + 2HCl(aq) H2SiO3(l) + 2NaCl(aq)
H2SiO3(s) SiO2.H2O(s)
2.3 Titanium Dioksida
Titanium dioksida adalah salah satu material yang banyak diteliti karena sifatnya yang menarik.Meskipun telah ditemukan lebih dari 200 tahun yang lalu dan telah diteliti sejak 85 tahun yang lalu namun hingga kini penelitian tentang TiO2 masih aktif dantetap dikembangkan (Hoffmann et al., 1995). TiO2 ditemukan pertama kalinyapada tahun
1821, dan tahun 1916 telah dikomersialkan sebagai zat pewarna putih.Titanium oksida atau yang lebih sering disebut titania adalah keluarga (IV) oksidayang merupakan semikonduktor dengan celah terlarang 3,0 untuk rutil dan 3,2 eVuntuk fasa anatase (Hoffmann et al., 1995; Fujishimeet al., 2000). Secara kimiatitanium dioksida dituliskan dengan lambang TiO2. Senyawa ini biasa digunakansebagai pigmen pada cat tembok (Braun et al., 1992), tabir surya (Zallen dan Moret, 2006) pasta gigi (Yuan dan Chen, 2005) solar sel, sensor, perangkatmemori serta sebagai fotokatalis.
Titanium merupakan kristal yang berwarna putih dan juga salah satu logam berlimpah nomor empat di dunia setelah aluminium, besi, dan magnesium. Selain itu,titanium juga merupakan elemen berlimpah kesembilan (mencakup 0,63% pada kerak bumi) 0,6% mineral TiO2 yang utama adalah FeTiO3 (iliminite), CaTiO3(perovskite). Titanium memiliki indeks bias (n) yang sangat tinggi yaitu 2,4 dalambentuk bubuk dan 2,7 dalam bentuk lapisan tipis (Dongsun et al., 2007). Titanium jugatahan terhadap degradasi warna akibat sinar matahari dengan titik lebur 5˚C A Ti-46 sampai Ti-50 dengan Ti-48 yang paling banyak terdapat di alam (73,8%) (Merck, 2000).
Secara fisika titanium memiliki sifat seperti yang ditunjukkan pada Tabel 2.2.Titanium memiliki massa jenis yang rendah, tahan karat, memilikibiokompabilitas yang tinggi dengan tubuh (Supriyanto dkk., 2007) sehingga dapat digunakan sebagai produk implan dalam tubuh.
Tabel 2.2 Sifat Fisika TiO2
No Sifat Nilai
1 Densitas 4 g.cm-3
2 Porositas 0%
3 Modulus Shear 90 GPa
4 Elastisitas 23 GPa
5 Resistivitas ( 25 0C) 1012 Ω
6 Resistivitas ( 700 0C) 2.5x104 Ω
7 Konstanta dielektrik 1 MHz 85 Volt/mil
8 Ekpansi termal RT-1000 0C 9x10-6 K-1 9 Konduktivitas termal 25 0C 11.7 Wm K-1
Titanium adalah logam keras, berwarna keabu-abuan. Ia dapat dilarutkan dalam asam sulfat pekat yang panas dan dalam hidrogen flourida. Seperti timah, titanium tak larut dalam asam nitrat pekat karena terbentuknya asam titanat pada permukaan logam,yang melindungi sisa logam dari asam itu. Untuk reaksi titanium dioksida dapat dilakukan dengan kalium pirosulfat sebanyak 12-15 kali lipat berlebih dalam kurs dari porselen atau paltinum.( Vogel ,1979)
TiO2 + 2K2S2O7 Ti (SO4)2 + 2K2SO4 2.4 Luas Permukaan dan Porositas
Luas permukaan dan porositas merupakan karakteristik yang sangat penting pada berbagai material. Penentuan dari isoterm adsorpsi dan desorpsi merupakan variabel yang sangat penting untuk menentukan struktur pori dan metode BET digunakan untuk menentukan total luas permukaan (Brown, 2003).
Suatu padatan dapat dikatakan sebagai berpori apabila memiliki pori-pori berupa lubang, terusan (chanel) atau celah yang lebih dalam dari luasnya. Pori-pori memiliki tipe yang berbeda dan diklasifikasikan berdasarkan aliran zat yang masuk melalui pori seperti gambar 2.2. berikut.
Gambar 2.2. Perbedaan jenis pori (Schubert and Husing, 2006) Tipe pori umumnya diklasifikasikan menjadi dua tipe yaitu:
A. Pori yang terisolasi dari pori yang lain disebut closed-pores (a)
B. Pori yang terbuka kepermukaan luar dari padatan, yang dipengaruhi sifat makroskopik padatan dan tidak aktif dalam reaksi kimia disebut open-pores yang terdiri dari: bentuk botol tinta (ink-bottle) (b), bentuksilinder terbuka (c), bentuk (funnel atau slitshaped) (d), pori terbuka pada kedua ujung (through pores) (e), silinder tertutup (silinder blind)(f) dan porositas yang kasar (roughness) pada permukaan luar (g)(Schubert and Husing, 2006)
Dalam karakterisasi pori sering digunakan istilah seperti yang terdapat pada tabel 2.2 berikut ini:
Tabel 2.3 Istilah yang digunakan dalam karakterisasi pori padatan
Istilah Keterangan
Densitas True density Densitas dari material tidak termasuk pori dan kekosongan interpartikel (densitas dari jaringan padatan)
Apparent density
Densitas dari material tertutup dan pori yang tidak dapat dilalui
Bulk density Densitas material termasuk pori dan kekosongan interpartikel (massa per total volume, dengan volume = fase padatan + pori tertutup + pori terbuka)
Volume pori Vp Volume pori
Ukuran pori Biasanya disebut lebar pori (diameter);
jarak dari dua dinding yang berlawanan Porositas Perbandingan dari volume total pori Vp
dengan volume yang terlihat (apparent volume) V dari partikel atau serbuk
Luas Permukaan Area yang tercapai pada permukaan padatan per satuan unit material
Luas pori atau diameter pori didefenisikan sebagai diameter untuk pori silinder dan jarak antara dinding pori yang berlawanan dalam pori bentuk celah. Luas pori diklasifikasikan oleh International Union of Pure and Applied Chemistry (IUPAC) terbagi tiga (Gates, 1992):
1. Mikropori, diameter lebih kecil dari 2 nm (d < 2 nm)
2. Mesopori, diameter antara 2 sampai 50 nm (2 nm < d < 50 nm) 3. Makropori, diameter lebih besar dari 50 nm (d > 50 nm)
Untuk menjelaskan pori padatan secara kualitatif dan kuantitatif diperlukan informasi tentang porositas, densitas, luas permukaan spesifik atau ukuran pori dan distribusi ukuran pori pada padatan berpori. Nilai hasil pengukurannya sangat ditentukan oleh metode yang digunakan, biasanya metode hanya dapat mendeteksi pori yang terbuka. Metode yang digunakan berupa adsorpsi molekul ke dalam celah. Hasil yang diperoleh tergantung pada ukuran molekul yang dilewatkan pada permukaan pori.
Misalnya untuk nilai luas permukaan akan lebih kecil jika digunakan molekul yang besar, sebaliknya nilai luas permukaan akan semakin besar jika digunakan molekul yang lebih kecil. Berikut ini skema adsorbsi gas pada permukaan menggunakan ukuran molekul yang berbeda (Schubert and Husing,2006).
Gamabr 2.3. Skema Adsorbsi gas pada permukaan pori material dengan perbedaan ukran moleku gas (Schubert and Husing,2006).
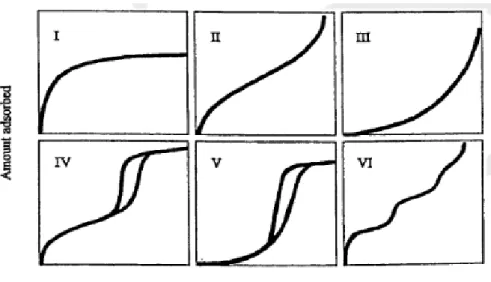
Menurut International Union of Pure and Applied Chemistry (IUPAC), terdapat enam klasifikasi isotherm adsorbsi seperti yang diperlihatkan gambar 2.4. Isotherm Tipe I merupakan karakteristik material mikropori (d < 2 nm). Material yang tidak berpori dan makropori (d > 50 nm) diklasifikasikan sebagai isotherm Tipe II dan Tipe III dengan
interaksi antara adsorbat dan adsorben yang kuat. Untuk material mesopori ( 2 nm < d <
50 nm) diklasifikasikan sebagai isotherm Tipe IV dan Tipe V dimana terdapat pembentukan multilayer dari kurva adsorbsi dan desorbsi sedangkan Tipe VI merupakan karakteristik padatan dua dimensi yang sangat homogen seperti grafit (Kanellopoulos, N. 2011).
Gambar 2.4. Klasifikasi Isotherm Adsorbsi menurut International Union Of Pure and Applied Chemistry (IUPAC)
Silika berpori merupakan variasi dari bentuk silika amorf. Material berbahan silika banyak diteliti karena memiliki struktur variasi yang luas. Struktur variasi ini dapat diatur melalui reaksi hidrolisis dan kondensasi, stabilitas termal yang tinggi pada jaringan amorf dan memiliki kekuatan grafting pada senyawa organik. Silika berpori dibuat dengan mengasamkan larutan silikat basa berair dan diperoleh gel silika pori.
Material padatannya diperoleh dengan proses sol-gel dalam larutan yang dikeringkan pada temperatur rendah dimana terjadi penekanan gel menjadi xerogel.
Parameter yang dapat mengkarakterisasi pori adalah luas permukaan spesifik (S) dengan satuan [m2/g], volume mikropori (WMP) dengan satuan [cm3/g], Volume pori (W) merupakan jumlah volume mikropori dan mesopori adsorben dalam [cm3/g] dan Pores Size Distribution (PSD) yang merupakan suatu grafik dari Vp/Dp versus Dp
dimana Vp adalah akumulasi pori hingga luas pori Dp diukur [cc-STP/GA]. Unit cc-STP menunjukkan jumlah pengukuran adsorbat dalam centimeter kubik pada STP yakni
pada temperatur standar dan tekanan standar masing-masing 273,15K dan tekanan 76 Torr (1.011325 x 105 Pa) (Schubert and Husing, 2006).
2.5 Metode Penentuan Luas Permukaan dan Mikroporositas 2.5.1. Metode Adsorpsi Brunauer-Emmet-Teller (BET)
Teori BET adsorpsi multilayer untuk menentukan luas permukaan (S) dikembangkan oleh Brunauer, Emmet dan Teller. Proses adsorpsi digambarkan sebagai proses lapisan dengan lapisan (Layer-by-layer), permukaan secara keseluruhan dianggap homogen, medan adsorpsi sama dalam setiap tempat permukaan. Proses adsorpsi dianggap tidak bergerak (setiap molekul yang diadsorbsi pada sisi dasar adsorbsi pada permukaan).
Lapisan pertama molekul yang diadsorbsi memiliki energi interaksi dengan medan adsorbs (Ea0) dan interaksi vertikal antara molekul setelah lapisan pertama (EL0) sama terhadap panas liqufaksi adsorbat dan molekul yang diadsorb tidak berinteraksi secara menyamping. Model adsorbsi BET digambarkan sebagai berikut (Roque-Malherbe, 2007).
Untuk menerapkan persamaan isotherm BET terhadap data adsorpsi yang diperoleh digunakan persamaan linier berikut:
( ) ( ) ⁄ Atau dapat dituliskan sebagai berikut:
( )
Dimana
p = tekanan akhir po = tekanan jenuh
V = volume gas yang terserap pada tekanan p Vm = volume gas terserap pada monolayer
C merupakan parameter yang dapat ditentukan dengan cara berikut:
Dengan A adalah konstanta, E1 merupakan panas yang diserap lapisan pertama dan El adalah panas kondensasi dari gas.
Untuk area yang dilewati setiap molekul dalam monolayer dianggap sempurna, dimana untuk nitrogen (N2) = 0,162 nm2 pada 77K dan argon (Ar) = 0,138 nm2 pada 87K (Kanellopoulos, N. 2011).
Metode BET tidak tepat untuk perhitungan mikropori, karena ketika metode ini diterapkan pada adsorben mikro maka akan terjadi penyerapan pada tekanan yang relatif rendah sehingga memungkinkan volume monolayer yang dihitung lebih dari satu lapisan terserap. Jika nilai ini diubah menjadi luas permukaan BET maka nilai yang dihasilkan akan lebih besar dari nilai yang sebenarnya. Meskipun metode BET tidak menggambarkan keadaan yang sebenarnya, namum metode ini yang lebih umum digunakan untuk analisa isotherm adsorbsi.
Ini disebabkan metode BET relatif sederhana dan dianggap memberikan kapasitas adsorpsi yang baik dari adsorben yang digunakan (Kanellopoulos, N. 2011).
2.5.2. Metode Barret-Joyner-Halenda (BJH)
Metode BJH digunakan untuk menentukan distribusi ukuran pori (PSD) merupakan grafik yang menyatakan Vp/Dp versus Dp, dimana Vp adalah akumulasi volume pori dan Dp merupakan luas pori diukur dalam [cc-STP/g.Å) dan cc-STP menunjukkan jumlah adsorbat dalam centimeter kubik pada STP berlangsung pada temperatur standar (273,15 K) dan tekanan standar (760 Torr atau 1.01325 x 105 Pa). Volume pori (W) adalah jumlah volume mikropori dan mesopori adsorben dalam [cm3/g] (Roque- Malherbe,2007).
Tekanan relatif awal proses desorpsi dalam metode Barret-Joyner-Halenda (BJH) berlangsung pada range 0,9< P/Po < 0,95 dan semua pori telah diisi fluida adsorbat. Pada tahap pertama (j=1) dalam proses desorpsi hanya melibatkan pemindahan kondensasi kapiler. Tahap berikutnya melibatkan pemindahan kondensat
dari inti pori dan penipisan multilayer dalam pori yang lebih besar misalnya pori telah siap dikosongkan dari kondesat.
Distribusi ukuran pori Barret-Joyner-Halenda (BJH-PSD) dapat dihitung menggunakan persamaan berikut ini.
(
) ( ( ) ∑
)
Keterangan :
Vpn : volume pori pada berbagai tekanan relatif rp : jari-jari pori
rk : jari-jari inti
V : perubahan volume pada berbagai tekanan relatif
t : ketebalan lapisan yang diserap
Ac : area terbuka pori yang kosong (Roque-Malherbe, 2007).
2.6 Spektroskopi Difraksi Sinar-X (XRD)
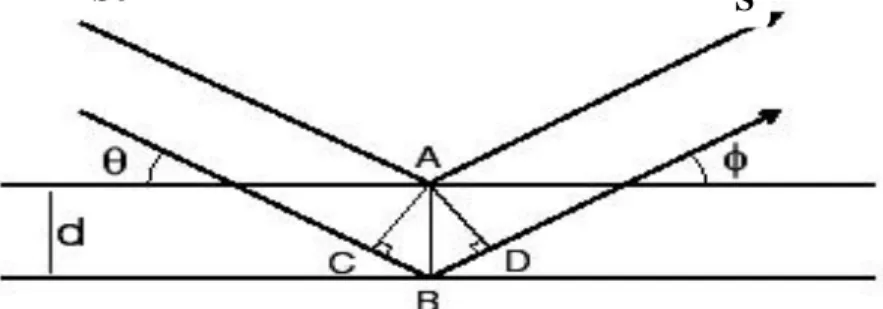
Spektroskopi difraksi sinar-x (X-Ray diffraction / XRD) merupakan salah satu metode karakterisasi material. Teknik ini digunakan untuk mengidentifikasi fasa kristalin dalam material dengan cara menentukan parameter struktur kisi serta untuk mendapatkaan ukuran partikel. Difraksi sinar-x terjadi pada hamburan elastis foton-foton sinar-x oleh atom dalam sebuah kisi periodik. Hamburan monokromatis sinar x dalam fasa tersebut memberikan interferensi yang konstruktif. Dasar penggunaan difraksi sinar-x untuk mempelajari kisi Kristal adalah berdasarkan persamaan Bragg (Cullity, 1978) :
n. = 2.d.sin ; = , ,…
dengan; adalah panjang gelombang sinar-x yang digunakan, d adalah jarak antara dua bidang kisi, adalah sudut antara sinar datang dengan bidang normal, n adalah bilangan bulat yang disebut sebagai orde pembiasan
Berdasarkan persamaan Bragg, ketika seberkas sinar-x menumbuk sampel
kristal, maka bidang kristal itu akan mendifraksi sinar-x yang memiliki panjang gelombang sama dengan jarak antar kisi dalam kristal. Semakin banyak jumlah elektron yang terdapat disekeliling atom pada suatu bidang, makin besar intensitas pantulan yang disebabkan oleh bidang tersebut dan menyebabkan makin jelas spot yang terekam pada film. Dengan menggunakan suatu metoda yang dikenal dengan nama metoda sintesis Fourier, kita dapat menghubungkan intensitas spot dengan kepekatan distribusi elektron yang terdapat dalam unit sel. Dengan mengamati kepekatan distribusi elektron dalam unit sel, kita dapat menduga letak atom dalam unit sel tersebut. Atom akan terletak pada daerah-daerah yang mempunyai kepekatan distribusi elektron maksimum (Bird, 1993). Persamaan Bragg dapat digambarkan seperti berikut:
Gambar 2.5. Refleksi sinar X pada Hukum Bragg ((Eisenberg, 1979)
Dimana:
So : Sinar Datang S : Sinar Pantul
A : Lapisan Atas Benda B : Lapisan bawah benda d : diameter benda
: Sudut sinar datang
: Sudut sinar pantul (Eisenberg, 1979)
2.7 Spektroskopi Inframerah (FT-IR)
Spektroskopi inframerah merupakan metode yang digunakan untuk mengamati interaksi interaksi molekul dengan radiasi elektromagnetik. Prinsip dasar spektroskopi
So S
inframerah yaitu interaksi antara vibrasi atom-atom yang berikatan/ gugus fungsi dalam molekul yang mengadsorbsi radiasi gelombang elektromagnetik inframerah. Adsorbsi terhadap radiasi inframerah dapat menyebabkan eksitasi energi vibrasi molekul ketingkat energi vibrasi yang lebih tinggi. Untuk dapat mengadsorbsi, molekul harus mempunyai perubahan momen dipol sebagai akibat dari vibrasi. Daerah radiasi spektroskopi inframerah berkisar pada bilangan gelombang 12800-10 cm-1. Umumnya daerah radiasi inframerah terbagi dalam daerah inframerah dekat (12800-4000 cm-1), daerah inframerah tengah (4000-200 cm-1), daerah inframerah jauh (200-10 cm-1).
Daerah yang paling banyak digunakan untuk berbagai keperluan adalah 4000-690 cm-1, daerah ini biasa disebut sebagai inframerah tengah (Khopkar, 2008).
Instrument yang digunakan untuk mengukur serapan radiasi inframerah pada pelbagai panjang gelombang disebut spektrometer inframerah. Pancaran inframerah umumnya mengacu pada bagian spektrum elektromagnet yang terletak diantara daerah tampak dan daerah gelombang mikro. Pancaran inframerah yang kerapatannya kurang daripada 100 cm-1 (panjang gelombang lebih dari 100 µm) diserap oleh sebuah molekul organik dan diubah menjadi energi putaran molekul. Penyerapan itu tercatuh dan demikian spektrum rotasi molekul terdiri dari garis-garis yang tersendiri (Hartomo, 1986).
Terdapat dua macam vibrasi molekul, yaitu vibrasi ulur dan vibrasi tekuk. Vibrasi ulur adalah suatu gerakan berirama disepanjang sumbu ikatan sehingga jarak antar atom bertambah atau berkurang dalam satu bidang datar. Vibrasi ulur dibagi menjadi dua yaitu simetri dan asimetri. Vibrasi ulur simetri terjadi akibat ikatan antar atom bergerak bersamaan sedangkan vibrasi ulur asimetri terjadi akibat ikatan antar atom bergerak tidak bersamaan dalam satu bidang datar. Perbedaan ini terdapat pada gugus Si-O-Si, dimana terdapat perbedaan antara vibrasi asimetri Si-O-Si dengan vibrasi simetri Si-O- Si. Pada vibrasi asimetri Si-O-Si, pergerakan molekul antar Si-O tidak bersamaan sedangkan pada vibrasi simetri Si-O-Si, pergerakan molekul antar Si-O bersamaan pada satu bidang datar. Perbedaan pergerakan molekul ini menyebabkan perbedaan energi serapan inframerah pada gugus Si-O-Si (Silverstein, 1986).
Vibrasi tekuk dapat terjadi karena perubahan sudut-sudut ikatan antara ikatan- ikatan pada sebuah atom atau karena gerakan sebuah gugusan. Contohnya liukan (twisting), goyangan (rocking), dan getaran putar yang menyangkut perubahan sudut-
sudut ikatan dengan acuan seperangkat koordinat yang disusun arbiter dalam molekul.
Hanya vibrasi yang menghasikan perubahan momen dwikutub secara berirama saja yang teramati di dalam inframerah (Hartomo, 1986).Identifikasi pita absorbsi khas yang disebabkan oleh berbagai gugus fungsi merupakan dasar penafsiran spektrum inframerah (Creshwell, 1972). Hadirnya sebuah puncak sarapan dalam sebuah spektrum inframerah hampir selalu merupakan petunjuk pasti bahwa beberapa gugus fungsi tertentu terdapat pada senyawa cuplikan (Pine, 1980).
BAB 3
METODE PENELITIAN
3.1 Alat
Neraca Digital AS 220/C/2 Radwag
Indicator Universal
Furnace Control Fisher
Hotplate Stirrer Thermilyte
DifraktometerSinar-X Rigaku 600 Miniflex
Fourier Transform Infrared
Brunauer-Emmett-Teller adsorpmeter
Oven
Peralatan Gelas Pyrex
Botol Vial
PipetTetes
Termometer
Kertas Saring Whatmann no. 42
3.2 Bahan
Abu Gunung Sinabung
TiO2 p.a
HCl p.a
NaOH p.a
Aquadest
H2SO4(p) p.a
3.3 Prosedur Penelitian
3.3.1. Kalsinasi Abu Vulkanik Gunung Sinabung
Abu vulkanik di oven hingga kering. Abu setelah kering lalu ditambahkan dengan HCl 6 N dan dipanaskan pada s C sambil diaduk hingga terjadi perubahan warna dari warna sebelumnya. kemudian dicuci dengan aquadest sampai filtrat berwarna bening. Filtrat bening ini dioven kembali hingga benar-benar kering setelah itu di kalsinasi pada C 6 jam sehingga diperoleh Abu vulaknik gunung sinabung hasil kalsinasi
3.3.2. Pembuatan Larutan Natrium Silikat
Sepuluh gram Abu vulkanik gunung Sinabung yang mana hasil kalsinasi ditambahkan NaOH 3 N sebanyak 60 mL sambil dipanaskan dan diaduk selama 2 jam C kemudian disaring, Kedalam filtrat ditambahkan HCl 2 N sa , C - , 5 5 , C
3.3.3 Pembuatan Larutan Titanium Sulfat
Dilarutkan 5 gram TiO2 di dalam 34 mL H2SO4 sambil distirer menggunakan hot plate selama 4 jam hingga terbentuk TiSO4
3.3.4 Pembuatan Titanium Silikat
Larutan natrium silikat di masukkan ke dalam larutan titanium sulfat sambil diaduk menggunakan hot plate stirer selama 4 jam hingga terbentuk s , C C selama 4 jam di analisa padatan putih lalu di karakterisasi dengan FT-IR, XRD dan BET
3.4 Bagan Penelitian
3.4.1 Kalsinasi Abu Vulkanik Gunung Sinabung
Abu Vulkanik Gunung Sinabung
dioven suhu 120 oC
diayak dengan ukuran 100 mesh 50 g Abu Vulkanik Kering
ditambahkan HCl 6 N sebanyak 100 ml
di panaskan suhu 110 oC sampai berubah warna didinginkan
ditambahkan aquadest disaring
dicuci dengan aquadest sampai filtrat bening disaring
Residu Filtrat
dioven pada suhu 120 o C
ditanur suhu 900 o C selama 6 jam
ditimbang Abu Vulkanik Hasil Kalsinasi
didinginkan
3.4.2 Pembuatan Larutan Natrium Silikat
10 gr Abu Vulkanik
ditambahkan 60 mL NaOH 3 N
didihkan sambil distirer selama 4 jam pada suhu 80
o C
didinginkan disaring
Filtrat Residu
ditambahkan HCl 2 N sampai pH 7 didiamkan selama 18 jam
didihkan selama 20 menit disaring
Filtrat Residu
dicuci dengan aquadest Panas Sampai Beberapa kali
dioven pada suhu 110 o C dihaluskan
Serbuk Silika
dimasukkan 5 gram kedalam NaOH 10 %
diaduk sambil dipanaskan pada suhu 100 o C
menggunakan stirer selama 2 jam
Larutan Natrium Silikat dikarakterisasi
FT-IR, XRD dan BET
3.4.3 Pembuatan Titanium Silikat
Larutan natrrium silikat Larutan titanium sulfat
diaduk menggunakan hotplate stirer selama 4 jam Suspensi Putih
dicuci dengan aquadest hingga pH netral dikeringkan didalam oven pada suhu 100 o C
Padatan Putih
ditanur pada suhu 900 o C selama 4 jam Padatan putih
FT-IR, XRD,BET Dikarekterisasi
BAB 4
HASIL DAN PEMBAHASAN
4.1 Pembuatan Natrium Silikat
Pembuatan Titanium Silikat menggunakan bahan baku yaitu silika dari abu vulkanik gunung Sinabung dan TiO2 sebagai sumber logam Ti. Silika dari abu vulkanik gunung Sinabung ini diperoleh dangan cara memanaskan 10 gr abu vulkanik dalam 60 mL NaOH 3 N selama 4 jam.
Hal ini dilakukan untuk mengektraksi silika dari abu vulkanik, karena silka larut dalam NaOH. Hali ini sesuai dengan reaksi (Basset, J. 1989)
SiO2(s) + 2NaOH(aq) Na2SiO3(aq) + H2O(l)
Tidak hanya NaoH yang dapat melarutkan SiO2, asam fluorida juga dapat melarutkan silika, sesuai dengan reaksi (Vogel, 1979).
SiO2 + 6HF H2[SiF6] + 2H2O
Setelah itu dilakukan pendiaman selama 1 malaman kemudian disaring ditambahkan HCl 2 N kedalam Filtrat sampai pH 7 hingga membentuk gel.Hal ini sesuai dengan reaksi(Bakri, R. 2008)
Na2SiO3(aq) + 2HCl(aq) H2SiO3(l) + 2NaCl(aq)
H2SiO3(s) SiO2.H2O(s)
Gel silika ini diam - C. Diperoleh silika dari ektraksi sebanyak 7 gram yang kemudian di karekterisasi dengan FT-IR, XRD dan BET 4.1.1 Karakterisasi Silika
4.1.1.1 Spektrum FT-IR
Silika yang diperoleh dianalisis menggunakan FT-IR untuk mengetahui adanya gugus
fungsi. Hasil FT-IR yang diperoleh ditunjukkan pada gambar 4.1 berikut ini:
4.1 Gambar Spektrum FT-IR Silika
Dari spektrum FT-IR yang ditunjukkan pada gambar 4.1 diperoleh puncak serapan pada bilangan yaitu 3762.99 cm-1 dan 3493.99 cm-1 yang menunjukkan ada nya gugugs Si-OH dan pada bilangan gelombang 1097 cm-1 dan 792 m-1 menunjukkan adanya gugus asimetri (as Si-O-Si) dan gugus simetri (s Si-O-Si).perbedaan puncak serapan ini disebakan oleh vibrasi pada Si-O-Si. Hal ini lah yang menyebabkan adanya perbedaan serapan antara gugus asimetri Si-O-Si dengan gugus simetri Si-O-Si (Pavia, 2009).
4.1.1.2 Difraksi sinar X ( XRD )
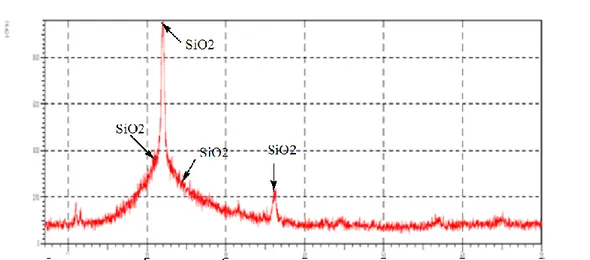
Difraktogram XRD digunakan untuk menganalisa komposisi dalam suatu sampel.Hasil analisa XRD produk diperlihatkan pada Gambar 4.2 berikut ini :
Gambar 4.2 Difraktogram XRD silika
Tabel 4.1 Daftar Peak XRD Silika
f θ beberapa peak yang berbeda yaitu 17 peak yang terbaca dan 4 peak yang intensitas nya cukup tajam. Adapun daftar peak yang intensitas nya cukup tajam ini mengindikasikan ada nya Silika (SiO2) berbentuk kuarsa pada daerah 20.940, 21.970, 23.020 , dan 36.110 peak yang ditunjukkan ini sesuai dengan peak XRD yang dilapokan oleh (Hubbard 1981) Lampiran 7.
4.1.1.3 Adsorpsi-desoprsi IsotermNitrogen BET
Adsorbsi-desorbsi isotherm nitrogen dilakukan untuk mengetahui porositas silika dan distribusi ukuran pori. Analisis ini dilakukan pada 77.3 Kdan diperoleh grafik adsorpsi-
desorbsi isotherm setelah dihitung dengan menggunakan metode Brunauer-Emmet- Teller (BET) dan diperlihatkan pada gambar 4.3 berikut.
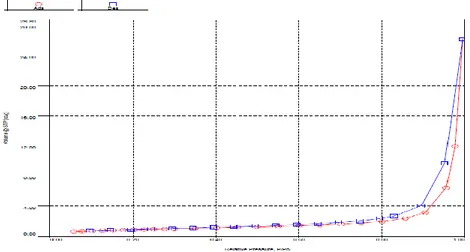
4.3 GambarKurva adsorbsi desorbsi silika
Gambar 4.3 ini menunjukkan adanya adsorbsi-desoprsi pada permukaan makropori yang diikuti dengan kondensasi kapiler pada tekanan relatif (P/Po) antara 0,955392 Sampai 0,995358 atm yang menunjukkan pola adsorbsi-desorpsiyang tergolong dalam tipe III menurut klasifikasi IUPAC (International Union of Pure and Applied Chemistry).Tipe ini adalah meterial tidak berpori dan makropori sehingga menunjukkan adanya daya adsorbsi dan desorpsi yang membuktikan bahwa pori memiliki diameteryang sangat besar
Adsorbsi-desorpsi isotherm nitrogen juga menghasilkan distribusi ukuran pori dari silika seperti gambar 4.4berikut ini.
0,00E+00 1,00E-05 2,00E-05 3,00E-05 4,00E-05 5,00E-05 6,00E-05
1 10 100 1000
dV(r)
Diameter pori (nm)
BJH Adsorpsi
BJH Adsorpsi
4.4 Gambar distribusi ukuran pori silika
Berdasarkan gambar 4.4 terlihat pada volume antara 0 sampai dengan 0,0005 cc/g distribusi ukuran pori dari silika yang dihasilkan sekitar 9,08 nm sampai dengan 63,93 nm yang tergolong ke dalam ukuran makropori.Hasil perhitungan BJH jika di lihat dari data (data 4.2) diperoleh luas permukaan sebesar 10.18 m2/g, diameterpori rata-rata sebesar 51.2 nm, dan volume pori sebesar 0.08 cc/g yang dapat dilihat pada data 4.1berikut ini :
4.1 Data Summary report silika
Berdasarkan analisa BET yang dilakukan pada silika hasil ekstraksi dari abu vulkanik
gunung Sinabung, diperoleh distribusi material yang heterogen, dimana sebagian dari silika memiliki ukuran mikropori yang ditunjukkan dalam DAanalisis (Dubinin- Astakhov Methode) pada Gambar 4.5 berikut:
0,00E+00 5,00E-05 1,00E-04 1,50E-04 2,00E-04 2,50E-04
0 2 4 6 8
dV(r)
Diameter pori (nm)
DA Analsisis (Micropori)
DA Analsisis (Micropori)
4.5 Gambar DA analisis mikropori silika
Berdasarkan Grafik 4.5 ditunjukkan penyebaran silika secara merata. Ukuran mikropori silika yang terdistribusi secara heterogen berada pada rentang 1.52 nm sampai dengan 2.7 nm. Dan ukuran mikropori yang paling dominan yaitu 2.0 nm.
4.2 Pembuatan Titanium Silikat
Silika hasil ektraksi ini diambil 5 g lalu dilarutkan kembali dalam NaOH 10 % untuk membentuk larutan Natrium Silikat sesuai dengan reaksi beikut :
SiO2(s) + 2NaOH(aq) Na2SiO3(aq) + H2O(l)
(Basset, J. 1989)
C terbentuk Natrium Silikat yang kemudian dicampur dengan larutan Ti(SO4)2 yang di peroleh dengan cara melarutkan 5 g TiO2 dalam 34 mL asam sulfat.dengan reaksi sebagai berikut:
2TiO2 + 2H2SO4 2Ti (SO4)2 + 2H2O
tidak hanya itu reaksi titanium dioksida dapat juga dilakukan dengan kalium pirosulfat sebanyak 12-15 kali lipat berlebih dalam kurs dari porselen atau paltinum.( Vogel ,1979)
TiO2 + 2K2S2O7 Ti (SO4)2 + 2K2SO4
Kemudian campuran ini diaduk selama 4 jam sampai terbentuk suspensi Putih TiSiO3
hal ini sesuai dengan reaksi :
2Na2SiO3+ 2Ti(SO4)2 2TiSiO3+ 2Na2SO4
Suspensi yang terbentuk kemudian didiamkan 1 malaman lalu disaring dan di cuci dengan menggunakan aquadest hingga pH netral lalu dikeringkan pada oven pada suhu 110 0C hingga terbentuk padatan putih kemudian di tanur pada suhu 900 0C selama 4 jam hingga di peroleh padatan TiSiO3 yang berwarna putih yang sangat halus sebanyak 3 g.
4.2.1 Karakterisasi Titanium Silikat 4.2.1.1 Spektrum FT-IR
Titanium silikat yang diperoleh dari hasil ekstraksi kemudian dikarektrisasi dengan analisa FTIR untuk mengetahui adanya gugus fungsi yang berikatan dengan Titanium Silkat. Hasil FTIR pada Titanium Silikat yang diperoleh ditunjukkan pada Gambar 4.1 berikut ini :
4.6Gambar Spektrum FT-IR Titanium Silikat
Dari hasil analisa FT-IR diperoleh pita serapan pada bilangan gelombang
1111 cm-1 ,678 cm-1, 570 cm-1 dan 486 cm-1 yang masing-masing menunjukkan bahwa pada bilangan gelombang 1111 cm-1 menunjukkan ada nya gugus Si-O-Si asimetri dan pada bilangan gelombang 678 cm-1 menunjukkan terdapat nya gugus Si-O- Ti kemudian pada bilangan gelombang 570 cm-1 menunjukkan adanya gugus Si-O-Si simetri serta puncak serapan pada bilangan gelombang 486 cm1 menunjukkan adanya gugusTiO2 ( Lenza,dkk 2002)
4.2.1.2 Difraksi sinar-X ( XRD )
Serbuk Titanium silikat yang diperoleh dikarakterisasi dengan analisa XRD untuk f f f θ Gambar 4.7 XRD berikut ini:
4.7 Gambar Difraktogram Analisis XRD dari Titanium Silikat Tabel 4.2 Data peak XRD paada Titanium Silikat
f θ menunjukkan intensitas paling tajam dihasilkan pada 25.250, 25,310 untuk TiSiO3 (Rilda, dkk 2013) dan pada puncak 36,990, 37.840, 38.510, 48.120, 53.840, 55.020, 62.240, 68.710, 70.250, 75.000, 76.010 untuk TiO2. peak yang di tunjukkan ini sesuai dengan peak XRD yang di dilaporkan (Hubbard 1981 Lampiran 8) yang merupakan bentuk kristal Anatase.
Dalam difraktogram XRD suatu sampel yang berupa padatan (powder), peak yang diperoleh bisa menunjukkan lebih dari satu jenis komposisi kristal (berupa campuran).Berdasarkan penelitian (Kiswanti 2013) ada dua jenis mineral titanium dioksida yaitu anatase dan rutil. Dalam penelitian ini jenis mineral yang dihasilkan yaitu kristal anatase dan titanium silikat yang dihasilkan juga bentuk anatase. Analisa XRD yang dilakukan dalam penelitian ini adalah analisa kualitatif, tinggi rendah nya yang terdapat dalam sampel. Sehingga perlu adanya pengujian kuantitatif.
4.2.1.3 Adsorpsi-desoprsi IsotermNitrogen BET
Untuk mengukur volume dan distribusi pori serta ukuran partikel Titanium Silikat dilakukan adsorpsi analisa dengan menggunakan karakterisasi dengan BET. Sebelum dilakukan analisa maka terlebih dahulu ditentukan adsorpsinya yang dinyatakan dalam nilai P/Po. Kemudian alatnya otomatis mengukur banyaknya gas yang terjerap pada tiap titik P/Po. Lalu data yang diperoleh akan dinyatakan dalam bentuk tabel dan grafik isotherm adsorpsi.
Gambar 4.8 menunjukkan puncak adsorbsi dan desorbsi yang menyatakan adanya pori dan dapat terjadi penyerapan.
Gambar 4.8 Kurva adsorbsi desorbsi Titanium Silikat
Gambar 4.8 ini menunjukkan adanya adsorbsi pada permukaan mesopori yang diikuti dengan kondensasi kapiler pada tekanan relatif (P/Po) antara 0,975907 Sampai 0,994615 yang menyatakan pola adsorbsi yang tergolong dalam tipe V.Tipe ini berlaku untuk material yang berdiameter berukuran mesopori yang menunjukkan adanya daya adsorbsi dan desorbsi yang membuktikan bahwa adanya pori sehingga memungkinkan terjadinya peristiwa adsorbsi.
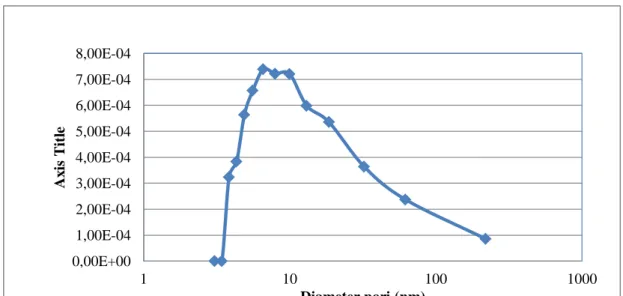
Adsorbsi-desorpsi isotherm nitrogen juga menghasilkan distribusi ukuran pori dari titanium silikat seperti gambar 4.10 berikut ini:
Gambar 4.10 Grafik distribusi ukuran pori Titanium Silikat
Berdasarkan gambar 4.10terlihat pada volume antara 0 sampai dengan 0,0008 cc/g distribusi ukuran pori dari titanium silikat yang dihasilkan sekitar 3,069 nm sampai dengan 32,3 nm yang tergolong ke dalam ukuran mesopori. Hasil perhitungan BJH bila dilihat dari data Summary Report diperoleh luas permukaan sebesar 109.54 m2/g, diameter pori rata-rata sebesar 29.2 nm dan volume pori sebesar 0.51 cc/g dan yang di tunjukkan pada datat 4.4 berikut.
4.2. Data Summary Report Titanium Silikat
0,00E+00 1,00E-04 2,00E-04 3,00E-04 4,00E-04 5,00E-04 6,00E-04 7,00E-04 8,00E-04
1 10 100 1000
Axis Title
Diameter pori (nm)
Berdasarkan analisa BET yang dilakukan pada titanium silikat hasil ekstraksi dari abu vulkanik gunung sinabung, diperoleh distribusi material yang heterogen, dimana sebagian dari silika memiliki ukuran mikropori yang ditunjukkan dalam DAanalisis (Dubinin-Astakhov Methode) pada Gambar 4.11 berikut:
Gambar 4.11 Grafik DA analisis mikropori Titanium Silikat
Berdasarkan Grafik 4.11 ditunjukkan penyebaran silika secara merata. Ukuran mikropori silika yang terdistribusi secara heterogen berada pada rentang 1.48 nm sampai dengan 3.2 nm. Dan ukuran mikropori yang paling dominan yaitu 1.88 nm.
Berdasarkan penelitian yang telah di lakukan, dapat disimpulkan bahwa hasil analisa dapat dilihat pada tabel 4.3 berikut ini :
Tabel. 4.3 Hasil Analisa BET Silika dan Titanium Silikat
Hasil Analisa Silika Titanium Silikat
Luas Permukaan 10.18 m2/g 109.54 m2/g
Volume Pori 0.08 cc/g 0.51 cc/g
Ukuran Pori 51.2 nm 29.2 nm
Adanya penambahan titanium dioksida menyebabkan ukuran pori silika berubah dari 51.2 nm menjadi 29.2 nm, volume pori 0.08 cc/g menjadi 0.52 cc/g dan luas permukaan dari 10.18 m2/g menjadi 109.54 m2/g perubahan ini terjadi dikarenakan tidak adanya pemanasan pada suhu 9000C terhadap silika sehingga kondisi reaksi antara silika
-0,0010 0,0000 0,0010 0,0020 0,0030 0,0040 0,0050
0 2 4 6 8
Axis Title
Sebaran ukuran mikropori (nm)
DA Analsis Mikropori
Series1
dengan titanium silikat tidak stabil bila dilihat dari ukuran pori dan luas permukaan yang sangat signifikan terjadi.
Dari penelitian yang dilakukan, dapat disimpulkan bahwa TiO2 masih banyak didapat pada analisa XRD yang diakibatkan karena pengaruh kalsinasi titanium dioksida pada suhu 9000C, seperti yang telah dilakukan oleh peneliti terdahulu(Rilda,dkk.2013) yang mana bentuk TiO2 kristal anatse stabil pada suhu kalsinasi 7000C. Sehingga hasil yang didapat pada penelitian ini tidak sepenuhnya titanium silikat tetapi banyak juga kristal TiO2 berbentuk anatase bila merujuk pada data JCPDS oleh ( Hubbard, 1981) Lampiran 8.
BAB 5
KESIMPULAN DAN SARAN 5.1 Kesimpulan
1. Berdasarkan penelitian yang sudah dilakukan bahwa penambahan TiO2 pada silika abu vulkanik yang di ektraksi menggunakan NaOH 3 N dapat dilakukan untuk memperoleh titanium silikat , Hal ini terbukti dari karakterisasi yang telah dilakukan dengan FT-IR , XRD dan adsoprsi desorpsi gas nitrogen yang menunjukkan karakter dari Titanium Silikat
2. Penambahan TiO2 pada silika abu vulkanik berpengaruh pada ukuran pori, volume pori dan luas permukaanyang dikarakterisasi dengan adsoprsi desorpsi gas nitrogen yang di tunjukkan oleh data berikut, yaitu : ukuran pori dari silika diperoleh luas permukaan sebesar 10.18 m2/g, diameter pori rata-rata sebesar 51.2 nm dan volume pori sebesar 0.08 cc/gsedangkan titanium silikat memiliki luas permukaan sebesar 109.54 m2/g, diameter pori rata-rata sebesar 29.2 nm, dan volume pori sebesar 0.51 cc/g.
5.2 Saran
Setelah dilakukan penelitian maka yang menjadi saran untuk penelitian selanjutnya agar silika yang telah diperoleh dikalsinasi dengan suhu yang seragam dengan titanium silikat sehingga kondisi reaksi menjadi stabil.