IKIP PGRI MADIUN Jl. Setiabudi 85 Madiun
Email: seagrass_nurul@yahoo.co.id
I. PENDAHULUAN
Lamun merupakan salah satu sumberdaya pesisir Indonesia yang bernilai ekologis dan ekonomis. Distribusi dan stabilitas komunitas lamun ditentukan oleh faktor-faktor antara lain: nutrien, cahaya, sedimen, salinitas, dan suhu (Udy dan Dennison 1997; Ralph et al. 2007; Hemminga dan Duarte 2000; Benjamin et al. 1999; Kahn dan Durako 2006; Masini et al. 1995; Campbell et al. 2006). Lamun mempunyai peran luar biasa di habitat litoral, antara lain: akar dan rimpang lamun mampu mengikat sedimen sehingga mengurangi erosi; sebagai stabilisator sedimen, garis pantai, dan menjernihkan air; sumber produktivitas primer dengan nilai produksi cukup tinggi; sumber makanan langsung bagi penyu hijau, dugong, dan
Biodiversitas Lamun (
Seagrass
) Pantai Tawang Pacitan
Nurul Kusuma Dewi, Raras Setyo Retno
Abstrak
Tujuan penelitian ini adalah untuk mengkaji biodiversitas lamun Pantai Tawang Pacitan melalui parameter luas tutupan dan kondisi fisiko kimianya dalam upaya pelestarian kawasan pesisir. Metode yang digunakan adalah metode transek dan petak contoh (transect plot). Pada setiap plot diidentifikasi setiap jenis tumbuhan lamun yang ada dan dicatat persen penutupannya. Dicatat semua organisme lain yang ditemukan dalam plot. Faktor-faktor fisiko kimia yang diukur meliputi: kecerahan, temperatur, salinitas, pH, kecepatan arus perairan dan nutrien berupa NH4, NO3, P2O5,
C organik, bahan organik. Hasil penelitian menunjukkan, ditemukan 3 jenis lamun yaitu Thalassia hemprichii, Cymodocea rotundata dan Halophila ovalis. Dari hasil perhitungan, didapatkan nilai persentase penutupan lamun rata-rata sebesar 37,66 %. Berdasarkan Keputusan Menteri Negara Lingkungan Hidup No.200 tahun 2004 nilai tersebut berarti kondisi padang lamun Pantai Tawang termasuk kategori kurang kaya/kurang sehat. Faktor-faktor yang menjadi penyebab kurang kayanya persentase penutupan lamun di Pantai Tawang, selain karena faktor alami, juga karena semakin meningkatnya aktivitas manusia dan tingginya kegiatan perahu-perahu nelayan di kawasan ini, sehingga kekeruhan sulit dihindarkan. Tingginya tingkat kekeruhan akan menghambat masuknya sinar matahari, sehingga kurang maksimal untuk fotosintesis. Menurunnya fotosintesis berarti mengurangi pertumbuhan lamun. Kekeruhan yang tinggi juga dapat mengakibatkan terganggunya sistem osmoregulasi. Hasil pengukuran fisiko kimia menunjukkan nilai-nilai yang masih berada dalam kisaran toleransi lamun. Lamun Pantai Tawang berasosiasi dengan berbagai jenis organisme. Beberapa jenis invertebrata yang ditemukan antara lain: Archaster typicus, Echinometra mathaei, Holothuria atra, Nerita chamaeleon, Trochus maculates, Conus textile, Cypraea eglantine, dan Turbo argyrostomus. Sedangkan jenis-jenis algae yang ditemukan antara lain: Padina sp., Ulva sp., dan Halimeda sp.
komunitas ikan familia Siganidae; merupakan habitat mencari makan, berpijah, pembesaran dan berlindung bagi berbagai jenis ikan dan avertebrata; substrat spesies algae epifitik yang menempel pada daun lamun; mempunyai kemampuan yang baik untuk menangkap dan mendaur ulang nutrien pada kolom air dan sedimen (Dawes 1981; Fortes 1990; Hemminga dan Duarte 2000; Waycott et al. 2004; Hogarth 2007).
Di lain pihak, padang lamun merupakan ekosistem yang rentan (fragile ecosystem). Berbagai aktivitas manusia dan industri memberi dampak terhadap ekosistem padang lamun, baik secara langsung maupun tidak langsung. Beberapa kegiatan berupa pembersihan atau pemanenan padang lamun yang dilakukan untuk tujuan tertentu, masuknya sedimen atau limbah dari daratan, maupun pencemaran minyak, dapat merusak padang lamun. Kerusakan juga dapat ditimbulkan oleh baling-baling perahu ataupun peletakan jangkar kapal, dan hal ini merupakan penyebab yang sangat umum dijumpai di berbagai pantai (Walker et al. 2001).
Informasi mengenai ekologi lamun dari wilayah tropis Indo-Pasifik masih jarang, padahal observasi menunjukkan bahwa kekayaan spesies tertinggi ditemukan di wilayah Indo-Pasifik (Erftemeijer dan Herman 1994; Hemminga dan Duarte 2000). Di daerah temperate padang lamun tersusun oleh 1 spesies, sebaliknya di wilayah tropis dan subtropis tersusun oleh lebih dari 1 spesies (Hemminga dan Duarte 2000). Di Indonesia terdapat 13 spesies lamun yang tergolong dalam 7 genus (Nontji 2005). Spesies terkini ditemukan adalah Halophila sulawesii, di kepulauan Spermonde barat daya Sulawesi (Kuo 2007).
Pacitan merupakan salah satu kabupaten di Jawa Timur yang memiliki potensi sumber daya alam laut yang luar biasa. Terdapat sekitar 17 pantai di Pacitan dengan karakteristik bervariasi. Pantai-pantai tersebut adalah Pantai Banyu Tibo, Pantai Buyutan, Pantai Karang Bolong, Pantai Klayar, Pantai Sruni, Pantai Srau, Pantai Watukarung, Pantai Teleng Ria, Pantai Tamperan Gung, Pantai Kali Uluh, Pantai Wawaran, Pantai Pidakan, Pantai Soge, Pantai Tawang, Pantai Taman, Pantai Kunir, dan Pantai Teluk Bawur. Di Pacitan, lamun dilaporkan tumbuh antara lain di Pantai Tawang dan Pantai Srau. Belum ada informasi tentang lamun dari pantai-pantai tersebut. Informasi tentang status padang lamun mutlak diperlukan untuk pengelolaan padang lamun secara lestari dan berkelanjutan. Tujuan penelitian ini adalah untuk mengkaji biodiversitas lamun Pantai Tawang Pacitan melalui parameter luas tutupan dan kondisi fisiko kimianya dalam rangka upaya pelestarian kawasan pesisir. Penelitian ini diharapkan juga akan memberikan informasi kepada pihak-pihak terkait tentang manfaat ekosistem padang lamun sebagai penunjang produksi perikanan dan peruntukan lainnya, sehingga kelestarian ekosistem padang lamun di masa mendatang akan lebih diperhatikan.
II. METODE
diidentifikasi setiap jenis tumbuhan lamun yang ada dan dicatat persen penutupannya. Diukur tinggi kanopi. Dicatat semua organisme lain yang ditemukan dalam plot. Diambil contoh lamun dari tiap spesies yang ada untuk dibuat herbarium. Faktor-faktor fisiko kimia yang diukur meliputi: kecerahan, temperatur, salinitas, pH, kecepatan arus perairan dan nutrien berupa NH4, NO3, P2O5, C organik, bahan organik.
III.HASIL DAN PEMBAHASAN
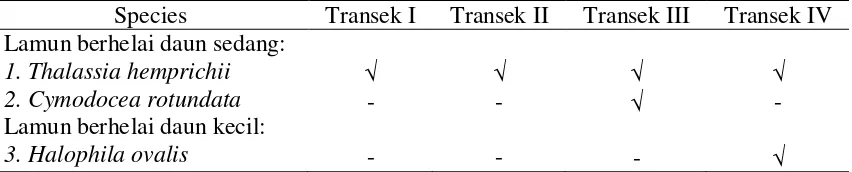
Hasil penelitian menunjukkan, kekayaan jenis lamun di Pantai Tawang sebanyak tiga jenis, dengan komposisi jenisnya pada Tabel 1. Berdasarkan kekayaan jenis lamun yang lebih dari satu jenis tersebut, maka komunitas lamun di Pantai Tawang berupa vegetasi campuran.
Tabel 1. Jenis-jenis Lamun Pantai Tawang.
No. Familia Sub Familia Genus Species
1. Potamogetonaceae Cymodoceoideae Cymodocea 1. C. rotundata
2. Hydrocharitaceae Thalassiodae
Jenis-jenis lamun yang ditemukan tersebut tergolong ke dalam dua familia yaitu Potamogetonaceae dan Hydrocharitaceae. Cymodocea dan Halophila adalah genus yang umum ditemukan di perairan pantai Indonesia (Romimohtarto dan Juwana 2001), sedangkan Thalassia hemprichii adalah jenis yang hampir selalu ditemukan di perairan Indonesia. Walaupun jenis-jenis lamun yang dijumpai adalah jenis yang umum ditemukan tetapi kekayaan dan komposisi jenis lamun berbeda antar transek. Pada transek I dan transek II hanya ditemukan Thalassia hemprichii, pada transek III ditemukan Thalassia hemprichii dan Cymodocea rotundata dan pada transek IV ditemukan Thalassia hemprichii dan Halophila ovalis. Kekayaan dan komposisi jenis lamun pada keempat transek disajikan secara lengkap pada Tabel 2.
Tabel 2. Kekayaan dan Komposisi Jenis Lamun pada Keempat Transek.
Species Transek I Transek II Transek III Transek IV Lamun berhelai daun sedang:
tumbuh pada substrat pasir berlumpur yang berbeda/ pasir medium kasar/ pecahan koral kasar (Fortes 1990).
Selain Thalassia hemprichii, pada transek III dijumpai jenis Cymodocea rotundata. Jenis ini sering tumbuh pada padang lamun campuran yang merupakan nursery gounds penting untuk udang dan invertebrata lain. Cymodocea rotundata tumbuh cepat dan berperan pada recovery habitat. Pada transek IV terdapat jenis Halophila ovalis selain Thalassia hemprichii. Halophila ovalis ditemukan pada semua habitat tetapi pada perairan lebih dalam tempat lamun tumbuh. Spesies ini merupakan makanan yang disukai dugong. Halophila ovalis sering menjadi spesies pioneer pada habitat yang mengalami gangguan dan membentuk padang lamun spesies tunggal selama fase tersebut untuk menjadi salah satu komponen padang lamun spesies campuran (Waycott et al., 2004).
Tidak terdapatnya Cymodocea rotundata dan Halophila ovalis pada beberapa transek kemungkinan disebabkan karena lingkungan pada lokasi ini tidak cocok untuk pertumbuhannya, dimana masing-masing jenis lamun memiliki kemampuan yang spesifik dalam memberikan tanggapan terhadap variasi faktor-faktor lingkungan yang ada di sekitarnya. Sesama vegetasi lamun juga terjadi saling bersaing untuk memperebutkan cahaya, ruang dan nutrisi. Lamun yang mempunyai daun lebih lebat dan tinggi akan menaungi lamun yang lebih rendah sehingga berakibat tidak dapat diperolehnya cahaya yang cukup bagi lamun yang lebih rendah dan menyebabkan proses pertumbuhannya menjadi terhambat. Sistem perakaran yang kuat dan padat menyebar merupakan suatu bentuk upaya bagi lamun tersebut untuk memonopoli sedimen. Akibatnya bagi jenis lamun lainnya yang tidak mempunyai perakaran yang lebih kuat maka akan sulit untuk dapat tumbuh pada substrat tersebut (Susetiono 2004).
Jenis lamun yang sama mempunyai kenampakan bentuk tumbuh (terutama daun dan rimpang tegak) yang berbeda apabila tumbuh pada habitat yang berlainan. Lamun yang tumbuh di Pantai Tawang ukurannya lebih besar daripada yang ditemukan di Pantai Pulau Panjang, Jepara (Dewi 2012). Menurut Kiswara (2004), lamun yang tumbuh pada dasar lumpur yang berair keruh mempunyai ukuran daun yang lebih besar dan rimpang tegak yang lebih panjang daripada lamun yang tumbuh pada dasar pasir dan puing karang dengan air yang jernih.
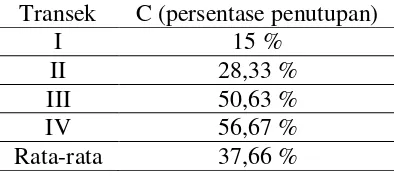
Kondisi padang lamun pada suatu lokasi tertentu dalam waktu tertentu dapat dinilai dengan menggunakan persentase luas tutupan. Berdasarkan hasil pengukuran di lokasi penelitian, diperoleh data sebagai berikut:
Tabel 3. Data Persentase Penutupan Lamun Pantai Tawang.
Transek C (persentase penutupan)
I 15 %
II 28,33 %
III 50,63 %
IV 56,67 %
Rata-rata 37,66 %
Tabel 4. Status Padang Lamun
Kondisi Penutupan (%)
Baik Kaya/sehat 60
Rusak Kurang kaya/kurang sehat 30 – 59,9
Miskin 29,9
Bila dibandingkan dengan dengan beberapa lokasi lain di kawasan Indonesia Timur (Laut Flores dan Lombok Selatan), penutupan lamun di Pantai Tawang memang tergolong kecil. Tetapi bila dibandingkan dengan beberapa tempat di Jawa (misalnya Pantai Sowan Tuban) sudah termasuk bagus. Faktor-faktor yang menjadi penyebab kurang kayanya presentase penutupan lamun di Pantai Tawang, selain karena faktor alami, juga karena semakin meningkatnya aktivitas manusia dan tingginya kegiatan perahu-perahu nelayan di kawasan ini, sehingga kekeruhan sulit dihindarkan. Nelayan-nelayan tersebut menjual hasil lautnya ke TPI Tawang. Kekeruhan bisa disebabkan adanya pergolakan di atas permukaan air oleh seringnya aktivitas perahu nelayan. Seperti diketahui bahwa tingginya tingkat kekeruhan akan menghambat masuknya sinar matahari, sehingga kurang maksimal untuk fotosintesis. Menurunnya fotosintesis berarti mengurangi pertumbuhan lamun. Selain itu kekeruhan yang tinggi dapat mengakibatkan terganggunya sistem osmoregulasi (Walker et al. 2001).
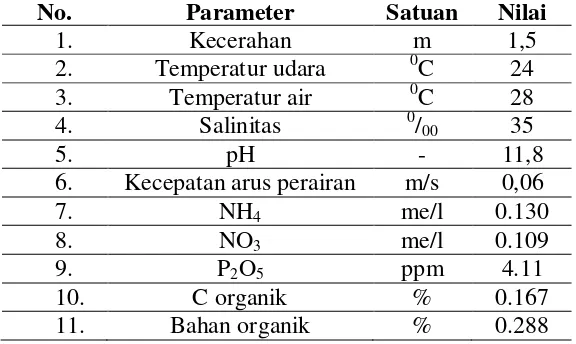
Seperti yang telah disebutkan sebelumnya, distribusi dan stabilitas komunitas lamun ditentukan oleh faktor-faktor antara lain: nutrien, cahaya, sedimen, salinitas, dan suhu (Udy dan Dennison 1997; Ralph et al. 2007; Hemminga dan Duarte 2000; Benjamin et al. 1999; Kahn dan Durako 2006; Masini et al. 1995; Campbell et al. 2006). Hasil pengukuran faktor-faktor fisiko kimia ditunjukkan pada tabel berikut:
Tabel 5. Kondisi fisiko kimia perairan Pantai Tawang.
No. Parameter Satuan Nilai
1. Kecerahan m 1,5
2. Temperatur udara 0C 24
3. Temperatur air 0C 28
4. Salinitas 0/00 35
5. pH - 11,8
6. Kecepatan arus perairan m/s 0,06
7. NH4 me/l 0.130
8. NO3 me/l 0.109
9. P2O5 ppm 4.11
10. C organik % 0.167
11. Bahan organik % 0.288
tinggi untuk membantu proses fotosintesis diperlihatkan dengan observasi dimana distribusinya terbatas pada perairan dengan kedalaman tidak lebih dari 10 meter (Dahuri et al. 2004). Pada perairan yang jernih, dengan intensitas cahaya relatif tinggi, lamun dapat tumbuh di tempat yang lebih dalam.
Temperatur merupakan salah satu faktor fisiko kimia yang mempengaruhi pertumbuhan lamun. Hasil pengukuran menunjukkan temperatur air permukaan Pantai Tawang sebesar 280 C (Tabel 5). Nilai tersebut masih berada dalam kisaran temperatur optimal untuk pertumbuhan lamun yaitu 28-300 (Nybakken 1992). Temperatur permukaan dipengaruhi oleh kondisi meteorologi. Faktor-faktor meteorologi yang berperan disini ialah curah hujan, penguapan, kelembaban udara, temperatur udara, kecepatan angin dan intensitas radiasi matahari serta asal massa air. Oleh sebab itu temperatur di permukaan biasanya mengikuti pula pola musiman (Arinardi dkk., 1997; Nontji, 2005). Pada saat penelitian yaitu pertengahan Nopember, di perairan Pantai Tawang temperatur air permukaan yang terukur relatif tinggi. Ini terjadi karena pada musim-musim pancaroba, angin biasanya lemah dan laut sangat tenang hingga proses pemanasan di permukaan dapat terjadi dengan lebih kuat
Temperatur air yang terlampau tinggi akan membahayakan kehidupan lamun. Demikian pula temperatur yang terlalu rendah diketahui juga dapat mematikan lamun di daerah tropis. Tekanan suhu rendah maupun tinggi menyebabkan gangguan pada fotosintesis dan penurunan biomasa lamun (Masini et al. 1995; Campbell et al. 2006). Beberapa spesies lamun tropis, C. rotundata, C. serrulata, H. uninervis dan T. hemprichii lebih toleran terhadap tekanan suhu tinggi daripada H. ovalis, Z. capricorni dan S. isoetifolium (Campbell et al. 2006). Menurut Dahuri et al. 2004 spesies lamun daerah tropik mempunyai toleransi yang rendah terhadap perubahan temperatur. Kisaran temperatur optimal bagi spesies padang lamun adalah 28 0- 300 C dan kemampuan proses fotosintesis akan menurun dengan tajam apabila temperatur perairan berada di luar kisaran optimal tersebut.
Spesies-spesies lamun memiliki toleransi terhadap salinitas yang berbeda-beda, namun sebagian besar memiliki kisaran toleransi yang lebar terhadap salinitas yaitu antara 10-440/00
(Hemminga dan Duarte 2000). Nilai optimum toleransi terhadap salinitas di air laut adalah 350/00 (Dahuri et al., 2004). Ini berarti, nilai salinitas di Pantai Tawang sesuai untuk
pertumbuhan lamun. Peningkatan salinitas yang melebihi ambang batas toleransi lamun dapat menyebabkan kerusakan, namun demikian lamun yang telah tua diketahui mampu meningkatkan toleransi terhadap fluktuasi salinitas yang besar. Salinitas juga berpengaruh pada biomassa, produktivitas, kerapatan, lebar daun dan kecepatan pulih lamun (Stapel 1997).
Derajat keasaman (pH) mempunyai pengaruh yang sangat besar terhadap organisme perairan sehingga dipergunakan sebagai petunjuk untuk menyatakan baik buruknya suatu perairan. Menurut Nybakken (1992), kisaran pH yang optimal untuk air laut antara 7,5-8,5. Namun demikian, di banyak tempat pH yang sangat basa masih dapat ditolerir lamun.
mempunyai pengaruh yang besar dalam memperlambat gerak arus. Perairan yang dangkal dan kerapatan lamun yang tinggi akan memperkecil arus (Zulkifli dan Efriyeldi 2003). Arus pasang surut yang tidak begitu kuat menyebabkan vegetasi lamun di Pantai Tawang mudah untuk menancapkan akarnya pada dasar perairan sehingga lamun mudah pula untuk berkembang biak dengan baik. Karena arus yang melintas di pantai Tawang tidak kuat, maka permukaan daun lamun yang tumbuh disana penuh ditumbuhi oleh epifit berikut material lain yang tertampung diantara algae tersebut.
Nutrien yang berpengaruh pada pertumbuhan lamun adalah nitrogen (N) dan fosfor (P). Nitrogen dan fosfor yang terukur di Pantai Tawang masih berada dalam jumlah yang cukup untuk pertumbuhan lamun. Pengkayaan nutrien (eutrofikasi) dapat memicu pertumbuhan algae epifitik pada daun lamun maupun algae di kolom air. Kedua tipe blooming algae tersebut mengurangi jumlah cahaya yang mencapai lamun. Hal ini mengurangi efektifitas fotosintesis sehingga menekan produktivitas lamun dan menyebabkan penurunan komunitas lamun di seluruh dunia (Hays 2005; Waycott et al. 2007; Christianen et al. 2011).
Lamun yang tumbuh di Pantai Tawang berasosiasi dengan berbagai jenis organisme. Akar yang kokoh dan daun lebat merupakan fungsi lamun yang sangat produktif bagi perairan. Akar-akarnya berfungsi sebagai penahan sedimen dari adukan arus, ombak dan badai. Daun-daunnya merupakan pelindung bagi dasar perairan berikut flora dan faunanya dari kekeringan dan sengatan sinar matahari. Beberapa jenis invertebrata yang menghuni padang lamun Pantai Tawang antara lain: Archaster typicus, Echinometra mathaei, Holothuria atra, Nerita chamaeleon, Trochus maculates, Conus textile, Cypraea eglantine, dan Turbo argyrostomus. Sedangkan jenis-jenis algae yang ditemukan antara lain: Padina sp., Ulva sp., dan Halimeda sp.
IV.KESIMPULAN
Kekayaan jenis lamun di Pantai Tawang sebanyak tiga jenis, yaitu Thalassia hemprichii, Cymodocea rotundata dan Halophila ovalis. Komposisi jenis lamun berbeda antar transek. Lamun berhelai daun sedang dominan di semua transek yang menunjukkan padang lamun Pantai Tawang dikarakteristikkan oleh spesies lamun berhelai daun sedang (Thalassia hemprichii dan Cymodocea serrulata. Nilai C (persentase penutupan) rata-rata sebesar 37,66 %. Berdasarkan Keputusan Menteri Negara Lingkungan Hidup No.200 tahun 2004 nilai tersebut berarti kondisi padang lamun Pantai Tawang termasuk kategori kurang kaya/kurang sehat.
Faktor-faktor yang menjadi penyebab kurang kayanya persentase penutupan lamun di Pantai Tawang, selain karena faktor alami, juga karena semakin meningkatnya aktivitas manusia dan tingginya kegiatan perahu-perahu nelayan di kawasan ini, sehingga kekeruhan sulit dihindarkan. Tingginya tingkat kekeruhan akan menghambat masuknya sinar matahari, sehingga kurang maksimal untuk fotosintesis. Menurunnya fotosintesis berarti mengurangi pertumbuhan lamun. Kekeruhan yang tinggi juga dapat mengakibatkan terganggunya sistem osmoregulasi. Hasil pengukuran fisiko kimia yang meliputi kecerahan, temperatur, salinitas, pH, kecepatan arus perairan dan nutrien berupa NH4, NO3, P2O5, C organik, bahan organik
Padang lamun merupakan ekosistem yang kompleks di perairan dangkal. Lamun Pantai Tawang berasosiasi dengan berbagai jenis organisme. Beberapa jenis invertebrata yang ditemukan antara lain: Archaster typicus, Echinometra mathaei, Holothuria atra, Nerita chamaeleon, Trochus maculates, Conus textile, Cypraea eglantine, dan Turbo argyrostomus. Sedangkan jenis-jenis algae yang ditemukan antara lain: Padina sp., Ulva sp., dan Halimeda sp.
V. DAFTAR PUSTAKA
Arinardi O.H., A.B. Sutomo, S.A. Yusuf, Trimaningsih, Elly Asnaryanti, S.H. Riyono. 1997. Kisaran Kelimpahan dan Komposisi Plankton Predominan di Perairan Kawasan Timur Indonesia. Pusat Penelitian dan Pengembangan Oseanologi. Lembaga Ilmu Pengetahuan Indonesia, Jakarta. Benjamin, K. J., D. I. Walker, A. J. McComb, J. Kuo. 1999. Structural response of marine and
estuarine plants of Halophila ovalis (R. Br.) Hook. f. to long-term hyposalinity. Aquatic Botany 64: 1-17
Campbell, S. J., L. J. McKenzie, S. P. Kerville. 2006. Photosynthetic responses of seven tropical seagrasses to elevated seawater temperature. Journal of Experimental Marine Biology and Ecology 330: 455-468
Christianen, M. J. A., T. van der Heide, T. J. Bouma, J. G. M. Roelofs, M. M. van Katwijk, L. P. M. Lamers. 2011. Limited toxicity of NHx pulses on an early and late successional tropical seagrass
species: Interactions with pH and light level. Aquatic Toxicology 104: 73-79
Dahuri, R.; J. Rais; S.P. Ginting; M.J. Sitepu. 2004. Pengelolaan Sumberdaya Wilayah Pesisir dan Lautan Secara Terpadu. PT. Pradnya Paramita, Jakarta
Dawes, C. J. 1981. Marine botany. A Wiley- Interscience Publication, New York, USA
Dewi, N. K. 2012. Distribusi dan Kemelimpahan Lamun (Seagrass) sebagai Respon terhadap Musim di Pantai Jepara. Tesis tidak diterbitkan. Yogyakarta: Pascasarjana Universitas Gadjah Mada Erftemeijer, P. L. A. and P. M. J. Herman. 1994. Seasonal changes in environmental variables,
biomass, production and nutrient contents in two contrasting tropical intertidal seagrass beds in South Sulawesi, Indonesia. Oecologia 99: 45-59
Fortes, M. D. 1990. Seagrasses: a resource unknown in the ASEAN region. ICLARM Education Series 5. International Center for Living Aquatic Resources Management. Manila, Philippines Hauxwell, J., J. Cebrian, I. Valiela. 2006. Light dependence of Zostera marina annual growth
dynamics in estuaries subject to different degress of eutrophication. Aquatic Botany 84: 17-25 Hays, C. G. 2005. Effect of nutrient availability, grazer assemblage and seagrass source population on
the interaction between Thalassia testudinum (turtle grass) and its algal epiphytes. Journal of Experimental Marine Biology and Ecology 314: 53-68
Hemminga, M. A., and C. M. Duarte. 2000. Seagrass ecology. Cambridge University Press
Hogarth, P. J. 2007. The Biology of Mangroves and Seagrasses. Second edition. Oxford University Press
Kahn, A. E., and M. J. Durako. 2006. Thalassia testudinum seedling responses to changes in salinity and nitrogen levels. Journal of Experimental Marine Biology and Ecology 335: 1-12
Kiswara, W., 1994. Dampak Perluasan Kawasan Industri terhadap Penurunan Luas Padang Lamun di Teluk Banten, Jawa Barat. Makalah disampaikan pada Seminar Nasional Dampak Pembangunan terhadap Wilayah Pesisir, Serpong, 2-3 Februari 1994.
Kuo, J. 2007. New monoecious seagrass of Halophila sulawesii (Hydrocharitaceae) from Indonesia. Short communication. Aquatic Botany 87: 171-175
Menteri Negara Lingkungan Hidup. 2004. Keputusan Menteri Negara Lingkungan Hidup Nomor : 200 Tahun 2004 Tentang Kriteria Baku Kerusakan dan Pedoman Penentuan Status Padang Lamun Nontji, A. 2005. Laut Nusantara. Djambatan, Jakarta
Nybakken, J. W. 1992. Biologi Laut, Suatu Pendekatan Ekologis. PT. Gramedia. Jakarta
Ralph, P. J., M. J. Durako, S. Enriquez, C. J. Collier, M. A. Doblin. 2007. Impact of light limitation on seagrasses. Journal of Experimental Marine Biology and Ecology 350: 176-193
Romimohtarto, K., dan S. Juwana. 2009. Biologi laut, ilmu pengetahuan tentang biota laut. Penerbit Djambatan, Jakarta
Stapel, J. 1997. Nutrient dynamics in Indonesian seagrass beds: factors determining conservation and loss of nitrogen and phosphorus. Disertation, Radboud University Nijmegen. 127p
Susetiono. 2004. Fauna Padang Lamun Tanjung Merah Selat Lembeh. Pusat Penelitian Oseanografi- Lembaga Ilmu Pengetahuan Indonesia. Jakarta
Tomascik, T., A. J. Mar, A. Nontji, M. K. Moosa. 1997. The ecology of Indonesian seas. Vol VIII, part two. Periplus Edition, Singapore
Udy, J. W., and W. C. Dennison. 1997. Growth and physiological responses of three seagrass species to elevated sediment nutrients in Moreton Bay, Australia. Journal of Experimental Marine Biology and Ecology 217: 253-277
Walker, C.H., S.P. Hopkin, R.M. Sibly, and D.B. Peakall. 2001. Principles of Ecotoxicology. 2rd edition. New York: Taylor & Francis, Inc.
Waycott, M., K. McMahon, J. Mellors, A. Calladine, D. Kleine. 2004. A guide to Tropical Seagrasses of the Indo-West Pacific. James Cook University
Waycott, M., C. Collier, K. McMahon, P. Ralph, L. McKenzie, J. Udy, A. Grech. 2007. Climate change and the Great Barrier Reef: a vulnerability assesment. Department of Primary Industries & Fisheries, Queensland.