SOAL-SOAL REAKSI REDUKSI OKSIDASI DAN JAWABANNYA
REAKSI REDUKSI OKSIDASI (REDOKS)
1. Definisikan oksidasi dan reduksi sesuai istilah berikut :
a. Pertukaran oksigen
b.
Pertukaran hidrogen
c. Pertukaran elektron
Jawab :
a. oksidasi : proses penangkapan oksigen oleh suatu unsur atau persenyawaan.
Reduksi : proses pelepasan oksigen dari suatu persenyawaan
b. oksidasi : proses pelepasan hydrogen
reduksi : proses penangkapan hydrogen
c. oksidasi : proses pelepasan electron
reduksi : proses penangkapan elektron
2. Identifikasi zat yang bertindak sebagai oksidator berikut:
a. Fe2O3(s) + 3 CO(g) → 2 Fe(s) + 3 CO2(g)
3. Tulis kembali dua persamaan setengah reaksi berikut dan berikan nama oksidasi atau reduksi.
a.
Zn(s) + Cu
2+(aq) → Zn2+(aq) + Cu(s)4. Tentukan bilangan oksidasi pada atom yang berbeda pada masing-masing berikut :
1.
Cl2, P4, SO2, H2S
2. MnO4
2-, ZnO2
-, HSO4
-, NH4
+3. MgCO3, KClO4, NaIO3, Na3PO4
Jawab :
a. Bilangan oksidasi Cl2 dan P4 = 0
bilangan oksidasi S dalam SO2 = +4, O dalam SO2 = -2
b. bilangan oksidasi Mn dalam MnO4
2-= +6, O dalam MnO4
2-= -2
5. Gunakan bilangan oksidasi untuk mengidentifikasi dua pasang senyawa yang terdiri dari
bromine dalam keadaan oksidasi yang sama.
Br, BrO
-, HBr, BrO
-4, HBrO3, Br2, Br2O, HBrO2Jawab : bilangan oksidasi Br dan Br2 = 0
bilangan oksidasi BrO4
-dan HBrO2 = +3
bilangan oksidasi BrO- dan Br2O = +1
6. Tulis persamaan setengah reaksi reduksi, diasumsikan dalam keadaan asam.
1.
SO4
2-(aq) ke SO2(g)7.
Tulis persamaan setengah reaksi oksidasi, diasumsikan dalam keadaan asam.
1. H2S(g) ke S(s)
oksidasi : SO2 + 2H2Oà SO4
2-+ 4H
++ 2e
-9. Tulis persamaan setimbang untuk reaksi berikut dan identifikasi agen pengoksidasi dan
pereduksinya.
a. Produksi logam timah dengan perlakuan awal dengan pemanasan bijih kasiterit (SnO2)
dengan arang (karbon)
b. Pengolahan air limbah terdiri dari hidrogen sulfida dengan klorin. H2S dioksidasi menjadi
belerang.
10. Tulis semua persamaan redoks berikut :
a. kalium permanganat mengoksidasi hidrogen peroksida menjadi oksigen. (Suasana asam)
b. kalium dikromat mengoksidasi belerang dioksida menjadi ion sulfat. (Suasana asam)
c. Pembentukan unsur selenium dan belerang dari H2S dengan H2SeO3.
Jawab :
11. Gas Klorin ditiupkan dalam larutan kalium iodida. Deskripsikan apa yang yang ingin diamati
dan seimbangkan persamaan reaksinya.
Jawab :
Klorin merupakan agen pengoksidasi kuat dari yodium, karena iodide dioksidasi oleh klorin
untuk yodium. Saat gas klorin ditiupkan ke dalam larutan kalium iodida, beberapa ion iodida
dioksidasi menjadi iodin.. Molekul-molekul iodin bergabung dengan ion iodida untuk
Dengan kelebihan klorin, iodin bereaksi untuk membentuk yodium monoklorida, ICl,
berwarna merah. yodium monoklorida bereaksi lebih lanjut untuk membentuk yodium
triklorida, ICl 3, warnanya lebih jernih.
Persamaan reaksinya :
12. Larutan Kalium permanganat mengoksidasi ammonium besi (II) sulfat, (NH4)2SO4. FeSO4.
6H2O. tulis semua persamaan reaksi seimbang
Jawab :
FeSO4 + (NH4)2SO4 + 6H2O → (NH4)2Fe(SO4)2.6H2O
13. Peristiwa oksidasi terdapat pada perubahan . . . .
a.
S
2-menjadi S
Bilangan oksidasi S pada S
2-adalah sesuai dengan muatannya yaitu -2. Dan bilangan oksidasi
S adalah 0. Jadi S yang mengalami oksidasi karena bilangan oksidasinya naik dari -2 menjadi
0.
14. Reaksi antara natrium dan air ditunjukan dengan persamaan :
2Na + 2H2O → 2NaOH + H2
Zat yang mengalami reduksi adalah . . . .
a. Air
Bilangan oksidasi H pada H2O adalah +1 sedangkan bilangan oksidasi H pada H2 adalah 0.
Jadi air yang mengalami reduksi karena bilangan oksidasinya turun.
15. Bilangan oksidasi dalam Al(NO3)3 = 0, berikan penjabarannya !
Jawab :
(1 x +1) + (3 x +5) + (9 x -2) = x
(+3) + (+15) + (-18) = x
0 = x
16.
Tentukan bilangan oksidasi N dalam HNO3 !
Jawab :
bilangan oksidasi N dalam HNO3 adalah +5
17.
Tentukan bilangan oksidasi N dalam NH4
+!
Jawab :
bilangan oksidasi N dalam NH4
+(1 x BO N) + (4 x BO H) = +1
Mahasiswa mampu menjelaskan beberapa konsep-konsep dasar ilmu kimia. (Gambar 2.1 adalah struktur 3-dimensi molekul vitamin C, salah satu contoh zat antioksidan).
Tujuan Instruksional Khusus (TIK):
Bila diberikan satu sistem reaksi redoks maka mahasiswa akan dapat menyusun selnya dan menulis reaksi yang terjadi baik sebagai sel galvanik maupun elektrolisis.
2.1 Pendahuluan
Manusia hidup karena reaksi oksidasi reduksi atau disingkat redoks. Glukosa dalam tubuh dapat menghasilkan energi karena reaksi oksidasi. Oleh karena itu, kekurangan oksigen dalam tubuh akan menyebabkan kekurangan energi yang dibutuhkan untuk melakukan aktivitas.
Reaksi yang berhubungan dengan oksigen disebut oksidasi. Oksigen bereaksi dengan hampir semua unsur membentuk senyawa yang disebut oksida. Contohnya, magnesium sangat mudah bergabung dengan oksigen. Permukaan logam yang masih baru
dikenakan terhadap udara akan segera teroksidasi menghasilkan lapisan magnesium oksida, MgO. Besi, juga dengan mudah dioksidasi diudara terbuka
menghasilkan karat yang disusun dari Fe2O3. Besi yang telah teroksidasi, atau oksida besi, dapat juga dirusak, atau direduksi, menghasilkan logam Fe murni Proses
Oksigen selain bereaksi dengan unsur dapat juga bereaksi dengan molekul. Reaksi oksigen dengan molekul yang mengandung unsur karbon dan hidrogen, misalnya glukosa, akan menghasilkan hasil akhir yaitu H2O dan CO2.
Selanjutnya, pengertian oksida dan reduksi menjadi lebih luas, tidak hanya reaksi dengan oksigen. Misalnya, besi oksida, Fe2O3, adalah senyawa ionik (lihat Kimia Dasar I tentang Struktur Molekul) yang tersusun dari ion Fe3+ dan O2-. Reaksi besi dengan oksigen adalah,
Fe(s) + 3O2(g) → 2 Fe2O3(s)
Berdasarkan reaksi di atas, mula-mula Fe adalah atom netral tetapi kemudian
kehilangan elektron sehingga berubah menjadi ion Fe3+. Besi dapat kembali menjadi logam besi. Proses balik ini terjadi bila ion Fe3+ memperoleh elektron.
Prosesmelepaskan dan menerima elektron masing-masing
disebut oksidasi dan reduksi. Jadi oksidasi adalah proses melepaskan elektron oleh suatu zat, dan reduksi adalah proses menerima elektron oleh suatu zat. Reaksi yang melibatkan oksidasi dan reduksi disebut reaksi oksidasi-reduksi, atau disingkat reaksi redoks.
Perhatikan reaksi pembentukan MgO, Mg(s) + O2(g) → 2MgO(s)
Produk MgO adalah senyawa ionik yang mengandung Mg2+ dan O2- yang terbentuk melalui pemindahan elektron dari Mg kepada oksigen. Magnesium melepaskan elektron melalui proses,
Mg → Mg2+ + 2e (oksidasi)
Perubahan Mg menjadi Mg2+ disebut oksidasi karena magnesium melepaskan elektron. Oksigen menerima elektron melalui reaksi,
O2 + 4e → 2O2- (reduksi)
Perubahan O2 menjadi O2- adalah reduksi karena oksigen memperoleh elektron. Oleh karena itu, pada reaksi Mg(s) + O2(g), magnesium dioksidasi dan oksigen direduksi. Pada setiap reaksi redoks, oksidasi dan reduksi terjadi secara bersamaan (simultan). Tidak pernah terjadi zat melepaskan elektron tanpa ada zat lain yang menerimanya. Hal ini disebabkan karena elektron tidak pernah ditemukan sebagai pereaksi atau produk dalam setiap perubahan kimia atau reaksi kimia. Dari sini juga dapat disimpulkan bahwa jumlah total elektron yang diperoleh sama dengan jumlah total elektron yang
dilepaskan. Jadi, pada reaksi Mg(s) + O2(g), 2 atom Mg bereaksi dengan 1 molekul O2, karena 2 atom Mg membebaskan 4e dan 1 molekul O2 menerima 4e.
Pada reaksi redoks terdapat 2 istilah yaitu zat pengoksidasi (oksidator) dan zat pereduksi (reduktor). Zat pengoksidasi adalah zat yang menerima elektron dari zat yang dioksidasi. Zat pengoksidasi adalah zat yang mengalami reduksi. Jadi zat pengoksidasi adalah zat yang menyebabkan terjadinya oksidasi. Pada reaksi
pembentukan MgO, O2 mengambil elektron dari Mg dan menyebabkan Mg teroksidasi. Jadi O2 adalah zat pengoksidasi. Pada reaksi Mg(s) + O2(g), zat pengoksidasi (O2) menjadi tereduksi. Zat pereduksi adalah zat yang memberikan elektron pada zat yang direduksi. Zat pereduksi adalah zat yang mengalami oksidasi. Jadi zat pereduksi adalah zat yang menyebabkan terjadinya reduksi. Pada reaksi pembentukan MgO, Mg
2.2 Bilangan Oksidasi
Pada reaksi O2 dengan masing-masing Mg dan S berikut, Mg(s) + O2(g) → MgO(s)
S(s) + O2(g) → SO2(s)
terdapat paling tidak satu kesamaan, yaitu kedua reaksi menghasilkan oksida. Perbedaannya adalah bahwa hasil reaksi MgO adalah oksida ionik tetapi SO2 adalah molekular yang tidak mengandung ion-ion. Namun demikian, kita harus mampu menjelaskan kedua reaksi dalam satu cara yaitu dengan membuktikan pernyataan bahwa oksigen mengoksidasi Mg dan S. Dengan kata lain, kita harus menjelaskan kedua reaksi sebagai reaksi redoks. Hal ini dapat dilakukan dEngan konsep bilangan
oksidasi. Bila menerapkan konsep bilangan oksida maka harus ditentukan terlebih dahulu bilangan oksida unsur. Untuk menentukan bilangan ini harus mangikuti aturan berikut.
Aturan-aturan menentukan bilangan Oksidasi:
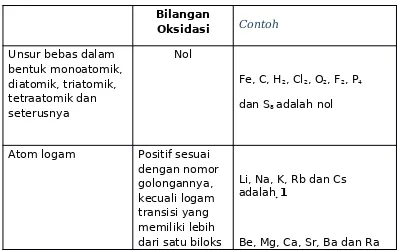
1. Bilangan Oksidasi setiap unsur dalam bentuk unsurnya adalah nol tanpa
memperhatikan kekompleksan molekul yang terjadi. Jadi atom-atom di dalam Ne, F2, P4 dan S8 semua mempunyai bilangan Oksidasi nol.
2. Bilangan oksidasi ion monoatomik (ion yang tersusun hanya dari satu atom) sama dengan muatannya. Jadi Na+, Al3+ dan S2- masing-masing mempunyai bilangan oksidasi +1, +3, dan -2.
3. Jumlah semua bilangan oksidasi dari semua atom-atom dalam Suatu senyawa adalah nol. Untuk ion poliatomik, jumlah bilangan oksidasi harus sama dengan
muatannya. Tambahan pada aturan ini adalah bahwa pada suatu senyawa: 4. Bilangan oksidasi F adalah -1.
5. Bilangan oksidasi H adalah +1. 6. Bilangan oksidasi O adalah -2.
Bila menentukan bilangan oksidasi, seringkali terjadi pertentangan antara aturan yang satu dengan yang lain. Bila hal ini terjadi maka prioritas adalah dari aturan tertinggi hingga aturan terendah.
Di dalam menentukan bilangan oksidasi atom-atom dalam berbagai senyawa, selain menggunakan aturan-aturan diatas dapat juga menggunakan teori-teori tentang pembentukan ion-ion dari logam dan non-logam.
Pada reaksi redoks terjadi perubahan bilangan oksidasi atau keadaan-oksidasi pada dua atau lebih unsur. Contohnya reaksi antara Mg dan oksigen,
Mg(s) + O2(g) → MgO(s) bilangan oksidasi: 0 0 +2 -2
dengan bilangan oksidasi tertulis dibawah simbol unsur-unsurnya. Bilangan oksidasi Mg berubah dari 0 menjadi +2 dan bilangan oksidasi O berubah dari 0 menjadi -2. Jadi, pada oksidasi Mg disertai dengan kenaikan bilangan oksidasi (dari 0 menjadi +2) dan pada reduksi O2 disertai dengan penurunan bilangan oksidasi (dari 0 menjadi -2). Contoh ini menghasilkan cara pendefinisian reaksi oksidasi dan reduksi lain yang lebih umum.
dengan definisi sebelumnya, maka zat pengoksidasi adalah zat yang direduksi dan zat pereduksi adalah zat yang dioksidasi.
Dengan definisi baru ini maka reaksi antara S dan O2 adalah reaksi redoks. Persamaan reaksinya adalah,
S(s) + O2(g) → SO2(s) bilangan oksidasi: 0 0 +4 -2
dengan bilangan oksidasi S naik dari 0 menjadi +4 dan bilangan oksidasi O turun dari 0 menjadi -2. Jadi S mengalami oksidasi dan O2 mengalami reduksi. Dalam pengertian lain bahwa O2 adalah zat pengoksidasi dan S adalah zat pereduksi.
Contoh 1:
Tentukan bilangan oksidasi atom-atom dalam senyawa berikut: (a) FeCl3, (b) KNO3, (c) H2O2, (d) Cr2O72-, (e) ClO3, (f) Na2S4O6, dan (g) Fe2(SO4)3.
Penyelesaian:
1. Senyawa yang terbentuk dari logam dan non logam adalah senyawa ionik. Klorida dapat mambentuk ion Cl- sehingga bilangan oksidamya adalah -1. (Catatan: karena bilangan oksidasi tidak sama dengan muatan sebenarnya, khususnya untuk senyawa molekular, maka keduanya harus dibedakan. Bila bilangan ditulis mendahului tanda muatan maka disebut muatan, dan bila tanda muatan ditulis mendahului
bilangan disebut bilangan oksidasi. Jadi bilangan oksidasi C1- = -1 dan muatan C1- = 1-). Bilangan oksidasi Fe dapat ditentukan dengan aturan 3.
Cl 3. (-1) = -3 Fe 1.( x) = x
Jumlah = O, maka x = +3. Jadi bilangan oksidasi Fe adalah +3.
2. K (golongan IA) membentuk ion dengan muatan 1+, K+. Jadi bilangan oksidasinya adalah +1 (aturan 2). Bilangan oksidasi oksigen adalah -2 (aturan 6). Bilangan oksidasi N ditentukan dengan aturan 3.
K 1.(+1) = +1 (aturan 2) O 3 (-2) = -6 (aturan 6) N 1.( x) = x
Jumlah = 0, maka x = +5. Jadi bilangan oksidasi N adalah +5.
3. H2O2 adalah senyawa non-logam atau molekular. Karena tidak ada ion-ion maka aturan 2 tidak dapat digunakan. Aturan 5 dan aturan 6 dapat digunakan,
tetapi terdapat pertentangan. Jika bilangan oksidasi H adalah +1, sesuai aturan 5, maka O harus -1 agar jumlah bilangan oksidasi nol. Tetapi jika O adalah -2, sesuai aturan 6, maka H harus +2 agar jumlah bilangan oksidasi nol. Tetapi bila terjadi pertentangan maka digunakan aturan yang lebih tinggi. Karena aturan lebih tinggi adalah aturan 5, maka bilangan oksidasi H = +1 dan O = -1. ‘
4. Untuk ion Cr2O72-, jumlah bilangan oksidasi sama dengan muatannya. Jadi, Cr 2.( x) = 2x
O 7. (-2) = -14 (aturan 6)
5. Ion ClO3- terbentuk dari 2 unsur non-logam. Ini berarti bahwa ion terikat dengan gaya tarik yang sama seperti dalam molekul. Ini berarti tidak ada ion Cl- di dalam ion ClO3- sehingga aturan 2 tidak dapat digunakan. Dengan aturan 6, bilangan oksidasi oksigen adalah -2. Sehingga bilangan oksidasi Cl dapat ditentukan.
Cl l.(x) = x
O 3.(-2) = -6 (aturan-6)
Jumlah = -1 (aturan -3), maka x = +5. Jadi bilangan oksidasi Cl adalah +5. Bila bersenyawa dengan logam, seperti pada NaCl dan FeCl3, maka klorida adalah sebagai Cl- sehingga bilangan oksidasinya adalah -1. Jadi dapat terjadi bilangan oksidasi Cl selain -1 yang terjadi bila Cl bersenyawa dengan non-logam. Hal yang sama berlaku untuk senyawa yang mengandung non-logam selain Cl.
6. Na adalah logam alkali, jadi Na+, sehingga bilangan oksidasinya adalah +1. Sesuai aturan 6, bilangan oksidasi oksigen adalah -2.
Na 2.(+1) = + 2 (aturan 2) S 4.( x) = 4x
O 6.(-2) = -12 (aturan 6)
Jumlah = 0, maka x = +5/2. Bilangan oksidasi S adalah +5/2.
Bilangan oksidasi tidak boleh semua bilangan (meskipun bilangan oksidasi itu ada).
7. Fe2(SO4)3 adalah senyawa ionik yang tersusun dari ion Fe3+ dan SO42-. Jadi
bilangan oksidasi Fe3+ adalah +3. Bilangan oksidasi oksigen adalah -2, sesuai aturan-6. Jadi,
Jenis reaksi antara ion-ion di dalam larutan tidak hanya reaksi metatesis. Reaksi metatesis atau reaksi pergantian adalah reaksi yang melibatkan dua senyawa dalam larutan dengan mempertukarkan kation diantara dua anion. contohnya reaksi,
AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq)
Reaksi redoks juga banyak melibatkan pereaksi ionik, produk ionik, atau pereaksi dan produk ionik. Reaksi redoks sering lebih kompleks dari reaksi metatesis sehingga sukar menyetimbangkan persamaan reaksinya. Namun demikian, ada metoda
menyetimbangkan reaksi redoks. Zat-zat yang dapat melakukan reaksi redoks meliputi zat-zat yang digunakan di laboratorium dan yang sudah digunakan dalam kehidupan sehari-hari. Salah satu contoh yang digunakan dalam kehidupan sehari-hari adalan cairan pengelantang seperti clorox, yaitu larutan encer NaOCl. Ion OCl¬- adalah zat pengoksidasi kuat yang mampu mengoksidasi senyawa-senyawa berwarna menjadi tidak berwarna.
Ion OCl- (hipoklorit) juga digunakan sebagai “active ingredient” dalam beberapa produk yang digunakan untuk mencegahpertumbuhan lumut, dan active ingredient pada bahan kimia yang ditambahkan ke dalam kolam renang untuk mengklorinasi air. Ion OCl- membunuh jamur dan mikroorganisme lain dengan cara mengoksidasinya. Disamping untukmembunuh bakteri, reaksi redoks juga digunakan untuk
Salah satu metoda yang dapat digunakan untuk menyetimbangkan reaksi redoks adalan metoda ion-elektron. Dengan metoda ini persamaan reaksi dipecah menjadi dua bagian, yang disebut ½-reaksi. Masing-masing ½-reaksi disetimbangkan dan kemudian dijumlahkan untuk memberikan persamaan ion total yang telah setimbang. Salah satu contoh adalah reaksi antara larutan SnCl2 dan HgCl2 menghasilkan Hg2Cl2 dan Sn4+.
Langkah-langkah penyetimbangan adalah sebagai berikut 1. Tuliskan semua zat yang terlibat dalam reaksi.
Sn2+ + Hg2+ + C1- → Sn4+ + Hg2C12
2. Membagi persamaan reaksi menjadi dua ½-reaksi. Untuk membagi reaksi maka dimulai dengan melihat produk yang mangalami perubahan dari pereaksi.
Sn2+ → Sn4+
Hg2+ + Cl- → Hg2Cl2
3. Menyetimbangkan ½-reaksi dengan aturan-aturan: • Menyamakan jumlah atom disebelah kiri dan kanan reaksi. • Menyamakan muatan total disebelah kiri dan kanan reaksi. Jadi diperoleh,
Sn2+ → Sn4+ + 2e
2e + 2Hg2+ + 2Cl- → Hg2Cl2
4. Menjumlahkan kedua ½-reaksi.
Untuk menjumlahkan ½-reaksi maka dipakai prinsip reaksi redoks yaitu jumlah elektron yang diterima harus sama dengan jumlah elektron yang dibebaskan. Bila ini telah dipenuhi maka baru dapat dijumlahkan. Jadi diperoleh,
2e + Sn2+ + 2Hg2+ + 2C1- → Sn4+ + Hg2C12 + 2e
Bila terdapat spesi yang sama di sebelah kiri dan kanan reaksi maka harus dihilangkan. Jadi dari persamaan ini elektron harus dihilangkan, sehingga diperoleh,
Sn2+ + 2Hg2 + 2Cl- → Sn+ + Hg2Cl2
Contoh 2:
Pada reaksi berikut, zat mana yang tereduksi dan teroksidasi, dan mana zat pengoksidasi dan zat pereduksi?
Dapat terlihat bahwa zat yang teroksidasi adalah HC1 dan zat yang tereduksi adalah K2Cr2O7. Atau zat pengoksidasi adalah K2Cr2O7 dan zat pereduksi adalah HC1.
2.4 Reaksi Redoks dalam Larutan Asam
adalah reaksi redoks antara HCl dan KMnO4 dalam suasana asam menghasilkan Cl2 dan Mn2+,
Cl¬- + MnO4 → Cl2 + Mn2+
Tahap-tahap menyetimbangkan reaksi diatas dengan metoda ion-elektron dalam larutan suasana asam adalah sebagai barikut:
1. Membagi persamaan reaksi menjadi ½-reaksi. Cl- → Cl2
MnO4- → Mn2+
2. Menyetimbangkan atom-atom selain H dan O. 2Cl- → Cl2
MnO4- → Mn2+
3. Menyetimbangkan oksigen dengan menambahkan H2O. 2Cl- → Cl2
MnO4-→ Mn2+ + 4H2O
4. Menyetimbangkan hidrogen dengan penambahan H+. 2CI- → Cl2
8H+ + MnO4- •— > Mn2+ + 4H2O
5. Menyetimbangkan muatan dengan penambahan elektron. 2Cl- → Cl2 + 2e
5e + 8H+ + MnO4 → Mn2+ + 4H2O
6. Membuat jumlah elektron yang diterima sama dengan jumlah elektron yang dibebaskan.
(2Cl- → C12 + 2e) x5
(5e + 8H+ + MnO4 → Mn2+ + 4H2O) x2
7. Menjumlahkan kedua ½-reaksi.
10Cl- + 16H+ + 2MnO4- → 5Cl2 + 2Mn2+ + 8H2O
8. Menghilangkan zat yang sama di sebalah kiri dan kanan reaksi. 10Cl- + l6H+ + 2MnO4- → 5Cl2 + 2Mn2+ + 8H2O
Contoh 3:
Tahap 6,7: 14H+ + Cr2O72- + 3H2S → 2Cr3+ + 7H2O + 3S + 6H+ Tahap 8: 8H+ + Cr2O72- + 3H2S → Cr3+ + 3S + 7H2O
2.5 Reaksi Redoks dalam Larutan Basa
Pada reaksi yang terjadi dalam suasana asam maka untuk menyetimbangkan reaksi digunakan H2O dan H+. Pada suasana basa digunakan H2O dan OH-. Selain cara ini, cara paling sederhana adalah dengan menghilangkan H+ pada persamaan reaksi setimbang dalam suasana asam dengan penambahan OH . Contohnya,
menyetimbangkan ½-reaksi yang terjadi dalam suasana basa, Pb → PbO
Hasil penyetimbangan dalam suasana asam adalah, H2O + Pb → PbO + 2H+ + 2e
Untuk mengkonversi ke suasana basa maka dilakukan dengan langkah-langkah sebagai berikut:
1. Mengeliminasi H+ dengan penambahan 0H-. H2O + Pb +2OH- → PbO+ 2H+ + 2OH- +2e
2. Menggabungkan H+ dengan OH- membentuk H2O. H2O + Pb + 2OH- → PbO + 2H2O +2e
3. Menghilangkan H2O dari kedua sisi persamaan reaksi. Pb + 2OH- → PbO + H2O + 2e
Contoh 4:
Setimbangkan reaksi berikut dalam suasana basa. Pb(OH)3- + OCl- → PbO2 + Cl- (basa). Tahap 5: Penambahan OH pada kedua sisi reaksi.
H+ + OH- + OCl- + Pb(OH)3- → Cl- +2H2O+PbO2+OH-Tahap 6: H2O + OCl- +Pb(OH)3- → Cl- +2H2O+PbO2+OH-Tahap 7: OCl- + Pb(OH)3- → Cl- + H2O + PbO2 +
OH-2.6 Beberapa Zat Pengoksidasi dan Pereduksi
Di laboratorium, sering diperlukan zat untuk mengoksidasi atau mereduksi bahan kimia yang digunakan pada percobaan. Untuk tujuan ini terdapat bebarapa zat pengoksidasi dan pereduksi yang dapat digunakan, tetapi perlu dipilih yang paling mudah digunakan. Contohnya, klorin, Cl2, adalah zat pengoksidasi yang sangat kuat tetapi tidak dapat digunakan di laboratorium terbuka karena sifat gasnya membuatnya bersifat racun. Jadi bila manggunakan Cl2 diperlukan perhatian khusus pada sifat gasnya. Oleh karena pekerjaan ini tidak mudah, maka dihindari penggunaan gas Cl2.
Terdapat 3 zat pengoksidasi yang biasa digunakan di laboratorium, yaitu: 1. Ion permanganat, MnO4-.
3. Ion bikromat, Cr2O72-.
Ketiga jenis pengoksidasi ion ini paling banyak digunakan karena penanganannya yang mudah. Garam ketiga ion ini harus ditangani atau disimpan dengan hati-hati karena sifat mengoksidasinya. Selain itu, ketiga ion- ini adalah pengoksidasi yang sangat efektif menghasilkan oksigen sehingga jangan dibiarkan melakukan kontak dengan bahan-bahan Organik karena sangat potensial menghasilkan api.
• Ion permanganat, MnO4-.
Di dalam larutan warnanya adalah ungu. Umumnya ion permanganat terdapat sebagai garam kalium, KMnO4, yang berwarna hitam keunguan. Pada larutan asam kuat mengalami reduksi dengan reaksi,
8H+(aq) + MnO4-(aq) + 5e → Mn2+(aq) + 4H2O
Pada reaksi ini terjadi perubahan warna yang drastis. Pada larutan netral atau sedikit basa terjadi reaksi,
2H2O + MnO4-(aq) + 3e → MnO2(s) + 4OH-(aq)
• Ion kromat, CrO42-, dan bikromat, Cr2O72-.
Di laboratorium, biasanya ditemukan sebagai garam kalium dan natrium. Pada suasana asam, larutan ion kromat yang berwarna kuning berubah menjadi bikromat yang berwarna merah jingga. Reaksinya adalah,
2CrO42-(aq) + 2H+(aq) → Cr2O72-(aq) + H2O
Pada larutan yang mengandung ion bikromat, dalam suasana basa, terjadi reaksi sebaliknya, yaitu:
Cr2O72-(aq) + 2OH-(aq) → 2CrO42-(aq) + H2O
Pada suasana apapun, baik asam atau basa, bila ion bikromat bekerja sebagai zat pengoksidasi maka akan berubah menjadi krom dengan bilangan oksidasi +3. Tetapi rumus kimia senyawa krom yang terjadi tergantung pada suasana larutan. Pada larutan asam terjadi reaksi,
6e + 14H+(aq) + Cr2O72-(aq) → 2Cr3+(aq) + 7H2O Pada larutan sedikit basa terjadi reaksi,
3e + 2H2O + CrO42-(aq) → Cr(OH)3(s) + 5OH-(aq) Pada larutan sangat basa terjadi reaksi,
3e + 2H2O + CrO42-(aq) → CrO2¬-(aq) + 4OH-(aq)
Zat pereduksi yang dapat digunakan di laboratorium adalah: 1. Logam, misalnya Mg atau Zn.
2. Ion sulfit dan bisulfit, SO32- dan HSO3-. 3. Ion tiosulfat,
S2O32-Dari ketiga pereduksi ini yang paling banyak digunakan sebagai pereduksi adalah (2) dan (3). Kekurangan logam bila digunakan sebagai pereduksi adalah bahwa karena reaksi terjadi pada permukaan maka reaksinya sukar dikontrol, Bila reaksi redoks dilakukan dalam larutan maka digunakan zat pereduksi yang larut dalam air. Jadi, dari ketiga zat pereduksi di atas yang dapat digunakan adalah (2) dan (3).
Anion sulfit dan bisulfit diperoleh dari netralisasi (sempurna atau sebagian) asam sulfit, H2SO3. Jika larutan adalah basa maka ion bisulfit berubah menjadi ion sulfit sehingga pereaksinya adalah ion sulfit. Atau sebaliknya, jika larutan adalah asam maka pereaksi adalah ion bisulfit atau bahkan H2SO3. Reaksi oksidasi ion bisulfit dalam suasana asam adalah,
Oksidasi SO32- dalam suasana basa terjadi lebih mudah, SO32-(aq) + 2OH-(aq) → SO42-(aq) + H2O + 2e
Soal-Soal
1. Sebutkan 2 definisi terbaru dari oksidasi dan reduksi. Definisi mana yang lebih disukai?
2. Je1askan perbedaan antara bilangan oksidasi dan muatan sebenarnya.
3. Je1askan kenapa reaksi antara kalsium dan oksigen adalah reaksi redoks.
4. Apa yang terjadi pada zat pengoksidasi pada reaksi redoks.
5. Sebutkan bilangan oksidasi untuk setiap atom dalam molekul berikut: (a) KC1O2 (d) O2F2 (g) O3 (j) CBr4
(b) BaMnO4 (e) IF5 (h) Hg2C12 (k) OCl-(c) Fe2O4 (f) HOC1 (i) OF2 (l) N2O4
6. Untuk setiap reaksi berikut, tunjukkan: (1) Zat yang teroksidasi (3) zat pengoksidasi (2) Zat yang tereduksi (4) Zat pereduksi Reaksi-reaksinya adalah ;
(a) 2HNO3 + 3H3AsO3 → 2NO + 3H3AsO4 + H2O (b) NaIO3 + 5NaI + 6HC1 → 6NaC1 + 3I2 + 3H2O
7. Setimbangkan persamaan reaksi berikut dengan metoda ion-e1ektron. Semua reaksi terjadi dalam suasana asam.
8. Setimbangkan persamaan reaksi berikut dengan metoda ion-elektron. Semua reaksi terjadi dalam suasana basa.
(a) CN- + AsO43- → AsO2- + CNO-(b) CrO2- + HO2- → CrO42- + OH-(c) Zn + NO3- → Zn(OH)42- + NH3
(d) N2H4 + Mn(OH)3 → Mn(OH)2 + NH2OH
9. Klorin, C12, adalah zat pengoksidasi kuat, tetapi jarang digunakan di 1aboratorium. Kenapa?
10. Tuliskan persamaan reaksi ionik setimbang untuk reaksi antara natrium sulfit dan natrium kromat dalam suasana asam.
11. Tuliskan persamaan reaksi ionik setimbang untuk reaksi Na2SO3 dan KMnO4 dalam suasana asam.
Rumus kimia menyatakan jenis dan jumlah atom dengan komposisi
tertentu dari suatu zat. Rumus kimia terdiri dari lambang unsur dan
nomor indeks.
Contoh :
Rumus kimia dibedakan menjadi :
1. Lambang Unsur
Rumus kimia unsur dinyatakan dengan lambang unsur. Contoh : Karbon =
C, Hidrogen = H, Oksigen = O, dll.
2. Rumus Kimia Senyawa, terdiri dari :
a. Rumus Molekul
Molekul adalah partikel penyusun senyawa. Rumus molekul merupakan
rumus yang menyatakan jenis dan jumlah atom yang membentuk suatu
molekul senyawa tersebut.
Rumus molekul terdiri dari :
Rumus Molekul Unsur, menyatakan gabungan atom-atom yang sama
yang membentuk molekul. Contoh : O2, O3, H2, P4, S8.
Rumus Molekul Senyawa, menyatakan gabungan dari beberapa atom
yang berbeda. Contoh : CO2, H2O, NH3, HCl, dll.
b. Rumus Empiris
Rumus empiris menyatakan perbandingan paling sederhana dari jumlah
atom penyusun suatu molekul.
Air
H
2O
H
2O
Asam Cuka
CH
3COOH
CH
2O
Glukosa
C
6H
12O
6CH
2O
B. TATA NAMA SENYAWA
I. TATA NAMA SENYAWA ANORGANIK
1. Tata Nama Senyawa Biner
Senyawa biner adalah senyawa yang tersusun atas dua jenis atom.
Berdasarkan jenis ikatannya, senyawa biner dapat dikelompokkan
menjadi :
a. Senyawa Biner Ionik,
terdiri atas suatu kation (ion logam) dan
suatu anion (ion non logam).
Nama kation logam + ( anion non logam +
-ida / -ide )
Contoh : NaCl ( Natrium klor
ida
/ Sodium chlor
ide
)
PbCl
2( Timbal[II] klor
ida
/ Lead[II] chlor
ide
)
PbCl
4( Timbal[IV] klor
ida
/ Lead[IV] chlor
ide
)
Untuk kation logam yang memiliki muatan lebih dari satu, muatannya
ditulis dengan angka romawi dalam tanda kurung.
Daftar nama beberapa ion, baik kation maupun anion :
Kation Logam
Anion Non Logam
Kation
Nama
Anion
Nama
Li
+ LitiumH
- Hidrida / HidrideK
+ Kalium / PotassiumO
2- Oksida / OxideMg
2+ MagnesiumP
3- Fosfida / PhosphideCa
2+ KalsiumS
2- Sulfida / SulfideBa
2+ BariumSe
2- Selenida / SelenideAl
3+ AluminiumF
- Fluorida / FluorideZn
2+ Seng / ZincCl
- Klorida / ChlorideAg
+ Perak / SilverBr
- Bromida / BromideNi
2+ NikelI
- Iodida / IodideSn
2+ Timah (II) / Tin (II)Si
4- Silikida / SilicideSn
4+ Timah (IV) / Tin (IV)As
3- Aresenida / ArsenidePb
2+ Timbel (II) / Lead (II)Te
2- Tellurida / TelluridePb
4+ Timbel (IV) / Lead (IV)Fe
2+ Besi (II) / Iron (II)Fe
3+ Besi (III) / Iron (III)Cu
+ Tembaga (I) / Copper (I)Cu
2+ Tembaga (II) / Copper (II)Hg
+ Raksa (I) / Mercury (I)Hg
2+ Raksa (II) / Mercury (II)Pt
2+ Platina (II) / Platinum (II)Pt
4+ Platina (IV) / Platinum (IV)Au
+ Emas ( I) / Gold (I)Au
3+ Emas ( III) / Gold (III)b. Senyawa Biner Kovalen
Aturan penamaan senyawa kovalen adalah sebagai berikut :
Penulisan unsur pertama pada senyawa kovalen mengikuti urutan
B – Si – C – Sb – As – P – N – H – S – I – Br – Cl – O – F
Contoh : Air, H
2O
bukan
OH
2, Amonia, NH
3 bukanH
3N
( Nama Yunani jumlah atom unsur ke-1 ) ( nama unsur ke-1 ) +
( nama Yunani jumlah unsur ke-2 ) ( nama unsur
ke-2 + ida/ide ).
Nama jumlah atom dalam bahasa Yunani :
1 =
mono
, 2 =
di
, 3 =
tri
, 4 =
tetra
, 5 =
penta
, 6 =
heksa
, 7 =
hepta
,
8 =
okta
, 9 =
nona
, 10 =
deka
.
Ket :
Jika jumlah atom unsur ke-1 hanya 1, tidak perlu ditambahkan
awalan mono.
Contoh : NO
2( Nitrogen Dioksida / Nitrogen Dioxide )
P
2O
5 ( Difosfor pentaoksida / Diphosphor pentaoxide)2. Tata Nama Senyawa Poliatomik
Senyawa poliatom dibentuk oleh dua atom atau lebih yang berbeda.
Nama kation + Nama anion
Daftar ion poliatomik :
Ion Poliatomik
Nama Ion Poliatomik
NH
4+Amonium
OH
- Hidroksida/HidroxideCO
32-Karbonat/Carbonate
CH
3COO
-Asetat/Acetate
CN
-OCN
-SCN
- Sianida/CyanideSianat/CyanateTiosianat/ThiocyanateC
2O
42-Oksalat/Oxalate
BrO
-BrO
3-BrO
4-Hipobromit/HypobromiteBromat/BromatePerbromat/Perbromate
IO
3-NH
4NO
3: Amonium nitrat (Senyawa dengan kation poliatomik dan anion
poliatomik)
3. Tata Nama Senyawa Terner
Senyawa terner sederhana meliputi asam, basa, dan garam. Reaksi asam
dengan basa menghasilkan garam.
a. Tata Nama Senyawa Asam
Asam adalah senyawa yang melepaskan ion H
+dalam air. Senyawa asam
terdiri atas :
Asam + (Nama atom non logam +
ida
)
(Hydro)Nama atom non logam(+
ic
) + acid
Contoh : HF ( Asam Fluorida / Hydrofuoric acid )
Molekul Poliatomik ( atom hydrogen dengan anion poliatomik )
Asam + Nama anion poliatomik
Nama anion poliatomik
*+ acid
*
jika ion poliatomik mengandung atom O, ganti akhiran
–ate
dengan
-ic
dan akhiran
–
ite
diganti dengan
–ous
Contoh : H
3PO
4(Asam fosfat / Phosphoric acid)
H
3PO
3( Asam fosfit / Phosphorous acid)
b. Tata Nama Senyawa Basa
Kation logam + hidroksida
Basa adalah zat yang dalam air menghasilkan ion OH
-.
Kation logam + hydroxide
Contoh : KOH ( Kalium hidroksida / Potassium hydroxide)
Mg(OH)
2( Magnesium hidroksida / Magnesium hydroxide)
4. Tata Nama Senyawa Hidrat
Nama senyawa + nama yunani jumlah hidrat
Senyawa hidrat adalah senyawa yang mengandung air kristal ( H
2O ).
Contoh : CuSO
4 .5H
2O
Senyawa organik adalah senyawa-senyawa karbon dengan sifat-sifat
tertentu. Senyawa organic memiliki tata nama khusus. Selain nama
sistematis, banyak senyawa organic mempunya nama dagang (nama
trivial). Beberapa diantaranya adalah :
1. CH4 : Metana (gas alam)
2. CO(NH2)2 : Urea
3. CH3COOH : Asam cuka (asam asetat)
4. C6H12O6 : Glukosa (gula darah, gula anggur)
5. C12H22O11 : Sukrosa (gula tebu)
6. HCHO : Formaldehida (bahan formalin)
7. CHCl3 : Kloroform (bahan pembius)
8. CHI3 : Iodoform (suatu antiseptic)
9. CH3CH2OH : Etanol (alkohol)
10. CH3COCH3 : Aseton (pembersih kuteks)
C. PERSAMAAN REAKSI KIMIA
1) Pengertian
Reaksi kimia mengubah zat-zat asal (pereaksi = reaktan) menjadi zat-zat
baru (produk). Misalnya reaksi gas hidrogen dengan gas oksigen
membentuk air. Suatu reaksi kimia dinyatakan dengan menuliskan zat-zat
yang terlibat dalam reaksi yang menggunakan pemaparan rumus-rumus
kimia dalam bentuk
persamaan reaksi
.
Contoh:
Dengan keterangan:
Tanda panah : arah reaksi dibaca ‘
membentuk’
Huruf
g
berarti gas,
l
(
liquid
) berarti cairan,
s
(
solid
) berarti padatan
dan
aq
(
aques
) berarti larutan dalam air.
Koefisien reaksi : bilangan yang mendahului rumus kimia zat
dalam persamaan reaksi. Menyatakan perbandingan parikel zat yang
terlibat dalam reaksi.
Persamaan reaksi yang sudah diberi koefisien yang sesuai disebut
‘
persamaan setara’
.
Dalam suatu reaksi, terjadi perubahan komposisi atom-atom penyusun
zat. Berdasarkan hukum kekelan massa (jumlah zat sebelum dan sesudah
reaksi adalah sama), maka dilakukan penyetaraan reaksi untuk
memenuhi hukum kekekalan massa.
2) Menuliskan Persamaan Reaksi
Penulisan persamaan reaksi dapat dilakukan dalam tiga langkah:
1. Menuliskan persamaan kata-kata yang terdiri dari nama dan keadaan zat
pereaksi serta nama dan keadaan zat hasil reaksi
2. Menuliskan persamaan rumus kimia zat pereaksi dan zat hasil reaksi,
lengkap dengan wujud/keadaannya
3. Menyetarakan yaitu memberi koefisien yang sesuai sehingga jumlah atom
setiap unsur sama pada kedua ruas
Contoh:
Tulis persamaan reaksi setara dari pembakaran gas metana (CH
4) dengan
gas oksigen (O
2) yang membentuk gas karbon dioksida (CO
2) dan uap air
(H
2O)
Jawab:
Langkah 1 :
menuliskan persamaan kata-kata
Langkah 3: penyetaraan
3) Penyetaraan Persamaan Reaksi
Pada reaksi kimia atom-atom mengalami penataan ulang, tetapi jenis dan
jumlah atom sebelum dan sesudah reaksi adalah sama. Untuk
menyamakan jenis dan jumlah atom tersebut maka reaksi perlu
disetarakan yaitu dengan memberi koefisien yang tepat. Banyak
dilakukan dengan cara menebak, sebagai pemulaan dengan langkah:
1. Tetapkan koefisien salah satu zat yang paling rumit, sama dengan 1
sedangkan zat lain diberi koefisien sementara dengan huruf
2. Setarakan terlebih dahulu unsur yang terkait langsung dengan zat yang
telah diberi koefisien 1 tadi.
3. Setarakan unsur lainnya.
Contoh:
Tuliskan persamaan reaksi yang setara untuk reaksi berikut ini!
Jawab:
Langkah 1: persamaan reaksi tersebut
Langkah 2: Penyetaraan
1. Tetapkan koefisien NaOH = 1 sedangkan yang lain dengan huruf
2. Setarakan jumlah atom sejenis pada ruas kanan dan ruas kiri
Na : 1 = b + c (1)
H : 1 = 2d (3)
Cl : 2a = b + c (4)
Dengan menggunakan model subtitusi dan eliminasi maka dapat
diperoleh dengan bilangan bulat: a = 3, b = 5, c = 1, d = 3. Persamaan
reaksinya menjadi:
Dapat juga dilihat pada
Tata Nama
Cara memberi
nama zat kimia
Minggu, 17 Maret 2013TATA NAMA SENYAWA KIMIA
TATA NAMA SENYAWA KIMIA
A.
Kompetensi Dasar
B.
Indikator
1. Menuliskan nama-nama senyawa oksida asam, oksida basa, asam, basa dan garam dari senyawa anorganik
2. Menuliskan nama senyawa organik paling sederhana yang mengandung atom C, H, benzena dan atom/gugus atom lainnya
Para ahli kimia memberikan nama zat berdasarkan nama orang, nama tempat, sifat zat dan lainnya. Seiring dengan perkembangan ilmu kimia, semakin banyak zat berupa senyawa anorganik dan organik yang ditemukan maupun yang disintesis. Oleh karena itu, pemberian nama diatas menjadi sulit. Jadi, diperlukan suatu tata nama senyawa. Untuk dapat menuliskan tata nama senyawa, dibutuhkan pengetahuan tentang rumus kimia dari senyawa dan bilangan oksidasi.
Jadi, pembahasan ini akan diawali dengan rumus kimia dan bilangan oksidasi. Setelah itu, kita akan menyimak tata nama senyawa anorganik. Untuk tata nama senyawa organikakan dibahas pada pertemuan lain.
A.
Rumus Kimia dan Bilangan Oksidasi
1. Rumus Kimia
Untuk menulis dan mengenal rumus kimia, harus menguasai lambang unsur. Rumus kimia menyatakan jenis dan jumlah atom dengan komposisi tertentu untuk setiap molekul. Rumus kimia sangat penting dalam mempelajari ilmu kimia karena pengertian yang utuh mengenai zat diawali dari rumus kimia. Rumus kimia suatu zat dapat berupa rumus molekul atau rumus empiris.
a. Rumus Kimia Unsur
Rumus kimia unsur terdiri atas satu atom (monoatomik) sama dengan lambing atom unsur tersebut. Kebanyakan unsur monoatomik adalah logam. Beberapa zat lain, seperti gas mulia, juga berbentuk monoatomik. Perhatikan table berikut!
Nama Unsur Rumus Kimia
Karbon C
Aluminium Al
Besi Fe
Seng Zn
b. Rumus Molekul
Rumus molekul menyatakan jenis dan perbandingan atom-atom unsur dalam molekul unsur atau senyawa.
Rumus molekul digolongkan menjadi dua, yaitu rumus molekul unsur dan rumus molekul senyawa.
1). Rumus Molekul Unsur
a). Molekul diatomik adalah molekul yang terbentuk dari dua atom yang sama. Jumlah atom tersebut dinyatakan dengan angka indeks. Angka indeks ditulis sebagai subskrip (di bawah) setelah lambang unsur. Indeks 1 pada unsur monoatomik tidak perlu dituliskan. Beberapa contoh rumus molekul diatomik dalah sebagai berikut.
Nama MolekulRumus
Oksigen O2
Hidrogen H2
Nitrogen N2
b). Molekul poliatomik yaitu tiga atom yang sama atau lebih bergabung membentuk sebuah molekul. Ozon merupakan salah satu molekul poliatomik.
2). Rumus Molekul Senyawa
Rumus molekul senyawa (rumus molekul) menyatakan rumus senyawa yang tersusun atas dua atom atau lebih yang berbeda yang membentuk molekul.
Tabel. Rumus Molekul Beberapa Senyawa Kimia
Senyaw
a
Rumus Molekul Jumlah Atom
Air H2O 3 atom (2 atom H dan 1
atom O) Karbon
dioksida
CO2 3 atom (1 atom C dan 2
atom O)
c. Rumus Empiris
Rumus empiris atau rumus perbandingan menyatakan jenis dan perbandingan paling sederhana dari atom-atom unsur dalam senyawa.
1). Rumus empiris senyawa molekul
Nama Senyawa
Rumus Molekul Rumus Empiris
Air H2O H2O
2). Rumus empiris senyawa ion
Rumus kimia senyawa ion merupakan rumus empiris. Aturan penulisan empirisnya adalah:
Ion positif (kation) ditulis terlebih dahulu diikuti ion negatif (anion).
Beri angka indeks pada kation dan anion sehingga total muatan kation sama dengan total muatan anion (senyawa bersifat netral).
Perbandingan angka indeks dalam rumus empiris harus merupakan bilangan bulat terkecil. Tabel. Beberapa contoh penulisan rumus empiris
Senyawa
Bilangan oksidasi atau tingkat oksidasi adalah nilai muatan atom dalam pembentukan suatu molekul atau ion. Muatan tersebut dapat berharga positif atau negatif. Bilangan oksidasi lazim disingkat biloks (b.o). Beberapa atom hanya memiliki 1 bilangan oksidasi, ada juga atom yang memiliki lebih dari 1 bilangan oksidasi.
Berikut ini ketentuan-ketentuan umum dalam penetapan bilangan oksidasi.
adalah2
Al adalah 3
Atom H 1 Kecuali dalam hibrida
logam (BaH2, AlH3, NaH)
= 1
Atom O 2 Kecuali jika berikatan
dengan atomF, atau dalam peroksida dansup eroksida.
Biloks atom O adalah -1
dalam H2O2
Biloks atom OF2
adalah 2 dalam
Senyawa superoksida
(seperti KO2 ), biloks atom
O bernilai -
Seluruh atom dalam ion
Sesuai muatan ion
Biloks Na= 1
MnO -4 = 1
Dari tabel di atas dapat dijelaskan sebagai berikut:
Bilangan oksidasi atom dalam unsur = nol Contoh:
Bilangan oksidasi Al dan Cu adalah nol
Jumlah bilangan oksidasi seluruh atom dalam senyawa = nol Contoh:
Jumlah bilangan oksidasi seluruh atom dalam ion = muatan ion Contoh:
Biloks Na= 1
MnO
-4= 1
Cara Mencari Bilangan Oksidasi
Contoh:
1. Tentukan bilangan oksidasi N dalam NH4Cl!
Penyelesaian:
Biloks H = 4 (1) = 4
Biloks Cl = 1
Agar jumlah biloks = nol, biloks N = 3
2. Tentukan bilangan oksidasi S dalam Na2S2O7!
Penyelesaian:
Muatan Na2S2O7 = (2 b.o Na) (2 b.o S) (7 b.o O)
0 = 2 (1) 2 (x) 7 (-2)
0 = 2 2x 14
x = 6
Jadi, bilangan oksidasi atom S dalam senyawa Na2S2O7 = 6
Cara mencari bilangan oksidasi atom dalam senyawa sebagai berikut:
Hitung jumlah atom (yang sama)
dalam senyawa
B.
Tata Nama Senyawa
Tata nama senyawa yang digunakan sekarang adalah tata nama IUPAC yang didasarkan atas rumus kimia senyawa. Di sini akan menyimak tata nama senyawa anorganik sederhana.
Tata Nama Senyawa Anorganik
Pembahasan tata nama anorganik dapat dikelompokkan menjadi:
- Senyawa oksida asam
- Senyawa oksida basa
- Senyawa asam
- Senyawa basa
- Senyawa garam
a. Tata nama oksida asam
Suatu unsure non logam jika direaksikan dengan oksigen, akan menghasilkan oksida nonlogam. Jika oksida nonlogam direaksikan dengan air, dapat terbentuk senyawa yang disebut asam, sehingga oksida nonlogam disebut juga oksida asam.
Catatan: jika awalan memiliki huruf terakhir ‘a’ atau ‘o’ dan unsur memiliki huruf awal ‘a’ atau ‘o’, maka kita menghilangkan huruf terakhir awalan yang digunakan. Misalnya karbon monoksida bukan karbon monooksida, demikian pula pada dinitrogen tetroksida bukan dinitrogen tetraoksida, kecuali untuk PI3 fosfor triiodida, bukan fosfor triodida.
Unsur non logam yang mempunyai lebih dari 1 macam bilangan oksidasi diberi nama
berdasarkan sistem stock, yaitu dengan membubuhkan angka romawi yang sesuai dengan bilangan oksodasi non logam.
Contoh Tata nama senyawa oksida asam
Rumus Kimia
Nama
Menggunakan Awalan
Sistem Stock
CO Karbon monoksida Karbon(II) oksida
SO3 Belerang trioksida Belerang(VI) oksida
PCl3 Fosfor triklorida Fosfor(III) klorida
N2O3 Dinitrogen trioksida Nitrogen(III) oksida
b. Tata nama oksida basa
Suatu unsur logam jika bereaksi dengan oksigen akan menghasilkan oksida logam. Jika oksida logam direaksikan dengan air, dapat terbentuk senyawa yang disebut basa, sehingga oksida logam disebut juga oksida basa. Unsur-unsur logam yang mempunyai lebih dari 1 macam bilangan oksidasi diberi nama berdasarkan sistem stock. Dalam sistem stock, bilangan oksidasi dari unsur logam ditunjukkan dengan angka romawi diantara tanda kurung tepat di belakang nama logam.Beberapa contoh senyawa dan namanya menurut sistem stock, yaitu
Rumus Oksida Basa
Sistem Stock
Cu2O Tembaga(I) oksida
CuO Tembaga(II) oksida
MnO Mangan(II) oksida
Mn2O3 Mangan(III) oksida
c. Tata nama asam
Menurut Arhenius asam adalah zat-zat yang jika dilarutkan didalam air dapat terionisasi menghasilkan ion hydrogen (H). Jumlah ion H yang dapat dibebaskan oleh suatu asam disebut valensi asam. Asam dapat dibedakan dalam 3 kategori sesuai dengan valensi asamnya, yaitu: (1) asam bervalensi satu (monoprotik), misalnya HCl, HBr, HNO3; (2) asam bervalensi dua(diprotik), misalnya H2SO4, H2CO3 dan H2CrO4; (3) asam bervalensi tiga (triprotik), misalnya H3PO4,
H3AsO3 dan H3SbO4.
Asam padat terbentuk dari unsure-unsur hydrogen, non logam dan oksigen. Berdasarkan ada tidaknya oksigen sebagai unsure penyusunnya, asam dapat dibagi menjadi asam biner (asam yang tidak mengandung oksigen) dengan rumus HnXm dan asam oksi (asam yang mengandung oksigen) dengan rumus HnXOm. Nama asam oksi yang memiliki 1 atom oksigen lebih sedikit daripada asam oksi diatas, terdiri atas kata asam ditambah nama unsure non logam dengan akhiran –it. Misalnya, HNO3 mempunyai nama asam nitrit dan H2SO3 mempunyai nama asam sulfit.
Beberapa contoh tata nama asam biner dan asam oksi yang diberikan dalam tabel.
Contoh Tata nama asam biner
Asam biner Nama
HF Asam fuorida
HCl Asam klorida
H2S Asam sulfida
HCN Asam sianida
Contoh Tata nama asam oksi
Asam oksi Nama
HNO3 Asam nitrat
HClO3 Asam klorat
H2CO3 Asam karbonat
d. Tata nama Basa
Menurut Arhenius basa adalah zat-zat yang jika dilarutkan didalam air dapat terionisasi
menghasilkan ion hidroksida (OH). Suatu basa terdiri dari atom logam dan atau lebih gugus hidroksil yang banyaknya sesuai dengan valensi logam yang bersangkutan. Di samping asam yang
mengandung atom logam, dikenal juga sebuah basa yang tidak berisi atom logam, misalnya ammonium hidroksida (NH4OH). Berdasarkan jumlah gugus hidroksil yang ada, basa dibagi dalam tiga macam yaitu: 1) basa bervalensi satu, misalnya NaOH, KOH, NH4OH; (2) basa bervalensi dua, misalnya Ca(OH)2, Ba(OH)2 dan Zn(OH)2; (3) basa bervalensi tiga, misalnya Fe(OH)3, Al(OH)3 dan Cr(OH)3. Tata nama basa terdiri dari nama atom logam ditambah hidroksida.
Contoh Tata nama basa
Rumus Basa Nama Basa
NaOH Natrium hidroksida
Ca(OH)2 Kalsium hidroksida
Fe(OH)3 Besi(III) hidroksida
e. Tata nama Garam
Garam adalah senyawa yang terbentuk dari gabungan ion logam dan ion sisa asam.
Ada 2 macam tata nama senyawa garam yaitu sistem lama dan sistem stock.
Pemberian nama untuk sistem stock, yaitu
Contoh Tata nama garam menurut sistem lama dan sistem stock
Rumus Garam
Sistem Lama Sistem Stock
KCl Kalium klorida Kalium klorida
FeCl2 Fero klorida Besi(II) klorida
Persamaan Reaksi
adalah persamaan yang menunjukkan zat-zat kimia terlibat dalam reaksi kimia.Hal ini dinyatakan oleh:
i. Rumus kimia zat-zat
ii. Koefisien reaksi
iii. Wujud/keadaan zat-zat
Untuk jelasnya, simak penulisan persamaan reaksi dari gas hydrogen (H2) dengan gas oksigen (O2) yang mengahsilkan uap air (H2O).
Koefisien reaksi
Jika harganya 1,
Tidak perlu ditulis
Produk reaksi, yakni
zat kimia sesudah reaksi
Pereaksi, yakni zat kimia sebelum reaksi
Tanda panah, artinya
‘bereaksi menjadi’
Rumus kimia zat-zat
Zat-zat yang terlibat dalam reaksi kimia dinyatakan oleh rumus kimianya. Zat yang berada di sebelah kiri tanda panah disebut pereaksi (reaktan), sedangkan zat yang berda di sebelah kanan tanda panah disebut produk reaksi (hasil reaksi).
Koefisien reaksi
Koefisien reaksi menyatakan jumlah partikel dari setiap pereaksi dan produk reaksi. Pada contoh diatas, 2 molekul H2 bereaksi dengan 1 molekul O2 menghasilkan 2 molekul H2O .Perhatikan! Koefisien reaksi 1 umumnya tidak ditulis.
Koefisien reaksi diberikan agar persamaan reaksi sesuai dengan Hukum Kekekalan Massa dari Lavoisier, yang menyatakan bahwa jumlah massa sebelum reaksi sama dengan
jumlah massa sesudah reaksi.
Jika kondisi ini dipenuhi, maka persamaan reaksi dikatakan telah setara.
Wujud/keadaan zatDalam persamaan reaksi, wujud/keadaan zat dapat disertakan. Ada 4 wujud/keadaan zat yang ditulis sebagai subskrip (huruf kecil setelah rumus kimia).
Tabel. Penulisan wujud/keadaan zat dalam persamaan reaksi
Wujud/keadaan Subskrip
Padat atau solid s
Cair atau liquid l
Larut dalam air atau aqueous
aq
Misalnya larutan asam klorida (HCl) ditambahkan pada larutan Natrium karbonat (Na2CO3). Produk yang dihasilkan adalah garam Natrium klorida (NaCl) dan gas Karbon dioksida (CO2) serta air (H2O). persamaan reaksinya yang setimbang adalah:
Langkah 1. Tulislah persamaan reaksi yang belum setimbang dan perhatikan rumus kimia reaktan dan produk harus benar.
HCl + Na2CO3 → NaCl + CO2 + H2O
Langkah 2. Berilah koefisien 2 di depan NaCl.
HCl + Na2CO3 → 2NaCl + CO2 + H2O
Setarakan untuk HCl dengan koefisien 2.
2HCl + Na2CO3 → 2NaCl + CO2 + H2O
Langkah 3. Tuliskan wujud zat pereaksi dan hasil reaksinya.
2HCl(aq) + Na2CO3(s) → NaCl(aq) + CO2(g) + H2O(l)
Ketika menyelesaikan langkah 2, yaitu pada penyetaraan koefisien reaksi suatu persamaan reaksi kimia, terkadang tidak terlalu mudah untuk dilakukan. Secara umum untuk tahapan ini, kita dapat menggunakan persamaan substitusi dan eliminasi. Misalnya untuk reaksi berikut.
Sn + HNO3 → SnO2 + NO2 + H2O
Langkah 2 dapat kita lakukan dengan membuat simbol huruf untuk mewakili koefisien
masing-masing zat.
aSn + bHNO3 → cSnO2 + dNO2 + eH2O
jumlah atom Sn : a = c .……….(1)
H : b = 2e ………..(2)
N : b = d ..………(3)
O : 3b = 2c + 2d + e ………..(4)
Misalkan b = 1
dari persamaan (3) diperoleh d
dari persamaan (2) diperoleh e
e = ½
dari persamaan (4) diperoleh c
3(1) = 2c + 2(1) + ½
c = ¼
dari persamaan (1) diperoleh a
a = ¼
reaksinya menjadi
¼ Sn + HNO3 → ¼ SnO2 + NO2 + ½ H2O
agar menjadi bulat, maka kedua ruas dikalikan 4, sehingga reaksinya menjadi
Sn + 4HNO3 → SnO2 + 4NO2 + 2H2O
Reaksi kimia yang rumit memerlukan langkah-langkah tertentu dalam penyetaraannya.Diskusikan penyetaraan reaksi-reaksi berikut dengan teman-teman Anda.
Daftar Rujukan
Effendy. 2006. A-Level Chemistry for Senior High School Students, Volume 1A. Malang: Bayumedia.
Purba, M., Hidayat, Soetopo. 2003. Kimia 200 untuk SMU Kelas 1 Jilid 1A. Jakarta: Erlangga
Romadlon, M., Budi W., Yani S. 2004. Kimia 1A Kelas X Semester 1. Jawa Timur: PT. Wahana Dinamika Karya
Santosa, J., Sri S., Deni P. 2004. Kimia untuk kelas X Jilid 1A. Yogyakarta: PT. Intan Pariwara
Sutresna, Nana dan Sholehudin, Dindin. 2006. Kimia untuk SMA Kelas 1 (Kelas X) Semester 1, Jilid 1A. Bandung: Grafindo Media Pratama.
Johari dan Rachmawati. 2004. Kimia SMA untuk Kelas X, Jilid 1. Jakarta: Esis.
Lestari, Sri. 2003. Kumpulan Rumus Kimia SMU. Jakarta: Kawan Pustaka.
Tamal dan Jamal, Abdul. Tanpa tahun. Rahasia Penerapan Rumus-rumus Kimia. Tanpa kota: Gita Media Press.
Diposkan oleh supri supriadi di 02.10
Kirimkan Ini lewat EmailBlogThis!Berbagi ke TwitterBerbagi ke Facebook
Poskan Komentar
Posting Lebih Baru Beranda
Langganan: Poskan Komentar (Atom)
Arsip Blog
▼ 2013 (2)
o ▼ Maret (2)
TATA NAMA SENYAWA KIMIA
Mengenai Saya
supri supriadi
Lihat profil lengkapku