III. HASIL DAN PEMBAHASAN
3.1 Hasil
3.1.1 Disosiasi Sel Testikular Ikan Gurame
Berdasarkan kriteria ukuran sel spermatogonia ikan gurame (5-15 µm) menurut Mauluddin (2009), jumlah dan persentase sel spermatogonia hasil disosiasi sel testikular (Gambar 7) ikan gurame pada penelitian ini memperlihatkan hasil yang berbeda antar individu (Tabel 1). Jumlah spermatogonia pada donor 1 sebanyak 6.300.000 sel (4,45%) sedangkan pada donor 2 sebanyak 4.000.000 sel (14,98%). Hal ini juga berpengaruh terhadap persentase spermatogonia pada setiap donor yaitu donor pertama dengan bobot tubuh yang lebih tinggi memiliki persentase spermatogonia yang lebih rendah (4,54%) dibandingkan dengan donor kedua (14,98%).
Gambar 7. Sel testikular ikan donor hasil disosiasi menggunakan PBS yang mengandung tripsin 0,5%. Spermatogonia ditunjukkan oleh anak panah.
Tabel 1. Hasil disosiasi sel gonad ikan donor
Donor Bobot tubuh (g) Bobot gonad (g) ∑ sel testikular (sel) Jumlah spermatogonia (sel) Persentase spermatogonia (%) 1 827 0,1513 138.625.000 6.300.000 4,54 2 608 0,1169 26.704.000 4.000.000 14,98
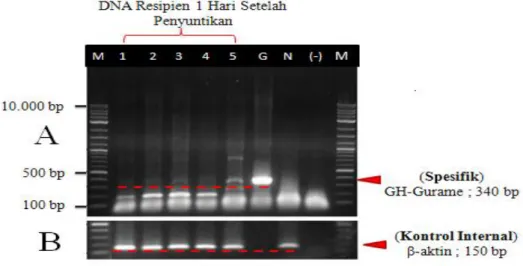
3.1.2 Analisis PCR pada DNA Resipien 1 Hari Setelah Penyuntikan
Konfirmasi keberhasilan proses penyuntikan sel donor ke rongga peritoneal atau rongga perut larva ikan nila (resipien) dilakukan menggunakan teknik PCR.
11 Dengan menggunakan teknik ini dapat diketahui masuk atau tidaknya sel donor yang telah disuntikkan pada resipien, yaitu dengan melihat visualisasi UV dari elektroforesis DNA sampel yang telah di PCR menggunakan primer spesifik yang hanya mendeteksi adanya DNA gurame (donor) dalam sampel (resipien) (Gambar 8).
Gambar 8. A) Analisis PCR DNA larva 1 hari setelah penyuntikan sel donor menggunakan marka molekular spesifik GH-Gurame (konfirmasi keberhasilan penyuntikan). M, marker; 1-5, DNA sampel larva; G, DNA ikan gurame sebagai kontrol positif; N, DNA ikan nila sebagai kontrol negatif; (-) Kontrol bahan pada proses PCR. B) PCR menggunakan primer Ti β-actin sebagai kontrol internal
Semua sampel yaitu 1-5 yang diperiksa dengan PCR menggunakan marka molekular spesifik GH-gurame memperlihatkan pita DNA (di atas garis merah) yang sejajar dengan pita kontrol positif DNA ikan gurame (G) dengan target sekuen 340 bp. Hal ini menunjukkan bahwa proses penyuntikan sel donor ke ikan resipien berhasil dilakukan.
3.1.3 Tingkat Kelangsungan Hidup Resipien
Tingkat kelangsungan hidup resipien 7 hari setelah penyuntikan menunjukkan kecenderungan peningkatan seiring dengan semakin meningkatnya umur resipien pada saat penyuntikan dilakukan (Gambar 9). Resipien yang disuntik pada umur 1-2 hari setelah menetas memiliki tingkat kelangsungan hidup
12 yang lebih rendah (89,34%) dibandingkan dengan resipien umur 3-4 hari setelah menetas (98,96%) dan kontrol (100%).
Gambar 9. Survival rate (SR) larva hingga 7 hari setelah penyuntikan. Hari 3-4, resipien yang disuntik saat berumur 3-4 hari setelah menetas; hari 1-2, resipien yang disuntik saat berumur 1-2 hari setelah menetas.
3.1.4 Kuantifikasi DNA Gonad Resipien 2 Bulan setelah Penyuntikan
Berdasarkan perhitungan konsentrasi DNA gonad menggunakan GeneQuant diperoleh data bahwa konsentrasi DNA gonad resipien hasil ekstraksi terendah adalah sebesar 1,1 ng/µl dan tertinggi adalah 10,5 ng/µl (Tabel 2). Ini menunjukkan bahwa DNA resipien sudah berhasil diekstraksi dan siap digunakan untuk keperluan PCR dalam mendeteksi kolonisasi sel donor pada gonad resipien.
Tabel 2. Data kuantifikasi DNA gonad resipien menggunakan Gene Quant No sampel*) Rasio Konsentrasi DNA (ng/µl) 1 1,784 7,3 2 1,854 3,0 3 1,896 1,4 4 1,909 2,5 5 1,856 5,9 6 1,949 1,7 7 1,764 4,1 8 1,687 10,5 9 1,777 9,8 10 1,881 1,1
Keterangan: *): sampel no 1-6, resipien yang disuntik saat umur 1-2 hari setelah menetas; no. 7-10: resipien yang disuntik saat umur 3-4 hari setelah menetas.Rasio merupakan nilai perbandingan antara absorbansi pada panjang gelombang 260 dan 280 nm.
0 20 40 60 80 100 Kontrol (tanpa penyuntikan) Hari Ke 1-2 Hari Ke 3-4 S R (% )
13 3.1.5 Analisis PCR Gonad Resipien
Resipien yang membawa atau tidak membawa sel donor pada saat umur 2 bulan dibedakan menggunakan teknik PCR dengan marka molekular tertentu yang mampu mendeteksi ada tidaknya sel gurame dalam gonad ikan nila. Tampak 6 (a-f) dari 6 sampel ikan nila resipien (disuntik pada umur 1-2 hari setelah menetas) yang diperiksa gonadnya melalui PCR memperlihatkan adanya pita DNA penyandi spesifik GH-gurame (Gambar 10) yang sejajar dengan (G) pita DNA gurame sebagai kontrol positif, hal ini menunjukkan bahwa semua sampel (100%) yang diperiksa membawa sel donor (sel testikular dari gonad ikan gurame) yang berarti sel donor mampu berkolonisasi di dalam gonad ikan resipien. Berbeda dengan hasil PCR terhadap resipien yang disuntik pada umur 1-2 hari setelah menetas, hasil deteksi terhadap larva resipien yang disuntik pada umur 3-4 hari (Gambar 11) menunjukkan adanya resipien yang tidak membawa sel donor (sampel ke-4) dalam gonadnya yang berarti sel donor gagal berkembang dan terkolonisasi di dalam gonad resipien.
Gambar 10. A) Analisis PCR DNA sampel resipien (yang disuntik pada umur 1-2 hari setelah menetas) 2 bulan setelah penyuntikan menggunakan marka molekular spesifik GH-Gurame. M, marker; (-), kontrol negatif bahan PCR, N, DNA ikan nila; G, DNA ikan gurame; a-f, DNA sampel resipien yang berumur 2 bulan setelah penyuntikan. B) PCR menggunakan primer Ti β-aktin sebagai kontrol internal.
14 Gambar 11. A) Analisis PCR DNA sampel resipien (yang disuntik pada
umur 3-4 hari setelah menetas) 2 bulan setelah penyuntikan menggunakan marka molekular spesifik GH-Gurame. M, marker; 1-4, DNA sampel resipien yang berumur 2 bulan setelah penyuntikan; G, DNA ikan gurame; N, DNA ikan nila; (-), kontrol negatif bahan PCR. B) PCR menggunakan primer Ti β-aktin sebagai kontrol internal.
3.2 Pembahasan
Sel donor khususnya sel spermatogonia dalam bentuk tunggal (terpisah dari jaringan gonad dan sel germinal lainnya) yang viable (hidup) dan berpotensi untuk berkembang ataupun berdiferensiasi di dalam gonad resipien dapat diperoleh dengan cara disosiasi sel (pemisahan sel dari jaringan). Menurut Kobayashi et al. (2004) selain tingkat kemurnian PGC atau sel donor dalam hal ini adalah hasil isolasi yang melibatkan proses disosiasi sel, viabilitas PGC atau sel donor juga dapat mempengaruhi kemampuan diferensiasi menjadi sel germinal pada resipien. Pada penelitian ini telah berhasil diperoleh sel testikular hasil disosiasi gonad ikan donor menggunakan tripsin 0,5% di dalam larutan PBS. Alimuddin et al. (2009) menyatakan bahwa disosiasi sel menggunakan tripsin-phosphate buffer saline (Trip-PBS) 0,5% dengan lama inkubasi kurang dari atau selama 2 jam diperoleh suspensi sel testikular ikan gurame dengan viabilitas 96,77-100%. Dalam penelitian ini, viabilitas sel hasil disosiasi tidak diamati, namun demikian viabilitasnya diduga sama dengan yang dilaporkan oleh Alimuddin et al. (2009).
15 Hasil disosiasi menunjukkan bahwa terdapat perbedaan jumlah sel testikular maupun sel spermatogonia pada donor yang digunakan (Tabel 1). Perbedaan jumlah spermatogonia hasil disosiasi gonad ikan donor tersebut diduga terkait oleh berbedanya bobot tubuh maupun bobot gonad pada setiap donor. Data tersebut (Tabel 1) memperlihatkan bahwa bobot tubuh yang lebih besar (donor 1) memiliki persentase spermatogonia yang lebih kecil jika dibandingkan dengan donor 2. Semakin tinggi bobot tubuh ikan gurame, maka semakin rendah persentase spermatogonia yang terkandung dalam gonadnya (Alimuddin, 2009).
Kemampuan deteksi sel donor dalam tubuh resipien menggunakan teknik PCR dengan primer spesifik GH-Gurame menunjukkan bahwa semua sampel (resipien) 1 sampai 5 (Gambar 8) telah membawa sel donor hasil penyuntikan. Melalui konfirmasi tersebut dapat dikatakan bahwa hasil penyuntikan sel donor ke dalam rongga perut resipien telah berhasil dilakukan. Teknik PCR menggunakan primer spesifik tersebut telah diuji tingkat sensitivitas dan spesifisitasnya oleh Achmad (2009). Teknik PCR ini mampu mendeteksi DNA ikan gurame dengan konsentrasi 1 ng/μl di dalam 700 ng/μl DNA ikan nila atau jika konsentrasi DNA tersebut dikonversi ke dalam jumlah sel melalui analisis ekstraksi DNA maka dapat dikatakan bahwa teknik PCR tersebut mampu mendeteksi 1 sel ikan gurame yang terdapat di dalam 10.000 sel ikan nila (Achmad, 2009). Dengan demikian nilai rasio jumlah sel donor yang disuntikkan ke resipien (larva) dapat dikatakan lebih dari sama dengan 1 berbanding 10.000 sel larva.
Terlihat bahwa tingkat kelangsungan hidup larva (Survival Rate) paling tinggi adalah kontrol, kemudian diikuti dengan perlakuan penyuntikan pada larva umur 3-4 hari (98,96%) dan paling rendah adalah perlakuan penyuntikan pada larva umur 1-2 hari (89,34%) (Gambar 9). Diduga umur larva yang masih muda memiliki daya tahan tubuh lemah dan rentan terhadap gangguan fisik dari luar yang dalam hal ini adalah teknis penyuntikan. Karena teknis penyuntikan ini beresiko mengenai organ lain yang dapat menyebabkan kerusakan organ sehingga larva mudah mati ketika selesai disuntik. Hal ini sesuai dengan Takeuchi et al. (2009) yang menyatakan bahwa resipien yang lebih kecil memiliki tingkat kelangsungan hidup yang lebih kecil juga, hal ini diperlihatkan dengan menurunnya SR larva dari 63,3% (pada resipien ikan nibe larva ukuran 6 mm)
16 menjadi 2,9% (pada resipien 3 mm). Kemampuan teknis dalam metode mikroinjeksi (transplantasi) sendiri memiliki peran penting terhadap keberhasilan masuknya sel donor ke dalam rongga perut resipien, selain itu penguasaan teknis penyuntikan secara tidak langsung juga dapat mempengaruhi tingkat kelangsungan hidup resipien pada saat penyuntikan dilakukan. Menurut Ath-thar (2008) dengan menggunakan teknik mikroinjeksi pada embrio memungkinkan adanya teknis injeksi yang membuat rusaknya jaringan tertentu sehingga menyebabkan telur tidak dapat menetas setelah dilakukan penyuntikan.
Proses kolonisasi (penggabungan) sel donor ke gonad resipien diawali dengan proses migrasi sel donor ke jaringan bakal gonad (genital ridge) dari ikan resipien. Menurut Yoshizaki (2010) proses migrasi primordial germ cell (PGC) pada ikan rainbow trout diawali dengan disekresikannya chemokine stromal
derived factor-1 (SDF-1) oleh sel somatik bakal gonad resipien, kemudian PGC
(sel donor) yang terletak di luar bakal gonad tersebut mengekspresikan reseptor yaitu CXC-chemokine receptor 4 (CXCR-4), PGC akan mengarah ke SDF-1 dan bermigrasi ke bakal gonad menggunakan pseudopodia (Raz & Reichman-Fried (2006) dalam Yoshizaki (2010)). Setelah mencapai daerah bakal gonad, PGC mengalami penggabungan (terkolonisasi) dengan gonad resipien.
Konfirmasi kolonisasi sel donor pada gonad resipien umur 2 bulan setelah transplantasi dilakukan karena gonad ikan nila yang berumur ± 2 bulan telah berkembang dan jika dilakukan pembedahan maka gonad sudah terlihat secara jelas dan mudah diambil serta dipisahkan dari organ lainnya untuk diekstraksi DNA nya. Kemudian waktu ± 2 bulan diduga merupakan waktu yang dapat untuk menentukan apakah sel donor dapat berkembang atau tidak di dalam gonad ikan resipien. Seperti yang telah diketahui sebelumnya bahwa tingkat kolonisasi atau perkembangan sel donor pada resipien (ikan rainbow trout) sudah dapat ditentukan dan dideteksi pada waktu 10 hari setelah dilakukan penyuntikan (proses transplantasi) (Takeuchi et al., 2003). Dengan mengacu Takeuchi et al. (2003) maka pemeriksaan gonad resipien (ikan nila) dalam rangka untuk mengetahui perkembangan sel donor pada penelitian ini masih layak dilakukan pada resipien yang berumur 2 bulan setelah transplantasi.
17 Berdasarkan deteksi sel gonad resipien dengan menggunakan teknik PCR tersebut dapat dikatakan bahwa keberhasilan kolonisasi dengan melakukan penyuntikan terhadap resipien yang berumur 1-2 hari setelah menetas dalam TST ini adalah 100% (Gambar 10). Keberhasilan ini diduga oleh karena rejection
immune system resipien belum berkembang dengan sempurna sehingga resipien
masih mampu menerima sel donor dari luar yang dimasukkan ke dalam rongga peritonialnya. Takeuchi et al. (2003) menyatakan bahwa sel donor tidak terkolonisasi di dalam tubuh resipien ketika resipien (rainbow trout) yang digunakan telah berumur 45 hari setelah fertilisasi. Hal ini diduga oleh adanya kemampuan ikan dalam menolak adanya bentuk sel dari luar. Pada beberapa spesies ikan yang baru menetas sistem imun masih relatif belum berkembang baik (Manning et al., 1996) sehingga sel donor masih dapat berkembang di dalam tubuh resipien. Selain itu Nakanishi (1985) menyatakan bahwa beberapa ikan dapat melakukan allograft rejection (penolakan transplantasi jaringan atau organ dari individu lain yang sama spesies oleh sistem imun) setelah umur tertentu, misalnya pada ikan mas umur 16 hari setelah menetas pada suhu 20-220C,
Xiphophorus maculates 23 hari setelah fertilisasi pada suhu 200C, dan pada
rainbow trout 14 hari setelah menetas pada suhu 140C.
Berbeda dengan hasil PCR terhadap resipien yang disuntik pada umur 1-2 hari setelah menetas, hasil deteksi terhadap larva resipien yang disuntik pada umur 3-4 hari (Gambar 11) menunjukkan adanya resipien yang tidak membawa sel donor (sampel ke-4) dalam gonadnya yang berarti sel donor gagal berkembang dan terkolonisasi di dalam gonad resipien. Dengan demikian dapat dikatakan bahwa keberhasilan kolonisasi hanya mencapai 75% dari 4 sampel yang diperiksa gonadnya. Kasus yang sama juga terjadi terhadap hasil penelitian dari Takeuchi et
al. (2003) yang menggunakan PGC atau Primordial Germ Cells ikan donor
(rainbow trout). Pada penelitian tersebut yaitu dengan menggunakan PGC dari umur embrio donor yang sama, kemudian ditransplantasikan ke resipien dengan umur berbeda (35, 40, dan 45 days post fertilization (dpf)) menunjukkan adanya penurunan tingkat kolonisasi yang signifikan terhadap sel donor pada resipien umur 45-dpf yang dicek pada waktu 30 hari setelah transplantasi dilakukan. Hal ini diduga bahwa umur resipien memiliki pengaruh penting dalam memberikan
18 lingkungan di dalam peritoneal (micro-environment) yang mampu mengarahkan migrasi sel donor ke genital ridge-nya sehingga sel donor dapat terkolonisasi. Hilangnya kondisi lingkungan di dalam peritoneal cavity resipien ikan rainbow
trout yang mampu mengarahkan PGC donor hasil transplantasi bermigrasi ke genital ridge-nya ketika resipien berumur antara 40 dan 45 dpf (Takeuchi et al.
(2003). Kemudian hal ini juga sesuai dengan Takeuchi et al. (2009) bahwa tingkat kolonisasi sel donor pada resipien (ikan nibe croaker (Nibea mitsukurii)) 3 minggu setelah penyuntikan mengalami kenaikan seiring dengan menurunnya ukuran resipien yang digunakan, resipien ukuran 6 mm (tidak ada kolonisasi), 5 mm (7,3 ± 3,6%), 4 mm (36,3 ± 12,1%) dan 3 mm (50%).