II. TINJAUAN PUSTAKA
2.1 Protozoa Bersilia, Ichtyophthirius multifiliis Forquet
Ichtyophthirius multifiliis adalah satu-satunya spesies parasit di dalam
genusnya (Lee et al. 1985 dalam Dickerson 2006). Sistematika lengkapnya menurut Hoffman (1967) adalah filum Protozoa, Subfilum Ciliaphora, kelas Ciliata, Subkelas Holotrica, Famili Holophrydae, Genus Ichthyophthirius, dan Spesies Ichtyophthirius multifiliis. Protozoa ini mengakibatkan penyakit bintik putih pada semua jenis ikan air tawar yang dikenal sebagai penyakit 'ich' atau white spot (Dickerson 2006; Davis et al. 2002).
2.1.1 Epidemiologi I. multifiliis
Distribusi geografi parasit I. multifiliis menyebar dari daerah tropik hingga sub-Artik yaitu pada wilayah-wilayah dimana beberapa jenis ikan air tawar masih dibudidayakan. Diduga ada perbedaan subspesies antara I. multifiliis yang menyerang di daerah tropik dengan daerah sub-Artik. Ikan dengan kemampuan toleransi suhu yang luas seperti cyprinid dan catfish berpeluang lebih besar untuk terserang oleh dua subspesies parasit tersebut (Dickerson 2006).
Wabah I. multifiliis membutuhkan lingkungan yang tepat dan juga adanya populasi inang yang rentan. Suhu yang relatif hangat mempermudah multiplikasi jumlah parasit, sedangkan stress akibat padat tebar, penanganan ikan, rendahnya kadar oksigen terlarut, adanya polutan, dan aktivitas pemijahan dapat menurunkan kompetensi sistem imunitas ikan yang akhirnya akan memicu wabah parasit (Dickerson 2006). Dalam suatu populasi, ikan dengan usia yang lebih muda akan lebih rentan terserang parasit ini dibandingkan ikan dewasa yang pernah terserang parasit yang sama, akan tetapi jika populasi tersebut untuk pertama kalinya terserang, maka semua usia ikan akan rentan terhadap serangan I. multifiliis (Dickerson 2006).
2.1.2 Siklus Hidup Parasit
Siklus hidup I. multifiliis terdiri dari dua tahap, yaitu tahap yang bersifat parasit pada epidermis ikan, dan tahap berenang bebas di lingkungan akuatik (Xu
et al. 2008). Tahap parasit di epidermis ikan dilakukan dalam stadia trophont
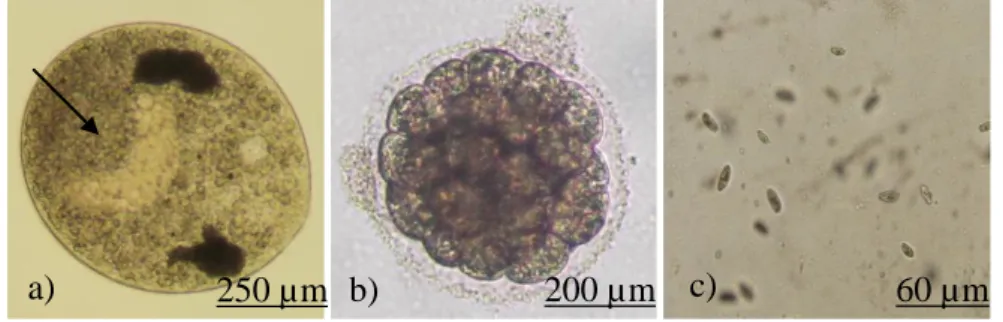
membentuk tomont yang akan menempel pada substrat di dasar perairan (Gambar 1b). Tomont akan membentuk kista yang di dalamnya terdapat ratusan hingga ribuan tomit yang bila cukup umur akan memecah dinding kista dan berubah menjadi stadia infektif theront (Gambar 1c) (Dickerson 2006). Morfologi beberapa stadia parasit dapat dilihat pada Gambar 1.
Gambar 1. Morfologi beberapa stadia parasit I. multifiliis a) sel trophont dengan makronukleus (tanda panah). b) sel tomont yang sedang melakukan pembelahan sel. c) sel theront yang berenang bebas Waktu yang dibutuhkan untuk merubah stadia trophont menjadi theront sangat dipengaruhi oleh faktor suhu. Pada suhu 5°C butuh waktu 9 hari, namun akan drastis menjadi 18 jam saja pada suhu 25°C (Buchmann et al. 2001). Siklus hidup dari parasit I. multifiliis dapat dilihat pada Gambar 2.
Gambar 2. Siklus hidup parasit I. multifiliis
Trophont encystment tomont excystment Theront Trophozoit Infection a) 250 µm b) 200 µm c) 60 µm
Stadia infektif dari parasit I. multifiliis berasal dari sel tomite yang berdiferensiasi di dalam kista sel tomont dan melepaskan diri pada proses
excystment dengan memecah kista. Proses diferensiasi mencakup perubahan
bentuk sel menjadi lebih lancip (pyriform), dan pembentukan perforatorium yang sangat berperan dalam proses infeksi (Dickerson 2006).
Stadia infektif theront sangat tertarik dengan komponen serum di dalam mukus, terutama pada daerah kulit yang lebih banyak diseliputi oleh mukus (Buchmann et al. 2001). Mekanisme theront dalam menginfeksi telah dipahami dengan baik, dimana theront melakukan gerakan berputar untuk menembus mukus ikan (Buchmann et al. 2001). Theront dapat bertahan hidup dalam perairan normal selama lebih 48 jam dan akhirnya mati jika tidak mendapatkan inang yang sesuai (Nielsen dan Buchmann 2000).
Tidak terdapat bukti bahwa stadia tomont dan theront melakukan aktivitas makan selama di lingkungan perairan. Vakuola makanan hanya terbentuk sesaat setelah theront menembus mukus ikan, dan semakin sempurna pada stadia trophont (Dickerson 2006). Namun beberapa peneliti menduga bahwa pada beberapa taraf, sel theront mampu memanfaatkan nutrisi dari lingkungannya. Hal tersebut dibuktikan oleh kemampuan sel theront untuk bertahan lebih lama jika dipelihara dalam media bernutrisi (Ekless 1993).
Gambar 3. Perubahan bentuk sel theront sebelum dan sesudah kontak dengan plasma ikan. a) Sel theront sebelum kontak dengan bentuk lancip, dan b) sel theront setelah kontak dengan bentuk yang relatif bulat Terdapat perbedaan morfologi sebelum dan sesaat setelah sel theront melakukan kontak dengan faktor dari inang seperti mukus dan serum (Nielsen dan Buchmann 2000). Perubahan tersebut adalah beralihnya bentuk lancip, pyriform,
menjadi lebih bulat, spherical. Contoh perubahan bentuk yang teramati setelah sel theront mengalami kontak dengan plasma ikan dapat dilihat pada Gambar 3.
I. multifiliis biasanya tidak tersebar merata pada permukaan tubuh ikan,
kecuali pada serangan yang parah. Parasit ini hanya terdeteksi pada permukaan punggung, sirip, dan beberapa bagian di kepala ikan. Selain sirip dan kulit, insang adalah bagian yang penting dalam serangan parasit. Adanya pergantian volume air dan sedikitnya mukus yang melindunginya, menjadikan organ ini berpeluang besar untuk penempelan parasit pada stadia infektif (Dickerson 2006). Tingkat keberhasilan sel theront dalam menginfeksi insang hanya 50% dari total populasi sel theront (Ewing et al. 1986).
Sel theront memiliki setidaknya 6 pola yang berbeda dalam mencari dan menemukan inangnya, dimana 4 pola diantaranya sangat dipengaruhi oleh komponen yang ada pada kulit ikan. Pola-pola tersebut diantaranya “berhenti dan mencari lalu mengubah arah” ketika terstimulasi oleh asam amino kulit ikan. Ketika terstimulasi oleh makromolekul glikoprotein kulit pada ikan maka sel theront akan “berhenti dan mendekati”, namun ketika terstimulasi oleh makromolekul glikokonjugat sel theront akan “berhenti dan menjauh” dari komponen kulit ikan tersebut (Hass et al. 1993).
Sesaat setelah sel theront berhasil menembus lapisan basal epidermis ikan, sel theront akan berdiferensiasi menjadi sel trophont yang dilengkapi dengan vokuola makanan. Secara bertahap ukuran parasit akan menjadi lebih besar dimana kecepatan pertumbuhanya sangat dipengaruhi oleh suhu lingkungan (Ewing et al. 1986). Stadia trophont dapat mudah dikenali dengan adanya makronukleus yang berbentuk ladam kuda jika diamati dengan menggunakan mikroskop (Dickerson 2006).
Walaupun sel trophont terlihat pada hampir semua bagian insang pada awal infeksi, namun pada hari ke-3 sel trophont bermigrasi dan lebih banyak berada di sekitar pembuluh darah insang. Selanjutnya sel-sel tersebut bermigrasi pada bagian sel epithelial inang dan tumbuh dengan diameter yang dapat mencapai 248 µm dalam 5 hari (Ewing dan Kocan 1986).
Parasit dalam stadia trophont akan terlihat sebagai titik putih pada tubuh ikan dengan diameter yang dapat mencapai 1 mm dan membentuk ruang pada
jaringan kulit ikan. Ruang ini terkadang berisi lebih dari satu sel trophont yang mungkin dikarenakan oleh adanya aktivitas migrasi bersama atau dikarenakan sel theront menginfeksi pada titik yang sama pada epithel ikan (Dickerson 2006). Sel trophont akan meninggalkan inang pada saat inang mati yang mekanismenya mungkin terkait dengan kemampuan parasit dalam mendeteksi perubahan tekanan osmotik pada tubuh inangnya (Nielsen dan Buchmann 2000). Sel trophont yang lepas dari tubuh inangnya segera berdiferensiasi menjadi sel tomont.
Sel trophont yang lepas dari inang akan berenang bebas kurang lebih 1 jam dan kemudian memproduksi materi lengket saat menempel pada substrat. Proses pembentukan kista (encystment) segera terjadi dan sel memulai pembelahan biner beberapa kali untuk menghasilkan sel tomite. Kecepatan pembelahan pada sel tomont sangat dipengaruhi oleh suhu lingkungan (Dickerson 2006).
2.1.3 Mekanisme Sakit
Tingkah laku ikan akan mengalami perubahan pada tahap awal infeksi, dimana ikan akan berenang dan mendekati pemasukan air (inlet) sebagai usaha untuk menghindari populasi sel theront. Ikan juga menggesek tubuhnya pada substrat atau objek tertentu sebagai reaksi dari proses infeksi. Pada infeksi lanjut, ikan menjadi kurang aktif dan banyak berdiam di dasar wadah atau berbaring dengan laju ventilasi operkulum yang meningkat (Dickerson 2006).
Selain modifikasi pada tingkah laku, infeksi parasit I. multifiliis juga mengakibatkan produksi mukus yang berlebihan. Ikan yang terinfeksi parah akan terlihat terbalut oleh lapisan putih pada tubuh dan siripnya. Infeksi ich yang berkembang menjadi ulcer akan menjadi pintu masuk bagi infeksi sekunder baik oleh bakteri maupun fungi oportunis. Kematian massal dapat dikaitkan dengan kerusakan sistem osmoregulasi pada tubuh ikan akibat infeksi parasit ini pada jaringan epidermis (Dickerson 2006). Kerusakan jaringan dapat terjadi dalam dua cara yaitu akibat luka dan apoptosis (Xu et al. 2005).
Insang adalah bagian tubuh ikan yang paling mudah terinfeksi oleh sel theront dikarenakan bagian ini tidak terlindungi sempurna oleh lapisan lendir. Selain itu adanya aliran dan pergantian volume air yang melewati insang menjadikan insang lebih rentan mengalami kontak dengan stadia infektif parasit dibandingkan bagian tubuh yang lainnya (Dickerson 2006; He et al. 1997).
Infestasi berat parasit pada insang dapat memicu hiperplasia sebagai reaksi sistem imunitas. Pada beberapa kasus infestasi juga mengakibatkan nekrosis pada insang dan juga produksi mukus yang menutup lembaran insang, sehingga kemampuan insang dalam mengambil oksigen dan melepas amoniak menjadi berkurang (Dickerson 2006).
Gambar 4. Produksi mukus yang berlebihan pada ikan yang terinfeksi
I. multifiliis
Infeksi parasit ini bersama dengan parasit lainnya seperti Trichodina dan
Gyrodactylus dapat menekan efikasi vaksinasi terhadap Streptococcus iniae pada
ikan nila. Ikan yang divaksinasi namun terinfeksi parasit I. multifiliis memiliki nilai relative percent survival (RPS) sebesar 72%, lebih rendah dari ikan yang juga divaksin tapi bebas dari parasit ini yang nilai RPSnya mencapai 95% (Martins et al. 2011a). Efikasi vaksin I. multifiliis juga mengalami penurunan pada ikan-ikan yang dipelihara pada suhu rendah 15-25°C. Ikan tersebut tidak mampu menghasilkan antibodi yang mencukupi dan setelah uji tantang populasi ikan mengalami kematian yang tinggi (Martins et al. 2011b).
Terkait dengan infeksi bersama dengan bakteri patogen, mekanisme kematian yang diakibatkan oleh parasit I. multifiliis dapat terjadi dalam 3 skenario. Pertama, parasit menyebabkan kerusakan secara langsung terhadap beberapa sistem fisiologi yang vital seperti osmoregulasi, respirasi, dan sistem pembuangan senyawa amoniak. Kedua, parasit merusak lini pertahanan pertama ikan (lendir) sehingga membuka peluang bakteri patogen oportunistik mendapatkan portal entry ke dalam tubuh ikan. Ketiga, infestasi parasit menyebabkan ikan menjadi stress sehingga menekan kompetensi sistem imunitas ikan dalam menghadapi infeksi oleh bakteri patogen (Xu et al. 2011).
2.2 Propagasi Parasit
Usaha untuk mengkultur beberapa organisme sederhana dalam media buatan telah dilakukan terhadap golongan bakteri, fungi, dan sebagian dari keluarga protozoa. Untuk beberapa organisme yang bersifat parasit obligat harus dikultur dalam organisme hidup ataupun dalam suatu kultur jaringan atau sel (cell
line). Kultur secara in vitro memungkinkan untuk mendapatkan organisme dalam
jumlah yang cukup karena tidak adanya predator atau kompetitor dalam media biakannya (Lee dan Mora 2005).
Kemampuan untuk menghasilkan organisme yang terbebas dari kontaminan sangat diperlukan bahkan dalam bidang biologi molekuler. Beberapa penelitian termasuk diagnosis dan studi etiologi hanya dapat dilakukan ketika tersedia sejumlah kecil organisme parasit, atau beberapa penelitian justru membutuhkan sejumlah organisme parasit tanpa kontaminasi dengan organisme atau materi dari inangnya. Satu keuntungan dari kultur in vitro terutama kultur murni, adalah kemampuan menghasilkan suplai organisme yang kontinyu (Visvesvara dan Garcia 2002).
Hasil dari beberapa penelitian yang menggunakan media buatan, membuktikan bahwa selain sebagai media untuk perbanyakan parasit, media buatan juga dapat dimanfaatkan sebagai media preservasi untuk waktu yang singkat. Nielsen dan Buchmann (2000) membuktikan bahwa media EMEM dan L-15 yang disuplementasi dengan faktor inang dapat memperpanjang masa hidup parasit I. multifiliis selama 11 hari, dibandingkan perlakuan tanpa faktor inang (7 hari) dan tanpa media buatan (2 hari). Sementara Syawal (1995) berhasil memperpanjang viabilitas sel theront I. multifiliis dalam media peptone dan glukosa walaupun sel tidak berkembang menjadi trophont.
Media buatan menawarkan beberapa keuntungan dalam kegiatan mengkultur atau mempreservasi parasit. Keunggulan tersebut antara lain komposisi media buatan yang dapat disesuaikan dengan kebutuhan nutrisi parasit, dapat diperbaharui secara berkala untuk menghindari peracunan pada parasit, dan dapat disuplementasi dengan faktor-faktor inang yang dibutuhkan parasit, seperti plasma ataupun mukus. Sementara itu untuk parasit-parasit yang obligat inang,
maka propagasi secara in vivo merupakan satu-satunya jalan untuk memperbanyak sel parasit.
Keberhasilan pada propagasi secara in vivo sangat ditentukan oleh kualitas parasit, kuantitas parasit, dan kualitas lingkungan. Jumlah inang yang dibutuhkan dalam suatu seri infeksi, kecepatan peralihan stadia, sifat infektif yang tidak stabil dari parasit, dan fenomena menurunnya patogenisitas parasit dengan bertambahnya seri infeksi adalah hal-hal yang harus diperhatikan dalam suatu propagasi parasit secara in vivo (Dan et al. 2006).
Penelitian yang dilakukan dengan menggunakan parasit C. irritans penyebab penyakit white spot pada ikan laut, menyimpulkan bahwa sel theront tidak selamanya bersifat infektif walaupun mungkin dapat disimpan dalam waktu yang lama. Selain itu ada fenomena semakin banyak seri infeksi dilakukan dalam propagasi secara in vivo, ternyata membutuhkan jumlah parasit yang semakin banyak untuk menimbulkan gejala bintik putih pada infeksi berikutnya. Penurunan kemampuan infeksi juga terjadi jika sel trophont yang digunakan telah dipreservasi pada suhu lebih rendah dari 12°C dan masa penyimpanan yang lebih lama dari 4 bulan. Penurunan tersebut dapat diamati dari meningkatnya persentase kecacatan pada sel theront yang dihasilkan, rendahnya derajat infektifitas, dan meningkatnya nilai lethal dosis (Dan et al. 2009).