BAB II
TINJAUAN PUSTAKA 2.1 Uraian Tumbuhan
2.1.1 Sistematika Tumbuhan Divisi : Spermatophyta Sub Divisi : Angiospermae Kelas : Dicotyledoneae Bangsa : Piperales
Suku : Piperaceae
Marga : Peperomia
Jenis : Peperomia pellucida H.B.&K
(Djumidi, 1997) 2.1.2 Nama daerah
Nama daerah tumbuhan ini adalah seladaan (Jawa), saladaan (Sunda), ketumpang ayer (Sumatera), gotu garoko (Maluku) (Dhauhariya, 2004). 2.1.3 Morfologi tumbuhan
Habistus : Herba, tinggi 10-20 cm Batang : Tegak, lunak hijau muda
Daun : Tunggal, duduk spiral, lonjong,panjang 1-4 cm, lebar 1,5-2 cm, ujung rncing, pangkal bertoreh, tepi rata, pertulangan melengkung, permukaan lici, lunak, hijau.
Bunga : Majemuk, bentuk bulir, diujung batang atau di ketiak daun, panjang bulir 2-3 cm, tangkai lunak, putih kekuningan.
Biji : Bulat, kecil, hitam Akar : Serabut, putih
(Djumidi, 1997) 2.2 Uraian Kimia
2.2.1 Terpenoida
Senyawa terpenoida mencakup sejumlah besar senyawa tumbuhan dan istilah terpenoida digunakan untuk menunjukkan bahwa secara biosintesis semua senyawa tumbuhan ini berasal dari senyawa yang sama. Senyawa terpenoida adalah senyawa yang berasal dari unit-unit isopren CH2=C(CH3)−CH2 dan kerangka karbonnya dibangun oleh persambungan dua atau lebih satuan C5 ini melalui kaidah persambungan “kepala dan ekor”. Terpenoida dapat mengandung dua, tiga atau lebih satuan isopren. Molekul-molekulnya dapat berupa rantai terbuka atau siklik, dan dapat mengandung gugus hidroksil, gugus karbonil atau gugus fungsional lainnya.
Terpenoida terdiri atas beberapa macam senyawa berdasarkan jumlah satuan isoprena yang terdapat dalam senyawa tersebut. Mulai dari komponen minyak atsiri, yaitu monoterpena dan seskuiterpena (C10 dan C15), diterpena yang lebih sukar menguap (C20), sampai ke senyawa yang tidak menguap yaitu triterpenoida (C30), serta pigmen karotenoida (C40). Golongan senyawa terpenoida tersebut dapat dilihat pada tabel 1 (Harborne, 1987).
Tabel 1. Golongan terpenoida tumbuhan
Jumlah satuan isoprena Jumlah Karbon Golongan 1 2 3 4 5 6 8 n C5 C10 C15 C20 C25 C30 C40 Cn hemiterpenoida monoterpenoida seskuiterpenoida diterpenoida sesterpenoida triterpenoida tetraterpenoida politerpenoida 2.2.2 Triterpenoida
Triterpenoida adalah senyawa yang kerangka karbonnya berasal dari enam satuan isoprena dan secara biosintesis diturunkan dari hidrokarbon C-30 asiklik, yaitu skualena, senyawa ini tidak berwarna, berbentuk kristal, bertitik leleh tinggi dan bersifat optis aktif yang umumnya sukar dicirikan karena tak ada kereaktifan kimianya. Uji yang banyak digunakan untuk uji atau identifikasi triterpenoida ialah reaksi Lieberman-Burchard (anhidrida asetat – H2SO4 pekat) yang biasanya menghasilkan warna hijau-biru (Harborne,1987).
Sebagian senyawa triterpenoida juga merupakan komponen aktif dalam tumbuhan dan telah digunakan untuk penyakit termasuk diabetes, gangguan menstruasi, gangguan kulit, kerusakan hati dan malaria. Beberapa senyawa menunjukkan aktivitas antibakteri, antifungi dan ada juga senyawa yang dapat menstimulasi serangga bertelur (Robinson, 1995).
Triterpenoida dapat dibagi menjadi empat golongan senyawa yaitu triterpena, steroida, saponin dan glikosida jantung.
a. Triterpena
Triterpena terutama terdapat dalam lapisan malam daun dan dalam buah yang berfungsi sebagai pelindung untuk menolak serangga dan serangan mikroba. Pembagian triterpena berdasarkan jumlah cincin yang terdapat dalam struktur molekulnya adalah:
1. Triterpena asiklik yaitu triterpenoida yang tidak mempunyai cincin tertutup dalam struktur molekulnya, misalnya skualena.
2. Triterpena trisiklik yaitu triterpenoida yang mempunyai tiga cincin tertutup dalam struktur molekulnya, misalnya ambrein.
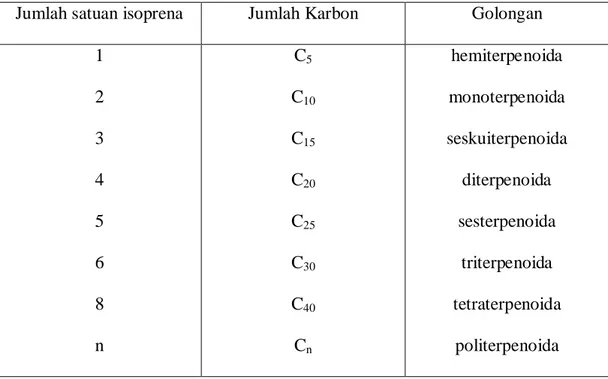
3. Triterpena tetrasiklik yaitu triterpenoida yang mempunyai lima cincin tertutup pada struktur molekulnya, misalnya lanosterol.
4. Triterpena pentasiklik yaitu triterpenoida yang mempunyai lima cincin tertutup pada struktur molekulnya, misalnya α-amirin pada buah apel (Harborne, 1987; Robinson, 1995).
Struktur dari senyawa triterpenoida tersebut dapat dilihat pada gambar 1 berikut ini.
Lanosterol α-amirin Gambar 1. Struktur dari beberapa senyawa triterpenoida b. Steroida
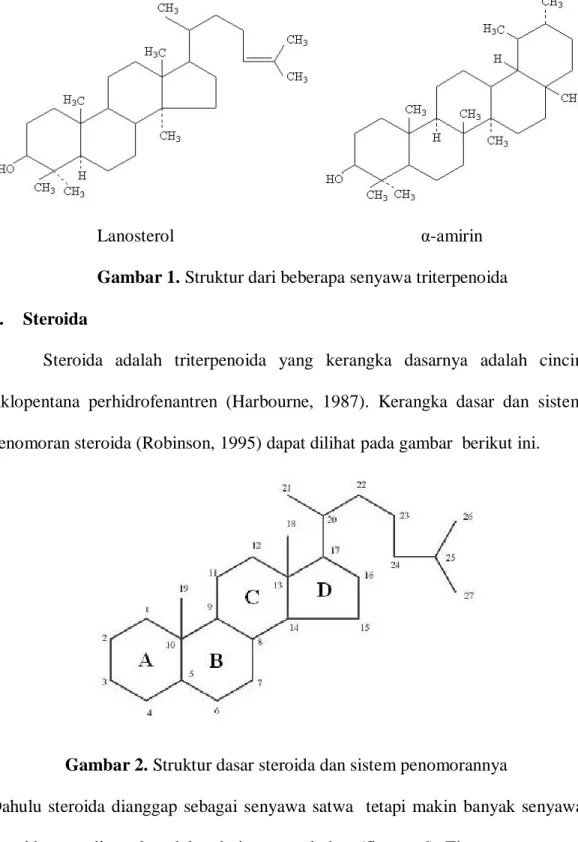
Steroida adalah triterpenoida yang kerangka dasarnya adalah cincin siklopentana perhidrofenantren (Harbourne, 1987). Kerangka dasar dan sistem penomoran steroida (Robinson, 1995) dapat dilihat pada gambar berikut ini.
Gambar 2. Struktur dasar steroida dan sistem penomorannya
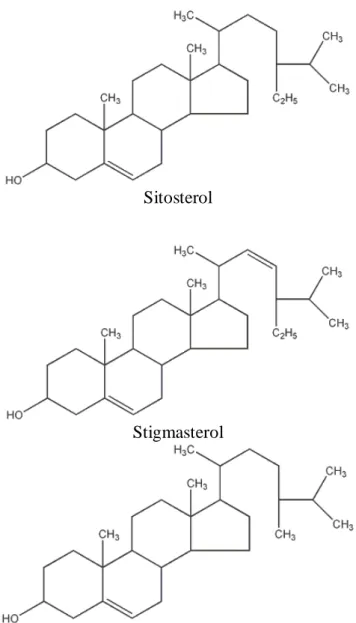
Dahulu steroida dianggap sebagai senyawa satwa tetapi makin banyak senyawa steroida yang ditemukan dalam jaringan tumbuhan (fitosterol). Tiga senyawa yang biasa disebut fitosterol terdapat pada hampir setiap tumbuhan tinggi yaitu: sitosterol, stigmasterol, dan kampesterol (Harbourne, 1987).
Sitosterol
Stigmasterol
Kampesterol
Gambar 3. Struktur beberapa senyawa fitosterol
c. Saponin
Saponin adalah senyawa aktif permukaan yang kuat, menimbulkan busa jika dikocok dalam air dan pada konsentrasi yang rendah sering menyebabkan hemolisis daram merah. Mula-mula disebut saponin karena sifatnya yang khas menyerupai sabun (bahasa latin, sapo : sabun). Dalam larutan yang sangat encer
saponin sangat beracun untuk ikan dan beberapa saponin bekerja sebagai anti mikroba.
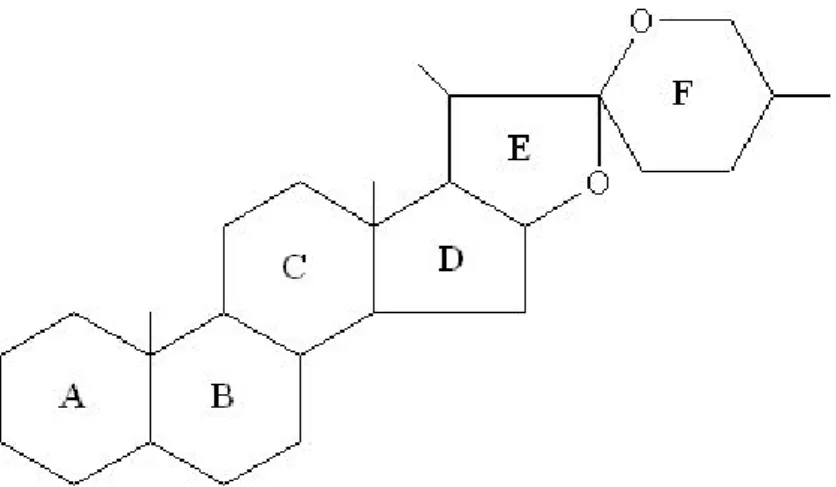
Dikenal dua jenis saponin yaitu glikosida triterpenoida alkohol dan glikosida steroida yang mempunyai rantai samping spiroketal. Aglikonnya disebut sapogenin, diperoleh dengan hidrolisis dalam suasana asam atau hidrolisis memakai enzim (Robinson, 1995)
Inti steroida spiroketal mempunyai struktur berikut:
Gambar 4. Struktur dasar spiroketal d. Glikosida Jantung
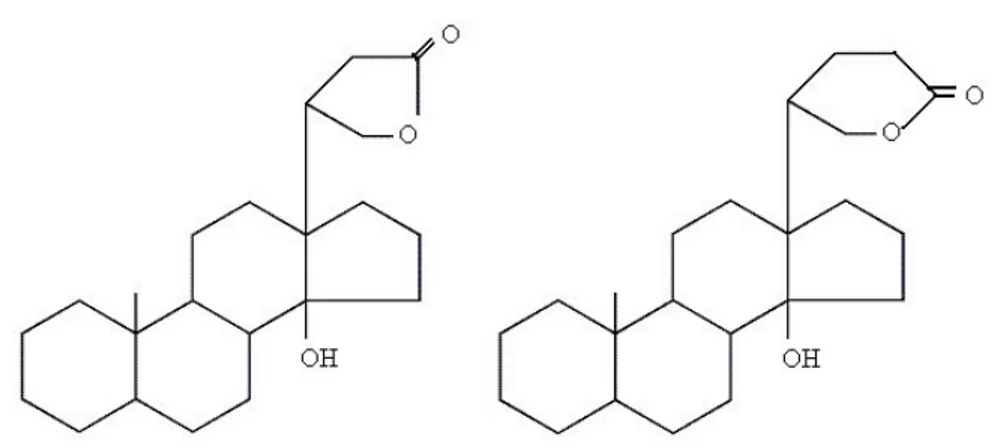
Glikosida jantung merupakan senyawa yang mempunyai kemampuan sebagai pemacu jantung (mempunyai efek menambah daya kontraksi otot jantung). Struktur dari glikosida jantung ini menyerupai struktur saponin steroida (Robinson, 1995).
Aglikon dari glikosida jantung merupakan golongan triterpena steroida yang mempunyai inti siklopentano perhidrofenantrena dan cincin lakton yang jenuh pada atom C-17 dan mengandung gugus hidroksil pada atom C-14.
Aglikon yang mempunyai cincin lakton tersebut ada 2 macam yaitu:
1. Kardenolida, berupa steroida dengan atom karbon 23 yang mempunyai rantai samping cincin lakton pentasiklik dengan sati ikatan rangkap dan satu buah gugus hidroksil pada C-14 (butirolakton, γ-lakton).
2. Bufadienolida, merupakan steroida dengan atom karbon 24 dengan rantai samping cincin lakton dan satu buah gugus hidroksil pada C-14 (valerolakton, δ-lakton) (Harborne, 1987; Robinson, 1995).
Tipe-tipe aglikon dari glikosida jantung dapat dilihat pada gambar 5 dibawah ini.
Kardenolida Bufadienolida
Gambar 5. Tipe aglikon dari glikosida jantung 2.3 Ekstraksi
2.3.1 Pengertian
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut. Pengetahuan tentang golongan senyawa yang dikandung simplisia akan mempermudah proses pemilihan pelarut dan cara ekstraksi yang tepat (Ditjen POM, 2000).
2.3.2 Metode-Metode Ekstraksi
Beberapa metode ekstraksi dengan menggunakan pelarut (Ditjen POM, 2000) yaitu:
1. Cara dingin a. Maserasi
Maserasi adalah proses penyarian simplisia dengan cara perendaman dalam pelarut sambil dilakukan beberapa kali pengocokan pada temperatur ruangan (suhu kamar).
Remaserasi berarti proses maserasi yang dilanjutkan dengan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama dan seterusnya sampai maserat tersebut jernih.
b. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur kamar. Proses perkolasi terdiri dari tahap pengembangan bahan, tahap perendaman antara, dan penampungan ekstrak. Untuk menentukan akhir dari pada perkolasi dapat dilakukan pemeriksaan zat secara kualitatif pada perkolat akhir.
2. Cara panas a. Refluks
Refluks adalah ekstraksi dengan menggunakan pelarut pada temperatur titik didihnya selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik.
b. Sokletasi
Sokletasi adalah ekstraksi mengunakan pelarut yang selalu baru, dengan menggunakan alat soxhlet sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
c. Digesti
Digesti adalah maserasi dengan pengadukan yang kontinu pada temperatur yang lebih tinggi dari temperatur ruangan yang umumnya pada temperatur 40-50°C.
d. Infus
Infus adalah ekstraksi dengan menggunakan pelarut air di mana bejana infus tercelup dalam penangas air mendidih, pada temperatur 96-98°C selama 15-20 menit.
Dekok adalah infus pada waktu yang lebih dari 30 menit dan temperaturnya mencapai titik didih air.
2.4 Kromatografi
Kromatografi adalah suatu metode pemisahan berdasarkan perbedaan perpindahan dari komponen-komponen senyawa diantara dua fase yaitu fase diam, dapat berupa zat cair atau zat padat, dan fase gerak, dapat berupa gas atau zat cair (Ditjen POM, 1995; Stahl, 1985). Jika fase tetap berupa zat padat maka cara tersebut dikenal sebagai kromatografi serapan, jika zat cair dikenal sebagai kromatografi partisi. Karena fase bergerak dapat berupa zat cair dan gas maka ada empat macam sistem kromatografi (Sastrohamidjojo, 1985) :
1. Fase bergerak zat cair – fase tetap padat (kromatografi serapan): - Kromatografi lapis tipis
- Kromatografi penukar ion
2. Fase bergerak gas – fase tetap padat (kromatografi serapan): - Kromatografi gas padat
3. Fase bergerak zat cair – fase tetap zat cair (kromatografi partisi): - Kromatografi cair kinerja tinggi
4. Fase bergerak gas – fase tetap zat cair (kromatografi partisi): - Kromatografi gas cair
- Kromatografi kolom kapiler
Pemisahan dan pemurnian kandungan tumbuhan terutama dilakukan dnegan mengunakan salah satu atau gabungan dari beberapa teknik tersebut dan dapat digunakan pada skala mikro maupun makro (Harborne, 1987).
2.4.1 Kromatografi Lapis Tipis
Kromatografi lapis tipis merupakan metode pemisahan yang memerlukan investasi yang kecil untuk perlengkapan, menggunakan waktu yang singkat serta pemakaian pelarut dan cuplikan dalam jumlah sedikit. KLT termasuk kromatografi serapan, dimana sebagai fase diam berupa zat padat yang disebut adsorben (penyerap) dan fase gerak adalah zat cair yang disebut larutan pengembang (Gritter dkk., 1991; Stahl, 1985).
Pendeteksian bercak hasil pemisahan dapat dilakukan dengan beberapa cara, yaitu dengan pengamatan langsung atau dibawah sinar ultraviolet jika senyawanya berwarna dan pengamatan dengan cahaya biasa atau cahaya ultraviolet setelah disemprot dengan pereaksi yang membuat bercak tersebut tampak. Beberapa senyawa organik bersinar atau berfluorosensi jika disinari
dengan sinar UV gelombang pendek (254 nm) atau gelombang panjang (366 nm) (Ditjen POM, 1995; Gritter dkk., 1991).
a. Fase diam (Lapisan Penyerap)
Pada kromatografi lapis tipis, fase diam berupa lapisan tipis yang terdiri atas bahan padat yang dilapiskan pada permukaan penyangga datar yang biasanya terbuat dari kaca, tetapi dapat pula terbuat dari plat polimer atau logam. Lapisan melekat pada permukaan dnegan bantuan bahan pengikat, biasanya kalsium sulfat atau amilum (pati). Penyerap yang umum dipakai untuk kromatografi lapis tipis adalah silika gel, alumina, kieselgur, dan selulosa (Gritter dkk, 1991).
Dua sifat yang penting dari fase diam adalah ukuran partikel dan homogenitasnya, karena adhesi terhadap penyokong sangat tergantung pada kedua sifat tersebut. Ukuran partikel yang biasa digunakan adalah 1-25 mikron. Partikel yang butirannya sangat kasar tidak akan memberikan hasil yang memuaskan dan salah satu cara untuk memperbaiki hasil pemisahan adalah dengan menggunakan fase diam yang butirannya lebih halus. Butiran yang halus memberikan aliran pelarut yang lebih lambat dan resolusi yang lebih baik (Sastrohamidjojo, 1985). b. Fase gerak (Pelarut Pengembang)
Fase gerak ialah medium angkut dan terdiri atas satu atau beberapa pelarut. Jika diperlukan sistem pelarut multi komponen, harus berupa suatu campuran sesederhana mungkin yang terdiri atas maksimum tiga komponen (Stahl, 1985).
Dalam pemisahan senyawa organik selalu menggunakan pelarut campur. Tujuan menggunakan pelarut campur adalah untuk memperoleh pemisahan senyawa yang baik. Kombinasi pelarut adalah berdasarkan atas polaritas
masing-masing pelarut, sehingga dengan demikian akan diperoleh sistem pengembang yang cocok. Pelarut pengembang yang digunakan dalam kromatografi lapis tipis antara lain: n-heksana, karbontetraklorida, benzena, kloroform, eter, etil asetat, piridian, aseton, etanol, metanol dan air (Gritter dkk., 1991; Sudjadi, 1988).
c. Harga Rf
Untuk menggambarkan jarak pengembangan senyawa pada kromatogram dipakai istilah harga Rf (Stahl, 1985).
Jarak titik pusat bercak dari titik awal Rf =
Jarak garis depan pelarut dari titik awal
Harga Rf beragam mulai dari 0 sampai 1. Faktor-faktor yang mempengaruhi harga Rf (Sastrohamidjojo, 1985):
a. Struktur kimia dari senyawa yang dipisahkan b. Sifat penyerap
c. Tebal dan kerataan dari lapisan penyerap d. Pelarut dan derajat kemurniannya
e. Derajat kejenuhan uap pengembang dalam bejana f. Teknik percobaan
g. Jumlah cuplikan yang digunakan h. Temperatur
i. Kesetimbangan
2.4.2 Kromatografi Cair Vakum
Cara ini pertama kali dipublikasikan oleh Coll dkk. Pada tahun 1977 dengan mengguanakan corong Buchner kaca masir atau kolom pendek untuk
mengisolasi diterpena sembrenoid dari terumbu karang Australia. Kolom kromatografi dikemas kering dalam keadaan vakum agar diperoleh kerapatan kemasan maksimum. Vakum dihentikan, pelarut yang kepolarannya rendah dituangkan ke permukaan penjerap lalu divakumkan lagi. Kolom dihisap sampai kering dan sekarang siap dipakai.
Sampel, dilarutkan dalam pelarut yang cocok, dimasukkan langsung pada bagian atas kolom atau pada lapisan pra penyerap dan dihisap perlahan-lahan kedalam kemasan dengan memvakumkannya. Kolom, dielusi dengan campuran pelarut yang cocok, mulai dari pelarut yang kepolarannya rendah lalu kepolarannya ditingkatkan perlahan-lahan, kolom dihisap sampai kering pada setiap pengumpulan fraksi. Oleh karena itu kromatografi cair vakum menggunakan tekanan rendah untuk meningkatkan laju aliran fase gerak (Hostettmann, 1995).
2.4.3 Kromatografi Lapis Tipis Preparatif
Salah satu metode pemisahan yang memerlukan biaya paling murah dan memakai peralatan sedarhana ialah KLT preparatif. Walaupun KLT preparatif dapat memisahkan dalam jumlah gram, sebagian besar pemakaian hanya dalam jumlah miligram. KLT preparatif dilakukan dengan menggunakan lapisan tebal (sampai 1 mm) sebagai pengganti lapisan penyerap yang tipis (0,10-0,25 mm). pita-pita sampel yang sudah dipisah dapat diperoleh kembali dengan cara mengerok penyerap dari plat KLT preparatif yang telah dikembangkan. Demikian kuatnya lapisan penyerap melekat pada kaca penyokong sehingga memungkinkan pengembangan plat berulang-ulang dengan pengembang yang sama atau
pengembang yang berbeda, dengan terlebih dulu mngeringkan plat sebelum pengembangan berikutnya (Harborne, 1987).
Fase diam yang paling sering dugunakan biasanya dengan ketebalan 0,5-2 mm dan ukuran plat kromatogram biasanya 20x20 cm. fase diam yang paling umum dipakai ialah silika gel dan dipakai untuk pemisahan berbagai campuran senyawa lipofil maupun senyawa hidrofil.
Sampel dilarutkan dalam sedikit pelarut sebelum ditotolkan pada plat KLT preparatif. Pelarut yang baik ialah pelarut yang mudah menguap (atsiri), karena jika pelarut kurang atsiri terjadi pelebaran pita. Konsentrasi sampel harus sekitar 5-10%. Sampel ditotolkan berupa pita yang harus ditotolkan sesempit mungkin karena pemisahan tergantung pada lebar pita. Pemilihan pelarut ditentukan berdasarkan pemeriksaan pendahuluan memakai KLT analitik. Karena ukuran partikel penyerap kira-kira sama, pelarut yang dipakai pada KLT analitik dapat dipakai pada KLT preparatif.
Pengembangan plat KLT preparatif biasanya dilakukan dalam bejana kaca yang dapat menampung beberapa plat. Bejana dijaga tetap jenuh dengan pelarut pengembang dengan bantuan sehelai kertas saring yang tecelup ke dalam larutan pengembang. Keefisienan pemisahan dapat ditingkatkan dengan cara pengembangan berulang. Harus diperhatikan bahwa semakin lama senyawa berkontak dengan penyerap maka semakin besar kemungkinan penguraian (Hostettmann, 1995).
2.5 Spektrofotometri
Spektroskopi adalah studi mengenai interaksi antara cahaya dengan atom dan molekul. Umumnya spektroskopi dibagi menjadi dua kelompok yaitu:
spektroskopi serapandan spektroskopi emisi. Pengelompokkan ini berdasarkan atas apa yang diukur setelah terjadi interaksi antara radiasi elektromagnetik dan sampel. Pembagian dapat juga berdasarkan daerah-daerah panjang gelombang dalam spektrum elektromagnetik. Cara pengukuran yang berasarkan spektroskopi umumnya dinamakan spektroskopi dan jika sumber energi berupa sinar/cahaya dan sistem detektor menggunakan sel fotolistrik maka metode pengukuran ini dinamakan spektrofotometri (Noerdin, 1985).
2.5.1 Spektrofotometri Ultraviolet
Spektrofotometri ultraviolet merupakan suatu teknik analisis berdasarkan atas pengukuran serapan suatu larutan yang dilalui radiasi monokromatis ultraviolet. Kegunaan spektrofotometri ini terletak pada kemampuannya mengukur jumlah ikatan rangkap atau konyugas aromatis di dalam suatu molekul (Sudjadi, 1983).
Spektrum serapan kandungan tumbuhan dapat diukur dalam larutan yang sangat encer dengan pembanding blanko pelarut menggunakan spektrofotometer yang merekam otomatis. Senyawa tan warna diukur pada daerah panjang gelombang 200-400 nm, senyawa berwarna pada panjang gelombang 400-800 nm.
Pelarut yang banyak digunakan untuk spektrofotometri UV ialah etanol 95% karena kebanyakan golongan senyawa larut dalam pelarut tersebut. Alkohol absolut komersial harus dihindari karena mengandung benzena yang dapat menyerap di daerah sinar UV pendek. Pelarut yang sering digunakan ialah air, etanol, metanol, heksana, eter minyak bumi dan eter. Pelarut seperti kloroform
dan piridin umumnya harus dihindari karena menyerap kuat di daerah 200-260 nm (Harbourne, 1987).
2.5.2 Spektrofotometri Inframerah
Spektrum inframerah senyawa tumbuhan dapat diukur dengan spektrofotometri inframerah yang merekam secara otomatis dalam bentuk larutan (dalam kloroform, karbontetrakloroida 1-5%), atau bentuk padat yang dicampur dengan kalium bromida. Daerah pengukuran adalah daerah bilangan gelombang 4000-667 cm-1 atau panjang gelombang 2,5-15 µm, dan perekaman spektrum memakan waktu kira-kira 3 menit (Noerdin, 1985).
Daerah pada spektrum inframarah di atas bilangan gelombang 1200 cm-1 menunjukkan pita spektrum atau puncak yang disebabkan oleh getaran ikatan kimia atau gugus fungsi dalam molekul yang ditelaah. Daerah di bawah 1200 cm-1 menunjukkan pita yang disebabkan oleh getaran seluruh molekul, dan karena kerumitannya dikenal sebagai daerah sidik jari. Intensitas berbagai pita direkam secara subjektif pada skala sederhana: kuat (K; strong, s), menengah (M; Medium, m) atau lemah (L; weak, w).
Kenyataan yang menunjukkan bahwa banyak gugus fungsi dapat diidentifikasi dengan menggunakan frekuensi getaran khasnya mengakibatkan spektrofotometri infra merah merupakan cara paling sederhana dan paling terandalkan dalam menentukan golongan senyawa yang terkandung dalam sebuah molekul (Harborne, 1987).
Penafsiran spektrum inframerah dari suatu senyawa yang belum diketahui harus ditujukan pada penentuan ada atau tidaknya beberapa gugus fungsional utama seperti C=O, O-H, N-H, C-O, C=C, C=N, NO2. Langkah-langkah yang
umum dilakukan untk memeriksa pita-pita yang penting pada spektrum inframerah secara berurutan adalah (Pavia et al., 1988):
1. Gugus Karbonil
Gugus C=O memberikan puncak yang kuat pada daerah bilangan gelombag 1820-1660 cm-1.
2. Bila gugus C=O ada, periksalah gugus-gugus berikut (jika C-O tidak ada langsung ke nomor 3).
Asam : periksalah gugus O-H, merupakan serapan melebar di daerah 3300-2200 cm-1.
Amida : periksalah gugus N-H, merupakan serapan medium di daerah 3500 cm-1, kadang-kadang dengan puncak rangkap.
Ester : periksalah gugus C-O, merupakan serapan medium di daerah 1300-1000 cm-1.
Anhidrida : mempunyai dua serapan C=O di daerah 1810 dan 1760 cm-1. Aldehida : periksalah gugus C-H, merupakan dua serapan lemah di daerah
2850 dan 2750 cm-1 yaitu di sebelah kanan serapan C-H. Keton : kemungkinan bila kelima gugus di atas tidak ada.
3. Bila gugus C=O tidak ada
Alkohol atau fenol : periksalah gugus O-H, merupakan senyawa melebar di daerah 3600-3300 cm-1 yang diikuti adanya serapan C-O di daerah 1300-1000 cm-1.
Amina : periksalah gugus N-H, yaitu serapan medium di daerah 3500 cm-1.
Eter : Periksalah gugus C-O (tidak adanya O-H), yaitu serapan medium di daerah 1300-1000 cm-1.
4. Ikatan rangkap dua dan cincin aromatik
- Serapan lemah sampai medium dan tajam C=C di daerah 1650 cm-1.
- Serapan medium sampai kuat dan tajam pada daerah 1650-1450 cm-1 sering menunjukkan adanya cincin aromatis.
- Buktikan kemungkinan di atas dengan memperhatikan serapan pada daerah C-H aromatis di sebelah kiri 3000 cm-1, sedangkan C-H alifatis terjadi di sebelah kana daerah tersebut (2925 cm-1 dan 2850 cm-1).
5. Ikatan rangkap tiga
- Serapan medium dan tajam dari C≡N di daerah 2250 cm-1. - Serapan lemah dan tajam dari C≡C di daerah 2150 cm-1-1. 6. Gugus nitro
Dua serapan yang kuat di daerah 1600-1500 cm-1 dan 1390-1300 cm-1. 7. Hidrokarbon
- Apabila keenam serapan di atas tidak ada.
- Serapan C-H alifatis di daerah sebelah kanan 3000 cm-1 (yaitu 2925 cm-1 dan 2850 cm-1).
- Serapan yang sangat sederhana di daerah 1450 cm-1 (CH2) dan 1375 cm-1 (CH3).