1
Hidrogenasi Elektrokimia Minyak Nabati
Oktivani
1, Tedi Hudaya
1, dan Tatang Hernas Soerawidjaja
2*1Laboratorium Rekayasa Reaksi Kimia dan Pemisahan Jurusan Teknik Kimia, Fakultas Teknologi Industri, Universitas Katolik Parahyangan
Jln Ciumbuleuit 94, Bandung 40141Telp/Fax : (022)-2032700, email : t_hudaya@yahoo.com.au 2* Program Studi Teknik Kimia, Fakultas Teknologi Industri, Institut Teknologi Bandung,
Jln Ganesha 10, Bandung 40132
Email : tatanghs@che.itb.ac.id, hstatang@yahoo.com Abstrak
Biodiesel yang dibuat dari minyak nabati berkadar asam lemak tak jenuh ganda tinggi (> 15%) umumnya memiliki kestabilan termal dan oksidatif yang rendah. Penelitian ini bertujuan meningkatkan kestabilan oksidatif dan termal minyak nabatidengan hidrogenasi elektrokimia, untuk menjenuhkan parsial gugus tak jenuh ganda menjadi gugus tak jenuh tunggal. Hidrogenasi elektrokimia dilangsungkan menggunakan reaktor hidrogenasi yang beranoda stainless steel dan katodanya adalah nickel screen yang dibentuk seperti raschig ring. Hidrogenasi dilakukan pada minyak kedelai dan minyak kemiri sunan (Reutalis trisprema) sehingga angka iodiumnya turun, dari nilai masing-masing 119,5 dan 120,1, sampai ke sekitar 85 (yaitu angka iodium asam oleat). Penelitian menyelidiki pengaruh variasi konsentrasi larutan elektrolit kalium format (2,5 ; 5; 7,5; 10 M) dengan pengambilan sampel pada 6 dan 12 jam waktu reaksi. Penurunan angka iodium hingga mendekati angka iodium asam oleat dicapai dengan waktu reaksi 5,2 jam dengan konsentrasi 7,5 M KCOOH; angka iodium akhir dari minyak kedelai dan minyak kemiri sunan hasil hidrogenasi adalah masing-masing 78,6 dan 78,7. Hasil-hasil ini menunjukkan bahwa metode hidrogenasi elektrokimia memang potensial untuk dapat diterapkan dengan baik untuk menurunkan angka iodium minyak kedelai dan minyak kemiri sunan.
Kata Kunci : hidrogenasi elektrokimia, kalium format, ikatan tak jenuh ganda, biodiesel, angka iodium
Abstract
Biodiesels made from fatty oils containing high amounts of polyunsaturated fatty acids (>15%) usually have a low oxidative and thermal stability. This research aims to improve the oxidative and thermal stability of vegetable oils through electrochemical hydrogenation which partially saturates the polyunsaturated groups into monounsaturated ones.The electrochemical hydrogenation reactor utilized a stainless steel spring as anode and bundles of raschig rings (made from nickel screen) as cathode. Hydrogenation was carried out to decrease the iodine values of soybean oil (initally 119.5) Reutealis trisperma oil (initially 120.07) down to that of oleic acid ( around 85). This research in particular investigated the effect of the variation in KCOOH electrolyte concentrations (2,5 M; 5 M; 7,5 M; 10 M). The oil sample was taken after 6 and 12 hours of reaction.At an electrolyte concentration of 7.5 M KCOOH, the iodine values of the hydrogenated oilsapproached oleic acid iodine value after 5,2 hours reaction time. The final iodine value is 78.6 for soybean oiland 78.7 for Reutealis oil. These results indicate that electrochemical hydrogenation is a potential low temperature low pressure method to decrease the iodine values of soy bean and Reutealis trisperma oils. .
Keywords : electrochemical hydrogenation, potassium formate, polyunsaturated, biodiesel, iodine
value
Pendahuluan
Minyak nabati adalah salah satu sumber daya alam yang banyak digunakan baik untuk konsumsi (dalam
bidang pangan) maupun sebagai bahan baku industri. Selain untuk menghasilkan berbagai bahan kimia (seperti asam-asam lemak, alkohol, gliserol, dsb),
2 dewasa ini minyak nabati juga mulai dimanfaatkan sebagai bahan baku pembuatan biodiesel. Alternatif pemanfaatan minyak nabati sebagai biodiesel sangat penting mengingat telah menipisnya bahan bakar fosil yang selama ini dimanfaatkan sebagai energi utama dunia. Berbagai eksperimen telah dan masih dilakukan untuk mengembangkan minyak nabati ke arah yang lebih baik lagi.
Biodiesel adalah bahan bakar mesin/motor diesel yang terdiri atas ester alkil dari asam-asam lemak. (Soerawidjaja, 2006). Pembuatan biodiesel dari minyak nabati dilakukan dengan proses transesterifikasi. Pada proses ini minyak nabati direaksikan dengan metanol pada keberadaan katalis kalium hidroksida. Reaksi transesterifikasi ini akan menghasilkan biodiesel (FAME) dengan gliserin. Sifat fisik biodiesel yang dihasilkan bergantung dari struktur alkil asam lemak penyusunnya.
Minyak nabati merupakan bahan alam yang terdiri dari campuran trigliserida (ester dari gliserol dan tiga gugus asam lemak). Minyak nabati (misal minyak kedelai, kemiri, dsb) mengandung asam lemak tidak jenuh ganda dengan komposisi yang cukup besar. Ikatan tak jenuh ini akan mempengaruhi kualitas dari biodiesel yang dihasilkan dari reaksi transesterifikasi, seperti rendahnya stabilitas oksidasi dan termal, peningkatan korosifitas bahan bakar, serta penyumbatan saluran injeksi bahan bakar.
Untuk meningkatkan kestabilan oksidatif dan termal minyak nabati dapat dilakukan dengan hidrogenasi. Hidrogenasi melibatkan hidrogen untuk membuat ikatan tak jenuh asam lemak menjadi ikatan jenuh. Hidrogenasi dapat dilakukan secara katalitik dan elektrokimia (F.Beck, 1979). Metode hidrogenasi elektrokimia memiliki keunggulan lebih efisien dalam penggunaan energi karena dapat dilakukan pada sekitar temperatur dan tekanan ruang. Metode hidrogenasi yang digunakan adalah hidrogenasi elektrokimia dengan luas permukaan konduktif katalis yang besar. Oleh karena itu, penelitian ini bertujuan untuk meningkatkan kestabilan oksidatif pada beberapa minyak nabati dengan proses hidrogenasi elektrokimia.
Landasan Teori
Minyak nabati berasal dari tumbuh-tumbuhan dan memiliki bermacam jenis asam lemak bergantung dari sumbernya, contoh minyak kelapa, minyak kelapa sawit, minyak kedelai, minyak kemiri, dan berbagai jenis lainnya.Di dalam minyak nabati tidak hanya terkandung asam lemak tak jenuh saja, tetapi terkandung pula asam lemak jenuh namun dengan komposisi yang umumnya lebih sedikit daripada asam lemak tak jenuh.
Asam lemak tak jenuh ganda merupakan asam lemak yang memiliki lebih dari satu ikatan rangkap dalam struktur ikatannya.Contoh asam lemak yang termasuk dalam asam lemak tak jenuh ganda adalah asam linoleat dan asam linolenat. Asam linoeat
memiliki dua buah ikatan rangkap sedangkan asam linoleat memiliki tiga ikatan rangkap dua (Fessenden, 1997).
Pada minyak kemiri sunan, terdapat komposisi asam α-eleostearat yang cukup tinggi. Menurut InfoTek Perkebunan (2009), adanya komposisi asam α-eleostearat yang cukup tinggi menyebabkan biji kemiri sunan beracun dan berbahaya untuk dikonsumsi oleh manusia.Struktur dari asam α-eleostearat ditunjukkan pada Gambar 1.Asam α-eleostearat merupakan asam linolenat terkonjugasi dimana memiliki tiga ikatan ganda konjugasi dalam struktur molekulnya. Asam α-eleostearat memiliki nama IUPAC yaitu asam cis-9,11,13-oktadekatrienoat. Asam lemak tak jenuh ganda terkonjugasi sendiri merupakan asam lemak tak jenuh ganda yang dipisahkan oleh satu ikatan tunggal. Ikatan asam lemak terkonjugasi ini sangat mudah mengalami proses oksidasi. Asam lemak dengan ikatan rangkap memiliki kecepatan oksidasi yang jauh lebih cepat daripada asam lemak jenuh. Semakin banyak ikatan rangkap yang terdapat dalam suatu struktur maka akan semakin cepat pula kecepatan oksidasinya. Perbandingan kecepatan oksidasi oleat (C18:1) terhadap asam linoleat (C18:2) dan asam linolenat (C18:3) adalah sebesar 1:10:20 (White and Miller, 1988). Untuk meningkatkan kestabilan oksidatif asam lemak dapat dilakukan hidrogenasi secara elektrokimia.
Gambar 1. Struktur Molekul Asam α-eleostearat
Hidrogenasi elektrokimia merupakan hidrogenasi yang dilakukan dalam sel elektrokimia dimana sumber hidrogen diperoleh dari reduksi air atau mediator dalam larutan elektrolit pada permukaan katoda. (Mondal & Lalvani, 2003). Hidrogen umumnya didapat dari reduksi molekul air pada larutan elektrolit, namun dapat juga diperoleh dari reduksi senyawa mediator lain dalam elektrolit seperti ion format. Ion format akan bereaksi dengan minyak lemak dan mereduksi ikatan rangkap di dalamnya pada permukaan katalis, dengan reaksi :
HCOO- +oil +H2O oil-H2 + HCO3- (1) HCO3- +2H++ 2e- HCOO- +H2O (2) Ion format yang telah bereaksi dengan minyak lemak akan membentuk ion bikarbonat. Ion bikarbonat ini akan mengalami reduksi secara elektrokimia pada
3 bagian katoda dan menghasilkan kembali ion format untuk bereaksi kembali dengan minyak lemak tak jenuh.
Selain itu, pada katoda dapat terjadi pula reduksi proton yang menghasilkan gas hidrogen (namun hal ini mesti dihindari atau diminimalkan agar bahaya ledakan dapat diminimalisasi) :
2H+ +2e- H2
Di lain pihak, pada anoda terjadi reaksi pembentukan gas oksigen dari molekul air (Mondal & Lalvani, 2003).
H2O 1/2 O2 + 2H +
+2e-
Reaksi hidrogenasi berlangsung pada permukaan katalis sehingga permukaan katalis yang lebih luas akan dapat mempengaruhi laju reaksi. Semakin besar luas permukaan katalis, maka semakin banyak reaktan yang dapat bereaksi, atau dengan kata lain didapatkan semakin besar penurunan angka iodium dari minyak lemak.
Penelitian ini bertujuan untuk mengetahui seberapa jauh penurunan angka iodium minyak dengan penggunaan metode hidrogenasi elektrokimia, untuk mencapai angka iodium asam oleat yaitu sekitar 85. Metodologi
Bahan yang digunakan pada penelitian adalah minyak kedelai dan minyak kemiri sunan, metanol sebagai pelarut, kalium format (KCOOH) sebagai mediator reaksi hidrogenasi, larutan Wijs sebagai reagen dalam analisa angka iodium, larutan KI 20% sebagai penentu senyawa halogen yang dibebaskan dalam uji Wijs, kloroform sebagai pelarut sampel minyak untuk analisis, larutan natrium tiosulfat (Na2S2O3) sebagai larutan untuk titrasi dalam uji Wijs, dan larutan pati sebagai indikator titrasi.
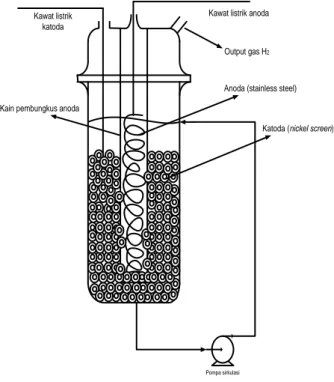
Penelitian dilakukan pada sel elektrokimia seperti ditunjukan pada Gambar 2. Sel elektrokimia terdiri dari katoda yang berupa nickel screen yang dibentuk
packing raschig ring yang disusun seperti packed bed reactor (Gambar 3), anoda berupa per stainless steel
dibungkus kain dan diletakkan di tengah reaktor, dan catu daya sebagai sumber tegangan arus searah (DC).
Penelitian dilakukan dalam percobaan pendahuluan dan percobaan utama.Percobaan pendahuluan dilakukan dengan penentuan tegangan kerja optimum pada sel elektrokimia, yaitu nilai tegangan dimana arus yang dihasilkan mulai konstan. Selain itu, percobaan awal hidrogenasi dilakukan pada minyak kedelai yang telah dimurnikan untuk memastikan alat telah berfungsi dengan baik sebelum diaplikasikan pada minyak kemiri sunan.
Percobaan utama dilakukan dengan menghidrogenasi minyak kemiri sunan dengan variasi konsentrasi larutan KCOOH (2,5 M; 5M; 7,5 M; 10 M) dan variasi waktu tempuh operasi (6 dan 12 jam).
Kawat listrik katoda
Kawat listrik anoda
Output gas H2
Pompa sirkulasi
Anoda (stainless steel)
Katoda (nickel screen) Kain pembungkus anoda
Gambar 2. Skema sel elektrokimia
Gambar 3. Katoda nickel screen berbentuk raschig
ring
Untuk analisa, sampel diambil dari reaktor hidrogenasi lalu ditambahkan aqua dm untuk memisahkan fasa minyak dan larutan.Selanjutnya, menggunakan corong pisah dilakukan pemisahan minyak dengan fasa akuatik. Minyak hasil pemisahan dengan corong pisah dimasukkan pada oven suhu 600C selama 1-2 jam lalu dimasukkan eksikator berisi Na2SO4. Pemisahan dilakukan uji Wijs terhadap menentukan perubahan angka iodium menggunakan prosedur AOCS Cd 1-25.
Hasil dan Pembahasan
Penentuan Tegangan Kerja. Tegangan kerja optimum ditentukan untuk mengetahui daerah tegangan operasi sel. Tegangan optimum yang digunakan adalah tegangan dimana kenaikan besarnya
4 voltase tidak mempengaruhi lagi besarnya arus listrik yang mengalir pada sel elektrokimia.Untuk mengetahui daerah tegangan kerja diperlukan pengamatan terhadap besarnya perubahan voltase dan perubahan arus yang mengalir pada sel. Hubungan antara perubahan voltase terhadap perubahan arus yang mengalir ditunjukkan pada Gambar 4.
Gambar 4. Hubungan antara perubahan voltase dan arus yang mengalir
Penentuan tegangan kerja optimum ini diambil pada rentang voltase yang tidak mengalami kenaikan arus listrik secara signifikan yaitu berada pada rentang 11,5-12,5 V. Oleh karena itu, dipilih tegangan kerja (operasi) sebesar 12 V.
Pada tegangan kerja optimum yang diambil yaitu 12 V, hasil pengamatan terhadap gelembung gas setelah melalui rentang arus konstan, kenaikan tegangan terus memperbesar arus yang ditandai dengan pelepasan gelembung gas H2 yang sangat cepat. Pada fase ini, tahanan perpindahan massa jauh berkurang karena jumlah gelembung gas yang menempel di permukaan katoda telah minimal. Kenaikan tegangan selanjutnya diduga karena laju perpindahan ion yang telah maksimum dan menjadi faktor pembatas adanya gelembung gas yang terlepas pada fasa curah cairan. Gelembung gas yang terlepas pada fasa curah sangat sedikit tetapi masih terdapat cukup banyak gelembung-gelembung kecil yang menempel pada permukaan katoda, hal ini menandakan bahwa sel masih dapat berjalan dengan baik pada tegangan yang diambil walaupun masih belum cukup efektif akibat tahanan perpindahan massa reaktan ke permukaan katoda.
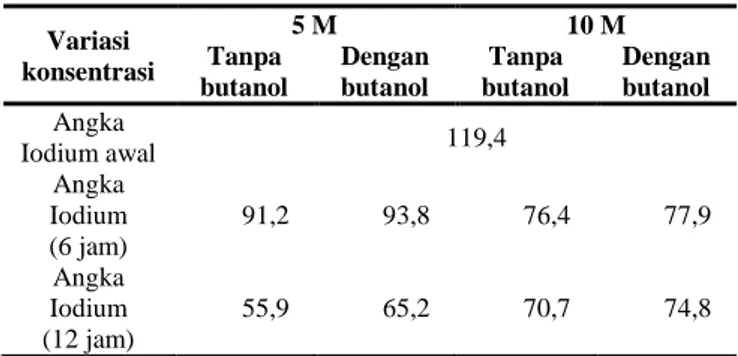
Pengaruh Penggunaan Emulsifier Terhadap Penurunan Angka Iodium Minyak Kedelai. Penggunaan emulsifier pada percobaan dilakukan untuk menghomogenkan fasa yang terlibat pada campuran larutan elektrolit dan minyak, dengan penambahan 1%-v butanol ke dalam campuran.
Tabel 1. Perbandingan Hasil Percobaan Dengan dan Tanpa Penggunaan Emulsifier
Variasi konsentrasi 5 M 10 M Tanpa butanol Dengan butanol Tanpa butanol Dengan butanol Angka Iodium awal 119,4 Angka Iodium (6 jam) 91,2 93,8 76,4 77,9 Angka Iodium (12 jam) 55,9 65,2 70,7 74,8
Dari hasil Tabel 1, percobaan tanpa menggunakan
emulsifier (butanol) memiliki angka iodium yang lebih
kecil daripada penggunaan emulsifier. Hal ini menunjukan bahwa reaksi berlangsung lebih efektif tanpa penggunaan emulsifier. Hal ini dapat disebabkan larutan elektrolit yang digunakan lebih banyak dari pada minyak. Selain itu, sistem sirkulasi menggunakan pompa dalam aplikasinya lebih cocok tanpa penggunaan emulsifier. Kemungkinan yang terjadi adalah penggunaan emulsifier menyebabkan kontak antara minyak pada katoda berlangsung tidak maksimal karena pengaruh emulsifier yang menyebabkan minyak dan larutan elektrolit hampir terdistribusi pada satu fasa yang sama, sehingga larutan elektrolit akan ikut membawa minyak pada proses sirkulasi tersebut dan menyebabkan waktu kontak minyak dengan katoda lebih sedikit dan hidrogenasi berjalan tidak maksimal.
Pengaruh Konsentrasi Larutan Elektrolit Terhadap Perubahan Angka Iodium Minyak Kedelai. Pada percobaan digunakan KCOOH sebagai larutan elektrolit yang bertindak pula sebagai mediator reaksi hidrogenasi. Konsentrasi KCOOH yang terlibat akan mempengaruhi reaksi hidrogenasi yang terlibat dalam sel elektrokimia. Pengaruh besarnya konsentrasi larutan elektrolit terhadap perubahan angka iodium minyak kedelai ditunjukkan pada Tabel 2.
Tabel 2. Perbandingan Konsentrasi Larutan Elektrolit Terhadap Perubahan Angka Iodium Minyak Kedelai
Makin besar konsentrasi KCOOH yang digunakan maka penurunan angka iodium minyak makin kecil (untuk reaksi selama 12 jam). Hal ini terlihat dari hasil angka iodium minyak pada sampel jam ke-12 untuk konsentrasi 2,5 dan 5 M memiliki angka iodium yang lebih kecil daripada konsentrasi 7,5 dan 10 M. Hal ini 0 0,5 1 1,5 2 2,5 0 5 10 15 20 I ( Amp ere ) Voltase (V) Konsentrasi 2,5 M 5 M 7,5 M 10 M Angka Iodium (6 jam) 89,5 91,6 78,6 76,4 Angka Iodium (12 jam) 57,7 55,9 71,3 70,7
5 menunjukkan bahwa penggunaan konsentrasi di atas 5 M tidak memberikan penurunan angka iodium yang lebih efektif, melainkan sebaliknya. Menurut Lalvani (2008), penggunaan konsentrasi elektrolit berlebihan menyebabkan semakin banyak sisi yang tertutupi dan tidak memberikan ruang yang cukup untuk asam lemak tak jenuh sehingga penurunan angka iodium berkurang.
Tetapi jika melihat hasil pengamatan seluruh sampel pada jam ke-6, makin besar konsentrasi KCOOH maka makin besar pula penurunan angka iodium minyak. Hal ini disebabkan karena konsentrasi KCOOH yang tersedia sebagai mediator untuk mengadisi ikatan tak jenuh makin banyak seiring dengan makin besar konsentrasi. Penurunan angka iodium lebih cepat karena makin banyak mediator yang tersedia maka makin banyak ikatan yang teradisi. Hal ini ditunjukkan dari perubahan angka iodium dari 5 M ke 7,5 M yang signifikan. Namun, penggunaan konsentrasi 10 M tidak cukup efektif dalam proses hidrogenasi karena tidak lagi menurunkan angka iodium minyak secara signifikan.
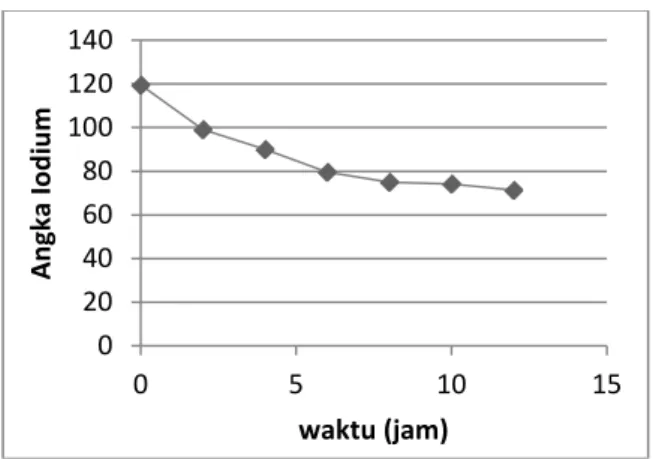
Dari hasil percobaan tersebut, dapat disimpulkan bahwa untuk mendapatkan angka iodium sekitar asam oleat yaitu 85 hanya membutuhkan waktu reaksi kurang dari 6 jam untuk konsentrasi 7,5 M dan 10 M, tetapi untuk konsentrasi 2,5 dan 5 M membutuhkan waktu antara 6-12 jam. Dilakukan pengamatan tambahan dimana sampel minyak diambil setiap 2 jam untuk konsentrasi larutan 7,5 M yang dianggap paling efektif dalam penurunan angka iodium. Berikut hasil pengamatan yang ditunjukan pada Gambar 5.
Gambar 5. Perubahan angka iodium minyak kedelai terhadap waktu
Dari Gambar 5 menunjukkan bahwa makin lama waktu reaksi maka makin besar pula penurunan angka iodium minyak. Profil perubahan besarnya angka iodium minyak sehingga dapat disimpulkan bahwa untuk mendapatkan angka iodium minyak sekitar 85 diperkirakan dengan bantuan grafik membutuhkan 5,2 jam.
Pengaruh Perbedaan Konsentrasi Larutan KCOOH Terhadap Penurunan Angka Iodium Minyak Kemiri Sunan. Percobaan ini dilakukan dengan variasi yang sama dengan perlakuan terhadap minyak kedelai pada percobaan pendahuluan. Hal ini dilakukan untuk mengamati reaksi hidrogenasi terhadap perubahan jenis minyak yang digunakan. Hasil pengamatan dilakukan terhadap perubahan angka iodium minyak kemiri sunan yang awalnya sebesar 120,1 ditunjukkan pada Tabel 3.
Tabel 3. Perbandingan Konsentrasi Larutan Elektrolit Terhadap Perubahan Angka Iodium Minyak Kemiri Sunan
Dari hasil pengamatan, perubahan konsentrasi KCOOH memberikan pengaruh signifikan terhadap penurunan angka iodium minyak seperti pada percobaan dengan minyak kedelai.Semakin besar konsentrasi elektrolit maka semakin besar penurunan angka iodium minyak sampai dengan konsentrasi 5 M. Di atas konsentrasi 5 M tidak terjadi perubahan angka iodium yang signifikan, justru sebaliknya cenderung mengalami kenaikan angka iodium. Hal ini disebabkan karena di atas konsentrasi 5 M, jumlah mediator yang terlibat terlalu banyak sehingga menghambat proses hidrogenasi seperti yang telah dijelaskan sebelumnya.
Dari hasil penelitian di Tabel 2 dan 3 dapat disimpulkan bahwa penggunaan konsentrasi larutan elektrolit yang terlalu kecil (2,5 M), laju awal hidrogenasi berlangsung lambat tetapi setelah 12 jam justru lebih efektif. Hal ini disebabkan karena pengaruh konsentrasi yang terlalu kecil sehingga pada awal reaksi tidak banyak ion format yang terlibat pada reaksi. Untuk penggunaan konsentrasi larutan elektrolit yang terlalu besar (7,5 M dan 10 M), laju awal hidrogenasi realtif cepat (kecuali data 10 M pada Tabel 3) tetapi dalam rentang waktu yang lama justru tidak efektif. Hal ini dikarenakan adanya efek
‘blocking’ di permukaan elektrode sehingga menghambat hidrogenasi minyak.
Hasil penelitian di Tabel 2 dan 3 menunjukkan bahwa perlakuan hidrogenasi elektrokimia efektif untuk menurunkan angka iodium minyak kedelai dan minyak kemiri sunan. Minyak kedelai yang digunakan berasal dari minyak kedelai murni yang komersil dan siap untuk digunakan konsumen.Sedangkan minyak kemiri sunan yang digunakan berasal dari daerah pengembangan tanaman kemiri sunan yang didapat dari pengepresan biji kemiri sunan (crude oil). Hal ini akan memudahkan bagi petani minyak kemiri sunan 0 20 40 60 80 100 120 140 0 5 10 15 An gk a I od iu m waktu (jam) Konsentrasi 2,5 M 5 M 7,5 M 10 M Angka Iodium (6 jam) 94,8 61,2 78,7 94,2 Angka Iodium (12 jam) 61,5 55 54 73,7
6 untuk menghidrogenasi minyak kemiri sunan sebagai bahan baku biodiesel tanpa harus melakukan perlakuan awal terhadap minyak terlebih dahulu.
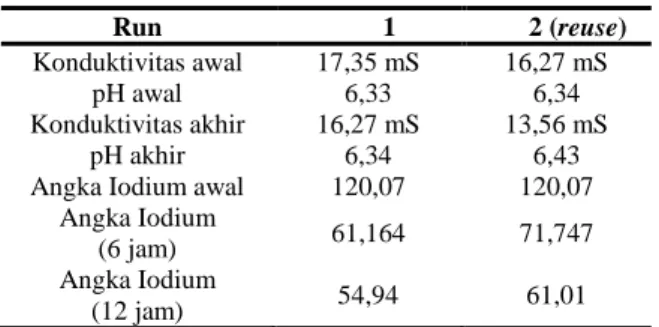
Pengaruh Reuse Larutan Elektrolit Terhadap Perubahan Angka Iodium Minyak. Penggunaan ulang dari larutan elektrolit dilakukan sebagai pengamatan tambahan karena sifat dari ion format sebagai mediator proses hidrogenasi yang dapat mengalami recycle. Penggunaan ulang larutan elektrolit ini dilakukan dengan mengambil terlebih dahulu larutan elektrolit pada penggunaan awal setelah dipisahkan dari minyak yang dihidrogenasi. Selanjutnya, larutan elektrolit yang telah dipisahkan tersebut dicampurkan dengan minyak baru lalu dihidrogenasi pada sel elektrokimia.
Tabel 4. Perbandingan Hasil Penggunaan Ulang Larutan Elektrolit pada Hidrogenasi Minyak Kemiri Sunan (Konsentrasi 5 M KCOOH) Run 1 2 (reuse) Konduktivitas awal 17,35 mS 16,27 mS pH awal 6,33 6,34 Konduktivitas akhir 16,27 mS 13,56 mS pH akhir 6,34 6,43
Angka Iodium awal 120,07 120,07
Angka Iodium
(6 jam) 61,164 71,747
Angka Iodium
(12 jam) 54,94 61,01
Dari hasil pengamatan pada Tabel 4, dapat disimpulkan bahwa penggunaan ulang larutan elektrolit dapat dilakukan walaupun tidak sepenuhnya memiliki kemampuan hidrogenasi sebaik larutan elektrolit pertama kali digunakan. Hal ini ditunjukan pada penurunan angka iodium minyak yang lebih kecil dengan penggunaan ulang larutan elektrolit. Selain itu, terjadi penurunan konduktivitas akhir yang menunjukkan larutan elektrolit berkurang akibat proses pemisahan minyak dari campuran elektrolit. Pengamatan serupa akibat berkurangnya jumlah mediator yang hilang selama proses pemisahan dengan minyak juga dilaporkan oleh Xiao (2010). Kesimpulan
Reaksi hidrogenasi elektrokimia dengan katoda berupa nickelscreen yang dibentuk raschig ring, anoda per stainless steel, dan mediator reaksi KCOOH dapat diterapkan dengan baik pada minyak kedelai dan minyak kemiri sunan tanpa penggunaan emulsifier pada campuran elektrolit dan minyak. Metode ini memberikan penurunan angka iodium terbesar minyak kemiri sunan hingga mencapai 54 dari 120,1 dengan penggunaan larutan KCOOH 7,5 M selama 12 jam. Untuk hidrogenasi elektrokimia minyak kedelai penggunaan konsentrasi KCOOH diatas 7,5 M tidak efektif, sedangkan untuk minyak kemiri sunan konsentrasi di atas 5 M penggunaannya tidak efektif
terhadap penurunan angka iodium minyak. Penurunan angka iodium dengan konsentrasi KCOOH 7,5 M hingga mencapai asam oleat (sekitar 85) dapat dilakukan sekitar 6 jam untuk kemiri sunan, bahkan lebih singkat untuk minyak kedelai (5,2 jam). Studi tambahan mengenai penggunaan ulang larutan elektrolit dapat dilakukan untuk menghemat penggunaan KCOOH, asalkan diperoleh kinerja yang tidak berbeda jauh dengan larutan elektrolit awal. Daftar Notasi
A = Ampere mS = mili Siemens V = Volt
Daftar Pustaka
F.Beck, 1979. Electrochemical and Catalytic Hydrogenation : Common Features and Differences.
International Chemical Engineering.
Fessenden. 1997. Kimia Organik. Penerbit Erlangga. Haiyi Xiao, H. J. K., David B. Min, Shashi B. Lalvani, 2010. High Oleic and Low Trans Fatty Acid Formation by an Electrochemical Process. American
Oil Chemistry Society.
Mondal, K. and S. Lalvani, 2003. Electrochemical Hydrogenation of Canola Oil Using a Hydrogen Transfer Agent. Journal of American Oil Chemists'
Society,8(11).
Mondal, K. and S. Lalvani, 2003. Mediator-assisted Electrochemical Hydrogenation of Soybean Oil.
Chemical Engineering Science,58, 2643-2656.
Mondal, K. and S. Lalvani, 2008. Low Temperature Soybean Oil Hydrogenation by An Electrochemical Process. Journal of Food Engineering,89, 526-533. Soerawidjaja, Tatang H, 2006. “Fondasi-Fondasi
Ilmiah dan Keteknikan dari Teknologi Pembuatan Biodiesel”. Handout Seminar Nasional “Biodiesel
Sebagai Energi Alternatif Masa Depan” UGM Yogyakarta.
Tahunan, D. B. T. and D. J. Perkebunan, 2009. Kemiri Sunan (Reutalistrisperma Blanco/Airy Show) Penghasil Biodiesel dan Konservasi.
White, P. J. and L. A. Miller, 1988.Oxidative stabilities of low-linolenate, high stearate and common soybean oils. Journal of American Oil Chemists'