Pemodelan Molekul Turunan p-Metoksi sinnamoil Hidrazida
Sebagai Inhibitor Checkpoint Kinase 1 dan Inhibitor
Aromatase secara In silico
Molecular modelling and in silico analysis of p-methoxy
cinnamoyl hydrazide analogues as Checkpoint Kinase-1 and
aromatase inhibitors
Galih Satrio Putra
1*, Melanny Ika Sulistyowatya
1,
Juni Ekowati
1, Tutuk Budiati
11Faculty of Pharmacy, Universitas Airlangga, Surabaya, Indonesia
Email : [email protected]; *corresponding author
Abstrak
Pengembangan obat antikanker dari derivat Etil-p-metoksi Sinamat (EPMS) terus dilakukan untuk memperoleh senyawa yang memiliki level apoptosis sel kanker yang tinggi dengan efek samping yang minimal. Senyawa turunan p-Metoksisinnamoil hidrazida yang diperoleh dari modifikasi struktur dari EPMS ditambatkan dengan enzim Check Point Kinase 1 (2YWP) dan enzim Aromatase (3S7S) dengan menggunakan software Molegro Virtual Docker (MVD) Ver.5.5. Parameter penambatan yang digunakan yaitu nilai Rerank score native ligand dibandingkan dengan rerank score senyawa turunan p-Metoksisinnamoil hidrazida. Senyawa 4b dan 4c memiliki nilai rerank score -99,98 kkal/mol dan -99,80 kkal/mol yang lebih rendah dari native ligand A42 dalam menghambat enzim check point kinase 1. Senyawa turunan p-Metoksisinnamoil hidrazida memiliki nilai rerank score yang lebih besar dibandingkan native ligan EXM dalam menghambat enzim aromatase. Senyawa turunan p-Metoksisinnamoil hidrazida terutama senyawa 4b dan 4c memiliki mekanisme antikanker dengan jalur menghambat enzim check point kinase 1 dan tidak memiliki aktivitas dalam menghambat enzim aromatase.
Abstract
The development of anticancer drugs from ethyl p-methoxycinnamate (EPMC) derivatives has been done to compounds high activity in inducing cancer cells apoptosis and minimal side effects. p-Methoxycinnamoyl hydrazide derivates, modified from EPMC structure, were docked into the ligand-binding pocket of Check point kinase 1 enzymes (2YWP) and the aromatase enzyme (3S7S) using software Molegro Virtual Docker (MVD) Ver.5.5. We compared the Rerank score of native ligand with p-Methoxycinnamoyl hydrazide derivates. Rerank scores of compounds 4b and 4c (-99.98 Kcal/mol and -99.80 Kcal/mol) were lower than the native ligand A42 in inhibiting the enzyme checkpoint kinase 1. Rerank values of p-Methoxycinnamoyl hydrazide derivate compounds were greater than the native ligand EXM in inhibiting the enzyme aromatase. p-Methoxycinnamoyl hydrazide derivate compounds, especially compounds 4b and 4c, had anticancer mechanism by inhibiting the checkpoint kinase 1 enzyme pathway and showed no activity in inhibiting the aromatase enzyme.
PENDAHULUAN
Kanker adalah ancaman terbesar bagi kesehatan manusia, baik di negara maju maupun berkembang. Menurut WHO (2014), kanker payudara menjadi kanker paling umum pada wanita dan penyebab kematian terbesar kedua setelah penyakit jantung di dunia. Fakta ini membuat banyak peneliti di dunia mencoba untuk mengembangkan obat antikanker yang selektif dengan sedikit efek samping.
Pada dekade ini dilaporkan bahwa Etil
p-metoksisinnamat (EPMS) sangat
prospektif dikembangkan sebagai obat antikanker. EPMS adalah senyawa utama yang terkandung dalam Kaempferia galanga Linn yang memiliki aktivitas hambatan enzim Cyclooxygenase-2 (COX-2) yang berkhasiat sebagai analgesik (Xiao et
al., 2006; Aroonrerk & Kamkaen, 2009).
Beberapa penelitian melaporkan bahwa aktivitas inhibisi COX-2 pada EPMS tidak hanya sebagai analgesik tetapi juga memiliki aktivitas antikanker melalui inhibisi proses angionegesis (Umar et al, 2014).
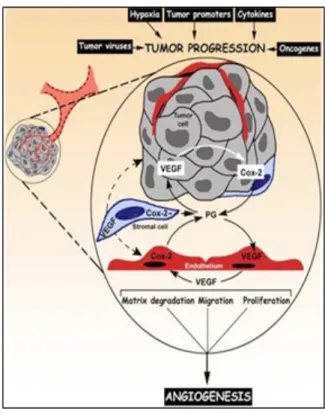
Mekanisme COX-2 pada proses angiogenesis (Gambar 1) yaitu dalam peningkatan PG (prostaglandin). Peningkatan PG akan memicu peningkatan VEGF (Vascular Endothelial
Growth Factor) yang merangsang sel endotel
pada pembuluh darah untuk membentuk vaskularisasi baru menuju sel kanker. Adanya vaskularisasi pada sel kanker menyebabkan nutrisi, oksigenasi dan kebutuhan selular
pada sel kanker terpenuhi lebih cepat yang berdampak pada pembelahan sel kanker menjadi tak terkendali. Hambatan selektif pada COX-2 diharapkan dapat menghambat pembentukan vaskularisasi sehingga dapat menekan pertumbuhan sel kanker (Iniguez et
al., 2003).
Gambar 1. Peran COX-2 pada proses angiogenesis (Iniguez et al., 2003)
Penelitian terbaru dilakukan dengan cara mensintesis derivat senyawa EPMS untuk meningkatkan aktivitasnya sebagai antikanker. Beberapa pengujian terhadap derivat EPMS memberikan hasil yang positif terhadap penghambatan pertumbuhan sel kanker pada jalur angiogenesis secara in silico dan in vitro dan in vivo studi yang berpotensi untuk diteliti lebih lanjut (Ekowati et al,2010 ; 2012; 2015).
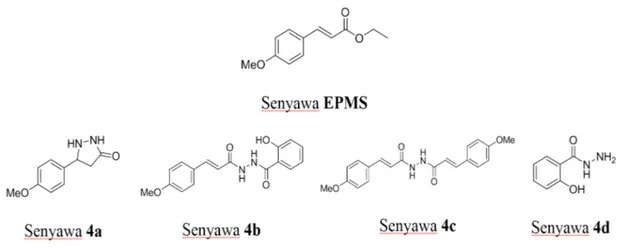
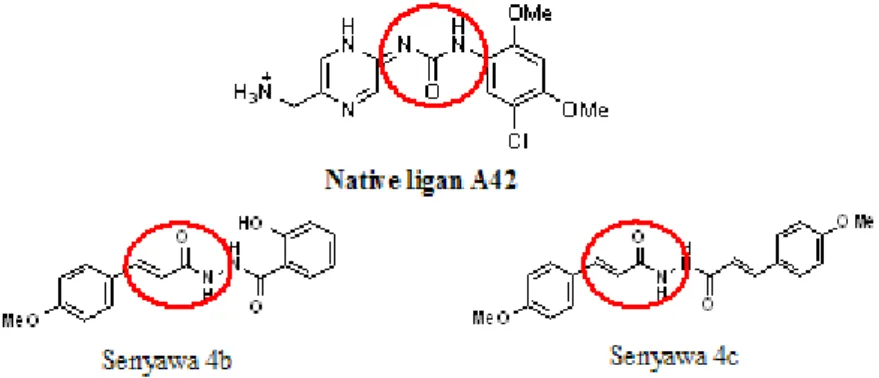
Pada penelitian sebelumnya, telah dilakukan modifikasi struktur EPMS menjadi senyawa turunan p-Metoksisinnamoil hidrazida
(Gambar 2) dan uji in silico dan in vitro aktivitas antikanker (Sulistyowaty et al., 2016). Hasil uji in silico senyawa 4c dengan reseptor COX-2 memberikan hasil nilai
rerank score yang lebih rendah dibandingkan
dengan celecoxib. Senyawa 4c berpotensi menghambat aktivitas enzim COX-2 sehingga menurunkan pertumbuhan sel kanker dengan mekanisme hambatan angiogensis (Clemente
et al., 2013; Basu et al., 2006) tetapi hasil
uji in vitro senyawa 4c menggunakan metode MTT assay pada sel T47D tidak menunjukkan penghambatan proses angiogenesis (Sulistyowaty et al., 2016). Beberapa penelitian melaporkan bahwa uji
in vitro untuk aktivitas antiangiogenesis
yang melibatkan hambatan enzim COX-2 berkolerasi linier dengan metode rat
aortic ring assay (Umar et al., 2014), Chick Chorioallantoic Membrane (CAM) Assay
(Ekowati et al., 2015; Hamid et al., 2013)
dan Matrigel Assay (Donovan et al., 2001). Hasil uji in vitro senyawa turunan
p-Metoksisinnamoil hidrazida menggunakan
metode MTT assay pada sel T47D menunjukkan aktivitas menghambat pertumbuhan sel T47D walaupun tidak sebaik doksorubisin (Sulistyowaty et al., 2016). Senyawa 4d memiliki nilai IC50 yang lebih kecil dibandingkan senyawa lainya yang menunjukan adanya mekanisme target reseptor lain yang bukan melalui jalur inhibisi enzim COX-2 dalam menghambat pertumbuhan sel kanker. Senyawa 4d adalah derivat hidrazida yang berpotensi menghambat pertumbuhan sel kanker dengan mekanisme hambatan enzim Thymidylate
synthase. Beberapa turunan senyawa aril
hidrazin dan hidrazida dilaporkan memiliki aktivitas yang besar dalam menghambat pertumbuhan breast cancer MCF-7 yang berkolerasi linier terhadap uji in silico pada inhibisi enzim Thymidylate synthase (Gohil
et al, 2009; Sweetman, 2009).
Gambar 2. Senyawa EPMS dan hasil modifikasi struktur EPMS menjadi senyawa turunan p-Metoksisinnamoil hidrazida (Sulistyowaty et al., 2016)
Gambar 3. Kemiripan struktur dalam menghambat enzim check point kinase 1
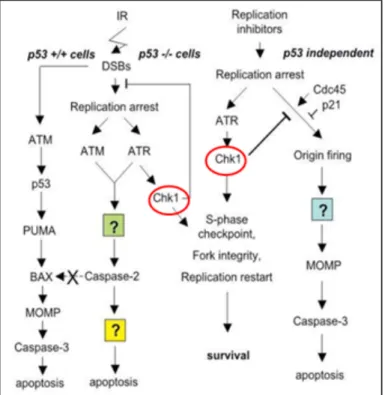
Checkpoint kinase 1 merupakan reseptor yang menjadi fokus para peneliti untuk pengembang obat antikanker selain pendekatan melalui penghambatan enzim COX-2. Checkpoint kinase 1 memiliki peran penting dalam respon selular (Gambar 4) terhadap gangguan replikasi DNA (Deoxyribonucleic Acid) pada sel kanker. Kerusakan DNA menyebabkan kematian sel secara terprogram (apoptosis). Adanya peningkatan ekspresi Checkpoint kinase
1 (Chk 1) menyebabkan hambatan proses apoptosis sehingga sel dengan DNA yang abnormal akan tetap hidup dan bereplikasi serta membentuk jaringan yang tumbuh dengan cepat menjadi sel kanker. Hambatan terhadap Checkpoint kinase diharapkan dapat menekan pertumbuhan sel kanker dengan cara meningkatkan apoptosis pada sel yang mengalami kerusakan DNA (Meuth, 2010; Ruswanto, 2013; Putra et al., 2016).
Gambar 4. Peran Chk1 terhadap proses apoptosis pada sel yang mengalami kerusakan DNA (Meuth, 2010)
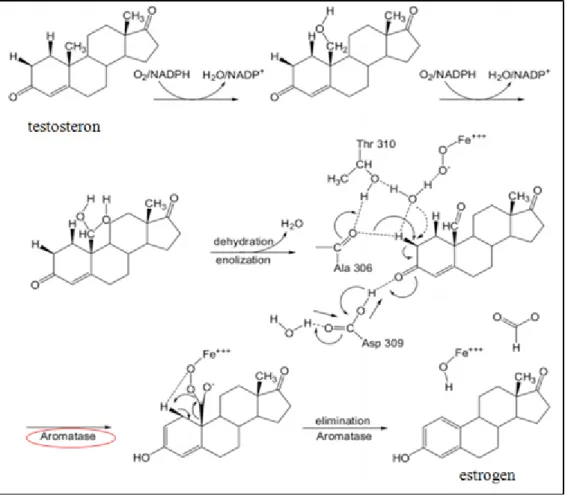
Reseptor target selain Checkpoint kinase 1, inhibisi terhadap enzim aromatase juga banyak diteliti. Enzim aromatase berperan dalam mengubah hormon testosteron menjadi hormon estrogen (Gambar 5). Terekspresinya aromatase yang berlebih di dalam tubuh menyebabkan meningkatnya hormon estrogen (Katzung, 2009). Meningkatnya hormon estrogen yang berlebih dapat memacu bertumbuhan dari sel payudara menjadi aktif dan tak terkendali sehingga menyebabkan terbentuknya sel kanker payudara. Inhibisi enzim aromatase menyebabkan terjadinya
penurunan kadar hormon estrogen sehingga dapat menghambat aktivitas pertumbuhan dan perkembangan sel kanker payudara (Suvannang et al., 2011; Dai et al., 2010; Winer at al., 2005; Wakeling at al., 2000). Penelitian ini difokuskan pada uji in silico senyawa turunan p-Metoksisinnamoil hidrazida sebagai inhibitor checkpoint kinase 1 dan inhibitor enzim aromatase untuk memprediksikan mekanisme dalam menghambat pertumbuhan dan perkembangan sel kanker.
Gambar 5. Peran aromatase dalam mengubah hormon testosteron menjadi hormon estrogen (Suvannang et al., 2011)
METODE
Alat yang digunakan yaitu laptop AMD A6 Vision dengan spesifikasi CPU @ 1.4 GHz, 4 GB of RAM, dan software Chembiodraw version 11, Molegro Virtual Docker (MVD) Ver.5.5.
Bahan yang digunakan Enzim Checkpoint kinase 1 dan aromatase diunduh dari protein data bank (http://www. rcsb. org/-pdb) dengan PDB ID : 2YWP (Fischer & Hubbard, 2011) dan 3S7S (Ghosh et al., 2012). Struktur senyawa p-Metoksisinnamoil hidrazida diperoleh dari hasil sintesis yang telah dianalisis dengan H-NMR, C-NMR dan MS dari penelitian sebelumnya (Sulistyowaty
et al, 2016).
Preparasi ligand molekul turunan
p-Metoksisinnamoil hidrazida dilakukan
dengan cara menggambar 2 Dimensi ligan pada software Chembiodraw version 11. Ligand 2 Dimensi dilakukan convert menjadi struktur ligand 3 Dimensi pada software Chembio3D version 11. Pada struktur ligan 3 Dimensi dilakukan perhitungan energi minimal yang paling stabil dengan kalkulasi MMFF94 dan ligan disimpan dengan tipe file MDL Molfile (.mol) (Sawy et al., 2015). Preparasi reseptor
Ligan pembanding dari reseptor Checkpoint kinase 1 yaitu A42 dan ligan pembanding pada reseptor aromatase yaitu EXM (exemestane) dari hasil kristalografi sinar-x. Unduhan PDB.file disimpan dalam bentuk
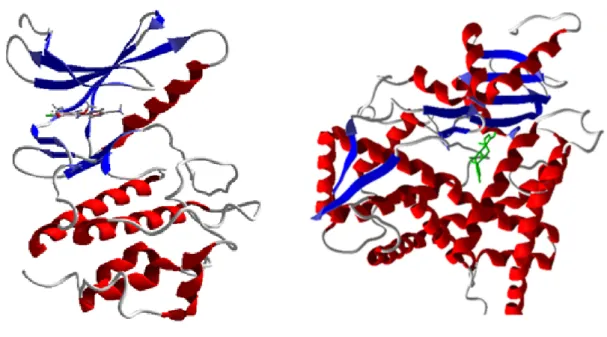
Gambar 6. Ribbon struktur dengan masing masing ligannya
file .mol untuk dilakukan penambatan ulang untuk menvalidasi software Molegro Virtual Docker (MVD) Ver.5.5. agar dapat digunakan untuk penambatan pada senyawa yang diteliti yaitu senyawa turunan p-Metoksisinnamoil hidrazida.
Senyawa turunan p-Metoksisinnamoil hidrazida ditambatkan pada sisi aktif kedua reseptor. Reseptor Checkpoint kinase 1 memiliki sisi aktif yang ditempati oleh native ligan A42 dengan volume sebesar 157.58 Å3
dan enzim aromatase memiliki sisi aktif yang ditempati oleh native ligan EXM dengan volume 96.26 Å3.
Penambatan senyawa uji terhadap reseptor dan visualisasi uji in silico
Penambatan dilakukan dengan native ligan dan senyawa turunan p-Metoksisinnamoil hidrazida dengan menggunakan software Molegro Virtual Docker (MVD) Ver.5.5. Hasil uji in silico yang diperoleh adalah rerank
score yang diinterpretasikan sebagai prediksi
interaksi ikatan antara obat dan reseptor.
Rerank score yang semakin kecil menunjukan
besarnya tingkat keserasian antara ligan dan reseptor untuk berinteraksi. Hasil uji in silico juga dapat divisualisasi dan diinterpretasikan untuk memberikan gambaran interaksi ikatan ligan dengan reseptor yang meliputi ikatan hidrogen, interaksi hidrofobik dan interaksi elektronik.
Validasi reseptor dan uji in silico
Validasi reseptor dilakukan dengan cara penambatan kembali native ligan A42 dengan reseptor Checkpoint kinase 1 dan native ligan
EXM dengan reseptor aromatase. Penambatan
kembali bertujuan untuk menvalidasi PBD file yang diunduh dan software yang digunakan sebagai metode penambatan untuk screening
virtual dari senyawa yang akan diteliti
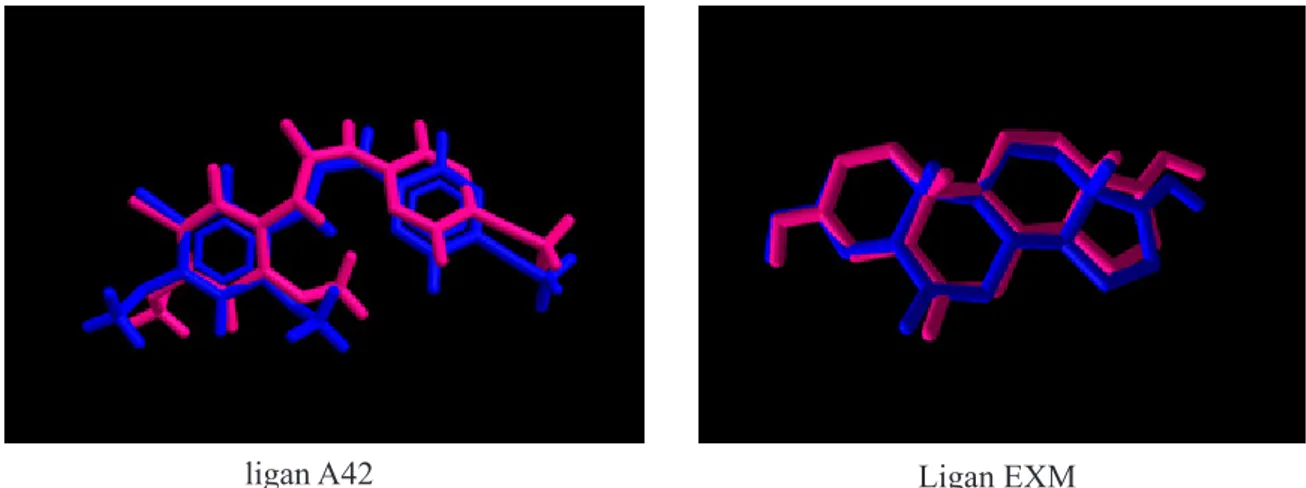
yaitu senyawa turunan p-Metoksisinnamoil hidrazida. Parameter penerimaan penambatan kembali adalah nilai Root Mean Square
ligan A42 Ligan EXM
Gambar 7. Perbandingan konformasi struktur kristalografi x-ray ligand (biru) dan hasil simulasi penambatan dengan software Molegro Virtual Docker (MVD)
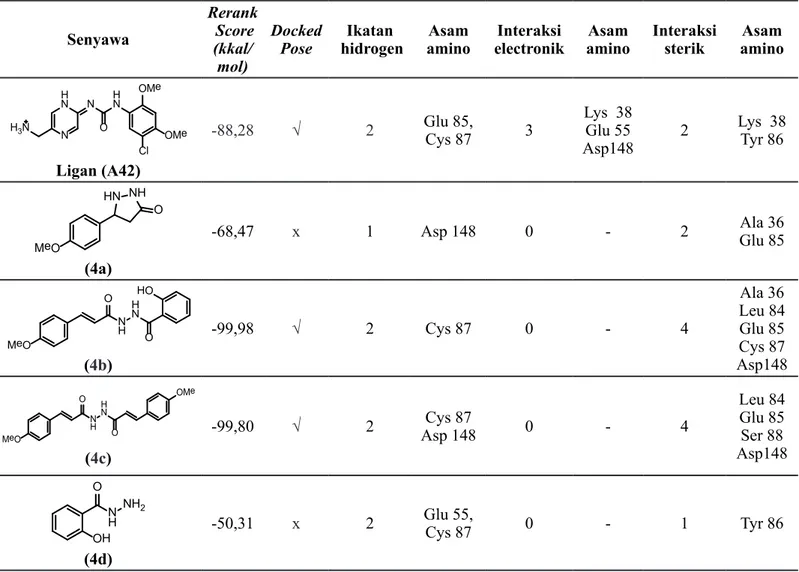
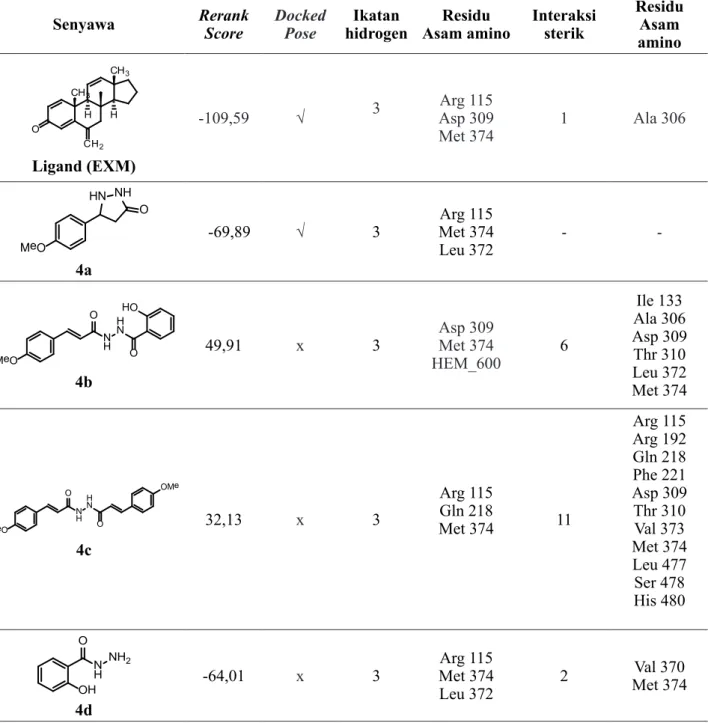
Tabel 1. Hasil penambatan senyawa turunan p-Metoksisinnamoil hidrazida dengan reseptor Checkpoint kinase 1 Senyawa Rerank Score (kkal/ mol) Docked
Pose hidrogenIkatan aminoAsam electronikInteraksi amino Asam Interaksi sterik amino Asam H N N H3N N O H N Cl OMe OMe Ligan (A42)
-88,28 √ 2 Glu 85, Cys 87 3 Lys 38Glu 55
Asp148 2 Lys 38 Tyr 86 MeO NH HN O (4a)
-68,47 x 1 Asp 148 0 - 2 Ala 36Glu 85
MeO N H H N O O HO (4b) -99,98 √ 2 Cys 87 0 - 4 Ala 36 Leu 84 Glu 85 Cys 87 Asp148 MeO N H H N O OMe O (4c) -99,80 √ 2 Asp 148Cys 87 0 - 4 Leu 84 Glu 85 Ser 88 Asp148 N H NH2 O OH (4d)
-50,31 x 2 Glu 55, Cys 87 0 - 1 Tyr 86
Ket : √ = menempati posisi sama seperti native ligan saat ditambatkan. Deviation (RMSD) < 2,0 Å. Nilai RMSD
menunjukan kesesuaian koordinat ligan dari hasil kristalografi dibandingkan dengan koordinat ligan yang ditambatkan ulang dengan software Molegro Virtual Docker (MVD) Ver.5.5 (Dai et al., 2010; Suvannang
et al., 2011; Ruswanto et al., 2013; Putra et al., 2016).
Nilai RMDS dari proses penambatan ulang pada ligan A42 dengan reseptor Checkpoint kinase 1 sebesar 0.96 Å. Nilai RMSD dari proses penambatan ulang ligan EXM dengan reseptor aromatase sebesar 0.50 Å. nilai RMSD dari hasil penambatan ulang keduanya membuktikan bahwa PDB file yang telah diunduh dan software Molegro Virtual Docker (MVD) Ver.5.5 dapat digunakan sebagai metode penambatan untuk screening virtual dari senyawa turunan p-Metoksisinnamoil hidrazida.
HASIL DAN PEMBAHASAN
Penambatan terhadap reseptor Checkpoint kinase 1
Penambatan senyawa turunan
p-Metoksisinnamoil hidrazida pada reseptor
Checkpoint kinase 1 dengan menggunakan
software Molegro Virtual Docker (MVD)
Ver.5.5 diperoleh data yang disajikan pada Tabel 1.
Energi ikatan senyawa 4b dan 4c dengan reseptor Checkpoint kinase 1 lebih rendah dibandingkan dengan native ligan A42. Senyawa 4b memiliki nilai rerank score -99,98 kkal/mol yang hampir senilai dengan senyawa 4c dengan rerank score sebesar -99,80 kkal/mol. Senyawa 4b dan 4c memiliki aktivitas inhibisi yang lebih besar terhadap enzim checkpoint kinase 1 dibandingkan
native ligannya yang memiliki rerank score
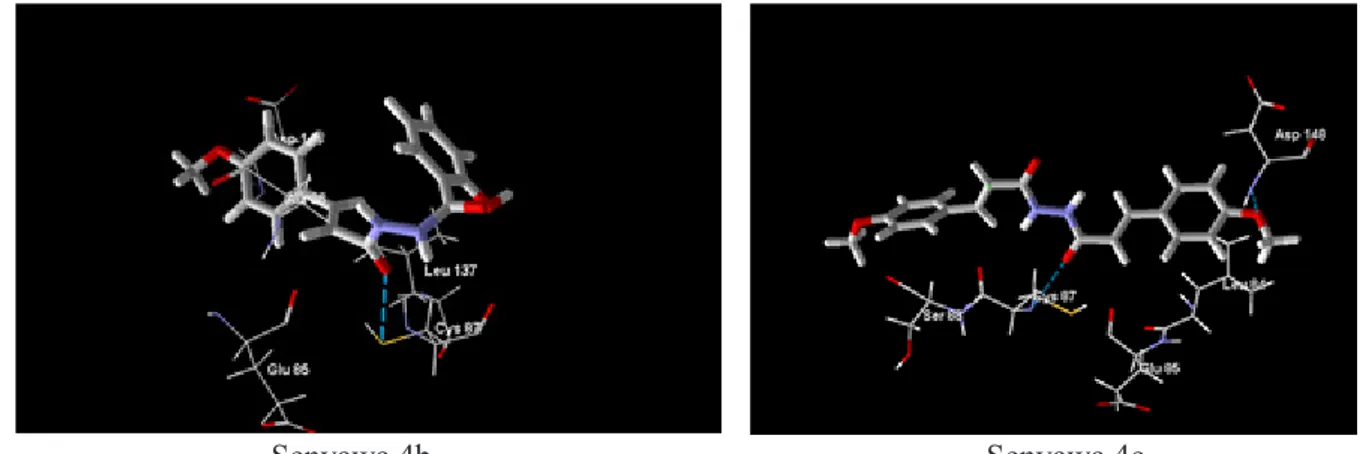
sebesar -88,28 kkal/mol berdasarkan prediksi hasil uji secara in silico. Visualisasi interaksi senyawa 4b dan 4c dengan reseptor checkpoint kinase 1 dapat dilihat pada Gambar 8.
Senyawa 4b berinteraksi dengan reseptor checkpoint kinase 1 melalui beberapa ikatan yaitu ikatan hidrogen dengan residu asam amino Cys87 dan interaksi hidrofobik (sterik) dengan residu asam amino Ala36, Leu84, Glu55, Cys87 dan Asp148. Senyawa 4c berinteraksi dengan reseptor checkpoint kinase 1 melalui ikatan hidrogen dengan residu asam amino Cys87, Asp148 dan interaksi hidrofobik (sterik) dengan residu asam amino Leu84, Glu85, Ser88 dan Asp148.
Penggantian Atom N dengan karbonil tak jenuh pada senyawa 4b dan 4c tidak menghilangkan interaksi pada residu Glu 85; Cys87 yang diprediksikan merupakan interaksi yang penting pada reseptor checkpoint kinase 1. Pada ligan A42 adanya gugus karbonil dan –NH terjadinya ikatan hidrogen pada asam amino Glu85 dengan jarak sejauh 2,66 Å dan residu asam amino Cys87 dengan jarak 3,34 Å. Pada senyawa 4b adanya gugus karbonil menyebabkan terjadinya ikatan hidrogen pada residu asam
Senyawa 4b Senyawa 4c
Gambar 8. Interaksi penambatan senyawa 4b dan 4c dengan reseptor checkpoint kinase dengan program Molegro Virtual Docker (MVD)
amino Cys87 dengan jarak 2,90 Å dan gugus –NH yang digantikan dengan ikatan rangkap karbonil tak jenuh (-C=C-) masih berinteraksi dengan asam amino Glu85 melalui interaksi sterik. Pada senyawa 4c adanya gugus karbonil menyebabkan terjadinya ikatan hidrogen pada residu asam amino Cys87 dengan jarak 2,82 Å gugus –NH yang digantikan dengan ikatan rangkap karbonil tak jenuh (-C=C-) masih berinteraksi dengan asam amino Glu85 melalui interaksi sterik.
Hasil uji in silico terhadap reseptor Checkpoint kinase 1, senyawa 4b dan 4c memiliki energi ikatan yang lebih kecil sehingga semakin stabil ikatan antara obat-reseptor dibandingkan dengan native ligannya. Senyawa 4b dan 4c sangat berpotensi memiliki aktivitas inhibisi terhadap enzim Checkpoint kinase 1 yang dapat menghambat pertumbuhan dan pembelahan dari sel kanker. Senyawa 4b dan 4c memiliki kesamaan struktur kimia dengan
native ligannya yang merupakan derivat dari
urea. Kepolaran dari atom N dari gugus urea pada native ligand A42 digantikan dengan ikatan rangkap karbonil tak jenuh pada
senyawa 4b dan 4c sehingga hasil uji in silico memberikan hasil rerank score yang lebih rendah (Gambar 9).
Uji in vitro perlu dilakukan untuk membuktikan senyawa 4b dan 4c berpotensi dalam menghambat pertumbuhan dan perkembangan sel kanker. Beberapa penelitian mengunakan uji in vitro terhadap sel hela dengan metode MTT assay dengan kontrol positif hidroksi urea untuk merepresentatifkan dari hasil uji in silico yang berpotensi menghambat aktivitas enzim checkpoint kinase 1 yang memberikan korelasi yang linier antara hasil uji in silico dan in vitro (Pangaribowo, 2014).
Penambatan terhadap reseptor Aromatase
Penambatan senyawa turunan
p-Metoksisinnamoil hidrazida pada reseptor
Aromatase dengan menggunakan software Molegro Virtual Docker (MVD) Ver.5.5 diperoleh data yang disajikan pada Tabel 2. Senyawa turunan p-Metoksisinnamoil hidrazida secara in silico study diprediksikan tidak memiliki aktivitas terhadap inhibisi
Gambar 9. Persamaan Struktur farmakofor native ligand A42 dengan senyawa 4b dan 4c
Tabel 2. Hasil Penambatan senyawa turunan p-Metoksisinnamoil hidrazida dengan reseptor aromatase
Senyawa Rerank Score DockedPose hidrogenIkatan Asam aminoResidu Interaksi sterik Residu Asam amino O CH2 H H CH3 CH3 Ligand (EXM) -109,59 √ 3 Arg 115 Asp 309 Met 374 1 Ala 306 MeO NH HN O 4a -69,89 √ 3 Arg 115Met 374 Leu 372 - -MeO N H H N O O HO 4b 49,91 x 3 Asp 309Met 374 HEM_600 6 Ile 133 Ala 306 Asp 309 Thr 310 Leu 372 Met 374 MeO N H H N O OMe O 4c 32,13 x 3 Arg 115 Gln 218 Met 374 11 Arg 115 Arg 192 Gln 218 Phe 221 Asp 309 Thr 310 Val 373 Met 374 Leu 477 Ser 478 His 480 N H NH2 O OH 4d -64,01 x 3 Arg 115Met 374 Leu 372 2 Val 370 Met 374
Gambar 10. Interaksi penambatan native ligan EXM dan senyawa 4a dengan reseptor Aromatase dengan program Molegro Virtual Docker (MVD)
Native ligand EXM Senyawa 4a
enzim aromatase karena rerank score native ligan EXM sebesar -109,59 Kkal/mol jauh lebih rendah dari senyawa yang diteliti. Senyawa 4a memiliki rerank score yang paling rendah sebesar -69,89 Kkal/mol dibandingkan dengan keseluruhan senyawa yang diteliti. Senyawa 4a berinteraksi dengan aromatase melalui beberapa ikatan yaitu ikatan hidrogen dengan residu asam amino Arg115, Met374, Leu372. Native ligan EXM berinteraksi dengan enzim aromatase melalui ikatan hidrogen pada residu asam amino Arg115, Asp309 dan Met374.
Senyawa yang dapat menginhibisi enzim aromatase adalah senyawa yang memiliki gugus hidroksi dengan jarak 10-11 Å (Dai et
al., 2010). Senyawa EXM adalah senyawa
inti steroid (siklopentano perhidrofenatren) yang memiliki gugus hidroksi pada C-3 da C-17. Atom O pada gugus hidroksi C-3 berinteraksi dengan ikatan hidrogen dengan residu asam amino Ala306 dan Asp309 dari enzim aromatase (Gambar 10). Atom O pada
gugus hidroksi C-17 berinteraksi dengan ikatan hidrogen pada residu asam amino Arg115 dan Met374 dari enzim aromatase. Senyawa 4a hanya memiliki gugus hidroksi dan metoksi yang antar atom O terpisah sejauh 8.89 Å sehingga hanya mampu mengadakan ikatan hidrogen dengan pada residu asam amino Arg115 dan Met374 dari enzim aromatase sehingga energi ikatan senyawa 4a lebih besar dibandingkan senyawa EXM namun paling rendah dibandingkan dengan senyawa 4b, 4c dan 4d.
KESIMPULAN
Senyawa 4b dan 4c diprediksiksn memiliki aktivitas menginhibisi enzim Checkpoint kinase 1 lebih baik dibandingkan dengan
native ligannya A42 secara uji in silico
sehingga berpotensi untuk diteliti lebih lanjut mengenai aktivitas antikankernya.
DAFTAR ACUAN
Aroonkerk, N. & N. Kamkaen. (2009). Anti-inflammatory Activity of Quercus Infectoria, Glycyrrhiza Uralensis, Kaempferia Galanga and Coptis Chinensis, The main Components of Thai Herbal Remedies for Aphthous Ulcer. J. Health Res, 23 (1), 17-22 Basu, Gargi D., Winnie S., Dietrich A., Lee
T., Christopher R., Barbara A., Pinku M. (2006). A novel role for cyclooxygenase-2 in regulating vascular channel formation by human breast cancer cells. Breast
Cancer Research, 8, 1-11
ChemBioDraw Ultra 13.0. (2012). Cambrigesoft. PerkinElmer, Inc
ChemBio3D Ultra 13.0. (2012). Cambrigesoft. PerkinElmer, Inc
Clemente, Monica., Ana R., David S., Lucia D., Asuncion M., Francesco S., Dolores P., Juan C., Susana D., Laura P. (2013). Different role of COX-2 and angiogenesis in canine inflammatory and non-inflammatory mammary cancer. The
Veterinary Journal, 197, 427–432
Dai, Yujie., Qiang W., Xiuli Z., Shiru J., Heng Z., Dacheng F.,& Peng Yu. (2010). Molecular docking and QSAR study on steroidal compounds as aromatase inhibitors. European Journal of
Medicinal Chemistry. xxx, 1-9
Donovan, D., J. Brown., T. Bishop., E. Levis. (2001). Comparison of three in vitro human ‘angiogenesis’ assay with capillaries formed in vivo. Angiogenesis, 4, 131-121
Ekowati, Juni., Bimo A., Shigeru S., Kimio H., Sukardiman, Siswandono, Tutuk B. (2012). Structure modification of ethyl p-methoxycinnamate and their bioassay as chemopreventive agent against mice’s fibrosarcoma. International Journal of
Pharmacy and Pharmaceutical Sciences,
4, 528-532
Ekowati, Juni., Marcellino R., Shigeru S., Tutuk B., Sukardiman, Adam H., Edy M. (2010). Structure Modification of Ethyl p-methoxycinnamate Isolated from Kaempferia galanga Linn. and Citotoxicity Assay of The Products on WiDr Cells. Indonesian Journal of
Cancer Chemoprevention., 1, 12-18
Ekowati, J., Hardjono, S., Hamid, I.S.(2015). Ethyl p-methoxycinnamate from Kaempferia galangal inhibits angiogenesis through tyrosine kinase.
UNIVERSA MEDICINA, 34, 43-51
Fischer, M. & Hubbard, E.R. (2011).Crystal structure of sialic binding protein.
ScienceDirect, 18 (10), 471-478
Ghosh, Debashis., Lo, J., Morton, D.., Valette, D., Xi, J., Griswold, J., Hubbell, S., Egbuta, C., Jiang, W., Davies, H. M. L. (2012). Novel aromatase inhibitors by structure-guided design. Journal of
Medicinal Chemistry, 55, 8464-8476
Gobil, M. Vikransinh., Satyam K., Ajit K., Divita G., C Gopimohan, Kamlesh K. Synthesis. (2010). Biological evaluation and molecular docking of ary hydrazines and hydrazides for anticancer activity.
Indian Journal of Experimental Biology,
Hamid, Iwan Sahrial., Dady S., Hermin R. (2013). Hambatan Ekspresi Vascular Endothelial Growth Factor oleh Ekstrak Daun Sambung Nyawa pada Endotel Membran Korioalantois. Jurnal
Veteriner, 14, 85-90
Iniguez, M. A., Rodriguez. A., Volpert, O. V., Fresno, M., Redondo, J. M. (2003). Cyclooxygenase-2 : therapeutic target in angiogenesis. Trends Mol Med, 9, 73-78 Katzung, B.G.,. Masters, S.B., Trevor, A.J.
(2009). Basic & Clinical Pharmacology, 11th Edition..New York: McGraw-Hill Companies. 671-700
Meuth, M. (2010). Chk1 suppressed cell death. Cell Division 5:21
Molegro Virtual Docker (MVD) 5.(2011). Molegro ApS
Pangaribowo, Dian Agung. (2014). Molecular docking, sintesis dan uji aktivitas sitotoksik senyawa 1-benzoil-1,3-dimetilurea. Cakra Kimia (Indonesian
E-Journal of Applied Chemistry), 2 : 1-6
Putra, G. S., Yuniarta, T. A., Syahrani, A., Rudyanto, M. (2016). Synthesis, molecular docking study and brine shrimp lethality test of benzoxazine and aminomethyl derivatives from eugenol. International Journal of
Pharma Research & Review, 5 (4), 1-11
Ruswanto, Taufik H. (2013). Desain dan pemodelan molekul turunan 1,3-dibenzoil tiourea sebagai inhibitor chk1 secara in silico. Jurnal Kesehatan
Bakti Tunas Husada, 9, 14-21
Sawy, Eslam., Heba M., Khalied M., Eman S., Amira M., Adel H. (2015).
Synthesis, anticancer activity and molecular docking study of novel 1, 3-diheterocycles indole derivatives.
International Journal of Pharmacy and Pharmaceutical Sciences, 7, 379-385
Song D.Q., Du N.N., Wang Y.M., He W.Y., Jiang E.Z., Cheng S.X. (2009). Synthesis and activity evaluation of phenylurea derivatives as potent antitumor agents.
Bioorg Med Chem, 17, 3873–3878
Sulistyowaty, M. I., Nugroho, A. E., Putra, G. S., Ekowati, J., Budiati, T. (2016). Syntheses, molecular docking study and anticancer activity examination of p-methoxycinnamoyl hydrazides.
International Journal of Pharmaceutical and Clinical Research, 8(6), 623-627
Suvannang,Naravut., Chanin N., Chartchalerm I., Virapong P. (2011). Molecular Docking of Aromatase Inhibitors. Molecules, 16, 3597-3617 Sweetman, Sean. (2009). Martindale the
complete drug refference (36th ed.).
London : Phamaceutical Press. 670-700 Umar, Muhammad Ihtisham., Mohd Z.,
Amirin S., Amin M., Fouad S., Loiy E., Rabia A., Mohamed B. (2014). Ethyl-p-methoxycinnamate isolated from kaempferia galanga inhibits inflammation by suppressing interleukin-1, tumor necrosis factor-a, and angiogenesis by blocking endothelial functions.
CLINICS, 69, 134-144
Xiao, L., Liu, C., Li, Y. (2009). Ultrasound Promoted of Bis(substituted pyrazol-4-ylcarbonyl)-Substituted Thioureas.
Wakeling, A.E. (2000). Similarities and distinctions in the mode of action of different classes of antioestrogens.
Endocrine-Related Cancer, 7, 17-28
Winer, Eric P., Clifford H., Harold J., Antonio C., Kathleen I., James N., et al. (2005). American Society of Clinical Oncology Technology Assessment on the Use of Aromatase Inhibitors As Adjuvant Therapy for Postmenopausal Women With Hormone Receptor–Positive Breast Cancer: Status Report 2004. Journal of