SELEKSI DAN OPTIMASI PEMURNIAN ENZIM SELULASE
MIKROB DARI LIMBAH MEDIA TANAM
JAMUR MERANG
NUR HASANAH
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2014
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Seleksi dan Optimasi Pemurnian Enzim Selulase Mikrob dari Limbah Media Tanam Jamur Merang benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Penelitian ini didanai oleh Pusat Penelitian Biologi LIPI. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014 Nur Hasanah NIM G84100025
ABSTRAK
NUR HASANAH. Seleksi dan Optimasi Pemurnian Enzim Selulase Mikrob dari Limbah Media Tanam Jamur Merang. Dibimbing oleh LAKSMI AMBARSARI dan IWAN SASKIAWAN.
Mikrob selulolitik diperlukan dalam mendegradasi selulosa yang dapat dimanfaatkan lebih lanjut. Penelitian ini bertujuan melakukan seleksi mikrob selulolitik dan optimasi pemurnian aktivitas selulase dari kultur murni jamur yang diisolasi dari limbah media tanam jamur merang. Aktivitas selulase dari 20 nomor kultur murni jamur hasil isolasi diuji secara kualitatif melalui metode pewarnaan merah kongo 0.1% dan diukur indeks selulolitiknya. Tiga kultur murni dengan indeks selulolitik tertinggi, kemudian ditentukan aktivitas selulolitiknya secara kuantitatif dengan metode asam 3,5-dinitosalisilat (DNS). Hasil penelitian menunjukkan bahwa isolat JMF 12 yang memiliki aktivitas spesifik tertinggi, yaitu sebesar 2.7812±0.081 U/mg. Aktivitas selulase optimum diperoleh pada suhu 45°C dan pH 6.0. Pengaruh logam pada aktivitas enzim menunjukkan bahwa kation Zn2+ dan Na+ berfungsi sebagai aktivator dan Ca2+, K+ Co2+, Fe3+, dan Hg2+ sebagai inhibitor. Optimasi pemurnian aktivitas selulase dengan amonium sulfat 30% menghasilkan aktivitas spesifik tertinggi sebesar 7.9446±0.100 U/mg dengan nilai kemurnian 1.3675 kali. Aktivitas spesifik meningkat setelah dilakukan dialisis, yaitu sebesar 10.2483±0.303 U/mg dengan nilai kemurnian 1.7641 kali. Kata kunci : optimasi, pemurnian, seleksi, selulase, selulolitik
ABSTRACT
NUR HASANAH. Selection and Optimization of Microbial Cellulase Enzyme Purification from the Waste of Mushroom Planting Medium. Supervised by LAKSMI AMBARSARI dan IWAN SASKIAWAN.
Cellulolytic microbes necessary to degrade cellulose that can be exploited further. The aim of this study is to screening and optimization of purification microbial cellulolytic activity of pure culture fungi isolated from the spent substrate of mushroom growing media. A twenty number of fungi has been screened for the cellulase activity by determination of cellulolytic index using 0.1% Congo Red stained as well as 3,5-dinitrosalisilat acid (DNS) method for determination of specific activity. The results showed that isolate JMF 12 is the highest cellulolytic specific activity. It was 2.7812±0.081 U/mg. The optimum activity was obtained at 45°C and pH 6.0. Furthermore, the cations Zn 2+ and Na+ were affected as an activator and Ca2+, K+, Co2+, Fe3+, and Hg2+ as an inhibitors of cellulase activity. Cellulase activity with 30 % amonium sulfate is obtained the highest specific activity of 7.9446±0.100 U/mg with a purity value of 1.3675 times. Specific activity of cellulase by dialysis increased the specific activity of 10.2483±0.303 U/mg with a purity value of 1.7641 times.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
SELEKSI DAN OPTIMASI PEMURNIAN ENZIM SELULASE
MIKROB DARI LIMBAH MEDIA TANAM
JAMUR MERANG
NUR HASANAH
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Skripsi : Seleksi dan Optimasi Pemurnian Enzim Selulase Mikrob dari Limbah Media Tanam Jamur Merang
Nama : Nur Hasanah NIM : G84100025 Disetujui oleh Dr Laksmi Ambarsari, MS Pembimbing I Dr Iwan Saskiawan Pembimbing II Diketahui oleh
Dr Ir I Made Artika, MAppSc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala nikmat dan karunia-Nya, sehingga penulis dapat menyelesaikan penelitian dengan baik dan lancar. Tidak lupa pula, shalawat serta salam kepada Nabi Muhammad Sallallahu ‘Alaih Wasallam, yang berkat jasa beliau manusia bisa mengenal Allah SWT lewat Islam. Penelitian ini dilaksanakan di Laboratorium Biokimia Mikrob Bidang Mikrobiologi, Pusat Penelitian Biologi LIPI dimulai dari bulan Januari 2014 hingga April 2014, dengan judul Seleksi dan Optimasi Pemurnian Enzim Selulase Mikrob dari Limbah Media Tanam Jamur Merang.
Penulis mengucapkan terima kasih kepada kedua orang tua, Rahmat Juarsa dan Sadiah atas doa, kasih sayang dan dukungan yang selalu diberikan. Penulis juga menyampaikan terima kasih dan penghargaan kepada Dr Laksmi Ambarsari, MS dan Dr Iwan Saskiawan selaku pembimbing serta Dra Nunuk Widhyastuti, MSi atas bimbingan dan arahan berikut kritik serta sarannya dalam karya ilmiah ini. Penghargaan dan terima kasih juga penulis ucapkan kepada seluruh dosen dan staf Biokimia IPB atas bimbingannya. Ucapan terima kasih penulis juga sampaikan kepada Ibu Kesi, Teh Eneng, Teh Tri, Teh Ismu, Ka Lusi atas bantuannya. Penulis juga menyampaikan terima kasih kepada Muchammad Fakhruzzaman Al Faisal atas doa, dukungan, dan kesabarannya selama ini. Terima kasih kepada Hani, Anes, Amar, Ola, Uwi, Lia, Sainstek, keluarga Biokimia 47, dan seluruh teman penulis yang tidak terucapkan atas doa, dukungan, dan persahabatannya. Penulis menyadari masih banyak kekurangan dalam penyusunan usulan penelitian ini, maka diharapkan kritik dan saran yang membangun untuk perbaikan dalam penulisan selanjutnya.
Akhir kata penulis berharap semoga apa yang dihasilkan dari penelitian ini membawa manfaat yang sebesar-besarnya bagi peningkatan kualitas penulis dan pembaca dalam ilmu pengetahuan.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xi
PENDAHULUAN 1
METODE 2
Waktu dan tempat 2
Alat 2
Bahan 2
Prosedur 3
HASIL 6
Mikrob Selulolitik yang Terseleksi melalui Uji Kualitatif dan Uji Kuantitatif 6 Kurva Pertumbuhan dan Produksi Enzim Selulase JMF 12 7
Pengendapan Selulase dengan Amonium Sulfat 8
Optimasi Kerja Enzim Selulase JMF 12 9
PEMBAHASAN 11
Mikrob Selulolitik yang Terseleksi melalui Uji Kualitatif dan Uji Kuantitatif 11 Kurva Pertumbuhan dan Produksi Enzim Selulase JMF 12 14
Pengendapan Selulase dengan Amonium Sulfat 15
Kondisi Optimum Kerja Enzim Selulase JMF 12 17
SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
DAFTAR PUSTAKA 18
LAMPIRAN 23
DAFTAR GAMBAR
1 Zona bening JMF 6 (a), JMF 11(b), dan JMF 12(c) 6
2 Indeks selulolitik JMF 6
3 Aktivitas spesifik enzim selulase isolat terpilih 7
4 Kurva pertumbuhan dan produksi Isolat JMF 12 8
5 Aktivitas spesifik hasil optimasi persen pengendapan amonium sulfat 8
6 Suhu optimum selulase isolat JMF 12 10
7 Nilai pH optimum selulase isolat JMF 12 10
8 Logam yang mempengaruhi aktivitas selulase isolat JMF 12 11
9 Isolat JMF 12 14
DAFTAR LAMPIRAN
1 Diagram alir penelitian secara umum 23
2 Kurva standar glukosa 24
3 Kurva standar BSA (Bovine Serum Albumin) 24
4 Penentuan indeks selulolitik isolat JMF 25
5 Penentuan aktivitas selulolitik isolat JMF terpilih 26 6 Penentuan kurva pertumbuhan dan produksi isolat JMF 12 28 7 Penentuan optimasi persen pengendapan amonium sulfat 29 8 Penentuan tingkat kemurnian enzim selulase JMF 12 31 9 Penentuan optimasi kerja enzim selulase JMF 12 33
PENDAHULUAN
Indonesia sebagai negara agraris setiap tahunnya menghasilkan limbah pertanian yang sangat melimpah. Limbah pertanian tersebut berupa jerami, tongkol jagung, batang kedelai, dan kulit pisang. Umumnya, limbah hasil pertanian ini masih mengandung sejumlah nutrien, sehingga dapat dikonversi menjadi produk yang memiliki nilai ekonomi seperti kompos, pakan ternak atau digunakan sebagai medium pertumbuhan mikrob (Meryandini 2009). Limbah pertanian tersebut memiliki komponen utama lignoselulosa. Lignoselulosa terdiri atas tiga polimer yaitu selulosa, hemiselulosa, dan lignin (Perez et al. 2002). Hidrolisis sempurna senyawa lignoselulosa sebagian besar menghasilkan glukosa yang merupakan bahan dasar pembuatan bioetanol. Potensi tersebut terkendala oleh sifat dari lignoselulosa yang sulit didegradasi karena struktur kristal dari selulosa yang merupakan komponen utama penyusun lignoselulosa pada tanaman (Koesnandar 2008). Selulosa adalah polimer linier glukosa dengan ikatan β-1,4-glikosidik (Kim et al. 2004). Hidrolisis selulosa menjadi glukosa merupakan proses yang komplek dan dapat dilakukan melalui konversi secara fisik, kimia maupun biologi. Salah satu proses konversi yang banyak diteliti adalah proses konversi biologi secara enzimatik.
Enzim yang dapat mendegradasi selulosa adalah enzim selulase. Enzim selulase mengkatalisis hidrolisis ikatan β-1,4-glikosidik pada molekul selulosa sehingga menghasilkan glukosa (Sinatari 2013). Enzim dapat diproduksi oleh kelompok bakteri, kapang maupun khamir (Imas 2009). Mikrob yang umum digunakan untuk menghasilkan enzim selulase adalah Trichoderma reseei (Kodri et al. 2013). Selain itu juga telah diteliti produksi selulase dari jenis mikrob lain seperti Aspergillus Niger (Julfana et al. 2013), Ganoderma lucidum (Basuni 2008), Trichoderma viride (Tridasma 2006), Penicillium nalgiovense (Nugraha 2006) dan lain-lain juga menunjukkan adanya kemampuan aktivitas selulolitik dan hemiselulolitik yang tinggi pada proses fermentasi untuk menghasilkan gula (Chandel et al. 2007). Enzim selulase umumnya digunakan dalam berbagai industri seperti bioteknologi makanan, tekstil, kertas, pertanian serta dalam pengembangan penelitian. Umumnya, enzim yang digunakan saat ini masih impor dan mahal.
Menurut Alam (2004), sebagian besar selulosa (90-96%) di alam didegradasi secara aerob dan sebagian kecil didegradasi secara anaerob. Hal ini menunjukkan keberadaan mikrob pendegradasi selulosa atau mikrob selulolitik di alam sangat melimpah dan dapat ditemukan pada limbah pertanian yang memiliki kandungan lignoselulosa, seperti jerami padi yang berperan sebagai substrat untuk mikrob penghasil enzim selulase. Permasalahan ketersedian enzim selulase dapat diatasi dengan mengisolasi mikrob selulolitik dari alam. Penelitian ini merupakan lanjutan dari penelitian terdahulu oleh Saskiawan (2013) yang melakukan isolasi mikrob dari limbah media tanam jamur merang. Selama ini, limbah media tanam jamur merang dari jerami padi hanya digunakan sebagai pakan atau dilakukan pembakaran ketika sudah tidak dapat dimanfaatkan kembali (Sunandar 2010). Selulosa dirombak oleh mikrob selulolitik dengan bantuan enzim selulase, salah satu mikrob perombak selulosa adalah jamur selulolitik. Selulosa dari sisa tumbuhan dan organisme lain diurai oleh mikrob menjadi senyawa sederhana
berupa glukosa, CO2 dan hidrogen yang sangat berguna sebagai zat hara bagi
tumbuhan dan organisme tanah lainnya (Oramahi et al, 2003). Jamur memiliki kemampuan untuk menghidrolisis selulosa alami melalui aktivitas selulase yang dimilikinya. Perolehan mikrob selulolitik yang mampu menghasilkan aktivitas selulase yang tinggi menjadi sangat penting untuk tujuan pengomposan limbah organik. Kemampuan enzim selulase dalam menghidrolisis selulosa akan meningkat apabila dilakukan optimasi pemurnian aktivitas selulase. Penelitian ini mengkaji aktivitas enzim selulase dari mikrob untuk pemanfaatan biomassa selulosa yang diisolasi dari limbah media tanam jamur merang dengan 20 nomor isolat, yaitu JMF 1 hingga JMF 20. Pokok bahasan difokuskan pada seleksi secara kualitatif dan kuantitatif aktivitas enzim selulase untuk memilih isolat yang memiliki aktivitas selulase tertinggi dari 20 nomor isolat hasil isolasi dan optimasi pemurnian enzim selulase untuk menentukan kondisi optimum dan meningkatkan aktivitas spesifik enzim selulase. Penelitian ini bertujuan menentukan mikrob yang memiliki aktivitas selulolitik dan optimasi pemurnian aktivitas enzim selulase meliputi, pengendapan dengan amonium sulfat, dialisis, optimasi pH, suhu, dan pengaruh logam terhadap aktivitas selulase.
METODE
Waktu dan tempat
Penelitian ini dilaksanakan pada tanggal 5 Januari sampai dengan 30 April 2014 di Laboratorium Biokimia Mikrob, Lembaga Ilmu Pengetahuan Indonesia, Cibinong Science Center.
Alat
Alat yang digunakan adalah petridish steril, bunsen, jarum ose, mikropipet Sibata, laminar air flow cabinet OSK CVB-1300M, labu Erlenmeyer Pyrex, labu ukur Pyrex, tabung reaksi IWAKI TE-32 Pyrex , tip, tip steril, tabung Eppendorf, autoklaf Hirayama, neraca analitik AND GR-300, oven Isuzu, eksikator, spektrofotometer UV-VIS 1700 Shimadzu, kuvet Hellma QS 10.00 mm, microwave Electrofast, vortex SIBATA, lemari pendingin, penangas air memmert EYELA digital waterbath SB-100, inkubator Isuzu, magnetic strirer, botol sentrifus, sentrifus PLC Series, pH meter HM-25G TOADKK, magnetic stirrer, tabung dialisis, shaker dan stopwatch. Adapun perlengkapan pendukung lainnya, yaitu kamera, penggaris, pena, logbook, dan spidol.
Bahan
Bahan yang digunakan pada penelitian ini antara lain 20 isolat jamur dengan kode JMF yang diisolasi dari limbah media tanam jamur merang, PDA (Potato Dextrosa Agar), PDB (Potato Dextrosa Borth), NaOH, Kalium Natrium Tartrat-Tetrahydrat, Carboxy Methyl-Cellulose (CMC), buffer phospat, kertas saring Whatman grade 42, akuades, glukosa, DNS (Dinitro salisilic acid), reagen Bradford, amonium sulfat, natrium klorida dan larutan congo red 0.1%.
Prosedur
Pembuatan Media PDA dan Peremajaan Isolat JMF
Media PDA (Potato Dextrosa Agar) dibuat dari 39 gram serbuk PDA dipanaskan dalam 1 liter akuades. Media disterilisasi pada suhu 121°C selama 15 menit. Sebanyak 20 isolat JMF diremajakan pada media agar miring PDA selama 3 hari pada suhu ruang.
Uji Kualitatif Selulolitik (modifikasi Fikrinda et al. 2000)
Seleksi mikrob selulolitik menggunakan media CMC pada cawan petri. Media CMC dibuat dengan mencampurkan 0.4 g CMC, 0.5 g MgSO4.7H2O, 0.03
g KNO3, 1.0 g K2HPO4, 0.0008 g FeSO4.7H2O, 0.08 yeast, 2 gr NaNO3, 18 g agar
dan dilarutkan dalam 1 liter akuades. Setelah diinkubasikan 24 jam pada suhu ruang, isolat kemudian ditetesi larutan merah kongo 0.1% (b/v) dan ditambahkan larutan NaCl 1%. Aktivitas selulolitik ditentukan dengan nilai indeks selulolitik yang merupakan nisbah antara diameter zona bening dengan diameter koloni.
Uji Kuantitatif Selulolitik (modifikasi Anggarawati 2012)
Campuran reaksi dalam uji kuantitatif adalah 125 μl sampel ekstrak kasar enzim selulase dan 875 μl larutan substrat CMC (Carboxy Methyl Celullose) 0.5 % (b/v), campuran tersebut kemudian divorteks hingga homogen dan diinkubasi selama10 menit, kemudian ditambahkan 1 mL DNS (3,5- Di Nitro Salisilic Acid) dan dipanaskan selama 5 menit dalam water bath. Hal ini dilakukan untuk menghentikan reaksi dan DNS dapat bercampur dengan produk glukosa yang terbentuk. Setelah divorteks sampai homogen, absorbansi setiap larutan sampel diukur dengan spektrofotometer UV-Vis pada panjang gelombang (λ) = 540 nm. Nilai absorbansi yang diperoleh diplotkan pada kurva standar untuk mengetahui konsentrasi produk glukosa pada sampel. Satu unit aktivitas enzim selulase dinyatakan sebagai jumlah μmol produk glukosa hasil hidrolisis enzim selulase tiap satu menit pada kondisi pengujian. Nilai aktivitas selulase ditentukan berdasarkan perhitungan sebagai berikut.
Aktivitas selulase (U/ml) = konsentrasi glukosa sampel x 1000 V.t.BM
Aterkoreksi : ((As – Ab) – (Ak – Ab))
Keterangan :
As = Absorbansi sampel Ab = Absorbansi blanko Ak = Absorbansi kontrol V = Volume enzim (125 μl)
t = waktu inkubasi BM = Bobot molekul glukosa (180 g/mol) 1000 = konversi dari mmol ke µmol
Pembuatan Kurva Standar Glukosa
Konsentrasi gula dalam kurva standar diukur dengan metode DNS. Pereaksi DNS dibuat dengan melarutkan 1 g DNS (3,5-Di Nitro Salisilic Acid) secara perlahan dalam 20 ml larutan NaOH 2 N dan 50 ml aquadest. Larutan DNS tersebut kemudian ditambah dengan 30 gram K-Na tartrat dan diaduk dengan magnetic stirrer serta ditera dengan aquadest hingga volume akhir 100 ml.
Sebanyak 7 tabung reaksi dimasukkan sebanyak 1 ml larutan standar glukosa glukosa (0.100, 0.125, 0.150, 0.175, 0.200, 0.225, 0.250 mg/ml) dan 1 tabung reaksi dengan 1 mL aquadest sebagai kontrol. Selanjutnya sebanyak l mL reagen DNS ditambahkan pada larutan standar glukosa tersebut. Semua tabung reaksi dipanaskan di dalam water bath selama 5 menit agar terjadi reaksi antara glukosa dengan DNS. Tabung reaksi didinginkan kemudian divorteks, sehingga homogen. Absorbansi tiap larutan diukur dengan spektrofotometer UV-Vis pada λ = 540 nm, konsentrasi standar glukosa ditunjukkan dengan kurva standar.
Produksi Enzim Selulase pada Media PDB (Potato Dextrosa Broth)
Isolat yang memiliki indeks selulolitik tertinggi diuji aktivitas selulolitiknya secara kuantitatif. Dengan menggunkan cork borer dengan diameter 0,6 cm isolat tersebut dipindahkan ke 200 ml media PDB (Potato Dextrosa Broth) dalam labu Erlenmeyer 300 ml, kemudian diinkubasi selama 4 hari pada suhu 370C dengan kecepatan shaker 120 rpm/menit. Setiap 24 jam diuji nilai aktivitas selulase isolat terpilih. Ekstrak kasar enzim selulase diperoleh dengan melakukan sentrifugasi pada sampel dengan kecepatan 9500 rpm, selama 30 menit, pada suhu 40C. Ekstrak kasar enzim selulase berada pada bagian supernatant, sementara limbah padat sel isolat akan terendap menjadi pelet. Supernatan tersebut, selanjutnya difiltrasi dengan menggunakan kertas saring Whatman grade 42, sehingga diperoleh filtrat jernih yang merupakan ekstrak kasar enzim selulase.
Pertumbuhan Isolat JMF 12 (Kusnatul 2002)
Isolat JMF 12 berdiameter 0.6 cm dimasukkan kedalam media PDB (Potato Dextrosa Broth) 200 ml dengan 3 ulangan untuk penentuan bobot kering miselia setiap 24 jam. Kemudian diinkubasi selama 4 hari pada suhu 370C dengan kecepatan shaker 120 rpm/menit. Setiap 24 jam selama 4 hari, dilakukan penentuan bobot kering miselia, yaitu dengan menimbang biomasa sel JMF 12. Setelah diinkubasi, biomasa sel disaring, lalu dikeringkan dengan menggunakan oven pada suhu 800C sampai bobot konstan.
Penentuan Kadar Protein (Bradford 1976)
Pengukuran Kurva Standar. Standar protein yang digunakan adalah bovine serum albumin (BSA) dengan konsentrasi 0.3-1.00 mg/mL dan menggunakan pelarut NaCl 0.15 M. Sebanyak 20 µl BSA ditambahkan dalam 1 mL larutan Bradford. Reagen Bradford dibuat dengan mencampurkan Coomassie Brilliant Blue G-250 100 mg, etanol 95% 50 ml, asam phospat 85% 100 ml dan akuades hingga 1 liter. Larutan divorteks dan diinkubasi selama 5 menit. Absorban larutan kemudian diukur pada λ 595 nm.
Pengukuran Sampel. Sebanyak 20 µl sampel enzim selulase ditambahkan
dalam 1 mL larutan Bradford. Larutan tersebut kemudia divorteks dan diinkubasi selama 5 menit pada suhu ruang. Absorban larutan kemudian diukur pada λ=595 nm.
Pembuatan Blanko. Sebanyak 20 µl NaCl 0.15 M ditambahkan dalam 1
mL lautan Bradford. Larutan divorteks dan diinkubasi selama 5 menit pada suhu ruang. Absorban larutan kemudian diukur pada λ=595 nm.
Pengendapan Amonium Sulfat (modifikasi Kresnawati 2013).
Selulase diendapkan dengan amonium sulfat dari persen kejenuhan 10% hingga 80%. Sebanyak 50 ml ekstrak enzim diendapkan dengan cara menambahkan amonium sulfat yang telah dihaluskan sedikit demi sedikit sambil diaduk perlahan dengan pengaduk bermagnet sampai mencapai kejenuhan. Semua pekerjaan dilakukan di atas penangas es. Pengadukan dilanjutkan selama 20 menit dan larutan disimpan dalam lemari pendingin selama 2 jam. Endapan yang terbentuk dipisahkan dengan sentrifugasi dan dilarutkan dengan 0.05 M bufer fosfat pH 6.5. Setelah diperoleh optimasi persen kejenuhan, pengendapan dengan amonium sulfat dilakukan dalam jumlah yang besar, yaitu 450 ml ekstrak enzim selulase yang diendapkan selama semalam. Endapan yang terbentuk dipisahkan dengan sentrifugasi dan dilarutkan dengan 0.05 M bufer fosfat pH 6.5. Larutan tersebut kemudian disentrifugasi dan diambil supernatannya. Kejenuhan amonium sulfat yang optimum akan ditunjukkan oleh aktivitas spesifik yang tinggi. Perhitungan jumlah amonium sulfat dihitung berdasarkan rumus sebagai berikut. Jumlah amonium sulfat (gram/liter) =
Keterangan
S1 : Konsentrasi awal amonium sulfat
S2 : Konsentrasi akhir amonium sulfat
NB : Nilai 533 menunjukkan bahwa dibutuhkan 533 gram amonium sulfat per liter untuk membuat larutan jenuh 100%.
Dialisis (modifikasi Kresnawati 2013).
Tabung dialisis (Novagen D-TubeTM Dialyzer Maxi, MWO 6-8 kDa) diisi 2.6 mL selulase hasil pengendapan amonium sulfat. Tabung kemudian direndam dalam buffer phospat 0.01 M yang diletakkan diatas stirer dan disimpan dalam Cool Room bersuhu 4ºC selama 24 jam.
Kondisi Optimum Kerja Enzim Selulase
Suhu Optimum. Sebanyak 875 μl CMC 0.5% dalam larutan buffer phospat 0.05 M pH 6.5 dicampurkan 125 μl enzim selulase. Campuran dalam labu diinkubasi selama 10 menit pada suhu berbeda (25oC, 30oC, 35oC, 40oC, 45oC, 50oC, dan 55oC) dan diuji aktivitasnya dengan metode DNS.
Nilai pH Optimum. Kondisi pH optimum ditentukan dengan cara
menyediakan beberapa larutan CMC 0.5% dalam buffer phospat 0.05 M dengan pH berbeda, yaitu 4.50; 5.00; 5.50; 6.00; 6.50; 7.00 dan 7.50. Masing-masing larutan diambil 875 μl dan ditambahkan 125 μl larutan enzim kemudian divorteks lalu diinkubasi 10 menit dan suhu optimum dan diuji aktivitasnya dengan metode DNS.
Pengaruh Logam. Sebanyak 125 μl enzim selulase dicampurkan substrat
CMC konsentrasi optimum, pH optimum dan suhu optimum, kemudian ditambah dengan senyawa logam CaCl2, NaCl, KCl, CoCl2, FeCl3, ZnCl2, dan HgCl2
dengan konsentrasi 10 mM dan diuji aktivitasnya dengan metode DNS.
HASIL
Mikrob Selulolitik yang Terseleksi melalui Uji Kualitatif dan Uji Kuantitatif
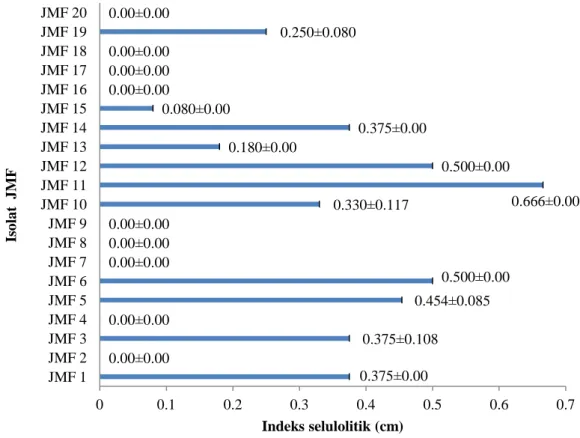
Uji kualitatif 20 nomor isolat jamur dilakukan pada media CMC komplek dan diinkubasi selama 24 jam. Terdapat 11 nomor isolat jamur yang menunjukkan hasil positif terhadap aktivitas selulolitik dan 9 isolat JMF yang tidak menunjukkan adanya aktivitas selulolitik. Zona bening yang dihasilkan dapat dilihat pada Gambar 1. Hasil analisis nilai indeks selulolitik dari 20 isolat jamur tersebut menunjukkan tiga nilai tertinggi dibandingkan dengan isolat lain yang diujikan, yaitu 0.500±0.000 cm, 0.666±0.000 cm, dan 0.500±0.000 cm masing-masing untuk isolat JMF6, JMF 11, dan JMF 12 (Gambar 2).
Gambar 1 Zona bening JMF 6, JMF 11, dan JMF 12
Gambar 2 Indeks selulolitik JMF
0.375±0.00 0.00±0.00 0.375±0.108 0.00±0.00 0.454±0.085 0.500±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.330±0.117 0.666±0.00 0.500±0.00 0.180±0.00 0.375±0.00 0.080±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.250±0.080 0.00±0.00 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 JMF 1 JMF 2 JMF 3 JMF 4 JMF 5 JMF 6 JMF 7 JMF 8 JMF 9 JMF 10 JMF 11 JMF 12 JMF 13 JMF 14 JMF 15 JMF 16 JMF 17 JMF 18 JMF 19 JMF 20 Indeks selulolitik (cm) Is o la t J M F a b c
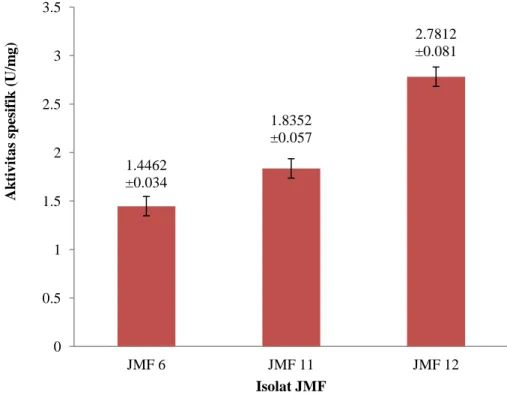
Tiga isolat terpilih dengan nilai indeks selulolitik tertinggi kemudian diuji secara kuantitatif untuk mengetahui aktivitas selulase dengan metode DNS. Penentuan aktivitas selulolitik isolat JMF terpilih terlampir pada Lampiran 5. Nilai aktivitas selulase (U/ml) untuk isolat JMF 6 sebesar 0.4800±0.012 U/ml dengan aktivitas spesifik sebesar 1.4462±0.034 U/mg, isolat JMF 11 memiliki aktivitas sebesar 0.5291±0.015 U/ml dengan nilai aktivitas spesifik sebesar 1.8352±0.057 U/mg dan isolat JMF 12 sebesar 0.7727±0.019 U/ml dengan aktivitas spesifik sebesar 2.7812±0.081 U/mg (Gambar 3). Berdasarkan hasil uji kuantitatif, JMF 12 merupakan isolat jamur yang memiliki aktivitas selulase dan aktivitas spesifik selulase tertinggi dibandingkan dengan isolat lainnya. Isolat tersebut kemudian digunakan dalam tahapan optimasi pemurnian enzim selulase yang dihasilkan.
Gambar 3 Aktivitas spesifik enzim selulase isolat terpilih
Kurva Pertumbuhan dan Produksi Enzim Selulase JMF 12
Kurva pertumbuhan yang dinyatakan dengan bobot kering miselia dan produksi enzim selulase diperlihatkan pada Gambar 4. Bobot kering mengalami peningkatan pada hari ke-1 hingga hari ke-3 dan selanjutnya mengalami penurunan. Aktivitas selulase mengalami peningkatan pada hari ke 1, kemudian mengalami penurunan pada hari selanjutnya. Aktivitas tertinggi sebesar 1.2796±0.115 U/ml pada hari pertama dengan bobot kering sebesar 1.4520±0.048 gram. Selanjutnya nilai aktivitas pada hari kedua sebesar 1.1162±0.057 U/ml dengan bobot kering 1.6222±0.046 gram. Nilai aktivitas pada hari ke-3 sebesar 1.1248±0.152 U/ml dengan bobot kering 2.0384±0.011 gram dan pada hari keempat nilai aktivitas JMF 12 sebesar 1.056±0.042 U/ml dengan bobot kering 1.9793±0.125 gram. Nilai aktivitas enzim selulase tertinggi pada hari ke-1 menunjukkan waktu produksi optimum pada hari ke-1.
1.4462 ±0.034 1.8352 ±0.057 2.7812 ±0.081 0 0.5 1 1.5 2 2.5 3 3.5 JMF 6 JMF 11 JMF 12 Ak tiv it a s spes if ik ( U/m g ) Isolat JMF 7
Gambar 4 Kurva Pertumbuhan ( ) dan Produksi Isolat JMF 12 ( )
Pengendapan Selulase dengan Amonium Sulfat
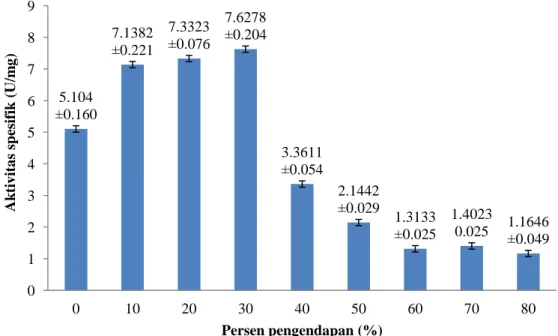
Produksi enzim selulase dilakukan dengan menumbuhkan mikrob penghasil selulase tertinggi dalam penelitian ini, yaitu JMF 12 pada media PDB 200 mL selama 1 hari inkubasi. Tahapan pemurnian pertama untuk meningkatkan aktivitas enzim selulase dari isolat JMF 12 dalam penelitian ini adalah dengan mengendapkan larutan enzim dengan amonium sulfat. Penentuan persen pengendapan dengan amonium sulfat optimum dilakukan pada penelitian ini dari amonium sulfat 10% hingga 80% (Lampiran 7). Hasil optimasi persen pengendapan dari 10% hingga 80% menunjukkan konsentrasi amonium sulfat pada 30% yang memiliki aktivitas spesifik tertinggi dibandingkan persen pengendapan lainnya, yaitu sebesar 7.6278±0.204 U/mg (Gambar 5).
Gambar 5 Aktivitas spesifik hasil optimasi persen pengendapan amonium sulfat.
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8 0 0.5 1 1.5 2 2.5 0 1 2 3 4 5 B o bo t k er ing ( g ra m ) Hari ke- Ak tiv ita s ( U/m l) 5.104 ±0.160 7.1382 ±0.221 7.3323 ±0.076 7.6278 ±0.204 3.3611 ±0.054 2.1442 ±0.029 1.3133 ±0.025 1.4023 0.025 1.1646 ±0.049 0 1 2 3 4 5 6 7 8 9 0 10 20 30 40 50 60 70 80 Ak tiv it a s spes if ik ( U/m g ) Persen pengendapan (%) 8
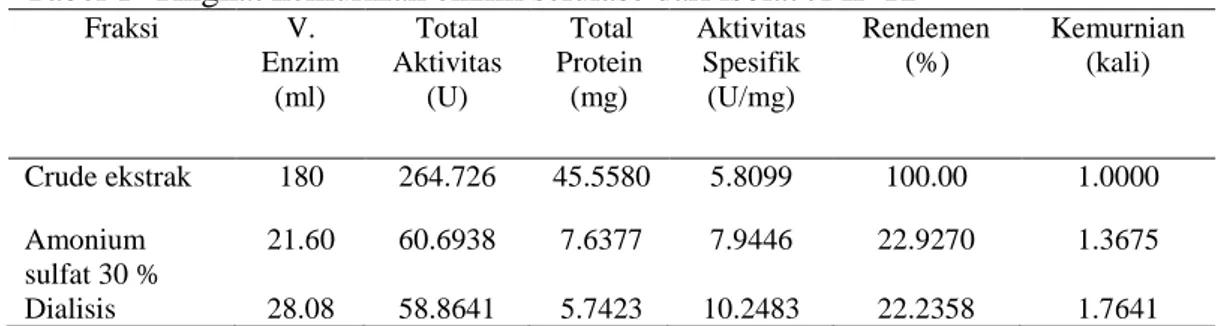
Ekstrak kasar enzim yang diperoleh sebesar 180 mL dengan nilai aktivitas selulolitiknya sebesar 1.4707±0.040U/ml dengan total aktivitas 264.7260 U dan kadar proteinnya adalah 0.2531±0.003 mg/ml dengan total kadar protein sebesar 45.5580 mg. Total aktivitas diperoleh dengan menghitung seluruh aktivitas dari volume enzim yang dihasilkan. Nilai aktivitas spesifik sebesar 5.8099±0.137 U/mg. Nilai rendemen yang diperoleh adalah 100% dengan nilai kemurniannya adalah 1 kali. Tahap pemurnian selanjutnya adalah dengan menggunakan amonium sulfat, berdasarkan hasil optimasi persen pengendapan pada ekstrak kasar selulase, nilai aktivitas spesifik tertinggi diperoleh pada persen pengendapan 30% amonium sulfat. Volume yang digunakan dalam pengendapan protein dengan amounium sulfat adalah 21.6 ml. Nilai aktivitas yang diperoleh dari tahap pemurnian dengan pengendapan larutan kasar enzim menggunakan amonium sulfat diperoleh sebesar 2.8099±0.004 U/ml dengan total aktivitas sebesar 60.6938 U. Kadar protein pada fraksi 30% sebesar 0.3536±0.003 mg/ml dengan total kadar protein sebesar 7.6377 mg. Nilai aktivitas spesifik setelah enzim diendapkan oleh amonium sulfat sebesar 7.9446±0.100 U/mg. Nilai rendemen yang diperoleh adalah 22.9270 % dengan nilai kemurniannya adalah 1.3675 kali.
Setelah dilakukan pengendapan protein dengan menggunakan amonium sulfat dilakukan dialisis yang bertujuan menghilangkan ion-ion garam. Nilai aktivitas selulolitik setelah dialisis sebesar 2.0963±0.030 U/ml dengan total aktivitas sebesar 58.8614 U. Kadar protein setelah dialisis adalah 0.2045±0.004 mg/ml dengan total kadar protein sebesar 5.7423 mg. Nilai aktivitas spesifik sebesar 10.2483±0.303 U/mg. Rendemen yang diperoleh dari hasil dialisis sebesar 22.2358 % dengan tingkat kemurnian 1.7641 kali. Tingkat kemurnian enzim selulase dari JMF 12 disajikan pada Tabel 1.
Tabel 1 Tingkat kemurnian enzim selulase dari isolat JMF 12
Fraksi V. Enzim (ml) Total Aktivitas (U) Total Protein (mg) Aktivitas Spesifik (U/mg) Rendemen (%) Kemurnian (kali) Crude ekstrak 180 264.726 45.5580 5.8099 100.00 1.0000 Amonium sulfat 30 % 21.60 60.6938 7.6377 7.9446 22.9270 1.3675 Dialisis 28.08 58.8641 5.7423 10.2483 22.2358 1.7641
Optimasi Kerja Enzim Selulase JMF 12 Suhu Optimum
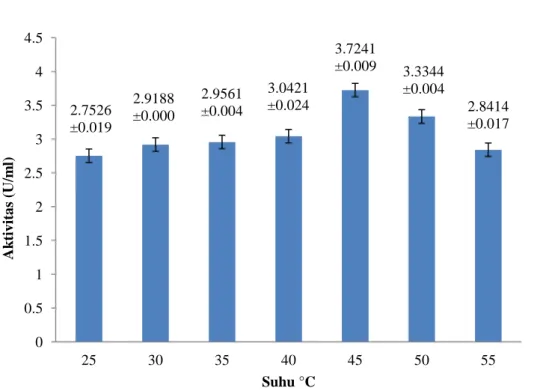
Gambar 6 menunjukkan pengaruh suhu terhadap aktivitas selulase. Pada suhu 25°C sampai 45°C, aktivitas selulase mengalami peningkatan, yaitu pada suhu 25°C sebesar 2.7526±0.019 U/ml, suhu 30°C sebesar 2.9188±0.000, suhu 35°C sebesar 2.9561±0.004 U/ml, suhu 40°C sebesar 3.0421±0.024 U/ml, hingga suhu 45°C sebesar 3.7241±0.009 U/ml dan menurun pada suhu 50-55°C, yaitu pada suhu 50°C sebesar 3.3344±0.004 U/ml, suhu 55°C sebesar 2.8414±0.017 U/ml. Aktivitas optimum diperoleh pada suhu 45°C dengan nilai aktivitas tertinggi.
Gambar 6 Suhu optimum selulase isolat JMF 12
Nilai pH Optimum
Gambar 7 menunjukkan pengaruh pH terhadap aktivitas selulase. Nilai pH antara pH 4.5 hingga 6.0 aktivitas selulase mengalami peningkatan, yaitu pada pH 4.5 sebesar 1.6578±0.021 U/ml, pH 5.0 sebesar 2.2367±0.013 U/ml, pH 5.5 sebesar 2.3199±0.019 U/ml, hingga pH 6.0 nilai aktivitas sebesar 3.3917±0.008 U/ml dan mengalami penurunan pada pH 6.5 sebesar 2.5721±0.004 U/ml, pH 7.0 sebesar 1.8871±0.008 U/ml, hingga 7.5 sebesar 0.7723±0.017 U/ml. Aktivitas tertinggi diperoleh pada pH 6.0 sebagai pH optimum.
Gambar 7 Nilai pH optimum selulase isolat JMF 12
2.7526 ±0.019 2.9188 ±0.000 2.9561 ±0.004 3.0421 ±0.024 3.7241 ±0.009 3.3344 ±0.004 2.8414 ±0.017 0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 25 30 35 40 45 50 55 Ak tiv it a s (U/m l) Suhu °C 1.6578 ±0.021 2.2367 ±0.013 2.3199 ±0.019 3.3917 ±0.008 2.5721 ±0.004 1.8871 ±0.008 0.7723 ±0.017 0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 5 5.5 6 6.5 7 7.5 Ak tiv it a s (U/m l) pH 10
Logam yang Mempengaruhi Aktivitas Selulase
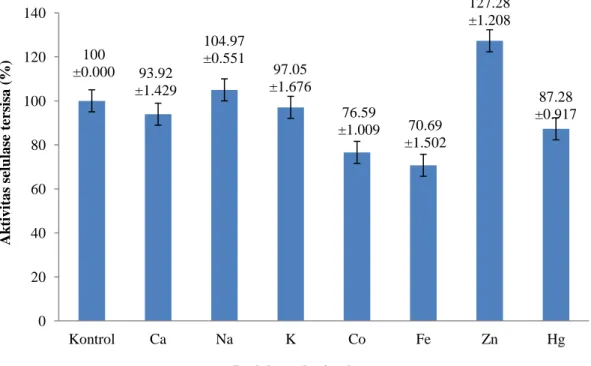
Pengaruh ion logam terhadap aktivitas selulase ditunjukkan pada Gambar 8. Hasil menunjukkan bahwa penambahan kation Na+ dan Zn2+ meningkatkan aktivitas, sedangkan Co2+, Ca2+, K+, Fe3+ dan Hg2+ menghambat aktivitas selulase.
Gambar 8 Logam yang mempengaruhi aktivitas selulase isolat JMF 12
PEMBAHASAN
Mikrob Selulolitik yang Terseleksi melalui Uji Kualitatif dan Uji Kuantitatif
Seleksi mikrob selulolitik secara kualitatif bertujuan untuk mengetahui ada atau tidaknya aktivitas enzim selulolitik dari suatu isolat. Salah satu uji kualitatif yang umum digunakan adalah melalui pewarnaan dengan larutan merah Kongo (Congo Red) 0.1%. Uji ini dilakukan dengan menumbuhkan isolat pada media agar yang mengandung karboksilmetil selulosa (CMC) komplek dan diinkubasi pada suhu ruang selama 24 jam lalu dilakukan pengamatan zona bening. Karboksimetil selulosa (CMC) merupakan suatu polimer anionik yang umum digunakan pada pengujian aktivitas selulase (Lee 2008). CMC merupakan polimer dengan bobot molekul tinggi sehingga tidak dapat ditranspor ke dalam sel mikroorganisme (Kim et al. 2004). Bobot molekul CMC bervariasi dari rentang 90-250 kDa. Hal ini menyebabkan enzim pendegradasi CMC akan ditahan pada permukaan dinding sel atau dilepaskan ke luar sel dan membuat selulase yang disekresikan akan berdifusi ke dalam permukaan media agar. Enzim selulase merupakan senyawa metabolit sekunder yang bersifat ekstraseluler (Imas 2009). Hal ini menyebabkan enzim tersebut akan disekresikan dalam media tumbuh isolat tersebut.
100 ±0.000 93.92 ±1.429 104.97 ±0.551 97.05 ±1.676 76.59 ±1.009 70.69 ±1.502 127.28 ±1.208 87.28 ±0.917 0 20 40 60 80 100 120 140 Kontrol Ca Na K Co Fe Zn Hg Ak tiv it a s selula se ter sis a ( %)
Perlakuan kation logam
Tahap pewarnaan dilakukan dalam media agar CMC selama 60 menit. Dalam selang waktu ini, pewarna merah Kongo akan mendeteksi zona yang mampu dihidrolisis oleh selulase. Prinsip pewarnaan ini adalah zat pewarna akan berdifusi ke dalam media agar dan hanya akan diabsorbsi oleh rantai panjang polisakarida yang memiliki ikatan β-D-glukan (Zhang et al. 2006). Setelah itu, kelebihan pewarna merah Kongo dibilas dengan larutan garam NaCl 1 % sebagai pencuci. Pencucian dengan larutan NaCl akan membuat zona hasil hidrolisis selulase akan tampak lebih jelas. Uji kualitatif terhadap 20 isolat jamur yang diisolasi dari limbah media jamur merang menunjukkan bahwa terdapat 11 nomor isolat yang mempunyai zona bening dan 9 isolat yang tidak menghasilkan zona bening. Zona bening yang diamati dikonversi menjadi nilai indeks selulolitik uji kualitatif dalam seleksi. Indeks selulolitik diperoleh dari nilai perbandingan antara diameter zona bening dan diameter zona koloni. Zona bening menunjukkan zona tempat terputusnya ikatan β-1,4-glikosidik yang menghubungkan monomor D-glukosa pada CMC (Hartanti 2010). Hal ini menunjukkan bahwa isolat yang memiliki zona bening merupakan isolat yang memiliki kemampuan dalam mendegradasi selulosa.
Berdasarkan hasil penelitian, diketahui bahwa isolat dari limbah media tanam jamur merang memiliki potensi menghasilkan enzim selulase untuk menghidrolisis ikatan β-1,4-glikosidik pada CMC. Selulase yang digunakan untuk proses hidrolisis ini bersifat ekstraseluler. Sifat enzim ekstraseluler terlihat dari zona bening yang terbentuk di sekitar koloni. Merah kongo berinteraksi kuat dengan ikatan β-1.4-glikosidik. Metode ini dipilih karena proses seleksi dapat berlangsung cepat, mudah, dan sensitif. Pewarnaan dengan merah kongo dapat menentukan mikrob selulolitik dalam konsentrasi selolusa yang rendah pada substrat dan dapat mempersingkat waktu inkubasi (Teather dan Wood 1982). Berbagai jenis selulase diperlukan dalam mendegradasi sempurna struktur selulosa yang kompleks (Yang et al. 2006). Hasil uji kualitatif berdasarkan penelitian ini, yaitu isolat JMF 1, JMF 3, JMF 5, JMF 6, JMF 10, JMF 11, JMF 12, JMF 13, JMF 14, JMF 15, dan JMF 19 memiliki aktivitas selulase karena mempunyai nilai indeks selulolitik, akan tetapi indeks selulolitik dari setiap 11 nomor isolat tersebut berbeda, hal tersebut menandakan bahwa terdapat perbedaan dari masing-masing isolat JMF dalam menghasilkan enzim selulase dalam menghidrolisis selulosa pada medium CMC. Kemampuan jamur dalam mendegradasi CMC dapat mendukung pertumbuhan miselia jamur dikarenakan bentuk selulosa yang lebih sederhana sehingga mudah untuk dihidrolisis oleh jamur (Ezekiel 2010). Uji degradasi dengan menggunakan metode zona bening adalah uji semi-kuantitatif, karena data yang diperoleh berupa perbandingan antara diameter zona bening dan diameter koloni yang terbentuk. Zona bening yang terbentuk terkait dengan kelarutan dari enzim selulase (Mustika et al. 2013). Berdasarkan nilai indeks selulolitik dari 11 nomor isolat JMF yang positif adanya aktivitas selulase dipilih 3 nomor Isolat JMF yang memiliki indeks selulolitik tertinggi diantaranya adalah isolat JMF 6, JMF 11, dan JMF 12. Kemudian isolat tersebut diuji secara kuantitatif dan diuji kadar protein menggunakan metode Bradford.
Uji kuantitatif dilakukan dengan mengetahui aktivitas selulase yang diukur berdasarkan jumlah gula pereduksi menggunakan metode asam dinitrosalisilat (DNS) dan glukosa sebagai kurva standar. Pengukuran aktivitas 12
enzim dilakukan dengan mensentrifus media kultur lalu diambil fraksi supernatan sebagai enzim ekstraseluler. Selanjutnya, pengukuran aktivitas enzim menggunakan metode asam dinitrosalisilat (DNS) yang didasarkan pada jumlah gula pereduksi sebagai hasil hidrolisis selulase (Dashtban et al. 2010). Metode DNS dipilih dalam pengujian ini karena merupakan metode yang umum digunakan untuk pengukuran aktivitas selulase dengan mengukur jumlah gula pereduksi yang terbentuk. Metode ini praktis dan mudah dilakukan untuk pengukuran sampel dalam jumlah yang banyak. Dalam mendegradasi selulosa menjadi glukosa, enzim endo-1,4-glukanase, ekso-1,4-glukanase, dan β-glukosidase bekerja secara sinergis (Lynd et al. 2002). Setelah enzim endo-1,4-β-glukanase memotong bagian amorphous, ekso-1,4-β-endo-1,4-β-glukanase memotong bagian ujung rantai selulosa kristalin menjadi gula pereduksi (Meryandini 2009). Prinsip pengujian dengan metode dinitrosalisilat adalah asam 3,5-dinitrosalisilat direduksi menjadi asam 3-amino-5-nitrosalisilat (Harisha 2007). Gugus aldehid pada rantai polisakarida dioksidasi menjadi gugus karboksil, disaat yang bersamaan, gugus aldehid gula akan mereduksi asam dinitrosalisilat. Reaksi tersebut akan berlangsung terus-menerus selama terdapat gula pereduksi dalam larutan yang diujikan. Perubahan warna yang terjadi pada reagen DNS adalah dari warna kuning menjadi oranye kemerahan (Febriana 2010).
Konsentrasi gula pereduksi ditentukan berdasarkan kurva standar glukosa. Kurva standar yang diperoleh memiliki persamaan y = 3.6186 x - 0.0575 dengan nilai R2 sebesar 0.9926 (Lampiran 2). Nilai limit deteksi kurva standar glukosa berdasarkan hasil perhitungan (Harvey 2000) sebesar 0.0152. Limit deteksi merupakan jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan dibandingkan dengan blanko (Harvey 2000). Data dari penelitian ini, masih diatas limit deteksi kurva standar yang didapatkan. Konsentrasi gula pereduksi digunakan untuk menghitung aktivitas enzim. Satu unit aktivitas enzim dinyatakan sebagai jumlah mikromol glukosa yang dihasilkan oleh satu mL enzim setiap menit. Berdasarkan hasil uji kuantitatif isolat yang memiliki nilai aktivitas selulolitik tertinggi adalah JMF 12, yaitu sebesar 0.7727±0.019 U/ml. Setelah diuji kadar protein diperoleh nilai aktivitas spesifik. Isolat JMF 12 memiliki aktivitas spesifik tertinggi, yaitu 2.7812±0.081 U/mg. Jika dibandingkan hasil uji kuantitatif dengan uji kualitatif sebelumnya dalam penelitian ini terdapat perbedaan nilai aktivitas selulase tertinggi. Hasil uji secara kualitatif menunjukkan bahwa isolat JMF 11 yang memiliki aktivitas tertinggi, sedangkan secara kuantitaif isolat JMF 12 yang memiliki aktivitas tertinggi. Seleksi mikrob selulolitik secara kuantitatif merupakan suatu konfirmasi dan hasilnya belum tentu tepat sama dengan penapisan daerah bening atau seleksi mikrob secara kualitatif. Hal ini disebabkan oleh kondisi lingkungan mikro yang berbeda antara medium padat dengan kultur terendam atau medium cair saat pengujian karena mempengaruhi produksi enzim (Purwadaria et al. 2003). Terdapat kemungkinan JMF 12 yang berdasarkan hasil uji kuantitatif memiliki aktivitas spesifik tertinggi akan tetapi secara kualitatif tidak, merupakan mikrob yang memerlukan kadar oksigen yang tinggi untuk pertumbuhannya. Selain itu, Setiap mikrob selulolitik menghasilkan kompleks enzim selulase yang berbeda-beda, tergantung dari gen yang dimiliki dan sumber karbon yang digunakan (Meryandini 2009). Uji kuantitatif enzim selulase dalam 13
penelitian ini menggunakan substrat CMC. Substrat CMC merupakan substrat selulosa murni yang berbentuk amorphous sehingga aktivitas enzim selulase pada substrat CMC merupakan aktivitas enzim endo-1,4-β-glukanase (Lynd et al. 2002). Endo-1,4-β-glukanase bekerja pada rantai dalam CMC menghasilkan oligosakarida atau rantai selulosa yang lebih pendek (Lynd et al. 2002).
Kurva Pertumbuhan dan Kurva Produksi Selulase dari Isolat JMF 12
Setiap mikroorganisme mempunyai kurva pertumbuhan. Kurva pertumbuhan fungi mempunyai beberapa fase, yaitu fase lag, fase akselerasi, fase eksponensial, fase deselerasi, fase stasioner, dan fase kematian. Fase lag, yaitu fase penyesuaian sel- sel dengan lingkungan dan pembentukan enzim-enzim untuk menguraikan substrat. Selanjutnya, fase akselerasi yang merupakan fase mulainya sel-sel membelah dan fase lag menjadi fase aktif. Fase eksponensial merupakan fase perbanyakan jumlah sel yang sangat banyak, aktivitas sel sangat meningkat dan fase ini merupakan fase yang penting bagi kehidupan fungi. Pada fase eksponensial dapat memanen enzim-enzim. Fase selanjutnya adalah fase deselerasi, yaitu waktu sel mulai kurang aktif membelah. Selanjutnya, fase stasioner merupakan fase jumlah sel yang bertambah dan jumlah sel yang mati relatif seimbang. Fase terakhir adalah fase kematian yang merupakan jumlah sel-sel yang mati lebih banyak daripada sel-sel-sel-sel yang masih hidup (Gandjar et al. 2006).
Tahapan pembuatan kurva pertumbuhan bertujuan mengetahui pola pertumbuhan jamur sejak fase adaptasi hingga fase kematian sel berdasarkan perhitungan bobot kering miselium atau biomassa (Gandjar et al. 2006). Gambar 9 menunjukkan isolat JMF 12 yang dikultivasi pada media PDA. Hasil kurva pertumbuhan dalam media PDB menunjukkan bahwa media ini mampu mensuplai nutrisi bagi pertumbuhan sel jamur dengan baik. Pembuatan kurva pertumbuhan JMF 12 diketahui berdasarkan bobot kering (gram) miselia yang ditimbang setiap hari sampai hari ke empat. Bobot kering miselia yang ditimbang hingga stabil menunjukkan hasil bahwa dari hari pertama hingga hari ke tiga terjadi peningkatan gram miselia dan pada hari ke empat bobot kering miselia mengalami penurunan. Penurunan tersebut disebabkan nutrisi yang dibutuhkan oleh mikrob sudah mencapai jumlah relatif sedikit, sehingga tidak dapat mensuplai nutrisi untuk pertumbuhan mikrob.
Gambar 9 Isolat JMF 12 14
Produksi enzim selulase dilakukan dengan menggunakan media PDB. Penggunaan media PDB dalam produksi enzim selulase menunjukkan adanya produksi enzim selulase. Aktivitas enzim selulase yang dihasilkan dapat ditingkatkan dengan menambahkan substrat pada media produksi enzim. Kurva produksi selulase didapatkan berdasarkan nilai aktivitas selulase dari hari pertama hingga hari ke empat. Kurva produksi selulase isolat JMF 12 menunjukkan bahwa hari pertama adalah waktu optimum produksi enzim selulase oleh JMF 12. Nilai aktivitas enzim selulase pada hari pertama sebesar 1.2796±0.115 U/ml. Nilai aktivitas enzim selulase pada hari ke dua sebesar 1.1162±0.057 U/ml. Nilai aktivitas selulase hari ke tiga sebesar 1.1248±0.152 U/ml dan hari ke empat sebesar 1.0560±0.042 U/ml. Waktu optimum produksi enzim digunakan sebagai waktu panen enzim.
Pengendapan Selulase dengan Amonium Sulfat
Pemanfaatan enzim selulase secara luas perlu didasarkan pada keefektifan aktivitasnya spesifiknya. Hal ini terkait optimasi pemurnian enzim selulase yang harus dikembangkan agar enzim selulase dapat bekerja secara optimal. Hal tersebut mendasari perlu dilakukannya pemurnian dengan pengendapan enzim oleh garam untuk meningkatkan aktivitas spesifik enzim. Penelitian ini, menggunakan garam amonium sulfat untuk pemurnian enzim selulase. Optimasi persen kejenuhan dilakukan untuk mengetahui konsentrasi optimum yang menghasilkan aktivitas selulase spesifik tertinggi dari persen pengendapan yang dilakukan. Hasil optimasi persen pengendapan yang dilakukan dapat dilihat pada Gambar 5. Berdasarkan hasil optimasi persen pengendapan garam amonium sulfat, aktivitas selulase tertinggi diperoleh pada pengendapan 30%, yaitu 2.7841±0.021 U/ml dengan aktivitas spesifik tertinggi sebesar 7.6278±0.204 U/mg. Hasil ini sesuai dengan penelitian yang dilakukan oleh Sinatari (2013), aktivitas spesifik selulase tertinggi berada pada fraksi 20-40% amonium sulfat.
Pengendapan enzim selulase dengan konsentrasi garam amonium sulfat 10% hingga 20 % belum dapat mengendapkan enzim selulase secara keseluruhan atau protein masih mengalami salting in, hal ini dibuktikan dari aktivitas selulase yang rendah. Ketika salting in, ion garam yang dihasilkan pada konsentrasi garam rendah akan melindungi molekul protein dan mencegah bersatunya molekul protein sehingga protein masih banyak yang larut dan enzim banyak yang terbuang pada saat pemisahan. Pengendapan pada konsentrasi 30% garam amonium sulfat dapat mengendapkan sebagian besar enzim selulase (salting out). Ketika salting out, ion garam yang dihasilkan akan meningkatkan muatan listrik disekitar protein yang mengakibatkan tertariknya mantel air dari protein, sehingga terjadi interaksi hidrofobik dan menurunkan kelarutan protein tersebut.
Pemisahan protein saat pengendapan dengan amonium sulfat berdasarkan sifat ioniknya selain itu enzim juga akan mengalami pemekatan (Yuanita et al. 2005). Fraksinasi protein dapat dilakukan dengan menggunakan garam amonium sulfat karena kestabilan protein di dalam amonium sulfat dapat bertahan lama. Fraksinasi protein bertujuan untuk pemisahan (pemurnian) ekstrak kasar protein (enzim) dari molekul-molekul protein lain. Prinsip pengendapan protein menggunakan prinsip salting out, yaitu mengendapnya protein (enzim) karena air berikatan dengan garam amonium sulfat. Molekul 15
protein terdiri atas bagian asam amino hidrofobik dan bagian asam amino hidrofilik. Bagian asam amino hidrofilik dari protein berinteraksi dengan molekul air sehingga protein yang mengandung asam amino hidrofilik akan larut dalam air, sedangkan protein yang mengandung asam amino hidrofobik akan mengendap terlebih dahulu (Sinatari et al. 2013). Penggunaan garam amonium sulfat digunakan untuk pengendapan enzim selulase, karena garam ini memiliki beberapa keuntungan, yaitu mudah larut, tidak toksik, dan stabil terhadap enzim karena tidak mempengaruhi struktur proteinnya. Proses pengendapan enzim selulase dengan garam amonium sulfat ditambahkan dalam bentuk kristal halus, hal ini bertujuan agar volume sampel tidak bertambah terlalu besar. Penambahan garam amonium sulfat dilakukan secara perlahan dan sambil diaduk dengan magnetic stirrer yang berfungsi agar kontak antara protein dengan garam dapat berlangsung baik. Suhu yang dingin sekitar 4°C digunakan juga pada saat pengendapan protein yang bertujuan menjaga agar protein yang terendapkan tidak mengalami kerusakan (Kristanti 2001).
Larutan kasar enzim memiliki banyak pengotor sehingga memiliki nilai aktivitas spesifik yang kecil, pada penelitian ini aktivitas spesifik larutan kasar enzim sebesar 5.8099±0.137 U/mg dengan kadar protein sebesar 0.2531±0.003 mg/ml dan aktivitas sebesar 1.4707±0.040 U/ml. Menurut penelitian Basuni (2008), aktivitas selulase yang dihasilkan sebesar 116.72 U/ml. Hal ini menunjukkan nilai aktivitas yang dihasilkan dalam penelitian ini masih rendah. Aktivitas spesifik dihitung dari perbandingan nilai aktivitas selulase dengan kadar protein. Kadar protein diukur menggunakan metode Bradford. Penentuan kadar protein dihitung berdasarkan persamaan garis y = 0.7957x + 0.0229 (Lampiran 3). Nilai limit deteksi kurva standar BSA sebesar 0.0516. Data yang didapatkan dalam penelitian ini dapat digunakan karena diatas nilai limit deteksi kurva standar BSA. Tingkat kemurnian larutan kasar enzim adalah 1 kali dengan nilai rendemen sebesar 100 %. Tingkat kemurnian diperoleh perbandingan aktivitas spesifik pemurnian dengan aktivitas spesifik larutan kasar enzim. Nilai rendemen enzim diperoleh berdasarkan dari perbandingan total aktivitas enzim yang dimurnikan dengan total aktivitas larutan kasar enzim. Aktivitas spesifik merupakan unit enzim yang terkandung dalam miligram protein. Setelah dilakukan amonium sulfat, nilai aktivitas spesifik meningkat menjadi 7.9446±0.100 U/mg pada 30% pengendapan amonium sulfat dengan kadar protein sebesar 0.3536±0.003 mg/ml dan aktivitas sebesar 2.8099±0.004 U/ml. Tingkat kemurnian setelah dilakukan amonium sulfat meningkat, menjadi 1.3675 kali dengan rendemen sebesar 22.9270 %. Hal ini disebabkan tahapan pemurnian dengan mengendapkan enzim selulase menggunakan amonium sulfat pada 30 % dapat meningkatkan aktivitas spesifik dari enzim selulase, sehingga tingkat kemurnian dari enzim bertambah. Aktivitas spesifik dapat meningkat disebabkan oleh berkurangnya kadar protein dari larutan enzim.
Selanjutnya, dalam penelitian ini dilakukan tahapan dialisis untuk menghilangkan garam-garam setelah tahapan pengendapan amonium sulfat, sehingga dapat meningkatkan nilai aktivitas spesifik dari enzim selulase yang diproduksi. Nilai aktivitas spesifik setelah dilakukan dialisis sebesar 10.2483±0.303 U/mg dengan kadar protein sebesar 0.2045±0.004 mg/ml dan aktivitas sebesar 2.0963±0.030 U/ml. Tingkat kemurnian setelah dialisis sebesar 1.7641 kali dengan rendemen sebesar 22.2358 %. Menurut Kristanti (2001), 16
penurunan protein pada sampel dialisis dapat disebabkan oleh adanya beberapa protein yang hilang selama proses dialisis. Ukuran pori-pori kantung selofan adalah 10 kDa (kilo Dalton). Adanya protein yang keluar dari kantong selofan diduga protein yang memiliki ukuran yang lebih kecil dibandingkan pori-pori kantung selofan. Tabung dialisis memiliki membran semipermeabel yang memungkinkan senyawa berukuran lebih kecil dari 10 kDA dapat keluar dari membran. Menurut penelitian Gang et al. (2010), bobot molekul enzim selulase yang dihasilkan dari Trichoderma reesei dan Aspergillus niger berkisar antara 18-120 kDa. Hal ini menunjukkan bahwa dimungkinkan enzim selulase tertahan pada tabung dialisis. Mekanisme pemurnian dengan metode dialisis adalah adanya konsentrasi garam yang lebih pekat dalam kantung selofan dibandingkan konsentrasi garam diluar kantung mengakibatkan garam yang ada dalam kantung akan keluar dan digantikan dengan larutan bufer hingga mencapai keseimbangan yaitu konsentrasi garam di dalam kantung dan diluar sama. Teknik pemurnian dialisis dilakukan tiga kali penggantian bufer, hal ini bertujuan agar ion garam amonium sulfat dapat dikeluarkan dari dalam sampel secara maksimal.
Kondisi Optimum Kerja Enzim Selulase JMF 12 Suhu Optimum
Beberapa parameter yang mempengaruhi aktivitas enzim adalah suhu, pH, dan pengaruh logam (Bintang 2010). Penelitian ini, dalam upaya mengoptimalkan aktivitas selulase maka setelah didapatkan enzim hasil pengendapan amonium sulfat, dilakukan optimasi yang meliputi suhu, pH, dan pengaruh adanya logam. Enzim dalam melakukan reaksinya dipengaruhi oleh suhu. Setiap enzim memiliki kisaran suhu tertentu untuk mencapai aktivitas yang optimum. Faktor suhu terhadap aktivitas enzim sangat kompleks, karena adanya peningkatan suhu dapat meningkatkan kecepatan reaksi enzim hingga mencapai aktivitas optimum dan disisi lain peningkatan suhu dapat mempercepat inaktivasi enzim. Gambar 6 menunjukkan aktivitas selulase yang dipengaruhi oleh suhu. Rentang pengaruh suhu terhadap aktivitas enzim selulase yang diujikan dimulai dari 25°C hingga 55°C selama 10 menit.
Enzim merupakan protein tiga dimensi yang bersifat sensitif terhadap lingkungan (Murray et al. 2009). Aktivitas selulase mengalami peningkatan seiring naiknya suhu karena energi kinetik yang dihasilkan oleh enzim semakin meningkat. Aktivitas enzim selulase mengalami peningkatan seiring bertambahnya suhu hingga mencapai aktivitas optimal pada suhu 45°C. Hasil aktivitas tertinggi berdasarkan optimasi suhu reaksi enzimatis terjadi pada suhu 45°C, yaitu sebesar 3.7241±0.009 U/ml. Menurut penelitian Yusak (2004), enzim selulase Aspergillus niger optimum pada suhu 45°C. Peningkatan gerak enzim meningkatkan terjadinya tumbukan antara enzim dengan substrat, sehingga meningkatkan produk yang dihasilkan. Sebaliknya. Suhu tinggi dapat menyebabkan enzim mengalami perubahan konformasi sisi aktif sehingga aktivitasnya mengalami penurunan (Hames dan Hooper 2005). Perubahan konformasi tersebut menyebabkan rusaknya interaksi non kovalen (ikatan hidrogen, ikatan van der walls, ikatan hidrofobik, dan interaksi elektrostatik) yang menjaga struktur 3D enzim. Akibatnya enzim mengalami denaturasi yang 17
merubah struktur lipatan enzim. Stuktur enzim akan terbuka dibagian permukaan sehingga sisi aktifnya berubah dan aktivitas enzim mengalami penurunan (Hames dan Hooper 2005). Setiap enzim bekerja lebih baik dalam kondisi tertentu dari pada kondisi yang lain, Karena kondisi optimal dapat mendukung bentuk paling aktif dari molekul enzim tersebut (Murray et al. 2009).
Nilai pH Optimum
Aktivitas selulase juga dipengaruhi oleh pH. Enzim sensitif terhadap perubahan pH, karena ion yang ada pada bufer akan mempengaruhi gugus karboksil dan gugus amino dari enzim sehingga adanya perubahan pH tertentu secara dapat menyebabkan enzim aktif dan adanya perubahan pH secara ekstrim menyebabkan enzim menjadi tidak aktif. Hasil uji aktivitas enzim selulase terhadap pH dapat dilihat pada Gambar 7. Berdasarkan hasil penelitian aktivitas selulase dari isolat JMF 12 bekerja optimal pada pH 6.0 dengan aktivitas enzim selulase sebesar 3.3917±0.008 U/ml. Menurut penelitian Febriana (2010), selulase bekerja pada pH mendekati netral, yaitu antara 6 hingga 7. Peningkatan aktivitas selulase sebelum mencapai aktivitas optimum disebabkan adanya interaksi antara H+ dari lingkungan dengan residu asam amino yang terletak pada sisi aktif enzim. Interaksi tersebut menyebabkan peningkatan keadaan ionisasi sisi aktif enzim. Hal ini menyebabkan sifat katalitik enzim untuk mengikat substrat meningkat. Ketika mencapai pH optimum, keadaan ionisasi berada pada keadaan yang tepat sehingga aktivitas enzim mencapai nilai tertinggi. Aktivitas enzim pada pH yang basa mengalami penurunan karena interaksi antara OH- dari lingkungan dengan residu asam amino akan menurunkan sifat katalitik enzim dan menyebabkan enzim terdenaturasi (Nelson dan Cox 2005).
Logam yang Mempengaruhi Aktivitas Selulase
Enzim membutuhkan koenzim dan kofaktor untuk meningkatkan sifat katalitiknya. Ion logam merupakan kofaktor yang dibutuhkan enzim untuk mengaktivasi kompleks substrat dengan enzim (Bintang 2010). Sebagai kofaktor ion logam dapat berperan sebagai aktivator atau inhibitor enzim. Ion logam akan mengikat substrat pada sisi pemotongan. Ion logam juga dapat menstabilkan konformasi aktif enzim (Baehaki et al. 2008). Hasil penelitian menunjukkan, kation Na+ dan Zn+ sebagai aktivator enzim. Hasil ini sesuai dengan hasil penelitian sebelumnya yang dilakukan oleh Munifah (2013), yaitu Zn+ dan Na+ sebagai aktivator enzim selulase. Kation Na+ merupakan bahan mineral yang dapat menjaga kestabilan aktivitas enzim (Haryati et al. 2010). Peningkatan aktivitas enzim terjadi karena ion logam menjadi bagian integral dari sisi aktif enzim, merubah konstanta keseimbangan reaksi enzimatis, merubah muatan listrik, menghambat ion inhibitor, dan menukar ion yang kurang efektif pada sisi aktif enzim atau substrat. Penurunan aktivitas enzim terjadi karena ion logam bertindak sebagai inhibitor. Hasil penelitian menunjukkan Co2+, Ca2+, K+, Fe3+ dan Hg+ menghambat aktivitas selulase. Kekuatan ion logam akan mempengaruhi konformasi dari enzim. Ion Cu2+ dan Hg2+ bertindak sebagai inhibitor irreversibel yang membentuk ikatan kovalen dengan gugus prostetik di sisi aktif enzim (Bintang 2010). Hampir semua enzim dapat dihambat oleh senyawa kimia tertentu misalnya ion logam, senyawa pengkelat, senyawa organik, bahkan substrat enzim itu sendiri (Lehninger 2004).
SIMPULAN DAN SARAN
Simpulan
Isolat terpilih hasil seleksi secara kualitatif dan kuantitaif yang memiliki nilai aktivitas selulase dan aktivitas spesifik tertinggi adalah isolat JMF 12 dengan nilai sebesar 0.7727±0.019 U/ml dan 2.7812±0.081 U/mg serta waktu produksi selulase JMF 12 optimum terjadi pada hari ke-1, yaitu sebesar 1.2796±0.115 U/ml. Optimasi pemurnian untuk meningkatkan aktivitas spesifik enzim selulase isolat JMF 12 melalui pengendapan amonium sulfat 30% menghasilkan aktivitas spesifik sebesar 7.9446±0.100 U/mg dengan nilai kemurnian sebesar 1.3675 kali. Tahapan pemurnian melalui dialisis menghasilkan aktivitas spesifik sebesar 10.2483±0.303 U/mg dengan nilai kemurnian sebesar 1.7641 kali. Selain itu, enzim selulase dari isolat JMF 12 optimum pada suhu 45ºC, pH 6 dan adanya pengaruh kation Zn2+ dan Na+ sebagai aktivator serta pengaruh kation Ca2+, K+ Co2+, Fe3+, dan Hg2+ sebagai inhibitor terhadap aktivitas selulase JMF 12. Optimasi pemurnian dapat mempengaruhi kemampuan enzim dalam meningkatkan aktivitas spesifik enzim.
Saran
Peningkatkan aktivitas spesifik dan untuk memperoleh karakter protein enzim selulase yang sudah diisolasi diperlukan penelitian lebih lanjut dengan melakukan produksi enzim selulase menggunakan induser substratnya. Selain itu, perlu dilakukan pemurnian lebih lanjut, menentukan parameter kinetika enzim, elektroforesis SDS PAGE, amobilisasi selulase, dan identifikasi isolat.
DAFTAR PUSTAKA
Alam M, Manchur M, Anwar M. 2004. Isolation, purification, characterization of cellulolytic enzymes produced by the isolate Streptomyces omiyaencis. Pakist J Biol Sci. 7(10): 1647-1653.
Anggarawati D. 2012. Aktivitas enzim selulase isolat SGS 2609 BBP4B-KP menggunakan substrat limbah pengolahan rumput laut yang dipretreatment dengan Asam [skripsi]. Depok (ID): Universitas Indonesia.
Anindyawati. 2009. Prospek enzim dan limbah selulosa untuk produksi bioetanol. Bioteknologi. 44 (1): 49-56.
Baehaki A, Maggy T, Nurheni S, Tati N. 2008. Purifikasi dan karakterisasi protease dari bakteri patogen Pseudomonas aeruginosa. Jurnal. Teknol Dan Industri Pangan. 19 (1): 80-87.
Basuni Y. 2008. Aktivitas selulase dari Ganoderma lucidum yang diinkubasikan dalam media jerami padi [skripsi]. Bogor (ID): Institut Pertanian Bogor. Bintang M. 2010. Biokimia: Teknik penelitian. Jakarta: EGC.
Bradford MM. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding . Anal Biochem. 72: 248-254.
Chandel A, Chan E, Rudravaram, Narasu M, Rao, Ravindra. 2007. Economics and environmental impact of bioethanol production technologies: an appraisal. Biotechnology and Molecular Biology Review. 2 (1): 14-32. Dashtban M, Maki M, Leung K T, Mao C, Qin W. 2010. Cellulase activities in
biomass conversion: measurenment method and comparison. Critical Reviews in Biotechnology. 1-8.
Ezekiel C, Odebode A, Omenka R, Adesioye F.A. 2010. Growth response and comparative cellulase induction in soil fungi grown on different cellulose media. Acta ATECH. 3(2): 52-59.
Febriana R. 2010. Optimasi aktivitas selulase ekstraseluler dari isolat bakteri RF-10 [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Fikrinda, Anas I, Purwadaria T, Santosa D. 2000. Isolasi dan seleksi bakteri penghasil selulase ekstremofil dari ekosistem air hitam. Mikrobiologi Indonesia. 5 (2): 48-53.
Gandjar I, Sjamuridjal W, Oetari A. 2006. Mikologi Dasar dan Terapan. Jakarta : Yayasan Obor Indonesia.
Gang Hu, John A. Heitmann, Jfr., Orlando J. Rojas, Joel J. Pawlak, Dimitris S. Argyropoulos. 2010. Monitoring cellulase protein adsorption and recovery using SDS-PAGE. Ind. Eng. Chem. Res. 49: 8333–8338.
Hames D, Hooper N. 2005. Biochemistry. New York: Taylor & Francis Group. Ed ke-3.
Harisha S. 2007. Biotechnology Procedures and Experiments Handbook. Kanada: Infinity Sci Pr.
Harvey D. 2000. Modern Analitycal Chemistry. Singapore (SG): McGraw-Hill. Haryati T., Marbun P.A., Purwadaria T. 2010. Preservasi selulase Bacillus
pumilus PU4-2 dengan teknik imobilisasi pada pollard dan penambahan kation. Mikrobiol Indonesia. 15(1): 63-71.
Imas T. 2009. Mikrobiologi Esensial. Jakarta: Ardy Agency.
Julfana R, Anita T, Idiawati N. 2013. Hidrolisis enzimatik selulosa dari ampas sagu menggunakan campuran selulase dari Trichoderma reesei dan Aspergillus niger. JKK. 2 (1): 52-57.
Kim K.H. Jeong, J.S. Ham, C.B. Yang, I.B. Chung, M.K. Kim, K.N. Kim, J. Compost Sci. 2004. Isolation and characterization of cellulase secreting bacterium from cattle manure: application to composting. Compost Science & Utilization. 12: 242-248.
Kodri, Dwi B, Yulianingsih R. 2013. Pemanfaatan enzim selulase dari Trichoderma reesei dan Aspergillus niger sebagai katalisator hidrolisis enzimatik jerami padi dengan pretreatment microwave. Bioproses Komoditas Tropis. 1 (1).
Koesnandar H, Nurhayati N. 2008. Recent development in the bioconversion of lignocelluloses into ethanol, Microbiology Indonesia. 2(3): 101-102. Kresnawati L. 2013. Purifikasi parsial dan karakterisasi β-Galaktosidase dari
isolat bakteri asam laktat (BAL) strain B134 [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Kristanti ND. 2001. Pemurnian Parsial dan Karakterisasi Lipase Ekstraseluler dari Kapang R. oryzae TR 32 [tesis]. Bogor (ID): Program Pascasarjana Ilmu Pangan, Institut Pertanian Bogor.
Kusnatul R. 2002. Pertumbuhan miselium jamur tiram abu-abu (Pleurolus sajor-ca/u) pada medium TEB (Tauge Extract Broth) yang dimodifikasi dengan berbagai konsentrasi sukrosa [thesis]. Semarang (ID): Universitas Diponegoro.
Lee Y. 2008. Purification and characterization of cellulase produced by Bacillus amyoliquefaciens DL-3 utilizing rice hull. Bioresource Technology. 99: 378–386.
Lehninger A. 2004. Principle of Biochemistry. Dasar-dasar Biokimia. Thenawidjaja Penerjemah. Jakarta : Erlangga. Jilid 1.
Lynd L, Paul J, Willem H, Isak. 2002. Microbial cellulosa utilization: fundamentals and biotechnology. Micro. Mol. Bio. Rev. 66:506-577. Meryandini A, Widosari W et al. 2009. Isolasi bakteri selulolitik dan karakterisasi
enzimnya. Makara Sains. 13 (1): 33-38.
Munifah I. 2013. produksi dan karakterisasi enzim selulase dari limbah pengelola rumput laut. Teknologi Pengelolaan Limbah. 16: 221-228.
Murray R, Granner D, Rodwell V. 2009. Biokimia Harper. Edisi ke 27. Jakarta: ECG.
Mustika R, Martina A, Leni B, Zul D, Ramadhan N. 2013. Isolasi dan seleksi jamur selulolitik dari tanah gambut di perkebunan karet Desa Rimbo Panjang kabupaten kampar Riau. Lampung, Indonesia.
Nelson D L, Cox M M. 2005. Principles of Biochemistry. New York: W.H Freeman and Company. Ed ke-4.
Nugraha R. 2006. Produksi enzim selulase oleh Penicillium nalgiovense SS240 pada substrat tandan sawit [skripsi]. Bogor (ID): Institut Pertanian Bogor. Oramahi H, Darmadji P, Haryadi. 2003. Optimasi kadar asam dalam asap cair dari
kayu karet dengan RSM [skripsi]. Yogyakarta (ID) : Universitas Gadjah Mada.
Perez J, Munoz , Rubia T, Martinez J. 2002. Biodegradation and biological treatments of cellulose, hemicelluloses and lignin: an overview. Int Microbiol. 5:53-63.
Purwadaria T, Marbun P, Arnold, Ketaren P. 2003. Perbandingan aktivitas enzim selulase dari bakteri dan kapang hasil isolasi dari rayap. JITV. 8(4).
Scopes RK. 1993. Protein Purification. New York: RR Doneley and Sons.
Sinatari, Aminin, Sarjono. 2013. Pemurnian selulase dari isolat KB kompos termofilik desa Bayat Klaten menggunakan fraksinasi amonium sulfat. Chem Info. 1: 130-140.
Sunandar B. 2010. Budidaya Jamur merang. Jakarta: Balai Pengkajian Teknologi Pertanian Jawa Barat.
Teather RM, Wood PJ. 1982. Use of congo red-polysaccharide interactions in enumeration and characterization of cellulolytic bacteria from the bovine rumen. Appl Environ Microbiol. 43(4):777-780.
Tridasma E. 2006. Produksi selo-oligosakarida dari fraksi selulosa tongkol jagung oleh selulase Trichoderma viride [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Yang Y, Biedendieck R, Wang W, Gamer M, Malten M, Jahn D, Deckwer. 2006. High yield recombinant penicillin G amidase production and export into the growth medium using Bacillus megaterium. Microb Cell Fact. 20(10):1-8
Yuanita L, Aline P, Suzana S, Sri H, Farid A, Arif B. 2005. Isolasi, pemurnian dan karakterisasi fitase Bacillus subtilis dari Holiwood Gresik. Berk Penel Hayati. 12:113-119.
Yusak Y. 2004. Pengaruh suhu dan pH buffer asetat terhadap hidrolisis CMC oleh enzim selulase dari ekstrak Aspergillus niger dalam media campuran onggok dan dedak. Sains Kimia. 8 (2): 35-37.
Zhang Y-HP, Himmel ME, Mielenz JR. 2006. Outlook for cellulase improvement: screening and selection strategies. Biotechnol Adv. 24: 452–4.
Lampiran 1 Diagram alir penelitian secara umum Kultivasi 20 nomor isolat JMF
Seleksi mikrob selulolitik
Uji kualitatif
Uji kuantitatif
Optimasi pemurnian aktivitas isolat terpilih
Pengendapan amonium sulfat Dialisis Optimasi suhu Optimasi pH Pengaruh logam Indeks selulolitik 23
Lampiran 2 Kurva standar glukosa Konsentrasi [mg/ml] Absorbansi 0.100 0.299 0.125 0.372 0.150 0.514 0.175 0.590 0.200 0.660 0.225 0.757 0.250 0.838
Lampiran 3 Kurva standar BSA (Bovine Serum Albumin)
Konsentrasi [mg/ml] Absorbansi 0.3 0.276 0.5 0.417 0.6 0.484 0.8 0.649 0.9 0.744 1.0 0.830 y = 3.6186x - 0.0575 R² = 0.9926 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 0.075 0.1 0.125 0.15 0.175 0.2 0.225 0.25 Abs o rba ns i Konsentrasi glukosa (mg/ml) 24