TINJAUAN PUSTAKA
Burung Puyuh
Bangsa burung puyuh hampir terdapat diseluruh belahan dunia yaitu benua Amerika, Eropa, Afrika, Asia sampai Australia (Woodard et al. 1973). Dikatakan pula bahwa burung puyuh termasuk genus Cotzrrnix dari family Phasianidae. Di Indonesia burung puyuh yang biasa dipelihara adalah Coturnix-coturnix japonica.
Wilson et al. (1961) mengatakan bahwa burung puyuh betina mulai bertelur pada umur 35 hari (rata-rata 40 hari) dan berproduksi penuh pada umur 50 hari. Dalam lingkungan yang sesuai puyuh berproduksi dalam periode yang lama, menghasilkan telur rata-rata 250 butir pertahun. Puyuh mampu menghasilkan 3 sampai 4 generasi dalam satu tahun. Menurut Yuwanta (1998) produksi telur ditentukan oleh produksi ovum, dan produksi ovum ditentukan oleh jumlah pakan yang dikonsumi. Produksi telur yang tinggi sampai akhir produksi dapat dicapai dengan memberikan makanan yang berkualitas baik yang sesuai dengan kebutuhan. Sedangkan Woodard et al. (1973) mengemukakan bahwa waktu untuk pertama kali bertelur pada burung puyuh dicapai pada umur sekitar 42 hari, dimana dewasa kelamin lebih cepat dicapai oleh puyuh betina namun dewasa tubuh lebih cepat oleh puyuh jantan. Kemudian dikatakan bahwa kematangan seksual puyuh dicapai pada pakan yang mengandung 25% protein sedangkan pada level 20% protein diperoleh produksi, fertilitas dan daya tetas telur yang optimal, disamping itu puyuh juga membutuhkan beberapa trace element seperti zinc, selenium dan magnesium.
Fertilitas optimum diperoleh dari perkawinan rasio I jantan dengan 1 atau 2 betina, fertilitas yang rendab dengan rasio perkawinan yang tinggi disebabkan oleh preferensi tingkah laku kawin (Woodard dan Abplanalp, 1967). Selama penyimpanan daya tetas telur menurun secara konstan sekitar 3% perhari. Kandungan nutrisi telur puyuh disajikan pada Tabel 1.
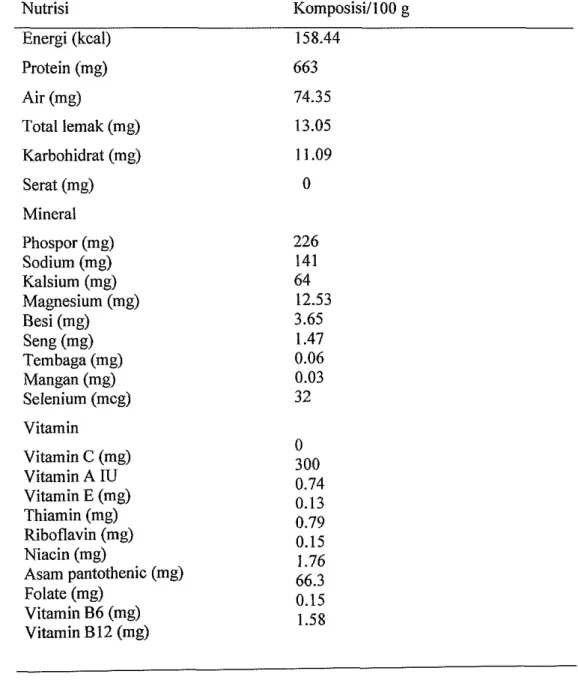
Tabel 1 Kandungan nutrisi telur puyuh (Riana 2000) Nutrisi Komposisi/100 g Energi (kcal) 158.44 Protein (mg) 663 Air (mg) 74.35 Total lemak (mg) 13.05 Karbohidrat (mg) 11.09 Serat (mg) 0 Mineral Phospor (mg) 226 Sodium (mg) 141 Kalsium (mg) 64 Magnesium (mg) 12.53 Besi (mg) 3.65 Seng (mg) 1.47 Tembaga (mg) 0.06 Mangan (mg) 0.03 Selenium (mcg) 32 Vitamin Vitamin C (mg) 0 Vitamin A IU 300 0.74 Vitamin E (mg) 0.13 Thiamin (mg) 0.79 Riboflavin (mg) 0.15 Niacin (mg) 1.76 Asam pantothenic (mg) 66.3 Folate (mg) 0.15 Vitamin B6 (mg) 1.58 Vitamin B12 (mg)
Umur induk berpengaruh terhadap daya tetas, dimana daya tetas telur maksimum terjadi pada umur induk 8-24 minggu (Woodard ef al. 1973). Selanjutnya dijelaskan bahwa kematian sebagian besar embrio puyuh terjadi selama 3 hari pertama inkubasi dan sesaat sebelum menetas. Puncak kematian umumnya disebabkan ketidakmampuan embrio berkembang membentuk organ vital atau kegagalan perkembangan embrio daiam fungsi-fungsi kritis yang
meliputi: pertukaran posisi embrio sebelum pipping (pemecahan kerahang), pemanfaatan sisa albumen dan penyerapan kantong kuning telur.
Woodard dan Wilson (1963) menyebutkan bahwa Telur puyuh mempunyai karakteristik pola warna yang bervariasi mulai dari coklat gelap, putih kekuningan dengan corak wama hitam, coklat atau bim. Telur puyuh pertama lebih kecil dibandingkan dengan telur puyuh berikutnya. Kemudian Mohmond dan Coleman (1967) melaporkan bahwa proporsi relatif dari telur puyuh adalah 47.4% albumen, 31.9% kuning telur, 20.7% memhran dan kerabang telur, sedangkan ketebalan kerabang dan membran adalah 0.197 dan 0.063 mm. Berat rata-rata telur puyuh 10 gram (sekitar 8% dari bemt tubuh betina).
Fertilitas dan Daya tetas
Fertilitas telur dipengaruhi oleh banyak faktor antara lain adalah kualitas sperma, kualitas ransum dan umur induk (North dan Bell 1990; Funk dan Irwin 1955). Fertilitas akan menurun apabila induk dan pejantan puyuh telah berusia lebih dari enam bulan (Woodard dan Abplanalp 1967)
North dan Bell (1990) mengemukakan bahwa ada 2 pengertian daya tetas, yang pertama adalah persentase telur yang menetas dari sejumlah telur yang ditetaskan. Kedua adalah persentase telur yang menetas dari telur yang fertil. Banyak faktor yang dapat mempengaruhi daya tetas, diautaranya adalah umur telur atau lamanya penyimpanan telur (Fasenko et al. 1992), dan ukuran telur (Tullet dan Burton 1982). Imbangan antara jantan dan induk juga akan mempengaruhi daya tetas (McDaniel et al. 1981), kualitas jantan ikut berperan dalam daya Letas. Inovasi dalam manajemen penetasan dan teknologi penetasan berkaitan erat dengan mortalitas embrio (Roque dan Soares 1994).
Peranan Selenium (Se) dan Vitamin E
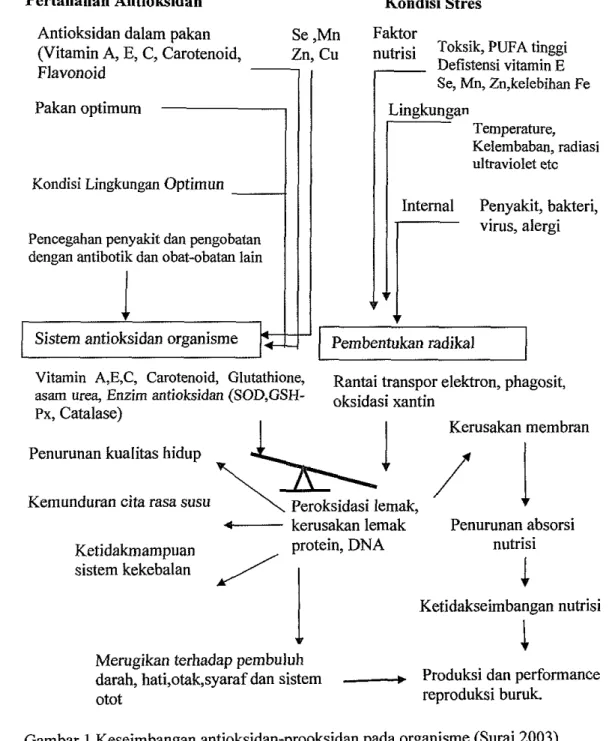
Bowie and O'Neill (2000) menyatakan bahwa keseimbangan antioksidan dan prooksidan merupakan unsur penting dalam pembentukan gen. Selanjutnya dikatakan bahwa keseimbangan antioksidan merupakan salah satu jalan untuk memelihara efisiensi produksi dan reproduksi pada temak. Gambar 1 menjelaskan keseimbangan antioksidan-prooksidan di mana selenium dan vitamin E sebagai komponen antioksidan dan keterkaitannya dalam produksi dan reproduksi temak.
Pertahanan Antioksidan Kondisi Stres Antioksidan dalam pakan Se ,Mn Faktor
(Vitamin A, E, C, Carotenoid, Zn, Cu nutrisi Toksik, PUFA tinggi Flavonoid
1
1
Defistensi vitamin E Se, Mn, Zn,kelebihan Fe Pakan optimum7
Kondisi Lingkungan Optimun
I
Pencegahan penyakit dan pengobatan dengan antibotik dan obat-obatan lain
I
Lingkungan
r
Temperature,Kelembaban, radiasi ultraviolet etc Internal Penyakit, bakteri,
virus, alergi
Vitamin A,E,C, Carotenoid, Glutathione, transpor elehon, phagosit, asam urea, Enzim antioksidan (SOD,GSH- oksidasi xantin
Px, Catalase)
I
I
Kerusakan membran+
.
C
Penurunan kualitas hidup
Kemunduran cita rasa susu Peroksidasi lemak,
9
1
+--- kerusakan lemak Penurunan absorsi Sistem antioksidan organisme
Ketidakmampuan
J
DNA nutrisi sistem kekebalan1
Ketidakseimbangan nutrisi I Pembentukan radikal CMerugikan terhadap pembuluh
4
darah, hati,otak,syaraf dan sistem
----.-
Produksi dan Performanceotot reproduksi buruk.
Gambar 1 Keseimbangan antioksidan-prooksidan pada organisme (Surai 2003) Jaeschke (1995) menyebutkan bahwa kondisi stres berhubungan dengan produksi radikal bebas yang menyebabkan stres oksidasi, dan keseimbangan prooksidan-antioksidan berpotensi mengakibatkan kerusakan jaringan. Selanjutnya Dalton et al. (1999) menerangkan bahwa berbagai kondisi stres merangsang pembentukkan radikal bebas yang disebabkan penurunan rangkaian oksidasi dan phosporilasi dalam mitokondria sehingga menghasilkan peningkatan
kerusakan elektron dan produksi radikal superoksida yang berlebihan. Kondisi stres secara umum dibagi kedalam tiga kategori utama. Kategori terpenting adalah stres nutrisi meliputi level tinggi asam lemak polyunsaturated pada pakan, defisiensi vitamin E, Selenium, Zinc atau mangan, kelebihan besi, hipervitaminosis A dan kehadiran bemacam-macam racun serta komponen- komponen racun. Kelompok kedua adalah stres kondisi lingkungan seperti peningkatan temperatur, kelembapan, radiasi dan lain-lain. Kategori ketiga yaitu stres internal yang disebabkan oleh bermacam-macam bakteri atau virus penyebab penyakit. Selain itu penetasan, anak yang berada pada inkubator sesaat setelah menetas, pengangkutan dari inkubator ke kandang serta vaksinasi dapat meningkatkan stres.
Produksi radikal bebas melebihi kapasitas sistem antioksidan untuk menetralkan peroksida lemak mengakibatkan kerusakan lemak tak jenuh pada sel membran, asam amino pada protein dan nukleotida pada DNA. Sebagai basilnya keutuban sel dan membran terganggu (Surai 1999). Kerusakan membran dapat mengakibatkan penurunan efisiensi absorbi nutrisi (meliputi vitamin larut dalam air) dan menimbulkan ketidakseimbangan vitamin, asam amino dan Inorganik. Keadaan ini mengakibatkan penurunan produksi dan penampilan reproduksi, kondisi ini semakin memburuk dengan penurunan kekebalan dan perubahan pada Cardiovascular, otak, saraf dan otot disebabkan peningkatan peroksida lemak.
Surai (2003) mengatakan bahwa konsumsi nutrisi antioksidan pada pakan dapat memelihara status antioksidan alami ternak. Selanjutnya dijelaskan bahwa penyediaan optimal selenium organik (Se) dengan kombinasi vitamin E memperbaiki stres dan daya tahan terhadap penyakit sebagai hasilnya performa produksi dan reproduksi meningkat. Kerja Se berhubungan erat dengan antioksidan lainnya terutama vitamin E, manfaat selenium pada dasmya terbentuk dari interaksi dengan vitamin E. Menurut Wilson (1997), dalam perkembangan embrio vitamin E dan selenium saling berinteraksi. Selanjutnya MacPherson (1994) menyatakan bahwa aktivitas Se dan vitamin E bekeja secara sinergis sebagai antioksidan utama menghilangkan radikal lemak, radial bebas oksigen atau metabolit reactive oksigen yang merupakan bagian yang penting dari fungsi sel, akan tetapi berpotensi mengakibatkan kerusakan sel dan proses
penyakit bila pola mekanisme pertahanannya berlebihan. Sitompul (2003) menjelaskan bahwa peran antioksidan diartikan sebagai suatu fungsi homeostatis dari organisme untuk menanggulangi akibat kerusakkan sel, jaringan dan organ akibat pengaruh radikal bebas.
Selenium dapat menghemat atau mengurangi kebutuhan vitamin E dengan liga cara: (1) menjaga fungsi pankreas, yang membuat pencemaan lemak normal sehingga penyerapan vitamin E lebih baik; (2) menurunkan jumlah vitamin E yang dibutuhkan untuk menjaga keutuhan membran lemak melalui GSH-Px; (3) membantu retensi vitamin E dalam plasma darah (Scott et al. 1982). Selanjutnya dikatakan bahwa vitamin E dapat mengurangi kebutuhan selenium dengan cara: (1) mencegah hilangnya selenium dari tubuh dengan jalan mempertahankan selenium dalam tubuh dalam bentuk aktif; (2) mencegah terjadinya rantai oto- oksidasi yang reaktif dalam membran sehingga menghambat produksi hidroperoksida.
Selenium Organik dan Inorganik
Selenium suatu unsur semilogam (metalloid) yang mempunyai sifat-sifat kimia mirip dengan sulfur. Selenium mempunyai nomor atom 34 dan berat atom 78.96. (McDowell 1992). Dalam beberapa nomor senyawa, Se menggantikan S atau Se ditemukan sebagai kompleks dengan S melalui ikatan kovalen koordinat (Scott et al. 1982). Mineral Se dapat direduksi menjadi bentuk oksidasi -2 (selenida) atau dioksidasi menjadi bentuk reduksi +4 (selenit) atau +6 (selenat) (McDowell 1992). Se mempunyai dua bentuk asam yaitu selenious (HzSe03) dan selenic (H2Se04), dimana dalam bentuk garamnya berturut-turut adalah selenit dan selenat (Georgievskii 1982). Tanaman dan mikroorganisma dapat mengganti S dalam sistein dan methionine dengan Se dengan demikian menghasilkan selenosistein dan selenomethionin (Scott et al. 1982).
Selenium secara kimiawi mempunyai 2 bentuk, organik dan inorganik. Selenium inorganik dapat ditemukan dalam bentuk logam selenit, selenat dan selenide. Sebaliknya dalam unsur sayuran selenium merupakan bagian dari asam- asam amino meliputi methionine dan sisteine yang menggantikan sulfur. Di alam ternak menerima selenium terutama dalam bentuk organik (Surai 1999). Selenoaminoacid adalah Selenomethionin, selenosisteine, dan selenosistine
sumber utamanya terdapat pada selenium tumbuhan (Levander 1986). Total selenium di dalam tumbuhan dan biji-bijian 50-80% merupakan selenoaminoacid yang terikat didalam protein sebagai Selenomethionin dan selenosistine (Butler dan Peterson 1967).
Keterbatasan penggunaan selenium inorganik adalah dapat bersifat racun, penyimpanan rendah, efisiensi transfer ke susu dan daging rendah dan kemampuan untuk mempertahankan cadangan selenium tubuh rendah, sehingga sebagian besar dari selenium yang dikonsumsi akan diekskresikan (Surai 1999). Selenomethionin tidak dapat disintesis dari selenit atau selenat pada temak, tetapi selenosistein dapat ditemukan pada tubuh ternak yang mengkonsumsi selenium inorganik seperti selenit dan selenat, ha1 ini disebabkan karena selenosistein tergabung didalamnya sintesis glutathione dan selenoprotein lainnya (Sunde 1990). Unggas tidak dapat mensintesis sistein sehingga Selenomethionin dibutuhkan untuk konversi Selenomethionin menjadi selenosistein. Selenomethionin berubah menjadi selenosistein melalui enzim sistothionase (Esaki et al. 1981). Lebih lanjut Sunde (1990) memaparkan, selenosistein dapat menggantikan sistein pada banyak protein, agar selenosistein dapat bergabung kedalam selenoprotein maka dibutuhkan reaksi selenosistein-P-lyase. Arthur (1997) mengatakan bahwa selenium organik harus berubah dari bentuk dasar organik kedalam bentuk inorganik dan kemudian kembali lagi kedalam bentuk organik untuk memenuhi fungsi biologisnya dalam sintesis selenoprotein. Kemudian Hawks et al. (1985) menambahkan bahwa 30-80% dari selenium didalam tubuh adalah selenosistein. Selenosistein adalah asam amino yang sangat penting dalam sintesis sitosolik glutathione peroksidase (Rotruck et al. 1973). Pada umumnya deposit Se dalam jaringan mempunyai konsentrasi lebih tinggi bila Se tersedia dalam bentuk organik dibandingkan dalam bentuk inorganik (McDowell 1992).
Kelebihan selenium organik dibandingkan dengan selenium inorganik menurut Surai (2003) adalah dapat berakumulasi pada jaringan dalam menyediakan cadangan selenium. Cadangan selenoarninoacid akan digunakan pada kondisi shes untuk sintesis selenoprotein dan mengatasi pengaruh buruk radikal bebas. Transfer yang efisien dari makanan induk ketelur dan jaringan
embrio dapat memperbaiki pertahanan antioksidan anak yang baru menetas dan meningkatkan resistensi terhadap penyakit serta memperbaiki daya tahan hidup anak. Transfer Se ketelur dan daging lebih efektif sehingga menghasilkan produk ternak yang dapat dikonsumsi kaya kandungan Se. Se organik memiliki sifat antioksidan sedangkan Se inorganik bersifat prooksidan dapat memicu pembentukan superoksida dan stres oksidasi melalui reaksi reduksi dengan glutathion. Selenomethionin (Selenomethionin) relatif tidak toksik, tidak katalitik dan tidak menghasilkan superoksida (Steward et al. 1999). Selenomethionin menyebabkan respon perbaikan DNA dan melindungi fibroblast dari kerusakan DNA (Seo et al. 2002). Sementara itu selenit dan selenat meningkatkan oksidasi elektron dan pernutusan rantai DNA (Sugiyama et al. 1987; Snyder 1988; Milligan et al. 2002). Selenomethionin dipertimbangkan sebagai antioksidan yang sangat kuat melindungi kerusakan sel dari pengaruh peroksinitrit. Selenoaminoacid ini secara langsung terlibat dalam garis ketiga dari pertahanan antioksidan (Sies et a1 1998.
Groof dan Sareen (1999) mengemukakan bahwa duodenum merupakan tempat utama penyerapan selenium, sedangkan pada jejenum maupun ileum penyerapan terjadi sangat sedikit. Se inorganik merupakan mineral jarang yang diabsorbsi secara pasif. Selama absorbsi Se inorganik direduksi membentuk selenid dan untuk memudahkan absorbsi perlu oksidasi tinggi, selanjutnya Se berikatan dengan protein plasma yang kemudian ditranspor ke hati untuk menjadi bagian dari cadangan Se dalam pembentukan selenoprotein. Selenoaminoacid diabsorbsi secara aktif melalui mekanisme transpor asam amino dan langsung Inenyebar diseluruh tubuh melalui darah dan ditranspor ke hati, selanjutnya berubah kedalam bentuk aktif selenoprotein atau langsung ke jaringan untuk bergabung kedalam protein jaringan. Masuknya Se organik kedalam sintesis protein jaringan akan meningkatkan penyimpanan selenium, sehingga kandungan selenium jaringan meningkat. Pada tingkat seluler, daur ulang protein tubuh berlangsung terus menerus, perombakan protein terjadi pada proteosom dan sintesis kembali di dalam ribosom (Combs dan Combs 1986).
Selenomethionin diabsorbsi lebih efektif dibandingkan dengan selenit, absorbsi asam selenomethionin diperkirakan 50-SO%, lebih baik dibandingkan
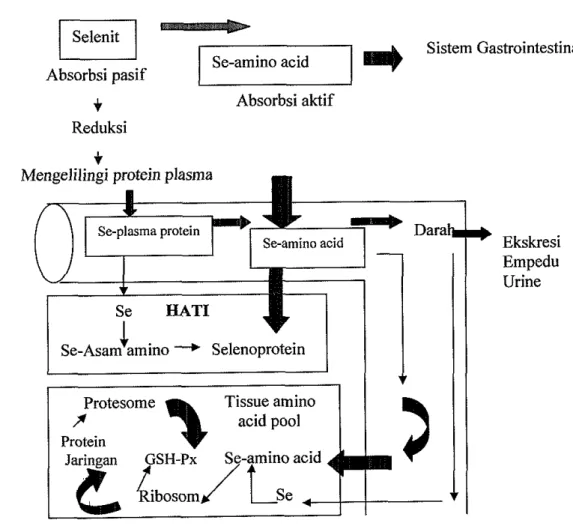
dengan absorbsi selenosistein. Sedangkan absorbsi selenit antara 44-70%, selenat diabsorbsi lebih baik dibandingkan selenit. Faktor-faktor yang meningkatkan absorbsi selenium termasuk Vitamin C, A dan E (Groof dan Sareen 1999). Mekanisme transporlasi dan absorbsi selenium dalam tubuh diilustrasikan pada Gambar 2.
Selenit
E l
Absorbsi pasif
m
Se-amino acidI)
Sistem Gastrointestinal
+
Absorbsi aktif Reduksi+
Ekskresi Empedu Urine Se a A T IGambar 2 Mekanisme transportasi dan absorbsi Se (Groof dan Sareen 1999) Metabolisme Selenium Organik dan Inorganik
Menurut Groof dan Sareen (1999), Se organik merupakan rangkaian yang khas untuk metabolisme karena bermanfaat untuk cadangan nutrisi yang akan digunakan untuk sintesis protein dalam otot, reproduksi, dan jaringan lain. Sebaliknya sebagian besar Se inorganik tidak dimanfaatkan dalam pembentukkan selenoprotein tetapi di ekskresikan melalui ginjal.
Di dalam jaringan hati, selenomethionin yang diperoleh dari makanan kemungkinan akan disimpan di dalam kelompok asam amino, atau digunakan untuk sintesis protein khususnya asam amino methionine atau dikatabolisme menjadi Se-Adenosylmethionin (SeAm) yang akhimya menghasilkan selenosistein dan selenosistin. Selenosistein yang diperoleh dari makanan atau hasil dari metabolisme selenomethionin akan didegradasi oleh selenosistein
P-
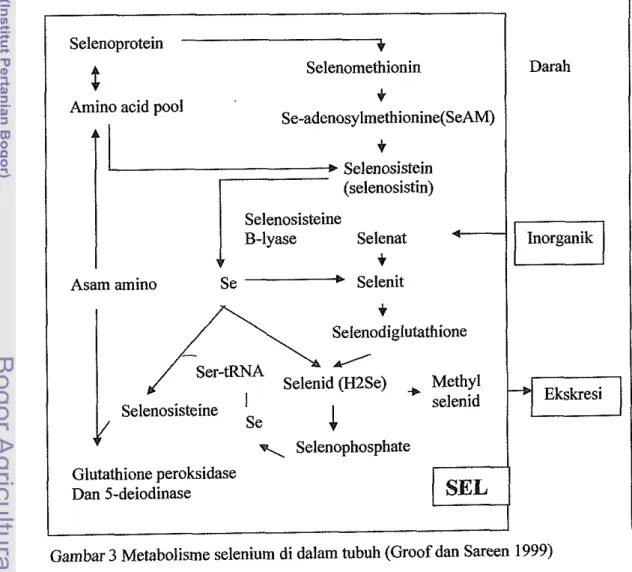
lyase untuk menghasilkan selenium bebas. Selenium bebas tersebut kemudian menempel pada transfer RNA yang berisi serin dan akhimya bergabung ke dalam kelompok enzim-enzim selenium. Selenium yang tidak digunakan sebagai kofaktor enzim kemungkinan disimpan untuk pemanfaatan berikutnya atau diubah menjadi selenid (H2Se) dan.selenit, atau diekskresikan (Groof dan Sareen 1999).Metabolisme selenium organik dan inorganik secara skematis tersaji pada Gambar 3.
Selenoprotein
t
C Selenomethionin
I
Darah+
Amino acid pool
+
Se-adenosylmethionine(SeAM) Selenosistein
7
(selenosistin)lL
+
I
Selenosisteine B-lyase Selenat+
Asam amino Se
-
SelenitEkskresi
I
Selenodiglutathione Methyl selenid Selenosisteine u, SelenophosphateGambar 3 Metabolisme selenium di dalam tubuh (Groof dan Sareen 1999) Glutathione peroksidase
Selenat di dalam tubuh diubah menjadi selenit kemudian dimetabolisme menjadi selenodigluthatione yang kemudian diubah menjadi selenide, selanjutnya selenide didegradasi menjadi selenophosphat atau methylselenide yang akan diekskresikan. Selenophosphat dimetabolisme dan kemudian menempel pada tRNA untuk sintesis 5-deiodinase atau gluthatione peroksidase.
Vitamin E
Vitamin E baru ditemukan sekitar tahun 1922 oleh Herbert Evans (Sell 1993). Kemudian Piliang (2004) menambahkan bahwa nama vitamin E dibuat oleh Evan (1925) yang kemudian peneliti lain yaitu Emerson mencoba memurnikan faktor tersebut dan menamakannya tocopherol yang berasal dari bahasa Yunani (tokos = kelahiran bayi dan kata kerja pherein = membawa atau menyebabkan). Penambahan akhiran ol pada akhir kata menunjukkan bahwa vitamin tersebut termasuk golongan alkohol.
Vitamin E meliputi 8 komponen yang disintesis oleh tumbuh-tumbuhan. Komponen ini dibagi menjadi 2 kelas yaitu: tocols yang mempunyai rangkaian jenuh (saturated) dan tocotrienols (trienol) yang mempunyai rangkaian tak jenuh (unsaturated). Masing-masing kelas tersusun dari 4 vitamer yaitu a,
P,
y, dan 6 yang memiliki karakteristik dan aktivitas biologis. Komponen yang paling aktif adalah a-tocopherol kemudian $-tocopherol yang lebih aktif dari y dan 6 tocopherol. Sedangkan untuk tocotrienols, hanya P-tocohienols yang mempunyai aktivitas sedikit lebih tinggi dari a-tocotrienols, sementara aktivitas y dan 6 tocotrienol tidak diketahui. Komponen lain dari vitamin E adalah a-tocopheryl acetat (Groff dan Sareen 1994). Ekstraksi tocopherol dari minyak tumbuh- tumbuhan menghasilkan dl-a-tocopheryl acetat. dl-a-tocopheryl acetat merupakan sumber vitamin E terbesar untuk suplementasi (McDowel2000)Farrel dan Robert (1994) mengemukakan bahwa secara umum vitamin E berfungsi sebagai antioksidan biologis yang melindungi membran seluler dari kerusakan oksidatif dan membersihkan (scavenger) membran dari radikal-radikal bebas. Vitamin E berpengaruh terhadap aktivitas enzim pada plasma, juga berperan dalam pengaturan sintesis asam nukleat, ekspresi gen dan kontrol daur hidup beberapa protozoa tertentu. Selanjutnya dikatakan, phospolipid pada sel dan subsel membran mengandung asam-asam lemak tak jenuh yang mudah
mengalami peroksidasi karena itu vitamin E sebagai antioksidan yang larut dalam lemak melindungi asam-asam lemak tersebut dengan jalan memecahkan radikal bebas yang dapat mengakibatkan kerusakan membran. Groff dan Sareen (1994) menambahkan bahwa fungsi vitamin E memelihara integritas sel tubuh, mencegah peroksidasi asam-asam lemak tak jenuh yang berada pada phospolipid membran seluler, membran mitokondria dan endoplasmik retikulum.
Metabolisme Vitamin E
Absorbsi vitamin E herhubungan dengan pencemaan lemak, dipermudah dengan adanya empedu dan lipase pankreas. Usus halus merupakan tempat utama absorbsi vitamin E dalam bentuk alkohol bebas maupun ester, sebagian besar vitamin E diabsorbsi sebagai alkohol. AIkohol rnemasuki usus dan ditranspor ke seluruh sirkulasi darah melalui kelenjar getah bening. Aktivitas terbesar vitamin E pada plasma dan jaringan hewan dalam bentuk a-tocopherol. Tocopherol masuk ke dalam sistem sirkulasi, menyebar keseluruh tubuh dan penyimpanan terbesar berada pada jaringan lemak. Vitamin E disimpan di dalam seluruh jaringan bbuh, terutama disimpan dijaringan adiposa, hati dan otot, penyimpanan terbesar berada pada hati. Sejumlah kecil vitamin
E
akan tersimpan di dalam tubuh dalam waktu yang lama. Jalur ekskresi utama dari absorbsi vitamin E adalah empedu. Biasanya kurang dari 1% konsumsi vitamin E akan diekskresikan melalui urine (McDowel 2000).Selenium dan Vitamin E sebagai Antioksidan
MacPherson (1994) menjelaskan bahwa Se merupakan mineral jarang (trace mineral) yang sangat efektif sebagai antioksidan yang penting untuk temak. Peranan Se yang sangat penting bagi temak adalah fungsinya dalam aktivitas selenoenzim (Gluthation peroksidase (GSH-Px)), GSH-Px bersama dengan katalase, melindungi sel dari kerusakan yang disebabkan oleh radikal bebas, peroksida dan oksidasi asam-asam lemak tak jenuh yang mengakibatkan kerusakan sel lemak serta menghancurkan peroksida sebelum peroksida dapat merusak membran seluler. Berbagai reaksi dan fungsi GSH-Px dalam tubuh meliputi detoksifikasi mencegah berakumulasinya hidrogen peroksida
(HOOH)
tereduksi, sintesis hormon-hormon tertentu yang berasal dari asam lemak arakhidonat, dan metabolisme senyawa-senyawa asing. Disamping itu glutathione sebagai kofaktor dalam metabolisme aldehida tertentu (methylglyoxal dan formaldehid), kemungkinan juga sebagai transport asam amino dalam ginjal. Lebih lanjut Brody (1994) menjelaskan, reabsorpsi asam amino yang terdapat dalam filtrat glomerulus menggunakan bermacam-macam sistem transport, salah satu sistem transport ini melibatkan glutathione. Sistem yang melibatkan glutathione erat hubungannya dengan enzim batas luar membran yaitu y-
glutamyltranspeptidase, enzim ini membatasi sel-sel epitel yang menempel pada lumen tubulus ginjal. Subtrat asam amino yang dikenali oleh enzim ini adalah sistein, glutamin, methionin, alanin dan serin, juga beberapa substrat dipeptida. Produk reaksi ini dipindahkan ke dalam sel epitel, dan kemudian dipecah kedalam asam amino sel. Selain itu Brigelius-Flohe (1999) menyebutkan bahwa fungsi utama dari GSH-Px adalah mengatur keseimbangan reaksi redoks. GSH-Px mengkatalisis pelepasan H202 menurut sepasang reaksi dibawah ini (Underwood
1977).
Glutatson Peroksidaso
2GSH
+
Hz02-
GSSG+
Hz0Glutat~on perolrsndm
GSSG
+
NADPH-
2GSH+
NADP'Selenium merupakan komponen penting sejumlah selenoprotein yang terlibat dalam aktivitas antioksidan. Selenoprotein P, selenoprotein W dan ke empat tipe GSH-Px berperan dalam menetralkan hidroperoksida dan radikal- radikal bebas oksigen pada berbagai jaringan. Selenoprotein terbaik adalah tipe GSH-Px. Empat tipe GSH-Px yaitu classical GSH-Px (Rotruck et al. 1973; Flohe et al. 1973). Kemudian Ursini et al. (1982) menemukan selenoperoksida kedua adalah phospholipid hidroperoksida GSH-Px (PH-GSH-Px). Maddipati dan Mamett (1987) menyebutkan selenoperoksida tipe ketiga adalah plasma GSH-Px (PGSH-Px). Selenoperoksida keempat adalah gastrointestinal GSH-Px (GI-GSH- Px) (Chu et al. 1993). Enzim-enzim ini berbeda pada spesifik jaringan dan fungsi utamanya adalah memusnahkan dan detoksifikasi hidrogen peroksida dan hidroperoksida lemak (Ursini et al. 1997).
MacPherson (1994) menyebutkan bahwa distribusi masing-masing tipe gluthatione peroksidase berbeda-beda tiap jaringan dan species, sehingga kebutuhan dan gejala defisiensi tiap species juga berbeda. Cytosolic GSH-Px merupakan selenoprotein yang termasuk ke dalam salah satu enzim antioksidan yang meliputi katalase, glutathion transferase dan superoksida dismutase. Enzim- enzim ini menetralkan radikal-radikal oksigen dan hidrogen peroksida yang dihasilkan didalam sel. Bersama-sama enzim-enzim tersebut mengurangi persediaan superoksida dan peroksida sehingga mengurangi kemungkinan kerusakan isi sel dan membran sel (Combs dan Combs 1986). Phospholipid hidroperoksida GSH-Px, erat kaitannya dengan membran sel, pada tipe GSH-Px ini terjadi interaksi antara selenium dan vitamin E, enzim ini dapat menetralkan peroksidasi lemak dan secara langsung melindungi membran. PH-GSH-Px kurang sensitif dibandingkan dengan cytosolic GSH-Px (McPherson 1994). Selanjutnya dikatakan bahwa plasma GSH-Px (PGSH-Px) adalah antioksidan ekstraseluler yang bersumber dari ginjal, berperan melindungi sel endothelial lapisan darah dan pembuluh getah bening. Sedangkan gastrointestinal GSH-Px (GI-GSH-Px) merupakan bentuk enzim dalam sel sistem gastrointestinal.
Selenoprotein P memiliki peranan antioksidan, di dalam fraksi protein plasma darah mengandung 60-80% Se. Selenoprotein W merupakan antioksidan yang berada di dalam hati dan jaringan otot, dan kemungkinan jumlahnya didalam jaringan tersebut sama dengan jumlah GSH-Px. Konsentrasi selenoprotein jaringan tergantung pada konsumsi selenium (Chen et al. 1990; Persson-Moschos
et al. 1998).
Vitamin E melindungi hati dari peroksidasi lemak dan kerusakan membran sel (Whitehead et al. 1998). Kemudian Halliwell dan Gutteridge (1989) mengemukakan bahwa vitamin E dikenal sebagai komponen hiologi membran dan dipertimbangkan sebagai rantai antioksidan dalam peroksidasi lemak Vitamin E terutama ditemukan pada hidrokarbon membran lemak sebagai alat penghubung membran dan erat kaitannya dengan oksidasi enzim yang mengakibatkan produksi radikal bebas, vitamin E melindungi sel dan jaringan dari kerusakan oksidasi oleh radikal bebas (Gallo-Toress 1980). Selanjutnya disebutkan bahwa vitamin E memegang peranan penting dalam metabolisme Se, dan Se dibutuhkan
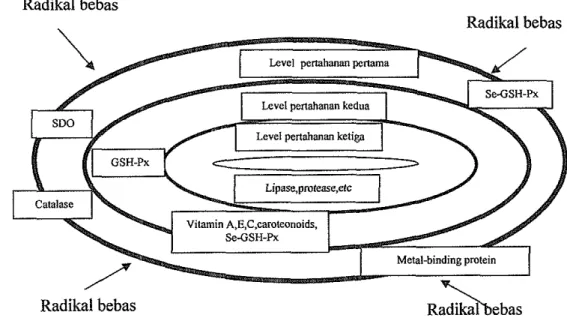
untuk fungsi normal dari pankreas. Defisiensi selenium dan tocopherol mengakibatkan kerusakan jaringan dan kematian sel yang disebabkan karena oksidasi membran sel lemak dan hidroperoksida lemak. Peroksidasi lemak dapat rnenghancurkan keutuhan smtktur sel dan menyebabkan kekacauan metabolisme (McDowell 1992; Brody 1994). Gambar 4 menyajikan tiga level pertahanan antioksidan di dalam sel.
Radikal bebas
Radikal bebas
Radikal bebas Radikal 3' ebas
Gambar 4 Level pertahanan antioksidan didalam sel (Surai 2000)
Surai (1999) mengemukakan bahwa sistem antioksidan pada sel hidup meliputi tiga level pertahanan utama, level pertahanan pertama bertanggung jawab mencegah pembentukan radikal bebas yang dilakukan oleh tiga enzim antioksidan, superoksida dismutase (SOD), glutathione peroksidase (GSH-Px) dan katalase bersama metal-binding protein. Halliwell dan Gutteridge (1999) menjelaskan bahwa Radikal superoksida adalah radikal bebas utama yang dihasilkan oleh sel hidup. Aktivitas penting dalam pertahahan antioksidan disediakan oleh GSI-I-Px dan katalase. Lebih lanjut Yu (1994) mengatakan bahwa GSH-Px ditemukan pada bagian-bagian yang berbeda pada sel, sedangkan katalase lokasi utamanya pada peroksisom. Pemusnahan hidrogen peroksida dari sel akan lebih tinggi dilakukan oleh GSH-Px.
Selenium merupakan bagian integral dari enzim antioksidan GSH-Px, berada pada level pertama pertahanan antioksidan. Garis pertama dari pertahanan antioksidan sel tidak mempunyai kekuatan yang cukup untuk mencegah pembentukan dan perkembangan radikal bebas secara sempuma. Selanjutnya berperan pertahanan antioksidan level kedua yang meliputi glutathione, vitamin larut dalam lemak (A, E, carotenoid, ubiquinon) dan vitamin larut dalam air (asam askorbat, asam urea dll). Antioksidan ini merupakan komponen rantai pemecah yang potensial mencegah pembentukan dan perkembangan rantai radikal bebas. Hidroperoksida dapat terbentuk selama reaksi radikal bebas dengan antioksidan,
ROO*
+
Toc = Toc*+
ROOHDimana: ROO* adalah radikal peroksil; Toc adalah tocoperol; Toc* adalah radikal tocoperoksil, ROOH adalah hidroperoksida. Hidroperoksida bersifat toksik dan jika tidak dihilangkan akan merusak struktur dan fungsi membran (Gutteridge dan Halliwell 1990). Kemudian Diplock (1994) menambahkan bahwa hidroperoksida lemak tidak stabil dan dengan kehadiran ion-ion logam transisi dapat terurai membentuk radikal-radikal bebas baru dan aldehid sitotoksik.
Hidroperoksida harus dikeluarkan dari dalam sel dengan jalan yang sama seperti H202, tetapi enzim katalase tidak dapat bereaksi dengan komponen- komponen ini, hanya cytosolic GSH-Px yang dapat mengubah radikal-radikal ini menjadi produk yang tidak reaktif Se sebagai bagian integral dari GSH-Px, yang juga termasuk kedalam level kedua pertahanan antioksidan tidak mampu untuk mencegah peroksidasi lemak sehingga beberapa molekul biologis mengalami kerusakan. Pada level ketiga pertahanan antioksidan, enzim-enzim spesifik seperti protease, lipase dan beberapa enzim lainnya berperan melakukan perbaikan terhadap molekul-molekul yang rusak. Selanjutnya seluruh element-element sistem antioksidan berinteraksi membentuk pertahanan antioksidan yang efisien. Interaksi ini dimulai pada saat absorbsi nutrisi dan berianjut selama metabolisme nutrisi (Brigelius-Flohe 1999).
Selenium dianggap penting dalam nutrisi temak karena kedua level pertahanan antioksidan (pertahanan pertama dan kedua) dalam sel tergantung pada aktivitas GSH-Px, yang keberadaannya tergantung pada kecukupan selenium. Peroksidasi lemak mempercepat defisiensi selenium dan merusak molekul-
molekul biologis sehingga mengakibatkan kematian sel (Halliwell dan Guteridge 1999).
Peranan Selenium dan Vitamin E pada Embrio
Sistem antioksidan embrio terdiri dari antioksidan alami dan kofaktor enzim yang diperoleh dari makanan induk, serta enzim antioksidan yang disintesis dalam jaringan. Kekuatan sistem pertahanan antioksidan sebagian besar tergantung pada komposisi makanan induk (Surai 1999). Persediaan antioksidan makanan yang baik seperti Vitamin E, vitamin C, selenium organik memberikan perlindungan pada embrio, meningkatkan daya tahan hidupnya. Meningkatkan satu antioksidan akan berpengamh terhadap peningkatan antioksidan lainnya. Sebagai contoh suplementasi selenium organik pada makanan memperlihatkan peningkatan level antioksidan lain (Vitamin A, E dan Carotenoid) dalam telur (Surai dan Sparks 2001).
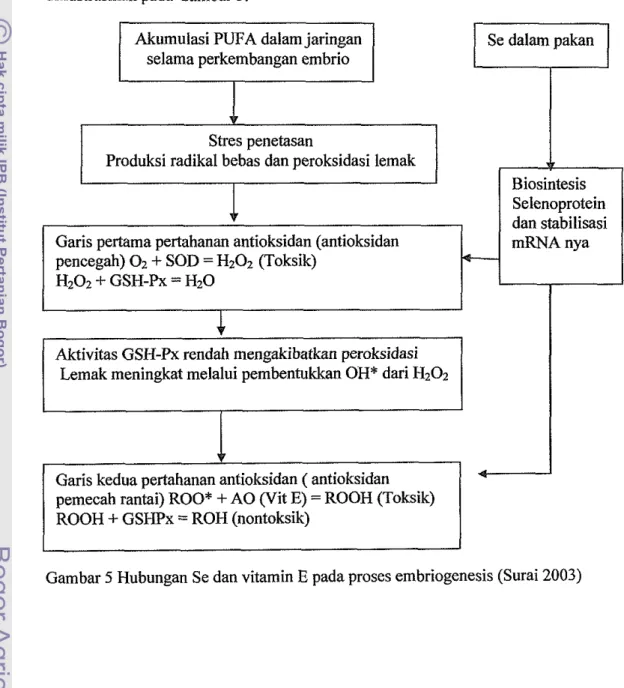
Surai (2003) memaparkan bahwa selama embriogenesis, asam lemak tak jenuh terakumulasi di dalam jaringan, di mana pada kondisi ini meningkatkan resiko shes oksidasi. Proses ini berawal dari shes defisiensi oksigen dan semakin memburuk selama dan sesaat setelah menetas. Selain itu pernafasan normal dan metabolisme oksidatif pada perkembangan embrio selama periode inkubasi khususnya beberapa hari sebelum menetas menghasilkan radikal bebas dan peroksidasi lemak, khususnya asam-asam lemak tak jenub. Peroksidasi lemak juga disebabkan karena rendahnya kandungan selenium dalam pakan sehingga sintesis selenoprotein terganggu dan aktivitas GSH-Px rendah dan perlindungan antioksidan tidak efektif. Peroksidasi lemak akan mengakibatkan kemsakan jaringan membran, enzim non aktif, level hormon dan sintesis enzim terganggu. Peroksidasi lemak juga mengakibatkan pertumbuhan dan perkembangan embrio terganggu serta penurunan daya tahan hidup awal anak setelah menetas. Aktivitas GSH-Px rendah juga akan mengakibatkan akumulasi hidroperoksida (ROOH) yang mengakibatkan toksik pada sel. Karena itu proses penetasan meningkatkan kebutuhan sistem antioksidan yang efisien (Surai 2000). Mekanisme pertahanan antioksidan embrio terdiri dari dua level, di mana level pertahanan pertama adalah tiga kelompok enzim yaitu superoksida dismutase, glutathion peroksidase dan katalase yang mengubah radikal bebas yang dihasilkan selama respirasi sel
menjadi alkohol yang kurang berbahaya (Ursini et al. 1997). Level pertahanan kedua adalah antoksidan alami vitamin E, carotenoids, asam askorbat, dan glutathion yang melindungi perkembangan anak. Pada kondisi oksidasi tinggi diakhir inkubasi dan sehari setelah menetas antioksidan sangat berpengaruh (Surai
1999).
Hubungan antara selenium dan vitamin E pada proses embriogenesis diilushasikan pada Gambar 5.
selama perkembangan embrio
Aktivitas GSH-Px rendah mengakibatkan peroksidasi Lemak meningkat melalui pembentukkan OH* dari Hz02
t
Stres penetasan
Produksi radikal bebas dan peroksidasi lemak
I
Garis kedua pertahanan antioksidan ( antioksidan pemecah rantai) ROO*
+
A 0 (Vit E) = ROOH (Toksik) ROOH+
GSHPx = ROH (nontoksik)I I
Gambar 5 Hubungan Se dan vitamin E pada proses embriogenesis (Surai 2003) Biosintesis Selenoprotein dan stabilisasi mRNA nya
1
Garis pertama pertahanan antioksidan (antioksidan
pencegah) 0 2