AKTIVITAS ANTIBAKTERI EKSTRAK HEKSAN DAUN KIRINYUH (Chromolaena odorata (L.) R. M. King & H. Rob.) TERHADAP BAKTERI
Propionibacterium acnes
SKRIPSI
Diajukan untuk Memenuhi SalahSatu Syarat Memenuhi Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Eugenia Sekar Aruna Larasati NIM : 168114055
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
AKTIVITAS ANTIBAKTERI EKSTRAK HEKSAN DAUN KIRINYUH (Chromolaena odorata (L.) R. M. King & H. Rob.) TERHADAP BAKTERI
Propionibacterium acnes
SKRIPSI
Diajukan untuk Memenuhi SalahSatu Syarat Memenuhi Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Eugenia Sekar Aruna Larasati NIM : 168114055
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
Skripsi ini kupersembahkan untuk:
Tuhan Yesus, Bunda, Ayah dan seluruh keluarga besar tercinta, sahabat dan teman-temanku yang tak henti-hentinya menyemangati
ix DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
LEMBAR PERNYATAAN PERSETUJUAN ... vi
PRAKATA ... vii
DAFTAR ISI ... ix
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
ABSTRAK ... xiii
ABSTRACT ... xiv
PENDAHULUAN ... 1
METODE PENELITIAN ... 3
HASIL DAN PEMBAHASAN ... 9
KESIMPULAN DAN SARAN ... 21
DAFTAR PUSTAKA ... 23
LAMPIRAN ... 30
x
DAFTAR TABEL
Tabel I. Plot 96-well plate Penentuan MIC ... 8
Tabel II. Hasil Selisih OD Jam 72 dan Jam 0 ... 13
Tabel III. Uji Post-hoc Games Howell ... 14
Tabel IV. Persen Penghambatan (MIC) Ekstrak Heksan Daun Kirinyuh ... 16
Tabel V. Optical Density Jam 0 (Sebelum Inkubasi) ... 36
xi
DAFTAR GAMBAR
Gambar 1. Penetapan Kadar Air ... 30
Gambar 2. Tanaman Chromolaena odorata (L.) R.M. King & H.Rob... 31
Gambar 3. Penetepan Bobot Tetap ... 32
Gambar 3a. Penimbangan Cawan Kosong ... 32
Gambar 3b. Hasil Penimbangan Pertama Bobot Tetap ... 32
Gambar 3c. Hasil Penimbangan Terakhir Bobot Tetap ... 32
Gambar 4. Ekstrak Heksan Daun Kirinyuh ... 33
Gambar 5. Kelarutan Ekstrak Dalam DMSO ... 33
Gambar 5a. Kelarutan Ekstrak Dalam DMSO 50% ... 33
Gambar 5b. Kelarutan Ekstrak Dalam DMSO 100% ... 33
Gambar 6. Kultur Bakteri ... 34
Gambar 6a. Kultur di Blood Agar ... 34
Gambar 6b. Kultur di Tryptone Soy Agar ... 34
Gambar 6c. Kultur di Brain Hearti Infusion ... 34
Gambar 7. Anaerogen, Indikator Anaerob dan Kontainer Airtight ... 34
Gambar 7a. Anaerogen ... 34
Gambar 7b. Cara Pakai Anaerogen ... 34
Gambar 7c. Indikator Anaerob ... 35
Gambar 7d. Kontainer Airtight... 35
Gambar 8. Indikator Anaerob Warna Putih ... 35
Gambar 9. Perlakuan MIC pada 96-well plate... 35
Gambar 9a. Konsentrasi Seri EHDK ... 35
Gambar 9b. Kontrol Pertumbuhan ... 35
Gambar 9c. Kontrol Negatif ... 35
Gambar 9d. Kontrol Positif ... 35
xii
DAFTAR LAMPIRAN
Lampiran 1. Surat Keterangan Determinasi Tanaman ... 30
Lampiran 2. Penetapan Kadar Air dengan Destilasi Toluen ... 31
Lampiran 3. Sertifikat Propionibacterium acnes ATCC 11827 ... 31
Lampiran 4. Tanaman Chromolaena odorata (L.) R.M. King & H.Rob ... 31
Lampiran 5. Penetapan Bobot Tetap ... 32
Lampiran 6. Ekstrak Heksan Daun Kirinyuh ... 33
Lampiran 7. Uji Kelarutan Ekstrak Dalam DMSO ... 33
Lampiran 8. Kultur Bakteri ... 33
Lampiran 9. Anaerogen dan Indikator Anaerob ... 34
Lampiran 10. Indikator Anaerob Berwarna Putih... 35
Lampiran 11. Perlakuan MIC di 96-well plate ... 35
Lampiran 12. Optical Density Jam 0 dan 72 pada Perlakuan MIC ... 36
Lampiran 13. Surat Keterangan Analisis Data ... 37
Lampiran 14. Uji Statistika ... 38
xiii ABSTRAK
Jerawat merupakan penyakit yang dialami oleh banyak orang dari berbagai umur dan terjadi karena beberapa faktor seperti keadaan psikologis dan bakteri. Bakteri yang berperan penting dalam pembentukan jerawat adalah bakteri Propionibacterium acnes. Meningkatnya resistensi antibiotik terhadap bakteri P. acnes membuat terapi terhadap jerawat menjadi lebih sulit. Pengobatan menggunakan tanaman merupakan salah satu alternatif yang sedang banyak diteliti sebagai salah satu upaya untuk mengurangi terjadinya resistensi antibiotik. Penelitian kali ini ingin melihat aktivitas antibakteri daun Chromolaena odorata (L.) R. M. King & H. Rob dari Yogyakarta, Indonesia. Daun C. odorata dimaserasi dengan pelarut heksan dan metode yang digunakan untuk melihat aktivitas antibakteri adalah mikrodilusi. Optical Density sebelum dan setelah inkubasi diukur dengan microplate reader pada 600nm kemudian dihitung persen penghambatannya. Hasil pada penelitian ini menyatakan bahwa konsentrasi 0.195 – 6.25 mg/ml ekstrak heksan daun kirinyuh dapat menghambat pertumbuhan bakteri P. acnes dengan persen penghambatan sebesar 13.005%-50.419%. Pada konsentrasi 0.391 – 6.25 mg/ml didapatkan hasil yang signifikan (p < 0.05) secara statistik, namun pada konsentrasi 0.195 mg/ml tidak didapatkan hasil yang signifikan (p > 0.05). MIC didapat pada konsentrasi 6.25 mg/ml dengan persen penghambatan 50.419 % yang menunjukkan bahwa ekstrak heksan daun kirinyuh memiliki aktivitas antibakteri yang cukup signifikan terhadap bakteri P. acnes.
Kata kunci : Jerawat, Propionibacterium acnes, Chromolaena odorata (L.) R. M. King & H. Rob., mikrodilusi.
xiv ABSTRACT
Acne is a disease that can be experienced by many people of various ages and occurs due to several factors such as psychological conditions and bacteria. Bacteria that play an important role in the formation of acne is Propionibacterium acnes. The increasing of antibiotic resistance to P. acnes bacteria makes therapy against acne more difficult. Treatment using plants is one of the alternative that can be developed as an effort to decrease antibiotic resistance. In this present study the antibacterial activity of Chromolaena odorata (L.) R. M. King & H. Rob leaves from Yogyakarta, Indonesia is tested. C. odorata leaves were macerated by hexane solvent and the method used to see the antibacterial activity was microdilution. Optical Density before and after incubation was measured with microplate reader at 600nm then the percent inhibition was calculated. The results of this study stated that the concentration of 0.195-6.25 mg/ml hexane extract of kirinyuh leaves can inhibit the growth of P. acnes bacteria with percent inhibition of 13.005%-50.419%. At concentrations of 0.391-6.25 mg/ml obtained significant results (p <0.05) based on statistics, but at concentrations of 0.195 mg/ml did not obtain significant results (p>0.05). MIC was obtained at the concentration of 6.25 mg/ml with 50.419% percent inhibition which means that hexane extract of kirinyuh leaves had significant antibacterial activity against P. acnes bacteria.
Keywords : Acne, Propionibacterium acnes, Chromolaena odorata (L.) R. M. King & H. Rob., microdilution.
1 PENDAHULUAN
Acne vulgaris atau jerawat merupakan peradangan pada kulit yang disebabkan oleh penyumbatan pada unit kelenjar pilosebasea yang kemunculannya dapat ditandai dengan adanya komedo, postul, nodul, papul (Sukmawati et al., 2019)dan biasa terjadi pada kulit wajah, dada ataupun punggung (Fisk et al., 2014). Pada kelenjar pilosebasea, terdapat 4 komponen penting dalam patogenesis pembentukan jerawat, dan salah satunya adalah proliferasi dari bakteri Propionibacterium acnes (Williams et al., 2012). Jerawat dapat timbul karena berbagai faktor, seperti keadaaan psikologis (Bowe and Logan, 2011) dan bakteri. Bakteri pemicu terjadinya jerawat antara lain adalah Staphylococcus aureus, Staphylococcus epidermidis dan Propionibacterium acnes (Sukmawati et al., 2019).
Jerawat dialami oleh 85% penduduk dunia yang berumur 12-15 tahun (Sinha et al., 2014). Di Indonesia, infeksi yang disebabkan oleh P. acnes berkisar 80-85%, pada remaja dengan puncak insidensi usia 15-18 tahun, 12% pada wanita usia > 25 tahun dan 3% pada usia 35-44 tahun (Madelina and Sulistiyaningsih, 2018). Jerawat dapat bertahan lama dan membutuhkan terapi dengan waktu yang cukup lama sehingga jerawat dapat dikategorikan sebagai penyakit kronis (Dawson and Dellavalle, 2013). Jerawat dapat menyebabkan rasa sakit dan gatal pada kulit sehingga mengganggu kenyamanan dalam beraktivitas (Williams et al., 2012). Remaja dan dewasa dengan jerawat memiliki tingkat kecemasan, depresi yang lebih tinggi dan yang memiliki jerawat parah juga memiliki rasio ditolak saat melamar kerja yang lebih tinggi dibandingkan mereka yang tidak memiliki jerawat (Zaenglein, 2018).
P. acnes adalah bakteri mikroaerofilik, anaerob-aerotoleran gram positif,
dan flora normal yang tinggal di folikel pilosebasea dari kulit manusia, rongga mulut, konjungtiva, saluran usus dan saluran telinga eksternal (Perry and Lambert, 2011). P. acnes menggunakan sebum sebagai nutrisi untuk berkembang biak dan pemicu terjadinya peradangan melalui aktivasi komplemen dan pelepasan produk metabolik sekunder, protease, dan faktor kemotaksis yang menarik neutrofil (Knutsen-Larson et al., 2012).
2
Terapi yang sering digunakan untuk mengatasi jerawat adalah antibiotik. Antibiotik efektif karena tidak hanya memberi efek antimikroba, namun juga efek antiinflamasi dan menghambat kemotaksis neutrofil (Knutsen-Larson et al., 2012). Antibiotik yang biasa digunakan adalah klindamisin dan eritromisin (Williams et al., 2012), namun banyak resistensi yang terjadi pada kedua antibiotik ini. Di Indonesia, resistensi antibiotik tertinggi terhadap P. acnes adalah klindamisin, diikuti oleh eritromisin, minosiklin, tetrasiklin dan doksisiklin (Hindritiani et al., 2017). Untuk mengatasi resistensi, tanaman dapat digunakan sebagai alternatif karena aman, memiliki efikasi tinggi, dan memiliki banyak fungsi. Tanaman yang mampu mengatasi jerawat adalah tanaman yang memiliki kemampuan antibakteri namun juga memiliki kemampuan antioksidan dan antiinflamasi (Glavas Dodov and Kulevanova, 2009). Hal ini membuat perlunya penelitian lebih lanjut mengenai aktivitas antibakteri dari tanaman terhadap P. acnes.
Kirinyuh (Chromolaena odorata (L.) R. M. King & H. Rob.) merupakan tanaman yang tersebar di Amerika Utara, Afrika dan Asia Tenggara, termasuk di Indonesia (Hanphakphoom et al., 2016). Kirinyuh terbukti memiliki banyak kegunaan dalam bidang kesehatan, seperti antiinflamasi, antibakteri, antioksidan, dan penyembuhan luka (Naidoo et al., 2011). Menurut Chakraborty et al., (2011), daun kirinyuh memiliki zat aktif seperti flavonoid, senyawa fenolik, terpen, serta alkaloid yang menunjang fungsinya tersebut. Daun tanaman kirinyuh dinyatakan merupakan bagian yang memiliki paling banyak kegunaan (Chakraborty et al., 2011). Dengan adanya fungsi tersebut diharapkan daun kirinyuh dapat menghambat pertumbuhan bakteri P. acnes.
Penelitian terhadap ekstrak daun kirinyuh terhadap bakteri P. acnes sudah beberapa kali dilakukan. Di Thailand ditemukan beberapa penemuan mengenai ekstrak daun kirinyuh terhadap bakteri P. acnes, diantaranya adalah Chomnawang et al., (2005) dan Hanphakphoom et al., (2016). Pada penelitian yang dilakukan oleh Chomnawang et al. (2005), dilakukan penelitian mengenai ekstrak daun kirinyuh menggunakan metode mikrodilusi terhadap bakteri P. acnes ATCC 6919 dan pada jurnal tersebut ekstrak daun kirinyuh memiliki aktivitas antibakteri dilihat dari MIC dan MBC yang dihasilkan. Kemudian, pada penelitian Hanphakphoom, et al. (2016) ekstrak heksan daun kirinyuh memiliki zona inhibisi terbesar, yaitu
3
14.2±0.8 mm, terhadap bakteri P. acnes dibandingkan dengan ekstrak etanol (9.7±0.6 mm) dan methanol (9.7±0.6 mm) daun kirinyuh. Hal tersebut dipengaruhi oleh kandungan fitokimia di dalam ekstrak.
Penelitian ekstrak heksan daun kirinyuh terhadap bakteri P. acnes oleh Hanpakphoom et al. (2016) adalah penelitian yang dilakukan di Thailand, kemudian tanaman didapatkan dari provinsi Amnat Charoen, Thailand. Penelitian kali ini dilakukan di Indonesia dan tanaman kirinyuh yang digunakan berasal dari Yogyakarta, Indonesia. Hal tersebut memungkinkan adanya perbedaan zat fitokimia di dalam tanaman kirinyuh, terutama flavonoid karena adanya perbedaan kondisi geografis (Kumar and Roy, 2018). Penelitian yang dilakukan oleh Ance et al., (2018) mengenai fitokimia simplisia daun kirinyuh yang diambil dari Surabaya, Malang dan Bogor memperlihatkan bahwa terdapat perbedaan jumlah flavonoid, fenol dan alkaloid yang ada didalam simplisia tersebut. Lawal et al. (2014) dan (Yajarla et al., 2014) mengatakan bahwa kandungan fitokimia di dalam ekstrak heksan daun kirinyuh adalah berupa terpenoid, senyawa fenolik dan juga flavonoid. Berdasarkan latar belakang tersebut, penelitian ini dilakukan untuk melihat aktivitas antibakteri ekstrak heksan daun kirinyuh yang diambil dari Yogyakarta, Indonesia terhadap bakteri P. acnes ATCC 11827 dengan metode mikrodilusi. Aktivitas antibakteri dilihat dari pembentukan persen penghambatan dan MICyang didapat. Perbedaan strain bakteri memungkinkan adanya perbedaan MIC karena adanya perbedaan produksi enzim dalam bakteri (Whitman et al., 2012). Metode mikrodilusi digunakan karena metode ini lebih sensitif, hasil lebih akurat dan hemat waktu dalam determinasi kemampuan antimikroba pada ekstrak tanaman dibandingkan metode agar (Klancnik et al., 2010).
METODE PENELITIAN Jenis dan Rancangan Penelitian
Jenis penelitian yang dilakukan adalah penelitian kuantitatif dengan rancangan eksperimental murni, dimana memiliki dua kelompok perlakuan yang berbeda, terdapat randomisasi dan pengendalian ketat pada variabel. Penelitian ini dilakukan di Laboratorium Farmakognosi-Fitokimia dan Laboratorium Mikrobiologi Fakultas Farmasi Universitas Sanata Dharma Yogyakarta
4 Alat dan Bahan
Alat yang digunakan pada penelitian ini adalah neraca analitik (Ohaus PA213), waterbath (Memmert), pompa vakum (GAST Model DOA-P504-BN), labu destilator (Schott Duran), pemanas destilator (M. Topo Tipe MS-E103), platform shaker (Innova 2100), microplate flexible flat-bottom PVC 96-well (Iwaki), mesh no 40, mikropipet (Gilson), microplate reader (Synergy HTX Biotek), vortex (Gallenkamp), Biosafety Safety Cabinet Class II A2 (ESCO Model LA2-3A1-E/Class II A2 Serial: 2016-95067), kontainer (Lion Star), inkubator (Memmert dan Heraeus Tipe B.5050), rotary evaporator (Buchi Switzerland Tipe R-210 dan R-300), oven (WTB Binder 7200 Tipe 33053099003100 dan Memmert 30-1060), hot plate, magnetic stirrer, nephelometer (BD Phoenix Spec), autoklaf (ALP Co., Ltd., Japan Model KT-40), blue tip, yellow tip, bunsen, jarum ose, mortir, stamper, dan alat-alat gelas (Pyrex) seperti cawan petri, tabung reaksi, labu takar, Erlenmeyer, gelas beker, gelas ukur, pipet volume, batang pengaduk, dan pipet tetes.
Bahan yang digunakan dalam penelitian ini adalah daun kirinyu yang diperoleh dari Lembaga Pendampingan Usaha Buruh Tani Nelayan (LPUBTN), bakteri Propionibacterium acnes ATCC 11827 (Thermo Scientific), anaerogen (Thermo Scientific) dan indikator anaerob (Thermo Scientific) dari PT. Dipa Puspa Labsains, klindamisin, n-heksan (CV General labora), Blood Agar (Oxoid), Tryptone Soy Agar (Oxoid), Brain Heart Infusion (Oxoid), aquadest, DMSO (Merck), tisu dan kertas saring Whatmann 1.
Preparasi Bahan Baku
Daun kirinyuh yang digunakan dalam penelitian ini dibeli dari Lembaga Pendampingan Usaha Buruh Tani Nelayan (LPUBTN). Kriteria untuk daun kirinyuh yang akan dipakai adalah daun hijau utuh dengan panjang 5-12 cm dan lebar 3-6 cm. Daun yang dipilih tidak berjamur dan tidak ada bahan pengotor lainnya. Determinasi dilakukan di Unit II Laboratorium Biologi Farmasi Universitas Gajah Mada. Daun kirinyuh yang sudah dikeringkan dengan oven diserbuk menggunakan mesin penyerbuk. Serbuk simplisia diayak menggunakan pengayak dengan mesh no. 40 sehingga didapatkan serbuk simplisia yang agak
5
kasar. Serbuk simplisia disimpan dalam wadah tertutup rapat dan diberi silica gel untuk menjaga kelembaban dan menghindari tumbuhnya jamur.
Penetapan Kadar Air Dengan Metode Destilasi Toluena
Alat destilasi terdiri dari labu 500 ml, kondensor dan tabung penerima berskala 0,1 ml. Sebelum melakukan destilasi, labu 500 ml dihubungkan dengan kondensor melalui alat penampung yang dilengkapi dengan tabung penerima berskala 0,1 ml dan bagian atas alat penampung dibungkus aluminium foil. Tabung penerima dan kondensor pada alat destilasi dibersihkan dengan asam pencuci, dibilas dengan air kemudian dikeringkan. Sebelum digunakan, toluene dijenuhkan dengan air terlebih dahulu dengan cara mengocok toluene dengan air kemudian dipisahkan dengan corong pisah, kemudian lapisan air dibuang dan lapisan toluene disimpan untuk digunakan untuk proses destilasi. Serbuk dun kirinyuh ditimbang 10 gram lalu dimasukkan ke dalam labu. Sebanyak kurang lebih 200 ml toluene yang sudah dijenuhkan dengan air dimasukkan kedalam labu, rangkaian alat dipasang. Labu dipanaskan selama 15 menit menggunakan pemanas listrik. Setelah toluene mulai mendidih, kecepatan penyulingan diatur menjadi 2 tetes perdetikm hingga sebagian besar air tersuling, kemudian kecepatan penyulingan dinaikkan hingga 4 tetes perdetik. Setelah penyulingan, tabung penerima dibiarkan mendingin hingga suhu kamar dan diusahakan seluruh tetesan air turun. Volume air dibaca setelah toluene dan air terpisah sempurna. Kadar air dinyatakan dalam persen. Kadar air dihitung dalam % v/b dengan rumus :
Kadar air = Volume air
Berat sampel x 100%
(Badan Pengawas Obat dan Makanan Republik Indonesia, 2012)
Ekstraksi Tanaman
Pembuatan ekstrak heksan daun kirinyuh dilakukan dengan metode maserasi menggunakan pelarut heksan pada suhu ruang dengan pengadukan konstan menggunakan shaker selama 48 jam. Rasio antara serbuk dengan pelarut (heksan) adalah 1:10 (w/v). Setelah 48 jam, didapatkan ekstrak cair yang kemudian disaring menggunakan kertas saring Whatman no. 1. Ekstrak cair yang didapat, diuapkan menggunakan rotary evaporator untuk menguapkan pelarut heksan pada
6
suhu 68oC, kemudian diuapkan kembali menggunakan waterbath pada suhu
50-60oC untuk menguapkan sisa heksan yang masih tersisa. Ekstrak kemudian ditimbang lalu dimasukkan kedalam oven selama kurang lebih 1 jam hingga diperoleh ekstrak kering. Penetapan bobot tetap, penetapan rendemen dan uji kadar air dilakukan sebagai standarsasi ekstrak kering. Persen rendemen dihitung menggunakan rumus :
Rendemen = Bobot ekstrak
Bobot simplisia x 100%
Penetapan bobot tetap dilakukan dengan menimbang ekstrak yang akan dikeringkan atau dipijarkan terlebih dahulu. Penimbangan dinyatakan mencapai bobot tetap apabila perbedaan dua kali penimbangan berturut-turut setelah dikeringkan atau dipijakrkan selama 1 jam tidak lebih dari 0.25% atau perbedaan penimbangan tidak melebihi 0.5 mg pada penimbangan dengan timbangan analitik (Kementrian Kesehatan Republik Indonesia, 2011).
Penyiapan Bakteri Uji Propionibacterium acnes
Loop murni bakteri P. acnes diinokulasikan pada media Tryptone Soy Agar (TSA) dan blood agar kemudian diinkubasi pada suhu 37oC selama 72 jam
sebelum digunakan. Inkubasi dilakukan dalam kondisi anaerob. Sebelum digunakan, bakteri tunggal pada media TSA diinokulasikan ke dalam media cair Brain Heart Infusion (BHI) dan diinkubasi selama 72 jam pada suhu 37oC.
Penyiapan Larutan Klindamisin
Pembuatan larutan klindamisin dengan melarutkan serbuk klindamisin (dari kapsul obat) setara dengan 0.504 mg dalam 1 liter aquades steril sehingga didapatkan larutan dengan konsentrasi 0.504 mg/L setara dengan 0.504 μg/ml.
Uji Aktivitas Antibakteri
Penentuan uji aktivitas antibakteri ekstrak heksan daun kirinyuh terhadap P. acnes dilakukan dengan menggunakan metode mikrodilusi pada 96-well plate. Kultur bakteri yang akan digunakan adalah kultur dalam BHI yang berusia 3 hari dan yang sudah disetarakan dengan 0.5 McFarland. Stok ekstrak dibuat dengan konsentrasi 200 mg/ml dilarutkan dengan DMSO 100%. Seri konsentrasi ekstrak
7
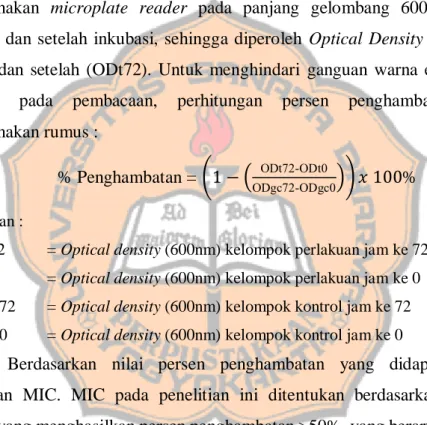
disiapkan dengan rentan konsentrasi 0.195-6.25 mg/mL diambil dari stok dan dilarutkan dengan aquadest steril. Kadar DMSO untuk melarutkan ekstrak pada sumuran maksimal 2%. 110 µL BHI yang telah berisi kultur bakteri dimasukkan kedalam 96-well plate. Larutan seri konsentrasi ekstrak kemudian ditambahkan sebanyak 90 µL kedalam sumuran yang sudah berisi kultur bakteri, dan dimasukkan kedalam 6 sumuran secara berurutan. Volume akhir setiap sumuran adalah 200 µL. Kontrol media, kontrol pertumbuhan, kontrol negatif DMSO, kontrol positif klindamisin 0.504 mg/L dibuat pada pengujian, inkubasi dilakukan selama 72 jam. Pengujian dilakukan sebanyak 3 kali. Absorbansi sampel pada plate diukur menggunakan microplate reader pada panjang gelombang 600 nm sebelum inkubasi dan setelah inkubasi, sehingga diperoleh Optical Density (OD) sebelum (ODt0) dan setelah (ODt72). Untuk menghindari ganguan warna ekstrak heksan kirinyuh pada pembacaan, perhitungan persen penghambatan dihitung menggunakan rumus :
% Penghambatan = (1 − ( ODt72-ODt0
ODgc72-ODgc0)) 𝑥 100% Keterangan :
- ODt72 = Optical density (600nm) kelompok perlakuan jam ke 72 - ODt0 = Optical density (600nm) kelompok perlakuan jam ke 0 - ODgc72 = Optical density (600nm) kelompok kontrol jam ke 72 - ODgc0 = Optical density (600nm) kelompok kontrol jam ke 0
Berdasarkan nilai persen penghambatan yang didapat, dilakukan penentuan MIC. MIC pada penelitian ini ditentukan berdasarkan konsentrasi terkecil yang menghasilkan persen penghambatan >50%, yang berarti menghambat lebih dari 50% pertumbuhan bakteri uji (Pineau et al., 2019).
8 Keterangan :
- Seri ekstrak heksan daun kirinyuh konsentrasi 0.195-6.25 mg/ml - Kontrol pertumbuhan
- Kontrol negatif DMSO 2%
- Kontrol positif kindamisin 0.504 mg/L - Kontrol media
Tata Cara Analisis Data
Penentuan kadar hambat minimum (KHM) ditentukan dengan rumus % penghambatan dalam yang dihitung dengan rumus :
% Penghambatan = (1 − ( ODt72-ODt0
ODgc72-ODgc0)) 𝑥 100% Keterangan :
- ODt72 = Optical density (600nm) kelompok perlakuan jam ke 72 - ODt0 = Optical density (600nm) kelompok perlakuan jam ke 0 - ODgc72 = Optical density (600nm) kelompok kontrol jam ke 72 - ODgc0 = Optical density (600nm) kelompok kontrol jam ke 0
Untuk menentukan normalitas distribusi data menggunakan Shapiro-Wilk. Jika p-value > 0.05 maka data terdistribusi normal dan jika p-value < 0.05 maka data tidak terdistribusi normal. Untuk menentukan homogenitas data menggunakan Levene’s Test. Untuk data yang terdistribusi normal dan tidak homogen dilanjutkan menggunakan uji One Way Anova + post hoc Games Howell dengan tingkat kepercayaan 95%.
HASIL DAN PEMBAHASAN
Penelitian ini menggunakan tanaman kirinyuh untuk dilihat kemampuan antibakterinya terhadap bakteri P. acnes ATCC 11827. Bagian tanaman yang digunakan adalah daunnya, karena menurut Chakraborty et al. (2011) ekstrak daun tanaman kirinyuh merupakan bagian yang lebih berguna. Berbagai macam kegunaan dari daun kirinyuh ini didukung oleh kandungan fitokimia didalamnya, diantaranya seperti flavonoid, terpenoid, alkaloid, dan senyawa fenolik (Chakraborty et al., 2011). Tanaman kirinyuh yang digunakan didapat dari
9
Lembaga Pendampingan Usaha Buruh Tani Nelayan (LPUBTN) dan daun yang digunakan diambil sesuai dengan kriteria yang diinginkan. Tanaman kirinyuh dinyatakan kebenarannya dengan surat determinasi yang diterbitkan oleh Unit II Laboratorium Biologi Farmasi Universitas Gajah Mada (Lampiran 1).
Kadar air yang baik untuk serbuk simplisia adalah tidak melebihi 10% (Yulianingtyas and Kusmartono, 2016). Penetapan kadar air serbuk simplisia daun kirinyuh dilakukan dengan metode destilasi toluen karena zat aktif di dalam tanaman kirinyuh memiliki minyak menguap (Departemen Kesehatan Republik Indonesia, 2008). Hasil dari proses destilasi toluen menyatakan bahwa kadar air serbuk simplisia daun kirinyuh yang akan digunakan adalah 9%, sehingga memenuhi syarat (Lampiran 2).
Ekstraksi yang dilakukan terhadap serbuk simplisia daun kirinyuh menggunakan metode maserasi dengan pelarut heksan dan dilakukan selama 48 jam. Maserasi dilakukan dengan cara merendam sampel dalam pelarut organik. Proses perendaman menyebabkan pelarut organik menembus dinding sel dan masuk ke dalam rongga sel yang mengandung metabolit sekunder, metabolit sekunder akan larut dan karena adanya perbedaan konsentrasi antara larutan di dalam dan di luar sel, maka larutan yang lebih pekat akan keluar sel membawa metabolit sekunder (Nugraha et al., 2017). Kandungan yang terdapat pada ekstrak heksan kirinyuh setelah proses maserasi menurut Hanphakphoom et al. (2016) adalah senyawa fenolik dan menurut Yajarla et al. (2014) terdapat flavonoid juga di dalam ekstrak heksan daun kirinyuh tersebut. Pelarut heksan merupakan pelarut non polar yang akan digunakan untuk melarutkan senyawa yang non polar juga. Target senyawa pada penelitian ini adalah flavonoid aglikon yang cenderung dapat terekstrak/larut pada pelarut non polar (Awouafack et al., 2017). Secara umum, kandungan flavonoid memiliki aktivitas antibakteri dengan menghambat sintesis asam nukleat, menghambat fungsi membran sitoplasma, menghambat metabolisme energi, menghambat perlekatan dan pembentukan biofilm, mengubah permeabilitas membran, dan melemahkan patogenisitas (Ren et al., 2014).
Ekstrak cair yang didapat dari hasil maserasi kemudian di evaporasi pada suhu 68oC sesuai dengan titik didih heksan yaitu 68oC (National Center for
10
tetap. Bobot tetap didapatkan jika setelah dua kali penimbangan berturut-turut didapatkan bobot tidak lebih dari 0.25% atau perbedaan penimbangan seperti tersebut di atas tidak melebihi 0.5 mg pada penimbangan dengan timbangan analitik (Departemen Kesehatan Republik Indonesia, 2008). Bobot tetap yang didapatkan adalah 2.0128 gram dan rendemen sebanyak 3.98%. Jumlah rendemen yang dihasilkan menandakan banyaknya komponen atau kandungan yang dapat terekstraksi (Maimulyanti and Prihadi, 2016). Banyaknya komponen yang dapat terekstraksi dapat dipengaruhi oleh polaritas pelarut yang digunakan (Sulaiman et al., 2011). Hal tersebut membuat hasil rendemen dari berbagai pelarut berbeda. Penelitian yang dilakukan oleh Kusuma et al. (2015) menunjukkan hasil rendemen ekstrak heksan daun kirinyuh sebanyak 4.45% dan rendemen ekstrak etanol daun kirinyuh sebanyak 8.46%. Hal ini menyatakan bahwa pada penelitian ini kandungan fitokimia bersifat non-polar yang dapat diambil oleh pelarut heksan pada penelitian ini ada sebanyak 3.98%. Perbedaan jumlah rendemen yang dihasilkan jika dibandingkan dengan penelitian Kusuma et al., (2015) mungkin dapat dipengaruhi karena adanya perbedaan jumlah kandungan fitokimia didalamnya karena perbedaan tempat tumbuh tanaman yang berbeda.
Bakteri yang digunakan dalam penelitian ini adalah Propionibacterium acnes ATCC 11827 yang didapat dari PT. Dipa Puspa Labsains dan kebenarannya dibuktikan oleh surat keterangan (Lampiran 3). P. acnes ATCC 11827 merupakan bakteri yang dapat tumbuh dalam kondisi anaerob, pada temperatur 37oC dan pada media Tryptone Soy Agar/Broth (TSA/TSB) yang diberi darah. Bakteri ini tidak akan tumbuh jika diinkubasi pada kondisi aerob (American Type Culture Collection, 2019). P. acnes itu sendiri merupakan bakteri mikroaerofilik, anaerob-aerotoleran, diphtheroid-like gram positif dan flora normal yang dapat mentolerir paparan oksigen selama beberapa jam dan mampu secara in vitro bertahan hidup dalam kondisi anaerob hingga 8 bulan (Portillo, 2013). Pada penelitian ini, P. acnes diinkubasi dalam kondisi anaerob, pada suhu 37oC dan dikultur pada TSA dan TSA dengan darah sesuai dengan ketentuan yang dinyatakan oleh ATCC. Perlakuan dilakukan menggunakan media Brain Heart Infusion seperti yang dilakukan pada penelitian Nirmal et al. (2014).
11
Proses inkubasi untuk bakteri P. acnes membutuhkan kondisi anaerob yang diwujudkan dengan cara meletakkan microplate pada container airtight dan tertutup rapat. Anaerogen dan indikator anaerob dimasukkan kedalam wadah tersebut. Terciptanya kondisi anaerob dibuktikan dengan warna putih pada indikator (Lampiran 10), sedangkan jika indikator berwarna merah muda menandakan masih adanya oksigen didalam wadah tersebut. Bakteri P. acnes merupakan bakteri dengan proses pertumbuhan yang cukup lambat. P. acnes dapat bertumbuh dalam waktu 2-15 hari (Achermann et al., 2014). Waktu inkubasi yang dibutuhkan untuk P. acnes pun harus sesuai, maka waktu inkubasi yang digunakan adalah 72 jam, atau 3 hari. Hal yang sama dilakukan juga oleh Tsai et al. (2009) dan Nirmal et al. (2014) dalam penelitiannya. Sebelum digunakan, bakteri P. acnes perlu dipreparasi selama 72 jam terlebih dahulu untuk mendapatkan bakteri yang sudah tumbuh optimal. Pada pengujian aktivitas antibakteri atau dalam mencari MIC, perlakuan diinkubasi kembali selama 72 jam (Lampiran 8).
Penentuan aktivitas antibakteri dilakukan menggunakan metode mikrodilusi. Metode mikrodilusi merupakan metode yang lebih mudah diaplikasikan yang mampu melakukan pengujian antimikrobial dengan beberapa agen antimikroba dalam satu wadah mikrodilusi untuk satu isolat (Carpenter and Citron, 2018). Metode mikrodilusi merupakan salah satu metode yang disarankan untuk pengujian bakteri anaerob (Gajdacs et al., 2017). Mikrodilusi dilakukan menggunakan 96-well plate dan diukur menggunakan microplate reader yang akan membaca absorbansi dengan panjang gelombang 600 nm. Menurut guideline mengenai kultur bakteri yang diterbitkan American Type Culture Collection (2015), untuk memonitor perkembangan bakteri pada suatu kultur, konsentrasi pada kultur bakteri dapat ditentukan menggunakan absorbansi atau optical density pada panjang gelombang 600nm. Panjang gelombang 600nm juga sudah digunakan oleh beberapa penelitian aktivitas antibakteri terhadap bakteri P. acnes seperti Tsai et al., (2009) dan Pineau et al., (2019), sehingga panjang gelombang 600nm dapat digunakan dalam penelitian ini.
Pada penelitian ini, uji aktivitas antibakteri dilakukan dengan enam variasi konsentrasi, yaitu 0.195; 0.391; 0.781; 1.5625; 3.125 dan 6.25 mg/ml ekstrak heksan daun kirinyuh yang dilarutkan dengan DMSO. Konsentrasi DMSO terbesar
12
yang digunakan pada well adalah 2%. Kontrol pertumbuhan, kontrol negatif DMSO 2%, kontrol positif klindamisin 0.504 mg/L dan kontrol media dibuat dalam penelitian ini. Fungsi dari kontrol pertumbuhan adalah untuk melihat banyaknya bakteri yang tumbuh selama proses inkubasi dan untuk membandingkan pertumbuhan bakteri pada perlakuan. Kontrol negatif diharapkan untuk tidak mengalami perubahan jika dibandingkan dengan kontrol pertumbuhan (Johnson and Besselsen, 2002). Kontrol negatif DMSO 2% dibuat dengan tujuan untuk melihat aktivitas antibakteri DMSO 2% sebagai pelarut dalam seri ekstrak. Sebagai pelarut ekstrak, DMSO 2% sebagai pelarut tidak diharapkan memiliki aktivitas antibakteri karena nantinya akan mengganggu hasil persen penghambatan dari ekstrak itu sendiri. Konsentrasi DMSO 2% ditentukan karena konsentrasi lebih dari 2% akan mengurangi kemampuan hidup sel (Lee and Park, 2017). Keaseptisan atau kesterilan perlakuan dilihat menggunakan kontrol media.
Antibiotik yang sering digunakan untuk mengatasi bakteri P. acnes adalah klindamisin, eritromisin, tetrasiklin dan benzoil peroksida. Kontrol positif yang digunakan pada penlitian ini menggunakan klindamisin. Klindamisin digunakan karena klindamisin merupakan salah satu antibakteri P. acnes yang sering digunakan dalam pengobatan (Williams et al., 2012). Banyaknya penggunaan klindamisin sebagai antibakteri terhadap bakteri P. acnes, menyebabkan meningkatnya resistensi P. acnes terhadap klindamisin (Zhu et al., 2019). Sehingga, penelitian menggunakan kontrol positif P. acnes diperlukan untuk melihat apakah ekstrak heksan daun kirinyuh dapat digunakan sebagai alternatif untuk mengatasi bakteri P. acnes. Mekanisme kerja klindamisin pada bakteri P. acnes adalah dengan menghambat sintesis protein dengan berikatan pada subunit ribosom 50s bakteri P. acnes (Purath and Coyner, 2017). Pada penelitian ini yang digunakan adalah 0.504 mg/L, karena Zhang et al., (2019) menyatakan bahwa MIC50
klindamisin didapat pada konsentrasi 0.5 µg/mL. Dogan et al. (2017) menyatakan bahwa jika MIC yang didapat dari konsentrasi klindamisin ≥ 8 µg/ml, bakteri P. acnes tersebut sudah resisten terhadap klindamisin. Namun, jika MIC yang didapat ≤ 2 µg/ml, maka bakteri yang digunakan tidak resisten terhadap klindamisin. Kontrol positif digunakan untuk menunjukkan bahwa respons dapat dideteksi, sehingga memberikan kontrol kualitas pada kelompok perlakuan (Johnson and
13
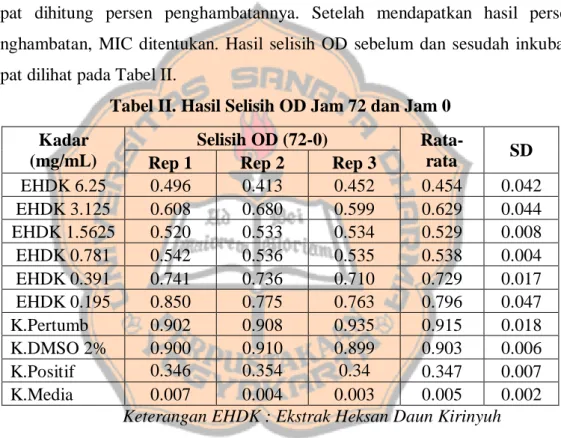
Besselsen, 2002). Pada penelitian ini, selain sebagai standar, kontrol positif klindamisin juga digunakan untuk melihat resistensi dari bakteri yang digunakan, apakah bakteri resisten terhadap klindamisin atau tidak. Pengukuran Optical Density (OD) dilakukan sebelum inkubasi dan sesudah inkubasi menggunakan microplate reader Synergy HTX (Gen5). Pengukuran OD merupakan salah satu teknik pengukuran yang paling sering digunakan dalam mengukur pertumbuhan bakteri. Menurut hukum Lambert-Beer, pengukuran OD sinonim atau setara dengan pengukuran jumlah bakteri atau konsentrasi bakteri (Stevenson et al., 2016). Hasil yang didapatkan dari pembacaan adalah Optical Density (OD) yang kemudian dapat dihitung persen penghambatannya. Setelah mendapatkan hasil persen penghambatan, MIC ditentukan. Hasil selisih OD sebelum dan sesudah inkubasi dapat dilihat pada Tabel II.
Tabel II. Hasil Selisih OD Jam 72 dan Jam 0
Keterangan EHDK : Ekstrak Heksan Daun Kirinyuh
Perhitungan persen penghambatan menggunakan OD0 (sebelum inkubasi) dan OD72 (setelah inkubasi) dilakukan untuk mengatasi adanya gangguan warna ekstrak (Quave et al., 2008). Data pada tabel 2 menunjukkan selisih OD pada jam 72 (setelah inkubasi) dan jam 0 (sebelum inkubasi) untuk menghitung persen penghambatan yang terjadi. Kontrol media pada penelitian ini tidak mengalami kontaminasi. Pertumbuhan bakteri dapat dilihat dari rata-rata selisih kontrol pertumbuhan pada jam 72 dengan jam 0. Bakteri bertumbuh sebanyak 0.915 ± 0.018 kali. Hasil selisih OD yang didapat kemudian diuji secara statistik untuk melihat kebermaknaannya.
Kadar (mg/mL)
Selisih OD (72-0)
Rata-rata SD
Rep 1 Rep 2 Rep 3
EHDK 6.25 0.496 0.413 0.452 0.454 0.042 EHDK 3.125 0.608 0.680 0.599 0.629 0.044 EHDK 1.5625 0.520 0.533 0.534 0.529 0.008 EHDK 0.781 0.542 0.536 0.535 0.538 0.004 EHDK 0.391 0.741 0.736 0.710 0.729 0.017 EHDK 0.195 0.850 0.775 0.763 0.796 0.047 K.Pertumb 0.902 0.908 0.935 0.915 0.018 K.DMSO 2% 0.900 0.910 0.899 0.903 0.006 K.Positif 0.346 0.354 0.34 0.347 0.007 K.Media 0.007 0.004 0.003 0.005 0.002
14
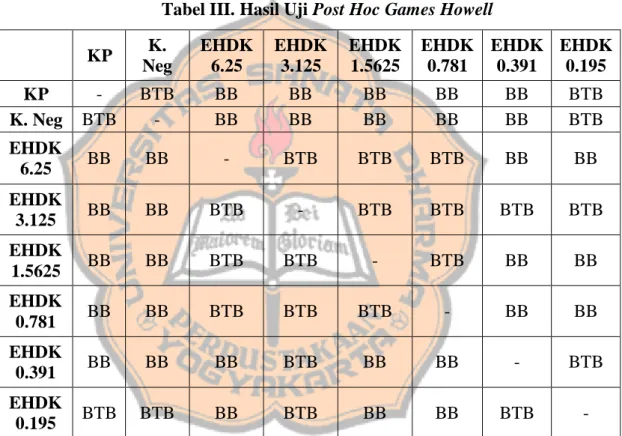
Pengujian statistik dilakukan dengan IBM SPSS (Lampiran 13). Pengujian normalitas data dilakukan dengan Shapiro Wilk dan hasil didapat adalah p > 0.05 sehingga disimpulkan bahwa data yang dimiliki terdistribusi normal. Uji homogenitas dilakukan dengan uji Levene’s test dan hasil yang didapatkan adalah p = 0.002 (p < 0.05) yang menandakan bahwa data yang dimiliki tidak homogen (Dahlan, 2014). Data yang terdistribusi normal dan tidak homogen kemudian diuji dengan Games Howell untuk melihat kebermaknaan data yang dimiliki (Shingala, 2015). Hasil pengujian Post-hoc Games Howell yang dilakukan terhadap data selisih OD dapat dilihat pada Tabel III.
Tabel III. Hasil Uji Post Hoc Games Howell
KP K. Neg EHDK 6.25 EHDK 3.125 EHDK 1.5625 EHDK 0.781 EHDK 0.391 EHDK 0.195 KP - BTB BB BB BB BB BB BTB K. Neg BTB - BB BB BB BB BB BTB EHDK 6.25 BB BB - BTB BTB BTB BB BB EHDK 3.125 BB BB BTB - BTB BTB BTB BTB EHDK 1.5625 BB BB BTB BTB - BTB BB BB EHDK 0.781 BB BB BTB BTB BTB - BB BB EHDK 0.391 BB BB BB BTB BB BB - BTB EHDK 0.195 BTB BTB BB BTB BB BB BTB -
Keterangan EHDK : Ekstrak Heksan Daun Kirinyuh; KP : Kontrol Pertumbuhan; K.Neg : Kontrol Negatif; BB : Berbeda Bermakna; BTB : Berbeda Tidak
Bermakna
Tabel 3 menunjukkan hasil dari uji Post Hoc Games Howell terhadap data hasil perlakuan ekstrak heksan daun kirinyuh terhadap bakteri P. acnes. Interpretasi data hasil uji Post Hoc Games Howell dengan taraf kepercayaan 95% dapat dilihat dari Sig yang terdapat pada tabel. Hasil berbeda bermakna akan menunjukkan p < 0.05 sedangkan hasil berbeda tidak bermakna akan menunjukkan p > 0.05. Pada data EHDK konsentrasi 0.195 mg/ml yang dibandingkan terhadap KP, hasil yang
15
didapat adalah berbeda tidak bermakna, sehingga jumlah perbedaan bakteri tidak signifikan terhadap KP dan menandakan bahwa pada EHDK 0.195 mg/ml memiliki jumlah bakteri yang tidak jauh berbeda dibandingkan dengan KP. Tidak banyaknya perbedaan jumlah bakteri akan menghasilkan persen penghambatan yang kecil pada pertumbuhan bakteri P. acnes. Sedangkan, pada EHDK konsentrasi 0.391 mg/ml – 6.25 mg/ml menunjukkan hasil berbeda bermakna jika dibandingkan dengan KP, yang berarti jumlah perbedaan bakteri signifikan terhadap KP dan menunjukkan bahwa bakteri yang terdapat pada EHDK konsentrasi 0.391 mg/ml – 6.25 mg/ml lebih sedikit dengan yang ada pada KP. Perbedaan jumlah bakteri yang signifikan tersebut menyatakan bahwa pada konsentrasi 0.391 mg/ml – 6.25 mg/ml memiliki persen penghambatan yang cukup tinggi pada pertumbuhan bakteri P. acnes.
Perbedaan yang bermakna selanjutnya ditunjukkan pada perbandingan antara EHDK 6.25, 1.5625 dan 0.781 dengan 0.391, 0.195 dan sebaliknya. Hal tersebut menunjukkan bahwa pada EHDK 6.25, 1.5625 dan 0.781 memiliki perbedaan jumlah bakteri yang signifikan dengan EHDK 0.391 dan 0.195. Berdasarkan hasil data dan statistika yang didapat, besarnya selisih Optical Density yang dihasilkan mungkin berkaitan dengan konsentrasi ekstrak heksan daun kirinyuh. Hasil statistik antara kontrol negatif dengan KP menunjukkan adanya perbedaan yang tidak bermakna (BTB) menandakan tidak adanya perbedaan jumlah bakteri yang signifikan atau jumlah bakteri yang tidak jauh berbeda antara kontrol negatif dengan KP. Setelah didapatkan OD, persen penghambatan dapat ditetapkan. Persen penghambatan yang dihitung adalah persen penghambatan pada kelompok perlakuan dan kontrol positif. Persen penghambatan didapatkan dengan membandingkan kelompok perlakuan dengan kelompok kontrol pertumbuhan. Kemudian, kadar hambat minimum (MIC) dapat ditentukan. MIC yang diterapkan pada penelitian ini adalah konsentrasi terkecil yang dapat menghambat minimal 50% pertumbuhan bakteri dalam kurun waktu 72 jam. Hal ini sesuai dengan penelitian Quave et al., (2015) yang menyatakan bahwa MIC50 didapat pada
konsentrasi yang menghambat minimal 50% pertumbuhan bakteri. Jumlah persen penghambatan yang dihasilkan dapat dilihat pada Tabel IV.
16
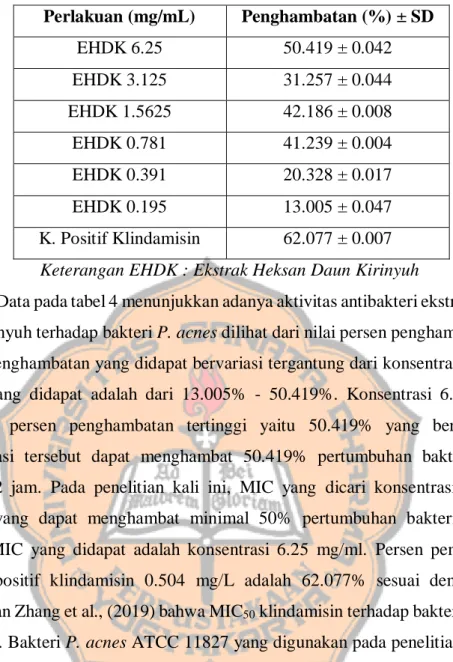
Tabel IV. Persen Penghambatan Ekstrak Heksan Daun Kirinyuh
Keterangan EHDK : Ekstrak Heksan Daun Kirinyuh
Data pada tabel 4 menunjukkan adanya aktivitas antibakteri ekstrak heksan daun kirinyuh terhadap bakteri P. acnes dilihat dari nilai persen penghambatannya. Persen penghambatan yang didapat bervariasi tergantung dari konsentrasi ekstrak. Range yang didapat adalah dari 13.005% - 50.419%. Konsentrasi 6.25 mg/ml memiliki persen penghambatan tertinggi yaitu 50.419% yang berarti pada konsentrasi tersebut dapat menghambat 50.419% pertumbuhan bakteri dalam waktu 72 jam. Pada penelitian kali ini, MIC yang dicari konsentrasi terendah ekstrak yang dapat menghambat minimal 50% pertumbuhan bakteri. Dengan begitu, MIC yang didapat adalah konsentrasi 6.25 mg/ml. Persen pengambatan kontrol positif klindamisin 0.504 mg/L adalah 62.077% sesuai dengan yang dinyatakan Zhang et al., (2019) bahwa MIC50 klindamisin terhadap bakteri P. acnes
0.5 mg/L. Bakteri P. acnes ATCC 11827 yang digunakan pada penelitian ini tidak resisten karena MIC yang didapat ≤ 2 µg/ml atau setara dengan 2 mg/L (Dogan et al., 2017).
Persen penghambatan yang didapat meningkat secara bertahap sesuai dengan konsentrasi yang semakin tinggi kecuali pada konsentrasi 3.125 mg/ml. Persen penghambatan yang dihasilkan pada konsentrasi 3.125 mg/ml lebih kecil dibandingkan dengan pada konsentrasi 1.5625 mg/ml. Hal tersebut dapat disebabkan oleh beberapa hal, seperti tidak homogennya persebaran kandungan fitokimia yang terdapat pada ekstrak, sehingga sebagian besar kandungan fitokimia ekstrak heksan daun kirinyuh yang terambil termasuk kandungan fitokimia yang bersifat antagonis, sehingga kandungan yang diharapkan memberikan aktivitas
Perlakuan (mg/mL) Penghambatan (%) ± SD EHDK 6.25 50.419 ± 0.042 EHDK 3.125 31.257 ± 0.044 EHDK 1.5625 42.186 ± 0.008 EHDK 0.781 41.239 ± 0.004 EHDK 0.391 20.328 ± 0.017 EHDK 0.195 13.005 ± 0.047 K. Positif Klindamisin 62.077 ± 0.007
17
antibakteri ternetralkan (Purwantoro et al., 2009). Menurut Putri et al. (2013) tidak sebandingnya konsentrasi dengan persen penghambatan yang dihasilkan cukup sering terjadi pada aktivitas ekstrak bahan alam. Hal ini disebabkan karena banyak faktor yang dapat mempengaruhi kestabilan bahan alam, seperti pH, besar partikel, kondisi penyimpanan yang dapat menyebabkan ketidakstabilan kimia, interaksi dengan bahan kontainer/wadah yang digunakan dan kehadiran zat kimia lain yang dapat mempengaruhi stabilitas (Thakur et al., 2011). Pada penelitian ini, ada kemungkinan ekstrak pada konsentrasi 3.125 mg/mL dipengaruhi oleh kondisi penyimpanan yang dapat menyebabkan ketidakstabilan kimia. Inkubasi dilakukan pada wadah tertutup rapat tanpa adanya oksigen dengan suhu 37oC selama 72 jam,
menyesuaikan dengan kondisi tumbuh bakteri. Menurut Thakur et al., (2011) suhu dan kelembaban adalah dua faktor utama yang mempengaruhi kualitas dan stabilitas produk herbal. Reaksi kimia meningkat dua dan tiga kali lipat untuk setiap kenaikan suhu 10°C. Kelembaban yang terserap pada ekstrak akan meningkatkan laju penguraian jika ekstrak rentan terhadap hidrolisis. Kehadiran enzim dalam produk juga meningkatkan laju kimia degradasi.
Jumlah persen penghambatan ekstrak heksan daun kirinyuh yang dihasilkan menunjukkan bahwa ekstrak heksan daun kirinyuh memiliki aktivitas antibakteri dan dapat menghambat pertumbuhan bakteri P. acnes. Kandungan fitokimia dalam ekstrak heksan daun kirinyuh memiliki peran dalam aktivitas antibakteri tersebut. Flavonoid, senyawa fenolik, terpenoid dan alkaloid merupakan kandungan fitokimia yang ada pada ekstrak heksan daun kirinyuh (Yulianti et al., 2017; Sukarno, 2017). Bakteri P. acnes merupakan bakteri gram positif yang memiliki dinding sel berupa peptidoglikan yang tebal dan tidak memiliki outer membran untuk menyaring molekul toksik yang akan masuk (Silhavy et al., 2010), hal tersebut memungkinkan salah satu mekanisme dari terpenoid, alkaloid ataupun flavonoid untuk bekerja yaitu mengubah permeabilitas membran sehingga pembentukan dinding sel bakteri tidak sempurna (Ren et al., 2014; Wahdaningsih et al., 2014) . Selain itu, dengan tidak adanya outer membran, protein langsung ada didalam atau di dekat membran/dinding sel dengan berikatan secara kovalen terhadap peptidoglikan (Silhavy et al., 2010), sehingga memungkinkan terpenoid dapat membentuk senyawa kompleks dengan porin (protein transmembran) pada
18
membran luar dinding sel bakteri, membentuk ikatan polimer yang kuat sehingga mengakibatkan rusaknya porin. Rusaknya porin yang merupakan pintu keluar masuknya senyawa akan mengurangi permeabilitas dinding sel bakteri yang akan mengakibatkan sel bakteri akan kekurangan nutrisi, sehingga pertumbuhan bakteri terhambat atau mati (Wahdaningsih et al., 2014).
Penelusuran literatur dilakukan oleh penulis mengenai beberapa penelitian pendahulu ekstrak heksan daun kirinyuh terhadap bakteri P. acnes. Salah satu penelitian mengenai ekstrak heksan daun kirinyuh terhadap bakteri P. acnes sudah pernah dilakukan sebelumnya oleh Hanphakphoom et al. (2016) dan Chomnawang et al., (2005) yang menyatakan pada penelitiannya bahwa MIC ekstrak heksan daun kirinyuh yang didapatkan ada pada konsentrasi 6.25 mg/ml dan 0.625 mg/ml. Pada penelitian Hanphakphoom et al. (2016) metode yang digunakan adalah macrobroth dilution, MIC yang didapatkan merupakan hasil dari minimal 80% penghambatan pertumbuhan bakteri jika dibandingkan dengan kontrol pertumbuhan, dan pelarut ekstrak yang digunakan adalah 10% DMSO. Sedangkan, pada penelitian Chomnawang et al., (2005) metode yang digunakan adalah microdilution dan MIC didefinisikan sebagai konsentrasi terkecil yang dapat menghambat pertumbuhan bakteri. Perbedaan hasil penelitian Hanphakphoom et al., (2016) dan Chomnawang et al., (2005) dengan yang dilakukan ini dikarenakan oleh beberapa faktor seperti perbedaan metode, perbedaan konsentrasi DMSO, perbedaan tempat tumbuh tanaman yang digunakan, umur tanaman yang digunakan, perbedaan waktu inkubasi dan perbedaan strain bakteri yang digunakan. DMSO merupakan cairan polar aprotik yang biasa digunakan sebagai pelarut (National Center for Biotechnology Information, 2020b). Lee and Park (2017) menyatakan bahwa DMSO konsentrasi 3-10% menunjukkan adanya pengurangan kelangsungan hidup sel. Sehingga, dengan adanya perbedaan konsentrasi DMSO memungkinkan terjadi perbedaan hasil penghambatan.
Metode yang digunakan pada penelitian ini adalah mikrodilusi yang memiliki tingkat sensitivitas lebih tinggi dan merupakan metode yang lebih layak untuk digunakan dalam pengujian aktivitas antibakteri dibandingkan denga metode agar (Klancnik et al., 2010). MIC yang didapatkan pada penelitian Klancnik et al. (2010) memperlihatkan bahwa MIC beberapa tanaman terhadap bakteri Escherecia
19
coli, Salmonella infantis dan Camphylobacter sp. yang dicari menggunakan mikrodilusi menunjukkan hasil yang sama atau bahkan didapat pada konsentrasi yang lebih kecil dibandingkan dengan metode dilusi lainnya. Hal ini menunjukkan bawha metode mikrodilusi memiliki sensitivitas yang lebih tinggi dibandingkan metode dilusi lainnya.
Perbedaan tempat tumbuh tanaman memungkinkan adanya perbedaan zat fitokimia yang terkandung di dalam tanaman (Kumar and Roy, 2018). Tanaman yang digunakan oleh penelitian Hanphakphoom et al. (2016) berasal dari Thailand, sedangkan tanaman pada penelitian ini berasal dari Yogyakarta, Indonesia. Perbedaan cuaca saat penanaman juga mempengaruhi zat fitokimia didalamnya terutama flavonoid. Jumlah flavonoid cenderung lebih banyak ketika tanaman tumbuh pada suhu tinggi atau saat cuaca panas (Kumar and Roy, 2018). Penelitian Harlina et al., (2013) yang dilakukan di Indonesia, menyatakan bahwa daun kirinyuh memiliki kandungan berupa alkaloid, senyawa fenolik, flavonoid dan terpenoid. Perbedaan kandungan fitokimia pada tanaman yang tumbuh di daerah berbeda dapat terjadi seperti yang dinyatakan pada penelitian Ance et al., (2018) mengenai kandungan fitokimia daun kirinyuh yang diambil dari 3 tempat tumbuh berbeda. Pada penelitiannya tersebut, daun kirinyuh diambil dari Malang, Surabaya dan Bogor dengan pertimbangan perbedaan curah hujan, suhu, kelembaban dan kualitas tanah. Daun kirinyuh dari ketiga daerah tersebut memiliki kandungan flavonoid, alkaloid, tannin, polifenol dan terpenoid. Hasil yang didapat menyatakan bahwa kandungan flavonoid dan senyawa fenolik terbanyak terdapat pada daun dari Surabaya, dan kandungan alkaloid terbanyak terdapat pada daun dari Malang. Hal ini menyatakan bahwa, perbedaan iklim (suhu, kelembaban, curah hujan, kualitas tanah) mempengaruhi kandungan fitokimia di dalam tanaman. Selain penelitian yang dilakukan oleh Ance et al., (2018), penelitian serupa juga dilakukan oleh Ghasemzadeh et al., (2015) terhadap daun Strobilanthes crispus (L.) yang tumbuh di Malaysia namun diambil dari kota yang berbeda. Pada penelitiannya, dinyatakan bahwa kandungan fitokimia ekstrak dari tanaman yang tumbuh dari kota yang berbeda, memiliki perbedaan yang cukup signifikan dalam jumlahnya.
Selain wilayah, umur dari tanaman itu sendiri bisa menjadi salah satu faktor. Daun yang digunakan dalam penelitian kali ini kurang lebih berumur 6
20
bulan, sedangkan pada penelitian aktivitas antibakteri ekstrak heksan daun kirinyuh terhadap bakteri P.acnes yang dilakukan Hanphakphoom et al., (2016) tidak diketahui umurnya. Hasil penelitian yang dilakukan oleh Ghasemzadeh et al., (2016) terhadap kandungan fitokimia tanaman Zingiber serumbet (L.) pada umur yang berbeda (3. 6 dan 9 bulan), menunjukkan adanya perbedaan kandungan fitokimia. Menurut Omokhua et al. (2017) jumlah flavonoid pada daun C. odorata yang dipanen pada umur 7 bulan memiliki jumlah flavonoid terbanyak dibandingkan dengan umur 3 bulan dan 5 bulan. Waktu panen yang tidak sesuai dapat mempengaruhi kandugan flavonoid di dalamnya dan membuat penghambatan kurang optimal.
Strain bakteri merupakan salah satu faktor hasil MIC yang didapatkan dalam penelitian aktivitas antibakteri suatu senyawa terhadap bakteri spesifik. Menurut Mostafa et al., (2018) variasi MIC dapat terjadi karena perbedaan strain bakteri yang digunakan dan variasi kandungan fitokimia didalamnya. Pada penelitian yang dilakukan oleh Kamei et al., (2009), dilakukan pengujian terhadap dua strain bakteri P.acnes yang berbeda (ATCC 11827 dan ATCC 25746). Hasil dari penelitian tersebut menyatakan bahwa MIC P. acnes terhadap klindamisin dari kedua bakteri tersebut berbeda. Beberapa penelitian sebelumnya yang meneliti kemampuan antibakteri eksrak heksan daun kirinyuh terhadap bakteri P. acnes seperti Hanphakphoom et al., (2016) dan Chomnawang et al., (2005) memiliki MIC yang berbeda terhadap bakteri P. acnes. Hal tersebut dikarenakan strain P. acnes yang digunakan berbeda, pada penelitian ini digunakan ATCC 11827 sedangkan pada penelitian Chomnawang et al., (2005) digunakan ATCC 6919 dan Hanphakphoom et al., (2016) digunakan DMST (Department of Medical Sciences Thailand) 14916. Perbedaan dari kedua strain ini adalah DMST 14916 merupakan bakteri yang dikeluarkan dan merupakan tipe yang ada di Thailand, sedangkan ATCC (American Type Culture Collection) 11827 merupakan bakteri yang dikeluarkan dan merupakan tipe yang ada di Amerika. Kemudian, perbedaan antara ATCC 6919 dengan ATCC 11827 terletak pada kandungan asam lemak dan hasil fermentasinya, ATCC 11827 memiliki kandungan asam lemak yang lebih sedikit dibandingkan ATCC 6919 dan ATCC 11827 dapat menghasilkan asam ribose, erithrytol dan sorbitol sedangkan ATCC 6919 tidak dapat menghasilkan
21
asam erithrytol. Kemudian, Whitman et al., (2012) menyatakan bahwa perbedaan strain bakteri dapat membuat adanya perbedaan produksi enzim dalam bakteri. Perbedaan produksi enzim dapat menyebabkan perbedaan MIC yang dihasilkan.
Penelitian mengenai tanaman seperti yang dilakukan pada penelitian ini merupakan salah satu upaya untuk mengatasi resistensi bakteri P. acnes terhadap antibiotik yang biasa digunakan. Selain resistensi, pengobatan dari tanaman dilakukan untuk menghindari efek samping senyawa sintetik dan juga biaya pengobatan dengan obat sintetik yang cenderung lebih mahal (Azimi et al., 2012). Tanaman memiliki kandungan fitokimia alami yang dapat diterima tubuh lebih baik dibandingkan dengan obat atau senyawa sintetik (Zaid et al., 2010). Tanaman dapat mengatasi resistensi karena bakteri sulit menjadi resisten dengan banyaknya kandungan fitokimia di dalam tanaman yang akan menyerang bakteri dari beberapa jalur atau mekanisme yang berbeda seperti gangguan fungsi membran dan struktur, dan gangguan sintesis dan fungsi DNA/RNA (Gupta and Birdi, 2017).
Penelitian yang dilakukan menunjukkan bahwa ekstrak heksan daun kirinyuh memiliki aktivitas antibakteri dalam menghambat pertumbuhan bakteri P. acnes. Kandungan fitokimia dalam ekstrak sangat berpengaruh terhadap aktivitas antibakteri, sehingga pengujian lebih lanjut terkait hubungan senyawa fitokimia dan aktivitas antibakteri ekstrak heksan daun kirinyuh diperlukan.
KESIMPULAN DAN SARAN
Ekstrak heksan daun kirinyuh memiliki aktivitas antibakteri terhadap bakteri P. acnes dilihat dari hasil persen penghambatan yang didapat. Pada seluruh konsentrasi ekstrak heksan daun kirinyuh terjadi penghambatan pertumbuhan dengan range persen penghambatan yang didapat adalah 13.005% - 50.419%. Hasil MICdidapatkan pada konsentrasi 6.25 mg/ml, yang berarti pada konsentrasi 6.25 mg/ml ekstrak heksan daun kirinyuh sudah dapat menghambat pertumbuhan bakteri P. acnes sebanyak minimal 50% setelah inkubasi selama 72 jam.
Saran bagi penelitian selanjutnya adalah melakukan pengujian kandungan fitokimia ekstrak heksan daun kirinyuh untuk mengetahui senyawa fitokimia yang berperan dalam aktivitas antibakteri. Kemudian, pengujian aktivitas antibakteri lanjutan menggunakan metode time-kill perlu dilakukan untuk mengetahui
22
kemampuan aktivitas antibakteri ekstrak heksan daun kirinyuh terhadap bakteri P. acnes yang lebih spesifik yaitu bakteriosidal dan bakteriostatik dan untuk mengetahui waktu optimal yang dibutuhkan ekstrak heksan daun kirinyuh untuk membunuh bakteri P.acnes. Selanjutnya, penelitian menggunakan bakteri P. acnes yang resisten terhadap klindamisin sebaiknya dilakukan, sehingga dapat diamati kemampuan ekstrak heksan daun kirinyuh terhadap bakteri P. acnes resisten.
23 DAFTAR PUSTAKA
Achermann, Y., Goldstein, E.J.C., Coenye, T., Shirtliffa, M.E., 2014. Propionibacterium acnes: From Commensal to opportunistic biofilm-associated implant pathogen. Clinical Microbiology Reviews, 27(3), 419–440. American Type Culture Collection, 2019. Cutibacterium acnes ATCC 11827. American Type Culture Collection, 2015. Atcc ® Bacterial Culture Guide.
Ance, P.E., Wijaya, S., Setiawan, H.K., Chromolaena, K., 2018. Standarisasi dari Daun Kirinyuh ( Chromolaena odorata ) dan Simplisia Kering dari Tiga Daerah yang Berbeda. Journal of Pharmacy Science and Practice, 5(1). Awouafack, M.D., Tane, P., Morita, H., 2017. Isolation and Structure
Characterization of Flavonoid. Intech Open Science,.
Azimi, H., Fallah-Tafti, M., Khakshur, A.A., Abdollahi, M., 2012. A review of phytotherapy of acne vulgaris: Perspective of new pharmacological treatments. Fitoterapia, 83(8), 1306–1317.
Badan Pengawas Obat dan Makanan Republik Indonesia, 2012. Pedoman Teknologi Formulasi Sediaan Berbasis Ekstrak.
Bowe, W.P., Logan, A.C., 2011. Acne vulgaris, Probiotics and the Gut-Brain-Skin Axis - Back to the future? Gut Pathogens, 3(1), 1–11.
Carpenter, D.E., Citron, D.M., 2018. Method for Antimicrobial Susceptibility Testing of Anaerobic Bacteria. Clinical and Laboratory Standards Instutute,. Chakraborty, A.K., Rambhade, S., Patil, U., 2011. Chromolaena odorata ( L .): An
Overview. Journal of Pharmacy Research, 4(3), 573–576.
Chomnawang, M.T., Surassmo, S., Nukoolkarn, V.S., Gritsanapan, W., 2005. Antimicrobial effects of Thai medicinal plants against acne-inducing bacteria. Journal of Ethnopharmacology, 101, 330–333.
Dahlan, M.S., 2014. Statistik untuk Kedokteran dan Kesehatan.
Dawson, A.L., Dellavalle, R.P., 2013. Acne vulgaris. BMJ, 1(May), 15029. Departemen Kesehatan Republik Indonesia, 2008. Farmakope Herbal Indonesia. Dogan, B., Bektore, B., Karabacak, E., Ozyurt, M., 2017. Resistance status of
antibiotics in Gram-positive bacteria isolated from acne lesions in İstanbul. Tukderm-Turkish Archives of Dermatology and Venereology, 32–36.
24
Fisk, W.A., Lev-tov, H.A., Sivamani, R.K., 2014. Botanical and Phytochemical Therapy of Acne. Phytotherapy Research, 1152(February), 1137–1152. Gajdacs, M., Spengler, G., Urban, E., 2017. Identification and Antimicrobial
Susceptibility Testing of Anaerobic Bacteria: Rubik ’ s Cube of Clinical Microbiology? Antibiotics, 6, 1–29.
Ghasemzadeh, A., Jaafar, H.Z.E., Ashkani, S., Rahmat, A., Juraimi, A.S., Puteh, A., Tengku, M., Mohamed, M., 2016. Variation in secondary metabolite production as well as antioxidant and antibacterial activities of Zingiber zerumbet ( L .) at different stages of growth. BMC Complementary and Alternative Medicine, 1–10.
Ghasemzadeh, A., Jaafar, H.Z.E., Rahmat, A., 2015. Phytochemical constituents and biological activities of different extracts of Strobilanthes crispus ( L .) Bremek leaves grown in different locations of Malaysia. BMC Complementary and Alternative Medicine, 1–10.
Glavas Dodov, M., Kulevanova, S., 2009. A Review of Phytotherapy of Acne vulgaris. Macedonian Pharmaceutical Bulletin, 55, 3–22.
Gupta, P.D., Birdi, T.J., 2017. Development of Botanicals to Combat Antibiotic Resistance. Journal of Ayurveda and Integrative Medicine, 8, 266–275. Hanphakphoom, S., Thophon, S., Waranusantigul, P., Kangwanrangsan, N., 2016.
Antimicrobial Activity of Chromolaena odorata Extracts against Bacterial Human Skin Infections. Modern Applied Science, 10(2), 159–171.
Harlina, Prajitno, A., Suprayitno, E., Nursyam, H., 2013. The Identification of Chemical Compound and Antibacterial Activity Test of Kopasanda ( Chromolaena Odorata L .) Leaf Extract Against Vibriosis -Causing Vibrio harveyi ( MR 275 Rif ) on Tiger Shrimp. Aquatic Science and Technology, 1(2), 15–29.
Hindritiani, R., Soedarwoto, A., Ruchiatan, K., Suwarsa, O., Budiarti, M.U., Husadani, D., Pranata, A.Y., 2017. Resistensi Antibiotik Propionibacterium acnes dari Berbagai Lesi Kulit Akne Vulgaris di Rumah Sakit Dr. Hasan Sadikin Bandung. Media Dermato-Venereologica Indonesiana, (38), 15–19. Johnson, P.D., Besselsen, D.G., 2002. Practical Aspects of Experimental Design in
25
Kamei, Y., Sueyoshi, M., Hayashi, K., Terada, R., Nozaki, H., 2009. The novel anti- Propionibacterium acnes compound , Sargafuran , found in the marine brown alga Sargassum macrocarpum (March), 259–263.
Klancnik, A., Jersek, B., Smole, S., Piskernik, S., 2010. Evaluation of Diffusion and Dilution Methods to Determine the Antibacterial Activity of Plant Extracts. Journal of Microbiological Methods, 81, 121–126.
Knutsen-Larson, S., Dawson, A.L., Dunnick, C.A., Dellavalle, R.P., 2012. Acne Vulgaris: Pathogenesis, Treatment, and Needs Assessment. Dermatologic Clinics, 30(1), 99–106.
Kumar, V., Roy, B.K., 2018. Population authentication of the traditional medicinal plant Cassia tora L . based on ISSR markers and FTIR analysis. Scientific Reports, (September 2017), 1–11.
Kusuma, I.W., Tangke, E., Kim, Y., 2015. Antimicrobial and antioxidant properties of medicinal plants used by the Bentian tribe from Indonesia. Food Science and Human Wellness, 3(3–4), 191–196.
Lee, H., Park, J.U.N.B., 2017. Evaluation of the effects of dimethylsulphoxide on morphology , cellular viability , mRNA , and protein expression of stem cells culture in growth media. Biomedical Records, 291–296.
Madelina, W., Sulistiyaningsih, 2018. Review: Resistensi Antibiotik Pada Terapi Pengobatan Jerawat. Farmaka, 15, 200–212.
Maimulyanti, A., Prihadi, A.R., 2016. Chemical composition of essential oil and hexane extract and antioxidant activity of various extracts of Acmella uliginosa ( Sw .) Cass fl owers from Indonesia. Agriculture and Natural Resources, 50(4), 264–269.
Mostafa, A.A., Al-askar, A.A., Almaary, K.S., Dawoud, T.M., Sholkamy, E.N., Bakri, M.M., 2018. Antimicrobial activity of some plant extracts against bacterial strains causing food poisoning diseases. Saudi Journal of Biological Sciences, 25(2), 361–366.
Naidoo, K., Coopoosamy, R., Naidoo, G., 2011. Screening of Chromolaeana odorata ( L .) King and Robinson for antibacterial and antifungal properties. Journal of Medicinal Plants Research, (September).
26
National Center for Biotechnology Information, 2020a. N-Hexane. PubChem Database,. URL https://pubchem.ncbi.nlm.nih.gov/compound/Hexane
National Center for Biotechnology Information, 2020b. Dimethyl-sulfoxide.
PubChem Database,. URL
https://pubchem.ncbi.nlm.nih.gov/compound/Dimethyl-sulfoxide
Nirmal, N.P., Panichayupakaranant, P., Nirmal, N.P., Panichayupakaranant, P., 2014. Anti-Propionibacterium acnes assay-guided purification of brazilin and preparation of brazilin rich extract from Caesalpinia sappan heartwood. Pharmaceutical Biology, 0209.
Nugraha, A.C., Prasetya, A.T., Mursiti, S., 2017. Isolasi, Identifikasi, Uji Aktivitas Senyawa Flavonoid sebagai Antibakteri dari Daun Mangga. Indonesian Journal of Chemical Science, 6(2).
Omokhua, A.G., Mcgaw, L.J., Chukwujekwu, J.C., Finnie, J.F., Staden, J. Van, 2017. A comparison of the antimicrobial activity and in vitro toxicity of a medicinally useful biotype of invasive Chromolaena odorata ( Asteraceae ) with a biotype not used in traditional medicine. South African Journal of Botany, 108, 200–208.
Perry, A., Lambert, P., 2011. Propionibacterium acnes: Infection Beyond the Skin. Expert Review of Anti-Infective Therapy, 9(12), 1149–1156.
Pineau, R.M., Hanson, S.E., Lyles, J.T., Quave, C.L., 2019. Growth Inhibitory Activity of Callicarpa americana Leaf Extracts Against Cutibacterium acnes 10(October), 1–12.
Purath, J., Coyner, T., 2017. Pharmacologic Therapy for Acne A Primer for Primary Care. Clinician Review, (October), 22–29.
Purwantoro, R.S., Agusta, A., Praptiwi, 2009. Aktivitas Antibakteri Ekstrak Daun Schefflera elliptica (Blume) Harms. Seminar Nasional Pusat Penelitian Biologi LIPI, 406–410.
Putri, E.P.K., Hamzah, B., Rahman, N., 2013. Analisis Kualitatif Zat Bioaktif Pada Ekstrak Daun Alpukat (Persea americana Mill) dan Uji Praklinis Dalam Menurunkan Kadar Glukosa Darah Pada Mencit(Mus musculus). Jurnal Akademika Kimia, 2(August), 119–127.
27
Quave, C.L., Lyles, J.T., Kavanaugh, J.S., Nelson, K., Parlet, P., Crosby, H.A., Heilmann, K.P., Horswill, A.R., 2015. Castanea sativa ( European Chestnut ) Leaf Extracts Rich in Ursene and Oleanene Derivatives Block Staphylococcus aureus Virulence and Pathogenesis without Detectable Resistance. Plos One, 1–32.
Quave, C.L., Plano, L.R.W., Pantuso, T., Bennett, B.C., 2008. Effects of Extracts from Italian Medicinal Plants on Planktonic Growth , Biofilm Formation and Adherence of Methicillin-Resistant Staphylococcus aureus. Journal of Ethnopharmacology, 118, 418–428.
Ren, L., Tang, F., Yang, W., Xie, Y., Chen, X., 2014. Antibacterial Activities of Flavonoids: Structure-Activity Relationship and Mechanism. Current Medicinal Chemistry, 22(1), 132–149.
Shingala, M.C., 2015. Comparison of Post Hoc Tests for Unequal Variance. International Journal of New Technologies in Science and Engineering, 2(5), 22–33.
Silhavy, T.J., Kahne, D., Walker, S., 2010. The Bacterial Cell Envelope. Cold Spring Harbor Perspective in Biology, 1–16.
Sinha, P., Srivastava, S., Mishra, N., Yadav, N.P., 2014. New Perspectives on Antiacne Plant Drugs: Contribution to Modern Therapeutics. BioMed Research International, 2014.
Stevenson, K., Mcvey, A.F., Clark, I.B.N., Swain, P.S., Pilizota, T., 2016. General calibration of microbial growth in microplate readers. Nature Publishing Group, (November), 4–10.
Sukarno, 2017. Uji Aktivitas Antibakteri Ekstrak Etanol, Etil Asetat dan n-Heksana Daun Laruna (Chromolaena odorata L) Terhadap Bakteri Staphylococcus aureus dan Escherichia coli.
Sukmawati, I.K., Yuniarto, A., Alighita, W., Jamaludin, A.Z., 2019. Antibacterial Activity of Extract and Fraction from Shiitake Mushroom ( Lentinula edodes ) against Acne Bacteria. Indonesia Journal of Pharmaceutical Science and Technology, 6(1).
Sulaiman, S.F., Sajak, A.A.B., Ooi, K.L., 2011. Journal of Food Composition and Analysis Effect of solvents in extracting polyphenols and antioxidants of
28
selected raw vegetables. Journal of Food Composition and Analysis, 24(4–5), 506–515.
Thakur, L., Ghodasra, U., Patel, N., Dabhi, M., 2011. Novel approaches for stability improvement in natural medicines. Pharmacognosy Reviews, 5(9).
Tsai, Tsung-hsien, Tsai, Tzung-hsun, Wu, W., Tseng, J.T., Tsai, P., 2009. In Vitro Antimicrobial and Anti-Inflammatory Effects of Herbs against Propionibacterium acnes. Food Chemistry, 119(3), 964–968.
Wahdaningsih, S., Untari, E.K., Fauziah, Y., 2014. Antibakteri Fraksi n -Heksana Kulit Hylocereus polyrhizus Terhadap Staphylococcus epidermidis dan Propionibacterium acnes Abstrak. Pharmaceutical Sciences and Research, 1(13), 180–193.
Whitman, W.B., Goodfellow, M., Kampfer, P., Busse, H.-J., Trujillo, M.E., Ludwig, W., Suzuki, K., 2012. Bergey’s Manual of Systematic Bacteriology Vol 5 : The Actinobacteria.
Williams, H.C., Dellavalle, R.P., Garner, S., 2012. Acne vulgaris. The Lancet, 379, 361–72.
Yajarla, V.N.G., Nimmanapalli, R.P., Parikapandla, S., Gupta, G., Karnati, R., 2014. Anti-inflammatory and Anti-proliferative Properties of Chromolaena odorata Leaf Extracts in Normal and Skin-Cancer Cell Lines. Journal of Herbs, Spices & Medicinal Plants, (September 2014), 37–41.
Yulianingtyas, A., Kusmartono, B., 2016. Optimization of Solvent Volume and Maceration Time on Extraction of Flavonoids From Averrhoa bilimbi Leaves. Jurnal Teknik Kimia, 58–64.
Yulianti, L., Supriadin, A., Rosahdi, T.D., 2017. Efek Larvasida Hasil Fraksinasi Ekstrak N-Heksana Daun Kirinyuh ( Chromolaena odorata L .) Terhadap Larva Aedes aegypti. al-Kimiya, 4(1).
Zaenglein, A.L., 2018. Acne vulgaris. The New England Journal of Medicine, 1, 15029.
Zaid, H., Raiyn, J., Nasser, A., Saad, B., Rayan, A., 2010. Physicochemical Properties of Natural Based Products versus Synthetic Chemicals. The Open Nutraceuticals Journal, 194–202.
29
Zhang, N., Yuan, R., Xin, K.Z., Lu, Z., 2019. Antimicrobial Susceptibility , Biotypes and Phylotypes of Clinical Cutibacterium ( Formerly Propionibacterium ) acnes Strains Isolated from Acne Patients : An Observational Study. Dermatology and Therapy, 9(4), 735–746.
Zhu, T., Zhu, W., Wang, Q., He, L., Wu, W., Liu, J., Li, Y., 2019. Antibiotic susceptibility of Propionibacterium acnes isolated from patients with acne in a public hospital in Southwest China : prospective cross- sectional study. BMJ Open, 1–7.
30 LAMPIRAN
Lampiran 1. Surat Keterangan Determinasi Tanaman
Lampiran 2. Penetapan Kadar Air Dengan Destilasi Toluen
31
Lampiran 3. Sertifikat Propionibacterium acnes ATCC 11827
Lampiran 4. Tanaman Chromolaena odorata (L.) R. M. King & H. Rob
32 Lampiran 5. Penetapan Bobot Tetap
Gambar 3. Hasil Penimbangan Cawan Kosong (a), Hasil Penimbangan Pertama Bobot Tetap (b), dan Hasil Penimbangan Terakhir Bobot Tetap (c)
(a) (b)
33 Lampiran 6. Ekstrak Heksan Daun Kirinyuh
Gambar 4. Ekstrak Heksan Daun Kirinyuh
Lampiran 7. Uji Kelarutan Ekstrak Dalam DMSO
Gambar 5. Kelarutan Ekstrak Dalam DMSO 50% (a) dan Kelarutan Ekstrak Dalam DMSO 100% (b)