UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL DAUN KEMBANG BULAN(Tithonia diversifolia (Hemsley) A. Gray) TERHADAP
BAKTERI Staphylococcus aureus, Propionibacterium acnes dan Pseudomonas aeruginosa
SKRIPSI
OLEH:
RONNI SIREGAR NIM 081524019
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA
UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL DAUN KEMBANG BULAN(Tithonia diversifolia (Hemsley) A. Gray) TERHADAP
BAKTERI Staphylococcus aureus, Propionibacterium acnes dan Pseudomonas aeruginosa
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara OLEH:
RONNI SIREGAR NIM 081524019
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA
PENGESAHAN SKRIPSI
UJI AKTIVITAS ANTIBAKTERIEKSTRAK ETANOL DAUN KEMBANG BULAN(Tithonia diversifolia (Hemsley) A. Gray) TERHADAP BAKTERI
Staphylococcus aureus, Propionibacterium acnes dan Pseudomonas aeruginosa.
OLEH : RONNI SIREGAR
NIM 081524019
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi
Universitas Sumatera Utara Pada tanggal : Juli 2011
Pembimbing I, Panitia Penguji,
Dr. Marline Nainggolan, M.S., Apt. Dr. M. Pandapotan Nasution, MPS., Apt. NIP 195709091985112001 NIP 194908111976031001
Pembimbing II, Dr. Marline Nainggolan, M.S., Apt. NIP 195709091985112001
Dra. Erly Sitompul, M.Si., Apt Drs. Panal Sitorus, M.Si., Apt. NIP 195006121980032001 NIP 195310301980031002
Dra. Anayanti Arianto, M.Si., Apt. NIP 195306251986012001
Medan, Juli 2011
Fakultas Farmasi Universitas Sumatera Utara
Dekan,
KATA PENGANTAR
Puji dan syukur kepada Tuhan Yang Maha Kuasa atas anugerah dan kasih
setiaNya, sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi
ini untuk memenuhi syarat dalam memperoleh gelar Sarjana Farmasi pada
Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini penulis mempersembahkan skripsi ini sebagai rasa
terima kasih kepada Ayahanda dan Ibunda tercinta, P.Siregar dan R. Sihombing,
kakak Hetty Siregar, Risda Siregar dan Lyndon Siregar, adik Leonard Siregar,
Petra Siregar dan Elvi Siregar, serta abang tercinta Hadi I. Walesa Panjaitan atas
doa, dorongan dan pengorbanan baik moril maupun material selama menempuh
pendidikan Strata 1 Farmasi.
Penulis juga menyampaikan terima kasih yang sebesar-besarnya kepada
Ibu Dr. Marline Nainggolan, M.S., Apt dan.Ibu Dra. Erly Sitompul, M.Si., Apt.,
yang telah membimbing dengan penuh kesabaran, tulus dan ikhlas selama
penelitian dan penulisan skripsi ini berlangsung.
Pada kesempatan ini penulis juga menyampaikan ucapan terima kasih
kepada :
1. Dekan Fakultas Farmasi Universitas Sumatera Utara, Prof. Dr. Sumadio
Hadisahputra, Apt., yang telah memberikan bantuan dan fasilitas selama masa
pendidikan.
2. Ibu Dra. Aswita Hafni Lubis M.Si., Apt. selaku Kepala Laboratorium
Laboratorium Mikrobiologi dan seluruh staf yang telah memberikan fasilitas
dan bantuan selama penelitian.
3. Ibu Dra. Juanita Tanuwijaya, Apt., selaku Penasehat Akademik yang telah
memberikan petunjuk dan bimbingan kepada penulis selama masa
pendidikan.
4. Bapak Dr. M. Pandapotan Nasution, MPS., Apt., Bapak Drs. Panal Sitorus,
M.Si., Apt., dan Ibu Dra. Anayanti Arianto, M.Si., Apt.selaku dosen penguji
yang telah memberikan saran dan kritikan kepada penulis hingga selesainya
penulisan skripsi ini.
5. Bapak dan Ibu staf pengajar Fakultas Farmasi USU yang telah membina dan
mendidik penulis selama menuntut ilmu.
6. Teman-teman Mahasiswa/i Ekstensi Farmasi angkatan 2008 khususnya
Chinda, Emi, Henni, Siska, Sondang, ka Liska, ka Roma, Santa, dan Widya
yang telah memberikan bantuan, saran, dan semangat sehingga penelitian dan
penulisan skripsi ini dapat selesai.
Penulis menyadari bahwa tulisan ini masih memiliki banyak kekurangan,
oleh karena itu dengan segala kerendahan hati penulis bersedia menerima kritikan
dan saran yang membangun pada skripsi ini.Semoga skripsi ini bermanfaat bagi
kita semua.
Medan, Juli 2011
Penulis,
UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL DAUN KEMBANG BULAN(Tithonia diversifolia (Hemsley) A. Gray) TERHADAP BAKTERI Staphylococcus aureus, Propionibacterium acnes
dan Pseudomonas aeruginosa ABSTRAK
Kembang bulan (Tithonia diversifolia (Hemsley) A. Gray) familia Asteraceae merupakan salah satu tanaman obat yang digunakan sebagai obat tradisional di Indonesia.Tanaman ini digunakan sebagai obat luka atau luka lebam, berkhasiat sebagai obat sakit perut kembung, penyakit lepra, dan penyakit lever.Daun kembang bulan mengandung flavonoida, glikosida, saponin, tanin dan triterpenoid/steroid.Senyawa fenol seperti flavonoid dan tanin memiliki aktivitas sebagai antibakteri. Adanya kandungan senyawa flavonoid dan tanin tersebut, diharapkan ekstrak daun kembang bulan dapat menghambat pertumbuhan bakteri
Staphylococcus aureus ATCC 25923,Propionibacteriumacnes ATCC 11827dan Pseudomonas aeruginosa ATCC 27853.
Penelitian ini dilakukan untukmengetahui karakteristik dan aktivitas antibakteri dari ekstrak etanol daun kembang bulan. Karakterisasi dilakukanmenurut Materia Medika Indonesia edisi VI yang meliputi penetapan kadar air, penetapan kadar sari larut dalam air, penetapan kadar sari larut dalam etanol, penetapan kadar abu total dan penetapan kadar abu tidak larut dalam asam. Pengujian aktivitas antibakteri dilakukan secara in vitro dengan metode difusi agar dengan pengenceran ekstrak etanol daun kembang bulan secara serial dengan konsentrasi berturut-turut 300 mg/ml, 250 mg/ml, 200 mg/ml, 150 mg/ml, 100 mg/ml, 75 mg/ml, 50 mg/ml, 25 mg/ml dan 10 mg/ml. Parameter yang dilihat adalah besarnya diameter hambat pertumbuhan bakteri yang diukur dengan menggunakan jangka sorong.
Hasil karakterisasi ekstrak etanol daun kembang bulan menunjukkan kadar air 8,85%, kadar abu total 6,82%, kadar abu total tidak larut asam 0,446%, kadar sari larut dalam air 69,054%, dan kadar sari larut dalam etanol 26,164%. Ekstrak etanol daun kembang bulan mempunyai aktivitas sebagai antibakteri. Aktivitas antibakteri ekstrak etanol daun kembang bulan yang memuaskan pada bakteri Staphylococcus aureus adalahpada konsentrasi 75 mg/ml dengan diameter hambat 14,25 mm, pada bakteri Propionibacterium acnes dan Pseudomonas
aeruginosa pada konsentrasi 100 mg/ml dengan diameter hambat 15,88 mm dan
15,65 mm.
Kata kunci: kembang bulan, antibakteri, Staphylococcus aureus,
TEST OF ANTIBACTERIAL ACTIVITY OF ETHANOL EXTRACT OF KEMBANG BULAN’S LEAVES (Tithonia diversifolia (Hemsley) A. Gray)
ON BACTERIA Staphylococcus aureus, Propionibacterium acnes and Pseudomonas aeruginosa
ABSTRACT
Kembang Bulan (Tithonia diversifolia (Hemsley) A. Gray), family Asteraceae is one of the medicinal plants used as traditional medicine in Indonesia. This plant is used as remedies for wounds or injuries bruising, efficacious for curing flatulence, leprosy, and liver disease. The leaves contain flavonoides, glycosides, saponins, tannins and triterphenoids/steroids. Phenol compounds such as flavonoids and tannins have activity as an antibacterial. That it contains flavonoids and tannins, it is expected that extract of kembang bulan’s leaves can inhibit the growth of bacteria Staphylococcus aureus ATCC 25923, Propionibacterium acnes ATCC and 11827, Pseudomonas aeruginosa ATCC 27853.
This research was conducted to investigate the characteristics and antibacterial activity of ethanol extract of kembang bulan’s leaves. Characterization was carried out according to Medika Materia Indonesia the sixth edition that includes the determination of water content, determination of water soluble extracts, determination of ethanol-soluble extract, determination of total ash content and the determination of ash content which does not dissolve in acid. Tests for antibacterial activity was tested in vitro by diffusion method in order due to the dilution of ethanol extract of kembang bulan’s leaves in a series with consecutive concentrations became 300 mg/ml, 250 mg/ml, 200 mg/ml, 150 mg/ml, 100 mg/ml, 75 mg/ml, 50 mg/ml, 25 mg/ml and 10 mg/ml. The parameters which are considered are the large diameter of bacterial growth inhibition that was measured by using a shove.
The results of characterization of ethanol extract of kembang bulan’s leaves showed the water content is 8.85%, total ash content is 6.82%, total ash acid insoluble content is 0.446%, water-soluble extract content is 69.054%, and content of soluble extract in ethanol is 26.164%. The ethanol extract of kembang bulan’s leaves has antibacterial activity. Antibacterial activity of ethanol extract of kembang bulan’s leaves which is satisfying on bacteria Staphylococcus aureus is at a concentration of 75 mg/ml with a diameter of inhibition 14.25 mm, on the bacteria Propionibacterium acnes and Pseudomonas aeruginosa at a concentration of 100 mg/ml with a diameter of inhibition 15.88 mm and 15.65 mm.
DAFTAR ISI
Halaman
Judul ... i
HalamanPengesahan ... ii
Kata Pengantar ... iv
Abstrak ... vi
Abstract ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xi
DAFTAR LAMPIRAN ... xii
BAB I PENDAHULUAN ... 1
1.1Latar Belakang ... 1
1.2Perumusan Masalah ... 2
1.3Hipotesis ... 3
1.4Tujuan ... 3
1.5 Manfaat ... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1 Uraian Tumbuhan ... 4
2.1.1 Habitat ... 4
2.1.2 Morfologi ... 4
2.1.3 Sistematika ... 5
2.1.4 Nama lain ... 5
2.1.5 Khasiat dan penggunaan ... 5
2.3 Sterilisasi ... 7
2.4 Uji Efek Antibakteri ... 9
2.4.1 Cara difusi ... 9
2.4.2 Cara turbidimetri ... 10
2.4.3 Cara dilusi ... 10
2.5 Uraian Bakteri ... 11
2.5.1 Klasifikasi bakteri ... 11
2.5.2 Struktur bakteri ... 13
2.5.3 Reproduksi bakteri ... 15
2.5.4 Fase pertumbuhan bakteri ... 15
2.5.5 Faktor-faktor yang mempengaruhi pertumbuhan bakteri 16 2.5.6 Uraian bakteri Staphylococcus aureus ... 20
2.5.7 Uraian bakteri Pseudomonas aeruginosa ... 21
2.5.8 Uraian bakteri, Propionibacterium acnes ... 23
BAB III METODOLOGI PENELITIAN ... 24
3.1 Alat dan Bahan ... 24
3.1.1Alat-alat ... 24
3.1.2 Bahan-bahan ... 24
3.2 Penyiapan sampel ... 25
3.2.1 Pengambilan Bahan Tumbuhan ... 25
3.2.2 Identifikasi Tumbuhan ... 25
3.2.3 Pembuatan Simplisia ... 25
3.3Pembuatan Ekstrak Etanol Daun Kembang Bulan ... 26
3.4.1 Penetapan Kadar Air ... 26
3.4.2 Penetapan Kadar Abu Total ... 27
3.4.3 Penetapan Kadar Abu Tidak Larut dalam Asam ... 27
3.4.4 Penetapan Kadar Sari Larut dalam Air ... 27
3.4.5 Penetapan Kadar Sari Larut dalam Etanol ... 28
3.5 Sterilisasi Alat ... 28
3.6 Pembuatan Media ... 28
3.6.1 Pembuatan Media Nutrient Agar (NA) ... 28
3.6.2 Larutan NaCl 0,9 % ... 29
3.7 Pembiakan Bakteri ... 29
3.7.1 Pembuatan Stok Kultur Bakteri ... 29
3.7.2 Pembuatan Inokulum Bakteri ... 30
3.8 Pembuatan Larutan Uji Ekstrak Etanol Berbagai Konsentrasi . 30 3.9 Metode Pengujian Efek Antibakteri Secara In Vitro ... 30
BAB IV HASIL DAN PEMBAHASAN ... 32
4.1 Hasil Identifikasi Tumbuhan ... 32
4.2 Hasil Maserasi ... 32
4.3 Hasil Karakterisasi ... 32
4.4 Hasil Uji Antibakteri Ekstrak Etanol Daun Kembang Bulan ... 33
BAB V KESIMPULAN DAN SARAN ... 36
5.1Kesimpulan ... 36
5.2 Saran ... 36
DAFTAR PUSTAKA ... 37
DAFTAR TABEL
Halaman
Tabel 4.1 Hasil karakterisasi ekstrak etanol daun kembang bulan ... 33
Tabel 4.2 Hasil pengukuran diameter daerah hambatan
pertumbuhanbakteriStaphylococcus aureus,
Propionibacterium acnes dan Pseudomonas aeruginosaoleh
DAFTAR LAMPIRAN
Halaman
Lampiran 1.Identifikasi Tumbuhan ... 39
Lampiran 2.Gambar tumbuhan kembang bulan (Tithonia diversifolia
(Hemsley) A. Gray) ... 40
Lampiran 3.Gambar daunsegartumbuhan kembang bulan ... 40
Lampiran 4.Bagan pembuatan ekstrak etanol daun kembang bulan ... 41
Lampiran 5.Perhitungan kadar air ekstrak etanol daun kembang
bulan ... 42
Lampiran 6.Perhitungan kadar abu total ekstrak etanol daun
kembang bulan ... 43
Lampiran 7.Perhitungan kadar abu tidak larut dalam asam ekstrak
etanol daun kembang bulan... 44
Lampiran 8.Perhitungan kadar sari larut dalam air ekstrak etanol
daun kembang bulan ... 45
Lampiran 9.Perhitungan kadar sari larut dalam etanol ekstrak
etanol daun kembang bulan... 46
Lampiran 10. Bagan uji efek antibakteri dari ekstrak etanol daun
kembang bulan ... 47
Lampiran 11. Tabel hasil pengukuran diameter daerah hambatan
pertumbuhanbakteriStaphylococcus aureus,
Propionibacterium acnes dan Pseudomonas aeruginosa
oleh ekstrak etanol daun kembang bulan ... 48
kembang bulan terhadap pertumbuhan Staphylococcus
aureus ... 49
Lampiran 13. Gambar hasil pengujian antibakteri ekstrak etanol daun
kembangbulan terhadap pertumbuhan
Propionibacterium acnes ... 50
Lampiran 14.Gambar hasil pengujian antibakteri ekstrak etanol daun
kembang bulan terhadap pertumbuhan Pseudomonas
UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL DAUN KEMBANG BULAN(Tithonia diversifolia (Hemsley) A. Gray) TERHADAP BAKTERI Staphylococcus aureus, Propionibacterium acnes
dan Pseudomonas aeruginosa ABSTRAK
Kembang bulan (Tithonia diversifolia (Hemsley) A. Gray) familia Asteraceae merupakan salah satu tanaman obat yang digunakan sebagai obat tradisional di Indonesia.Tanaman ini digunakan sebagai obat luka atau luka lebam, berkhasiat sebagai obat sakit perut kembung, penyakit lepra, dan penyakit lever.Daun kembang bulan mengandung flavonoida, glikosida, saponin, tanin dan triterpenoid/steroid.Senyawa fenol seperti flavonoid dan tanin memiliki aktivitas sebagai antibakteri. Adanya kandungan senyawa flavonoid dan tanin tersebut, diharapkan ekstrak daun kembang bulan dapat menghambat pertumbuhan bakteri
Staphylococcus aureus ATCC 25923,Propionibacteriumacnes ATCC 11827dan Pseudomonas aeruginosa ATCC 27853.
Penelitian ini dilakukan untukmengetahui karakteristik dan aktivitas antibakteri dari ekstrak etanol daun kembang bulan. Karakterisasi dilakukanmenurut Materia Medika Indonesia edisi VI yang meliputi penetapan kadar air, penetapan kadar sari larut dalam air, penetapan kadar sari larut dalam etanol, penetapan kadar abu total dan penetapan kadar abu tidak larut dalam asam. Pengujian aktivitas antibakteri dilakukan secara in vitro dengan metode difusi agar dengan pengenceran ekstrak etanol daun kembang bulan secara serial dengan konsentrasi berturut-turut 300 mg/ml, 250 mg/ml, 200 mg/ml, 150 mg/ml, 100 mg/ml, 75 mg/ml, 50 mg/ml, 25 mg/ml dan 10 mg/ml. Parameter yang dilihat adalah besarnya diameter hambat pertumbuhan bakteri yang diukur dengan menggunakan jangka sorong.
Hasil karakterisasi ekstrak etanol daun kembang bulan menunjukkan kadar air 8,85%, kadar abu total 6,82%, kadar abu total tidak larut asam 0,446%, kadar sari larut dalam air 69,054%, dan kadar sari larut dalam etanol 26,164%. Ekstrak etanol daun kembang bulan mempunyai aktivitas sebagai antibakteri. Aktivitas antibakteri ekstrak etanol daun kembang bulan yang memuaskan pada bakteri Staphylococcus aureus adalahpada konsentrasi 75 mg/ml dengan diameter hambat 14,25 mm, pada bakteri Propionibacterium acnes dan Pseudomonas
aeruginosa pada konsentrasi 100 mg/ml dengan diameter hambat 15,88 mm dan
15,65 mm.
Kata kunci: kembang bulan, antibakteri, Staphylococcus aureus,
TEST OF ANTIBACTERIAL ACTIVITY OF ETHANOL EXTRACT OF KEMBANG BULAN’S LEAVES (Tithonia diversifolia (Hemsley) A. Gray)
ON BACTERIA Staphylococcus aureus, Propionibacterium acnes and Pseudomonas aeruginosa
ABSTRACT
Kembang Bulan (Tithonia diversifolia (Hemsley) A. Gray), family Asteraceae is one of the medicinal plants used as traditional medicine in Indonesia. This plant is used as remedies for wounds or injuries bruising, efficacious for curing flatulence, leprosy, and liver disease. The leaves contain flavonoides, glycosides, saponins, tannins and triterphenoids/steroids. Phenol compounds such as flavonoids and tannins have activity as an antibacterial. That it contains flavonoids and tannins, it is expected that extract of kembang bulan’s leaves can inhibit the growth of bacteria Staphylococcus aureus ATCC 25923, Propionibacterium acnes ATCC and 11827, Pseudomonas aeruginosa ATCC 27853.
This research was conducted to investigate the characteristics and antibacterial activity of ethanol extract of kembang bulan’s leaves. Characterization was carried out according to Medika Materia Indonesia the sixth edition that includes the determination of water content, determination of water soluble extracts, determination of ethanol-soluble extract, determination of total ash content and the determination of ash content which does not dissolve in acid. Tests for antibacterial activity was tested in vitro by diffusion method in order due to the dilution of ethanol extract of kembang bulan’s leaves in a series with consecutive concentrations became 300 mg/ml, 250 mg/ml, 200 mg/ml, 150 mg/ml, 100 mg/ml, 75 mg/ml, 50 mg/ml, 25 mg/ml and 10 mg/ml. The parameters which are considered are the large diameter of bacterial growth inhibition that was measured by using a shove.
The results of characterization of ethanol extract of kembang bulan’s leaves showed the water content is 8.85%, total ash content is 6.82%, total ash acid insoluble content is 0.446%, water-soluble extract content is 69.054%, and content of soluble extract in ethanol is 26.164%. The ethanol extract of kembang bulan’s leaves has antibacterial activity. Antibacterial activity of ethanol extract of kembang bulan’s leaves which is satisfying on bacteria Staphylococcus aureus is at a concentration of 75 mg/ml with a diameter of inhibition 14.25 mm, on the bacteria Propionibacterium acnes and Pseudomonas aeruginosa at a concentration of 100 mg/ml with a diameter of inhibition 15.88 mm and 15.65 mm.
BAB I PENDAHULUAN
1.1Latar Belakang
Alam Indonesia sangat kaya akan berbagai macam tumbuhan, baik sengaja
dipelihara maupun yang tumbuh dengan liar. Banyak tumbuhan yang telah
dibudidayakan dan digunakan sebagai obat tradisional. Namun informasi tentang
nama maupun kandungan dan ramuannya belum banyak dipublikasikan, sehingga
pemanfaatan tanaman untuk tujuan pengobatan sebagian besar hanya didasarkan
pada pengalaman turun-temurun. Informasi ini terbatas pada pengalaman setiap
daerah (Syukur dan Hernani, 2001).
Kembang bulan (Tithonia diversifolia (Hemsley) A. Gray) merupakan
salah satu tanaman obat yang digunakan sebagai obat tradisional di
Indonesia.Tanaman ini digunakan sebagai obat luka atau luka lebam, berkhasiat
sebagai obat sakit perut kembung, penyakit lepra, dan penyakit lever (Anonim,
2004; Hutapea, 1994).
Hasil skrining fitokimia yang dilakukan oleh Purba (2003), daun kembang
bulan mengandung flavonoida, glikosida, saponin, tanin dan triterpenoid/steroid.
Hasil penelitian Didik dan Sulistijowati (2001), menyebutkan daun kembang
bulan mengandung 12 senyawa terpenoid, 14 senyawa flavonoid dan gula.
Menurut Robinson (1995), senyawa fenol seperti flavonoid dan tanin memiliki
aktivitas sebagai antibakteri.
Adanya kandungan senyawa flavonoid dan tanin, diharapkan ekstrak
etanol daun kembang bulan dapat menghambat perkembangbiakan bakteri
Staphylococcus aureus merupakan bakteri gram positif yang terdapat pada
kulit, luka, mulut, selaput lendir dan saluran cerna.Infeksi oleh bakteri ini adalah
yang terutama menimbulkan penyakit pada manusia dan dapat menyerang seluruh
tubuh.Propionibacterium acnesadalah bakteri gram positif, termasuk flora normal
pada kulit dan saluran cerna.Bakteri ini berperan pada terjadinya jerawat yang
dapat mengkontaminasi darah dengan cara menembus kulit. Sedangkan
Pseudomonas aeruginosa adalah bakteri gram negatif dan merupakan penyebab
utama infeksi pneumonia nosokomial.Infeksi oleh bakteri ini terjadi pada
seseorang yang mengalami gangguan pada sistem pertahanan tubuh, misalnya
pada orang yang mengalami luka atau luka bakar, dan pada orang yang ada
gangguan metabolisme. Bakteri ini juga dapat menginfeksi kornea dan saluran
kemih. (Jawetz, et al., 2001; Pelczar, 1988).
Berdasarkan uraian di atas, maka peneliti ingin melakukan pengujian
terhadap daun kembang bulan (Tithonia diversifolia (Hemsley) A. Gray) yang
meliputi karakterisasi ekstrak dan uji antibakteri ekstrak etanol terhadap
Staphylococcus aureus, Propionibacterium acnes dan Pseudomonas aeruginosa.
1.2Perumusan Masalah
1. Bagaimanakah karakteristik ekstrak etanol daun kembang bulan (Tithonia
diversifolia (Hemsley) A. Gray)?
2. Apakah ekstrak etanol daun kembang bulan (Tithonia diversifolia (Hemsley)
A. Gray) mempunyai aktivitas antibakteri terhadap Staphylococcus aureus,
1.3Hipotesis
1. Karakteristik ekstrak etanol daun kembang bulan dapat diperoleh dengan
memakai prosedur pada Materia Medika Indonesia.
2. Ekstrak etanol daun kembang bulan (Tithonia diversifolia (Hemsley) A. Gray)
mempunyai aktivitas antibakteri terhadap pertumbuhan bakteri
Staphylococcus aureus,Propionibacteriumacnes dan Pseudomonas
aeruginosa.
1.4Tujuan
Tujuan penelitian ini adalah untuk:
1. Mengetahui karakteristik ekstrak etanol daun kembang bulan (Tithonia
diversifolia (Hemsley) A. Gray).
2. Mengetahui adanya aktivitas antibakteri dari ekstrak etanol daun kembang
bulan (Tithonia diversifolia (Hemsley) A. Gray).
1.5Manfaat
Hasil penelitian ini diharapkan dapat memberikan informasi tentang efek
antibakteri dari ekstrak etanol daun kembang bulan (Tithonia diversifolia
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan Kembang Bulan 2.1.1 Habitat
Tumbuhan Kembang bulan (Tithonia diversifolia (Hemsley) A. Gray)
umumnya tumbuhan liar di tempat-tempat curam, misalnya di tebing-tebing, tepi
sungai dan selokan. Sekarang banyak ditanam sebagai tanaman hias karena warna
bunganya yang kuning indah dan sebagai pagar untuk mencegah kelongsoran
tanah. Juga merupakan tumbuhan tahunan yang kerap tumbuh di tempat terang
dan banyak sinar matahari langsung. Tumbuh dengan mudah di tempat atau di
daerah berketinggian 5-1500 m di atas permukaan laut. (Didik dan Sulistijowati,
2001; Watt, 1962).
2.1.2 Morfologi
Tumbuhan kembang bulan (Tithonia diversifolia (Hemsley) A. Gray)
merupakan tumbuhan perdu yang tegak dengan tinggi lebih kurang ± 5 m.
Batang tegak, bulat, berkayu hijau. Daunnya tunggal, berseling, panjang 26-32
cm, lebar 15-25 cm, ujung dan pangkal runcing, pertulangan menyirip, hijau.
Bunga merupakan bunga majemuk, di ujung ranting, tangkai bulat, kelopak
bentuk tabung, berbulu halus, hijau, mahkota lepas, bentuk pita, halus, kuning,
benang sari bulat, kuning, putik melengkung, kuning.Buahnya bulat, jika masih
muda berwarna hijau setelah tua berwarna coklat.Bijinya bulat, keras, dan
berwarna coklat. akarnya berupa akar tunggang berwarna putih kotor (Hutapea,
2.1.3 Sistematika tumbuhan
Tumbuhan kembang bulan memiliki sistematik (Hutapea, 1994) sebagai
berikut :
Divisi :Spermatophyta
Sub divisi :Angiospermae
Kelas :Dicotyledoneae
Bangsa :Asterales
Suku :Asteraceae
Marga :Tithonia
Jenis : Tithonia diversifolia (Hemsley) A. Gray
2.1.4 Nama lain
Tumbuhan kembang bulan memiliki nama lain yaitu :
Sinonim : Mirasolia diversifolia Hemsley (Hutapea, 1994).
Nama daerah : Rondose-moyo, Harsaga (Jawa), Kirinyu (Sunda), Kayu Paik
(Minang) (Agusta, 2000; Didik dan Sulistijowati, 2001).
Nama asing : Mary Gold, Shrub Sunflower, Mexican Sunflower (Inggris),
Mirasol (Guatemala), Yellow Flower (Portugis) (Anonim, 2003;
Anonim, 2004)
2.1.5 Khasiat dan penggunaan
Tumbuhan kembang bulan (Tithonia diversifolia (Hemsley) A. Gray)
umum digunakan sebagai obat luka atau luka lebam, dan sebagai obat sakit perut
kembung.Banyak juga digunakan sebagai obat lepra, penyakit lever, obat diabetes
dan dapat digunakan sebagai penggugur kandungan (Anonim, 2004; Hutapea,
2.2 Metode Ekstraksi
Ekstraksi adalah suatu cara untuk menarik satu atau lebih zat dari bahan
asal dengan menggunakan pelarut (Syamsuni, 2006). Zat aktif yang terdapat
dalam simplisia tersebut dapat digolongkan ke dalam golongan minyak atsiri,
alkaloid, flavonoid dan lain - lain (Depkes, 2000).Tujuan utama ekstraksi ini
adalah untuk mendapatkan atau memisahkan sebanyak mungkin zat - zat yang
memiliki khasiat pengobatan (Syamsuni, 2006).
Metode ekstraksi dengan menggunakan pelarut dapat dilakukan dengan
beberapa cara :
1. Maserasi
Maserasi berasal dari kata “macerare” artinya melunakkan. Maserat
adalah hasil penarikan simplisia dengan cara maserasi, sedangkan maserasi adalah
cara penarikan simplisia dengan merendam simplisia tersebut dalam cairan
penyari dengan beberapa kali pengocokan atau pengadukan pada temperature
kamar, sedangkan remaserasi merupakan pengulangan penambahan pelarut
setelah dilakukan penyaringan maserat pertama, dan seterusnya (Depkes, 2000).
Keuntungan dari metode maserasi yaitu prosedur dan peralatannya sederhana
(Agoes, 2007).
2. Perkolasi
Perkolasi berasal dari kata “colare”, artinya menyerkai dan “per” =
through, artinya menembus. Dengan demikian, perkolasi adalah suatu cara
penarikan memakai alat yang disebut perkolator dimana simplisia terendam
secara beraturan (Syamsuni, 2006). Prosesnya terdiri dari tahapan pengembangan
bahan, tahap perendaman antara, tahap perkolasi sebenarnya
(penetesan/penampungan perkolat) sampai diperoleh ekstrak (Depkes, 2000).
Keuntungan dari metode perkolasi ini adalah proses penarikan zat
berkhasiat dari tumbuhan lebih sempurna, sedangkan kerugiannya adalah
membutuhkan waktu yang lama dan peralatan yang digunakan mahal (Agoes,
2007).
3. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya,
selama waktu tertentu dan pelarut akan terdestilasi menuju pendingin dan akan
kembali ke labu (Depkes, 2000).
4. Sokletasi
Sokletasi adalah ekstraksi kontinu menggunakan alat soklet, dimana
pelarut akan terdestilasi dari labu menuju pendingin, kemudian jatuh membasahi
dan merendam sampel yang mengisi bagian tengah alat soklet setelah pelarut
mencapai tinggi tertentu maka akan turun ke labu destilasi, demikian
berulang-ulang (Depkes, 2000).
5. Infus
Infus adalah sediaan cair yang dibuat dengan menyari simplisia nabati
dengan air pada suhu 90°C selama 15 menit (Depkes, 2000).
2.3 Sterilisasi
Steril merupakan keadaan suatu zat yang bebas dari mikroba hidup, baik
sterilisasi adalah suatu proses untuk membuat ruang atau benda menjadi steril
(Syamsuni,2006).
Peralatan yang dipergunakan dalam uji antibakteri harus dalam keadaan
steril, artinya pada peralatan tersebut tidak didapatkan bakteri, baik yang akan
merusak media dan proses yang sedang berlangssung.
Steril didapatkan melalui sterilisasi, cara sterilisasi yang umum dilakukan
antara lain :
1. Sterilisasi secara fisik, misalnya dengan pemanasan menggunakan sinar
gelombang pendek seperti sinar X, sinar gama dan sinar ultra violet.
2. Sterilisasi secara kimiawi, dengan menggunakan desinfektan dan larutan
alkohol (Suriawira, 2005).
Selain itu, ada beberapa macam sterilisasi yang dapat digunakan
(Syamsuni, 2006) yaitu :
1. Sterilisasi dengan pemanasan secara kering
Pemanasan secara kering menggunakan alat yang dinamakan dengan oven,
yaitu lemari pengering dengan dinding ganda, dilengkapi dengan termometer dan
lubang tempat keluar masuknya udara, dan dipanaskan dengan gas atau listrik
(Depkes, 1979).Selain dengan oven, sterilisasi dengan pemanasan secara kering
biasanya dilakukan dengan pemijaran. Pemijaran dilakukan dengan memakai api
gas dengan nyala api tidak berwarna atau api dari lampu spiritus. Cara ini sangat
sederhana, cepat dan menjamin sterilisasi bahan atau alat yang disterilkan, tetapi
penggunaannya terbatas hanya untuk beberapa alat atau bahan saja.Biasanya
alat-alat yang disterilkan dengan pemijaran ini antara lain benda-benda logam (pinset,
lainnya.Sedangkan mortar dan stamfer disiram dengan alkohol kemudian dibakar
(Syamsuni, 2006).
2. Sterilisasi dengan pemanasan secara basah
Sterilisasi dengan pemanasan secara basah menggunakan temperatur di
atas 100°C dilakukan dengan uap yaitu menggunakan autoklaf.Prinsip autoklaf
adalah terjadinya koagulasi protein yang cepat dalam keadaan basah dibandingkan
keadaan kering (Pratiwi, 2008).Siklus sterilisasi dengan pemanasan secara basah
meliputi fase pemanasan, pemaparan uap, pembuangan dan pengeringan (Lukas,
2006).
Sterilisasi ini biasanya digunakan untuk mensterilkan baju operasi dengan
suhu 134°C selama 3 menit, sediaan injeksi dan suspensi dengan suhu 121°C
selama 15 menit (Lukas, 2006).
2.4 Uji Efek Antibakteri
Pengujian aktivitas antibakteri dapat dilakukan dengan cara 3 cara yaitu
2.4.1 Cara difusi
Sebagai pencadang dapat digunakan cakram kertas, silinder gelas,
porselen, logam dan pencetak lubang (punch hole).
1. Cara tuang
Media agar yang telah diinokulasikan dengan suspensi bakteri uji
dituangkan ke dalam cawan petri, dan dibiarkan memadat.Ke dalam cakram yang
digunakan di teteskan zat antibakteri, kemudian diinkubasikan pada suhu 37°C
silinder menunjukkan hambatan pertumbuhan bakteri, diamati dan diukur
(Stainer, et al., 1982)
2. Cara sebar
Media agar dituangkan ke dalam cawan petri kemudian dibiarkan
memadat, lalu suspensi bakteri uji disebarkan. Media dilubangi dengan alat
pencetak lubang (punch hole), ke dalamnya diteteskan zat antibakteri, didiamkan,
diinkubasikan pada suhu 37°C selama 18-24 jam. Zona hambat diukur yaitu
daerah bening disekitar lubang dengan menggunakan jangka sorong (Lay, 1994).
2.4.2 Cara turbidimetri
Pada cara ini digunakan media cair, yaitu dilakukan penuangan media ke
dalam tabung reaksi, ditambahkan suspensi bakteri, kemudian dilakukan
pemipetan larutan uji, dan inkubasi. Selanjutnya dilakukan pengukuran
kekeruhan, kekeruhan yang disebabkan oleh pertumbuhan bakteri diukur dengan
menggunakan instrument yang cocok, misalnya nephelometer setelah itu
dilakukan penghitungan potensi antimikroba (Depkes,1995).
2.4.3 Cara dilusi
Cara ini digunakan untuk menentukan KHM (kadar hambat minimum) dan
KBM (kadar bunuh minimum) dari obat antimikroba. Prinsip dari metode dilusi
adalah sebagai berikut :
Menggunakan satu seri tabung reaksi yang diisi media cair dan sejumlah
tertentu sel mikroba yang diuji.Kemudian masing-masing tabung diuji dengan
obat yang telah diencerkan secara serial.Seri tabung diinkubasi pada suhu 37oC
selama 18-24 jam dan diamati terjadinya kekeruhan pada tabung.Konsentrasi
tampak jernih (tidak ada pertumbuhan mikroba) adalah KHM dari
obat.Konsentrasi terendah obat pada biakan padat yang ditunjukkan dengan tidak
adanya pertumbuhan koloni mikroba adalah KBM dari obat terhadap bakteri uji
(Pratiwi, 2008).
2.5 Uraian Bakteri
Bakteri adalah mikroorganisme yang bersel satu, berkembang biak dengan
cara membelah diri, serta demikian kecilnya sehingga hanya dapat dilihat dengan
menggunakan mikroskop (Dwijoseputro, 1978).
2.5.1 Klasifikasi Bakteri
Berdasarkan bentuk morfologinya, maka bakteri dapat di bagi atas tiga
bagian (Pratiwi, 2008) yaitu :
1. Bentuk Basil
Basil dari kata bacillus, merupakan bakteri yang bentuknya menyerupai
batang atau silinder, membelah dalam satu bidang, basil dapat berupa batang
tunggal, berpasangan atau bentuk rantai pendek atau panjang. Bentuk basil ini
dapat dibedakan atas :
a) Bentuk tunggal, yaitu basil yang terlepas satu sama lain dengan
ujung-ujungnya yang tumpul.
b) Diplobasil, yaitu basil yang bergandengan dua-dua dengan ujung-ujungnya
yang tumpul.
c) Streptobasil, yaitu basil yang bergandeng-gandengan panjang dengan
ujung-ujungnya yang tumpul.
Kokus adalah bakteri yang berbentuk bulat atau oval, ada yang hidup
sendiri dan ada yang dijumpai hidup berpasangan, kubus atau membentuk rantai
panjang, bergantung pada caranya membelah diri kemudian melekat satu sama
lain setelah pembelahan. Bentuk kokus ini dapat dibedakan atas :
a) Diplokokus, yaitu kokus yang bergandengan dua-dua.
b) Tetrakokus, yaitu kokus yang mengelompok berempat.
c) Stapfilokokus, yaitu kokus yang mengelompok merupakan suatu untaian.
d) Streptokokus, yaitu kokus yang bergandeng-gandengan panjang seperti rantai.
e) Sarsina, kokus yang mengelompok serupa kubus.
3. Bentuk Spiral
Kelompok bakteri ini terdiri atas beraneka ragam bentuk bakteri berbentuk
silinder, yang bukan lurus seperti basil melainkan melingkar. Bakteri bentuk spiral
ini dibedakan menjadi beberapa jenis antara lain :
a) Vibrio, yaitu bakteri yang benbentuk batang melengkung menyerupai koma,
ada yang tumbuh sebagai benang-benang membelit atau berbentuk s.
b) Spiril, yaitu dari kata spirilium yang menyerupai spiral atau lilitan yang
sebenarnya.
c) Spirochaeta, yaitu merupakan bakteri spiral, tetapi bakteri ini memiliki spiril
yang bersifat fleksibel (mampu melenturkan dan melekukkan tubuhnya sambil
bergerak).
Berdasarkan tempat kedudukan flagel, maka bakteri dapat diklasifikasikan
sebagai berikut (Waluyo, 2004) :
a) Monotrik, jika flagel hanya satu dan melekat pada ujung sel.
c) Amfitrik, jika flagel melekat pada kedua ujung sel masing-masing satu flagel.
d) Peritrik, jika flagel tersebar dari ujung sampai ke sisi-sisi sel.
e) Atrik, jika spesies tidak mempunyai flagel sama sekali.
Berdasarkan pengecatan gram, maka bakteri dapat dibedakan menjadi dua
bagian (Lay, 1994) yaitu :
1. Bakteri gram positif, yaitu bakteri yang dapat mengikat zat warna pertama
(kristal violet) akan memberikan warna ungu dan setelah dicuci dengan
alkohol, warna ungu tersebut akan tetap kelihatan. Kemudian ditambahkan zat
warna kedua (safranin), warna ungu pada bakteri tidak berubah.
2. Bakteri gram negatif, yaitu bakteri yang kehilangan warna dari kristal violet
ketika dicuci dengan alkohol dan setelah diberi zat warna kedua (safranin),
bakteri akan memberikan warna merah muda
2.5.2 Struktur bakteri
Struktur bakteri terbagi menjadi dua (Lay, 1994) yaitu :
1. Struktur dasar (dimiliki oleh hampir semua jenis bakteri)
a) Dinding sel tersusun dari peptidoglikan yaitu gabungan protein dan
polisakarida (ketebalan peptidoglikan membagi bakteri menjadi bakteri gram
positif bila peptidoglikannya tebal dan bakteri gram negative bila
peptidoglikannya tipis).
b) Membrane plasma adalah membrane yang menyelubungi sitoplasma tersusun
atas lapisaan fosfolipid dan protein. Membran plasma merupakan barier yang
fungsinya mengatur keluar masuknya bahan-bahan dari dalam sel atau dari
luar sel, dan hanya bahan-bahan tertentu saja yang dapat melewatinya
c) Sitoplasma adalah cairan sel
d) Ribosom adalah organel yang tersebar dalam sitoplasma, tersusun atas protein
dan RNA.
e) Granula penyimpanan, karena bakteri menyimpan cadangan makanan yang
dibutuhkan.
2. Struktur tambahan (dimiliki oleh jenis bakteri tertentu)
a. Kapsul atau lapisan lendir adalah lapisan di luar dinding sel pada jenis bakteri
tertentu, bila lapisannya tebal disebut kapsul dan bila lapisannya tipis disebut
lapisan lendir. Kapsul dan lapisan lendir tersusun atas polisakarida dan air.
b. Flagellum atau bulu cambuk adalah struktur berbentuk batang atau spiral
yang menonjol dari dinding sel. Flagela tersusun dari protein yang disebut
flagelin.
c. Pilus dan fimbria adalah struktur berbentuk seperti rambut halus yang
menonjol dari dinding sel, pilus mirip dengan flagellum tetapi lebih pendek,
kaku dan berdiameter lebih kecil dan tersusun dari protein dan hanya terdapat
pada bakteri gram negative. Fimbria adalah struktur sejenis pilus tetapi lebih
pendek daripada pilus. Pilus yang berfungsi sebagai alat untuk menempelkan
dirinya pada sel hospes disebut colonizing factor.
d. Klorosom adalah struktur yang berada tepat dibawah membrane plasma dan
mengandung pigmen klorofil dan pigmen lainnya untuk proses fotosintesis.
Klorosom hanya terdapat pada bakteri yang melakukan fotosintesis.
e. Vakuola gas terdapat pada bakteri yang hidup di air dan berfotosintesis
f. Endospora adalah bentuk istirahat (laten) dari beberapa jenis bakteri gram
bagi kehidupan bakteri. Endospora mengandung sedikit sitoplasma, materi
genetic dan ribosom. Dinding endospora yang tebal tersusun atas protein dan
menyebabkan endospora tahan terhadap kekeringan, radiasi cahaya, suhu
tumbuh menjadi sel bakteri baru.
2.5.3 Reproduksi bakteri
Bakteri pada umumnya berkembang biak dengan membelah diri (binary
fission). Pada waktu akan membelah sel bakteri membesar 2 kali semula
kemudian membelah menjadi 2. Masing-masing sel bakteri yang baru menerima
sitoplasma dan bahan genetic dalam jumlah yang sama. Dalam lingkungan yang
ideal bakteri membelah engan sangat cepat. Jika bakteri bereproduksi setiap 20
menit, maka akan terbentuk suatu koloni bakteri yang terdiri atas lebih dari 2 juta
bakteri selama 7 jam, jika makanannya masih cukup. Ada beberapa bakteri yang
berkembang biak secara konjugasi. Konjugasi terjadi antara bakteri yang sama
jenisnya, jika satu bakteri mempunyai plasmid yang lainnya tidak. Bakteri jantan
dan betina yang sama jenisnya saling melekatkan diri dengan membuat jembatan
sitoplasma (pilus penghubung) dan selanjutnya terjadi pertukaran material
genetic. Konjugasi sebetulnya jarang terjadi dan hanya pada beberapa spesies
bakteri (Pratiwi, 2008).
2.5.4 Fase pertumbuhan bakteri
Ada 4 fase pertumbuhan bakteri, di antaranya :
1. Fase Lambat (lag phase), yaitu fase yang terjadi antara beberapa jam
tergantung pada umur dari sel inokulum, spesies, dan lingkungannya. Waktu
pada fase lag ini dibutuhkan untuk penyesuaian diri terhadap kondisi
2. Fase Cepat (Log phase), yaitu setelah beradaptasi terhadap kondisi baru, sel –
sel ini akan tumbuh dan membelah diri secara eksponensial sampai jumlah
maksimum yang dapat dicapai sesuai kondisi lingkungan.
3. Fase Tetap (Stationary phase), populasi bakteri jarang dapat tetap tumbuh
secara eksponensial dengan kecepatan tinggi untuk jangka waktu yang lama.
Setelah 48 jam, pertumbuhan eksponensial bakteri dengan waktu pembelahan
20 menit akan menghasilkan sebesar 2,2 x 1031 bakteri. Pertumbuhan populasi
mikroorganisme biasanya dibatasi oleh habisnya nutrisi yang tersedia,
akibatnya kecepatan pertumbuhan menurun dan pertumbuhan akhirnya
terhenti, fase ini dikatakan sebagai fase tetap (stationary phase). Komposisi
sel-sel pada fase ini berbeda dibandingkan dengan saat fase eksponensial dan
umumnya lebih tahan terhadap perubahan panas, dingin maupun radiasi.
4. Fase Kematian (death phase), yaitu sel-sel pada fase tetap, akhirnya akan mati
bila tidak di pindahkan ke media segar yang lain. Sebagaimana pertumbuhan,
kematian sel juga secara eksponensial dan karenannya dalam bentuk
logaritmis, fase menurun atau kematian ini merupakan penurunan secara garis
lurus yang digambarkan oleh jumlah sel-sel yang hidup terhadap waktu.
Kecepatan kematian berbeda-beda tergantung dari lingkungan dan spesies
mikroorganisme (Waluyo, 2004).
2.5.5 Faktor – faktor yang mempengaruhi pertumbuhan bakteri
1. Nutrisi
Semua mahluk hidup memerlukan bahan makanan untuk keperluan
hidupnya.Bahan makanan ini diperlukan untuk sintesis bahan sel dan untuk
membutuhkan energi dari lingkungannya.Bahan tersebut dinamakan nutrisi (zat
gizi) (Waluyo, 2004).
Semua mikroorganisme memerlukan nutrisi sebagai sumber energi dan
pertumbuhan selnya.Unsur – unsur dasar tersebut adalah karbon, nitrogen, sulfur,
zat besi dan sejumlah kecil logam-logam lainnya.Kekurangan sumber nutrisi ini
dapat mempengaruhi pertumbuhan mikroba hingga pada akhirnya dapat
menyebabkan kematian (Gaman, 1992).
Pembiakan bakteri dalam laboratorium memerlukan media yang berisi zat
hara serta lingkungan pertumbuhan yang sesuai bagi bakteri.Zat hara diperlukan
untuk pertumbuhan, sintesis sel, keperluan energi dalam metabolisme dan
pergerakan.Lazimnya, media biakan mengandung air, sumber energi, zat hara
sebagai sumber karbon, nitrogen, sulfur, fosfat, oksigen dan hidrogen.Dalam
bahan dasar media dapat pula ditambahkan faktor pertumbuhan berupa asam
amino dan vitamin. Media biakan dapat dikelompokkan dalam beberapa kategori,
yaitu:
1) Berdasarkan asalnya, media dibagi atas:
a) Media sintetik yaitu media yang kandungan dan isi bahan yang ditambahkan
diketahui secara terperinci. Contoh: glukosa, kalium fosfat, magnesium
fosfat.
b) Media non-sintetik yaitu media yang kandungan dan isinya tidak diketahui
secara terperinci dan menggunakan bahan yang terdapat di alam. Contohnya:
ekstrak daging dan pepton (Lay, 1994).
a) Media selektif
Media selektif adalah media biakan yang mengandung paling sedikit satu
bahan yang dapat menghambat perkembang biakan mikroorganisme yang
tidak diinginkan dan membolehkan perkembang biakan mikroorganisme
tertentu yang ingin diisolasi.
b) Media diferensial
Media ini digunakan untuk menyeleksi suatu mikroorganisme dari berbagai
jenis dalam suatu lempengan agar.
c) Media diperkaya
Media ini digunakan untuk menumbuhkan mikroorganisme yang diperoleh
dari lingkungan alami karena jumlah mikroorganisme yang ada terdapat
dalam jumlah sedikit (Irianto, 2006).
3) Berdasarkan konsistensinya, dibagi atas (Irianto, 2006):
a) Media padat/ solid
b) Media semi solid
c) Media cair
2. Temperatur
Bakteri sangat peka terhadap suhu atau temperatur dan daya tahannya
tidak sama untuk semua spesies. Bakteri dapat diklasifikasikan menjadi tiga
a) Bakteri Psikrofil, yakni mikroorganisme yang dapat hidup baik pada suhu
0-20°C, dengan suhu optimumnya adalah 10-20°C. kebanyakan golongan ini
tumbuh di tempat dingin.
b) Bakteri Mesofil, mikroorganismeyang dapat hidup dengan baik pada suhu
5-60°C, dan memiliki suhu pertumbuhan optimal antara 20-45°C. Umumnya
mikroba ini hidup dalam saluran pencernaan.
c) Bakteri Termofil, mikroorganisme dapat hidup baik pada suhu 45-80°C. Suhu
optimumnya antara 50-60°C, mikroba ini terutama terdapat di tempat yang
bertemperatur tinggi (Gaman, 1992).
3. Oksigen
Bakteri dapat dibedakan menjadi 4 kelompok berdasarkan kebutuhan
oksigen selama pertumbuhan, antara lain :
a) Aerob yaitu bakteri yang membutuhkan oksigen di dalam pertumbuhannya.
b) Anaerob yaitu bakteri yang tidak membutuhkan oksigen di dalam
pertumbuhannya, bahkan oksigen ini dapat menjadi racun bagi bakteri
tersebut.
c) Anaerob fakultatif yaitu bakteri yang dapat hidup tumbuh dengan atau tanpa
adanya oksigen.
d) Mikroaerofilik yaitu bakteri yang memerlukan hanya sedikit oksigen dalam
pertumbuhannya (Pratiwi, 2008).
4. pH
Pertumbuhan bakteri juga memerlukan pH tertentu, namun umumnya
2004). Untuk tiap mikroorganisme dikenal nilai pH minimum, optimum, dan
maksimum.
Atas dasar daerah, pH bagi kehidupan mikroba, dibedakan adanya 3
golongan besar (Suriawira, 2005) yaitu :
a) Mikroba yang asidofilik, yaitu yang dapat tumbuh pada pH antara 2,0-5,0
b) Mikroba yang netrofilik, yaitu yang dapat tumbuh pada pH antara 5,5-8,0
c) Mikroba yang alkalifilik, yaitu yang dapat tumbuh pada pH antara 8,7-9,5
5. Tekanan Osmosis
Osmosis merupakan perpindahan air melewati membrane semipermiabel
karena ketidakseimbangan material terlarut dalam media. Pada larutan hipotonik
air akan masuk ke dalam sel mikroorganisme sedangkan dalam larutan hipertonik
air akan keluar dari dalam sel mikroorganisme sehingga membran plasma
mengkerut dan lepas dari dinding sel (plasmolisis), serta menyebabkan sel secara
metabolik tidak aktif. Mikroorganisme halofil mampu tumbuh pada lingkungan
hipertonik dengan kadar garam yang tinggi, contohnya Halobacterium halobium
(Dwidjoseputro, 1988).
2.5.6 Uraian Staphylococcus aureus
Sistematika Staphylococcus aureus (Dwidjoseputro, 1988) yaitu :
Divisi : Protophyta
Klas : Schizomycetes
Bangsa : Eubacteriales
Suku : Micrococcaceae
Marga : Staphylococcus
Staphylococcus aureus adalah jenis kuman yang terutama menimbulkan
penyakit pada manusia.Setiap jaringan maupun alat tubuh dapat diinfeksi olehnya
dan menimbulkan timbulnya penyakit dengan tanda-tanda yang khas.Bentuk
klinisnya tergantung dari bagian tubuh yang terkena infeksi.Staphylococcus
aureus merupakan kokus gram positif, aerobik atau anaerobik fakultatif.Nama ini
berasal dari bahasa Yunani staphyle yang berarti setandan anggur.Staphylococcus
aureus ditemukan sebagai flora normal pada kulit, selaput lendir, bisul, luka,
saluran pencernaan.
Sel bakteri Staphylococcus aureus berbentuk bola dengan diameter
rata-rata 0,7-1,2 µm tersusun dalam kelompok-kelompok. Pada biakan cair ditemukan
dalam bentuk berpasangan, rantai pendek dan kokus yang tunggal.Kokus muda
bersifat gram positif.Bakteri Staphylococcus aureus tidak bergerak dan tidak
membentuk spora.Bakteri ini tumbuh baik pada suhu 37°C. Pertumbuhan terbaik
dan khas adalah pada suasana aerob, bersifat anaerob fakultatif dan pH optimum
untuk pertumbuhan adalah 7,4. Koloni bakteri ini berbentuk bulat, cembung, dan
mengkilap.Warna khas adalah kuning keemasan (Pelczar, 1988).
2.5.7 Uraian Pseudomonas aeruginosa
Sistematika Pseudomonas aeruginosa (Dwidjoseputro, 1988) yaitu :
Divisi :Bacteria
Sub Divisi : Proteobacteria
Kelas : Gamma Proteobacteria
Suku :Pseudomonadaceae
Marga :Pseudomonas
Spesies :Pseudomonas aeruginosa
Pseudomonas aeruginosa dapat menginfeksi seseorang yang mengalami
gangguan pada sistem pertahanan tubuhnya, misalnya pada orang yang menderita
luka bakar, pada orang yang mengalami gangguan metabolisme dan pada
penderita yang mendapat pengobatan radiasi.Bakteri ini dapat menginfeksi hampir
seluruh jaringan tubuh yang masuk melalui lesi lokal yang ada di permukaan
tubuh. Selanjutnya akan memasuki pembuluh darah dan menyebar pada jaringan
tubuh yang lain. Bakteri ini adalah bakteri gram negatif aerob obligat, berkapsul,
mempunyai flagella polar sehingga bakteri ini bersifat motil, berukuran sekitar
0,5-1,0 µm, tidak menghasilkan spora dan tidak dapat menfermentasikan
karbohidrat. Pada uji biokimia, bakteri ini menghasilkan hasil negatif pada uji
indol, merah metil, dan voges-proskauer.Bakteri ini secara luas dapat ditemukan
di alam, contohnya di tanah, air, tanaman, dan hewan.Pseudomonas aeruginosa
adalah pathogen oportunistik.Bakteri ini merupakan penyebab utama infeksi
pneumonia nosokomial.Meskipun begitu, bakteri ini dapat berkolonisasi pada
manusia normal tanpa menyebabkan penyakit. Ketika bakteri ini ditumbuhkan
pada media yang sesuai, bakteri ini akan menghasilkan pigmen nonfluoresen
berwarna kebiruan, piosianin. Beberapa strain Pseudomonas juga mampu
menghasilkan pigmen fluoresen berwarna hijau, yaitu pioverdin. Pseudomonas
aeruginosa memproduksi katalase, oksidase, dan amonia dari arginin (Pelczar,
2.5.8 Uraian Propionibacterium acnes
Sistematika Propionibacterium acnes ((Dwidjoseputro, 1988) yaitu :
Divisi : Bacteria
Sub Divisi : Actinobacteria
Kelas : Actinobacteridae
Bangsa : Actinomycetales
Suku : Propionibacteriaceae
Marga : Propionibacterium
Jenis : Propionibacterium acnes
Propionibacterium acnes adalah berbentuk batang tak teratur yang terlihat
pada pewarnaan gram positif.Bakteri ini dapat tumbuh di udara dan tidak
menghasilkan endospora.Bakteri ini dapat berbentuk filament bercabang atau
campuran antara bentuk batang/filamen dengan bentuk kokoid.Propionibacterium
acnes memerlukan oksigen mulai dari aerob atau anaerob fakultatif sampai ke
mikroerofilik atau anaerob.Beberapa bersifat patogen untuk hewan dan tanaman.
Propionibacterium acnes termasuk dalam kelompok bakteri
orynebacteria.Bakteri ini termasuk flora normal kulit, berperan pada pathogenesis
jerawat dengan menghasilkan lipase yang memecah asam lemak bebas dari lipid
kulit.Asam lemak ini dapat mengakibatkan inflamasi jaringan ketika berhubungan
dengan sistem imun dan mendukung terjadinya akne.Propionibacterium acnes
termasuk bakteri yang tumbuh relatif lambat. Bakteri ini tipikal bakteri anaerob
gram positif yang toleran terhadap udara (Pelczar,1988).
METODOLOGI PENELITIAN
Metode penelitian ini meliputi pengumpulan sampel dan pengolahan
sampel, pembuatan ekstrak etanol dengan cara maserasi dan karakterisasi ekstrak,
serta uji aktivitas antibakteri secara in vitro dengan metode difusi agar
menggunakan silinder logam. Parameter yang dilihat adalah besarnya diameter
hambat pertumbuhan bakteri yang diukur dengan menggunakan jangka
sorong.Penelitian ini dilakukan di Laboratorium Fitokimia dan Laboratorium
Mikrobiologi Fakultas Farmasi Universitas Sumatera Utara.
3.1.Alat dan Bahan 3.1.1. Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas,
blender (Miyako), seperangkat alat penetapan kadar air, autoklaf (Webeco),
inkubator (Fischer Scientific), lemari pendingin (Toshiba), oven (Gallenkamp),
neraca kasar (Ohasus), neraca listrik (Vibra AJ), jarum ose, silinder logam,
jangka sorong, pipet mikro (Eppendorf), rotary evaporator (Buchi 461), hotplate,
water bath (Yenaco ), freeze dryer (Modulio), kamera digital (Casio), Laminar
Air Flow Cabinet (Astec HLF 1200L), dan spektrofotometer visibel (Dynamic).
3.1.2. Bahan-bahan
Bahan-bahan yang digunakan pada penelitian ini adalah daun kembang
bulan, etanol 96% (hasil destilasi), bahan yang berkualitas proanalisa (E.Merck)
yaitu kloroform, asam klorida, dan toluena, nutrient agar (Difco), larutan NaCl
ATCC 27853 dan Propionibacteriumacnes ATCC 11827 (Laboratorium
Mikrobiologi Fakultas Farmasi USU).
3.2.Penyiapan Sampel Daun Kembang Bulan (Tithonia diversifolia (Hemsley) A. Gray)
Penyiapan sampeldaun kembang bulan (Tithonia diversifolia (Hemsley) A.
Gray) meliputi pengambilan sampel, identifikasi sampel, dan pengolahan sampel.
3.2.1. Pengambilan sampel
Sampel yang digunakan adalah daunKembang Bulan (Tithonia diversifolia
(Hemsley) A. Gray) yang masih segar berwarna hijau tua (tidak terlalu tua dan
tidak terlalu muda), yang diambil dari daerah Kecamatan Lintongnihuta,
KabupatenHumbang Hasundutan. Pengumpulan sampel dilakukan secara purposif
tanpa membandingkan dengan tumbuhan yang sama dari daerah lain.
3.2.2. Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan di Herbarium Medanense, Universitas
Sumatera Utara.
3.2.3. Pembuatan simplisia
Daun kembang bulan yang telah dikumpulkan dicuci bersih kemudian
dikeringkan di udara terbuka dan terlindung dari cahaya matahari.Daun yang telah
kering (rapuh) dihaluskan menjadi serbuk.
Sebanyak 500 g serbuk simplisia dimasukkan ke dalam wadah gelas
dibiarkan selama 5 hari dan terlindung dari cahaya matahari sambil sesekali
diaduk, kemudian diserkai, diperas ampasnya dengan cairan penyari secukupnya
hingga diperoleh 100 bagian. Ampas dimaserasi kembali dengan etanol 80%
selama 2 hari dengan menggunakan prosedur yang sama. Seluruh maserat
digabung dan diuapkan dengan menggunakan rotary evaporator pada temperatur
± 50°C sampai diperoleh ekstrak kental, kemudian dikeringkan dengan freeze
dryer pada suhu - 40°C selama ± 24 jam (Depkes, 1979).
3.4.Karakterisasi Ekstrak
Karakterisasi ekstrak etanol daun kembang bulan dilihatmenurut Materia
Medika Indonesia edisi VI.
3.4.1. Penetapan Kadar Air
Penetapan kadar sari dilakukan dengan metode azeotropi (destilasi
toluena). Cara penetapan : ke dalam labu alas bulat dimasukkan 200 ml toluena
dan 2 ml aquades, didestilasi selama 2 jam. Setelah toluena didinginkan dan
volume air pada tabung penerima dibaca.Kemudian ke dalam labu dimasukkan 5
g ekstrak yang telah ditimbang seksama, dipanaskan hati-hati selama 15 menit.
Setelah toluena mendidih,kecepatan tetesan diatur,kurang lebih 2 tetes tiap detik,
hingga sebagian air tersuling, kemudian naikkan kecepatan penyulingan hingga 4
tetes tiap detik. Setelah semua tersuling, bagian dalam pendingin dibilas dengan
toluena yang telah jenuh.Penyulingan dilanjutkan selama 5 menit, kemudian
memisah sempurna, volume dibaca.Selisih kedua volume air dibaca sesuai dengan
kandungan air yang terdapat dalam bahan yang diperiksa.
3.4.2. Penetapan Kadar Abu Total
Lebih kurang 2 g sampai 3 g ekstrak yang telah ditimbang seksama,
dimasukkan kedalam krus porselin yang telah dipijar dan ditara, kemudian
diratakan. Krus porselen bersama isinya dipijarkan perlahan - lahan hingga arang
habis, dinginkan, ditimbang sampai diperoleh bobot yang tetap.Kadar abu
dihitung terhadap bahan yang telah dikeringkan di udara.
3.4.3. Penetapan Kadar Abu Yang Tidak Larut Dalam Asam
Abu yang diperoleh pada penetapan kadar abu total dididihkan dengan 25
ml asam klorida encer selama 5 menit, kumpulkan bagian yang tidak larut dalam
asam, saring dengan kertas saring,lalu cuci dengan air panas. Kemudian residu
dan kertas saring dipijarkan sampai diperoleh bobot tetap, didinginkan dan
ditimbang beratnya.Kadar abu yang tidak larut dalam asam dihitung terhadap
bahan yang telah dikeringkan di udara.
3.4.4. Penetapan Kadar Sari Larut Dalam Air
Sebanyak 5 g ekstrak dimaserasi selama 24 jam dalam 100 ml
air-kloroform (2,5 ml air-kloroform dalam aquadest sampai 1 liter) dengan menggunakan
botol bersumbat warna coklat sambil sekali-kali dikocok selama 6 jam pertama,
kemudian dibiarkan selama 18-24 jam dan disaring, sejumlah 20 ml filtrat
pertama diuapkan hingga kering dalam cawan yang telah dipanaskan dan ditara.
tetap.Kadar sari yang larut dalam air di hitung terhadap bahan yang telah
dikeringkan di udara.
2.4.5. Penetapan Kadar Sari Larut Dalam Etanol
Sebanyak 5 g ekstrak dimaserasi selama 24 jam dalam 100 ml etanol 96 %
dengan menggunakan botol bersumbat berwarna coklat sambil sekali-kali dikocok
selama 6 jam pertama, kemudian dibiarkan selama 18-24 jam dan disaring.
Sejumlah 20 ml filtrat pertama diuapkan hingga kering dalam cawan yang telah
dipanaskan dan ditara.Residu dipanaskan dalam oven pada suhu 105°C sampai
diperoleh bobot tetap.Kadar sari larut dalam etanol dihitung terhadap bahan yang
telah dikeringkan di udara.
3.5. Sterilisasi Alat
Alat - alat yang digunakan dalam uji aktivitas antibakteri ini, disterilkan
terlebih dahulu sebelum dipakai. Alat - alat gelas disterilkan di dalam oven pada
suhu 170°C selama 2 jam. Media disterilkan di autoklaf pada suhu 121°C selama
15 menit. Jarum ose dan pinset dengan lampu Bunsen (Lay, 1994).
3.6. Pembuatan Media
3.6.1. Pembuatan Media Nutrient Agar (NA) (Difco Laboratories,1977)
Komposisi : Bacto – Beef extract 3 g
Bacto peptone 5 g
Bacto – Agar 15 g
Sebanyak 23 g nutrient agar (NA) ditimbang, disuspensikan di dalam air
suling 1000 ml, lalu dipanaskan sampai larut sempurna.Lalu media dimasukkan
dalam labu dan disterilkan di dalam autoklaf pada suhu 121°C selama 15 menit.
3.6.2. Pembuatan Larutan NaCl 0,9 %
Komposisi : Natrium Klorida 0,9 g
Air suling ad 100 ml
Cara Pembuatan : Natrium klorida ditimbang sebanyak 0,9 g lalu dilarutkan
dalam air suling sedikit demi sedikit sampai 100 ml, disterilkan di autoklaf pada
suhu 121°C selama 15 menit.
3.7. Pembiakan Bakteri 3.7.1. Pembuatan stok kultur
3.7.1.1. Bakteri Staphylococcus aureus
Satu koloni bakteri Staphylococcus aureus diambil dengan menggunakan
jarum ose steril lalu ditanamkan pada media nutrient agar (NA) miring dengan
cara menggores, setelah itu diinkubasi dalam inkubator pada suhu 37 ± 1°C
selama 18-24 jam (Depkes, 1995).
3.7.1.2. Bakteri Pseudomonas aeruginosa dan Propionibacterium acne
Pembuatan stok kultur bakteri Pseudomonas aeruginosa dan
Propionibacterium acne sama dengan prosedur untuk bakteri Staphylococcus
3.7.2. Pembuatan Inokulum
3.7.2.1. Bakteri Staphylococcus aureus
Koloni bakteri Staphylococcus aureusdiambil dari stok kultur dengan
jarum ose steril lalu disuspensikan dalam tabung reaksi yang berisi 10 ml larutan
NaCl 0,9%. Kemudian diukur kekeruhan larutan pada panjang gelombang 580 nm
sampai diperoleh transmitan 25% (Depkes, 1995).
3.7.2.2. Bakteri Pseudomonas aeruginosa dan Propionibacterium acne
Pembuatan inokulum bakteri Pseudomonas aeruginosa dan
Propionibacterium acnesama dengan prosedur untuk bakteri Staphylococcus
aureus (Depkes, 1995).
3.8. Pembuatan Larutan Uji ekstrak etanol dengan berbagai konsentrasi.
Cara kerja :
Sebanyak 1,5 g ekstrak etanol daun kembang bulan, ditimbang lalu
dilarutkan dengan etanol, volumenya dicukupkan hingga 5 ml (konsentrasi ekstrak
adalah 300 mg/ml). Kemudian dibuat pengenceran sampai diperoleh ekstrak
dengan konsentrasi 250 mg/ml, 200 mg/ml, 150 mg/ml, 100 mg/ml, 75 mg/ml, 50
mg/ml, 25 mg/ml dan 10 mg/ml.
3.9. Pengujian Efek Antibakteri secara In vitro dengan Metode Difusi Agar
Metode ini menggunakan media padat dan silinder logam, penentuan daya
hambat pertumbuhan bakteri dilakukan dengan cara mengukur diameter daerah
Cara kerja :
Media agar steril dicairkan dan ditunggu hingga suhu mencapai ± 45°C.
Suspensi bakteri sebanyak 0,1 ml yang telah diukur kekeruhannya kemudian
dimasukkan ke dalam cawan petri steril. Kemudian dicampurkan dengan media
agar, homogenkan campuran dan dibiarkan memadat. Silinder logam diletakkan
tegak lurus pada media padat tersebut, lalu dimasukkan 0,1 ml ekstrak ke dalam
silinder logam dengan berbagai variasi konsentrasi. Inkubasi pada 37 ± 1°C
selama 18-24 jam.Hasil pengukuran konsentrasi hambat minimum/uji aktivitas
antibakteri dari ekstrak etanol dapat diukur dengan menggunakan jangka sorong
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil Identifikasi Tumbuhan
Identifikasi tumbuhan yang digunakan dalam penelitian ini dilakukan di Herbarium Medanense, Universitas Sumatera Utara. Hasilnya adalah daun
kembang bulan (Tithonia diversifolia (Hemsley) A. Gray) familia
Asteraceae.Hasil identifikasi tumbuhan dapat dilihat pada Lampiran1 halaman 39.
4.2 Hasil Maserasi
Hasil maserasi dari 500 g serbuk daun kembang bulan (Tithonia
diversifolia (Hemsley) A. Gray) dengan menggunakan pelarut etanol
80%,diperoleh 85,430 g ekstrak kental.
4.3 Hasil Karakterisasi Ekstrak Etanol Daun Kembang Bulan
Hasil pemeriksaan karakterisasi dari ekstrak etanol daun kembang bulan
(Tithonia diversifolia (Hemsley) A. Gray) dapat dilihat pada Tabel 4.1 dibawah
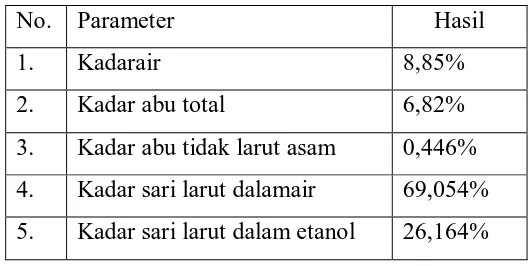
Tabel 4.1.Hasil pemeriksaan karakterisasi ekstrak etanol kembang bulan (Tithonia diversifolia (Hemsley) A. Gray)
No. Parameter Hasil
1. Kadarair 8,85%
2. Kadar abu total 6,82%
3. Kadar abu tidak larut asam 0,446%
4. Kadar sari larut dalamair 69,054%
5. Kadar sari larut dalam etanol 26,164%
Tujuan menentukan kadar air adalah karena air merupakan media yang
baik untuk ditumbuhi bakteri. Penetapan kadar abu total dilakukan untuk
mengetahui kadar senyawa - senyawa anorganikpada ekstrak tersebut misalnya
logam K, Ca, Na, Pb, Hg, silika. Sedangkan penetapan kadar abu tidak larut
dalam asam dilakukan untuk mengetahui bahan-bahan yang tidak larut dalam
asam misalnya silika, logam-logam berat seperti Pb, Hg. Kadar sari larut dalam
air dilakukan untuk mengetahui senyawa polar yang terlarut dalam air misalnya
flavonoid, tanin dan glikosida. Kadar sari larut dalam etanol untuk mengetahui
senyawa yang terlarut dalam etanol, misalnya triterpenoid/steroid, lemak dan
klorofil, bebas saponin, flavonoid dan tanin.Perhitungan hasil karakterisasi
ekstrak dapat dilihat pada lampiran halaman 43-47.
4.4 Hasil Uji Aktivitas Antibakteri Ekstrak Etanol Daun Kembang Bulan
Penentuan aktivitas antibakteri ekstrak etanol daun kembang bulan
dilakukan dengan metode difusi agar, karena lebih praktis namun tetap
memberikan hasil yang diharapkan. Prinsip metode ini adalah menggunakan
pertumbuhanbakteri ditentukan dengan cara mengukur diameter hambat
pertumbuhan. Daerah hambat pertumbuhan bakteri adalah daerah jernih di
sekeliling silinder logam.Pengukuran daerah hambat pertumbuhan dapat
dilakukan dengan menggunakan jangka sorong. Menurut Dwidjoseputro (1998),
semakin tinggi konsentrasi ekstrak akan menghasilkan diameter daerah hambat
yang semakin besar pula. (Menurut Depkes RI (1995), batas daerah hambat yang
memuaskan adalah dengan diameter lebih kurang 14 mm sampai 16 mm.
Hasil uji aktivitas antibakteri menunjukkan bahwa ekstrak etanol dapat
menghambat pertumbuhan bakteri Staphylococcus aureus, Propionibacterium
acnes dan Pseudomonas aeruginosayang dapat dilihat pada Tabel 4.2 berikut:
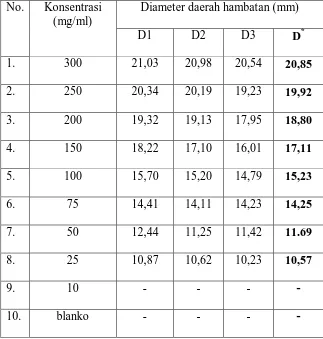
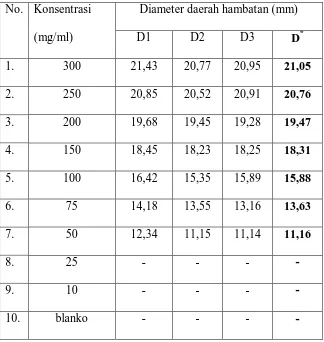
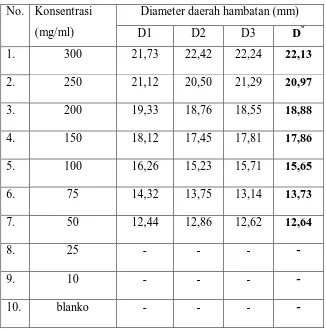
Tabel 4.2.Hasil pengukuran diameter daerah hambatan pertumbuhanbakteri
Staphylococcus aureus, Propionibacterium acnes dan Pseudomonas aeruginosaoleh ekstrak etanol daun kembang bulan
No .
Konsentrasi (mg/ml)
Diameter daerah hambatan (mm)*
Staphylococcus aureus Propionibacterium acnes Pseudomonas aeruginosa
1. 300 20,85 21,05 22,13
2. 250 19,92 20,76 20,97
3.. 200 18,80 19,47 18,88
4. 150 17,11 18,31 17,86
5. 100 15,23 15,88 15,65
6. 75 14,25 13,63 13,73
7. 50 11,69 11,63 12,64
8. 25 10,57 - -
9. 10 - - -
10 Blanko - - -
Pada Tabel 4.2 di atas menunjukkan bahwa ekstrak etanol daun kembang
bulan dapat menghambat pertumbuhanbakteri Staphylococcus aureus,
Propionibacterium acnes dan Pseudomonas aeruginosa, sedangkan pada blanko
tidak menunjukkan aktivitas antibakteri terhadap ketiga bakteri yang digunakan.
Aktivitas antibakteri dapat disebabkan adanya kandungan senyawa kimia yaitu
tanin dan flavonoida.Tanin dan flavonoidamerupakan golongan senyawa
fenol.Golongan fenol diketahui memilikiaktivitas antimikrobayang bersifat
bakterisidal namun tidak bersifat sporisidal (Pratiwi, 2008). Senyawa fenol
bekerja dengan cara mendenaturasi protein sel dan merusak dinding sel bakteri
sehingga bakteri mati, juga dapat merusaklipid pada membransel
melaluimekanisme penurunan tegangan permukaan membran sel (Pelczar dan
Chan, 1986).
Ekstrak etanol daun kembang bulan memberikan batas daerah hambat
yang memuaskan pada konsentrasi 75 mg/ml untuk bakteri Staphylococcus aureus
dengan diameter 14,25 mm sedangkan untuk bakteriPropionibacterium acnes dan
Pseudomonas aeruginosa pada konsentrasi 100 mg/ml dengan diameter 15,88 mm
BAB V
KESIMPULAN DAN SARAN
5.1.Kesimpulan
1. Hasil karakterisasi ekstrak etanol daun kembang bulan (Tithonia diversifolia
(Hemsley) A. Gray) diperoleh kadar air 8,85%, kadar abu total 6,82%, kadar
abu total tidak larut asam 0,446%, kadar sari larut dalam air 69,054%, kadar
sari larut dalam etanol 26,164%.
2. Ekstrak etanol daun kembang bulan mempunyai aktivitas sebagai antibakteri.
Aktivitas antibakteri ekstrak etanol daun kembang bulan yang memuaskan
pada bakteri Staphylococcus aureus adalahpada konsentrasi 75 mg/ml dengan
diameter hambat 14,25 mm, pada bakteri Propionibacterium acnes dan
Pseudomonas aeruginosa pada konsentrasi 100 mg/ml dengan diameter
hambat 15,88 mm dan 15,65 mm.
5.2. Saran
Disarankan pada penelitian selanjutnya untuk menguji aktivitas antibakteri
dari fraksi-fraksi daun kembang bulan (Tithonia diversifolia (Hemsley) A.Gray)
DAFTAR PUSTAKA
Agoes, G. (2007). Teknologi Bahan Alam. Bandung : Penerbit ITB Press
Anonim.Online (2003).Tithonia diversifolia(Hemsley) Gray, Asteraceae. http://www.hear.org/pier/species/ Tithonia diversifolia.htm
Anonim.Online (2004).Tithonia diversifolia (Hemsley) Gray), A Plant with
Potential for the sustainable Production in the tropic.http://www.fao.org/ag/ayap/frg/agfor1/rias14.htm
Departemen Kesehatan RI. (1979). Farmakope Indonesia. Edisi III. Jakarta: Depkes RI. Hal 33
Departemen Kesehatan RI. (2000). Parameter Standar Umum Ekstrak Tumbuhan
Obat. CetakanPertama. Jakarta : Depkes RI. Hal. 10-11
Departemen Kesehatan RI. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Depkes RI. Hal 896
Departemen Kesehatan RI. (1995). Materia Medika Indonesia. Jilid VI. Jakarta: Depkes RI. Hal.297, 321 – 323, 325
Didik,G. dan Sulistijowati, A. (2001). Efek Ekstrak daun Kembang Bulan
Terhadap candida albicans serta profil Kromatogramnya.Dalam: Cermin
Dunia Kedokteran No. 130. Jakarta: UI-Press. Hal. 31-32, 35
Difco. (1977). Difco Manual of Dehydrated Culture Media and Reagents for
Microbiology and Clinical Laboratory Procedures. 9th ed.
DetroitMichigan: Difco Laboratories. Page 33, 93-94
Dwidjoseputro, D. (1988). Dasar – Dasar Mikrobiologi. Jakarta: Penerbit Djambatan. Hal. 22 – 34, 36 – 47
Gamman, P. M. (1992).Pengantar Ilmu Pangan Nutrisi Dan Mikrobiologi, terjemahan Gardjito, M., dkk. Edisi Kedua. Yogyakarta: Gadjah Mada University Press. Hal. 236 – 254, 257 – 263
Hutapea, J. R., (1994). Inventaris Tanaman Obat Indonesia. Jakarta: Badan Penelitian dan Pengembangan Kesehatan. Hal. 297
Irianto, K., (2006). Mikrobiologi Menguak Dunia Mikroorganisme. Jilid I. Bandung: Penerbit Yrama Widya. Hal. 16-18, 21-22
Lay, W. B. (1994). Analisis Mikrobiologi di Laboratorium. Jakarta: Penerbit PT.