MODUL 1
MODUL 1
–
– Pengenalan Berbagai Bentuk Energi dan Penentuan Energi
Pengenalan Berbagai Bentuk Energi dan Penentuan Energi
Dalam
Dalam
1.1.
1.1. Tujuan PercobaanTujuan Percobaan
Tujuan percobaan pada modul 1 adalah sebagai berikut: Tujuan percobaan pada modul 1 adalah sebagai berikut:
--
Membedakan berbagai jenis energi.Membedakan berbagai jenis energi.--
Membuktikan perubahan kerja (W) menjadi panas dan sebaliknya.Membuktikan perubahan kerja (W) menjadi panas dan sebaliknya. -- Merumuskan neraca energi yang disusun dari hukum I Termodinamika.Merumuskan neraca energi yang disusun dari hukum I Termodinamika.--
Menghitung energi dalam pada sistem yang tertutup (proses yang tidakMenghitung energi dalam pada sistem yang tertutup (proses yang tidak mengalir).mengalir).
1.2.
1.2. MetodologMetodologi i PercobaanPercobaan a.
a. Alat dan BahanAlat dan Bahan
Alat dan bahan yang digunakan di modul 1 adalah sebagai berikut: Alat dan bahan yang digunakan di modul 1 adalah sebagai berikut: -- Air kranAir kran
-- Air aquadesAir aquades -- Minyak gorengMinyak goreng
-- Erlenmayer 250 ml dan 500 mlErlenmayer 250 ml dan 500 ml -- Termometer 100Termometer 100 ooCC
-- Ultrasonic VibratorUltrasonic Vibrator -- StatifStatif
-- Bak plastikBak plastik -- Kain lapKain lap
-- Neraca digital Neraca digital -- Gelas ukurGelas ukur
-- Alat pengubah arus (rectifier Alat pengubah arus (rectifier ) atau sumber listrik DC, 1 buah) atau sumber listrik DC, 1 buah -- Alat pengukur arus, 1 buahAlat pengukur arus, 1 buah
-- Alat pengukur tegangan, 1 buahAlat pengukur tegangan, 1 buah -- Kalorimeter tara kalor listrik, 1 unitKalorimeter tara kalor listrik, 1 unit -- StopwatchStopwatch, 1 buah., 1 buah.
b. Diagram Alir Percobaan
Gambar 1.1. Diagram alir percobaan pengenalan berbagai bentuk energi. Menuang air kran sebanyak 250 ml
ke dalam ultrasonic vibrator.
Menyalakan ultrasonic vibrator dan mengamati temperatur dengan interval 5 menit selama 30 menit.
Memasang termometer ke ultrasonic vibrator pada posisi
ujung termometer tercelup.
Mengulangi prosedur dengan mengganti variabel dengan minyak
goreng.
Mendinginkan erlenmeyer yang berisi air yang telah diamati dengan
merendamnya dalam air.
Mengamati temperatur dalam erlenmeyer dengan interval 1 menit
sampai temperatur kembali ke mula-mula.
Menggambar kurva perbandingan waktu dan temperatur pada vibrator
Mengulangi seluruh prosedur dengan tegangan yang berbeda.
Memasukan Air kran 50ml kedalam Kalorimeter.
Mmbaca dan mencatat suhu dalam kalorimeter.
Mengatur tegangan pada posisi terendah (4,5 volt).
Menyalakan Sumber listrik dan stopwatch secara bersama.
Membaca dan pembacaan alat pengukur arus dan tegangan.
Mengamati dan catat kenaikan suhu pada termometer, matikan
sumber arus dan stopwatch
Mengulangi (interval 5 menit) hingga 30 menit.
Gambar 1.2 Rangkaian Percobaan Penentuan Energi Dalam.
1.3. Hasil Percobaan
Hasil percobaan pada modul 1 sebagai berikut:
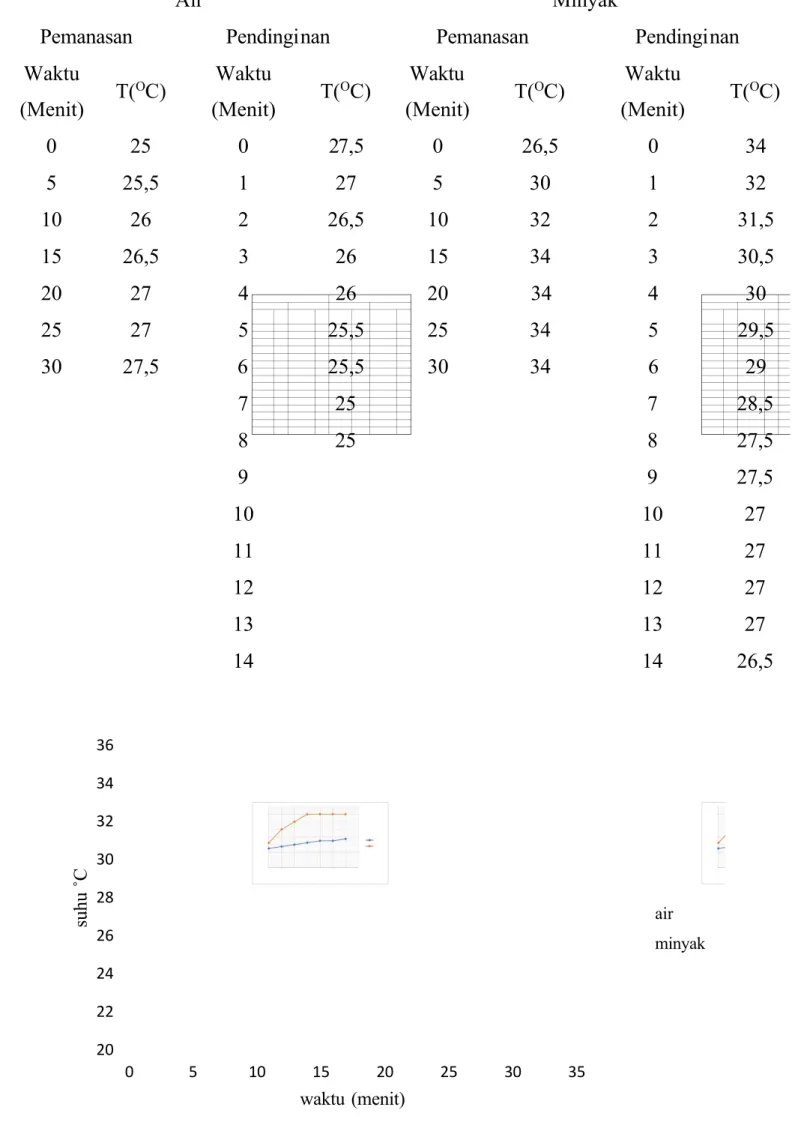
Tabel 1.1. hasil pengamatan temperatur pada alat ultrasonic vibrator.
Air Minyak
Pemanasan Pendinginan Pemanasan Pendinginan
Waktu (Menit) T( OC) Waktu (Menit) T( OC) Waktu (Menit) T( OC) Waktu (Menit) T( OC) 0 25 0 27,5 0 26,5 0 34 5 25,5 1 27 5 30 1 32 10 26 2 26,5 10 32 2 31,5 15 26,5 3 26 15 34 3 30,5 20 27 4 26 20 34 4 30 25 27 5 25,5 25 34 5 29,5 30 27,5 6 25,5 30 34 6 29 7 25 7 28,5 8 25 8 27,5 9 9 27,5 10 10 27 11 11 27 12 12 27 13 13 27 14 14 26,5 20 22 24 26 28 30 32 34 36 0 5 10 15 20 25 30 35 s u h u ˚ C waktu (menit) air minyak
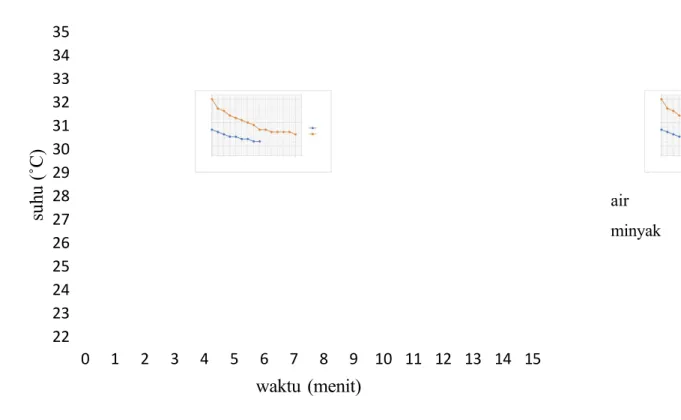
Gambar 1.5 Hubungan antara waktu terhadap suhu pada pendinginan air dan minyak.
Tegangan 8 volt Waktu
(menit) T (ºC) Volt (V) Arus (mA)
Energi Dalam (J) Energi Listrik (J) 0 25 0 0 0 0 5 41,6 11,6 0,88 68346,5 3,062 10 58,1 11,61 0,87 136281 6,06 15 71,4 11,62 0,87 191041 9,098 20 73,2 11,62 0,87 198452 12,131 25 73,6 11,62 0,87 200099 15,164 30 72,8 11,62 0,87 196805 18,196 Tegangan 12 volt Waktu
(menit) T (ºC) Volt (V) Arus (mA)
Energi Dalam (J) Energi Listrik (J) 0 25 0 0 0 0 5 41,6 11,6 0,88 68346,5 3,062 10 58,1 11,61 0,87 136281 6,06 15 71,4 11,62 0,87 191041 9,098 20 73,2 11,62 0,87 198452 12,131 25 73,6 11,62 0,87 200099 15,164 30 72,8 11,62 0,87 196805 18,196
Tabel 1.2 Hasil pengamatan hubungan suhu, waktu, volt dan arus pada alat kalorimeter.
22 23 24 25 26 27 28 29 30 31 32 33 34 35 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 s u h u ( ˚ C ) waktu (menit) air minyak
Contoh perhitungan untuk energi dalam dan energi listrik. Perhitungan Energi Dalam
Q = m c ∆T
= 0,9803 x 4200 x 10,4 = 42819,50 J
Perhitungan Energi Listrik Q = m c ∆T = 0,9803 x 4200 x 16,6 = 68346,52 J 0 5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 0 5 10 15 20 25 30 35 s u h u ( ℃ ) waktu (menit) ∆U (kJ)
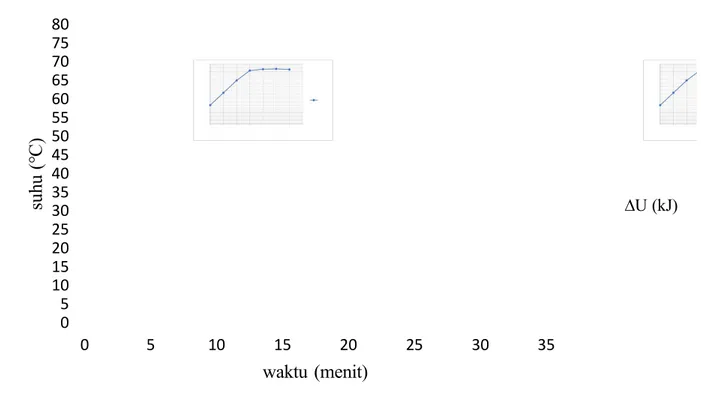
Gambar 1.6 Hubungan antara energi dalam dan energi listrik variabel 8 volt.
0 5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 0 5 10 15 20 25 30 35 s u h u ( ℃ ) waktu (menit) ∆U (kJ)
1.4. Pembahasan
Joule menyimpulkan bahwa setiap satuan massa bahan cairan akan mengalami kenaikan temperatur akibat pengadukan. Apabila cairan diberi kerja sebesar yang dibutuhkan maka cairan akan mengalami kenaikan temperatur. Kerja yang ditambahkan pada percobaan ini berasal dari pengadukan. (Smith, 2001).
Tabel 1.1 menjelaskan tentang suhu dan waktu pada pemanasan air dan minyak menggunakan alat ultrasonic vibrator. Ultrasonic vibrator memanfaatkan getaran dari gelombang ultrasonik yang diubah menjadi panas. Panas dari getaran akan mempengaruhi perubahan suhu pada air dan minyak, sehingga suhu pada air akan berubah meningkat. Perubahan bentuk energi dari kerja menjadi panas
dipengaruhi oleh gelombang ultrasonik yang menghasilkan getaran. Getaran tersebut merupakan kerja (W). Getaran merupakan energi kinetik karena getaran menghasilkan gerakan yang menghasilkan panas.
Kalor adalah perpindahan energi internal. Kalor mengalir dari satu bagian sistem ke bagian lain atau dari satu sistem ke sistem lain karena ada perbedaan temperatur (Zemansky, 1986).
“Wadah kemudian didinginkan maka temperatur kembali ke kondisi awal.” (Smith.).
“we know from experience that a hot object brought in contact with a cold object becomes cooler, whereas the cold object becomes warmer.” (Smith, 2001). Panas berpindah dari suhu tinggi menuju suhu rendah. Praktikum pendinginan air dan minyak ini membuktikan kutipan tersebut. Panas pada air didalam erlenmayer (sistem) berpindah pada air didalam bak (lingkungan). Suhu tinggi pada air (sistem) berpindah ke suhu rendah pada bak (lingkungan).
Gambar grafik 1.1 menjelaskan tentang hubungan antara waktu dan suhu pemanasan pada air dan minyak. Data dari grafik 1.4 dapat dilihat bahwa
hubungan pemanasan antara suhu dan waktu tidak berbanding lurus. Interval waktu pada percobaan pemanasan air sebesar 5 menit selama 30 menit. 5 menit pertama hingga menit ke 20 menunjukan peningkatan suhu yang konstan sebesar 0.5oC, sedangkan pada menit ke 20 hingga menit ke 25 menunjukan kenaikan namun tidak konstan sebesar 0,2oC. Menit ke 20 hingga menit ke 25 menunjukan
kembali kenaikan sebesar 0,8oC. Data dari grafik 1.4 juga menjelaskan hubungan pemanasan antara suhu dan waktu tidak berbanding lurus. Interval waktu pada percobaan pemanasan minyak sebesar 5 menit. 5 menit pertama menunjukan kenaikan sebesar 3,5oC, sedangkan pada menit ke 5 hingga menit ke-10 menunjukan kenaikan sebesar 2oC. menit ke-15 hingga menit ke 30 tidak menunjukan kenaikan suhu. Suhu tetap berada pada 34oC.
Kapasitas kalor adalah jumlah panas yang diperlukan untuk menaikkan suhu dari suatu sampel bahan sebesar 1℃ Kapasitas panas mempunyai beberapa sifat yaitu
sifat ekstensif dan intensif. Sifat ekstensif dari kapasitas panas yaitu jumlahnya tergantung dari besar sampel, sedangkan sifat intensif dari kapasitas panas berhubungan dengan panas jenis (c) yang didefenisikan sebagai jumlah panas yang diperlukan untuk menaikkan temperatur dari 1g massa bahan sebesar 1oC.
Semakin kecil kapasitas panas jenis suatu benda, semakin mudah naik suhunya bila dipanasi, demikian juga sebaliknya semakin besar kapasitas panas jenis suatu benda semakin banyak panas yang harus diberikan untuk menaikkan suhunya.
(Simbolon).
Perbedaan kenaikan suhu antara air dan minyak disebabkan oleh kapasitas kalor. Kapasitas kalor antara air dan minyak adalah berbeda. Kapasitas yang dimiliki minyak lebih kecil dibanding air, sehingga kenaikan temperatur pada pemanasan minyak lebih tinggi dibandingkan dengan air yang memiliki interval waktu yang sama.
Data pada gambar grafik 1.5 dapat dilihat bahwa pendinginan pada air dan minyak tidak berbanding lurus. Menit pertama menunjukan penurunan air sebesar 0.5oC setiap menit dari menit ke-0 hingga menit ke-3. Menit ke 3 hingga menit ke 4 tidak menunjukan penurunan suhu. Hal ini terjadi juga pada menit ke-5 hingga menit ke-6 dan menit ke-7 hingga menit ke-8. Penurunan kembali terjadi sebesar 0,5 pada menit ke-4 hingga menit ke-5 dan menit ke-6 hingga menit ke-7. Waktu yang dibutuhkan untuk mendinginkan air kembali ke suhu mula mula adalah 8 menit. Gambar grafik 1.2 juga menjelaskan tentang hubungan pendinginan antara suhu dan waktu pada minyak. Data pada tabel 1.5 juga menunjukan suhu dan
waktu pendinginan pada minyak. Menit pertama hingga menit ke-8 menunjukan penurunan yang tidak stabil. Menit ke-8 hingga menit ke-9 tidak menunjukan penurunan suhu, suhu tetap sebesar 27,5oC. Menit ke-9 hingga menit ke-10 menunjukan penurunan suhu sebesar 0,5oC. Menit ke 10 hingga menit ke-13 tidak terjadi penurunan suhu, suhu tetap sebesar 27oC. Suhu kembali turun pada menit ke-13 hingga menit ke-14 sebesar 26,5oC. Waktu yang dibutuhkan untuk pendinginan minyak adalah selama 14 menit.
Istilah energi dalam pada termodinamika adalah energi yang terkandung di dalam sistem, tidak termasuk energi kinetik yang digunakan untuk memindahkan cairan tersebut. (Smith.7th edition).
Persamaan yang digunakan adalah Q = ΔU + W. Perbedaan yang digunakan tanda positif dan negatif. Besaran Q bernilai positif bila kalor masuk atau diberikan ke sistem, Q bernilai negatif bila kalor dihasilkan oleh sistem, W bernilai negatif bila usaha diberikan ke sistem, W bernilai positif bila usaha dihasilkan oleh sistem. Sementara energi dapat meningkat atau menurun, sehingga ∆U bernilai positif bila terjadi kenaikan energi dalam dan ∆U bernilai negatif bila terjadi penurunan energi dalam (Giancoli, 2005).
Praktikum kali ini adalah tentang penentuan energi dalam, dengan mengubah energi listrik menjadi energi panas. Alat yang digunakan dalam percobaan ini adalah berupa rangkaian alat berupa kalorimeter yang dihubungkan dengan sumber tegangan. Perbedaan tegangan yang digunakan yaitu sebesar 8 volt dan 12 volt.
Kalorimeter adalah alat untuk menentukan kalor jenis tipis yang dimasukkan dalam bejana tembaga yang lebih besar. Pada prinsipnya, antara bejana kecil (dinding dalam) dengan bejana besar (dinding luar) dibatasi oleh bahan yang tidak dapat dialiri kalor (adiabatic). Kemudian, diberi tutup yang mempunyai dua lubang untuk memasukkan / tempat thermometer dan pengaduk. Pengukuran kalor jenis dengan calorimeter didasarkan pada asas Black, yaitu kalor yang diterima
oleh calorimeter sama dengan kalor yang diberikan oleh zat yang dicari kalor jenisnya. Hal ini mengandung pengertian jika dua benda yang berbeda suhunya
saling bersentuhan, maka akan menuju kesetimbangan termodinamika. Suhu akhir kedua benda akan sama. (Saras,2012).
Energi listrik dapat diubah menjadi energi panas karena energi listrik dihasilkan oleh elemen pemanas listrik tersebut selama t sekon sebesar W = V I t. Kemudian, energi tersebut diubah menjadi energi kalor sebesar Q = m c ∆T. Secara matematis, perubahan energi listrik W menjadi energi kalor Q dapat dituliskan W = Q, V I t = m c ∆T. (Mahfud,2018)
Perbandingan data yang di dapatkan antara dua tegangan yang digunakan adalah suhu dengan tegangan 8 volt lebih kecil dibanding suhu yang bertegangan 12 volt. Tegangan semakin besar maka energi listrik yang dihasilkan juga akan semakin besar, dan jika suhu semakin tinggi energi dalam yang dihasilkan akan semakin besar, sehingga dapat disimpulkan bahwa tegangan berbanding lurus energi listrik dan suhu berbanding lurus dengan energi dalam. Hal ini juga terjadi karena adanya perpindahan energi, dari energi listrik ke energi kalor yang ditandai dengan meningkatnya suhu air dalam kalorimeter.
Terdapat konsep dalam sistem termodinamika tertutup dimana tidak ada proses yang mengalir sehingga dapat dirumuskan Q = ΔU, dan dapat disimpulkan bahwa energi dalam sama dengan energi kalor.
Energi kalor memiliki kesetaraan dengan energi listrik sehingga dalam grafik akan membentuk kurva linier.
Gambar 1.6 grafik yang menjelaskan tentang hubungan energi dalam dan energi listrik dengan tegangan 8 volt. Besar energi kalor yang diperoleh dengan tegangan 8 volt dari praktikum kali ini dapat dilihat pada gambar grafik 1.6., energi dalam tersebut juga diubah menjadi energi listrik. Grafik tersebut seharusnya membentuk kurva linier, akan tetapi grafik yang dihasilkan tidak sesuai dengan literatur. Terdapat beberapa kesalahan yang relatif kecil pada percobaan yang dilakukan ini sehingga grafik terlihat mendekati kesetaraan antara energi dalam dan energi listrik.
Tegangan yang digunakan pada percobaan kedua (gambar 1.7) ini lebih besar dibanding dengan percobaan pertama sehingga suhu yang dihasilkan menjadi
semakin tinggi. Energi dalam dan energi listrik yang dihasilkan juga tinggi. Energi kalor yang diperoleh sesuai dengan yang ada pada . Energi kalor tersebut diubah menjadi energi listrik. Grafik antara energi dalam dan energi listrik pada variable 12 volt tidak sesuai dengan literatur, dimana seharusnya grafik antara energi dalam dan energi listrik terbentuk garis lurus seperti garis linier. Hal ini dikarenakan masih kurangnya ketelitian saat membaca temperatur yang bersamaan dengan tegangan saat melakukan percobaan.
1.5. Kesimpulan
Kesimpulan yang dapat diambil dari percobaan modul 1 adalah sebagai berikut: 1. Kerja dapat mempengaruhi kenaikan dan penurunan temperatur air dan
minyak. Kerja dapat berubah bentuk menjadi panas.
2. Panas berpindah dari temperatur yang tinggi menuju temperatur yang rendah. 3. Energi listrik dapat diubah menjadi panas dan sebaliknya.
4. Tegangan berbanding lurus dengan energi listrik dan suhu berbanding lurus dengan energi dalam.
5. Menghitung energi dalam pada sistem tertutup dapat dirumuskan dengan ΔU = Q maka Q = m.c.ΔT dan energi listrik dengan Q = V .I.t
1.6. Daftar Pustaka
Smith, J.M., Van Ness, H.C., Abbott M. (). Introduction to Chemical Engineering
Thermodynamics. 7 th edition. McGraw-Hill, New York.
Suryantari M.Sc, Risti.(2013). Problem Solving dengan Metode Identifikasi Variabel berdasarkan skema : Tinjauan terhadap Topik Termodinamika. Universitas Katolik Parahyangan.
Pramudita, Saras Dian.(2012). Jurnal Panas Lebur Es. Universitas Muhammadiyah Prof Dr Hamka.