LAPORAN PRAKTIKUM FISIKA DASAR
Kalorimeter
Disusun oleh:
Nama : Mina Amalina
NPM : 240210130028
Kelompok/shift : 4/TIP A1
Hari/tanggal : Senin/23 September 2013 Waktu : 08.00-10.00 WIB
Asisten : Koko Iwan Agus Kurniawan
LABORATORIUM FISIKA DASAR JURUSAN TEKNOLOGI INDUSTRI PANGAN FAKULTAS TEKNOLOGI INDUSTRI PERTANIAN
▸ Baca selengkapnya: laporan praktikum fisika roket air
(2)BAB I PENDAHULUAN
1.1 Latar Belakang
Hukum kekekalan energi menyatakan energi tidak dapat dimusnahkan dan diciptakan melainkan hanya dapat diubah dari satu bentuk kebentuk lain. Banyak terdapat energi di alam ini seperti energi listrik, energi gerak, energi bunyi, energi kalor, namun energi kalor hanya dapat dirasakan contohnya ada pada panas matahari.
Dalam kehidupan sehari-hari kita sering melihat alat-alat pemanas yang menggunakan energi listrik seperti pemanas ruangan, kompor listrik, pemanas air ataupun penanak nasi. Pada dasarnya alat-alat tersebut memiliki cara kerja yang sama yaitu mengubah energi listrik menjadi energi kalor. Sama halnya dengan kalorimeter yang dapat digunakan untuk mengukur panas/kalor.
1.2 Tujuan
BAB II
TINJAUAN PUSTAKA
2.1 Kalorimeter
Kalor adalah energi panas yang dimiliki oleh suatu zat. Secara umum, untuk mendeteksi adanya kalor yang dimiliki oleh suatu benda yaitu dengan mengukur suhu benda tersebut. Jika suhunya tinggi, maka kalor yang dikandung oleh benda sangat besar, begitu juga sebaliknya jika suhunya rendah maka kalor yang dikandung sedikit. Alat yang dapat mengukur kalor disebut kalorimeter (Young & Freedman,2002).
Kalor reaksi dapat diperoleh dari hubungan massa zat (m), kalor jenis zat (c) dan perubahan suhu (∆T), yang dinyatakan dengan persamaan berikut
Keterangan :
q = jumlah kalor (Joule) m = massa zat (kg)
Δt = perubahan suhu (takhir - tawal) c = kalor jenis
Kimia termo mempelajari perubahan panas yang mengikuti reaksi kimia dan perubahan-perubahan fisika (pelarutan, peleburan dan sebagainya). Satuan tenaga panas biasanya dinyatakan dengan kalori, joule atau kilo kalori.
1 Joule = 10-7 erg = 0,24 kal
1 kal = 4,184 joule (Dogra, 1990).
Setiap kalorimeter mempunyai sifat khas dalam mengukur panas. Ini dapat terjadi karena kalorimeter sendiri (baik gelas, polistirena atau logam) menghisap panas yang diserap, sehingga tidak semua panas terukur. Untuk itu kita perlu menentukan berapa banyak panas yang diserap oleh kalorimeter beserta termometer pengaduknya (Dogra, 1990).
Panas adalah energi yang berpindah, jadi prinsipnya adalah prinsip kekekalan energi. Hukum kekekalan energi menyatakan bahwa “Energi tak bisa diciptakan atau dimusnahkan, energi hanya bisa diubah dari suatu bentuk menjadi
bentuk energi lain” Kuantitas panas yang ditambahkan pada suatu benda sebagai positif dan pada kuantitas yang meninggalkan benda sebagai negative. Ketika sejumlah benda berinteraksi, jumlah aljabar dari setiap kuantitas panas yang dipindahkan pada semua benda harus sama dengan nol. Ini adalah Azas Black yang dasarnya adalah kekekalan energi. Kalor selalu berkaitan dengan dua hal yaitu proses pemanasan atau proses pendinginan yang melibatkan perubahan suhu dan proses perubahan wujud zat yang terjadi pada suhu yang tetap (Dogra, 1990).
2.2 Keterkaitan Asas Black dengan Kalor
Asas Black menyatakan jumlah kalor yang masuk sama dengan jumlah kalor yang dilepaskan pada suatu sistem. Menurut asas black jika dua buah zat atau lebih dicampur menjadi satu maka zat yang suhunya tinggi akan melepaskan kalor sedangkan zat yang suhunya rendah akan menerima kalor, sampai tercapai kesetimbangan termal. Bila persamaan tersebut dijelaskan, maka akan diperoleh:
m1.c1 (t1-ta) = m2.c2 (ta-t2) (Mulyono,2001).
2.3 Hukum Termodinamika
Hukum pertama termodinamika menghubungkan perubahan energi dalam suatu proses termodinamika dengan jumlah kerja yang dilakukan pada sistem dan jumlah kalor yang dipindahkan kesistem (Petrucci, 1987).
Hukum kedua termodinamika yaitu membahas tentang reaksi spontan dan tidak spontan. Proses spontan yaitu reaksi yang berlangsung tanpa pengaruh luar. Sedangkan reaksi tidak spontan tidak terjadi tanpa bantuan luar (Petrucci, 1987).
Hukum ketiga termodinamika menyatakan bahwa entropi dari kristal sempurna murni pada suhu nol mutlak ialah nol. Kristal sempurna murni pada suhu nol mutlak menunjukkan keteraturan tertinggi yang dimungkinkan dalam sistem termodinamika. Jika suhu ditingkatkan sedikit diatas 0 K, entropi meningkat. Entropi mutlak selalu mempunyai nilai positif (Petrucci, 1987).
2.4 Arus Listrik
BAB III
METODE PRAKTIKUM
3.1 Alat dan Bahan 3.1.1 Alat
1. Sebuah kalorimeter dilengkapi kumparan pemanas dan pengaduk 2. Termometer, untuk mengukur perubahan suhu pada air suling 3. Voltmeter, untuk mengukur tegangan listrik
4. Ampermeter, untuk mengukur hambatan listrik yang terjad 5. Gelas ukur, untuk mengisi kalorimeter dengan air
6. Stopwatch, untuk mengukur waktu saat terjadi perubahan suhu 7. 6 kabel penghubung, untuk mengalirkan arus listrik
3.1.2 Bahan
Air suling 80 mL
3.2 Prosedur Praktikum
1. Kalorimeter diisi dengan air suling sebanyak 50 mL dengan menggunakan gelas ukur. Massa air suling pada kalorimeter tersebut dicatat
2. Alat-alat yang digunakan pada percobaan disusun seperti pada gambar. Periksakan kepada asisten terlebih dahulu sebelum mengaktifkan sumber tegangan
3. Arus dihubungkan dalam waktu yang singkat dan diatur sebesar 0,3 A, kemudian sumber tegangan DC dimatikan lagi
4. Air diaduk, dan catat suhu sebagai suhu awal T1.
5. Arus listrik kembali dialirkan (sumber tegangan DC diaktifkan). Catat tegangan yang terukur pada voltmeter
6. Mencatat suhu pada saat 3 menit, 6 menit, 9 menit, 12 menit, dan 15 menit, isikan sebagai suhu akhir T2. Setelah 15 menit sumber tegangan DC dimatikan
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil
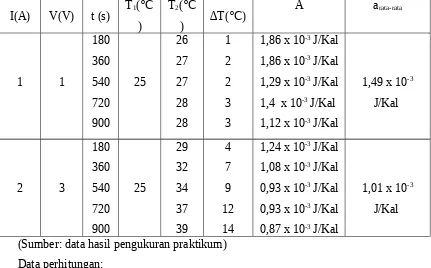
1. Maassa air suling : 80 mL = 0,008 L = 8 x 10-5 m3 2. jari-jari gelas ukur : 3 cm = 0,03 m
3. tara panas air (Aair) : 0,238 J/Kal 4. kalori jenis air (Cair) : 4,2 KJ/Kg K
(Sumber: data hasil pengukuran praktikum) Data perhitungan:
1) Menghitung tinggi air suling
t=0,02830m t=2,83cm
2) Menghitung massa air suling Massa=ρair . Vair
¿1000.0,0008
¿0,08Kg
3) Menghitung tara panas listrik a. 1 Ampere
a1=m. c . ∆ T V . I . t
¿0,00008.4,2.1 1.1.180
¿0,000336 180 ¿0,001866J/Kal
= 1,86 x 10-3 J/Kal
a2=m .c . ∆ T V . I . t
¿0,00008.4,2.2 1.1.360
¿0,000672 360
¿0,001866J/Kal
= 1,86 x 10-3 J/Kal
a3=m . c . ∆ T V . I .t
¿0,00008.4,2.2 1.1.540
¿0,000336726 540 ¿0,001244J/Kal
a4=m .c . ∆ T V . I .t
¿0,00008.4,2.3 1.1.720
¿0,001008 720
¿0,00140J/Kal
= 1,40 x 10-3 J/Kal
a5=m . c . ∆ T V . I .t
¿0,00008.4,2.3 1.1.900
¿0,001008 900
¿0,000112J/Kal
= 1,12 x 10-3 J/Kal
b. 2 Ampere
a1=m. c . ∆ T V . I . t
¿0,00008.4,2.4 3.2.180
¿0,001344 108 ¿0,001244J/Kal
= 1,24 x 10-3 J/Kal
a2=m .c . ∆ T V . I . t
¿0,00008.4,2.7 3.2.360
¿0,00108J/Kal
~
5) Menghitung R dan P a. 1 Ampere
6) Menghitung ketelitian percobaan (KP) a. 1 Ampere
KP = aˇ−aair aair
x 100%
= −0,23651
0,238 x 100% = 99,37 %
b. 2 Ampere
KP = a−ˇ aair aair
x 100%
= 0,001010,238−0,238 x 100%
= −0,23699
0,238 x 100% = 99,57 %
7) Menghitung kesalahan relatif (KR) - 1 Ampere
KR = 100% - KP = 100% - 99,37% = 0,63%
- 2 Ampere
KR = 100% - KP
= 100% - 99,57% = 0,43%
4.2 Pembahasan
Pada praktikum kali ini, praktikan melakukan percobaan untuk membuktikan kebenaran mengenai hukum termodinamika I mengenai energi yang tidak dapat di ciptakan dan di musnahkan melainkan energi hanya berubah dari bentuk satu ke bentuk lainnya. Dalam melakukan percobaan ini praktikkan menggunakan kalorimeter.
mengetahui besar rata-rata nilai tara panas listrik dari kenaikan suhu tersebut. Selain dapat menentukan nilai rata-rata, praktikkan juga dapat mengetahui nilai kesalahan relatif yang dilakukan pada saat praktikkum berlangsung.
Pada percobaan diatas, dengan media utama air suling dapat diketahui besarnya tara panas listrik pada Kalorimeter, tara panas listrik tersebut dapat dihitung besarnya. Secara sistematis dapat dirumuskan sebagai berikut:
Keterangan:
a : Tara panas J/Kal m : massa air suling (Kg)
c : kapasitas kalor air 1 kall/°C gram (1 kall = 4,2 Joule) T1 : suhu awal (K)
T2 : suhu akhir (K)
T : selisih suhu akhir dengan suhu awal (K) V : tegangan listrik (Volt)
t : waktu (s)
Khususnya pada percobaan menghitung nilai tara panas listrik ini,dilakukan dengan mengatur amperemeter dan voltmeter sehingga arus dan tegangan listrik berbeda. Pada percobaan pertama dialiri arus 1 ampere dengan tegangan pada 1 volt. Sedangkan pada percobaan kedua dialiri arus sebesar 2 ampere dengan tegangan 3 volt. Kemudian suhu dapat di amati dan dicatat perubahannya pada waktu 3 menit, 6 menit, 9 menit, 12 menit, dan terakhir 15 menit. Untuk mengetahui suhu air suling pada kalorimeter maka dilakukan dua kali pengukuran suhu yaitu suhu awal dan suhu akhir, suhu yang kita gunakan pada tara panas listrik ini adalah selisih antara suhu akhir dengan suhu awal, maka didapatlah nilai tara panas listrik yang pertama dan yang kedua, kemudian jumlah nilai tara panas listrik ini dibagi dengan jumlah percobaan yang dilakukan, sehingga didapatkan nilai tara panas rata-rata.
Karena kita melakukan percobaan dengan alat yang berbeda, maka ketelitian hasil pratikum akan berbeda. Oleh karena itu, perlu adanya perhitungan ketelitian
percobaan dan ketelitian relatif.
BAB V PENUTUP
5.1 Kesimpulan
1. Keberhasilan dalam percobaan ini dipengaruhi oleh kualitas alat dan ketelitian pelaku percobaan, jika alat yang digunakan masih bagus dan pelaku percobaan memiliki ketelitian yang tinggi maka percobaan akan cenderung berhasil. 2. Pada prinsip percobaan kali ini, energi listrik mengalir kekumparan sehingga
pada kumparan daya esipasinya keluar dalam bentuk kalor.
3. Dalam perhitungan tara panas hal-hal yang mempengaruhinya adalah jumlah kumparan, waktu, dan alat.
4. perubahan suhu yang terjadi dan waktu yang diperlukan selama terjadi perubahan suhu dapat mempengaruhi besarnya tara panas listrik.
5.2 Saran
1. Sebelum melakukan praktikum, praktikan sebaiknya memahami materi praktikum yang akan di praktikan.
2. Lebih teliti dalam melakukan pengukuran, karena ketelitian pengukuran dan penentuan nilai hasil pengukuran akan sangat mempengaruhi perhitungan data, juga ketelitian yang rendah dapat menyebabkan terjadinya tingkat kesalahan yang cukup tinggi.
DAFTAR PUSTAKA
Dogra, S.K. 1990. Kimia Fisik dan Soal-soal. UI Press. Jakarta
Mulyono, M. 2001. Kamus Kimia. Ganesindo. Bandung
Petrucci, R. H. 1987. Fisika Dasar Prinsip dan Terapan Modern. Erlangga. Jakarta.