AKTIVITAS ANTIOKSIDAN DAN KOMPONEN BIOAKTIF
LILI LAUT (Comaster sp.)
Dian Rachma Safitri
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
RINGKASAN
DIAN RACHMA SAFITRI C34060035. Aktivitas Antioksidan dan Komponen Bioaktif Lili Laut (Comaster sp.). Dibimbing oleh NURJANAH dan ASADATUN ABDULLAH.
Lili laut (Comaster sp.) adalah salah satu anggota filum echinodermata, morfologinya menyerupai tanaman lili atau pakis dan bagian tangannya memiliki corak yang beraneka ragam warna. Lili laut (Comaster sp.) sampai saat ini masih belum dimanfaatkan dan belum bernilai ekonomis. Kajian ilmiah mengenai khasiat lili laut bagi kesehatan manusia belum dilakukan, sehingga pengujian ilmiah aktivitas antioksidan dan komponen bioaktif lili laut perlu dilakukan.
Tujuan dari penelitian ini adalah untuk menentukan kandungan zat gizi (air, lemak, protein, abu, dan karbohidrat), aktivitas antioksidan dan komponen bioaktif yang terkandung dalam lili laut. Pengujian yang dilakukan meliputi analisis proksimat, uji kuantitatif aktivitas antioksidan dengan metode DPPH dan uji fitokimia.
Karakteristik lili laut (Comaster sp.) memiliki warna hitam keunguan, dengan tekstur yang keras, memiliki segment cirrus 25 buah dan arms sebanyak 48 buah. Komposisi kimia lili laut meliputi kadar air, abu, protein, lemak, dan karbohidrat. Lili laut memiliki kandungan air yaitu sebesar 74,67%, abu 13,51%, protein 0,11%, lemak 0,55%, dan karbohidrat 11,16%. Ekstrak kasar lili laut memiliki aktivitas antioksidan yang terlihat dari nilai IC50 yang diperoleh. Nilai
IC50 dari ekstrak etanol sebesar 1.605,25 ppm, ekstrak kloroform sebesar 5.718,08
ppm, ekstrak etil asetat sebesar 2.016,78 ppm dan ekstrak metanol sebesar 419,21 ppm. Ekstrak kasar lili laut ini mengandung 4 dari 9 komponen bioaktif yang diuji, yaitu alkaloid, steroid, flavonoid, dan karbohidrat. Alkaloid dan flavonoid dari lili laut yang terdeteksi pada komponen ekstrak etanol dan metanol diduga memiliki kandungan antioksidan. Berdasarkan hasil uji fitokimia, lili laut berpotensi untuk dimanfaatkan sebagai bahan baku dalam industri farmasi dan pangan fungsional.
AKTIVITAS ANTIOKSIDAN DAN KOMPONEN BIOAKTIF LILI LAUT (Comaster sp.)
DIAN RACHMA SAFITRI C34060035
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan di Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul : AKTIVITAS ANTIOKSIDAN DAN KOMPONEN BIOAKTIF LILI LAUT (Comaster sp.)
Nama : Dian Rachma Safitri
NRP : C34060035
Departemen : Teknologi Hasil Perairan
Menyetujui,
Dosen Pembimbing I Dosen Pembimbing II
Dr, Ir. Nurjanah, MS Asadatun Abdullah, S.Pi, M.Si, M.S.M NIP. 1959 1013 1986 01 2 002 NIP. 1983 0405 2005 01 2 001
Mengetahui,
Ketua Departemen Teknologi Hasil Perairan
Dr. Ir. Ruddy Suwandi, MS, M.Phil NIP. 1958 0511 1985 03 1 002
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI Dengan ini saya menyatakan bahwa skripsi dengan judul ”Aktivitas Antioksidan dan Komponen Bioaktif Lili Laut (Comaster sp.)” adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada Perguruan Tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang telah diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Oktober 2010
Dian Rachma Safitri C34060035
KATA PENGANTAR
Puji syukur penulis ucapkan kehadirat Allah SWT atas segala nikmat dan karunia yang telah diberikan. Sholawat dan salam semoga selalu tercurah kepada Rasulullah SAW. yang telah membimbing kita semua ke dalam ajaran agama Islam. Atas berkat rahmat serta karunia-Nya penulis mampu menyelesaikan penulisan hasil penelitian dengan judul ”Aktivitas Antioksidan dan Komponen Bioaktif Lili Laut (Comaster sp.)”. Penulisan hasil penelitian ini dilaksanakan sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dan memberi dukungan kepada penulis selama penyusunan skripsi ini, terutama kepada:
1. Ayah dan ibu serta kakak-kakakku tersayang yang telah mendoakan, mendukung, dan terus mengajari banyak hal tentang arti kehidupan dan semangat untuk terus maju.
2. Dr. Ir. Nurjanah, MS dan Asadatun Abdullah, S.Pi, M.Si, M.S.M sebagai dosen pembimbing yang telah memberikan bimbingan dan arahan kepada penulis dengan penuh kesabaran.
3. Dr. Ir. Ruddy Suwandi, MS, M.Phil. sebagai Ketua Departemen Teknologi Hasil Perairan.
4. Dr. Ir. Agoes Mardiono Jacoeb Dipl. Biol, sebagai Ketua Program Studi Departemen Teknologi Hasil Perairan dan dosen penguji.
5. Staf pengajar Departeman Teknologi Hasil Perairan dan Staf Tata Usaha yang telah membantu penulis dalam menyelesaikan penelitian ini.
6. Bu Emma, Mbak Lastri, Mas Ipul yang telah banyak membantu penulis selama melakukan penelitian di laboratorium.
7. Teman-teman Diklat 25 (Luki, Hedra, Herbet, Sukma, James, Opik, Iqbal, Apoy, Ratih, Ami, Mpus, Muti, Fadil, Via dan Mprit) yang telah menemani perjuangan selama diklat dalam susah dan senang.
8. Teman-teman di Fisheries Diving Club (FDC-IPB) Diklat 22, 23, 24, 26, 27, dan 28, yang telah memberikan pengalaman berharga dan kenangan yang indah di kehidupan saya.
9. Tim antioksidan ( Uuk, Aul, Fau, Pipit, dan Leli), yang telah membantu penulis dalam pelaksanaan penelitian ini.
10. Teman-teman THP 43 yang telah membuat kehidupan saya menjadi lebih berwarna selama masa kuliah.
11. Geng Backdoors (Vkar, Ozzy, Joha, Idur, Idris, dan Komeng) yang selalu membuat saya tertawa dalam menghadapi penelitian.
12. Sobat THP 41, 42, 43, 44 dan 45 yang selama ini telah memberi semangat dalam menjalani segala kegiatan di THP.
13. Semua pihak yang tidak dapat disebutkan satu per satu di sini, penulis mengucapkan terima kasih banyak atas bantuan dan kerjasamanya dalam penulisan skripsi ini.
Penulis menyadari bahwa masih banyak kekurangan dalam penulisan skripsi ini. Oleh karena itu, penulis mengharapkan kritik dan saran yang bersifat membangun dari berbagai pihak dalam proses penyempurnaan laporan penelitian ini. Semoga tulisan ini dapat bermanfaat bagi semua pihak yang memerlukan.
Bogor, Oktober 2010
Dian Rachma Safitri C34060035
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta, pada tanggal 2 Juni 1989. Penulis adalah anak terakhir dari enam bersaudara dari Bapak Machmudi dan Ibu Ati Sunarti. Penulis memulai pendidikan formal di Sekolah Dasar Negeri 09 PG Jagakarsa Jakarta Selatan dan lulus pada tahun 2000, dilanjutkan Sekolah Menengah Pertama di SLTP Negeri 166 Jakarta dan lulus pada tahun 2003, dan melanjutkan pendidikan Tingkat Menengah Atas di SMU Negei 49 Jakarta dan lulus pada tahun 2006.
Penulis masuk Institut Pertanian Bogor melalui jalur USMI pada tahun 2006 dan diterima sebagai mahasisa Fakultas Perikanan dan Ilmu Kelautan pada Program Studi Teknologi Hasil Perairan. Selain itu penulis juga aktif di organisasi Fisheries Diving Club- Institut Pertanian Bogor (FDC-IPB) tahun 2007-2010 dan menjabat sebagai pengurus Penelitian dan Pengembangan FDC-IPB (2008-2009) dan sebagai pengurus Pendidikan dan Pelatihan Selam FDC-IPB (2009-2010).
Selama di FDC penulis pernah mengikuti beberapa kegiatan diantarnya Sail Bunaken (Guinnes Book of Record) pada tahun 2009, Simulasi dan Monitoring Terumbu Karang di Pulau Pramuka (2008) sebagai Tim Benthos, dan “Ekspedisi Zooxhaantellae X Biak-Numfor, Papua” (2009), Takabonarate Island Expedition (2010). Penulis ikut serta dalam penulisan laporan ilmiah hasil monitoring terumbu karang yang berjudul “Kondisi dan Potensi Ekosistem Terumbu Karang Kepulauan Padaido, Kabupaten Biak-Numfor” sebagai Tim Benthos. Dalam bidang akademik penulis juga merupakan asisten praktikum mata kuliah Pengetahuan Bahan Baku (2010).
Penulis melakukan penelitian dan menyusun skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan, dengan judul “Aktivitas Antioksidan dan Komponen Bioaktif Lili Laut (Comaster sp)”, dibimbing oleh Dr. Ir. Nurjanah, MS dan Asadatun Abdullah, S.Pi, M.Si, M.S.M.
DAFTAR ISI
Halaman
KATA PENGANTAR ... iv
DAFTAR ISI ... vii
DAFTAR GAMBAR ... ix DAFTAR TABEL ... x DAFTAR LAMPIRAN ... xi 1 PENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Tujuan ... 2 2 TINJAUAN PUSTAKA ... 3
2.1 Deskripsi dan Klasifikasi Lili Laut (Comaster sp.) ... 5
2.2 Radikal Bebas ... 5 2.3 Antioksidan ... 6 2.4 Mekanisme Antioksidan ... 8 2.4.1 Antioksidan primer ... 8 2.4.2 Antioksidan sekunder ... 9 2.4.3 Antioksidan tersier ... 9
2.5 Uji Aktivitas Antioksidan ... 10
2.6 Senyawa Fitokimia ... 11 2.6.1 Alkaloid ... 11 2.6.2 Terpenoid / Steroid ... 11 2.6.3 Flavonoid ... 12 2.6.4 Saponin ... 12 2.6.5 Fenol hidrokuinon... 13 2.6.6 Karbohidrat ... 13 2.6.7 Gula pereduksi ... 14 2.6.8 Peptida ... 14 2.6.9 Asam amino ... 15 3 METODOLOGI ... 16
3.1 Waktu dan Tempat ... 16
3.2 Alat dan Bahan ... 16
3.3 Identifikasi dan Pengambilan Sampel ... 17
3.5 Ekstraksi dan Evaporasi Komponen Antioksidan ... 20
3.5.1 Uji aktivitas antioksidan (DPPH) ... 22
3.5.2 Uji Fitokimia... 23
4 HASIL DAN PEMBAHASAN ... 25
4.1 Karakteristik Lili Laut (Comaster sp.) ... 25
4.2 Proksimat Lili Laut (Comaster sp.) ... 26
4.3 Hasil Ekstrak Komponen Bioaktif Lili Laut (Comaster sp.) ... 29
4.4 Aktivitas Antioksidan ... 30
4.5 Uji Fitokimia ... 36
5 KESIMPULAN DAN SARAN ... 39
5.1 Kesimpulan ... 39
5.2 Saran ... 39
DAFTAR PUSTAKA ... 40
DAFTAR GAMBAR
Halaman
1 Lili laut (Comaster sp.) ... 3
2 Morfologi Stalk Crinoid ... 4
3 Struktur DPPH dan DPPH tereduksi hesail reaksi dengan antioksidan ... 10
4 Diagram alir proses ekstraksi lili laut... 21
5 Lili laut yang diambil dari areal Pulau Pramuka ... 25
6 Nilai rata-rata rendemen ekstrak kasar lili laut ... 29
7 Grafik hubungan konsentrasi BHT dengan persen inhibisinya... 32
8 Hubungan konsentrasi dengan rata-rata persentase penghambatan ekstrak kasar lili laut...33
DAFTAR TABEL
Halaman
1 Alat dan bahan yang digunakan pada penelitian ... 16
2 Hasil pengamatan karakteristik fisik lili laut ... 25
3 Hasil uji proksimat lili laut ... 26
4 Hasil uji aktivitas antioksidan ... 31
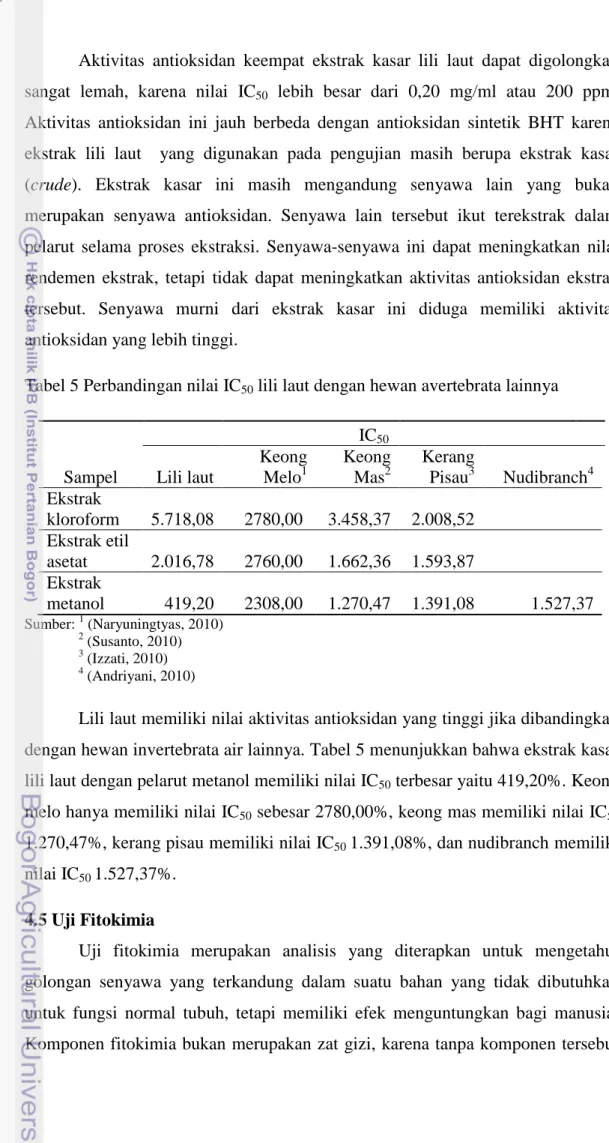
5 Perbandingan nilai IC50 dengan hewan avertebrata lainnya ... 35
6 Hasil uji fitokimia ekstrak kasar lili laut ... 36
DAFTAR LAMPIRAN
Halaman
1 Perhitungan analisis proksimat lili laut ... 45
2 Data rendemen ekstrak kasar lili laut ... 46
3 Perhitungan pembuatan larutan stok dan pengencerannya ... 47
4 Perhitungan persen inhibisi dan IC50... 48
1 PENDAHULUAN
1.1 Latar Belakang
Setiap orang memiliki keinginan untuk tetap sehat baik mental maupun fisik. Semakin majunya peradaban di dunia tidak hanya menimbulkan efek positif saja tetapi juga menimbulkan efek negatif yang memerlukan pemecahan masalah yang bersifat rasional dan ilmiah. Tingginya polusi udara dan kebiasaan mengkonsumsi makanan cepat saji yang tinggi akan zat aditif (sintetis) dapat memicu dihasilkannya radikal bebas yang mengakibatkan tingginya kemungkinan terjangkit penyakit degeneratif yaitu penuaan dini, diabetes, kanker dan tumor.
Antioksidan merupakan senyawa yang mampu menghambat oksidasi molekul lain. Senyawa antioksidan ini akan menyerahkan satu atau lebih elektronnya kepada radikal bebas sehingga dapat menghentikan kerusakan yang disebabkan oleh radikal bebas. Di dalam tubuh terdapat mekanisme antioksidan atau radikal bebas secara endogenik, tetapi bila jumlah radikal bebas dalam tubuh berlebih maka dibutuhkan antioksidan yang berasal dari luar tubuh (eksogenik) (Pratiwi et al. 2006).
Antioksidan sintetik yang berkembang saat ini dikhawatirkan memberi efek samping yang berbahaya bagi kesehatan manusia. Tubuh manusia mempunyai batasan maksimum dalam mentolerir seberapa banyak konsumsi bahan tambahan makanan setiap hari yang disebut Acceptability Daily Intake (ADI). Nilai ADI untuk BHT adalah sebesar 0-0,3 mg/kg per hari (JECFA 1999; D’Mello 2003 dalam Andayani 2008). Pemakaian antioksidan sintetik dalam waktu yang lama dan dalam dosis yang berlebihan dapat menyebabkan mutagenetik dan karsinogenetik (Darmawan 2009). Potensi antioksidan alami harus dikembangkan untuk memperoleh antioksidan yang baik untuk dikonsumsi. Salah satu sumber daya perairan yang berpotensi sebagai penghasil antioksidan alami adalah lili laut (Comaster sp.).
Lili laut (Comaster sp.) merupakan salah satu genus dari filum Echinodermata yang sampai saat ini masih sedikit sekali pemanfaatannya dan belum bernilai ekonomis penting. Bentuk tubuh dari lili laut sangatlah unik karena berbentuk seperti tanaman. Kelimpahan lili laut di sekitar pulau Pramuka
mencapai 3.142 ind/ha dan belum termanfaatkan dengan maksimal (FDC-IPB 2010). Pemanfaatan lili laut di Indonesia khususnya Kepulauan Seribu dapat dijadikan sebuah indikator suatu ekosistem terumbu karang. Hal ini telah dibuktikan dalam penilitian Yusri et al. (2005) bahwa lili laut memiliki kelimpahan maksimum di perairan yang masih baik, sedangkan pada perairan yang buruk lili laut tidak dapat hidup.
Penelitian mengenai kehidupan lili laut cukup banyak dilakukan pakar-pakar asing terutama untuk jenis lili laut yang hidup di terumbu karang (Aziz et al. 1990). Upaya untuk meningkatkan pengetahuan masyarakat Indonesia dan untuk meningkatkan nilai komersialitas dari lili laut adalah dengan melakukan penelitian mengenai antioksidan yang terkandung dari di dalam lili laut tersebut. Hal ini diharapkan dapat memperkaya informasi mengenai kandungan senyawa antioksidan lili laut yang dapat bermanfaat untuk bidang pangan, farmasi maupun industri lainnya.
1.2 Tujuan
Penelitian ini dilakukan untuk menentukan kandungan zat gizi (air, abu, lemak, protein, karbohidrat), aktivitas antioksidan dan komponen bioaktif yang terkandung dalam lili laut (Comaster sp.).
2 TINJAUAN PUSTAKA
2.1 Deskripsi dan Klasifikasi Lili Laut (Comaster sp.)
Lili laut atau Crinoidea adalah salah satu anggota filum Echinodermata. Bentuk tubuh dan penampilannya menyerupai tanaman lili atau pakis. Bagi orang awam lili laut mungkin dianggap sebagai flora laut, apalagi bagian tangannya (arms) mempunyai corak warna yang beraneka ragam, hijau, kuning, merah atau kombinasi dari dua atau lebih warna (Aziz et al. 1990). Klasifikasi lili laut (Comaster sp.) menurut Carpenter (1888) adalah sebagai berikut:
Kingdom : Animalia Filum : Echinodermata Subfilum : Crinozoa Kelas : Crinoidae Ordo : Comatulidae Famili : Comasteridae Subfamili : Comasterinae Genus : Comaster sp.
Gambar 1 Lili laut (Comaster multibrachiatus) Sumber : Collin & Arneson (1995)
Lili laut pada umumnya mempunyai cara dan kebiasaan makan yang sama dengan teripang, bulu babi, bintang laut, dan bintang mengular yaitu termasuk kedalam kelompok biota penyaring (filter feeders). Makanannya berupa plankton dan partikel melayang (Aziz et al. 1990).
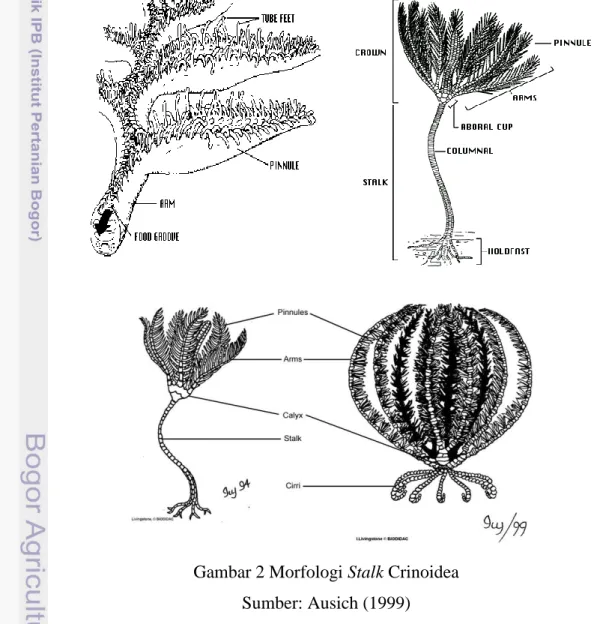
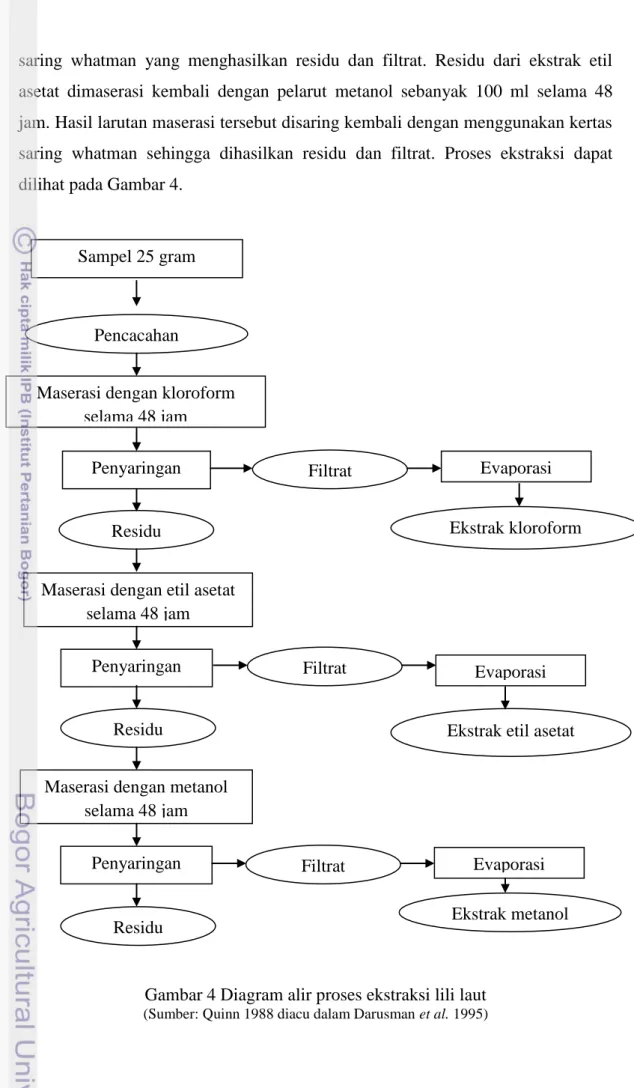
Hewan ini mirip tumbuhan, karena bentuknya menyerupai bunga lili. Kulitnya tersusun dari zat kitin. Biasanya melekat pada dasar perairan. Jika lingkungan tidak memungkinkan, misalnya makanan habis atau keselamatannya terancam, ia akan pindah ke tempat lain yang sesuai dan aman. Kelompok hewan ini juga sering disebut bintang bulu. Juga dikenal sebagai lili laut yaitu hewan yang mempunyai lengan bercabang serta anus dan mulut berada di permukaan oral, kaki tabungnya tidak mempunyai saluran penghisap, dan alur ambulakranya terbuka (Clark 1976). Bentuk dan morfologi dari lili laut dapat dilihat pada Gambar 2 berikut ini.
Gambar 2 Morfologi Stalk Crinoidea Sumber: Ausich (1999)
Lili laut sebagaimana anggota filum Echinodermata lainnya mempunyai susunan tubuh bersimetri lima (pentraradial simetri), tubuh berbentuk cakram (disk) di dalamnya terdapat sistem pencernaan, sistem respirasi dan sistem saraf. Tubuh dilindungi oleh lempeng kapur berbentuk perisai (osscles). Mulut dan anus terletak di sisi yang sama yaitu di sisi oral. Anggota suku Comasteridae yang mulutnya terletak di pertengahan dari disk disebut sebagai kondisi endocyclic, sedangkan yang mulutnya terletak pada posisi tepi dari disk disebut kondisi exocyclic. Dari disk tumbuh lima tangan (arms) atau lebih. Percabangan tangan bisa berupa percabangan ganda atau semi ganda, atau berupa percabangan tak beraturan, sehingga pada kenyataannya lili laut mempunyai lebih dari 10 tangan, biasanya berkisar 10 sampai 200 tangan (Clark 1976).
2.2 Radikal Bebas
Radikal bebas merupakan hasil samping dari proses oksidasi atau proses metabolisme organisme aerobik. Pada sistem pertahanan tubuh, radikal bebas berperan untuk melawan virus dan bakteri yang masuk ke dalam tubuh. Radikal bebas yang dihasilkan berlebihan, dapat mengakibatkan kerusakan karena sifat molekul ini sangat reaktif. Molekul radikal bebas sangat mudah bereaksi dengan molekul lain dengan cara mengoksidasi sehingga dapat menimbulkan pengaruh negatif terhadap tubuh antara lain mengakibatkan kerusakan lipida, protein, DNA dan membran sel. Kerusakan-kerusakan tersebut dapat memicu timbulnya penyakit degeneratif yaitu kanker, aterosklerosis, diabetes, dan tekanan darah tinggi (Santoso et al. 2010). Berbagai kemungkinan dapat terjadi sebagai akibat kerja radikal bebas, misalnya gangguan fungsi sel, kerusakan struktur sel, molekul termodifikasi yang tidak dapat dikenali oleh sistem imun, dan bahkan mutasi. Semua bentuk gangguan tersebut dapat memicu munculnya berbagai penyakit (Winarsi 2007).
Radikal bebas memiliki reaktivitas yang sangat tinggi. Reaktivitas radikal bebas merupakan upaya untuk mencari pasangan elektron. Dampak dari kerja radikal bebas akan terbentuk radikal bebas baru yang berasal dari atom atau molekul yang elektronnya diambil untuk berpasangan dengan radikal sebelumnya. Bila dua senyawa radikal bertemu, elektron-elektron yang tidak berpasangan dari kedua senyawa tersebut akan bergabung dan membentuk ikatan kovalen yang
stabil. Sebaliknya, bila senyawa radikal bebas bertemu dengan senyawa yang bukan radikal bebas akan terjadi tiga kemungkinan, yaitu (1) radikal bebas akan memberikan elektron yang tidak berpasangan (reduktor) kepada senyawa bukan radikal bebas, (2) radikal bebas menerima elektron (oksidator) dari senyawa bukan radikal bebas, (3) radikal bebas bergabung dengan senyawa bukan radikal bebas (Winarsi 2007).
Mekanisme reaksi radikal bebas digambarkan sebagai suatu deret reaksi-reaksi bertahap. Mekanisme reaksi-reaksi tersebut dibagi menjadi tiga tahapan yaitu pembentukan awal radikal bebas (inisiasi), perambatan atau terbentuknya radikal baru (propagasi) dan tahap terakhir (terminasi), yaitu pemusnahan atau
pengubahan menjadi radikal bebas stabil dan tak reaktif (Fessenden dan Fessenden 1986).
Radikal bebas yang terdapat dalam endotel akan bereaksi dengan nitrit oksida menjadi peroksinitrit, yang merupakan prooksidan reaktif dan menyebabkan kerusakan sel endotel. Kerusakan sel endotel pembuluh darah di seluruh tubuh akan menimbulkan berbagai komplikasi (Winarsi 2007), yaitu:
a. Penurunan daya penglihatan yang berakhir dengan kebutaan, jika kerusakan itu terjadi pada retina mata.
b. Gangguan fungsi ginjal yang berakhir dengan gagal ginjal tahap akhir yang memerlukan hemodialisis, jika terjadi pada ginjal.
c. Penuruna daya tahan tubuh terhadap infeksi.
d. Meningkatnya resiko penyakit jantung koroner dan stroke. 2.3 Antioksidan
Antioksidan merupakan senyawa pemberi elektron (electron donor) atau reduktan. Senyawa ini memiliki berat molekul kecil, tetapi mampu menginteraksi berkembangnya reaksi oksidasi, dengan cara mencegah terbentuknya radikal. Antioksidan juga merupakan senyawa yang dapat menghambat reaksi oksidasi, dengan mengikat radikal bebas dan molekul yang sangat reaktif. Akibatnya, kerusakan sel akan dihambat (Winarsi 2007).
Antioksidan sangat bermanfaat baik untuk mempertahankan mutu produk pangan maupun untuk kesehatan tubuh. Antioksidan dalam tubuh akan menggangu mekanisme kerja pembentukan radikal bebas dan juga akan
menghambat oksidasi atau reaksi rantai radikal bebas, sehingga berbagai penyakit degeneratif, misalnya katarak, kanker dan proses penuaan dapat dihambat dengan antioksidan, baik yang diperoleh dari luar maupun dari melalui metabolisme tubuh (Niwa 1997).
Berdasarkan sumbernya, antioksidan digolongkan menjadi antioksidan alami dan antioksidan buatan (sintetik). Antioksidan yang sering digunakan pada bahan pangan umumnya berasal dari alam (natural antioxidant), misalnya asam sitrat, askorbat, dan tartarat, karoten, lesitin, asam maleat, dan gum guaiak. Pemakaian antioksidan buatan dalam bahan pangan harus lebih hati-hati karena banyak diantaranya yang menyebabkan keracunan pada dosis tertentu. Contoh antioksidan sintetik yang dijinkan untuk makanan adalah Butil Hidroksi Anisol (BHA), Butil Hidroksi Toluen (BHT), propil galat, Tert-Butil Hidroksi Quinon (TBHQ), dan tokoferol. Biasanya penggunaan antioksidan buatan untuk tujuan pangan diatur oleh pemerintah (Ketaren 1986).
Antioksidan bereaksi melalui pemberian senyawa oksigen reaktif atau penurunan konsentrasinya secara lokal, pembersihan ion logam katalitik, pembersihan radikal bebas yang berfungsi sebagai insiator, misal hidroksil, peroksil, alkoksil, pemutus rantai reaksi yang diinisiasi oleh radikal bebas dan peredam reaksi serta pembersih singlet oksigen (Pratt 1992).
Mekanisme penghambatan oksidasi lemak oleh antioksidan yaitu dengan mengurangi peroksida yang dapat merangsang terjadinya proses ketengikan yang terbentuk pada permulaan autooksidasi. Kemungkinan lain, antioksidan akan dioksidasi secara langsung atau saling mempengauhi dengan peroksida, sehinga dengan demikian mencegah oksidasi langsung atau tidak langsung dengan memutuskan rantai reaksi pembentukan gugus peroksida (Gordon 1990 dalam Trilaksani 2003). Kemungkinan selanjutnya, molekul aktif dari lemak bereaksi dengan oksigen menghasilkan peroksida aktif. Kemudian peroksida aktif memberikan energinya lagi kepada molekul lemak yang lain sehingga terbentuk reaksi berantai. Dengan adanya zat penghambat oksidasi (antioksidan), sejumlah peroksida yang aktif dipisahkan dari rantai reaksi dengan memindahkan energinya kepada antioksidan. Molekul aktif dari antioksidan akan teroksidasi dan menjadi lemak (Goutora et al. 1980).
2.4 Mekanisme Antioksidan
Antioksidan yang baik akan bereaksi dengan radikal bebas segera setelah senyawa tersebut terbentuk. Mekanisme antioksidan dalam menghambat oksidasi atau menghentikan reaksi berantai pada radikal bebas dari lemak yang teroksidasi, dapat disebabkan oleh empat macam mekanisme reaksi, yaitu pelepasan hidrogen dari antioksidan, pelepasan elektron dari antioksidan, adisi lemak ke dalam cincin aromatik pada antioksidan, dan pembentukan senyawa kompleks antara lemak dan cincin aromatik dari antioksidan (Ketaren 1986).
Antioksidan dikelompokkan menjadi tiga berdasarkan fungsi dan mekanismenya, yaitu antioksidan primer, antioksidan sekunder, dan antioksidan tersier.
2.4.1 Antioksidan primer
Antioksidan primer disebut juga antioksidan enzimatis. Suatu senyawa dikatakan sebagai antioksidan primer, apabila dapat memberikan atom hidrogen secara cepat kepada senyawa radikal, kemudian radikal antioksidan yang terbentuk segera berubah menjadi senyawa yang lebih stabil (Winarsi 2005 dalam Algameta 2009). Antioksidan primer bekerja dengan cara mencegah pembentukan senyawa radikal bebas yang telah terbentuk menjadi molekul yang kurang reaktif (Belleville-Nabet 1996 dalam Algameta 2009).
Antioksidan ini berfungsi untuk mencegah terbentuknya radikal bebas baru karena dapat mengubah radikal bebas menjadi molekul yang berkurang dampak negatifnya sebelum sempat bereaksi (Winarsi 2005 dalam Algameta 2009). Tubuh dapat menghasilkan antioksidan berupa enzim yang aktif bila didukung oleh nutrisi pendukung atau mineral yang disebut juga kofaktor. Antioksidan primer yang berperan sebagai kofaktor yaitu:
a. Superoksida dismutase (SOD)
Antioksidan ini merupakan enzim yang bekerja bila ada mineral-mineral misalnya tembaga, mangan yang bersumber pada kacang-kacangan, dan padi-padian.
b. Glutathione peroksidase
Enzim tersebut mendukung aktivitas enzim SOD bersama-sama dengan enzim katalase dan menjaga konsentrasi oksigen akhir agar stabil dan tidak
berubah menjadi pro-oksidan. Glutathione sangat penting sekali melindungi selaput-selaput sel.
c. Katalase
Enzim katalase selain mendukung aktivitas enzim SOD juga dapat mengkatalisa perubahan berbagai macam peroksida dan radikal bebas menjadi oksigen dan air (Arulselvan dan Subramanian 2007 dalam Algameta 2009).
2.4.2 Antioksidan sekunder
Antioksidan sekunder merupakan senyawa yang berfungsi menangkap radikal bebas dan mencegah terjadinya reaksi berantai sehingga tidak terjadi kerusakan yang lebih besar. Contoh antioksidan sekunder adalah vitamin E, vitamin C, dan betakaroten yang dapat diperoleh dari buah-buahan (Winarsi 2005 dalam Algameta 2009).
Antioksidan sekunder disebut juga antioksidan eksogenus atau non-enzimatis. Antioksidan dalam kelompok ini juga disebut sistem pertahanan preventif. Antioksidan non-enzimatis dapat berupa komponen non-nutrisi dan komponen nutrisi dari sayuran dan buah-buahan. Kerja sistem antioksidan non-enzimatik yaitu dengan cara memotong reaksi oksidasi berantai dari radikal bebas atau dengan cara menangkapnya. Akibatnya, radikal bebas tidak akan bereaksi dengan komponen seluler (Lampe 1999 dalam Winarsi 2007).
Antioksidan sekunder (antioksidan pencegah) didefinisikan sebagai suatu senyawa yang dapat memperlambat laju reaksi autooksidasi lipid. Antioksidan ini bekerja dengan berbagai mekanisme, antara lain mengikat ion metal, menangkap oksigen, memecah hidroperoksida ke bentuk-bentuk non radikal menyerap radiasi UV atau mendeaktifkan singlet oksigen. Contoh yang populer dari antioksidan sekunder ini adalah vitamin E, vitamin C, dan betakaroten (Kumalaningsih 2006). 2.4.3 Antioksidan tersier
Antioksidan tersier merupakan senyawa yang memperbaiki sel-sel dan jaringan yang rusak karena serangan radikal bebas. Biasanya yang termasuk kelompok ini adalah enzim (Winarsi 2005). Biasanya yang termasuk golongan ini adalah enzim metionin sulfoksidan reduktase yang dapat memperbaiki DNA dalam inti sel. Enzim tersebut bermanfaat untuk perbaikan DNA pada penderita kanker (Kumalaningsih 2006).
2.5 Uji Aktivitas Antioksidan
Metode yang umum digunakan untuk menguji aktivitas antioksidan suatu bahan adalah menggunakan radikal bebas diphenylpicrylhydrazyl (DPPH). DPPH adalah radikal bebas yang bersifat stabil dan beraktivitas dengan cara mendelokasi elektron bebas pada suatu molekul, sehingga molekul tersebut tidak reaktif sebagaimana radikal bebas yang lain. Proses delokasi ini ditunjukkan dengan adanya warna ungu (violet) pekat yang dapat dikarakterisasi pada pita absorbansi dalam pelarut etanol pada panjang gelombang 520 nm (Molyneux 2004).
Pengukuran aktivitas antioksidan dengan metode DPPH menggunakan prinsip spektrofotometri. Senyawa DPPH (dalam metanol) berwarna ungu tua terdeteksi pada panjang gelombang sinar tampak sekitar 517 nm. Suatu senyawa dapat dikatakan memiliki aktivitas antioksidan apabila senyawa tersebut mampu mendonorkan atom hidrogennya untuk berikatan dengan DPPH membentuk DPPH tereduksi, ditandai dengan semakin hilangnya warna ungu (menjadi kuning pucat) (Molyneux 2004). Struktur DPPH dan DPPH tereduksi hasil reaksi dengan antioksidan dapat dilihat pada Gambar 3.
Diphenylpicrylhydrazyl (radikal bebas) Diphenylpicrylhydrazine (non radikal)
Gambar 3 Struktur DPPH dan DPPH tereduksi hasil reaksi dengan antioksidan Parameter untuk menginterpretasikan hasil pengujian dengan metode DPPH adalah IC50 (inhibition concentration). IC50 merupakan konsentrasi larutan
substrat atau sampel yang akan menyebabkan reduksi terhadap aktivitas DPPH sebesar 50% (Molyneux 2004). Semakin kecil nilai IC50 berarti semakin tinggi
aktivitas antioksidan. Secara spesifik suatu senyawa dikatakan sebagai antioksidan sangat kuat jika nilai IC50 kurang dari 0,05 mg/ml, kuat untuk IC50
antara 0,05-0,10 mg/ml, sedang jika IC50 bernilai 0,10-0,15 mg/mldan lemah jika
2.6 Senyawa Fitokimia
Fitokimia adalah senyawa bioaktif yang terdapat dalam tumbuhan dan dapat memberikan kesehatan pada tubuh manusia. Fitokimia mempunyai peran penting dalam penelitian obat yang dihasilkan dari tumbuh-tumbuhan. Pada tumbuhan terdapat senyawa kimia bermolekul kecil yang penyebarannya terbatas dan sering disebut sebagai metabolit sekunder (Sirait 2007).
2.6.1 Alkaloid
Alkaloid adalah golongan terbesar dari senyawa hasil metabolisme sekunder yang terbentuk berdasarkan prinsip pembentukan campuran (Sirait 2007). Senyawa alkaloid mencakup senyawa bersifat basa yang mengandung satu atau lebih atom nitrogen sebagai bagian dari sistem siklik. Alkaloid yang mengandung cincin heterosiklik biasanya disebut alkaloid sejati, sedangkan yang tidak mengandung cincin heterosiklik disebut protoalkaloid. Keduanya merupakan turunan dari asam amino (Harborne 1987)
Alkaloid umumnya tanwarna, bersifat optis aktif, dan sebagian besar berbentuk kristal hanya sedikit yang berupa cairan. Alkaloid banyak ditemukan pada bagian tumbuhan yaitu biji, daun, ranting, serat kayu. Alkaloid terakumulasi pada jaringan yang tumbuh aktif yakni epidermis, hipodermis, dan kelenjar lateks. Fungsi alkaloid pada tumbuhan belum dapat dinyatakan dengan pasti akan tetapi beberapa senyawa berperan sebagai pengatur pertumbuhan dan pemikat serangga (Suradikusumah 1989).
2.6.2 Triterpenoid/Steroid
Triterpenoid merupakan senyawa yang kerangka karbonnya berasal dari enam satuan isoprene dan secara biosintesis diturunkan dari hidrokarbon C30
asiklik, yaitu skualena. Senyawa ini berstruktur siklik yang umumnya berupa alkohol, aldehida, atau asam karboksilat. Senyawa tersebut tidak berwarna, kristalin, memiliki titik lebur yang tinggi, dan umumya sulit untuk dikarakterisasi karena secara kimia tidak reaktif (Harborne 1987). Triterpenoid terbagi menjadi empat golongan senyawa berupa triterpena sebenarnya, steroid, saponin, dan glikosida jantung. Kedua golongan terakhir disebut triterpenoid esensial atau steroid yang umumnya terdapat dalam tanaman sebagai glikosida (Sirait 2007).
Steroid merupakan triterpena yang kerangka dasarnya sistem cincin siklopentana perhidrofenantrena. Pada awalnya, steroid diduga merupakan senyawa yang hanya terdapat pada hewan (sebagai hormon seks, asam empedu, dan lain-lain). Tetapi akhir-akhir ini ditemukan senyawa semacam ini pada jaringan tumbuhan yang dikenal dengan fitosterol (Sirait 2007).
2.6.3 Flavonoid
Flavonoid merupakan senyawa fenol terbanyak yang ditemukan di alam. Flavonoid banyak ditemukan pada tumbuhan tingkat tinggi tetapi tidak dalam mikroorganisme. Senyawa ini menjadi zat warna merah, ungu, biru, dan kuning dalam tumbuhan. Flavonoid memiliki kerangka dasar yang terdiri dari 15 atom karbon, dimana dua cincin benzene terikat pada suatu rantai propane membentuk susunan C6-C3-C6 (Suradikusumah 1989).
Flavonoid umumnya terdapat pada tumbuhan sebagai glikosida dan terdapat pada seluruh bagian termasuk pada buah, tepung sari, dan akar. Flavonoid diklasifikasikan menjadi sebelas golongan yaitu flavon, flavonol, flavanon, flavanonol, calkon, dihidrokalkon, auron, antosianidin, katekin, dan flavan-3,4-diol (Sirait 2007). Flavonoid dapat larut dalam air, dan dapat terekstraksi dengan etanol 70% (Suradikusumah 1989).
Flavonoid memiliki banyak kegunaan baik bagi tumbuhan maupun manusia. Flavonoid digunakan tumbuhan sebagai penarik serangga dan binatang lain untuk membantu proses penyerbukan dan penyebaran biji. Sedangkan bagi manusia, dalam dosis kecil flavon bekerja sebagai stimulan pada jantung, dan flavon yang terhidroksilasi bekerja sebagai diuretik dan sebagai antioksidan pada lemak (Sirait 2007).
2.6.4 Saponin
Saponin adalah glikosida triterpena dan sterol yang telah terdeteksi dalam lebih dari 90 suku tumbuhan. Saponin merupakan senyawa aktif permukaan, bersifat seperti sabun, serta dapat dideteksi berdasarkan kemampuannya membentuk busa dan menghemolisis sel darah. Pencarian saponin dalam tumbuhan telah dirangsang oleh kebutuhan akan sumber sapogenin yang mudah diperoleh dan dapat diubah menjadi sterol hewan yang berkhasiat penting. Pola
glikosida saponin kadang rumit, banyak saponin yang mempunyai satuan gula sampai lima dan komponen yang umum ialah asam glukuronat (Harborne 1987).
Sebagian besar saponin bereaksi netral (larut dalam air), beberapa ada yang bereaksi asam (sukar larut dalam air), dan sebagian kecil ada yang bereaksi basa. Saponin dapat membentuk senyawa kompleks dengan kolesterol. Saponin bersifat toksik terhadap ikan dan binatang berdarah dingin lainnya. Hal inilah yang menyebabkan saponin banyak dimanfaatkan sebagai racun ikan. Saponin yang beracun disebut sapotoksin (Sirait 2007).
Saponin menyebabkan stimulasi pada jaringan tertentu misalnya, pada epitel hidung, bronkus, ginjal, dan sebagainya. Stimulasi pada ginjal dapat menimbulkan efek diuretika. Sifat menurunkan tegangan muka yang ditimbulkan oleh saponin dapat dihubungkan dengan daya ekspektoransia. Dengan sifat ini lendir akan dilunakkan atau dicairkan. Saponin dapat mempertinggi resorpsi berbagai zat oleh aktivitas permukaan serta dapat meregang partikel (Sirait 2007). 2.6.5 Fenol hidrokuinon
Kuinon merupakan senyawa berwarna dan memiliki kromofor dasar. Kuinon dapat diidentifikasikan berdasarkan tujuannya menjadi empat kelompok yaitu, benzokuinon, naftokuinon, antrakuinon, dan kuinon isoprenoid. Tiga kelompok pertama umumnya terhidroksilasi dan sering terdapat dalam sel sebagai glikosida atau dalam bentuk kuinon tanpa warna, dan juga bentuk dimer. Iso prenoid kuinon terlihat dalam respirasi sel (ubikuinon) dan fotosintesis (plastokuinon) yang secara umum terdapat dalam tumbuhan (Suradikusumah 1989).
Senyawa kuinon yang terdapat sebagai glikosida sedikit larut dalam air, kuinon lebih mudah larut dalam lemak dan akan terekstraksi dalam tumbuhan bersama-sama dengan karotenoid dan klorofil. Reaksi yang khas adalah reduksi bolak-balik yang mengubah kuinon menjadi senyawa tanpa warna, kemudian warna kembali lagi bila terjadi oksidasi oleh udara. Reduksi dapat dilakukan dengan menggunakan natrium borohidrida (Harbone 1987).
2.6.6 Karbohidrat
Karbohidrat atau gula merupakan konstituen yang paling banyak jumlahnya dibandingkan dengan kandungan kimia lainnya yang terdapat dalam
tanaman dan hewan. Karbohidrat terbentuk melalui proses fotosintesis pada tanaman. Zat tersebut dapat diubah menjadi senyawa kimia organik lain yang diperlukan tanaman (Sirait 2007).
Karbohidrat dikelompokkan menjadi tiga golongan berdasarkan ukuran molekulnya, yaitu monosakarida sederhana misalnya glukosa, fruktosa, dan turunannya; oligosakarida yang terbentuk melalui penggabungan atau kondensasi dua atau lebih monosakarida; dan polisakarida yang terdiri atas satuan monosakarida berantai panjang, disambungkan dengan cara kepala ke ekor berbentuk rantai lurus atau bercabang (Harborne 1987). Karbohidrat berguna sebagai penyimpan energi yaitu pati, dan juga berguna sebagai pengangkut energi yakni sukrosa, dan sebagai penyusun dinding sel yakni selulosa (Sirait 2007). 2.6.7 Gula pereduksi
Sifat pereduksi dari suatu molekul gula ditentukan oleh ada atau tidaknya gugus hidroksil (OH) bebas yang reaktif. Gugus hidroksil yang reaktif pada glukosa (aldosa) biasanya terletak pada karbon nomor satu (anomerik), sedangkan pada fruktosa (ketosa) terletak pada karbon nomor dua. Sukrosa tidak mempunyai gugus OH bebas yang reaktif karena keduanya sudah saling terikat, sedangkan laktosa mempunyai OH bebas pada atom C nomor satu pada gugus glukosanya (Winarno 1997).
Sifat sebagai reduktor pada monosakarida dan beberapa disakarida disebabkan oleh adanya gugus aldehida atau keton bebas dalam molekul karbohidrat. Sifat ini dapat digunakan untuk keperluan identifikasi karbohidrat maupun analisis kuantitatif. Pereaksi Benedict berupa larutan yang mengundang kuprisulfat, natrium karbonat dan natrium sitrat. Glukosa dapat mereduksi ion Cu2+ dari kuprisulfat menjadi ion Cu2+ yang kemudian mengendap sebagai Cu2O.
Adanya natrium karbonat dan natrium sitrat membuat pereaksi Benedict bersifat basa lemah. Endapan yang terbentuk dapat berwarna hijau, kuning atau merah bata. Warna endapan ini tergantung pada konsentrasi karbohidrat yang diperiksa (Poedjiadi 1994).
2.6.8 Peptida
Peptida merupakan hasil polikondensasi asam amino. Gugus karbonil dari satu asam amino berikatan dengan gugus asam amino lain membentuk ikatan
amida atau ikatan peptida. Pengertian peptida biasanya untuk menyatakan polimer yang memiliki berat molekul lebih rendah dari 5000. Peptida dapat dihidrolisis sebagian menjadi protein, juga senyawa yang mengandung asam amino non-protein (Sastrohamidjojo 1996).
Dipeptida diturunkan dari dua asam amino tripeptida dari tiga asam amino, dan seterusnya. Siklisasi dipeptida menghasilkan 2,5-dioksopi-perazin dan senyawa sejenisnya sering disintesis oleh mikroorganisme (Sastrohamidjojo 1996). Dipeptida masih mempunyai gugus amino dan karboksil bebas sehingga dapat bereaksi dengan dipeptida-dipeptida lain membentuk polipeptida dan akhirnya membentuk molekul protein (Winarno 1997).
2.6.9 Asam amino
Asam amino merupakan komponen penyusun protein yang dihubungkan oleh ikatan peptida. Struktur asam amino secara umum adalah satu atom C yang mengikat empat gugus, yaitu gugus amina (NH2), gugus karboksil (COOH), atom
hidrogen (H), dan satu gugus sisa (R dari Residu) atau disebut juga gugus rantai samping yang membedakan satu asam amino dengan asam amino lainnya (Winarno 2008).
Asam amino memiliki atom C pusat yang mengikat empat gugus yang berbeda, maka asam amino memiliki dua konfigurasi yaitu konfigurasi D dan konfigurasi L. Molekul asam amino mempunyai konfigurasi L apabila gugus –NH2 terdapat di sebelah kiri atom karbon α dan bila posisi gugus NH2 di sebelah
kanan, maka molekul asam amino disebut asam amino konfigurasi D (Lehninger 1990).
Asam amino biasanya larut dalam air dan tidak larut dalam pelarut non polar misalnya eter, aseton, dan kloroform. Asam amino khususnya diklasifikasikan berdasarkan sifat kimia rantai samping tersebut menjadi empat kelompok. Rantai samping dapat membuat asam amino bersifat basa lemah, asam lemah, hidrofilik jika polar dan hidrofobik jika nonpolar (Almatsier 2006).
3 METODOLOGI
3.1 Waktu dan Tempat
Penelitian dilaksanakan pada bulan Maret sampai Mei 2010. Penelitian dilakukan di Laboratorium Karakteristik Bahan Baku, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan; Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan; Laboratorium Biokimia Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan; Laboratorium Bioteknologi Hasil perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan; dan Laboratorium Biologi- Pusat Antar Universitas, Institut Pertanian Bogor.
3.2 Alat dan Bahan
Alat dan bahan yang digunakan pada saat pengambilan sampel, uji proksimat, ekstraksi dan evaporasi, uji DPPH, dan uji fitokimia dapat dilihat pada Tabel 1.
Tabel 1 Alat dan bahan yang digunakan pada penelitian
Tahapan Alat Bahan
1. Pengambilan sampel Scuba diving Es batu Foto bawah air Etanol Gelas kaca
Kertas label Timabangan digital
Cool box
Penjepit kayu
2. Uji Proksimat Oven n-heksana p.a.
Kapas bebas lemak Akuades
Cawan porselan Kjeltab jenis selenium Desikator H2SO4 p.a. pekat Tanur pengabuan H3BO3 (asam borat) Labu kjehdal
Destilator
Kertas saring Whatman 42 Gegep
3. Ekstraksi dan Evaporasi Erlenmeyer Kloroform
Gelas ukur Etil asetat
Orbital shaker Metanol Kertas saring Whatman 42
Corong kaca Gelas piala Botol kaca Sudip
Rotary vaccum evaporator
Kapas bebas lemak
4. Uji DPPH Tabung reaksi Ekstrak kloroform lili laut Pipet mikro Ekstrak etil asetat lili laut Kapas bebas lemak Ekstrak metanol lili laut Spektrofotometer UV-VIS Ekstrak etanol lili laut
Vortex Metanol
Inkubator Kristal DPPH
Labu takar Butylated Hydroxytoluena Pipet tetes
Corong kaca
Botol kaca
5. Uji Fitokimia Botol kaca H2SO4 pekat
Gelas ukur Kloroform
Kompor listrik Serbuk magnesium Tabung reaksi Amil alkohol
Pipet HCl 2N
Sudip Etanol 70%
Gegep FeCl3 5%
Penangas air Pereaksi Wagner Pereaksi Meyer Pereaksi Dragendroff Pereaksi Molisch Pereaksi Benedict Pereaksi Biuret Larutan ninhidrin 0,1% Anhidra asetat
3.3 Identifikasi dan Pengambilan Sampel
Sampel lili laut diambil di areal dramaga Pulau Pramuka, Kepulauan Seribu, DKI Jakarta pada tanggal 1 April 2010 pukul 16.30 WIB. Spesies lili laut
diidentifikasi dengan melihat penampakan, bentuk, warna, jumlah arms dan segment cirrus dan disesuaikan dengan buku identifikasi yang berjudul Tropical Pasific Invertebrate (Collin dan Arnesson 1995), A monograph on the existing crinoid (Clark 1971) dan menggunakan media internet yaitu Identifikasi Comaster sp. (Carpenter 1888).
Sampel lili laut yang diambil dibagi menjadi dua bagian untuk analisis proksimat dan ekstraksi yang akan digunakan untuk uji aktivitas antioksidan serta fitokimia. Lili laut yang digunakan untuk proksimat sebanyak 200 gram disimpan ke dalam cool box yang berisi es agar sampel tersebut tetap segar. Sedangkan sampel yang digunakan untuk ekstraksi disimpan dalam larutan etanol 100 ml dengan berat sampel 25 gram tanpa adanya pemotongan dan disimpan selama 1 minggu. Larutan etanol yang berfungsi sebagai media transportasi diekstraksi dan dievaporasi untuk diuji aktivitas antioksidan serta fitokimia guna mengetahui aktivitas antioksidan dan komponen bioaktif yang terdapat dari larutan etanol. 3.4 Analisis Proksimat
Sampel lili laut basah dihaluskan kemudian dilakukan pengujian proksimat. Analisis proksimat yang dilakukan terhadap lili laut meliputi uji kadar air, uji kadar abu, uji kadar lemak menggunakan metode sokhlet, dan uji kadar protein menggunakan metode kjeldahl.
1) Analisis kadar air (AOAC 2005)
Penentuan kadar air didasarkan pada berat contoh sebelum dan sesudah dikeringkan. Cawan kosong dikeringkan di dalam oven selama ±30 menit pada suhu 105 oC, lalu dimasukkan ke dalam desikator selama 15 menit kemudian ditimbang. Sampel sebanyak 1-2 gram dimasukkan ke dalam cawan lalu dikeringkan di dalam oven pada suhu 100-102 oC selama 6 jam dan kemudian cawan dimasukkan ke dalam desikator selama 30 menit dan selanjutnya ditimbang kembali. Kadar air ditentukan dengan rumus:
% Kadar air = B - C x 100% B - A
Keterangan: A = Berat cawan kosong (gram)
B = Berat cawan dengan lili laut (gram)
2) Analisis kadar abu (AOAC 2005)
Cawan dibersihkan dan dikeringkan di dalam oven selama 30 menit dengan suhu 105 oC, lalu dimasukkan ke dalam desikator dan kemudian ditimbang. Sampel sebanyak 1-2 gram ditimbang lalu dimasukkan ke dalam cawan dan kemudian dibakar di atas kompor listrik (diarangkan) sampai tidak berasap lagi dan selanjutnya dimasukkan ke dalam tanur pengabuan (600 oC) ± 6 jam. Cawan dimasukkan ke dalam desikator lalu ditimbang. Kadar abu ditentukan dengan rumus:
% Kadar abu = Berat abu x 100% Berat sampel
3) Analisis kadar lemak (AOAC 2005)
Lili laut seberat 2 gram (W1) diletakkan di atas kapas bebas lemak lalu
dimasukkan ke dalam kertas saring dan selanjutnya dimasukkan ke dalam selongsong lemak, kemudian dimasukkan ke dalam labu lemak yang sudah ditimbang berat kosongnya (W2) dan disambungkan dengan tabung soxhlet.
Selongsong lemak dimasukkan ke dalam ruang ekstraktor tabung soxhlet dan disiram dengan pelarut lemak (n-heksana). Tabung ekstraksi dipasang pada alat destilasi soxhlet lalu dipanaskan pada suhu 40 0C dengan menggunakan pemanas listrik dan direfluks selama 6 jam. Pelarut lemak yang ada dalam labu lemak didestilasi hingga semua pelarut lemak menguap. Pada saat destilasi pelarut akan tertampung di ruang ekstraktor, pelarut dikeluarkan sehingga tidak kembali ke dalam labu lemak, selanjutnya labu lemak dikeringkan dalam oven pada suhu 105 0C, setelah itu labu dimasukkan ke dalam desikator hingga beratnya konstan lalu ditimbang (W3). Perhitungan kadar lemak pada lili laut:
% Kadar Lemak = W3-W2 x 100%
W1
Keterangan : W1 = Berat sampel lili laut (gram)
W2 = Berat labu lemak tanpa lemak (gram)
W3 = Berat labu lemak dengan lemak (gram)
4) Analisis kadar protein (AOAC 1980)
Analisis kadar protein terdiri dari tiga tahap, yaitu destruksi, destilasi, dan titrasi. Pengukuran ini dilakukan dengan metode kjeldahl. Sampel lili laut
ditimbang sebanyak 2 gram, kemudian dimasukkan ke dalam labu kjeldahl 50 ml, lalu ditambahkan 7 g K2SO4 kjeltab 0,005 g jenis HgO, 15 ml H2SO4 pekat dan 10
ml H2O2 ditambahkan secara perlahan ke dalam labu dan didiamkan selama 10
menit di ruang asam. Sampel didestruksi pada suhu 410 0c selama kurang lebih 2 jam atau sampai cairan berwarna hijau bening. Labu kjeldahl dicuci dengan aquades 50 hingga 70 ml, kemudian air tersebut dimasukkan ke dalam alat destilasi. Hasil destilasi ditampung dalam erlenmeyer 125 ml yang berisi 25 ml asam borat (H3BO3) 4% yang mengandung indikator bromcherosol green 0,1%
dan methyl red 0,1% dengan perbandingan 2:1. Destilasi dilakukan dengan menambahkan 50 ml larutan NaOH-Na2S2O3 ke dalam alat destilasi hingga
tertampung 100-150 ml destilat di dalam erlenmeyer dengan hasil destilat berwarna hijau. Lalu destilat dititrasi dengan HCl 0,2 N sampai terjadi perubahan warna merah muda yang pertama kalinya. Volume titran dibaca dan dicatat. Kadar protein dihitung dengan rumus sebagai berikut :
N ml HCl ml blanko N HCl 4,00
mg contoh faktor koreksi alat* 00 *) Faktor koreksi alat = 2,5
Kadar Protein N faktor konversi*
*) Faktor Konversi = 6,25
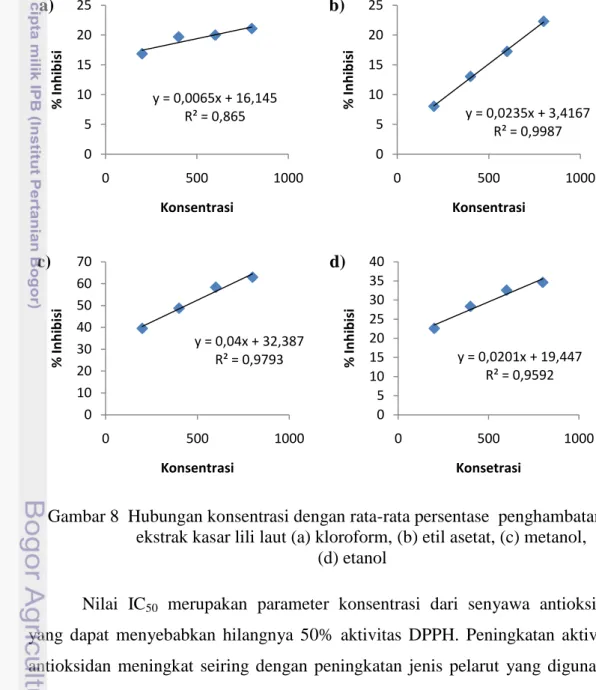
3.5 Ekstraksi dan Evaporasi Komponen Antioksidan
Ekstraksi komponen antioksidan dilakukan dengan menghasilkan ekstrak kasar terlebih dahulu. Komponen antioksidan diperoleh melalui ekstraksi bertingkat dengan menggunakan tiga jenis pelarut. Pelarut yang digunakan yaitu pelarut non polar (kloroform), pelarut semi polar (etil asetat), pelarut polar (metanol). Sampel lili laut yang disimpan dalam larutan etanol di hancurkan sampai halus sebanyak 25 gram dan dimaserasi dengan menggunakan pelarut kloroform sebanyak 100 ml selama 48 jam. Hasil maserasi yang berupa larutan disaring dengan menggunakan kertas saring whatman sehingga dihasilkan residu dan filtrat. Residu yang dihasilkan dimaserasi selama 48 jam menggunakan 100 ml pelarut etil asetat, kemudian disaring kembali dengan menggunakan kertas
saring whatman yang menghasilkan residu dan filtrat. Residu dari ekstrak etil asetat dimaserasi kembali dengan pelarut metanol sebanyak 100 ml selama 48 jam. Hasil larutan maserasi tersebut disaring kembali dengan menggunakan kertas saring whatman sehingga dihasilkan residu dan filtrat. Proses ekstraksi dapat dilihat pada Gambar 4.
Gambar 4 Diagram alir proses ekstraksi lili laut (Sumber: Quinn 1988 diacu dalam Darusman et al. 1995) Pencacahan
Sampel
Maserasi dengan kloroform selama 48 jam
Penyaringan
Residu
Maserasi dengan etil asetat selama 48 jam
Penyaringan
Evaporasi
Ekstrak kloroform
Maserasi dengan metanol selama 48 jam Residu Penyaringan Residu Filtrat Filtrat Evaporasi
Ekstrak etil asetat
Filtrat Evaporasi
Ekstrak metanol Sampel 25 gram
Filtrat dari kloroform, etil asetat, metanol dievaporasi untuk memisahkan pelarut dengan ekstraknya. Proses evaporasi menggunakan vacuum evaporator sehingga dihasilkan ekstrak kasar. Ekstrak kasar ini kemudian dimasukkan ke dalam botol ekstrak yang akan digunakan untuk dilakukan uji aktivitas antioksidan dengan metode DPPH (Bois 1958 diacu dalam Hanani et al. 2005) dan uji fitokimia secara kualitatif (Harborne 1987).
3.5.1 Uji aktivitas antioksidan (DPPH) (Bois 1958 diacu dalam Hanani et al. 2005)
Ekstrak kasar lili laut yang diperoleh dari ektraksi bertingkat dengan kloroform, etil asetat, metanol, etanol dilarutkan dengan pelarut metanol p.a dengan konsentrasi 200, 400, 600, 800 ppm. Antioksidan sintetik BHT digunakan sebagai pembanding dengan konsentrasi 2, 4, 6, 8 ppm. Larutan DPPH yang digunakan, dibuat dengan melarutkan kristal DPPH dalam pelarut metanol dengan konsentrasi 1 mM. Proses pembuatan larutan DPPH 1 mM dilakukan dalam kondisi suhu rendah dan terlindung dari cahaya matahari. Sebanyak 4,5 ml larutan uji dan pembanding direaksikan dengan 500 µl larutan DPPH 1 mM dalam tabung reaksi. Campuran tersebut diinkubasi pada suhu 37 °C selama 30 menit, kemudian diukur absorbansinya dengan menggunakan spektrofotometri UV-VIS Hitachi U-2800 pada panjang gelombang 517 nm. Aktivitas antioksidan dari masing-masing sampel dan pembanding BHT dinyatakan dengan persen inhibisi, yang dihitung dengan rumus sebagai berikut:
inhibisi absorbansi blanko absorbansi sampel
absorbansi blanko x 00
Nilai konsentrasi sampel (ekstrak maupun pembanding BHT) dan persen inhibisinya diplot masing-masing pada sumbu x dan y pada persamaan regresi
linear. Persamaan regresi linear yang diperoleh dalam bentuk persamaan y = a + bx, digunakan untuk mencari nilai IC50 (inhibitor concentration 50%) dari
masing-masing sampel dengan menyatakan nilai y sebesar 50 dan nilai x yang akan diperoleh sebagai IC50. Nilai IC50 menyatakan besarnya konsentrasi larutan
sampel (ekstrak maupun antioksidan pembanding BHT) yang dibutuhkan untuk mereduksi radikal bebas DPPH sebesar 50%.
3.5.2 Uji fitokimia (Harborne 1987)
Uji fitokimia dilakukan untuk menentukan komponen bioaktif yang terdapat pada ekstrak kasar lili laut masing-masing pelarut. Uji fitokimia yang dilakukan terdiri dari uji alkaloid, steroid/triterpenoid, flavonoid, saponin, fenol hidrokuinon, Molisch, Benedict, Biuret dan Ninhidrin. Metode uji ini berdasarkan Harborne (1987).
a) Uji alkaloid
Sejumlah sampel dilarutkan dalam beberapa tetes asam sulfat 2 N kemudian diuji dengan tiga pereaksi alkaloid yaitu, pereaksi Dragendorff, pereaksi Meyer, dan pereaksi Wagner. Hasil uji dinyatakan positif bila dengan pereaksi Meyer terbentuk endapan putih kekuningan, endapan coklat dengan pereaksi Wagner dan endapan merah hingga jingga dengan pereaksi Dragendorff.
Pereaksi Meyer dibuat dengan cara menambahkan 1,36 gram HgCl2
dengan 0,50 gram KI lalu dilarutkan dan diencerkan dengan akuades menjadi 100 ml dengan labu takar. Pereaksi ini tidak berwarna. Pereaksi Wagner dibuat dengan cara 10 ml akuades dipipet kemudian ditambahkan 2,50 gram iodin dan 2 gram KI lalu dilarutkan dan diencerkan dengan akuades menjadi 200 ml dalam labu takar. Pereaksi ini berwarna coklat. Pereaksi Dragendorff dibuat dengan cara 0,80 gram bismut subnitrat ditambahkan dengan 10 ml asam asetat dan 40 ml air. Larutan ini dicampur dengan larutan yang dibuat dari 8 gram kalium iodida dalam
20 ml air. Sebelum digunakan, 1 volume campuran ini diencerkan dengan 2,30 volume campuran 20 ml asam asetat glasial dan 100 ml air. Pereaksi ini
berwarna jingga.
b) Uji steroid/triterpenoid
Sejumlah sampel dilarutkan dalam 2 ml kloroform dalam tabung reaksi. Anhrida asetat ditambahkan sebanyak 10 tetes kemudian ditambahkan asam sulfat pekat 3 tetes ke dalam campuran tersebut. Hasil uji positif mengandung steroid dan triterpenoid yaitu dengan terbentuknya larutan berwarna merah untuk pertama kali kemudian berubah menjadi biru dan hijau.
c) Uji flavonoid
Sejumlah sampel ditambah serbuk magnesium 0,1 mg dan 0,4 ml amil alkohol (campuran asam klorida 37% dan etanol 95% dengan volume yang sama)
dan 4 ml alkohol kemudian campuran dikocok. Hasil uji positif sampel mengandung flavonoid ditunjukkan dengan terbentuknya warna merah, kuning atau jingga pada lapisan amil alkohol.
d) Uji saponin
Saponin dapat dideteksi dengan uji busa dalam air panas. Busa yang stabil selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N menunjukkan adanya saponin.
e) Uji fenol hidrokuinan (pereaksi FeCl3)
Sejumlah sampel diekstrak dengan 20 ml etanol 70%. Larutan yang dihasilkan diambil sebanyak 1 ml kemudian ditambahkan 2 tetes larutan FeCl3
5%. Hasil uji positif sampel mengandung fenol hidrokuinan ditunjukkan dengan terbentuknya warna hijau atau hijau biru.
f) Uji molisch
Sebanyak 1 ml larutan sampel diberi 2 tetes pereaksi Molisch dan 1 ml asam sulfat pekat melalui dinding tabung. Uji positif yang menunjukkan adanya karbohidrat ditandai terbentuknya kompleks berwarna ungu diantara 2 lapisan cairan.
g) Uji benedict
Larutan sampel sebanyak 8 tetes dimasukkan ke dalam 5 ml pereaksi Benedict. Campuran dikocok dan dididihkan selama 5 menit. Hasil uji positif sampel mengandung gula pereduksi ditunjukkan dengan terbentuknya larutan berwarna hijau, kuning atau endapan merah bata.
h) Uji biuret
Sebanyak 1 ml larutan sampel ditambahkan 4 ml pereaksi Biuret. Campuran dikocok dengan seksama. Hasil uji positif sampel mengandung senyawa peptida dengan terbentuknya larutan berwarna ungu.
i) Uji ninhidrin
Sebanyak 2 ml larutan sampel ditambah beberapa tetes larutan ninhidrin 0,1%. Campuran dipanaskan dalam penangas air selama 10 menit. Hasil uji positif sampel mengandung asam amino ditunjukkan dengan warna biru.
4 HASIL DAN PEMBAHASAN
4.1 Karakteristik Lili Laut (Comaster sp.)
Lili laut merupakan hewan dari filum Echinodermata yang mirip tumbuhan. Kulitnya tersusun dari zat kitin dan biasanya melekat pada dasar perairan, lili laut juga dikenal sebagai hewan yang mempunyai lengan bercabang serta anus dan mulut berada di permukaan oral (Clark 1976). Morfologi lili laut yang diambil dari areal dramaga Pulau Pramuka, Kepulauan Seribu, DKI Jakarta dapat dilihat pada Gambar 5.
Gambar 5 Lili laut yang diambil dari areal dramaga Pulau Pramuka
Sampel lili laut yang diperoleh, diamati karakteristik fisiknya meliputi warna, tekstur, bentuk, segment cirrus, dan arms. Hasil pengamatan karakteristik fisik dari lili laut dapat dilihat pada Tabel 2.
Tabel 2 Hasil pengamatan karakteristik fisik lili laut
Komponen Karakteristik
Warna Hitam keunguan
Tekstur Bentuk
Keras
Menyerupai tanaman lili
Segment cirrus 25 buah
Lili laut yang digunakan dalam penelitian ini memiliki warna hitam keunguan, menyerupai tanaman lili, memiliki tekstur yang keras, dan memiliki lendir yang berfungsi sebagai pertahanan. Jumlah segment cirrus adalah 25 serta arms yang berjumlah 38. Arms dari lili laut ini mudah rapuh, sedangkan aboral cup dan columnal memiliki struktur yang kuat dan tidak mudah rapuh. Menurut Clark (1971) lili laut dengan famili Comasteridae memiliki arms sampai 80 tetapi biasanya kurang dari 60 dan segment cirrus mencapai 30.
4.2 Proksimat Lili Laut (Comaster sp.)
Lili laut yang digunakan dalam penelitian ini berasal dari Pulau Pramuka, Kepulauan Seribu, DKI Jakarta. Analisis proksimat yang dilakukan pada lili laut meliputi uji kadar air, abu, protein, dan lemak sedangkan karbohidrat dihitung dengan by difference (100%-kadar air-kadar abu-lemak-protein). Hasil analisis proksimat lili laut ditunjukkan pada Tabel 3.
Tabel 3 Hasil uji proksimat lili laut dibandingkan dengan bulu babi dan teripang Komponen Lili laut (%) Bulu babi (%)1 Teripang (%)2
Kadar air 74,67 (bb) 69,47 (bb) 92,65 (bb)
Kadar lemak 0,55 (bk) 2,45 (bk) 0,15 (bk)
Kadar protein 0,11 (bk) 16,99 (bk) 2,85 (bk)
Kadar abu 13,51 (bk) 2,25 (bk) 3,16 (bk)
Kadar karbohidrat 11,16 (bk) 8,84 (bk) 1,19 (bk) Sumber: 1 ( Murniyati dan Setiabudi 1998 dalam Mustafa 2007)
2 ( Meydia 2007)
Air merupakan komponen yang penting dalam bahan makanan, karena air dapat memberikan pengaruh pada penampakan, tekstur serta cita rasa. Bahkan di dalam makanan kering sekalipun, terkandung air dalam jumlah tertentu. Produk hasil perikanan memiliki kandungan air yang sangat tinggi, sekitar 80%. Kandungan air dalam bahan makanan ikut menentukan daya terima, kesegaran dan daya simpan bahan tersebut (Winarno 2008).
Analisis kadar air dalam penelitian ini bertujuan untuk mengetahui jumlah air yang terkandung dalam lili laut. Hasil pengujian ini menunjukkan bahwa lili laut memiliki kadar air yang cukup tinggi yakni 74,67%. Jika dibandingkan dengan kadar air dari Diadema setosum (bulu babi) sebesar 69,47% (Murniyati dan Setiabudi 1998 dalam Musthofa 2007), dan memiliki kandungan air yang
lebih rendah jika dibandingkan dengan Stichopus variegatus (teripang) yaitu sebesar 92,65% (Meyda 2007). Perbedaan ini terjadi diduga karena adanya pengaruh beberapa faktor yaitu faktor internal dan eksternal. Faktor internal yang diduga kuat menjadi penyebab perbedaan ini adalah sifat genetik antara lili laut bulu babi, dan teripang yang terdapat ditempat yang berbeda. Faktor eksternal yang diduga berpengaruh terhadap perbedaan ini adalah habitat dan kondisi lingkungan yang berbeda. Faktor eksternal dan internal yang berbeda ini diduga berpengaruh pada kadar komponen gizi lain dalam tubuh lili laut, yaitu kadar protein dan kadar lemak. Jika proporsi kedua zat gizi ini berbeda dalam tubuh organisme, maka kadar air dalam tubuh organisme tersebut pun akan berbeda proporsinya.
Lemak merupakan zat yang penting dan merupakan sumber energi yang lebih efektif bagi tubuh dibandingkan karbohidrat dan protein. Lemak memberi cita rasa dan memperbaiki tekstur pada makanan juga sebagai sumber pelarut bagi vitamin A, D, E dan K (Winarno 1997). Lemak pada tubuh makhluk hidup disimpan sebesar 45% di sekililing organ dan rongga perut (Almatsier 2006).
Kadar lemak yang terkandung dalam lili laut adalah sebesar 0,55%, sangatlah kecil jika dibandingkan dengan kandungan lemak pada bulu babi yaitu sebesar 2,45% (Murniyati dan Setiabudi 1998 dalam Musthofa 2007), dan lebih besar jika dibandingkan dengan teripang yaitu 0,15% (Meyda 2007). Lemak secara umum memiliki beberapa fungsi, diantaranya adalah penghasil energi, pembangun/pembentuk struktur tubuh, penghasil asam lemak essensial yang penting bagi tubuh, pembawa vitamin larut lemak, pelumas diantara persendian, membantu pengeluaran sisa makanan, pemberi kepuasan cita rasa dan agen pengemulsi (Suhardjo dan Kusharto 1988). Lemak akan semakin meningkat dengan bertambahnya usia, karena sifat fisiologis hewan yang akan menuju fase perkembangbiakan. Hewan akan membutuhkan lebih banyak energi yang disimpan dalam bentuk lemak untuk berkembang biak. Adanya variasi komposisi kimia dapat terjadi antar spesies dan antar individu dalam satu spesies (Suzuki 1981).
Protein merupakan makromolekul yang dibentuk dari asam-asam amino yang berikatan peptida. Protein berfungsi sebagai bahan bakar dalam tubuh, serta
berperan sebagai zat pembangun dan pengatur. Protein merupakan sumber asam-asam amino yang mengandug unsur C, H, O, dan N yang tidak dimiliki oleh lemak ataupun karbohidrat. Molekul protein juga mengandung fosfor, belerang dan ada pula jenis protein yang mengandung unsur logam yaitu besi dan tembaga (Winarno 2008). Kandungan protein yang terdapat pada lili laut adalah sebesar 0,11% sangatlah rendah jika dibandingkan dengan kandungan protein bulu babi yaitu sebesar 16,99% (Murniyati dan Setiabudi 1998 dalam Musthofa 2007) dan teripang sebesar 2,85% (Meyda 2007).
Abu adalah zat anorganik sisa hasil pembakaran suatu bahan organik. Bahan makanan terdiri dari 96% bahan organik dan air. Sisanya terdiri dari unsur-unsur mineral yang juga dikenal sebagai zat anorganik atau kadar abu. Dalam proses pembakaran, komponen-komponen organik terbakar, tetapi komponen anorganiknya tidak, karena itulah disebut abu (Winarno 2008). Kadar abu yang terdapat pada lili laut adalah sebesar 13,51%, sangat berbeda jika dibandiangkan dengan kadar abu bulu babi yaut sebesar 2,25% (Murniyati dan Setiabudi 1998 dalam Musthofa 2007) dan teripang sebesar 3,16% (Meyda 2007). Tinggi rendahnya kadar abu dapat disebabkan oleh perbedaan habitat dan lingkungan hidup yang berbeda. Setiap lingkungan perairan dapat menyediakan asupan mineral yang berbeda-beda bagi organisme akuatik yang hidup didalamnya. Selain itu juga, masing masing individu organisme juga memiliki kemampuan yang berbeda-beda dalam mergulasi dan mengabsorbansi mineral, sehingga hal ini nantinya akan memberikan pengaruh pada nilai kadar abu dalam masing masing bahan (Susanto 2010).
Karbohidrat adalah kelompok nutrien yang penting dalam susunan makanan yaitu sebagai sumber energi. Senyawa-senyawa ini mengandung unsur karbon, hidrogen, dan oksigen (Gaman dan Sherrington 1992). Karbohidrat mempunyai peranan penting dalam menentukan karakteristik bahan makanan dalam rasa, warna, dan tekstur. Karbohidrat berguna untuk mencegah timbulnya pemecahan protein yang berlebihan, kehilangan mineral, dan membantu metabolisme lemak dan protein (Winarno 1997). Kadar karbohidrat yang terkandung dalam lili laut pada penelitian ini adalah sebesar 11,16%. Keberadaan karbohidrat di dalam bahan pangan kadang tidak sendiri melainkan berdampingan
dengan zat gizi yang lain yakni berdampingan protein dan lemak (Deep 2009). Karbohidrat yang ada dalam produk perikanan tidak mengandung serat, kebanyakan dalam bentuk glikogen, selain itu juga terkandung glukosa, fruktosa, sukrosa serta monosakarida dan disakarida lainnya. Kandungan glikogen yang terkandung pada produk perikanan sebesar 1% untuk ikan, 1% untuk krustasea dan 1-8% untuk kerang-kerangan (Okuzumi dan Fujii 2000).
4.3 Hasil Ekstrak Komponen Bioaktif Lili Laut (Comaster sp.)
Ekstraksi merupakan peristiwa pemindahan zat terlarut (solut) antara dua pelarut yang tidak saling bercampur. Proses ekstraksi bertujuan untuk mendapatkan bagian-bagian tertentu dari bahan yang mengandung komponen-komponen aktif. Larutan etanol yang berfungsi sebagai media penyimpanan ketika transportsi lili laut juga diekstraksi guna mengetahui rendemen yang dihasilkan dan juga untuk mengetahui aktivitas antioksidan yang terdapat pada larutan etanol tersebut. Nilai rata-rata rendemen ekstrak dari masing-masing pelarut dapat dilihat pada diagram batang Gambar 6.
Gambar 6 Nilai rata-rata rendemen ekstrak kasar lili laut
Ekstraksi dengan pelarut kloroform dilakukan pada awal proses dengan tujuan memisahkan lemak (lipid) dari bahan sehingga tidak menghalangi keluarnya senyawa bioaktif pada esktraksi dengan pelarut-pelarut berikutnya. Proses ekstraksi selanjutnya digunakan pelarut etil asetat untuk mengekstrak
1,40 0,46 0,28 0,32 0,00 0,20 0,40 0,60 0,80 1,00 1,20 1,40 1,60
Etanol Kloroform Etil Asetat Metanol
% Re n d em en
senyawa semi polar, dan terakhir adalah pelarut metanol untuk mengekstrak senyawa polar.
Proses evaporasi dari filtrat lili laut dengan ketiga jenis pelarut menghasikan ekstrak kasar dengan karakteristik yang berbeda-beda. Ekstrak etanol berwarna kuning tua, ekstrak kloroform berwarna ungu tua pekat dan kering, ekstrak etil asetat memiliki warna ungu yang lebih muda dibandingkan warna ekstrak kloroform, sedangkan ekstrak metanol memiliki warna kuning kecoklatan. Hasil ekstraksi menggunakan empat jenis pelarut yang memiliki tingkat kepolaran yang berbeda-beda, akan menghasilkan rendemen ekstrak yang berbeda-beda pula. Rendemen ekstrak merupakan perbandingan antara jumlah ekstrak yang dihasilkan dengan jumlah sampel awal yang diekstrak. Rendemen ekstrak dinyatakan dalam persen. Proses perhitungan rendemen ekstrak dari masing-masing pelarut dapat dilihat pada Lampiran 2.
4.4 Aktivitas Antioksidan
Keberadaan senyawa antioksidan dalam suatu bahan dapat diketahui melalui uji aktivitas antioksidan. Metode yang digunakan untuk menguji aktivitas antioksidan dalam lili laut adalah dengan menggunakan radikal bebas diphenylpicrylhydrazyl (DPPH). Diphenylpicrylhydrazyl merupakan radikal bebas yang bersifat stabil dan beraktivitas dengan cara mendelokasi elektron bebas pada suatu molekul, sehingga molekul tersebut tidak reaktif sebagaimana radikal bebas yang lain. Metode ini dipilih karena karena merupakan metode yang sederhana, mudah, dan menggunakan sampel dalam jumlah yang sedikit dengan waktu yang singkat (Hanani et al. 2005).
Aktivitas antioksidan pada penelitian ini menggunakan metode DPPH dengan menggunakan prinsip spektrofotometri dengan panjang gelombang 517nm. Larutan senyawa antioksidan dari hasil ekstraksi lili laut yang ditambahkan dengan larutan DPPH (dalam metanol) berubah warna dari ungu menjadi kuning cerah. Penurunan absorbansi, yang ditunjukkan dengan berkurangnya warna ungu menunjukkan adanya aktivitas antioksidan. Menurut (Molyneux 2004). Suatu senyawa dapat dikatakan memiliki aktivitas antioksidan apabila senyawa tersebut mampu mendonorkan atom hidrogennya pada radikal DPPH, yang ditandai dengan perubahan warna ungu menjadi kuning pucat.