i
ISOLASI DAN IDENTIFIKASI TANIN PADA HERBA KROKOT ( Portulaca oleracea L. )
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh : Prima Esteti NIM : 028114077
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
YOGYAKARTA 2008
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
iv
HALAMAN PERSEMBAHAN
Sebab Aku ini mengetahui rancangan-rancangan apa yang ada pada-Ku mengenai kamu, demikianlah firman Tuhan, yaitu rancangan damai sejahtera dan bukan rancangan kecelakaan, untuk memberikan kepadamu hari depan yang penuh harapan.
Yeremia 29 : 11
Kupersembahkan untuk :
Tuhan Yesus Kristus Juru Selamatku
Papa dan Mamaku yang tercinta
Adik-adikku tersayang : Clara, Bintang, dan Bagus
Almamaterku
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
vi INTISARI
Krokot (Portulaca oleracea L) merupakan gulma yang dapat dimanfaatkan sebagai tumbuhan sayuran dan dapat digunakan sebagai tumbuhan obat. Tumbuhan krokot mengandung tanin, saponin, asam nikotinat, dan lain sebagainya. Penelitian ini dilakukan untuk mengetahui jenis kandungan tanin pada herba krokot sehingga dapat diketahui manfaat herba krokot sebagai tumbuhan obat yang tepat berkhasiat.
Penelitian ini termasuk penelitian non eksperimental. Tujuan penelitian ini yaitu untuk mengisolasi tanin pada herba krokot dengan KLT preparatif dan mengidentifikasi jenis tanin yang terdapat pada isolat herba krokot. Sebagai langkah awal dilakukan determinasi tumbuhan krokot, pengumpulan bahan, uji pendahuluan, uji pengendapan, identitas jenis tanin. Penyarian dengan menggunakan pelarut air-aseton (3:7), kemudian pemeriksaan KLT menggunakan fase diam silika gel GF254 dan fase gerak n-butanol, asam asetat, air (4:1:5)v/v dan pembanding asam tanat. Isolasi tanin dengan metode KLT preparatif, pemeriksaan kemurnian isolat dengan KLT multi eluen, dan identifikasi isolat dengan reaksi warna dan reaksi pengendapan. Reaksi warna dengan cara merebus herba dengan larutan HCl, sedangkan reaksi pengendapan dengan penambahan Pb asetat 10%, penambahan asam asetat : Pb asetat (2:1) dan penambahan putih telur.
Hasil penelitian yang didapat dari uji yang dilakukan menunjukkan bahwa herba krokot mengandung tanin jenis terkondensasi.
Kata kunci : krokot, tanin terkondensasi, kromatografi lapis tipis (KLT)
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
vii ABSTRACT
Purslane (Portulaca oleracea L) was weeds which could be used as vegetale plants and could be used as drug plants. Purslane contained tannin, saponin, nicotinic acid, etc. This research aimed to know kinds of tannin content on purslane herb until can know the benefit of purslane herbs as therapeutic drugs.
This research was non-experimental research. The objectives of the research were to isolate and to identify kinds of tannin on purslane herb. As the first step, the researcher did determinating of purslane, collecting the material, introduction test, detecting condensated tanin. Then she extracted purslane with water-acetone (3:7), after that she controlled thin layer chromatography using adsorbent silica gel GF254 and eluent n-butanol, acetic acid, water (4:1:5)v/v and standardized the comparison of tanat acid. Next, she isolated tannin with preparative thin layer chromatography method, controlled isolate purity with multi eluent TLC, and identified isolate with color reaction and precipitate reaction. Color reaction was done by steeping herb into boiled HCl, whereas precipitation reaction was done by adding Pb(CH3COO)2 (mine) and albumin(protein). That test was to differ hidrolyzed tannin and condensated tannin.
The result of research showed that purslane herb contained condensated tannin.
Key words : purslane, condensated tannin, thin layer chromatography (TLC)
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
viii
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
ix
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Tuhan Yesus Kristus atas segala berkat, kasih, dan pertolonganNya, sehingga penulis dapat menyelesaikan skripsi yang berjudul ISOLASI DAN IDENTIFIKASI TANIN PADA HERBA KROKOT ( Portulaca oleracea L. ). Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi (S.Farm).
Penyusunan skripsi ini banyak didukung oleh berbagai pihak dalam hal doa, materi, motivasi, semangat, saran, kritik, dan bimbingan. Untuk itu penulis mengucapkan terima kasih kepada semua pihak yang telah membantu penulis menyelesaikan skripsi ini, terutama kepada :
1. Yesus Kristus sumber kekuatanku.
2. Ibu Rita Suhadi, M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
3. Bapak Yohanes Dwiatmaka, M.Si., selaku dosen pembimbing yang telah membimbing dengan kesabarannya, memberikan saran, dan pengetahuan selama penelitian dan penulisan skripsi ini.
4. Bapak Ign. Y. Kristio Budiasmoro, M.Si., selaku dosen penguji yang telah bersedia menguji, memberikan saran dan masukan yang sangat berguna dalam penyelesaian skripsi ini.
5. Ibu Erna Tri Wulandari, M.Si, Apt., selaku dosen penguji yang telah bersedia menguji, memberikan saran dan masukan yang sangat berguna dalam penyelesaian skripsi ini.
6. Papa dan Mamaku, terima kasih untuk doa, dukungan, kasih sayang dan semangat yang telah diberikan kepadaku hingga saat ini.
7. Adik-adikku, Clara, Bintang, dan Bagus yang selalu mendoakanku dan menghiburku.
8. Iik Yat, Tio Sin dan semua saudaraku yang sudah mendoakanku dan mendukungku.
9. Teman seperjuanganku : Ayu dan Shinta, terima kasih untuk bantuan, dukungan dan semangat serta motivasinya selama ini.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
x
10. Sahabat-sahabatku : Yiyin, Ulin, Puri, Rika, Adit, Asti, Lena, Leni, Arinawa, Elly, Via, Nana, Duma, terima kasih sudah membantu, mendukung dan mengingatkanku dalam skripsi ini.
11. Teman-teman se-Lab. FF : Vivi, Wira, Kristin, Yuni, Titin, Rosa, Devi, Mita, Nia, Yohana, Rinto, Novi, terimakasih untuk kebersamaannya, dan untuk info-info yang sudah dibagikan.
12. Teman-teman satu angkatan (2002), terutama kelompok C. Terima kasih sudah mengukir kenangan indah semasa kuliah ini bersama kalian.
13. Mas Wagiran, mas Sigit, mas Sarwanto, mas Andre dan Pak Mukmin, terima kasih atas semua bantuan dan informasi yang diberikan selama penelitian. 14. Teman-teman sepelayanan : Semua tim DFJ, tante Beppy, Stevanny, tante
Rida, oma Rosy, cik Ratna, Hengky, K’Betty, K’Otie, K’Siska, Papi Tedjo, Linda, bi Ithien, Elce, Willy, Hero, Rina, Osa, Awin, Lola, Ko Unt, K’Din2, K’Rin2, Cik Yo2, Elyn, Edo, Rifa, Titis, Lisa, KP dan KR GKI Gejayan yang tak bisa kusebutkan satu persatu, terima kasih untuk share dan dukungan doanya.
15. Teman KKN yang terus mendukungku mas Sumantri, Danu, Aning, Agnes, Aray, K’Unie, Louis, dan Tony.
16. Inoph, Nana, dan semua teman lamaku terima kasih untuk doa dan semangatnya.
17. Petra dan sekontrakannya atas bantuan ngeprintnya.
18. Semua pihak yang tidak dapat penulis sebutkan satu persatu yang telah banyak memberikan bantuan, dukungan, dan doanya selama ini.
Akhirnya, penulis menyadari bahwa penyusunan skripsi ini masih jauh dari sempurna, karena keterbatasan pikiran, waktu dan tenaga. Maka dari itu, penulis menerima segala saran maupun kritik yang bersifat membangun, dan yang dapat membantu dan mendukung skripsi ini agar dapat menjadi lebih sempurna. Semoga Tuhan Yesus melimpahkan berkat dan kasihNya kepada semua pihak yang telah membantu penulis dalam menyelesaikan skripsinya.
Yogyakarta, 29 Mei 2008 Penulis
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xi DAFTAR ISI
Halaman
HALAMAN JUDUL... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
INTISARI . ... vi
ABSTRACT... vii
LEMBAR PERSETUJUAN PUBLIKASI... viii
KATA PENGANTAR ... ix
DAFTAR ISI... xi
DAFTAR TABEL... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN... xvii
BAB I . PENGANTAR... 1
A. Latar Belakang... 1
1. Permasalahan... 4
2. Keaslian penelitian... 4
3. Manfaat penelitian... 4
B. Tujuan Penelitian... 4
BAB II PENELAAHAN PUSTAKA... 6
A. Krokot... 6
1. Keterangan botani... 6
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xii
2. Deskripsi... 6
3. Ekologi... 6
4. Khasiat dan kegunaan... 7
5. Kandungan kimia... 7
B. Tanin... 7
C. Penyarian... 13
D. Kromatografi Lapis Tipis (KLT)... 16
E. Kromatografi Lapis Tipis Preparatif (KLTP)... 18
F. Keterangan Empiris... 20
BAB III METODOLOGI PENELITIAN... 21
A. Jenis dan Rancangan Penelitian... 21
B. Definisi Operasional... 21
C. Alat dan Bahan penelitian... 22
D. Tahapan Penelitian... 22
1. Determinasi tanaman krokot... 22
2. Pengumpulan bahan... 23
3. Uji pendahuluan... 23
4. Uji pengendapan... 23
5. Deteksi tanin terkondensasi (proantosianidin)... 24
6. Penyarian... 24
7. Pemeriksaan tanin dengan KLT………... 24
8. Isolasi senyawa dengan KLT preparatif... 25
9. Uji identifikasi Tanin... 25
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xiii
E. Tata Cara Analisis Hasil... 26
BAB IV. HASIL DAN PEMBAHASAN... 27
A. Determinasi Tumbuhan Krokot... 27
B. Pengumpulan Bahan... 27
C. Uji Pendahuluan... 29
D. Uji Pengendapan... 29
E. Deteksi Tanin Terkondensasi (proantosianidin)... 30
F. Penyarian... 31
G. Pemeriksaan Tanin dengan KLT... 32
H. Isolasi Senyawa dengan KLT Preparatif... 37
I. Uji Identifikasi Tanin………... . 40
1. Penambahan Pb asetat 10%... .. 40
2. Uji pengendapan ……….... .... 42
3. Uji untuk membedakan tanin terhidrolisis dan tanin terkondensasi ……… 43
BAB V. KESIMPULAN DAN SARAN... 45
A. Kesimpulan... 45
B. Saran... 45
DAFTAR PUSTAKA... 46
LAMPIRAN... 48
BIOGRAFI PENULIS... 52
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xiv
DAFTAR TABEL
Tabel I . Penggolongan tanin tumbuhan ... 12 Tabel II . Hasil organoleptik herba krokot ... 28 Tabel III . Hasil kromatogram KLT dengan menggunakan fase diam
silika gel GF254 dan fase gerak n-butanol, asam asetat, air
(4:1:5) v/v ... 35 Tabel IV . Hasil kromatogram KLTP dengan menggunakan fase diam
silika gel GF254 dan fase gerak n-butanol, asam asetat, air
(4:1:5) v/v ... 38
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xv
DAFTAR GAMBAR
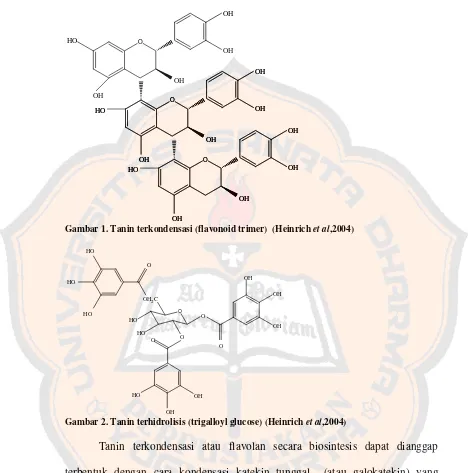
Gambar 1. Tanin terkondensasi (flavonoid trimer)... 9
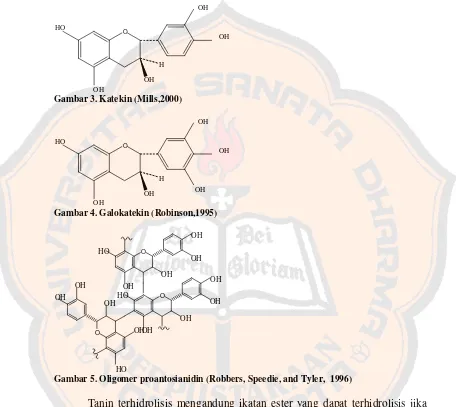
Gambar 2. Tanin terhidrolisis (trigalloyl glucose)... 9
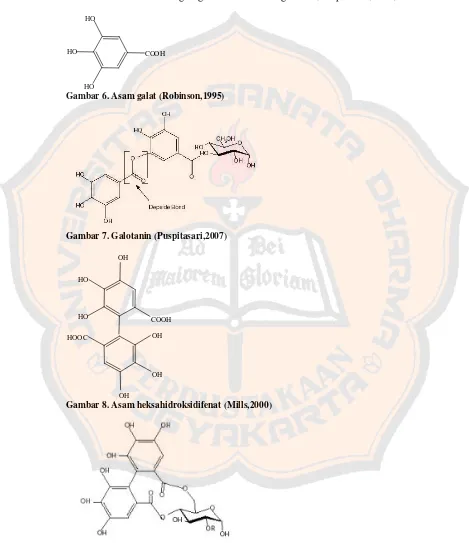
Gambar 3. Katekin ... 10
Gambar 4. Galokatekin ... 10
Gambar 5. Oligomer proantosianidin... 10
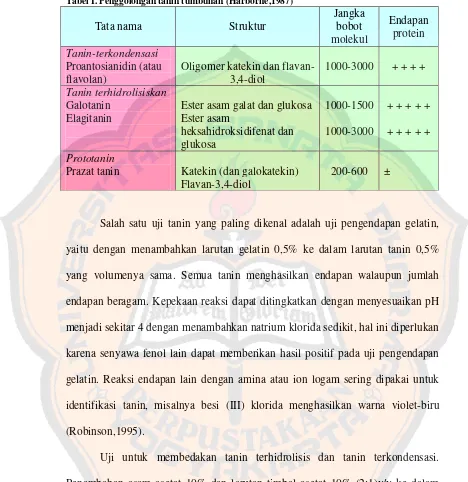
Gambar 6 . Asam galat... 11
Gambar 7. Galotanin ... 11
Gambar 8. Asam heksahidroksidifenat ... 11
Gambar 9. Asam elagitanin... 11
Gambar 10. Reaksi pembentukan antosianidin untuk flavan-3,4-diol.... 30
Gambar 11. Foto deteksi tanin terkondensasi ... 31
Gambar 12. Komplek logam Fe dengan senyawa fenol ... 33
Gambar 13. Hasil KLT dengan tiga fase gerak yang berbeda ... 34
Gambar 14. Hasil KLT dengan fase gerak n-butanol, asam asetat, air (4:1:5)v/v... 36
Gambar 15. Hasil KLTP dengan fase gerak n-butanol, asam asetat, air (4:1:5)v/v... 38
Gambar 16. Hasil KLT multi eluen... 40
Gambar 17. Reaksi dengan penambahan Pb (CH3COO)2... 41
Gambar 18. Foto terbentuknya endapan pada penambahan Pb asetat 10% 41 Gambar 19. Foto uji pengendapan ... 42
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xvi
Gambar 20. Reaksi penambahan CH3COOH dan Pb(CH3COO)2 (2:1) . 43 Gambar 21. Foto penambahan asam asetat 10% dan timbal asetat 10% (2:1) ke dalam larutan tanin 0,4%... ... 44
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xvii
DAFTAR LAMPIRAN
Lampiran 1 . Surat determinasi ... 48
Lampiran 2 . Foto krokot ... 49
Lampiran 3 . Uji pendahuluan... 50
Lampiran 4 . Uji pengendapan ... 51
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
1 BAB I PENGANTAR
A. Latar Belakang
Perkembangan obat tradisional semakin meningkat seiring dengan kesadaran masyarakat tentang manfaat tanaman sebagai obat tradisional. Hal ini juga didukung oleh adanya berbagai jenis tanaman yang tumbuh di Indonesia. Krokot adalah salah satu jenis tumbuhan di Indonesia. Krokot merupakan tumbuhan pengganggu yang biasanya diberantas. Namun ternyata krokot juga dapat digunakan sebagai obat tradisional. Maka dari itu perlu dilakukan penelitian kandungan fitokimia krokot agar didapat informasi ada tidaknya zat berkhasiat pada tumbuhan tersebut kemudian diteliti aktivitas farmakologi dan toksisitasnya, sehingga krokot tersebut dapat digunakan sebagai tumbuhan obat yang aman dan manjur bila digunakan sebagai obat tradisional.
Krokot dapat digunakan sebagai obat karena salah satu faktornya yaitu krokot mengandung metabolit sekunder. Metabolit sekunder didefinisikan sebagai suatu senyawa yang hanya ditemukan secara terbatas pada kelompok tumbuhan tertentu, atau ditemukan dalam konsentrasi yang lebih tinggi dari kelompok tumbuhan yang lain, dan tidak merupakan sumber makanan yang penting bagi herbivora (Widarto,2008). Senyawa-senyawa metabolit sekunder itu, meskipun tidak sangat penting bagi eksistensi suatu individu, tetapi sering berperan bagi kelangsungan hidup suatu spesies dalam perjuangan menghadapi spesies-spesies lain. Sebagai contoh pada tumbuhan, senyawa metabolit sekunder biasa
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
2
digunakan sebagai senjata penangkal serangan hama dan penyakit. Sedangkan pada hewan, senyawa metabolit sekunder seperti feromon digunakan sebagai zat penarik sex lawan jenis (Putra,2005).
Krokot (Portulaca oleracea L) adalah salah satu jenis gulma yang tumbuh liar yang banyak dijumpai sebagai tumbuhan pengganggu tanaman sayuran, palawija, maupun tanaman perkebunan. Krokot biasanya digunakan dalam pengobatan pada beberapa penyakit, seperti disentri, radang usus buntu, sakit perut, radang gusi, demam, digigit binatang berbisa, eksim, jantung berdebar, kencing darah, dan bisul. Cara penggunaannya bisa dengan dimakan langsung ataupun dengan cara direbus dengan campuran bahan lainnya. Krokot merupakan tanaman liar yang tumbuh di tempat terbuka, tempat agak terlindung, dan pada tanah agak lembab seperti di pekarangan, pinggiran kampung, pinggiran selokan, dan pinggir jalan. Selain sebagai gulma, tanaman ini kadang-kadang ditanam sebagai sayuran (Djauhariya & Hernani,2004).
Krokot mengandung tanin, saponin, KCl, K2SO4, KNO3, asam nikotinat, vitamin A, vitamin B, vitamin C, 1-noradrenalin, dopamin, dan dopa (Djauhariya & Hernani,2004). Tanin pada krokot menarik untuk diteliti mengingat khasiat krokot sebagai anti-diare, antiseptik, bahkan untuk obat jantung berdebar. Secara kimia terdapat dua jenis tanin yaitu tanin terhidrolisis dan tanin terkondensasi. Menurut Bruneton (1999) secara umum tanin mempunyai efek antiseptik yang dapat digunakan untuk terapi infeksi diare dan dermatitis. Tanin juga merupakan inhibitor beberapa enzim. Tanin terhidrolisis mempunyai aktivitas antioksidan sedangkan tanin terkondensasi (proantosianidin) mempunyai khasiat untuk
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
3
mencegah penyakit cardiovascular. Salah satu contoh tanin terhidrolisis yaitu acutimissin A yang termasuk golongan polifenol elagitanin, mempunyai khasiat sebagai anti kanker (Anonim,2007). Contoh tanin terkondensasi yaitu katekin yang dapat membantu menyingkirkan radikal bebas sehingga tidak memiliki kesempatan mengoksidasi LDL yang dapat membentuk plak pada dinding arteri yang menjadi penyebab arterosklerosis (melancarkan peredaran darah ke jantung) (Anonim,2003). Kedua jenis tanin ini mempunyai aktivitas terapi yang berbeda sehingga perlu dilakukan penelitian tentang jenis tanin pada herba krokot.
Metode yang digunakan untuk mengisolasi tanin yang terdapat pada herba krokot adalah kromatografi lapis tipis preparatif (KLTP), diharapkan dengan menggunakan metode ini dapat memisahkan senyawa-senyawa yang ada sehingga dapat mengisolasi tanin pada herba krokot. Metode ini merupakan metode yang dapat digunakan untuk pemisahan bahan dalam jumlah yang kecil dan menggunakan peralatan yang sederhana. Setelah diisolasi tanin yang terdapat pada herba krokot diidentifikasi jenisnya apakah termasuk tanin terkondensasi atau tanin terhidrolisis. Cara identifikasi yang digunakan adalah dengan reaksi warna dan reaksi pengendapan. Penelitian ini diharapkan dapat memberikan informasi untuk penelitian selanjutnya tentang tanaman krokot, khususnya tentang kandungan senyawa tanin.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
4
1. Permasalahan
a. Apakah senyawa tanin yang terdapat pada herba krokot dapat diisolasi dengan KLTP?
b. Identitas jenis tanin apakah yang terdapat pada herba krokot dengan reaksi warna dan reaksi pengendapan?
2. Keaslian penelitian
Sejauh penelusuran informasi yang dilakukan oleh penulis, penelitian tentang isolasi dan identifikasi tanin pada herba krokot secara khusus belum pernah dilakukan.
3. Manfaat penelitian
Manfaat yang diharapkan dari hasil penelitian ini adalah : a. Manfaat teoritis
Penelitian ini diharapkan dapat memberikan tambahan pengetahuan mengenai jenis tanin yang terdapat pada herba krokot.
b. Manfaat praktis
Untuk melengkapi informasi mengenai manfaat herba krokot sebagai tumbuhan obat.
B. Tujuan Penelitian Tujuan penelitian ini adalah :
1. Tujuan umum
Untuk lebih mendalami pengetahuan tentang kandungan tanin pada herba krokot, sehingga dapat digunakan sebagai tumbuhan obat.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
5
2. Tujuan khusus
a. Untuk mengetahui bahwa senyawa tanin pada herba krokot dapat diisolasi menggunakan KLTP.
b. Untuk memperoleh identitas tanin pada herba krokot dengan cara reaksi warna dan reaksi pengendapan.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
6 BAB II
PENELAAHAN PUSTAKA
A. Krokot 1. Keterangan botani
Tumbuhan krokot termasuk dalam jenis Portulaca oleracea L. yang merupakan anggota suku Portulacaceae. Krokot mempunyai nama yang berbeda-beda pada setiap daerah. Krokot (Jawa); gelang (Sunda, Jawa, Sumatra); re-serean (Madura); jalu-jalu kiki (Ternate); purslane (Inggris) (Anonim,1995).
2. Deskripsi
Krokot merupakan tumbuhan berumur setahun, batang merebah, bentuk bulat, lunak dan berair, tidak berkayu, kulit batang warna kemerahan, panjang batang 10 – 50 cm. Daun tunggal, berbentuk bulat telur, tebal, berdaging, duduk daun tersebar atau berhadapan, tangkai pendek. Ujung daun melekuk ke dalam. Pangkal daun meruncing, tepi daun rata, panjang 1-4 cm, lebar 5-35 mm. Permukaan atas daun warna hijau tua sedangkan bagian bawah merah tua. Bunga berkelompok, keluar dari ujung-ujung cabang, mahkota bunga kecil, berjumlah 5, warna kuning. Bunga mekar dari jam 8-10 pagi, layu menjelang sore. Buah berkotak, biji banyak, kecil. Buah yang sudah matang bijinya warna hitam. Tumbuhan ini berkembang biak dengan biji (Djauhariya & Hernani,2004).
3. Ekologi
Krokot adalah tumbuhan liar yang tumbuh di tempat terbuka, tempat agak terlindung, dan pada tanah agak lembab seperti di pekarangan, pinggiran
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
7
kampung, pinggiran selokan, dan pinggir jalan. Tumbuh dari dataran rendah sampai ketinggian 1800 m dpl. Tumbuhan ini merupakan gulma pada tanaman semusim, palawija, sayuran, maupun tanaman perkebunan. Selain sebagai gulma, tanaman ini kadang-kadang ditanam sebagai sayuran (Djauhariya & Hernani,2004).
4. Khasiat dan kegunaan
Djauhariya dan Hernani (2004) menunjukkan bahwa krokot berkhasiat sebagai obat disentri, radang usus buntu, sakit perut, radang gusi, demam, digigit binatang berbisa, eksim, jantung berdebar, kencing darah, dan bisul. Krokot juga berkhasiat sebagai obat gatal dan dapat memperbaiki pencernaan (Anonim,1995). 5. Kandungan kimia
Djauhariya dan Hernani (2004) menyebutkan kandungan kimia yang dimiliki oleh krokot adalah tanin, saponin, KCl, K2SO4, KNO3, asam nikotinat, vitamin A, vitamin B, vitamin C, 1-noradrenalin, dopamin, dan dopa.
B. Tanin
Tanin terdapat luas dalam tumbuhan berpembuluh terdapat khusus dalam jaringan kayu. Menurut batasannya, tanin dapat bereaksi dengan protein membentuk kopolimer mantap yang tak larut dalam air. Dalam industri, tanin adalah senyawa yang berasal dari tumbuhan, yang mampu mengubah kulit hewan yang mentah menjadi kulit siap pakai karena kemampuannya menyambung silang protein (Harborne,1987). Tanin adalah sejenis kandungan tumbuhan yang bersifat fenol mempunyai rasa sepat dan mempunyai kemampuan menyamak kulit. Tanin
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
8
ini larut, setidak-tidaknya sampai batas tertentu, dalam pelarut organik yang polar, tetapi tak larut dalam pelarut organik nonpolar seperti benzena atau kloroform. Larutan tanin dalam air dapat diendapkan dengan penambahan asam mineral atau garam. Kemampuan tanin untuk bereaksi dengan protein dan mengendapkannya menimbulkan masalah pada penyiapan enzim atau protein lain dari beberapa tumbuhan. Kadar tanin yang tinggi mungkin mempunyai arti pertahanan bagi tumbuhan yaitu untuk membantu mengusir hewan pemangsa tumbuhan (Robinson,1995). Beberapa tanin terbukti mempunyai aktifitas antioksidan, menghambat pertumbuhan tumor, dan menghambat enzim seperti reverse transkriptase dan DNA topoisomerase (Robinson, 1995).
Tanin dapat dijumpai dalam bagian yang berbeda-beda pada tumbuhan, khususnya dalam daun, periderm, jaringan pembuluh, buah muda, dan kulit biji. Di dalam sel, tanin dijumpai dalam vakuola atau dalam sitoplasma dengan bentuk tetesan yang sangat halus, dan kadang-kadang menembus ke dalam dinding sel, seperti misalnya dalam jaringan gabus. Tanin diduga berfungsi untuk melindungi tumbuhan terhadap dehidrasi, proses pembusukan, serta perusakkan oleh hewan (Fahn,1995).
Secara kimiawi tanin dalam tumbuhan dibagi menjadi dua golongan, yaitu tanin terkondensasi dan tanin terhidrolisis. Tanin terkodensasi terjadi karena reaksi polimerisasi (kondensasi) antar flavonoid, sedangkan tanin terhidrolisis dibentuk dari reaksi esterifikasi asam fenolat dan gula (glukosa) (Heinrich, Barnes,Gibbons, and Williamson, 2004).
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
9 O HO OH OH OH OH O HO OH OH OH OH O HO OH OH OH OH O HO OH OH OH OH O HO OH OH OH OH
Gambar 1. Tanin terkondensasi (flavonoid trimer) (Heinrich et al,2004)
O
HO
HO
HO
O
OH2C
HO O O OH OH OH O O OH OH HO HO
Gambar 2. Tanin terhidrolisis (trigalloyl glucose) (Heinrich et al,2004)
Tanin terkondensasi atau flavolan secara biosintesis dapat dianggap terbentuk dengan cara kondensasi katekin tunggal (atau galokatekin) yang membentuk senyawa dimer dan kemudian oligomer yang lebih tinggi. Nama lain tanin terkondensasi adalah proantosianidin, karena bila direaksikan dengan asam dan dipanaskan, beberapa ikatan karbon-karbon penghubung satuan terputus dan menghasilkan monomer antosianidin. Kebanyakan proantosianidin adalah
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
10
prosianidin, dan bila direaksikan dengan asam akan menghasilkan sianidin (Harborne,1987). O OH HO OH OH H OH
Gambar 3. Katekin (Mills,2000)
O OH HO OH OH H OH OH
Gambar 4. Galokatekin (Robinson,1995)
O HO OH OH OH OH O HO OH OH OH OH O HO OH OH OH OH
Gambar 5. Oligomer proantosianidin (Robbers, Speedie, and Tyler, 1996)
Tanin terhidrolisis mengandung ikatan ester yang dapat terhidrolisis jika dididihkan dalam asam klorida encer. Tanin terhidrolisis biasanya berupa senyawa amorf, higroskopis, berwarna coklat kuning yang larut dalam air (Robinson,1995). Contoh tanin terhidrolisis adalah asam galat dan asam heksahidroksidifenat serta derivatnya, hasil esterifikasi dengan glukosa (Robbers et al ,1996). Galotanin
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
11
adalah ester asam galat dengan glukosa, sedangkan ester asam heksahidroksidifenat dengan glukosa adalah elagitanin (Puspitasari,2007)
HO HO
HO
COOH
Gambar 6. Asam galat (Robinson,1995)
Gambar 7. Galotanin (Puspitasari,2007)
OH
HO
HO
HOOC OH
OH COOH
OH
Gambar 8. Asam heksahidroksidifenat (Mills,2000)
Gambar 9. Asam elagitanin (Puspitasari,2007)
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
12
Tabel I. Penggolongan tanin tumbuhan (Harborne,1987)
Tata nama Struktur
Jangka bobot molekul Endapan protein Tanin-terkondensasi Proantosianidin (atau flavolan)
Oligomer katekin dan flavan-3,4-diol
1000-3000 + + + + Tanin terhidrolisiskan
Galotanin Elagitanin
Ester asam galat dan glukosa Ester asam heksahidroksidifenat dan glukosa 1000-1500 1000-3000 + + + + + + + + + + Prototanin
Prazat tanin Katekin (dan galokatekin) Flavan-3,4-diol
200-600 ±
Salah satu uji tanin yang paling dikenal adalah uji pengendapan gelatin, yaitu dengan menambahkan larutan gelatin 0,5% ke dalam larutan tanin 0,5% yang volumenya sama. Semua tanin menghasilkan endapan walaupun jumlah endapan beragam. Kepekaan reaksi dapat ditingkatkan dengan menyesuaikan pH menjadi sekitar 4 dengan menambahkan natrium klorida sedikit, hal ini diperlukan karena senyawa fenol lain dapat memberikan hasil positif pada uji pengendapan gelatin. Reaksi endapan lain dengan amina atau ion logam sering dipakai untuk identifikasi tanin, misalnya besi (III) klorida menghasilkan warna violet-biru (Robinson,1995).
Uji untuk membedakan tanin terhidrolisis dan tanin terkondensasi. Penambahan asam asetat 10% dan larutan timbal asetat 10% (2:1)v/v ke dalam larutan tanin 0,4% yang sudah disaring, tanin terhidrolisis akan menimbulkan endapan dalam 5 menit, sedangkan tanin terkondensasi tetap berupa larutan. Selain itu juga dapat menggunakan kromatografi lapis tipis, bercak dapat ditunjukkan memakai uap amonia dan dilihat dengan sinar UV, atau dengan
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
13
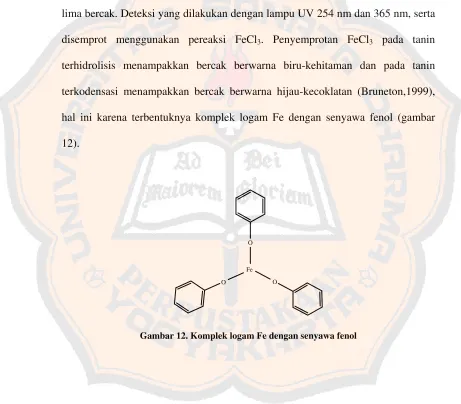
penyemprotan memakai FeCl3 (Robinson,1995). Penyemprotan FeCl3 pada tanin terhidrolisis menampakkan bercak berwarna biru-kehitaman dan pada tanin terkodensasi menampakkan bercak berwarna hijau-kecoklatan (Bruneton,1999).
Proantosianidin dapat dideteksi langsung dalam jaringan tumbuhan hijau dengan mencelupkannya ke dalam HCl 2 M mendidih selama 30 menit. Bila terbentuk warna merah yang dapat diekstraksi dengan amil atau butil alkohol, maka ini merupakan bukti adanya senyawa tersebut (Harborne,1987).
C. Penyarian
Penyarian merupakan peristiwa pemindahan zat aktif yang semula berada di dalam sel, ditarik oleh cairan penyari sehingga cairan penyari tersebut menjadi larutan zat aktif. Pada umumnya penyarian akan bertambah baik bila permukaan serbuk simplisia yang bersentuhan dengan cairan penyari makin luas. Cairan penyari harus dapat mencapai seluruh serbuk dan secara terus menerus mendesak larutan yang memiliki konsentrasi yang lebih tinggi keluar (Anonim,1986).
Pemilihan cairan penyari harus mempertimbangkan banyak faktor. Cairan penyari yang baik harus memenuhi kriteria : murah dan mudah diperoleh, stabil secara fisika dan kimia, bereaksi netral, tidak mudah menguap dan tidak mudah terbakar, selektif yaitu hanya menarik zat berkhasiat yang dikehendaki, tidak mempengaruhi zat berkhasiat, dan diperbolehkan oleh peraturan. Pelarut organik kurang digunakan dalam penyarian, kecuali dalam proses penyarian tertentu. Salah satu contoh eter minyak tanah yang digunakan untuk menarik lemak dari serbuk simplisia sebelum dilakukan proses penyarian (Anonim,1986).
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
14
Cairan penyari yang digunakan dapat berupa air, etanol, air-etanol dan pelarut lain. Air dipertimbangkan sebagai penyari karena murah dan mudah diperoleh, stabil, tidak mudah menguap, dan tidak mudah terbakar, tidak beracun, dan alamiah. Kerugian penggunaan penyari air adalah tidak selektif, sari dapat ditumbuhi kapang dan kuman serta cepat rusak, dan untuk pengeringan diperlukan waktu yang lama (Anonim,1986).
Metode penyarian menurut buku sediaan galenik (Anonim,1986) antara lain infundasi, maserasi, perkolasi, dan penyarian berkesinambungan.
1. Infudasi adalah proses menyari simplisia dengan air pada suhu 90ºC selama 15 menit. Infudasi umumnya digunakan untuk menyari zat kandungan aktif yang larut dalam air dari bahan-bahan nabati. Penyarian ini menghasilkan sari yang tidak stabil dan mudah tercemar oleh kuman dan kapang. Maka dari itu, sari yang diperoleh tidak boleh disimpan lebih dari 24 jam.
2. Maserasi dilakukan dengan cara merendam serbuk simplisia dalam cairan penyari. Cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif, zat aktif akan larut dan karena adanya perbedaan konsentrasi antara larutan zat aktif di dalam sel dengan yang di luar sel, maka larutan yang terpekat didesak keluar. Peristiwa tersebut berulang sehingga terjadi keseimbangan konsentrasi antara larutan diluar sel dan di dalam sel. Cairan penyari yang digunakan dapat berupa air, etanol, air-etanol dan pelarut lain. Bila cairan penyari digunakan air maka untuk mencegah timbulnya kapang, dapat ditambahkan bahan pengawet, yang diberikan pada awal penyarian.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
15
Keuntungan cara penyarian dengan maserasi adalah cara pengerjaan dan peralatan yang digunakan sederhana dan mudah diusahakan. Cara penyarian ini juga mempunyai kerugian yaitu pengerjaannya lama dan penyariannya kurang sempurna.
Maserasi dapat dilakukan modifikasi, misalnya:
a. Digesti adalah cara maserasi dengan menggunakan pemanasan lemah, yaitu pada suhu 40°-50°C.
b. Maserasi dengan mesin penggaduk. Penggunaan mesin pengaduk yang berputar terus menerus sewaktu proses maserasi dapat dipersingkat menjadi 6-24jam.
c. Remaserasi yaitu cairan penyarinya dibagi dua. Seluruh serbuk simplisia dimaserasi dengan cairan penyari pertama, sesudah dienap tuangkan dan diperas, ampas dimaserasi lagi dengan cairan penyari yang kedua.
3. Perkolasi adalah cara penyarian yang dilakukan dengan mengalirkan cairan penyari melalui serbuk simplisia yang telah dibasahi. Prinsip perkolasi adalah serbuk simplisia ditempatkan dalam suatu bejana silinder, yang bagian bawahnya diberi sekat berpori. Cairan penyari dialirkan dari atas ke bawah melalui serbuk tersebut, cairan penyari akan melarutkan zat aktif sel-sel yang dilalui sampai mencapai keadaan jenuh. Gerak ke bawah disebabkan oleh kekuatan gaya berat sendiri dan cairan diatasnya, dikurangi dengan daya kapiler yang cenderung untuk menahan.
4. Penyarian berkesinambungan menggabungkan antara proses menghasilkan ekstrak cair dan proses penguapan. Cairan penyari dipanaskan hingga mendidih,
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
16
uap penyari akan naik keatas melalui serbuk simplisia. Uap penyari mengembun karena didinginkan oleh pendingin balik. Embun turun melalui serbuk simplisia sambil melarutkan zat aktifnya dan kembali ke labu. Cairan akan menguap kembali dan prosesnya akan berulang (Anonim,1986).
D. Kromatografi Lapis Tipis
Kromatografi lapis tipis (KLT) digunakan untuk memisahkan senyawa yang berbeda, seperti senyawa organik alam dan senyawa organik sintetik, kompleks anorganik-organik, dan bahkan ion anorganik. KLT dapat dilakukan dengan waktu yang relatif singkat dengan alat yang sederhana dan harganya tidak terlalu mahal. Kelebihan KLT yang lain ialah pemakaian pelarut dan cuplikan dalam jumlah sedikit (Gritter, Bobbit, and Scwharting, 1991).
Metode pemisahan pada dasarnya menggunakan dua fase yaitu fase gerak dan fase diam. Fase gerak bergerak terhadap fase diam pada bidang datar sedangkan fase diam ditempatkan pada penyangga berupa gelas yang cocok. Campuran senyawa (ekstrak) yang akan dipisahkan ditotolkan pada fase diam dan dikembangkan dalam bejana berisi fase gerak yang tertutup rapat (Stahl,1985).
Kelebihan khas KLT ialah keserbagunaan, kecepatan, dan kepekaannya. Keserbagunaan KLT disebabkan karena sejumlah fase diam yang berbeda-beda dapat disaputkan pada pelat kaca atau penyangga lain dan digunakan untuk kromatografi. Walaupun silika gel paling banyak digunakan, lapisan dapat pula dibuat dari selulosa, alumunium oksida, kalsium hidroksida, damar penukar ion, magnesium fosfat, poliamida, sephadex, polivinil pirolidon, dan campuran dua
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
17
bahan di atas atau lebih. Kepekaan KLT bila diperlukan dapat memisahkan bahan yang jumlahnya lebih sedikit dari ukuran µg (Harborne,1987).
Lapisan penjerap dapat terikat dan melekat pada pelat kaca karena adanya berbagai pengikat. Pengikat yang paling umum digunakan adalah kalsium sulfat (CaSO4) yang ditambahkan ke dalam penjerap sampai 10-15%. Maka nama dari penjerap biasanya diberi tanda G, misal silica gel G (Redja, 1980). Lapisan penjerap sering mengandung indikator fluoresensi yang ditambahkan untuk membantu penampakan bercak tidak berwarna pada lapisan yang telah dikembangkan. Indikator fluoresensi adalah senyawa yang memancarkan sinar tampak jika disinari dengan sinar berpanjang gelombang lain, biasanya sinar ultraviolet. Dan biasanya penjerap yang dicampur dengan indikator fluoresensi diberi tanda F, misalnya silika gel GF. Jika senyawa pada bercak yang ditampakkan mengandung ikatan rangkap terkonjugasi atau cincin aromatis, maka sinar UV yang mengeksitasi tidak dapat mencapai indikator fluoresensi sehingga tidak ada cahaya yang dipancarkan. Dengan demikian hasilnya ialah bercak gelap dengan latar belakang yang bersinar. Cara ini sangat peka dan tidak merusak senyawa yang ditampakkan. Indikator fluoresensi yang paling sering digunakan adalah sulfida anorganik, yang dapat memancarkan cahaya jika disinari pada 254 nm (Gritter et al, 1991).
Jika semua senyawa yang dikromatografi berwarna, dapat dengan mudah dilihat apakah campuran terpisah dan seberapa jauh pemisahan itu. Jika beberapa atau semua senyawa tak berwarna, bercak harus ditampakkan dengan beberapa cara atau pereaksi. Cara penampakan dapat berupa metode umum yang dipakai
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
18
pada pelat kecil ialah uap iodium, pemakaian sinar UV pada senyawa yang berfluoresensi, dan pemakaian sinar UV pada lapisan yang mengandung indikator fluoresensi (Gritter et al, 1991).
Identifikasi dari senyawa-senyawa yang terpisah pada lapisan tipis lebih baik dikerjakan dengan pereaksi kimia dan reaksi-reaksi warna. Tetapi lazimnya untuk identifikasi menggunakan harga Rf , harga Rf didefinisikan sebagai berikut:
Jarak dari totolan sampai titik tengah bercak Harga Rf =
Jarak pengembangan
Harga-harga Rf untuk senyawa-senyawa murni dapat dibandingkan dengan harga-harga Rf standar. Harga-harga-harga Rf untuk berbagai campuran dari fase gerak dan fase diam juga dapat diperoleh dan dibandingkan dengan harga standar untuk senyawa yang campuran (Sastrohamidjojo,2002).
Faktor-faktor yang mempengaruhi gerakan bercak dalam KLT yang juga mempengaruhi harga Rf adalah struktur kimia dari senyawa yang sedang dipisahkan, sifat dari penjerap dan derajat aktifitasnya, tebal dan kerataan dari lapisan penjerap, pelarut (dan derajat kemurnian) fase gerak, derajat kejenuhan dari uap dalam bejana pengembangan yang digunakan, teknik percobaan, jumlah cuplikan yang digunakan, suhu, kesetimbangan antara atmosfer dalam bejana jenuh dengan uap pelarut (Sastrohamidjojo, 2002).
E. Kromatografi Lapis Tipis Preparatif
Kromatografi lapis tipis preparatif (KLTP) merupakan salah satu metode pemisahan yang memerlukan biaya yang murah dan memakai peralatan yang
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
19
sederhana. Walaupun KLTP dapat memisahkan bahan dalam jumlah gram, sebagian besar pemakaian hanya dalam jumlah miligram (Hostettmann, Hostettmann, and Marston, 1995).
Berbagai penelitian telah dilakukan untuk memeriksa pengaruh ketebalan fase diam terhadap kualitas pemisahan (Stahl,1985) tetapi ketebalan yang sering dipakai ialah 0,5-2 mm. Ukuran pelat kromatografi biasanya 20x20cm atau 20x40cm. Pembatasan ketebalan lapisan dan ukuran pelat sudah tentu mengurangi jumlah bahan yang dapat dipisahkan dengan KLTP. Fase diam yang paling umum ialah silika gel dan dipakai untuk pemisahan campuran senyawa lipofil maupun campuran senyawa hidrofil (Hostettmann et al,1995).
Cuplikan dilarutkan dalam sedikit pelarut sebelum ditotolkan pada pelat KLTP. Pelarut yang baik ialah pelarut atsiri (heksana, diklorometana, etil asetat), karena jika pelarut kurang atsiri terjadi pelebaran pita. Konsentrasi cuplikan harus sekitar 5-10%. Cuplikan ditotolkan berupa pita yang harus sesempit mungkin karena pemisahan bergantung pada lebar pita. Penotolan dapat dilakukan dengan tangan (pipet) tetapi lebih baik dengan penotol otomatis (Camag, Desaga, dsb). Untuk pita yang terlalu lebar, dapat dilakukan pemekatan dengan cara pengembangan memakai pelarut polar sampai kira-kira 2 cm di atas tempat penotolan. Kemudian pelat dikeringkan dan dielusi dengan pelarut yang diinginkan (Hostettmann et al,1995).
Cuplikan yang akan dipisahkan ditotolkan berupa garis pada salah satu sisi pelat lapisan besar dan dikembangkan secara tegak lurus pada garis cuplikan sehingga campuran akan terpisah menjadi beberapa pita. Pita ditampakkan dengan
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
20
cara yang tidak merusak jika senyawa itu tanpa warna dan fase diam yang mengandung pita dikerok dari pelat kaca. Kemudian cuplikan dielusi dari fase diam dengan pelarut polar. Cara ini berguna untuk memisahkan campuran reaksi sehingga diperoleh senyawa murni (Gritter et al,1991).
F. Keterangan Empiris
Tanaman krokot diketahui mengandung senyawa tanin. Senyawa tanin terbagi menjadi dua jenis, yaitu tanin terhidrolisis dan tanin terkondensasi. Maka penelitian ini dimaksudkan untuk mengisolasi dan mengidentifikasi jenis senyawa tanin yang terdapat pada herba krokot. Isolasi dilakukan dengan KLTP dan diidentifikasi menggunakan reaksi warna dan reaksi pengendapan.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
21 BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini tergolong dalam penelitian yang bersifat non eksperimental, karena di dalam penelitian ini tidak dilakukan manipulasi atau intervensi terhadap subyek uji.
B. Definisi Operasional Definisi yang terdapat dalam penelitian ini adalah :
1. Krokot yang digunakan adalah krokot yang berbatang kemerahan, bunga berwarna kuning mekar pada jam 8-10 pagi dan layu menjelang sore, daun tunggal dan berbentuk bulat telur, tebal, berdaging, dan permukaan atas berwarna hijau tua sedangkan permukaan bawah merah tua.
2. Herba krokot yang dimaksud dalam penelitian ini adalah bagian dari tanaman krokot yang berada di atas permukaan tanah (daun, batang, bunga, dan buah). 3. Isolasi tanin adalah proses pemisahan senyawa tanin yang terdapat dalam
herba krokot dengan metode KLT preparatif.
4. Identifikasi tanin adalah uji kualitatif keberadaan tanin secara uji pengendapan dan penentuan jenisnya dengan menggunakan metode KLT, uji pengendapan, dan reaksi warna.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
22
5. Uji pengendapan yang dimaksud adalah uji untuk mengetahui identitas tanin pada krokot dengan penambahan Pb asetat 10%, penambahan asam asetat : Pb asetat (2:1), dan penambahan putih telur.
6. Uji warna adalah uji ada atau tidaknya proantosianidin yang menghasilkan warna pada penambahan HCl dan dipanaskan.
C. Alat dan Bahan Penelitian 1. Alat penelitian
Alat-alat gelas (Pyrex), timbangan elektrik (Metler Toledo), pisau stainless steel, peralatan kromatografi lapis tipis, oven, waterbath (Memmert), lampu ultra
violet (UV) dengan λ 254 nm dan 365 nm, corong Buchner, shaker (InnovaTM 2100), sintered glass, dan alat fotografi.
2. Bahan penelitian
Semua bahan kimia yang digunakan pada penelitian ini berderajat pro analisa (p.a) kecuali disebut khusus.
a. Bahan yang diteliti : herba krokot.
b. Bahan yang diperlukan dalam penelitian : KOH, NaCl, tanin, gelatin, HCl, silika gel GF 254, n-butanol, asam asetat, akuades, etil asetat, metanol, asam formiat, etanol, protoleum eter, aseton, dan Pb asetat.
D. Tahapan Penelitian
1. Determinasi tumbuhan
Determinasi tumbuhan dilakukan dengan acuan (Van Steenis,1992).
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
23
2. Pengumpulan bahan
Bahan uji berupa tanaman krokot yang tumbuh liar di daerah pinggir jalan selokan Babarsari, Yogyakarta. Krokot yang diambil mempunyai bunga berwarna kuning, berbatang kemerahan, daunnya berbentuk bulat telur, pada bagian atas berwarna hijau tua sedangkan bagian bawahnya berwarna merah tua. Pengumpulan pada bulan Januari dan pengambilannya pukul 9 pagi.
3. Uji pendahuluan
Herba krokot (20g) dirajang halus dengan ukuran maksimal 0,5 cm menggunakan pisau stainless steel ditambah air (40ml) dipanaskan selama 30 menit di atas waterbath. Larutan disaring dengan kapas. Bila larutan berwarna kuning sampai merah menunjukkan adanya senyawa yang mengandung kromofor (flavonoida, antrakinon, dan sebagainya), dengan gugus hidrofilik (gula, asam, fenolat, dan sebagainya). Pada penambahan beberapa tetes larutan KOH warna larutan menjadi lebih intensif.
4. Uji pengendapan
Sejumlah 15 g herba krokot yang dirajang halus dengan ukuran maksimal 0,5 cm menggunakan pisau stainless steel dipanaskan dengan 30 ml air selama 30 menit di atas penangas air kemudian disaring. Diambil 5 ml filtrat kemudian ditambah larutan NaCl 2%. Bila terjadi suspensi atau endapan disaring melalui kertas saring, kemudian filtrat ditambah gelatin 1% sebanyak 5ml. Terbentuknya endapan menunjukkan adanya tanin.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
24
5. Deteksi tanin terkondensasi (proantosianidin)
Herba krokot dirajang halus kemudian dimasukkan ke dalam tabung reaksi dan direndam dengan HCl 2M, dipanaskan di atas penangas air selama 5 menit, kemudian didinginkan. Jika positif ada proantosianidin akan terbentuk warna merah (Harborne, 1987).
6. Penyarian
Sebelum diisolasi, terlebih dahulu dilakukan penyarian dengan cara maserasi terhadap rajangan herba krokot. Caranya dengan merendam rajangan herba krokot (20g) menggunakan pelarut petroleum eter kemudian larutan petroleum eter dibuang dan dilanjutkan dengan pelarut air : aseton (30:70) sebanyak 40ml dalam erlenmeyer selama satu hari dengan proses pengadukan sampai menjadi bubur cair. Ekstraksi ini dilakukan sebanyak 5 erlenmeyer. Campuran dipisahkan dengan corong Buchner dibantu dengan penghisapan. Ekstrak yang didapat kemudian diuapkan sampai mengental. Selanjutnya dilakukan dengan uji identifikasi dengan KLT.
7. Pemeriksaan tanin dengan KLT
Ekstrak kental dibuat konsentrasi 2% dengan cara diencerkan. Kemudian ditotolkan pada fase diam silika gel GF254 yang terlebih dahulu sudah diaktifkan dalam oven dengan suhu kira-kira 100ºC selama 30 menit (Sastrohamidjojo,2002) supaya fase diam benar-benar bebas dari air. Setelah totolan kering, lempeng KLT dikembangkan dalam bejana jenuh yang berisi fase gerak. Penjenuhan bejana dilakukan dengan memasukkan kertas saring yang dipotong seukuran setengah keliling bejana dengan posisi vertikal pada bejana yang terisi fase gerak. Bejana
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
25
dianggap jenuh bila kertas saring sudah terbasahi seluruhnya oleh fase gerak. Pengembangan dilakukan sampai batas jarak pengembangan.
Fase gerak yang digunakan adalah n-butanol, asam asetat, air (4:1:5)v/v; etil asetat, metanol, air (100:16,5:13,5)v/v; etil asetat, asam formiat, asam asetat, air (100:11:11:27)v/v dan fase diam silika gel GF 254. Deteksi awal bercak dilakukan di bawah sinar UV 254 nm dan 365 nm. Apabila bercak belum jelas dapat diperjelas dengan disemprot pereaksi FeCl3 menghasilkan bercak berwarna hijau, biru,ungu, atau hitam. Dari hasil KLT yang didapat kemudian dipilih yang harga Rf-nya paling mendekati standart tanin dan yang hasil pemisahan senyawanya terbaik.
8. Isolasi senyawa dengan KLT preparatif
Ekstrak air yang ditotolkan berupa garis pada fase diam. Selanjutnya dikembangkan dengan fase gerak yang paling cocok diantara ketiga fase gerak dari pemeriksaan awal dengan jarak pengembangan 10 cm. Bercak yang terbentuk dilihat dengan sinar UV 254 nm dan 365 nm, kemudian dikerok dan dikumpulkan lalu disari dengan air : aseton (30:70).
9. Uji Identifikasi tanin a. Penambahan Pb asetat 10%.
Setengah gram isolat dipanaskan dengan 5 ml air selama 30 menit kemudian disaring. Filtrat (2,5 ml) ditambah larutan Pb asetat 10% sebanyak 2,5 ml. Jika positif tanin akan terbentuk endapan (Robinson, 1995).
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
26
b. Uji pengendapan.
Larutan encer tanin terkondensasi akan mengendap dengan penambahan putih telur ayam dengan pH antara 3 sampai 6 (Harborne, 1987).
c. Uji untuk membedakan tanin terhidrolisis dan tanin terkondensasi
Dalam larutan tanin 0,4 % yang sudah disaring ditambahkan asam asetat dan Pb asetat (2:1) v/v. Jika terjadi endapan setelah 5 menit berarti tanin terhidrolisiskan, tetapi jika tetap berupa larutan berarti tanin terkondensasi. Bandingkan dengan larutan asam tanat 0,4 % yang diberi perlakuan yang sama.
E. Tata Cara Analisis Hasil
Data yang telah diperoleh berupa data kualitatif dan akan dipaparkan secara eksploratif deskriptif.
Analisis kandungan kimia herba krokot, dalam hal ini untuk mengetahui jenis tanin dilakukan dengan uji pendahuluan dan pemeriksaan tanin dengan KLT; yaitu dengan cara membandingkan warna dan fluoresensi bercak serta hRf dari ekstrak herba krokot dan senyawa pembanding asam tanat secara kualitatif.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
27 BAB IV
HASIL DAN PEMBAHASAN
A. Determinasi Tumbuhan Krokot
Krokot yang digunakan dalam penelitian ini dideterminasi terlebih dahulu. Hal ini bertujuan untuk memastikan bahwa tanaman yang diteliti sesuai dengan yang dimaksud, sehingga tidak terjadi kekeliruan jenis tanaman yang digunakan dalam penelitian ini. Determinasi dilakukan menggunakan acuan (Van Steenis,1992).
Berdasarkan hasil determinasi dapat disimpulkan bahwa tanaman krokot yang digunakan dalam penelitian ini adalah benar yaitu Portulaca oleracea L (lampiran 1).
B. Pengumpulan Bahan
Penelitian ini menggunakan herba krokot yang diambil dari daerah Babarsari, tanaman krokot ini merupakan gulma yang tumbuh liar di pinggir selokan dan pinggir jalan pada tanah yang lembab, mempunyai bunga berwarna kuning (lampiran 2). Herba yang digunakan pada penelitian ini adalah herba segar. Hal ini dikarenakan herba krokot mengandung banyak air sehingga apabila dikeringkan membutuhkan waktu yang lama dan memungkinkan herba menjadi busuk. Selain itu Harborne (1987) menyebutkan bahwa ektraksi tanin dengan simplisia kering akan mengurangi jumlah zatnya dalam ekstrak karena terjadi perlekatan tanin pada tempatnya di dalam sel. Pengumpulan herba krokot ini
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
28
dilakukan pada waktu berbunga yaitu pagi hari (sekitar pukul 9), hal ini supaya herba krokot yang diambil benar jenisnya yaitu krokot yang bunganya berwarna kuning ( Portulaca oleracea L) sehingga bahan yang digunakan dalam penelitian ini tepat dengan yang dimaksud oleh peneliti.
Herba krokot yang telah dikumpulkan diuji organoleptik dahulu untuk memastikan herba tersebut sesuai dengan yang ingin diteliti. Pemeriksaan organoleptik dilakukan dengan berdasarkan pengamatan terhadap bentuk, rasa, warna, dan bau dari herba tersebut. Dari hasil pengamatan didapatkan data :
Tabel II. Hasil organoleptik herba krokot
Yang diamati Hasil
Bentuk
daun berbentuk bundar telur ; bunga berkelompok, keluar dari ujung-ujung cabang , mahkota bunga kecil dan berjumlah 5 ; batang merebah, bentuk bulat, lunak, berair dan tidak berkayu. Rasa asam agak sepet dan asam
Warna akar berwarna coklat ; batang berwarna coklat ungu kemerahan ; daun berwarna hijau tua bunga berwarna kuning. Bau baunya seperti sayuran pada umumnya
Data ini sesuai dengan deskripsi yang ada tentang krokot menurut Djauhariya & Hernani (2004), sehingga dapat disimpulkan bahwa herba ini sesuai dengan yang ingin diteliti.
Herba krokot yang telah dikumpulkan kemudian dicuci dengan air bersih yang mengalir dengan tujuan untuk menghilangkan kotoran yang menempel pada herba. Herba kemudian dirajang halus untuk memperkecil ukuran herba. Ukuran
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
29
yang kecil akan memperluas permukaan kontak dengan pelarut dan diharapkan tanin yang terekstraksi lebih banyak.
C. Uji Pendahuluan
Uji pendahuluan dilakukan untuk mengetahui adanya senyawa yang mengandung gugus kromofor dengan gugus hidrofilik (tanin, gula, asam fenolat,dsb). Dari hasil percobaan diperoleh hasil yang positif ditandai dengan larutan berwarna merah, dengan penambahan KOH warna larutan menjadi semakin intensif (lampiran3), sehingga dapat dikatakan herba krokot ini mengandung senyawa yang mempunyai gugus kromofor dengan gugus hidrofilik. Tanin mengandung gugus kromofor dengan gugus hidrofilik, dari uji ini dapat diduga bahwa herba krokot mengandung tanin.
D. Uji Pengendapan
Setelah dilakukan uji pendahuluan kemudian dilakukan uji tanin untuk memastikan bahwa herba krokot mengandung tanin. Salah satu uji yang paling dikenal ialah pengendapan gelatin. Uji tersebut dilakukan melalui proses penambahan natrium klorida dan penambahan gelatin. Kepekaan reaksi uji pengendapan dengan penambahan gelatin ini dapat ditingkatkan dengan menyesuaikan pH menjadi sekitar 4, karena senyawa fenol lainpun dapat memberikan uji positif, dan menambahkan natrium klorida sedikit (Robinson,1995). Uji tersebut menunjukkan hasil positif bahwa herba krokot mengandung tanin dengan tanda terbentuknya endapan (lampiran 4). Peristiwa
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
30
tersebut terjadi karena sifat tanin yang dapat menyamak protein (gelatin) sehingga membentuk endapan yang tidak larut air. Protein lebih sulit larut pada konsentrasi garam yang tinggi, penambahan natrium klorida yang merupakan garam ini dimaksudkan supaya pengendapan gelatin lebih optimal.
E. Deteksi Tanin Terkondensasi (Proantosianidin)
Proantosianidin dapat dideteksi langsung dalam jaringan tumbuhan hijau dengan merendam herba ke dalam HCl 2M yang dipanaskan selama setengah jam. Bila terbentuk warna merah merupakan bukti adanya senyawa tersebut (Harborne,1987). Deteksi tanin terkondensasi dalam penelitian ini menghasilkan hasil positif, yaitu terbentuk larutan yang berwarna merah (gambar 11).
Reaksi dengan asam ini menghasilkan antosianidin. Reaksi ini bersifat oksidasi. Oksidasi senyawa yang semula berupa polimer tak berwarna menghasilkan polimer berwarna yang dikenal sebagai flobafen atau merah tanin (Robinson,1995).
O
+ O
H H
OH OH H
OH H
H+ O2
Gambar 10. Reaksi pembentukan antosianidin untuk flavan-3,4-diol
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
31
Gambar 11. Foto deteksi tanin terkondensasi
F. Penyarian
Metode penyarian yang digunakan ialah maserasi. Maserasi dilakukan dengan cara merendam serbuk simplisia dalam cairan penyari (Anonim,1986). Herba krokot disari menggunakan campuran air : aseton (30:70), karena tanin mudah larut dalam larutan campuran air : aseton (30:70). Pertama-tama herba krokot disari menggunakan petroleum eter selama 30 menit. Petroleum eter bersifat non polar, penyarian ini dimaksudkan untuk melarutkan
senyawa-PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
32
senyawa yang bersifat non polar seperti lemak, lilin, dan klorofil. Penyarian kemudian dilanjutkan menggunakan cairan penyari (air : aseton (30:70)) selama 1hari dibantu dengan pengadukan.
Mekanisme penyarian dengan metode maserasi yaitu cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif. Zat aktif akan larut karena adanya perbedaan konsentrasi antara larutan zat aktif di dalam sel dengan yang di luar sel (Anonim,1986). Penyarian dengan cara maserasi ini dilakukan dengan pengadukan. Pengadukan yang dilakukan dalam percobaan ini menggunakan bantuan shaker, yaitu mesin pengaduk yang terus menerus berputar selama 1hari. Proses pengadukan ini berfungsi untuk mempercepat waktu maserasi.
Proses penyarian ini menghasilkan ekstrak cair yang berwarna coklat tua, kemudian ekstrak cair ini dipekatkan di atas penangas air hingga menjadi ekstrak kental. Ekstrak kental inilah yang kemudian digunakan untuk deteksi adanya senyawa tanin dengan menggunakan KLT dan KLTP.
G. Pemeriksaan Tanin dengan KLT
Pemeriksaan tanin dengan KLT pada ekstrak herba krokot diawali dengan pemilihan fase gerak dan fase diam yang sesuai. Fase gerak dan fase diam yang sesuai dapat diketahui dengan melihat terbentuknya bercak yang saling terpisah setelah pengembangan. Fase diam yang digunakan adalah silika gel GF254, dengan fase gerak n-butanol, asam asetat, air (4:1:5)v/v; etil asetat, metanol, air (100:16,5:13,5)v/v; serta etil asetat, asam formiat, asam asetat, air
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
33
(100:11:11:27)v/v. Dari hasil penelitian di dapatkan fase gerak yang paling sesuai untuk pemeriksaan tanin dengan KLT pada ekstrak herba krokot yaitu n-butanol, asam asetat, air (4:1:5)v/v (BAW), karena totolan yang dikembangkan pada fase gerak BAW memiliki bercak pemisahan yang baik (gambar 13).
Hasil yang didapat pada pengembangan dengan fase gerak BAW terlihat lima bercak. Deteksi yang dilakukan dengan lampu UV 254 nm dan 365 nm, serta disemprot menggunakan pereaksi FeCl3. Penyemprotan FeCl3 pada tanin terhidrolisis menampakkan bercak berwarna biru-kehitaman dan pada tanin terkodensasi menampakkan bercak berwarna hijau-kecoklatan (Bruneton,1999), hal ini karena terbentuknya komplek logam Fe dengan senyawa fenol (gambar 12).
O
Fe
O O
Gambar 12. Komplek logam Fe dengan senyawa fenol
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
34
Gambar 13. Hasil KLT dengan tiga fase gerak yang berbeda
Keterangan :
Fase diam : silika gel GF254
Fase gerak : a. n-butanol, asam asetat, air (4:1:5)v/v
b. etil asetat, metanol, air (100:16,5:13,5)v/v
c. etil asetat, asam formiat, asam asetat, air
(100:11:11:27)v/v
Pembanding : asam tanat (Cp)
Cs : sampel
Penampak bercak : sinar UV 365 nm
a b c
1,00
0,00 0,50 Rf
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
35
Tabel III. Hasil kromatogram KLT dengan menggunakan fase diam silika gel GF254 dan fase
gerak n-butanol, asam asetat, air (4:1:5)v/v
Warna bercak Nama bercak No
bercak hRf UV 254nm UV 365nm Sinar tampak dengan penyemprotan FeCl3 Cp
(pembanding) - 65 Kelabu
Ungu
kecoklatan Ungu kecoklatan 1 11 Kelabu Cokelat Cokelat 2 43 Kelabu Cokelat
muda Coklat muda 3 52 Kelabu Cokelat Cokelat
4 69 Kelabu Ungu
kecoklatan Ungu kecoklatan Cs
(sampel)
5 91 Hijau Kelabu Hijau kecoklatan
Dari hasil kromatogram (gambar14), dapat dilihat bahwa bercak ke empat mempunyai harga Rf yang hampir sama dengan bercak pembanding. Pembanding yang digunakan adalah asam tanat 2%. Asam tanat termasuk jenis tanin terhidrolisis. hRf bercak keempat sampel adalah 69 sedangkan bercak asam tanat 2% yaitu 65, harga hRf ini hampir sama dan juga warna bercak yang dihasilkan sama yaitu ungu kecoklatan. Robinson (1995) menyebutkan bahwa identifikasi tanin dengan ion logam, misalnya FeCl3 menghasilkan warna violet-biru, sehingga dapat disimpulkan bercak keempat tersebut adalah bercak tanin.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
36
Gambar 14. Hasil KLT dengan fase gerak n-butanol, asam asetat, air (4:1:5)v/v
Keterangan :
Fase diam : silika gel GF254
Pembanding : asam tanat (Cp)
Cs : sampel
Penampak bercak : sinar UV 254 nm
Sifat tanin cenderung polar, biasanya senyawa polar menggunakan fase diam yang non polar dan fase geraknya polar. Penelitian ini pernah menggunakan
0,00 0,50 1,00
1 2 3 4 5 Rf
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
37
fase diam selulosa tetapi bercak yang tampak berada di batas atas pengembangan (tidak memisah) sehingga menggunakan fase diam silika gel yang sifatnya polar supaya senyawa dalam ekstrak dapat sedikit tertahan pada fase diam sehingga dapat menampakkan pemisahan bercak yang baik. Fase gerak yang digunakan adalah BAW yang sifatnya cenderung kurang polar dibandingkan dengan 2 fase gerak yang lainnya. Penggunaan BAW sebagai fase gerak dapat menampakkan bercak pemisahan yang lebih baik dari 2 fase gerak yang lain (gambar 13). Hal ini karena senyawa-senyawa yang ingin dipisahkan tidak ikut fase geraknya (dapat tertahan pada fase diam) sehingga tampak pemisahan bercak yang baik.
H. Isolasi Senyawa dengan KLT Preparatif
Isolasi dilakukan dengan metode KLTP dengan menggunakan fase diam silika gel GF254 dan fase gerak BAW, karena pada KLT menghasilkan pemisahan bercak yang tampak baik di bawah sinar lampu UV 254 nm dan 365 nm, serta dengan penyemprotan menggunakan pereaksi FeCl3. Cuplikan yang akan diisolasi ditotolkan dengan bentuk pita pada plat KLTP. Jumlah cuplikan yang ditotolkan adalah 15 µl tiap totolan. Totolan harus benar-benar kering jika akan dielusi, karena jika totolan masih basah maka pemisahan bercak menjadi tidak baik.
Pemisahan dari KLTP ini (gambar 15, tabel IV) hanya terlihat 3 bercak dengan deteksi di bawah lampu UV 254 nm dan 365 nm dan deteksi semprot FeCl3. Untuk analisis lebih lanjut diambil bercak kedua karena bercak kedua mempunyai warna dan hRf yang mirip dengan bercak pembanding.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
38
Tabel IV. Hasil kromatogram KLTP dengan menggunakan fase diam silika gel GF254 dan
fase gerak n-butanol, asam asetat, air (4:1:5)v/v
Warna bercak Nama bercak No
bercak hRf
UV 254nm UV 365nm
Sinar tampak dengan penyemprotan
FeCL3 Cp
(pembanding) - 68 Kelabu
Ungu
kecoklatan Ungu kecoklatan 1 53 Kelabu Cokelat
muda Cokelat
2 62 Kelabu Ungu
kecoklatan Ungu kecoklatan Cs
(sampel)
3 89 Hijau oranye Hijau kecoklatan
A B
Gambar 15. Hasil KLTP dengan fase gerak n-butanol, asam asetat, air (4:1:5)v/v
Keterangan :
Fase diam : silika gel GF254
Pembanding : asam tanat (Cp)
Cs : sampel
Penampak bercak : a. sinar UV 254 nm b. sinar UV 365 nm
Cp
Cp Cs Cs
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
39
KLTP ini hanya terlihat 3 bercak, hal ini mungkin terjadi karena senyawa yang ada tidak terpisah dengan baik (menumpuk). Hasil isolasi yang ada perlu uji kemurnian sebelum uji identifikasi, hal ini untuk memastikan senyawa yang telah dipisahkan benar-benar murni senyawa yang diinginkan (tanin). Uji kemurnian ini menggunakan KLT multi eluen. KLT multi eluen ini adalah KLT dengan bermacam-macam fase gerak yang ada namun juga tetap dipertimbangkan kecocokannya dengan senyawa yang akan dipisahkan dan bila isolat yang benar-benar murni maka hanya tampak 1 bercak saja. KLT multi eluen dalam penelitian ini menggunakan 3 macam fase gerak yang berbeda-beda polaritasnya. Hal ini supaya bercak yang kemungkinan menumpuk pada isolat yang mempunyai polaritas yang berbeda dapat terdeteksi dengan KLT multieluen dengan fase gerak yang berbeda. Fase gerak dipilih berdasarkan literatur yang ada(Wagner,1984).
Hasil KLT multieluen dengan tiga macam fase gerak ini, masing-masing hanya menampakkan satu bercak namun hRfnya berbeda-beda (gambar 16). KLT dengan fase gerak BAW (4:1:5)v/v hRfnya 73, KLT dengan fase gerak etil asetat, metanol, air (100:13,5:10)v/v hRfnya 88, dan KLT dengan fase gerak etil asetat, metanol, air (100:16,5:13,5)v/v hRfnya 59. HRf ini berbeda-beda karena fase gerak yang digunakan berbeda-beda kepolarannya.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
40
Gambar 16. Hasil KLT multi eluen
Keterangan :
Fase diam : silika gel GF254
Fase gerak : a. n-butanol, asam asetat, air (4:1:5)v/v b. etil asetat, metanol, air (100:13,5:10)v/v
c. etil asetat, metanol, air (100:16,5:13,5)v/v Penampak bercak : sinar UV 254 nm
I. Uji Identifikasi Tanin
1. Penambahan Pb asetat 10%
Reaksi pengendapan dengan ion logam sering dipakai untuk identifikasi tanin, sehingga dalam penelitian ini diuji dengan penambahan larutan Pb asetat 10% pada filtrat isolat. Hasil yang didapat membentuk endapan berwarna putih Rf
1,00
0,00
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
41
kekuningan (gambar 18). Terbentuknya endapan ini dapat digunakan untuk menyimpulkan bahwa positif terdapat tanin.
O
O
H
H
+ Pb (CH3COO)2
O
O
Pb + 2 CH3COOH
Gambar 17. Reaksi dengan penambahan Pb(CH3COO)2
Gambar 18. Foto terbentuknya endapan pada penambahan Pb asetat 10%
Tanin terkondensasi Pb asetat
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
42
2. Uji pengendapan
Uji pengendapan dengan penambahan putih telur ayam dengan pH antara 3 sampai 6. Uji pengendapan dengan penambahan putih telur pada penelitian ini dilakukan pada pH 4. Hasil uji menghasilkan endapan berwarna putih kekuningan (gambar 21). Endapan dapat terjadi karena tanin mempunyai kemampuan untuk menyamak protein dengan membentuk senyawa komplek dengan protein sehingga tidak larut air (Harborne,1987). Hal ini karena tanin berikatan dengan permukaan protein membentuk lapisan hidrofil yang tidak larut air.
Gambar 21. Foto uji pengendapan
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
43
3. Uji untuk membedakan tanin terhidrolisis dan tanin terkondensasi
Isolat yang diperoleh kemudian diidentifikasi jenis taninnya. Robinson (1995) menyebutkan beberapa uji untuk membedakan tanin terhidrolisis (galotanin) dan tanin terkondensasi (tanin katekin). Salah satunya yaitu, pada tanin terhidrolisis akan terjadi endapan setelah 5 menit pada penambahan asam asetat 10% dan timbal asetat 10% (2:1) ke dalam larutan tanin 0,4% yang sudah disaring, tetapi pada tanin kondensasi tetap berupa larutan. Hasil yang diperoleh pada percobaan ini adalah larutan isolat tetap berupa larutan dan tidak dihasilkan endapan (gambar 20), ini berarti bahwa jenis tanin yang terdapat pada herba krokot adalah jenis tanin terkondensasi.
O
O
H
H
+ Pb (CH3COO)2
O
O
Pb + 2 CH3COOH
Gambar 19. Reaksi penambahan CH3COOH dan Pb(CH3COO)2 (2:1)
Tanin terkondensasi Pb asetat Asam asetat
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
44
Gambar 20. Foto penambahan asam asetat 10% dan timbal asetat 10% (2:1) ke dalam larutan tanin 0,4%
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
45 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Herba krokot mengandung tanin jenis tanin terkondensasi yang dapat diisolasi secara KLTP.
B. Saran
1. Perlu dilakukan uji kemurnian isolat menggunakan metode HPLC.
2. Perlu dilakukan penelitian tentang struktur tanin terkondensasi pada herba krokot ini.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
46
DAFTAR PUSTAKA
Anonim, 1986, Sediaan Galenik, 4-6, 8, 10, 16, 25, Departemen Kesehatan Republik Indonesia.
Anonim, 1995, Materia Medika Indonesia, Vol. VI, 215, Departemen Kesehatan Republik Indonesia.
Anonim, 2003, Sinar Harapan, http://www.sinarharapan.co.id/iptek/kesehatan/
2003/1010/kes1. html, diakses pada 18 Juli 2008.
Anonim, 2007, Wine Sehatkan Jantung, http://cybermed.cbn.net.id/cbprtl/
common/ptofriend.aspx?x=Nutrition&y=cybermed%7CO%7cO%7C6%7 C422, diakses pada 18 Juli 2008.
Anonim, 2008, Salting Out, http://en.wikipedia.org/wiki/Salting_out, diakses pada 1mei 2008.
Bruneton, J., 1999, Pharmacognosy: Phytochemistry Medicinal Plant, translated by Hatton C..K. , 2nd edition, 371-401, Intercept Ltd., New York.
Djauhariya, E. dan Hernani, 2004, Gulma Berkhasiat Obat, 8-10, 96-99, Penebar Swadaya, Jakarta.
Evans, W. C., 2002, Trease and Evans Pharmacognosy, 15th edition, 221-227, W.B. Saunders, Toronto.
Fahn, A., 1995, Plant Anatomy, diterjemahkan oleh Soediarto A., edisi III, 41, Gajah Mada University Press, Yogyakarta.
Gritter, R.J., Bobbit, J.M, dan Scwharting, A.E. , 1991, Introduction to Chtomatography, diterjemahkan oleh Padmawinata K., Terbitan ke-2, 107-115, 140, ITB, Bandung.
Harborne, J. B., 1987, Phytochemical Methods, 13-15, 102-109, diterjemahkan oleh Padmawinata.K dan Soediro I , Terbitan kedua, ITB, Bandung.
Heinrich, M., Barnes, J., Gibbons, S., dan Williamson, E. M., 2004, Fundamental of Pharmacognosy and Phytotherapy, 77-78, Churchill Livingstone, Toronto.
Hostettmann, K., Hostettmann, M., dan Marston, A., 1995, Cara Kromatografi Preparatif, diterjemahkan Padmawinata.K , 9-11, Penerbit ITB, Bandung.
Mann, J., Davidson, R.S., Hobbs, J.B., Banthorpe, D.V., dan Harborne, J.B., 1994, Natural Product
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
47
Mills, S, 2000, Principles and Practise of Phytoteraphy, 43-47, Churchill Livingstone, China.
Puspitasari, 2007, Tanin, elearning.unej.ac.id/courses/FAU1502/document/tanin. ppt.cidReg=FAU1502, diakses pada 1 Oktober 2007.
Putra, S. E., 2005, Bahan Alam, Ujung Tombak Riset Kimia di Indonesia, http://www.chem-is-try.org/?sect=fokus&ext=19, diakses pada 19 Juli 2008.
Redja, W., 1980, Teori Dasar Analisa Farmasi, Ed I, 99-102, 109, Sekolah Tinggi Laboratorium Kimia Farmasi, Departemen Kesehatan RI, Jakarta.
Robbers, J. E., Speedie, M.K., dan Tyler, V.E., 1996, Pharmacognosy and Pharmacobiotechnology, 139-142, Williams & Wilkins, Maryland, USA.
Robinson, T., 1995, The Organic Constituent of Higher Plants, diterjemahkan oleh Kosasih Padmawinata dan Iwang Soediro, edisi VI,71-72, Penerbit ITB, Bandung.
Sastrohamidjojo, H, 2002, Kromatografi, 26-36, Lieberty Yogyakarta, Yogyakarta.
Setyawan, E. I., 2004, Isolasi dan Identifikasi Tanin pada Daun salam, Skripsi, Fakultas Farmasi USD, Yogyakarta.
Stahl, E., 1985, Drug Analysis by Chromatografi and Microscopy, diterjemahkan oleh Kosasih Padmawinata & Iwang Soedira, 6-7; 16-17, ITB, Bandung.
Van, Steenis, C.G.G.J, 1992, Flora, cetakan ke-6, 34-37,48-56,182-183, PT. Pradnya Paramita, Jakarta.
Tyler V. E., Lynn, R.B., dan James, E.R. , 1988, Pharmacognosy, ninth edition, 77-81, Lea & Febiger, Philadelphia.
Wagner, H , Bladt, S, dan Zgainski, E.M, 1984, Plant Drug Analysis, 225-227, translated by Th.A.Scott, Springer-Verlag, Berlin.
Widarto, H. T., 2008, Bagaimana Tumbuhan Melindungi Diri dari Serangan
Serangga Hama?,http://ditjenbun.deptan.go.id/perlinbun/linbun
/index.php?option=com_content&task=view&id=123&Itemid=26, diakses pada 19 Juli 2008.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
48
Lampiran 1. Surat pengesahan determinasi
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
49
Lampiran 2. foto Krokot
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
50
Lampiran 3. Uji pendahuluan
Keterangan :
A = larutan rebusan krokot B = larutan asam tanat 3%
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
51
Lampiran 4. Uji pengendapan
Keterangan :
A = larutan asam tanat 3% B = larutan rebusan krokot
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
52
BIOGRAFI PENULIS
Prima Esteti lahir di Yogyakarta pada tanggal 11 Oktober 1984 sebagai putri pertama dari empat bersaudara, dari pasangan Siek Suhardiman dan Ie Marmiyatun. Penulis mulai menempuh pendidikan di Taman Ka