IDENTIFIKASI FLAVONOIDA PADA HERBA PEGAGAN EMBUN (Hydrocotyle sibthorpioides Lmk.) HASIL ISOLASI SECARA
KROMATOGRAFI LAPIS TIPIS PREPARATIF (KLTP)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Farmasi
Oleh :
Titien Christinawati NIM : 038114056
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
Ta k a d a h a l y a n g p a lin g in d a h d a la m h i d u p in i s e la in
s a a t k it a m e n d a p a t k a n
dukungan
d a r i o r a n g -o r a n g
y a n g s a n g a t k it a s a y a n g i d a n m e n y a y a n g i k it a d i
s a a t k it a ja t u h .
“Janganlah hendaknya kamu kuatir
tentang apapun juga, tetapi nyatakanlah
dalam segala hal keinginanmu kepada Allah
dalam doa dan permohonan dengan ucapan
syukur” (Filipi 4; 6)
Persembahanku untuk
Tuhan Yesus dan Bunda Maria yang selalu menjadi perantara doa-doaku
Bapak dan I buku yang tak pernah berhenti menyayangi dan mendoakanku
Mbak Ari, Mas Eko dan Mbak I na yang selalu menyemangatiku
Mas Freddyku yang selalu menemani dan memberikan dukungannya
INTISARI
Herba pegagan embun (Hydrocotyle sibthorpioides Lmk.) merupakan salah satu jenis tumbuhan yang belum banyak dikenal masyarakat. Herba pegagan embun telah diketahui mengandung minyak atsiri, kumarin, saponin, terpen dan hiperin. Herba pegagan embun berkhasiat untuk mengobati sakit kuning (hepatitis), infeksi saluran kencing, infeksi amandel, infeksi telinga tengah dan sariawan. Kemungkinan yang berperan adalah flavonoidanya.
Penelitian ini bertujuan untuk mengidentifikasi jenis flavonoida selain hiperin yang terkandung dalam herba pegagan embun dengan menggunakan kromatografi lapis tipis (KLT), reaksi warna dan spektrofotometri UV. Flavonoida didapat dengan mengekstraksi herba pegagan embun dengan menggunakan campuran metanol dan air secara maserasi yang selanjutnya dianalisis dengan KLT dengan fase diam selulosa dan fase gerak n-butanol : asam asetat : air (BAW; 4 : 1 : 5, fase atas). Kemudian dilakukan isolasi dengan kromatografi lapis tipis preparatif (KLTP).
Didapat 3 bercak yang sesuai ciri flavonoida. Bercak tersebut masing-masing dengan Rf 0,63; 0,76; 0,90. Bercak dengan Rf 0,76 dan 0,90 dikerok dan dilarutkan dalam metanol yang kemudian diperiksa kemurniannya dengan menggunakan KLT multi eluen dengan fase diam selulosa dan fase gerak BAW dan asam asetat 15%. Dari hasil KLT multi eluen diketahui bahwa senyawa belum murni sehingga dilakukan reisolasi dengan fase gerak asam asetat 15 %. Dari hasil reisolasi diperoleh bahwa semua senyawa adalah tunggal (murni) sehingga dapat digunakan untuk analisis selanjutnya. Dipilih isolat yang tidak sesuai dengan ciri hiperin. Isolat tersebut dianalisis dengan reaksi warna dan spektrofotometri UV untuk mengetahui golongan dan posisi OH pada struktur flavonoida.
Hasil penelitian ini menunjukkan bahwa isolat flavonoida yang diidentifikasi termasuk dalam golongan isoflavon yaitu 7,8-dihidroksi isoflavon.
ABSTRACT
Pegagan embun herb (Hydrocotyle sibthorpioides Lmk.) is a kind of plants that has not been known by people. Pegagan embun herb contains essential oil, coumarin, saponin, terpenoid and hyperin. Pegagan embun herb is useful for healing hepatitis, urinary tract infection, tonsil infection, middle ear infection and sprue. Flavonoid might play its role in healing those diseases.
This study has a purpose to identify the kind of flavonoid instead of hyperin that is contained in pegagan embun herb by using thin layer chromatography (TLC), color reaction and UV spectrofotometry. Flavonoid was obtained by extracting pegagan embun herb using mixture of methanol and water by maseration that furthermore analyzed with TLC with stationery phase of cellulose and mobile phase of n-butanol : acetic acid : water (BAW; 4 : 1 : 5, upper phase). And then, isolation was done with preparative thin layer chromatography (PTLC).
It was obtained 3 spots that similar to the characteristics of flavonoid. That spot with each Rf 0,63; 0,76; 0,90. The spot with Rf 0,76 and 0,90 were taken and dissolved into methanol and then the purity was examined using multi eluen (TLC) with stationery phase of cellulose and mobile phase of BAW and 15 % acetic acid. From the result of multi eluen TLC was known that compound was not yet pure so reisolation was done with mobile phase of 15 % acetic acid. From the result of reisolation, it was obtained that all of the compounds were singular (pure), so it can be used for next analysis. An isolate was chosen, in which the characteristic is not similar to the characteristic of hyperin. The isolate was analyzed with color reaction and UV spectrofotometry to know the group and the OH position on the flavonoid structure.
The result of this examination indicated that the identified flavonoid isolate was included in the isoflavone group that is 7,8-dihydroxy isoflavone.
Key words : flavonoid, pegagan embun herb, UV spectrofotometry, PTLC, 7,8-dihydroxy isoflavone
KATA PENGANTAR
Puji syukur dan terima kasih penulis panjatkan kepada Tuhan Yesus dan
Bunda Maria atas berkat, kasih karunia dan penyertaan-Nya sehingga penulis
dapat menyelesaikan skripsi yang berjudul Identifikasi Flavonoida pada Herba Pegagan Embun (Hydrocotyle sibthorpioides Lmk.) Hasil Isolasi Secara Kromatografi Lapis Tipis Preparatif (KLTP).
Skripsi ini disusun guna memenuhi salah satu syarat untuk memperoleh
gelar Sarjana Farmasi (S. Farm.) pada Fakultas Farmasi Universitas Sanata
Dharma Yogyakarta.
Selama penelitian sampai penyusunan skripsi ini, penulis tidak lepas dari
bantuan dari berbagai pihak berupa bimbingan, dorongan, pengarahan, saran,
ataupun fasilitas. Untuk itu pada kesempatan ini penulis ingin menyampaikan
ucapan terima kasih kepada :
1. Ibu Rita Suhadi, M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas
Sanata Dharma Yogyakarta.
2. Bapak Yohanes Dwiatmaka, M.Si. selaku dosen pembimbing atas segala
bimbingan, saran, pengarahan, dan kesempatan yang telah diberikan
selama penelitian maupun dalam penyusunan skripsi ini.
3. Ibu Christine Patramurti, M.Si., Apt. selaku dosen penguji atas segala
masukan berupa kritik dan saran demi kesempurnaan skripsi ini.
4. Ibu Erna Tri Wulandari, M.Si., Apt. selaku dosen penguji atas segala
5. Laboran Fakultas Farmasi, Mas Wagiran, Mas Sigit, Mas Andri, Mas
Ottok, Mas Kunto dan Pak Mukmin yang telah membantu selama
penelitian.
6. Sahabat-sahabatku tercinta, Ratna, Rosa, Komang, Devi, Maria dan Anin
untuk persahabatan dan dukungannya selama ini dalam segala hal.
7. Teman-teman kelompok C untuk kebersamaan dan kenangannya selama 3
tahun dalam praktikum.
8. Hartono, Aan, Timur, Madya, Bhodonk, Mas Prasojo dan Mas Sugiyono
atas bantuannya dalam penyusunan skripsi.
9. Teman-teman kos Benteng, Mbak Utik, Mbak Kenny, Veni, Neldy, Mbak
Icha, Mbak Kristin, Ajoe dan Mbak Nanay atas keceriaannya dan
kebersamaannya.
10.Teman-teman kelas B dan teman-teman seperjuanganku di Laboratorium
Farmakognosi-Fitokimia.
11.Semua pihak yang telah membantu selama penyelesaian skripsi ini yang
tidak dapat disebutkan satu persatu.
Penulis menyadari bahwa dalam penelitian dan penyusunan skripsi ini
masih terdapat banyak kekurangan. Namun penulis berharap semoga skripsi ini
dapat bermanfaat bagi masyarakat dan perkembangan ilmu pengetahuan.
Yogyakarta, Juli 2007
DAFTAR ISI
Halaman
HALAMAN JUDUL ………i
HALAMAN PERSETUJUAN PEMBIMBING ………...ii
HALAMAN PENGESAHAN ………iii
HALAMAN PERSEMBAHAN ………...iv
PERNYATAAN KEASLIAN KARYA ………..v
INTISARI ………...vi
ABSTRACT ………vii
KATA PENGANTAR ……….viii
DAFTAR ISI ………...x
DAFTAR TABEL ………...xiv
DAFTAR GAMBAR ………...xvi
DAFTAR LAMPIRAN ……….xviii
BAB I. PENGANTAR………..……….1
A. Latar Belakang ………1
1. Permasalahan …...………..3
2. Keaslian penelitian ………...4
3. Manfaat penelitian ……….4
B. Tujuan Penelitian ………....4
BAB II. PENELAAHAN PUSTAKA ………..5
A. Tumbuhan Pegagan Embun ………...5
2. Nama lokal ………5
3. Morfologi ………...5
4. Kandungan ………...5
5. Penggunaan ………6
6. Penelitian ………...6
B. Pengeringan Bahan ………...7
C. Maserasi ………..7
D. Flavonoida ………..8
1. Struktur flavonoida ………....8
2. Distribusi flavonoida ………...9
3. Penggolongan flavonoida ………..9
4. Manfaat flavonoida ………...10
5. Kelarutan flavonoida………11
6. Isolasi senyawa flavonoida ………..12
7. Identifikasi warna flavonoida ………..12
E. Kromatografi Lapis Tipis (KLT) ………...16
F. Kromatografi Lapis Tipis Preparatif (KLTP)……….18
G. Spektrofotometri Ultraviolet ……….19
1. Tinjauan umum ………19
2. Spektrum senyawa flavonoida ……….22
H. Keterangan Empiris ………..28
BAB III. METODOLOGI PENELITIAN ……….29
B. Variabel Penelitian dan Definisi Operasional ……….29
1. Variabel penelitian ………..29
2. Definisi operasional ………29
C. Bahan dan Alat Penelitian ……….30
1. Bahan penelitian ………..30
2. Alat penelitian ……….30
D. Tata Cara Penelitian ……….31
1. Determinasi tumbuhan pegagan embun ………..31
2. Pengumpulan bahan ………31
3. Pembuatan serbuk simplisia ………31
4. Penyarian flavonoida ………...31
5. Pemeriksaan pendahuluan flavonoida dengan KLT ………32
6. Isolasi flavonoida dengan KLTP ……….………..………..32
7. Pemeriksaan kemurnian isolat ………..………...33
8. Reaksi warna flavonoida ………...……...33
9. Identifikasi senyawa flavonoida dengan spektrofotometri ultraviolet ….33 E. Analisis Data ………..………...35
BAB IV. HASIL PENELITIAN DAN PEMBAHASAN ………..37
A. Determinasi Tumbuhan ……….…...37
B. Pengumpulan dan Pengeringan Bahan ……….37
C. Penyarian Bahan ………...38
D. Pemeriksaan Pendahuluan Flavonoida Secara KLT ……….39
F. Pemeriksaan Kemurnian Isolat ………..46
G. Identifikasi Senyawa Flavonoida ………..48
1. Identifikasi dengan reaksi warna ……… 48
2. Identifikasi dengan spektrofotometri ultraviolet ……….52
BAB V. KESIMPULAN DAN SARAN ……….63
A. Kesimpulan ………..63
B. Saran ……….64
DAFTAR PUSTAKA ………...65
LAMPIRAN ……….68
DAFTAR TABEL
Halaman
Tabel I. Penampakan warna bercak pada kromatogram yang dideteksi dengan
uap amonia (Markham, 1988) ………15
Tabel II. Penampakan warna golongan flavonoida dengan pereaksi
(Venkataraman, 1962) …..………..16
Tabel III. Rentangan serapan spektrum UV pada flavonoida (Markham, 1988)
………..22
Tabel IV. Penafsiran spektrum ultraviolet flavonoida dengan penambahan
NaOH (Markham, 1988) ……….25
Tabel V. Penafsiran spektrum ultraviolet flavonoida dengan penambahan
NaOAc (Markham, 1988) ………..……….26
Tabel VI. Penafsiran spektrum ultraviolet flavonoida dengan penambahan
NaOAc dan H3BO3 (Markham, 1988) ………....26
Tabel VII. Penafsiran spektrum ultraviolet flavonoida dengan penambahan
AlCl3 serta AlCl3 dan HCl (Markham, 1988) ………....27
Tabel VIII. Penampakan warna bercak sampel (ekstrak metanol herba pegagan
embun) ……….………....43
Tabel IX. Analisis hasil KLT pendahuluan dan hasil spektra dibandingkan
dengan pustaka acuan (Markham, 1988) ……….47
Tabel X. Penampakan perubahan warna isolat setelah penambahan pereaksi
Tabel XI. Penafsiran spektrum flavonoida dengan penambahan pereaksi geser
DAFTAR GAMBAR
Halaman
Gambar 1. Kerangka flavonoida ………..……….9
Gambar 2. Sistem penomoran flavonoida ……….9
Gambar 3. Kerangka struktur golongan-golongan flavonoida …....………14
Gambar 4. Dua komponen penyerap (benzoil dan sinamoil) ………….……….23
Gambar 5. Kromatogram uji KLT pendahuluan ekstrak metanol herba pegagan embun …....……….…………....……….……42
Gambar 6. Reaksi yang terjadi setelah diberi uap amonia ………..……….43
Gambar 7. Hasil reaksi warna ……….……….…50
Gambar 8. Reaksi yang terjadi setelah pemberian NaOH ……….…..51
Gambar 9. Reaksi yang terjadi setelah penambahan H2SO4 pekat………..51
Gambar 10. Reaksi yang terjadi setelah penambahan Mg dan HCl………52
Gambar 11. Spektrum spektrofotometri UV isolat flavonoida dalam metanol...53
Gambar 12. Spektrum spektrofotometri UV isolat flavonoida dalam metanol dan diberi NaOH ……….……….55
Gambar 13. Spektrum spektrofotometri UV isolat flavonoida dalam metanol dan diberi NaOH setelah 5 menit ……….………56
Gambar 14. Spektrum spektrofotometri UV isolat flavonoida dalam metanol dan diberi AlCl3…....……….……….………....57
Gambar 15. Reaksi yang terjadi setelah pemberian AlCl3………..57
Gambar 17. Reaksi yang terjadi setelah pemberian HCl pada isolat C dengan
AlCl3……….……….………59
Gambar 18. Spektrum spektrofotometri UV isolat flavonoida dalam metanol dan
diberi NaOAc……….……….………….59
Gambar 19. Reaksi yang terjadi setelah penambahan NaOAc …....………60
Gambar 20. Spektrum spektrofotometri UV isolat flavonoida dalam metanol dan
diberi NaOAc/H3BO3……….………61
Gambar 21. Reaksi yang terjadi setelah pemberian NaOAc dan ditambah dengan
H3BO3 ……….……….………....61
Gambar 22. Gambar 22. 7, 8-dihidroksi isoflavon dengan kemungkinan letak gula
pada posisi 5 ……….……….…....…………..62
Gambar 23. Gambar 22. 7, 8-dihidroksi isoflavon dengan kemungkinan letak gula
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat pengesahan determinasi ………68
Lampiran 2. Foto tumbuhan herba pegagan embun (Hydrocotyle sibthorpioides
Lmk.) ………...……….69
Lampiran 3. Foto kromatogram KLTP hasil reisolasi isolat I dengan fase diam
selulosa, fase gerak asam asetat 15 % ………..70
Lampiran 4. Foto kromatogram KLTP hasil reisolasi isolat II dengan fase diam
selulosa, fase gerak asam asetat 15 % ……….71
Lampiran 5. Foto kromatogram KLT multi eluen isolat A dengan fase diam
selulosa, fase gerak asam asetat 15 % ……….………72
Lampiran 6. Foto kromatogram KLT multi eluen isolat A dengan fase diam
selulosa, fase gerak BAW ………...73
Lampiran 7. Foto kromatogram KLT multi eluen isolat B dengan fase diam
selulosa, fase gerak asam asetat 15 % ……….74
Lampiran 8. Foto kromatogram KLT multi eluen amonia B dengan fase diam
selulosa, fase gerak BAW ………...75
Lampiran 9. Foto kromatogram KLT multi eluen isolat C dengan fase diam
selulosa, fase gerak asam asetat 15 % ……….76
Lampiran 10. Foto kromatogram KLT multi eluen amonia C dengan fase diam
selulosa, fase gerak BAW ……….77
Lampiran 11. Foto kromatogram KLT multi eluen isolat D dengan fase diam
Lampiran 12. Foto kromatogram KLT multi eluen isolat D dengan fase diam
selulosa, fase gerak BAW ………...79
Lampiran 13.1. Spektrum spektrofotometri UV isolat A dalam metanol …….80
13.2. Spektrum spektrofotometri UV isolat B dalam metanol ……..80
Lampiran 14.1. Spektrum spektrofotometri UV isolat D dalam metanol ……81
BAB I PENGANTAR A. Latar Belakang
Banyak jenis tumbuhan telah digunakan oleh masyarakat Indonesia
sebagai bahan obat. Tanaman obat tersebut diramu menjadi sediaan obat, yang
lebih dikenal sebagai obat tradisional. Obat tradisional ada yang berasal dari
tumbuhan, hewan, maupun mineral yang digunakan untuk pemeliharaan,
peningkatan kesehatan dan penyembuhan penyakit. Namun masih banyak
tumbuhan liar yang belum diketahui zat berkhasiat dan kegunaannya.
Dewasa ini minat masyarakat untuk memanfaatkan tumbuh-tumbuhan
sebagai ramuan obat semakin berkembang. Banyaknya permintaan dunia akan
obat-obatan yang berasal dari alam, menunjukkan bahwa masyarakat memiliki
kecenderungan untuk menempuh gaya hidup kembali ke alam atau ”back to nature” dalam mencapai tujuan hidup yang lebih sehat dan aman terhadap berbagai macam gangguan kesehatan (Kuswara, 2000).
Herba pegagan embun (Hydrocotyle sibthorpioides Lmk.) merupakan salah satu jenis tumbuhan yang belum banyak dikenal masyarakat. Herba pegagan
embun mengandung minyak atsiri, kumarin dan hiperin (Anonim, 2005).
Beberapa penelitian sebelumnya menyebutkan bahwa herba pegagan embun juga
mengandung saponin (Matsushita, Sasaki, Warashina, Miyase, Noguchi, Velde,
busung, batu empedu, batu dan infeksi saluran kencing, batuk dan sesak nafas,
sariawan, radang tenggorokan, infeksi amandel dan infeksi telinga tengah
(Anonim, 2005).
Timbulnya khasiat penyembuhan pada suatu penyakit tentunya
disebabkan oleh adanya senyawa dengan struktur tertentu yang terdapat di dalam
tumbuhan. Oleh karena itu, dengan diketahuinya struktur dari suatu senyawa akan
membuka peluang untuk pengembangan obat baru. Untuk mengetahui suatu
senyawa yang terkandung dalam suatu tumbuhan dapat dilakukan dengan
mengisolasi senyawa tersebut secara kromatografi lapis tipis preparatif (KLTP)
dan dilanjutkan dengan penentuan golongan serta strukturnya.
Digunakan metode KLTP karena KLTP memiliki beberapa kelebihan
dari kromatografi kolom yaitu pemisahan yang lebih baik karena pemisahan yang
dihasilkan berupa bercak yang tidak bergerak., mudah mengambil
senyawa-senyawa yang terpisah secara individu dengan jalan mengeroknya dan
mengumpulkan tiap-tiap lapisan, dan peralatannya yang sederhana (Gasparic dan
Churacek, 1978). KLTP merupakan salah satu metode pemisahan yang
memerlukan pembiayaan paling murah dan memakai peralatan paling dasar
(Hostettmann, Hostettmann, Marston, 1995).
Tanaman yang mengandung flavonoida banyak digunakan dalam dunia
pengobatan tradisional, karena dapat bekerja sebagai inhibitor pernafasan.
Flavonoida juga dapat menghambat perdarahan dan menghambat reaksi oksidasi,
sebagai antihipertensi, dan flavonoida juga mempunyai potensi sebagai antibakteri
(Robinson, 1995).
Adanya khasiat herba pegagan embun untuk mengobati sakit kuning
(hepatitis), infeksi saluran kencing, infeksi amandel, infeksi telinga tengah dan
sariawan kemungkinan yang berperan dalam pengobatan adalah flavonoidanya
karena flavonoida sendiri menurut Robinson (1995) memiliki daya sebagai
bakterisida, antiinflamasi dan antioksidan.
Flavonoida tersebar luas dalam dunia tumbuh-tumbuhan dan ditemukan
dalam bagian-bagian tertentu dari tumbuhan. Flavonoida dalam jaringan
tumbuhan ditemukan sebagai senyawa campuran (Swain, 1976). Pada penelitian
sebelumnya telah ditemukan senyawa flavonoida yang terkandung dalam herba
pegagan embun yaitu hiperin. Senyawa flavonoida ditemukan dalam bentuk
campuran sehingga kemungkinan masih ada senyawa flavonoida lainnya yang
terkandung dalam herba pegagan embun yang belum ditemukan. Oleh karena itu
penelitian kandungan kimia khususnya jenis-jenis flavonoida lainnya yang
terkandung dalam herba pegagan embun perlu dilakukan untuk pengembangan
dan pemanfaatan herba pegagan embun dalam pengobatan.
1.Permasalahan
Permasalahan yang ada dalam penelitian ini adalah :
Senyawa golongan flavonoida apakah yang terdapat dalam herba
pegagan embun selain hiperin dengan isolasi secara KLTP dan bagaimana
prakiraan struktur parsialnya dengan menggunakan kromatografi lapis tipis
2.Keaslian penelitian
Berdasarkan hasil penelusuran pustaka, penelitian yang berkaitan
dengan flavonoida pada herba pegagan embun yang pernah dilakukan adalah
penelitian yang menemukan adanya flavonoida quercetin 3-O-β- -(6″ -caffeoylgalactoside) (Shigematsu et al., 1981) atau hiperin (Anonim, 2005). Sehingga penelitian ini dilakukan untuk menemukan jenis flavonoida lainnya
selain hiperin.
3.Manfaat penelitian
Manfaat dari penelitian ini meliputi 2 hal :
a. Manfaat teoritis yaitu memberikan informasi yang diharapkan dapat
dijadikan acuan untuk penelitian berikutnya tentang kandungan dan
kegunaan herba pegagan embun.
b. Manfaat praktis yaitu penelitian ini diharapkan dapat memberikan informasi
tentang kandungan flavonoida selain hiperin pada herba pegagan embun
untuk pengembangan dan pemanfaatan tanaman tersebut dalam pengobatan.
c. Manfaat metodologis yaitu penelitian ini diharapkan dapat memberikan
informasi tentang penggunaan KLTP dalam isolasi senyawa flavonoida
pada herba pegagan embun.
B. Tujuan Penelitian
Penelitian ini bertujuan untuk mengidentifikasi senyawa flavonoida dari
herba pegagan embun selain hiperin dengan menggunakan metode isolasi secara
BAB II
PENELAAHAN PUSTAKA A. Tumbuhan Pegagan Embun 1.Keterangan botani
Herba pegagan embun (Hydrocotyle sibthorpioides Lmk.) mempunyai sinonim Hydrocotyle rotundifolia Roxb. dan Hydrocotyle formosana Masamune., termasuk dalam familia Umbelliferae (Apiaceae) (Anonim, 2005).
2.Nama lokal
Sunda : pegagan embun, antanan beurit, a. lembut
Jawa : andem, katepa’n, rendeng, semanggi
Madura : salatun, take cena
China : tikim, patikim, tian hu sui (Anonim, 2005).
3.Morfologi
Tumbuh merayap, ramping, subur di tempat lembab, terbuka maupun
teduh di pinggir jalan, pinggir selokan, lapangan rumput dan tempat lain sampai
setinggi kira-kira 2.500 m dari permukaan laut. Batang lunak, berongga,
panjang 45 cm atau lebih, daun tunggal berseling, bertangkai panjang, bentuk
bulat (Anonim, 2005).
4.Kandungan
Herba pegagan embun mengandung minyak atsiri, kumarin dan hiperin
(Anonim, 2005). Beberapa penelitian menyebutkan bahwa herba pegagan
al., 1982) dan quercetin 3-O-β- -(6″-caffeoylgalactoside) (Shigematsu et al., 1981).
5. Penggunaan
Herba pegagan embun dapat digunakan untuk mengobati sakit
kuning (hepatitis), pengecilan hati dengan busung, batu empedu, batu dan
infeksi saluran kencing, batuk dan sesak nafas, sariawan, radang tenggorokan,
infeksi amandel dan infeksi telinga tengah (Anonim, 2005).
6. Penelitian
Terdapat beberapa penelitian yang pernah dilakukan terhadap herba
pegagan embun, yaitu :
a. Penelitian yang mengisolasi flavonoida quercetin 3-(6”-caffeoylgalactoside dari herba pegagan embun (Shigematsu et al., 1981).
b.Penelitian yang menemukan adanya terpenoid dari herba pegagan embun
dengan kandungan terpenoid utamanya yaitu trans- β-farnesene (Asakawa et al., 1982).
c. Penelitian yang menemukan adanya kandungan minyak atsiri pada herba
pegagan embun (Janardhanan, Thoppil, 2001).
d. Penelitian yang mengisolasi tujuh saponin triterpenoid yang salah satunya
B. Pengeringan Bahan
Tujuan pengeringan ialah untuk mendapatkan simplisia yang tidak
mudah rusak sehingga dapat disimpan dalam waktu yang lebih lama. Pengurangan
kadar air dengan adanya pengeringan akan menghentikan reaksi enzimatik
sehingga penurunan mutu simplisia dapat dicegah.
Pada dasarnya dikenal dua cara pengeringan yaitu:
1.Pengeringan alamiah
a. Dengan sinar matahari langsung. Cara ini dilakukan untuk mengeringkan
bagian tanaman yang relatif keras seperti kayu, kulit kayu, biji dan
sebagainya, dan mengandung senyawa aktif yang relatif stabil.
b. Dengan diangin-anginkan dan tidak dipanaskan dengan sinar matahari
langsung. Cara ini terutama untuk mengeringkan bagian tanaman yang
lunak seperti bunga, daun, dan sebagainya dan mengandung senyawa aktif
mudah menguap.
2.Pengeringan buatan
Prinsip pengeringan buatan adalah udara dipanaskan oleh suatu sumber seperti
lampu, kompor, mesin disel, atau listrik, udara panas dialirkan dengan kipas ke
dalam ruangan atau lemari yang berisi bahan yang akan dikeringkan yang telah
disebarkan di atas rak-rak pengering (Anonim, 1985).
C. Maserasi
Maserasi merupakan cara penyarian yang sederhana. Maserasi dilakukan
akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat
aktif. Zat aktif akan larut dan karena adanya perbedaan konsentrasi antara larutan
zat aktif di dalam sel dengan yang di luar sel, maka larutan yang terpekat didesak
keluar. Peristiwa tersebut berulang sehingga terjadi kesetimbangan konsentrasi
antara larutan di luar sel dan di dalam sel. Cairan penyari yang digunakan dapat
berupa air, etanol, air-etanol atau pelarut lain.
Keuntungan cara penyarian dengan maserasi adalah cara pengerjaan dan
peralatan yang digunakan sederhana dan mudah dilakukan. Pada penyarian
dengan cara maserasi, perlu dilakukan pengadukan. Pengadukan diperlukan untuk
meratakan konsentrasi larutan di luar butir serbuk simplisia, sehingga dengan
pengadukan tersebut tetap terjaga adanya derajat perbedaan konsentrasi yang
sebesar-besarnya antara larutan di dalam sel dengan larutan di luar sel (Anonim,
1986).
D. Flavonoida 1.Struktur flavonoida
Golongan flavonoida dapat digambarkan sebagai deretan senyawa C6
-C3-C6. Artinya, kerangka karbonnya terdiri atas dua gugus C6 (cincin benzena
tersubstitusi) disambungkan oleh rantai alifatik tiga-karbon (Gambar 1).
Kelas-kelas yang berlainan dalam golongan ini dibedakan berdasarkan cincin
heterosiklik-oksigen tambahan dan gugus hidroksil yang tersebar menurut pola
yang berlainan. Flavonoida sering terdapat sebagai glikosida. Golongan
rantai tiga-karbon dengan salah satu dari cincin benzena. Sistem penomoran
untuk turunan flavonoida diberikan pada gambar 2 (Robinson, 1995).
C C C
Dua cincin karbon di ujung kiri dan kanan molekul dinyatakan
berturut-turut sebagai cincin A dan B. Gugus hidroksil hampir selalu terdapat di
flavonoida, khususnya tertempel pada cincin B di posisi 3` dan 4` atau
tertempel pada posisi 5 dan 7 cincin A, atau pada posisi 3 cincin tengah. Gugus
hidroksil ini merupakan tempat menempelnya berbagai gula yang
meningkatkan kelarutan flavonoida dalam air (Salisbury & Ross, 1995).
Di dalam tumbuhan, flavonoida biasanya berikatan dengan gula sebagai
glikosida. Molekul yang berikatan dengan gula disebut aglikon (Riyanto, 1990).
2.Distribusi flavonoida
Flavonoida mencakup banyak pigmen yang paling umum dan terdapat
pada seluruh dunia tumbuhan mulai dari fungus sampai Angiospermae. Dikenal
hampir 500 aglikon, dan lebih dari 4000 flavonoida jika glikosida diperhatikan
juga. Pada tumbuhan tinggi, flavonoida terdapat baik dalam bagian vegetatif
maupun dalam bunga (Robinson, 1995).
3.Penggolongan flavonoida
Penggolongan flavonoida umumnya berdasarkan substitusi cincin
heterosiklik yang mengandung gugus OH. Perbedaan gugus OH di bagian C3
flavanon, isoflavon, auron, dan khalkon dengan flavon dan flavonol sebagai
golongan terbesar (Gambar 3) (Robinson, 1995).
4.Manfaat flavonoida
Flavonoida berfungsi sebagai pengatur tumbuh, pengatur fotosintesis,
pengatur kerja antimikroba, antivirus, dan serangga bagi tanaman yang
mengandungnya. Fitoaleksin merupakan senyawa flavonoida yang dibentuk
sebagai tanggapan terhadap infeksi atau luka yang menghambat fungus
penyerangnya. Sebagai pigmen, flavonoida berperan dalam menarik serangga
atau burung untuk membantu proses penyerbukan (Robinson, 1995).
Tanaman yang mengandung flavonoida banyak digunakan dalam dunia
pengobatan tradisional, karena dapat bekerja sebagai inhibitor pernafasan.
Flavonoida juga dapat menghambat perdarahan dan menghambat reaksi
oksidasi, baik secara enzimatik maupun non enzimatik, beberapa flavonoida
dapat bekerja sebagai antihipertensi, dan flavonoida juga mempunyai potensi
sebagai antibakteri (Robinson, 1995).
Isoflavon memiliki aktivitas anti kanker, anti inflamasi, aktivitas pada
pembuluh darah dan aktivitas estrogenik. Isoflavon berpengaruh pada sistem
sirkulasi dan penyakit jantung koroner yaitu dengan menghambat agregasi
platelet (keping-keping sel darah), dilatan koroner dan menghambat introphy
otot jantung (cardio trophyc) sehingga dapat memperlancar sistem sirkulasi darah (Pawiroharsono, 1994). Isoflavon berpotensi sebagai anti-kontriksi
density lipoprotein) sehingga dapat mengurangi terjadinya arteriosclerosis pada pembuluh darah (Jha, 1985; Jha, 1997).
Senyawa isoflavon juga mempunyai efek hormonal, khususnya efek
estrogenik. Hormon estrogen berpengaruh pula terhadap metabolisme tulang,
terutama proses kalsifikasi, maka adanya isoflavon dapat melindungi proses
osteoporosis pada tulang sehingga tulang tetap padat dan masif.
Isoflavon juga mempunyai efek terhadap penurunan kolesterol.
Mekanisme penurunan kolesterol oleh isoflavon melalui pengaruh terhadap
peningkatan katabolisme sel lemak untuk pembentukan energi, yang berakibat
pada penurunan kandungan kolesterol (Pawiroharsono, 1998).
5.Kelarutan flavonoida
Aglikon flavonoida adalah polifenol, oleh karena itu mempunyai sifat
kimia fenol. Adanya gula yang terikat pada aglikon akan menaikkan sifat
polaritas dari flavonoida yang bersangkutan (Mursyidi, 1990).
Senyawa polar akan larut dalam pelarut polar. Oleh karena itu
flavonoida larut dalam pelarut polar. Pelarut polar yang biasa digunakan untuk
menyari glikosida flavonoida adalah air, metanol, etanol, butanol, aseton,
dimetilsulfoksida dan dimetil formamid. Penyarian akan memberikan hasil
yang baik bila digunakan campuran pelarut-pelarut di atas dengan air. Untuk
aglikon yang kurang polar seperti isoflavon, flavanon, flavon, serta flavonol
yang mempunyai gugus metoksi, akan lebih mudah larut dalam pelarut yang
6.Isolasi senyawa flavonoida
Isolasi flavonoida dilakukan dengan cara penyarian. Flavonoida mudah
mengalami peruraian karena panas, kerja enzim, adanya air, dan pH. Oleh
karena itu beberapa usaha dilakukan untuk menghindari perubahan molekul
flavonoida pada proses isolasi (Mursyidi, 1990).
Banyak senyawa dari golongan ini yang mudah larut dalam air,
terutama bentuk glikosidanya, dan oleh karena itu senyawa ini berada dalam
ekstrak air tumbuhan. Bahkan senyawa yang hanya larut sedikit dalam air
kepolarannya memadai untuk diekstraksi dengan baik memakai metanol,
etanol, atau aseton; dan metanol 80 % barangkali merupakan pelarut yang
sering dipakai untuk ekstraksi flavonoida (Robinson, 1995).
Flavonoida yang diperoleh dengan cara penyarian umumnya
merupakan campuran. Isolasi masing-masing komponen biasanya dilakukan
dengan teknik kromatografi (Mursyidi, 1990).
7.Identifikasi warna flavonoida
Flavonoida dapat diidentifikasi dengan mengamati perubahan warna
pada KLT sebelum dan sesudah diuapi amonia yang dilihat pada sinar UV 366
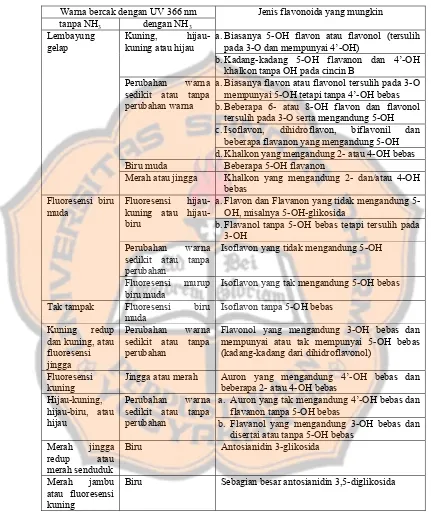
nm. Menurut Markham (1988) warna bercak dapat digunakan sebagai petunjuk
adanya flavonoida tertentu (Tabel I).
Dalam suasana basa, aglikon flavonoida yang mengandung gugus
hidroksi (bersifat asam) larut dalam air dengan membentuk warna kuning dan
suasana basa tersebut digunakan untuk deteksi pada kromatografi dan
spektrofotometri (Mursyidi, 1990).
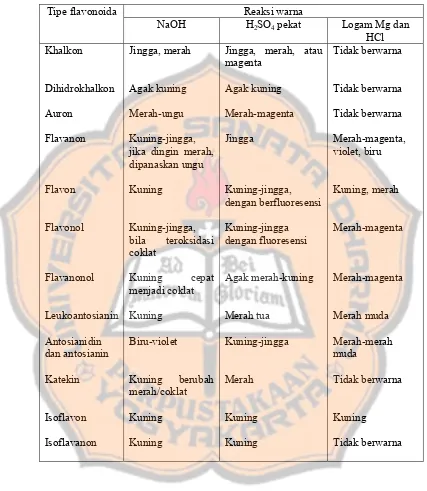
Penelitian fitokimia juga dilakukan dengan uji kimia tertentu seperti
menggunakan pereaksi NaOH, H2SO4 pekat, logam Mg dan HCl (Tabel II)
(Venkataraman, 1962). Uji warna memberikan gambaran umum golongan
flavonoida yang terkandung pada hidroksilasi dan macam substitusi pada
senyawa tersebut sehingga pada beberapa turunan flavonoida tidak memberikan
warna pada uji tersebut. Uji warna selanjutnya didukung analisis
O
Tabel I. Penampakan warna bercak pada kromatogram yang dideteksi dengan uap amonia (Markham, 1988)
Warna bercak dengan UV 366 nm Jenis flavonoida yang mungkin tanpa NH3 dengan NH3
a.Biasanya 5-OH flavon atau flavonol (tersulih pada 3-O dan mempunyai 4’-OH)
Kuning, hijau-kuning atau hijau
b.Kadang-kadang 5-OH flavanon dan 4’-OH khalkon tanpa OH pada cincin B
a.Biasanya flavon atau flavonol tersulih pada 3-O mempunyai 5-OH tetapi tanpa 4’-OH bebas b.Beberapa 6- atau 8-OH flavon dan flavonol
tersulih pada 3-O serta mengandung 5-OH
c.Isoflavon, dihidroflavon, biflavonil dan beberapa flavanon yang mengandung 5-OH Perubahan warna
sedikit atau tanpa perubahan warna
d.Khalkon yang mengandung 2- atau 4-OH bebas Biru muda Beberapa 5-OH flavanon
Lembayung gelap
Merah atau jingga Khalkon yang mengandung 2- dan/atau 4-OH bebas
a.Flavon dan Flavanon yang tidak mengandung 5-OH, misalnya 5-OH-glikosida
Fluoresensi kuning atau
hijau-biru b.Flavanol tanpa 5-OH bebas tetapi tersulih pada 3-OH
Perubahan warna sedikit atau tanpa perubahan
Isoflavon yang tidak mengandung 5-OH Fluoresensi biru
muda
Fluoresensi murup biru muda
Isoflavon yang tak mengandung 5-OH bebas
Tak tampak Fluoresensi biru muda
Isoflavon tanpa 5-OH bebas
Kuning redup dan kuning, atau fluoresensi jingga
Perubahan warna sedikit atau tanpa perubahan
Flavonol yang mengandung 3-OH bebas dan mempunyai atau tak mempunyai 5-OH bebas (kadang-kadang dari dihidroflavonol)
Fluoresensi kuning
Jingga atau merah Auron yang mengandung 4’-OH bebas dan beberapa 2- atau 4-OH bebas
a. Auron yang tak mengandung 4’-OH bebas dan flavanon tanpa 5-OH bebas
Hijau-kuning, hijau-biru, atau hijau
Perubahan warna sedikit atau tanpa
perubahan b. Flavanol yang mengandung 3-OH bebas dan disertai atau tanpa 5-OH bebas
Merah jingga redup atau merah senduduk
Biru Antosianidin 3-glikosida
Merah jambu atau fluoresensi kuning
Tabel II. Penampakan warna golongan flavonoida dengan pereaksi (Venkataraman, jika dingin merah, dipanaskan ungu
Jingga, merah, atau magenta
E. Kromatografi Lapis Tipis (KLT)
Kromatografi lapis tipis adalah metode pemisahan fisikokimia. Dalam
berbagai jenis teknik kromatografi, KLT adalah yang paling cocok untuk analisis
pemisahan, sensitif, kecepatan pemisahan tinggi dan mudah untuk memperoleh
kembali senyawa-senyawa yang dipisahkan dan memerlukan jumlah cuplikan
yang sangat sedikit. KLT adalah suatu cara pemisahan yang berdasarkan atas
pembagian campuran senyawa ke dalam dua fase yaitu fase diam (padat/cair) dan
fase bergerak (cair/gas). Adsorben yang umum digunakan antara lain silika gel,
alumina, dan selulosa. Untuk penggunaan khusus digunakan sephadex atau resin
penukar ion. Silika gel bersifat asam dan berguna untuk kromatografi pembagian
maupun penyerapan. Alumina bersifat basa terutama digunakan untuk
kromatografi penyerapan (Harborne,1987).
Fase gerak adalah medium angkut yang terdiri atas satu atau beberapa
pelarut. Fase gerak bergerak dalam fase diam disebabkan karena adanya gaya
kapiler. Pelarut yang digunakan dengan tingkat mutu analitik. Pemilihan pelarut
yang digunakan sebagai fase gerak tergantung dari sifat kelarutan komponen yang
akan dipisahkan (Stahl, 1985).
Senyawa yang dideteksi biasanya sebagai bercak warna atau
berfluoresensi pada UV setelah direaksikan dengan pereaksi semprot yang sesuai.
Kromatogram yang dihasilkan diuraikan dari zona-zona dan dicirikan oleh
nilai-nilai hRf.
Bilangan Rf adalah jarak yang ditempuh senyawa pada kromatografi,
nisbi terhadap garis depan. Bilangan Rf diperoleh dengan mengukur jarak antar
bercak pada titik awal dan jarak rambat bercak yang dihasilkan senyawa, dan
jarak ini kemudian dibagi dengan jarak antara titik awal dan garis depan yaitu
Faktor-faktor yang mempengaruhi gerakan noda dalam kromatografi
lapis tipis yang juga mempengaruhi harga Rf antara lain struktur kimia dari
senyawa yang sedang dipisahkan, sifat dari penyerap dan derajat aktivitasnya,
tebal dan kerataan dari lapisan penyerap, pelarut (dan derajat kemurniannya) fase
gerak, derajat kejenuhan dari uap dalam bejana pengembangan yang digunakan,
teknik percobaan, jumlah cuplikan yang digunakan, suhu dan kesetimbangan
(Sastrohamidjojo, 2001).
F. Kromatografi Lapis Tipis Preparatif (KLTP)
Kromatografi lapis tipis preparatif merupakan salah satu metode
pemisahan yang memerlukan pembiayaan paling murah dan memakai peralatan
paling dasar (Hostettmann et al., 1995). Ukuran pelat kromatografi biasanya 20 x 20 cm. Ketebalan lapisan dan ukuran pelat mempengaruhi jumlah bahan yang
akan dipisahkan dengan KLTP (Stahl, 1969).
Cuplikan dilarutkan dalam sedikit pelarut sebelum ditotolkan pada pelat
KLTP. Konsentrasi cuplikan harus sekitar 5-10 %. Cuplikan ditotolkan berupa
pita yang harus sesempit mungkin karena pemisahan bergantung pada lebar pita.
Penotolan dapat dilakukan dengan tangan (pipet) tetapi lebih baik dengan penotol
otomatis (Stahl, 1967).
pelarut yang paling kurang polar yang mungkin (sekitar 5 ml pelarut untuk 1 g
penjerap) (Hostettmann et al., 1995).
KLT preparatif adalah cara yang ideal untuk pemisahan cuplikan kecil
(50 mg sampai 1 g) dari senyawa yang kurang atsiri (Gritter, Bobbitt, Schwarting,
1991). Walaupun KLTP dapat memisahkan bahan dalam jumlah gram, sebagian
besar pemakaian hanya dalam jumlah miligram (Hostettmann et al., 1995).
KLTP berguna untuk memisahkan campuran reaksi sehingga diperoleh
senyawa murni untuk telaah pendahuluan, untuk menyiapkan cuplikan analisis,
untuk meneliti bahan alam yang lazimnya berjumlah kecil dan campurannya
rumit, dan untuk memperoleh cuplikan yang murni untuk mengalibrasi KLT
kuantitatif (Gritter et al., 1991). Beberapa keuntungan KLTP dari kromatografi kolom adalah pemisahan yang lebih baik karena pemisahan yang dihasilkan
berupa bercak yang tidak bergerak, mudah mengambil senyawa-senyawa yang
terpisah secara individu dengan jalan mengeroknya dan mengumpulkan tiap-tiap
lapisan, dan peralatannya yang sederhana (Gasparic et al., 1978).
G. Spektrofotometri Ultraviolet 1.Tinjauan umum
Spektrofotometri ultraviolet adalah interaksi molekul yang mempunyai
gugus kromofor dengan radiasi elektromagnetik pada daerah ultraviolet yang
menyebabkan transisi elektromagnetik dan diperoleh spektra absorbsi elektron,
karena transisi elektronik yang terjadi tergantung dari strukturnya dan jumlah
pengabsorbsi, maka spektra absorbsi dapat digunakan untuk analisa kualitatif
yaitu memberikan informasi mengenai pola oksigenasi atau penentuan
kedudukan hidroksi fenol (Sastrohamidjojo, 2001).
Spektrum ultraviolet adalah suatu gambar antara panjang gelombang
atau frekuensi serapan lawan intensitas serapan (Absorbansi). Absorbans suatu
senyawa pada suatu panjang gelombang tertentu bertambah dengan banyaknya
molekul yang mengalami transisi. Oleh karena itu absorban bergantung pada
struktur elektronik senyawanya dan juga pada kepekatan senyawa tersebut
(Fessenden & Fessenden, 1999).
Transisi elektronik ditentukan oleh konfigurasi elektron dari orbital
molekul dan transisi vibrasi-rotasi ditentukan oleh gugusan-gugusan fungsional
dari suatu molekul, jadi transisi ini ditentukan oleh struktur molekul sehingga
terdapat hubungan antara struktur molekul dengan frekuensi atau panjang
gelombang. Hubungan ini merupakan dasar dari analisa kualitatif
(Sastrohamidjojo, 1985).
Terdapat pertalian antara panjang gelombang, frekuensi, dan kecepatan
cahaya yang dinyatakan oleh persamaan :
n c/
=
ν λ
dimana c = kecepatan cahaya dalam hampa (2,9976 x 1010 cm/det) dan n adalah
indeks bias (perbandingan kecepatan cahaya dalam hampa dengan
kecepatannya dalam media) (Sastrohamidjojo, 2001).
Untuk melukiskan bagaimana radiasi elektromagnetik berinteraksi
setiap foton berbanding langsung dengan frekuensi radiasi dan hal ini
dinyatakan dalam persamaan :
λ ν hc n h
E = = /
dimana E = tenaga foton dalam erg, ν = frekuensi radiasi elektromagnetik
dalam hertz, dan h = tetapan Planck, 6,624 x 10-34 J-det. Foton yang memiliki
frekuensi yang tinggi (panjang gelombang pendek) mempunyai tenaga yang
lebih tinggi daripada foton yang berfrekuensi rendah (panjang gelombang
panjang) (Sastrohamidjojo, 2001).
Kromofor merupakan gugus molekul suatu zat yang dapat menyerap
sinar tampak dan UV. Molekul yang mengandung kromofor dinamakan
kromogen. Auksokrom merupakan gugus yang bila berdiri sendiri tidak dapat
menyerap sinar tampak dan UV, tetapi jika terikat pada sebuah kromofor akan
merubah panjang gelombang dan intensitas resapan maksimum. Contoh
auksokrom adalah gugus hidroksil, gugus amino, dan halogen. Serah terima
antara elektron (n) dan elektron (π) pada kromofor membentuk (n- π konjugasi).
Perubahan spektrum dapat diklasifikasikan sebagai berikut:
a.Pergeseran batokromik
Pergeseran resapan ke arah panjang gelombang lebih panjang (red shift). b.Pergeseran hipsokromik
Pergeseran resapan ke arah panjang gelombang lebih pendek (blueshift). c.Efek hiperkromik
d.Efek hipokromik
Berkurangnya intensitas resapan gugus kromofor.
Intensitas resapan dinyatakan dalam absorbtivitas molar pada panjang
gelombang maksimum, semakin besar nilai absorbtivitas molar makin besar
intensitasnya (Christian, 2004).
2. Spektrum senyawa flavonoida
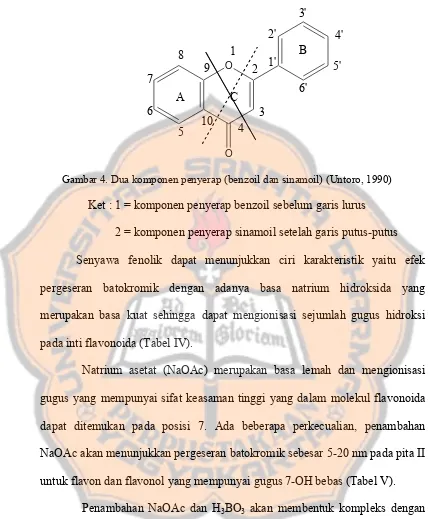
Flavonoida mempunyai sistem aromatik terkonjugasi, karena itu
mempunyai pita serapan di daerah ultraviolet/cahaya tampak. Spektra dari
golongan flavonoida dalam metanol memperlihatkan dua puncak utama yaitu
pita I dan pita II pada daerah 240 nm-400 nm (Tabel III). Pita I menunjukkan
absorbsi yang sesuai dengan cincin B sinamoil, sedangkan pita II berhubungan
dengan absorbsi cincin A benzoil (Gambar 4).
Tabel III. Rentangan serapan spektrum UV pada flavonoida (Markham, 1988)
Pita II (nm) Pita I (nm) Jenis Flavonoida
250-280 310-350 Flavon
250-280 330-360 Flavonol (3-OH tersubstitusi) 250-280 350-385 Flavonol 3-OH bebas
245-275 310-330 Isoflavon
320-329 Isoflavon 5-deoksi-6,7 dioksigenasi 275-295 300-330 Flavanon dan dihidroflavonol 230-270
O
Gambar 4. Dua komponen penyerap (benzoil dan sinamoil) (Untoro, 1990)
Ket : 1 = komponen penyerap benzoil sebelum garis lurus
2 = komponen penyerap sinamoil setelah garis putus-putus
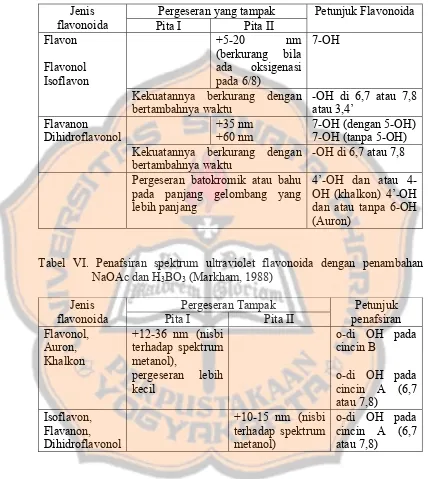
Senyawa fenolik dapat menunjukkan ciri karakteristik yaitu efek
pergeseran batokromik dengan adanya basa natrium hidroksida yang
merupakan basa kuat sehingga dapat mengionisasi sejumlah gugus hidroksi
pada inti flavonoida (Tabel IV).
Natrium asetat (NaOAc) merupakan basa lemah dan mengionisasi
gugus yang mempunyai sifat keasaman tinggi yang dalam molekul flavonoida
dapat ditemukan pada posisi 7. Ada beberapa perkecualian, penambahan
NaOAc akan menunjukkan pergeseran batokromik sebesar 5-20 nm pada pita II
untuk flavon dan flavonol yang mempunyai gugus 7-OH bebas (Tabel V).
Penambahan NaOAc dan H3BO3 akan membentuk kompleks dengan
gugus orto dihidroksi pada semua posisi kecuali pada atom C5 dan C6 (Tabel
VI).
Adanya AlCl3 dan AlCl3/HCl, dapat membentuk kompleks tahan asam
tak tahan asam dengan gugus orto-dihidroksi, pereaksi ini dapat digunakan
untuk mendeteksi kedua gugus tersebut. Jadi spektrum AlCl3 merupakan
penjumlahan pengaruh semua kompleks terhadap spektrum, sedangkan
spektrum AlCl3 dan HCl hanya merupakan pengaruh kompleks hidroksi-keto
Tabel IV. Penafsiran spektrum ultraviolet flavonoida dengan penambahan NaOH (Markham, 1988)
Pergeseran tampak
Mantap ±45-65 nm kekuatan tidak menurun
4’-OH
Mantap ±45-65 nm kekuatan menurun
3-OH, tidak ada 4’-OH bebas
Flavon Flavonol
Pita baru (bandingkan dengan MeOH) 7-OH
Tidak ada oksigenasi pada 4’
(auron)
Tabel V. Penafsiran spektrum ultraviolet flavonoida dengan penambahan NaOAc (Markham, 1988)
Pergeseran yang tampak Jenis
Kekuatannya berkurang dengan bertambahnya waktu
-OH di 6,7 atau 7,8 atau 3,4’
+35 nm
+60 nm
7-OH (dengan 5-OH) 7-OH (tanpa 5-OH) Flavanon
Dihidroflavonol
Kekuatannya berkurang dengan bertambahnya waktu
-OH di 6,7 atau 7,8
Pergeseran batokromik atau bahu pada panjang gelombang yang lebih panjang
4’-OH dan atau 4-OH (khalkon) 4’-4-OH dan atau tanpa 6-OH (Auron)
Tabel VII. Penafsiran spektrum ultraviolet flavonoida dengan penambahan AlCl3 serta AlCl3 dan HCl (Markham, 1988)
Pergeseran yang tampak Jenis flavonoida oksigenasi pada 6
Mungkin 5-OH dengan gugus prenil pada 6 + 50 sampai 60 nm Mungkin 3-OH
(dengan atau tanpa 5-OH)
Pergeseran
AlCl3/HCl tambah
30 sampai 40 nm
o-diOH pada cincin B Flavanon dan pergeseran o-di OH pada cincin B)
o-diOH pada cincin A (6,7 dan 7,8) 5-OH (tambahan pada sembarang pergeseran
o-diOH pada cincin B Auron, Khalkon
(AlCl3 dan HCl)
(AlCl3)
Penambahan lebih kecil
Mungkin o-diOH pada cincin A
Banyak diOH atau
H. Keterangan Empiris
Penelitian ini bersifat eksploratif dengan tujuan untuk mengidentifikasi
struktur parsial senyawa flavonoida dalam herba pegagan embun selain hiperin
hasil isolasi secara KLTP yang dapat ditentukan dari warna bercak dan harga Rf
pada KLT, hasil reaksi warna dan spektrofotometri UV berdasarkan pembentukan
BAB III
METODOLOGI PENELITIAN A. Jenis Penelitian
Penelitian ini termasuk jenis penelitian non eksperimental yang dilakukan di
Laboratorium Farmakognosi Fitokimia, Fakultas Farmasi, Universitas Sanata
Dharma, Yogyakarta.
B. Variabel Penelitian dan Definisi Operasional 1. Variabel penelitian
a. Variabel terkendali : sumber tumbuhan, pengumpulan tumbuhan,
pengeringan, pembuatan serbuk, proses penyarian flavonoida dan
bahan-bahan pereaksi yang digunakan.
b. Variabel tak terkendali : kondisi fisiologis tumbuhan dan kondisi tempat
tumbuh.
2.Definisi operasional
a.Isolasi flavonoida herba pegagan embun adalah proses pengambilan senyawa
flavonoida dari herba pegagan embun dengan maserasi dan dilanjutkan
dengan kromatografi lapis tipis preparatif (KLTP).
b.Identifikasi senyawa flavonoida adalah uji kualitatif untuk mengetahui
prakiraan struktur parsial senyawa flavonoida dalam herba pegagan embun
secara kromatografi lapis tipis (KLT), reaksi warna dan spektrofotometri
c.Simplisia herba pegagan embun adalah seluruh bagian tumbuhan pegagan
embun yang ada di atas permukaan tanah yang telah dikeringkan dengan cara
diangin-anginkan.
d.Maserasi adalah cara penyarian sederhana yang dilakukan dengan merendam
serbuk simplisia ke dalam cairan penyari yaitu campuran metanol : air
(dengan perbandingan 9 : 1 dan 1 : 1) yang disimpan selama 6-12 jam
dengan digojog pada shaker.
C. Bahan dan Alat Penelitian 1. Bahan penelitian
a. Bahan tumbuhan yang digunakan adalah herba pegagan embun.
b. Semua bahan kimia yang digunakan berderajat p.a (pro analysis), produk Merck kecuali dinyatakan lain.
Bahan yang diperlukan dalam penelitian : metanol, n-butanol, asam asetat,
amonia pekat, aluminium klorida, magnesium, asam klorida pekat, asam
sulfat pekat, natrium hidroksida, natrium asetat anhidrat, asam borat.
2. Alat penelitian
Alat-alat yang digunakan dalam penelitian : spektrofotometer UV/vis model
D. Tata Cara Penelitian 1.Determinasi tumbuhan pegagan embun
Determinasi terhadap tumbuhan pegagan embun dilakukan dengan
menggunakan kunci determinasi tanaman (Backer dan Bakhuizen Van den
Brink Jr.; 1963, 1965).
2.Pengumpulan bahan
Bahan berupa herba yang diperoleh dari lingkungan kampus
Universitas Sanata Dharma, Paingan dikumpulkan pada bulan Januari tahun
2006.
3.Pembuatan serbuk simplisia
Herba tumbuhan pegagan embun terlebih dahulu dibersihkan dari debu
dan kotoran pada air mengalir. Kemudian herba dikeringkan dengan
diangin-anginkan. Herba dinyatakan kering apabila ketika diremas mudah hancur.
Herba yang telah kering tersebut diserbuk dengan menggunakan blender
kemudian diayak. Serbuk disimpan dalam plastik hitam yang diikat rapat.
4.Penyarian flavonoida
Bahan yang telah diserbuk dan diayak, ditimbang sebanyak 20 gram.
Penyarian dilakukan dengan cara maserasi. Proses maserasi dilakukan dengan
merendam serbuk menggunakan campuran pelarut pertama yaitu metanol : air
(9 : 1) sebanyak 150 ml. Campuran digojog dengan shaker selama 6-12 jam, di tempat yang terlindung cahaya pada suhu kamar. Untuk pemisahan serbuk dan
cairan hasil penyarian, dilakukan penyaringan menggunakan kertas saring.
dilakukan dengan cara yang sama seperti di atas. Kedua hasil penyarian
dicampur, diuapkan dengan vakum rotaevaporator hingga tinggal sepertiga atau
metanolnya hampir menguap semua. Pelarut yang masih tersisa diuapkan pada
oven.
5.Pemeriksaan pendahuluan flavonoida dengan KLT
Pemeriksaan flavonoida dilakukan terhadap ekstrak metanol secara
KLT dengan menggunakan fase diam selulosa dan fase gerak BAW (n-butanol :
asam asetat : air = 4 : 1 : 5, fase atas). Ekstrak metanol ditotolkan pada lempeng
selulosa, kemudian dikembangkan dengan jarak pengembangan 10 cm dari
totolan. Pemisahan bercak yang didapat pada kromatogram dideteksi dengan
menggunakan lampu UV 365 nm, sebelum dan sesudah diuapi amonia (warna
reversible).
6.Isolasi flavonoida dengan KLTP
Isolasi dengan KLTP dilakukan dengan fase diam selulosa dan fase
gerak BAW. Ekstrak metanol ditotolkan berupa garis yang selanjutnya
dikembangkan dengan jarak pengembangan 10 cm dari totolan, dan didapatkan
bercak pemisahan berupa pita. Pita yang diduga sebagai flavonoida dikerok,
dimasukkan ke dalam Beaker glass dan dilarutkan dengan metanol. Selanjutnya dilakukan penyaringan dengan menggunakan sintered glass dan disedot dengan vakum. Filtrat yang didapat dikeringkan dan kemudian ditimbang. Dilakukan
reisolasi dengan fase diam selulosa dan fase gerak asam asetat 15 %. Reisolasi
diperoleh digunakan untuk dianalisis dengan KLT multi eluen, reaksi warna
dan spektrofotometri UV. Sisa serbuk disimpan.
7.Pemeriksaan kemurnian isolat
Kemurnian isolat flavonoida dapat diketahui menggunakan KLT multi
eluen. KLT ini menggunakan fase gerak pertama BAW dan fase gerak kedua
asam asetat 15 % dengan fase diam selulosa. Jika hasil dari kedua fase gerak
tersebut adalah bercak tunggal maka dapat disimpulkan bahwa isolat flavonoida
tersebut sudah murni.
8.Reaksi warna flavonoida
Isolat flavonoida hasil pemisahan dianalisis dengan uji reaksi warna :
a.Tiga tetes larutan isolat pada plat tetes ditambah dengan 1 tetes larutan
NaOH 1 % (Larutan NaOH 1 % dibuat dengan melarutkan 1 g NaOH dalam
air bebas CO2 hingga 100 ml). Warna yang terjadi dicatat.
b.Tiga tetes larutan isolat pada plat tetes ditambah dengan 1 tetes larutan
H2SO4 pekat. Warna yang terjadi dicatat.
c.Tiga tetes larutan isolat pada plat tetes ditambah sedikit serbuk Mg dan 2
tetes HCl pekat. Warna yang terjadi dicatat.
9.Identifikasi senyawa flavonoida dengan spektrofotometri ultraviolet (Mabry, Markham, Thomas, 1970)
Identifikasi dan penentuan struktur parsial isolat flavonoida dilakukan
dengan metode spektrofotometri UV dengan melarutkan isolat dalam metanol
dan berturut-turut dilakukan pemberian pereaksi geser atau diagnosis yaitu
Cara pembuatan pereaksi geser :
a. NaOH 2 M
Larutan NaOH 2 M dibuat dengan melarutkan 80,00 gram NaOH dalam air
bebas CO2 hingga 1000 ml.
b. AlCl3
Larutan AlCl3 dibuat dengan melarutkan 5 gram AlCl3 dalam metanol
hingga 100 ml.
c. HCl
Larutan HCl dibuat dengan menambahkan 50 ml HCl pekat ke dalam 100
ml aquadest.
d. NaOAc
Digunakan serbuk NaOAc anhidrat.
e. H3BO3
Digunakan serbuk asam borat anhidrat.
Tahap-tahap pengerjaan dengan spektrofotometri UV adalah sebagai berikut :
a.Tahap I
Larutan isolat flavonoida dalam metanol dimasukkan dalam kuvet sampel.
Pada kuvet blanko dimasukkan metanol. Keduanya dibaca serapannya pada
panjang gelombang 200-500 nm.
b.Tahap II
Larutan sampel dari tahap I ditambah 3 tetes pereaksi NaOH, dicampur dan
pembacaan serapan dilakukan kembali untuk mengetahui kemungkinan
terjadinya dekomposisi flavonoida.
c.Tahap III
Larutan isolat flavonoida baru ditambah 6 tetes pereaksi AlCl3, dicampur dan
dibaca serapannya pada panjang gelombang 200-500 nm.
d. Tahap IV
Larutan sampel dari tahap III ditambah 3 tetes pereaksi HCl, dicampur dan
dibaca serapannya pada panjang gelombang 200-500 nm.
e.Tahap V
Larutan isolat flavonoida baru dalam kuvet sampel ditambah serbuk NaOAc
anhidrat sampai kira-kira setinggi 2 mm dari dasar kuvet, dikocok dan dibaca
serapannya pada panjang gelombang 200-500 nm.
f. Tahap VI
Larutan sampel dari tahap V ditambah serbuk H3BO3 dengan jumlah
setengah dari jumlah NaOAc yang digunakan, dicampur dan dibaca
serapannya pada panjang gelombang 200-500 nm.
E. Analisis Data
Metode yang dipakai dalam penelitian ini adalah metode non
eksperimental deskriptif komparatif dengan data hasil penelitian yang berupa
harga Rf, warna bercak pada kromatogram, pembentukan warna pada reaksi
warna, dan spektra hasil spektrofotometri UV senyawa flavonoida dengan
Data tersebut dianalisis dan dibandingkan dengan pustaka acuan menurut
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN A. Determinasi Tumbuhan
Determinasi tumbuhan dilakukan untuk memastikan bahwa tanaman
yang diteliti sesuai dengan yang dimaksud sehingga tidak terjadi kesalahan pada
jenis tanaman yang digunakan. Berdasar hasil determinasi (lampiran 1), tumbuhan
pegagan embun yang digunakan dalam penelitian ini memiliki nama ilmiah
Hydrocotyle sibthorpioides Lmk. Bagian tumbuhan yang digunakan untuk determinasi yaitu batang, daun, bunga dan buah.
B. Pengumpulan dan Pengeringan Bahan
Bahan berupa herba pegagan embun diperoleh dari lingkungan kampus
Universitas Sanata Dharma, Paingan yang dikumpulkan pada bulan Januari tahun
2006. Herba sebelum dikeringkan terlebih dahulu dicuci dengan air mengalir.
Pencucian herba dimaksudkan untuk menghilangkan kotoran-kotoran atau
bahan-bahan asing lain seperti tanah, kerikil, rumput, dan juga dengan pembersihan awal
ini diharapkan dapat mengurangi jumlah mikroba.
Untuk membuat simplisia agar tidak mudah rusak dan tahan lama, maka
herba pegagan embun dikeringkan dengan diangin-anginkan. Pemilihan cara
pengeringan ini karena simplisia yang digunakan berupa herba yang bersifat lunak
dan tipis. Tujuan dari pengeringan ini adalah mengurangi kadar air agar
menghentikan reaksi enzimatik yang dapat menguraikan senyawa aktif dari
mikroba pada simplisia. Herba dikatakan kering apabila ketika diremas mudah
hancur. Herba yang telah kering kemudian diserbuk dengan menggunakan blender
dan diayak dengan ayakan tepung berukuran 35. Simplisia dibuat serbuk dan
diayak untuk mendapatkan ukuran yang lebih kecil sehingga luas permukaan
serbuk lebih banyak kontak dengan cairan penyari sehingga semakin besar dan
cepat senyawa aktif tersari. Selanjutnya serbuk disimpan dalam plastik hitam yang
diikat rapat dan diharapkan melindungi simplisia dari cahaya dan kelembaban
untuk mencegah penguapan dan penguraian zat aktif, karena dengan adanya
cahaya dapat menyebabkan terjadinya fotooksidasi yang akan menguraikan
susunan-susunan kimia senyawa aktif simplisia.
C. Penyarian Bahan
Penyarian dilakukan dengan cara maserasi, karena maserasi merupakan
salah satu metode penyarian yang sederhana, mudah dikerjakan, dan untuk
menghindari kemungkinan rusaknya senyawa lain selain flavonoida karena
pemanasan tinggi yang akan mengganggu proses penyarian..
Pelarut yang digunakan dalam proses penyarian adalah campuran
metanol-air dengan perbandingan 9 : 1 dan 1 : 1. Proses maserasi dilakukan
dengan merendam serbuk selama 6-12 jam dengan digojog pada shaker. Proses maserasi dengan campuran pelarut pertama (perbandingan 9 : 1) sebanyak 150 ml
dilakukan sebanyak satu kali, sedangkan proses maserasi dengan campuran
pelarut kedua (perbandingan 1 : 1) sebanyak 150 ml dilakukan sebanyak lima kali.
menembus membran dan masuk ke dalam rongga sel yang mengandung
flavonoida di dalam sel, dan zat aktif akan larut sehingga terjadi perbedaan
konsentrasi antara larutan di dalam sel dan konsentrasi cairan penyari di luar sel.
Konsentrasi di dalam sel lebih besar daripada cairan penyari di luar sel karena
arah perpindahan terjadi dari konsentrasi tinggi ke rendah maka flavonoida dapat
tersari oleh cairan penyari. Pada proses maserasi dilakukan penggojogan dengan
shaker untuk meratakan konsentrasi larutan di luar sel sehingga tetap terjadi perbedaan konsentrasi yang berarti antara larutan di dalam sel dan di luar sel.
Ekstrak yang didapat kemudian diuji dengan kromatografi lapis tipis (KLT).
D. Pemeriksaan Pendahuluan Flavonoida Secara KLT
Pemeriksaan pendahuluan adanya flavonoida dilakukan dengan
menotolkan ekstrak metanol herba pegagan embun dan rutin sebagai pembanding
pada KLT dengan fase diam selulosa yang kemudian dielusi menggunakan fase
gerak n-butanol : asam asetat : air (BAW = 4 : 1 : 5, fase atas). Pemilihan fase
diam dan fase gerak didasarkan pada polaritas dan sifat flavonoida. Penggunaan
selulosa sebagai fase diam karena selulosa bersifat non polar sehingga sesuai
dengan senyawa flavonoida yang bersifat polar dan juga selulosa dapat
memisahkan glikosida dari aglikon yang kurang polar. Apabila digunakan fase
diam lain contohnya silika yang mengandung logam CaSO4 akan mengakibatkan
terjadinya kompleks dengan flavonoida yang banyak mengandung gugus OH dan
dengan adanya kompleks dapat menyebabkan terjadinya pemisahan yang tidak
Fase gerak yang dipakai adalah BAW karena BAW bersifat polar
sehingga sesuai dengan flavonoida yang juga bersifat polar. Dengan persamaan
sifat polar ini maka BAW dapat mengelusi flavonoida dengan baik karena akan
terjadi interaksi yang lebih kuat antara flavonoida dengan BAW daripada
flavonoida dengan selulosa. Ketiga larutan tersebut akan membentuk dua lapisan,
yaitu fase atas dan fase bawah. Pemisahan disebabkan adanya perbedaan sifat
kepolaran yaitu asam asetat dan air lebih polar dibandingkan dengan n-butanol.
Asam asetat dengan sifatnya yang polar dan volumenya yang sedikit dapat larut
dalam air. Fase atas mengandung n-butanol namun karena volume di fase atas
lebih banyak daripada volume pada n-butanol yang semula ditambahkan maka
menandakan adanya air dan asam asetat yang terdispersi dalam n-butanol.
Untuk deteksi bercak pemisahan digunakan cahaya tampak dan UV 365
nm sebelum dan sesudah diuapi amonia pekat. KLT menggunakan fase diam
selulosa dengan fase gerak BAW menghasilkan kromatogram (Gambar 5) dimana
terdapat 3 bercak, ketiganya diduga sebagai flavonoida. Ketiga bercak tersebut
memiliki nilai Rf sebagai berikut 0,63; 0,76; dan 0,90. Diperoleh juga harga Rf
rutin 0,73 (Tabel VIII). Rutin berfungsi sebagai senyawa baku pembanding.
Digunakan rutin karena rutin memiliki aglikon yang sama dengan hiperin yaitu
kuersetin. Sehingga dengan penggunaan rutin sebagai senyawa baku pembanding
diharapkan dapat dipilih bercak yang bukan hiperin untuk dianalisis lebih lanjut.
Bercak dengan Rf 0,63 dan 0,90 memiliki penampakan warna yang sama
dengan rutin yaitu pada cahaya tampak bercak tidak tampak namun ketika dilihat
0,76 pada cahaya tampak bercak tidak tampak namun ketika dilihat pada UV 365
nm warna yang tampak adalah fluoresensi biru muda. Kemudian kromatogram
diuapi dengan uap amonia pekat yang dengan cepat menimbulkan bercak
berwarna kuning yang mudah hilang pula, namun pada UV 365 nm warna yang
timbul tidak jauh berbeda dengan sebelum diuapi amonia pekat pada UV 365 nm
Gambar 5. Kromatogram uji KLT pendahuluan ekstrak metanol herba pegagan embun, fase gerak BAW (4 : 1 : 5, fase atas), fase diam selulosa, jarak pengembangan 10 cm, deteksi dengan lampu UV 365 nm sesudah diuapi amonia.
Keterangan :
Tabel VIII. Penampakan warna bercak sampel (ekstrak metanol herba pegagan embun) dan pembanding (rutin 0,05% dalam metanol) sebelum dan sesudah diberi pereaksi uap amonia pekat yang dideteksi dengan cahaya tampak dan UV 365 nm.
Tanpa pereaksi Diuapi amonia Bercak Cahaya
tampak
Pembanding (C) Tidak tampak
Ungu Kuning Ungu 0,73
a Tidak tampak
Ungu Kuning Ungu 0,63
b Tidak
Ungu Kuning Ungu 0,90
O
Gambar 6. Reaksi yang terjadi setelah diberi uap amonia
Struktur flavonoida memiliki gugus auksokrom OH dengan atom O yang
sifatnya senang untuk menarik elektron, dengan adanya basa amonia akan mudah
melepaskan H yang kemudian diikat oleh amonia sehingga O memiliki 3 pasang
elektron bebas. Dengan adanya tambahan elektron tersebut, energi yang
diperlukan untuk mempromosikan elektronnya semakin kecil sehingga akan
diserap pada panjang gelombang yang lebih besar. Warna kuning terjadi karena
suatu senyawa menjadi berwarna. Warna dapat cepat kembali seperti semula
karena di udara terdapat banyak uap air (H-OH) yang akan memberikan H pada O
yang kelebihan elektron sehingga reaksi kembali seperti semula (reversible).
Dengan melihat data perubahan warna pada ketiga bercak dan
dibandingkan menurut acuan (Markham, 1988), dapat dinyatakan bahwa ketiga
bercak tersebut merupakan senyawa flavonoida.
E. Isolasi Flavonoida dengan Kromatografi Lapis Tipis Preparatif (KLTP)
Isolasi flavonoida secara KLTP dengan cara menotolkan ekstrak metanol
herba pegagan embun berupa pita memanjang. Fase diam yang digunakan adalah
selulosa dan fase geraknya adalah BAW. Pada KLTP ini dihasilkan 3 bercak
pemisahan, 2 dari 3 bercak tersebut yang memiliki intensitas warna yang kuat
dikerok dan dilarutkan dalam metanol yang kemudian disebut isolat I untuk
bercak dengan Rf 0,76 dan isolat II untuk bercak dengan Rf 0,90.
Kedua isolat tersebut selanjutnya diperiksa kemurniannya dengan
kromatografi lapis tipis multi eluen (KLT multi eluen). KLT multi eluen
merupakan KLT dengan menggunakan lebih dari satu fase gerak. Fase diam yang
digunakan adalah selulosa dengan fase gerak BAW dan asam asetat 15 % yang
dideteksi dengan sinar UV 365 nm.
Dari KLT multi eluen isolat I dengan fase gerak BAW tampak 1 bercak
dengan Rf 0,73, sedangkan dari KLT multi eluen dengan fase gerak asam asetat
belum murni. Dan selanjutnya dari KLT multi eluen isolat II diperoleh hasil yang
sama dengan KLT multi eluen isolat I, yaitu dengan fase gerak BAW tampak 1
bercak dengan Rf 0,90 dan dengan fase gerak asam asetat 15 % tampak 2 bercak
dengan Rf 0,55 dan 0,80. Jadi, diperoleh hasil bahwa kedua isolat belum murni
sehingga perlu dilakukan reisolasi.
Karena diketahui bahwa KLT multi eluen untuk kedua isolat dengan fase
gerak asam asetat 15 % menghasilkan 2 bercak, sedangkan dengan fase gerak
BAW hanya menghasilkan 1 bercak maka untuk reisolasi dengan KLTP
digunakan fase gerak asam asetat 15 % dengan fase diam yang sama, yaitu
selulosa. Dari KLTP isolat I diperoleh 3 pita pemisahan yaitu pita dengan Rf 0,36
(isolat a) berwarna ungu; Rf 0,77 (isolat b) dan 0,86 (isolat c) berwarna biru.
Sedangkan dari KLTP isolat II diperoleh 3 pita pemisahan yaitu pita dengan Rf
0,50 (isolat d) berwarna ungu; Rf 0,73 (isolat e) dan 0,86 (isolat f) berwarna biru.
Setiap pita pemisahan masing-masing isolat dikerok dan hasil kerokan dari pita
dengan warna dan Rf yang hampir sama dicampur, yaitu isolat b dengan isolat e
dan isolat c dengan isolat f. Sehingga, didapatkan 4 isolat yaitu isolat a (A), isolat
campuran b dan e (B), isolat campuran c dan f (C), dan isolat d (D). Selanjutnya
setiap isolat dilarutkan dalam metanol dan dianalisis lagi kemurniannya dengan
KLT multi eluen.
Isolat tersebut selanjutnya akan digunakan untuk pemeriksaan kemurnian
dengan KLT multi eluen, untuk reaksi warna dan untuk pemeriksaan
F. Pemeriksaan Kemurnian Isolat
Sebelum semua isolat dianalisis lebih lanjut, terlebih dahulu diperiksa
kemurniannya agar tidak mengganggu proses analisis reaksi warna dan
spektrofotometri UV. Pada pemeriksaan ini digunakan KLT multi eluen dengan
fase gerak pertama adalah BAW dan fase gerak kedua adalah asam asetat 15 %.
Dari KLT dengan fase gerak pertama, yaitu BAW tampak bahwa semua isolat
hanya menghasilkan 1 bercak. Masing-masing isolat menghasilkan bercak dengan
Rf 0,79 (isolat A); 0,77 (isolat B); 0,76 (isolat C) dan 0,76 (isolat D). Dan
selanjutnya dari KLT dengan fase gerak kedua, yaitu asam asetat 15 % juga hanya
1 bercak saja yang muncul pada masing-masing isolat, yaitu dengan Rf 0,40
(isolat A); 0,80 (isolat B); 0,84 (isolat C) dan 0,51 (isolat D). Hal ini menunjukkan
bahwa semua isolat adalah tunggal (murni) sehingga dapat digunakan untuk
analisis selanjutnya.
Sebelum dilakukan analisis dengan reaksi warna, terlebih dahulu
dilakukan scanning terhadap semua isolat untuk mengetahui hasil spektranya. Dari hasil scanning diperoleh puncak-puncak spektra dengan panjang gelombang tertentu yang sesuai dengan golongan flavonoida tertentu. Hasil puncak-puncak
spektra tersebut dianalisis dan dibandingkan dengan acuan. Dari hasil scanning dan hasil KLT pendahuluan maka dapat diketahui prakiraan golongan dari
masing-masing isolat (Tabel IX). Isolat A dan D mengarah pada golongan flavon
atau flavonol dengan 3-OH tersubstitusi. Isolat B mengarah pada golongan
flavanon dan dihidroflavonol. Sedangkan isolat C mengarah pada golongan