UJI KEMAMPUAN METODE KROMATOGRAFI LAPIS TIPIS-
DENSITOMETRI UNTUK MEMISAHKAN ASAM SALISILAT DAN EUGENOL
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh : Rosita Secoadi NIM : 08 8114 166
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2012
UJI KEMAMPUAN METODE KROMATOGRAFI LAPIS TIPIS-
DENSITOMETRI UNTUK MEMISAHKAN ASAM SALISILAT DAN EUGENOL
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh : Rosita Secoadi NIM : 08 8114 166
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2012
i
Halaman Persembahan
iv
Kupersembahkan Karya ini untuk: Papi - Mami - Saudara-saudaraku Almamaterku
UJI KEMAMPUAN METODE KROMATOGRAFI LAPIS TIPIS- DENSITOMETRI UNTUK MEMISAHKAN
ASAM SALISILAT DAN EUGENOL
INTISARI
Metode Kromatografi Lapis Tipis (KLT) Densitometri merupakan metode yang dikembangkan untuk penetapan kadar asam salisilat dan eugenol dalam sediaan krim topikal. Untuk memberikan hasil yang dapat dipercaya, maka metode ini perlu diuji kemampuannya dalam memisahkan kedua senyawa tersebut.
Penelitian ini merupakan penelitian non eksperimental-deskriptif. Asam salisilat dan eugenol dipisahkan dengan metode KLT dengan fase diam silika gel 60 F254 dan fase gerak toluena : etil asetat : metanol (65,2 : 2,4 : 32,4), serta dengan jarak pengembangan sejauh 15 cm. Setelah pemisahan senyawa dengan metode KLT, kemudian dilakukan analisis kuantitatif dengan densitometer pada panjang gelombang 288 nm. Parameter uji kemampuan metode yang diteliti adalah selektivitas, linearitas, perolehan kembali, presisi, dan range.
Hasil penelitian menunjukkan metode ini memiliki selektivitas dengan nilai α 5,825 dan nilai resolusi 5,125, dengan range pengukuran 1020 - 1224 ppm untuk asam salisilat dan 680 – 800 ppm untuk eugenol dan linearitas yang baik untuk asam salisilat dengan nilai r2 0,9972 dan untuk eugenol dengan nilai r2 0,9973, nilai rata-rata % recovery dan CV untuk level kadar rendah, sedang, dan tinggi berturut-turut adalah 98,4173% dan 2,3360%; 98,9914% dan 0,9778%; 98,9664% dan 0,8958% untuk asam salisilat, 100,5497% dan 1,0065%; 99,8064% dan 1,2278%; 99,7653% dan 0,8365% untuk eugenol. Berdasarkan hasil tersebut, maka metode KLT-densitometri ini memiliki kemampuan yang baik untuk memisahkan asam salisilat dan eugenol.
Kata kunci : KLT–Densitometri, asam salisilat, eugenol, uji kemampuan metode.
viii
THE CAPABILITY TEST OF THIN LAYER CHROMATOGRAPHY -DENSITOMETRY METHOD IN ORDER TO SEPARATE
SALICILIC ACID AND EUGENOL
ABSTRACT
Thin layer chromatography (TLC) densitometry method has been developed to separate a combination of salicylic acid and eugenol. To guarantees the method used provide reliable results, it is necessary to give a capability test to this methode.
In this non-experimental descriptive research, salicylic acid and eugenol were spotted on TLC silica gel F254 plates, which were developed with a mixture of toluene, ethyl acetate and methanol 65,2 : 2,4 : 32,4 (v/v). Quantitative spots at 288 nm.
The result showed α value 5,825, resolution value 5,125, linearity which is showed on coefficient of determination 0,9972 for salicylic acid and 0,9973 for eugenol. The mean recovery and CV value for low, medium and high level concentration respectively are 98,4173% and 2,3360%; 98,9914% and 0,9778%; 98,9664% and 0,8958% for salicylic acid, 100,5497% and 1,0065%; 99,8064% and 1,2278%; 99,7653% and 0,8365% for eugenol.
The densitometry method is selective, linear, precise, and have a good recovery. The quantitative testing shows that concentration of salicylic acid and eugenol range from 1020 ppm – 1224 ppm for salicylic acid and 680 ppm – 800 ppm for eugenol.
PRAKATA
Puji Syukur dan terima kasih penulis haturkan kepada Tuhan Yang Maha Esa atas segala berkat, rahmat, karunia dan penyertaan-Nya selama penelitian dan penyusunan skripsi ini sehingga penulis dapat menyelesaikan skripsi ini dengan baik. Skripsi dengan judul: “Uji Kemampuan Metode Kromatografi Lapis Tipis- Densitometri Untuk Memisahkan Asam Salisilat Dan Eugenol” ini disusun untuk memenuhi salah satu syarat untuk memperoleh gelar Sarjana Strata Satu Program Studi Ilmu Farmasi (S.Farm.) di Universitas Sanata Dharma Yogyakarta.
Dalam menyelesaikan skripsi ini, banyak dihadapi kesulitan. Namun, dengan adanya bantuan dari berbagai pihak, baik berupa dukungan moril maupun spirituil, maka pada akhirnya skripsi ini dapat diselesaikan dengan sebaik mungkin. Dengan penuh kerendahan hati, maka penulis ingin mengucapkan rasa terima kasih kepada :
1. Tuhan Yesus Kristus dan Bunda Maria yang selalu menyertai penulis. 2. Papi, Mami, Nana dan Dessy atas doa, dukungan, dan cinta kasihnya. 3. Ipang Djunarko M.Si., Apt., selaku Dekan Fakultas Farmasi Universitas
Sanata Dharma Yogyakarta.
4. Jeffry Julianus S.Farm., M.Si., selaku dosen pembimbing yang dengan
sabar dan bijaksana selalu memberikan bimbingan dan pengarahan kepada penulis, yang selalu ceria dengan canda tawanya ketika bimbingan.
5. Lucia Wiwid Wijayanti, M. Si., selaku dosen penguji atas kesediaannya
meluangkan waktu untuk menjadi penguji.
6. Prof. Dr. Sri Noegrohati, Apt., atas pengarahannya serta kesediaannya
meluangkan waktu untuk menjadi penguji.
7. Christine Patramurti S.Si., M.Si., Apt., atas pengarahannya serta kesediaannya meluangkan waktu untuk memberikan masukan dan semangat pada saya.
8. Seluruh dosen Fakultas Farmasi USD, atas ilmu yang diberikan dan
kebersamaan selama kuliah di Fakultas Farmasi Universitas Sanata Dharma.
9. Seluruh staf laboratorium, staf kebersihan, dan staf keamanan Fakultas
Farmasi, Universitas Sanata Dharma, Yogyakarta. Terutama Mas Bimo, Pak Parlan, Mas Kunto, Mas Otok, dan Pak Ketul yang telah membantu kelancaran penulis dalam menyelesaikan penelitian.
10. Edward Wijaya Setiawan, atas doa, dorongan, semangat, dan perhatiannya.
11. Vica, Uchan, Satya, dan Sisca sahabat saya yang telah memberikan doa,
dukungan, bantuan, dan semangat serta pengalaman tak terlupakan selama penelitian dan penyusunan skripsi. Terima kasih atas saran dan masukkan yang diberikan.
12. Keluarga ‘DJUminten’, Sisca, Cici, Brian, Dimbex, Uchan, Vica, Aga dan
Satya, atas semangat, canda, tawa, semangat dan pengalaman yang tak terlupakan selama di universitas ini.
13. Teman seperjuangan saya, Vica, dan Dhimas yang selalu setia menemani,
membantu, dan mendorong saya dalam menyelesaikan skripsi.
xi
14. Teman-teman Grup Antistres Paul, Hepi, Adi (Kimpul), Velly, Vica,
Dhimas, Uchan, Sasa, Satya, Yuni, Elisa, Novie, dan Ike sebagai teman seperjuangan mengerjakan skripsi di Laboratorium Analisis Instrumental. Terima kasih atas diskusi, semangat, cerita, canda-tawa, masukan, dan kebersamaan selama kita bekerja bersama.
15. Teman-teman kelompok praktikum C2: Uchan, Sasa, Satya, Asti, Dian,
Tika, Yuni, atas kekompakkan, kebersamaan, dan kerja sama selama kuliah, praktikum, dan di luar itu.
16. Sahabat-sahabatku dan teman-temanku yang lain atas segala doa dan
dukungannya.
17. Teman-Teman angkatan 2008, khususnya teman-teman FST atas suka
duka dan kebersamaannya.
18. Semua pihak yang tidak dapat disebutkan satu persatu yang telah membantu penulis dalam menyelesaikan skripsi ini.
Penulis menyadari bahwa dalam penyusunan dan penyelesaian skripsi ini masih banyak terdapat kesalahan dan kekurangan mengingat keterbatasan kemampuan dan pengetahuan penulis. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun dari semua pihak. Akhir kata, semoga laporan ini dapat berguna bagi pembaca.
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
PERNYATAAN PERSETUJUAN PUBLIKASI ... vi
INTISARI ... vii
ABSTRACT ... viii
PRAKATA ... ix
DAFTAR ISI ... xii
DAFTAR TABEL ... xvi
DAFTAR GAMBAR ... xvii
DAFTAR LAMPIRAN ... xix
BAB I : PENDAHULUAN ... 1
A. Latar Belakang ... 1
1. Rumusan Permasalahan ... 3
2. Keaslian Penelitian ... 3
3. Manfaat Penelitian ... 4
B. Tujuan Penelitian ... 5
BAB II : PENELAAHAN PUSTAKA ... 6
A. Asam Salisilat ... 6
B. Eugenol ... 7
C. Kromatografi Lapis Tipis ... 8
1. Fase Diam ... 10
2. Fase Gerak ... 12
3. Aplikasi (penotolan) ... 14
4. Pengembangan ... 15
5. Deteksi ... 15
D. Densitometri ... 16
E. Selektivitas (selectivity) ... 18
F. Perolehan Kembali (recovery) ... 19
G. Ketelitian (precision) ... 20
H. Linearitas (linearity) ... 21
I. Rentang (range) ... 24
J. Landasan Teori ... 24
K. Hipotesis ... 25
BAB III : METODE PENELITIAN ... 26
A. Jenis dan Rancangan Penelitian ... 26
B. Variabel Penelitian ... 26
C. Definisi Operasional ... 27
D. Bahan Penelitian ... 27
E. Alat Penelitian ... 27
F. Tata Cara Penelitian ... 28
1. Pembuat fase gerak ... 28
2. Penjenuhan chamber ... 28
3. Pengaktifan fase diam ... 28
4. Pembuatan larutan baku asam salisilat ... 29
5. Pembuatan larutan baku eugenol ... 29
6. Pembuatan larutan baku tunggal asam salisilat dan eugenol ... 30
7. Pembuatan larutan baku campuran asam salisilat dan eugenol ... 30
8. Penetapan panjang gelombang pengamatan ... 30
9. Penetapan kurva baku asam salisilat dan eugenol dan pengamatan nilai Retardation Factor (Rf) asam salisilat dan eugenol ... 31
10. Penentuan selektivitas, uji perolehan kembali, presisi, linearitas, dan rentang ... 31
G. Analisis Hasil ... 32
1. Selektivitas ... 32
2. Linearitas ... 32
3. Uji Perolehan Kembali ... 32
4. Presisi ... 33
5. Rentang ... 33
xv DA
BI
BAB IV : HASIL DAN PEMBAHASAN ... 34
A. Sistem Kromatografi ... 34
B. Pembuatan Larutan Baku Asam Salisilat dan Eugenol ... 35
C. Penetapan Panjang Gelombang Pengamatan ... 37
D. Analisis Kualitatif ... 40
E. Penetapan Kurva Baku ... 45
F. Kemampuan Pemisahan ... 49
1. Selektivitas ... 49
2. Uji Perolehan Kembali ... 49
3. Presisi ... 52
4. Linearitas ... 54
5. Rentang ... 55
BAB V : KESIMPULAN DAN SARAN ... 57
A. Kesimpulan ... 57
B. Saran ... 57
FTAR PUSTAKA ... 58
LAMPIRAN ... 62
DAFTAR TABEL
Tabel I. Adsorben yang Sering Digunakan pada KLT Berdasarkan Urutan
Kepolarannya ... 10
Tabel II. Nilai Indeks Polaritas Pelarut ... 13
Tabel III. Kriteria Penerimaan Persen Perolehan Kembali pada Konsentrasi Analit yang Berbeda ... 20
Tabel IV. Kriteria Penerimaan Presisi pada Konsentrasi Analit yang Berbeda... 21
Tabel V. Hubungan dan Arah Koefisien Korelasi ... 22
Tabel VI. Kekuatan Hubungan Berdasarkan Nilai Koefisien Korelasi ... 23
Tabel VII. Perbandingan Nilai α dan Nilai Resolusi dan Rf pada Baku Asam Salisilat dan Eugenol ... 42
Tabel VIII. Data Replikasi Kurva Baku Asam Salisilat ... 46
Tabel IX. Data Replikasi Kurva Baku Eugenol ... 46
Tabel X. Data % Recovery Asam Salisilat Tunggal ... 51
Tabel XI. Data % Recovery Eugenol Tunggal ... 51
Tabel XII. Data % Recovery Campuran Asam Salisilat-Eugenol ... 52
Tabel XIII. Data % CV Asam Salisilat Tunggal ... 53
Tabel XIV. Data % CV Eugenol Tunggal ... 53
Tabel XV. Data % CV Campuran Asam Salisilat-Eugenol ... 53
DAFTAR LAMPIRAN
Lampiran 1. Certificate of Analysis Baku Asam Salisilat ... 63
Lampiran 2. Certificate of Analysis Baku Eugenol ... 64
Lampiran 3. Data Pengambilan Bahan dan Perhitungan Konsentrasi Sebenarnya64 Lampiran 4. Perhitungan Indeks Polaritas Fase Gerak ... 68
Lampiran 5. Spektra Panjang Gelombang Asam Salisilat dan Eugenol dengan Perbandingan 1,5 : 1 pada Tiga Tingkat Konsentrasi Rendah, Sedang, dan Tinggi ... 69
Lampiran 6. Standar Operasional Prosedur (SOP) Analisis Kuantitatif ... 70
Lampiran 7. Densitogram Seri Kurva Baku Asam Salisilat Replikasi 1 ... 71
Lampiran 8. Densitogram Seri Kurva Baku Asam Salisilat Replikasi 2 ... 73
Lampiran 9. Densitogram Seri Kurva Baku Asam Salisilat Replikasi 3 ... 75
Lampiran 10. Data Penentuan Kurva Baku Asam Salisilat ... 77
Lampiran 11. Persamaan Regresi Linear dan Gambar Grafik Seri Kurva Baku Asam Salisilat ... 78
Lampiran 12. Densitogram Seri Kurva Baku Eugenol Replikasi 1 ... 79
Lampiran 13. Densitogram Seri Kurva Baku Eugenol Replikasi 2 ... 81
Lampiran 14. Densitogram Seri Kurva Baku Eugenol Replikasi 3 ... 83
Lampiran 15. Data Penentuan Kurva Baku Eugenol ... 85
xx
Lampiran 16. Persamaan Regresi Linear dan Gambar Grafik Seri Kurva Baku
Eugenol ... 85
Lampiran 17. Densitogram Baku Tunggal Asam Salisilat (Uji kemampuan
metode) ... 87
Lampiran 18. Densitogram Baku Tunggal Eugenol (Uji kemampuan metode) .... 91
Lampiran 19. Densitogram Baku Campuran Asam Salisilat dan Eugnol (Uji
kemampuan metode) ... 95
Lampiran 20. Perhitungan % Recovery dan CV Baku Tunggal dan Campuran
dari Asam Salisilat dan Eugenol ... 99
BAB I PENDAHULUAN
A. Latar Belakang
Asam salisilat dan eugenol merupakan bahan alam yang saat ini penggunaannya semakin meningkat. Hal ini dapat dilihat dari maraknya produk-produk farmasi yang mengandung komponen utama asam salisilat dan eugenol, seperti krim-krim perawatan kulit dan masker wajah. Kedua senyawa ini akan memberikan efek kulit yang makin halus dan bebas dari mikrobakteri.
Kedua senyawa ini merupakan kombinasi yang dapat memberikan efek kulit yang makin halus dan bebas dari mikrobakteri, namun dalam dosis yang tidak tepat asam salisilat dan eugenol dapat menyebabkan iritasi pada jaringan, dan pada orang yang sangat sensitif dapat menyebabkan dermatitis (Duke, 1987).
Asam salisilat merupakan senyawa bahan alam golongan fenol yang telah diproduksi secara sintetik dan memiliki aktifitas sebagai keratolitik, antiinflamasi dan analgesik (Viswanatha, Kharat, Shylaja, and Lakshman, 2010). Senyawa ini berbentuk serbuk berwarna putih dan tak berbau (Direktorat Jenderal Pengawasan Obat dan Makanan RI, 1995).
Eugenol merupakan salah satu senyawa golongan fenol yang berasal dari alam, yang merupakan komponen utama dari minyak cengkeh. Selain memiliki harum yang khas, eugenol juga memiliki aktifitas sebagai analgesik (Thompson, Norbeck, Olsson, Constantin-Teodosiu, Van der Zee, and Moldous, 1988). Senyawa ini merupakan senyawa berwarna kuning pucat, berupa cairan jernih yang akan berubah menjadi gelap apabila terpapar oleh cahaya, dan praktis tidak
1
larut air (European Pharmacopoeia Convention, 2005). Selain itu, eugenol juga memiliki peran penting sebagai dasar pembuatan produk farmasi dan dapat diproses menjadi isoeugenol, eugenol asetat dan vanilin (Harnani, 2010).
Dalam penelitian ini akan diteliti kemampuan dari Kromatografi Lapis Tipis-Densitometri dalam memisahkan campuran asam salisilat dan eugenol. Asam salisilat merupakan golongan fenol yang dapat memberikan efek antiinflamsi, keratolitik dan analgesik. Eugenol merupakan senyawa golongan fenol yang memberikan efek analgesik, bersifat antimikroba dan berbau harum.
Berdasarkan penjelasan di atas, dibutuhkan adanya metode untuk memisahkan asam salisilat dan eugenol sehingga dapat diteliti kadarnya masing-masing agar mutu dan keamanan dari produk tetap terjaga. Penjaminan mutu berguna untuk menjamin khasiat dan keamanan produk. Dalam menganalisis suatu campuran senyawa, dibutuhkan metode yang mampu memisahkan campuran senyawa tersebut untuk dapat dilihat kadar dari masing-masing senyawa dalam sampel.
bersamaan (Rohman, 2009). Disamping itu, KLT-Densitometri memiliki ketepatan penentuan kadar yang lebih baik daripada Kromatografi Cair Kinerja Tinggi (KCKT) atau Kromatografi Gas Cair (KGC) karena komponen yang ditentukan merupakan noda yang tak bergerak (Mulya dan Suharman, 1995).
Sebelum digunakan untuk diaplikasikan, metode ini perlu diuji kemampuannya dalam memisahakan asam salisilat dan eugenol. Uji kemampuan pemisahan kedua campuran senyawa dengan metode ini didasarkan pada parameter selektivitas, akurasi, presisi, linearitas, dan rentang. Hal ini perlu dilakukan untuk member gambaran tentang kemampuan pemisahan dari Kromatografi Lapis Tipis – Densitometri dalam menganalisi campuran asam salisilat dan eugenol.
1. Rumusan Permasalahan
Berdasarkan latar belakang di atas, maka dapat disusun permasalahan sebagai berikut: apakah metode KLT-Densitometri dengan fase diam silika gel 60 F254 dan fase gerak toluena : etil asetat : metanol (65,2 : 2,4 : 32,4) memiliki kemampuan pemisahan yang baik untuk memisahkan campuran asam salisilat dan eugenol yang didasarkan pada parameter selektivitas, perolehan kembali, presisi, linearitas, dan rentang?
2. Keaslian Penelitian
eberm. Leaf powder by high-performance thin-layer chromatography oleh Vidya V. Dighe, Atish A. Gursale, Ramesh T. Sane, Sasikumar Menon, and Shvetali C. Raje (2005) dengan fase diam silika gel 60 F254 dan fase gerak toluena : etil asetat : asam format (90 : 10 : 01), dideteksi dengan densitometri pada λ=280nm dan Quantitative analysis of eugenol in clove extract by a validated HPLC method oleh So-Mi Yun, Myoung-Heon Lee, Kwang-Jick Lee, Hyun-Ok Ku, Seong-Wan Son, and Yi-Seok Joo (2010) dengan fase diam XTerra RP18 column (250 x 4.6 mm id, 5 microm) dan fase gerak isokratik metanol 60%, dideteksi pada λ=280nm.
Berdasarkan penelusuran pustaka yang telah dilakukan penulis, penelitian tentang pemisahan asam salisilat dan eugenol dengan metode KLT-Densitometri belum pernah dilakukan sebelumnya.
3. Manfaat Penelitian
Hasil penelitian ini diharapkan mempunyai manfaat sebagai berikut: a. Manfaat Teoritis
Penelitian ini diharapkan dapat membuktikan bahwa metode Kromatografi Lapis Tipis-Densitometri mampu memisahkan asam salisilat dan eugenol. b. Manfaat Metodologis
c. Manfaat Praktis
Penelitian ini diharapakan dapat digunakan untuk memisahkan campuran asam salisilat dan eugenol.
B. Tujuan Penelitian
BAB II
PENELAAHAN PUSTAKA
A. Asam Salisilat
Gambar 1. Struktur Asam Salisilat
Asam salisilat yang disebut juga 2-Hydroxybenzoic acid dapat ditemukan
pada buah-buahan seperti peach, berry dan strawberry, namun saat ini sudah
dapat dibuat secara sintesis (Rhodia, 2011). Senyawa ini berbentuk padat tak
berbau, berwarna putih dengan nilai pH pada saturated condition 2,4. Asam
salisilat memiliki nilai LD 50 melalui kulit sesuai dengan nilai LD50 tikus yaitu
1250 - 1580 mg/kg, memiliki massa molar 138,12 g/mol, nilai kelarutan dalam air
sekitar 2 g/L, nilai kerapatan 1.443 g/cm3 pada suhu 20 °C, dan memiliki nilai
titik didih 2110C dengan nilai tekanan uap sebesar 27 hPa pada suhu 2110C
(Merck, 2006). Selain itu, asam salisilat juga memiliki nilai konstanta Henry
sebesar 1,52 x 10-9 atm-m3/mol pada suhu 250C (RSC, 2012), dengan nilai Kow
2,26 (Vijon, 2008). Biasanya asam salisilat digunakan sebagai analgesik, obat
jerawat, produk perawatan wajah, dan pestisida(EnvironmentalProtectionAgency,
2005).
Nilai dari asam salisilat dalam 0,5 N natrium hidroksida (NaOH)
sebesar 260 pada λmaks 300 nm (Clarke, 1971). Asam salisilat merupakan serbuk %
kristal putih atau berwarna, kristal asirkular, sedikit larut dalam air, mudah larut
dalam kloroform, eter dan etanol (96%), sedikit larut dalam metilen klorida
(European Pharmacopoeia Convention, 2005).
B. Eugenol
O OH
Gambar 2. Struktur Eugenol
Komponen utama dari minyak cengkeh yaitu eugenol, merupakan senyawa
berbentuk cairan tidak berwarna atau kuning pucat dengan bobot molekul 164,20
g/mol. Senyawa ini memiliki bau cengkeh kuat, menusuk, dan rasa pedas. Bila
terpapar udara warna eugenol menjadi lebih gelap dan mengental. Kelarutan eugenol
baik dalam etanol, kloroform, eter, dan minyak lemak, namun sukar larut dalam air.
Nilai kelarutannya sebesar 1,85 mg/L pada air disuhu 200C dan lebih dari 25000
mg/L pada alkohol, etil asetat dan pelarut organik lain pada suhu 200C (BPDB,
2011).Bobot jenis eugenol antara 1,064 g/mL - 1,070 g/mL (Budavari, 2001). Nilai
Kow 2,7 dengan titik didih 2480C, serta memiliki nilai tekanan uap sebesar 1mmHg
pada suhu 78,40C (TCI America, 2008). Selain itu, eugenol juga memiliki nilai
konstanta Henry sebesar 0,24 Pa.m3/mol pada suhu 250C dan termasuk dalam
katagori cukup volatil (BPDP, 2011). Nilai dari eugenol dalam etanol
sebesar 406 dengan λmaks 231,5 nm dan 193 pada λmaks 282 nm (Clarke, 1971). %
Eugenol merupakan fenol atau senyawa aromatis hidroksi (Tarigan, 2009).
analgesik(Thompsonet al.,1988).Disampingdigunakan sebagai bahan penambah
aroma, eugenol juga mempunyai sifat stimulant, anestetik lokal, karminatif,
antiemetik, antiseptik dan antispasmodik yang digunakan dalam sabun, detergen,
pasta gigi, parfum dan produk farmasi. Penggunaan eugenol dalam produk
farmasi diantaranya balsam untuk mengurangi rasa nyeri, obat sakit gigi, dan
bahan campuran untuk menambal gigi (Nurdjannah, 2011).
Allylguaiacol atau yang lebih dikenal dengan eugenol merupakan
senyawa golongan fenol yang tak larut air, namun akan berubah menjadi bentuk
garam fenolik yang larut air oleh penambahan basa seperti NaOH dan kalium
hidroksida (KOH). Untuk menjamin kesempurnaan reaksi diperlukan pemanasan
dan atau pengadukan (Gearien and Grabowski, 1969).
C. Kromatografi Lapis Tipis
Kromatografi didefinisikan sebagai prosedur pemisahan zat terlarut oleh
suatu proses migrasi diferensial oleh sistem yang terdiri dari dua fase atau lebih,
salah satu diantaranya bergerak secara kontinyu dalam arah tertentu dan zat-zat di
dalamnya menunjukkan perbedaan mobilitas karena adanya perbedan adsorpsi,
partisi,kelarutan,tekananuap,ukuranmolekulataukerapatanmuatanion.Dengan
pemisahan tersebut maka masing-masing zat dapat diidentifikasi atau ditetapkan
kadarnya dengan metode analitik (Direktorat Jenderal Pengawasan Obat dan
MakananRI,1995).Kromatografilapistipis(KLT)merupakanmetodepemisahan
dibawah gerakan pelarut pengembang atau pelarut pengembang campur (Mulya
dan Suharman, 1995).
Kromatografi lapis tipis dapat digunakan untuk menguji kemurnian dari
campuran suatu senyawa. Hal ini berkaitan untuk pembuktian ada atau tidaknya
komponen yang dicari dan apakah komponen tersebut murni atau tidak.
Penggunaan secara khusus KLT adalah untuk mengetahui kemurnian senyawa
selama proses pemurnian. Hal ini dilakukan dengan cara membandingkan
senyawa hasil pemurnian dengan senyawa standarnya. Senyawa yang murni akan
memberikan bercak tunggal pada berbagai fase gerak dengan berbagai tingkat
kepolaran dan mempunyai harga Rf yang sama dengan senyawa standarnya
(Gasparic and Churacek, 1978).
Pada KLT, hasil yang diperoleh ditunjukkan dengan nilai Rf yang
menggambarkan migrasi relatif komponen senyawa terhadap pelarut dan
berhubungan dengan koefisien distribusi komponen. Beberapa variabel dapat
mempengaruhi nilai Rf, seperti komposisi pelarut, suhu, ukuran chamber, dan
lapisan sorbent (Braithwaite and Smith, 1999). Dalam analisis kuantitaif dengan
metode KLT, nilai Rf diharapkan berada antara 0,2 dan 0,8 (Kowalska, 2003).
R (1)
Dalam pelaksanaannya, KLT lebih murah, lebih mudah, dan peralatannya
lebih sederhana dibandingkan dengan kromatografi kolom. Keuntungan lainnya
menurut Gandjar dan Rohman (2007) adalah sebagai berikut
a. Pemisahan analit dapat diidentifikasi dengan menggunakan pereaksi warna,
b. Elusi dapat dilakukan dengan cara menaik, menurun atau elusi 2 dimensi
1. Fase Diam
Dalam KLT, fase diam terdiri atas lapisan tipis adsorben yang
dipadatkan diatas lempengan solid sebagai lapiasan tipis dengan ketebalan
kurang lebih 0.25 mm kemudian sampel akan diaplikasikan di dekat salah
satu ujung fase diam dalam rupa spot/totolan kecil (Drenthe College The
Netherlands, 2011).
Lempeng fase diam ini sebaiknya disimpan dalam lingkungan yang
tidak lembab atau bebas dari uap laboratorium (Stahl, 1985). Sebelum
digunakan, lempeng adsorben perlu diaktifkan terlebih dahulu di dalam oven
dengan suhu 120o-150oC untuk menghilangkan air yang ada pada permukaan
adsorben. Jika temperatur yang digunakan terlalu tinggi dapat menonaktifkan
adsorben secara permanen (Braithwaite and Smith, 1999).
Tabel I. Adsorben yang Sering Digunakan pada KLT
Berdasarkan Urutan Kepolarannya (Gandjar dan Rohman, 2007)
Adsorben Tingkatan Kepolaran
Alumina Paling polar
Paling non polar Silika gel
Magnesium silikat Selulosa
Resin-resin polimerik
Makin meningkat
Fase diam yang umum ialah silika gel, aluminium oksida, kieselgur,
selulosa dan turunannya, dan lain-lain (Stahl, 1985). Silika gel adalah fase
diam yang paling banyak digunakan (Stahl, 1985). Silika gel GF254 artinya
silika tersebut mengandung gypsum (CaSO4½H2O) yang merupakan pengikat,
dan juga meningkatkan gaya adhesi antar partikel silika. F254 adalah indikator
fosforesensi pada panjang gelombang 254 nm yang berarti silika tersebut
dapat berfosforesensi pada panjang gelombang 254 nm (Jork, 1990).
Semua silika gel adalah silikon dioksida dari sudut pandang kimia.
Masing-masing atom silikon dikelilingi oleh empat atom oksigen dengan
bentuk tetrahedron. Pada permukaan silika gel, elektron valensi dari oksigen
terhubungkan dengan hidrogen (Si-OH, gugus silanol) atau dengan atom
silikon lainnya (Si-O-Si, gugus siloksan). Gugus silanol mewakili pusat
permukaan adosorpsi-aktif yang mampu berinteraksi dengan molekul sampel.
Oleh karena itu, silika gel cocok sebagai fase diam di dalam kromatografi.
Kemampuan gugus silanol untuk bereaksi secara kimia dengan reagen yang
sesuai dapat digunakan untuk memodifikasi permukaan silika gel (Kowalska,
2003).
Gambar 3. Stuktur Silika Gel (Hauck and Mack, 1996)
Partikel silika gel mengandung gugus hidroksi pada permukaannya
yang akan membentuk interaksi hidrogen dengan molekul yang polar. Adanya
air yang teradsorbsi akan mencegah molekul polar untuk membentuk interaksi
menghilangkan air yang teradsorbsi (Christian, 2004). Kandungan air yang
ideal dalam silika adalah antara 11-12 % b/b (Rohman, 2009).
2. Fase Gerak
Proses KLT dapat diubah-ubah dengan memodifikasi fase diam atau
dengan mengubah kepolaran fase gerak yang digunakan, dimana mengubah
kepolaran fase gerak lebih mudah dilakukan. Polaritas fase gerak diubah
dengan cara menambahkan fase gerak lain sehingga diperoleh kepolaran yang
tepat untuk memisahkan campuran senyawa. Kepolaran fase gerak yang
digunakan untuk mengelusi harus disesuaikan berdasarkan kemampuannya
bersaing dengan permukaan fase diam untuk berinteraksi dengan molekul
yang terlarut (Gritter, Bobbit, and Scharting, 1991). Semakin besar indeks
polaritas yang dimiliki pelarut maka pelarut semakin polar dan semakin besar
eluotropic values dari pelarut menunjukkan semakin mudah untuk mengelusi
sampel(Snyder,Kirkland,andGlajch,1997).
Polaritas fase gerak dapat mempengaruhi separasi/pemisahan. Untuk
ituperludicarisuatukomposisifasegerakyangmampumemberikanpemisahan
yangbaik(Anonim, 2011a). Biasanya pemilihan pelarut yang digunakan untuk
analisis dengan metodeKLT,harusdapatmelarutkananalitdengansempurna,
mudah menguap, viskositas rendah, serta dapat membasahi lapisan penyerap
(Sherma and Fried, 1996).
Dalam penentuan fase gerak melalui proses trial and error ini, perlu
memperhatikan sifat polaritas solut. Semakin polar solut maka semakin
afinitas atau mempunyai sedikit afinitas yang kecil terhadap adsorben polar,
sementara solut-solut yang terpolarisasi memiliki afinitas yang kecil terhadap
adsorben polar disebabkan adanya interaksi dipol atau interaksi-interaksi yang
diinduksi oleh dipol. Solut-solut polar, terutama yang mampu membentuk
ikatan hidrogen, akan terikat kuat pada adsorben karenanya butuh fase gerak
yang relatif polar untuk mengelusinya (Gandjar dan Rohman, 2007).
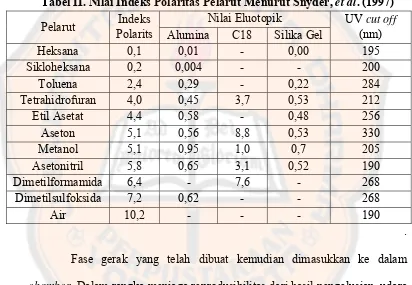
Tabel II. Nilai Indeks Polaritas Pelarut Menurut Snyder, et al. (1997)
Pelarut Indeks Polarits
Nilai Eluotopik UV cut off
(nm) Alumina C18 Silika Gel
Heksana 0,1 0,01 - 0,00 195
Sikloheksana 0,2 0,004 - - 200
Toluena 2,4 0,29 - 0,22 284
Tetrahidrofuran 4,0 0,45 3,7 0,53 212 Etil Asetat 4,4 0,58 - 0,48 256
Fase gerak yang telah dibuat kemudian dimasukkan ke dalam
chamber. Dalam rangka menjaga reprodusibilitas dari hasil pengelusian, udara
yang ada di dalam chamber harus terjenuhkan oleh fase gerak. Hal ini dapat
dilakukan dengan menyiramkan fase gerak di sekeliling chamber sebelum
memasukkan plate kemudian dijaga kejenuhannya dengan kertas saring dan
menjaga agar chamber tetap tertutup sepanjang waktu pengelusian sampai
plate akan diambil (Anonim, 2011b). Bila ada ruang tak jenuh di balik
besar daripada bagian tengah lempeng, yang berarti angka Rf di tepi akan lebih
besar dan memberi pengaruh batas (batas elusi akan tampak melengkung ke
bawah di bagian tengah lempeng). Hal ini menyebabkan penurunan harga Rf
di bagian tengah lempeng, efeknya dapat ditekan dengan menjenuhkan
chamber dengan bantuan kertas saring (Munson,1984).
3. Aplikasi (penotolan)
Campuran yang akan dipisahkan, biasanya dibuat menjadi bentuk
larutan, ditotolkan dalam bentuk bercak atau pita. Setelah itu, plat diletakkan
di dalam bejana tertutup rapat yang berisi fase gerak yang cocok, pemisahan
terjadi selama pengembangan (Stahl, 1985). Pelarut cuplikan harus sedapat
mungkin merupakan pelarut yang mudah menguap dan juga sedapat mungkin
memiliki poleritas yang rendah (Sastrohamidjojo, 2005).
Pemisahan pada kromatografi lapis tipis yang optimal akan diperoleh
hanya jika menotolkan sampel dengan ukuran bercak sekecil mungkin dan
sesempit mungkin. Sebagaimana dalam prosedur kromatografi yang lain, jika
sampel yang digunakan terlalu banyak maka akan menurunkan resolusi. Hasil
penelitian menunjukkan bahwa penotolan sampel secara otomatis lebih dipilih
daripada penotolan secara manual terutama jika sampel yang akan ditotolkan
lebih dari 15 μL. Penotolan sampel yang tidak tepat akan menyebabkan bercak
yang menyebar dan puncak ganda (Gandjar dan Rohman, 2007).
Untuk memperoleh reprodusibilitas, volum sampel yang ditotolkan
paling sedikit 0,5 μL. Jika volum sampel yang akan ditotolkan lebih besar dari
pengeringan antar totolan (Rohman, 2009). Penempatan spot di atas plat
kira-kira 1 cm dari salah satu ujung di mana ujung ini nanti dicelupkan dalam
pelarut pengembang dan spot masing-masing diaplikasikan pada jarak
kira-kira 1cm dari masing-masing pusat spot (Sastrohamidjojo, 2005).
4. Pengembangan
Ada beberapa teknik pengembangan dalam KLT, seperti
pengembangan ascending, pengembangan descending, dan pengembangan
dua dimensi. Teknik pengembangan yang sering dipakai adalah teknik
pengembangan ascending dimana ujung bawah lempeng yang terdapat
spot-spot analit dicelupkan dalam pelarut pengembang (Rohman, 2009).
Jarak pengembangan fase gerak biasanya kurang lebih 10-15 cm,
akan tetapi beberapa ahli kromatografi memilih mengembangkan lempeng
pada jarak 15-20 cm (Rohman, 2009). Untuk plat ukuran 20 x 20 cm, jarak
pengembangan maksimal yang dapat dilakukan adalah 0,5 cm dari ujung atas
plat (19,5 cm) (Sastrohamidjojo, 2005).
5. Deteksi
Biasanya untuk visualisasi cukup mudah, karena ada beberapa
senyawa organik yang bewarna, jika beruntung senyawa yang dipisahkan
adalah senyawa organik bewarna seperti dyes dan tinta, sehingga tidak
membutuhkan bantuan visualisasi khusus. Namun, kebanyakan senyawa
organik tidak berwarana sehingga metode visualisasi diatas tidak berlaku.
Sehingga digunakan lampu UV untuk melihat bercak yang muncul pada plat
menjadi berpenjar kehijauan dibawah lampu UV 254 nm (Anonim, 2011a).
Pengukuran kromatogram KLT kebanyakan dilakukan pada kisaran panjang
gelombang UV rendah (190 nm-300 nm). Pada alat yang lebih modern seperti
densitometri dapat dilakukan scanning pada permukaan lempeng (Rohman,
2009).
D. Densitometri
Densitometri merupakan metode analisis instrumental yang mendasarkan
pada interaksi radiasi elektromagnetik dengan analit yang merupakan bercak pada
plat KLT. Metode ini lebih dititikberatkan untuk analisis kuantitatif analit-analit
dengan kadar kecil, yang mana diperlukan pemisahan terlebih dahulu dengan
KLT (Rohman, 2009). Metode densitometri mempunyai cara kerja yang
sederhana dan cepat (Gritter et al., 1991).
Pada metode densitometri diperlukan adsorben dan fase gerak yang
murni. Untuk memperoleh hasil yang baik, umumnya digunakan adsorben siap
pakai yang telah mengalami pra pencucian (Gritter et al., 1991). Teknik
pengukuran pada densitometri dapat didasarkan atas pengukuran intensitas sinar
yang diserap (absorbansi), intensitas sinar yang dipantulkan (reflectance) atau
intensitas sinar yang dipendarkan (fluorescence) (Gandjar dan Rohman, 2007).
Pada densitometri absorbsi, bercak pada lempeng KLT dipindai oleh
seberkas sinar monokromatik dalam bentuk slit dengan panjang slit yang dapat
diatur panjang dan lebarnya (Rohman, 2009) disesuaikan dengan diameter dari
bergerak di atas bercak pemisahan pada lempeng kromatografi. Lempeng akan
digerakkan menyusuri berkas sinar yang berasal dari sumber sinar tersebut
(Sudjadi, 1988).
Beberapa TLC scanner sudah dilengkapi dengan alat pemroses data,
sehingga integrasi luas puncak atau tinggi puncak dapat langsung direkam atau
tercatat sebagai data sekaligus dengan densitogramnya dan dapat pula dicatat
langsungsebagaikadarnya,denganteknikpemrogramantertentu(Mintarsih,1990).
Penetapan kadar suatu senyawa dengan metode KLT-densitometri
dilakukan dengan mengukur kerapatan bercak senyawa yang dipisahkan dengan
cara KLT. Pada umumnya pengukuran kerapatan bercak tersebut dibandingkan
dengan kerapatan bercak senyawa standar yang dielusi bersama (Hardjono, 1985).
Ada dua cara penetapan kadar dengan alat densitometer. Pertama, setiap
kali penetapan ditotolkan sediaan baku dari senyawa yang bersangkutan dan
dielusi bersama dalam suatu lempeng, lalu AUC (Area Under Curve) sampel
dibandingkan dengan harga AUC zat baku. Yang kedua, dengan membuat kurva
baku hubungan antara jumlah zat baku dengan AUC. Kurva baku dibuat dengan
menotolkan zat baku pada plat KLT dengan berbagai macam konsentrasi. AUC
yang diperoleh dibuat persamaan garis lurus y=bx+a, dimana x adalah konsentrasi
yang diperoleh sedangkan y adalah besarnya AUC (Sudjadi, 1988).
Penelusuran bercak dapat dilakukan secara horisontal maupun vertikal
(scanning horizontal atau scanning vertical). Penelusuran bercak secara horisontal
dapat dilakukan satu persatu, atau apabila satu plat bercak yang diperoleh segaris
Sedangkan cara penelusuran vertikal, hanya dapat dilakukan satu per satu. Pada
penelusuran bercak horisontal dengan penelusuran beberapa bercak sekaligus
hanya dapat dilakukan apabila bercak-bercak tesrsebut benar-benar berada dalam
satu baris. Cara ini akan mengalami kesulitan jika bercak yang sangat dekat
dengan bercak yang akan ditetapkan, karena ada kemungkinan bercak yang tidak
diinginkan ikut tertetapkan (Mintarsih, 1990). Semakin kecil dan intensif suatu
bercak, akan dihasilkan suatu puncak kurva absorbsi yang sempit dan tajam,
sebaliknya bercak yang lebar akan menghasilkan puncak kurva absorbsi yang
lebar dan tumpul (Sudjadi, 1988).
E. Selektivitas (selectivity)
Selektivitas suatu metode analisis adalah kemampuan untuk
mengukur analit secara cermat dan seksama dengan adanya komponen yang
mungkin ada dalam matrik sampel (Yuwono dan Indrayanto, 2005).
Selektivitas sering dapat dinyatakan sebagai derajat penyimpangan metode
terhadap sampel yang mengandung bahan yang ditambahkan berupa cemaran,
produk degradasi, senyawa sejenis, dan senyawa asing lain (Harmita, 2004).
Gambar 4 merupakan suatu simulasi pemisahan puncak kromatografi
antara dua kurva Gaussian identik, yang terpisah secara perlahan-lahan. Dapat
dilihat bahwa nilai resolution factor (R) akan sesuai dengan diagram. Dimana
nilai R = 0,75 kedua puncak masih berhimpit sekitar 65%, pada R = 1, kedua
puncak masih berhimpit sekitar 27%, dan pada R=1,5 kedua puncak dapat
dianggap telah akan mencapai baseline dimana kedua puncak hanya berhimpit
sekitar 2% (Rouessac and Rouessac, 2007).
Selektivitas pada metode kromatografi dapat ditunjukkan melalui
nilai α (separation factor) dan nilai resolusi (daya pisah) antara analit yang
dituju dengan pengganggu lainya harus > 1,5 (Gandjar dan Rohman, 2007).
Harga R > I,5 disebut baseline resolution, yaitu pemisahan sempurna dari dua
puncak dengan ukuran yang sama (Pecsok, Shield, Cairns and McWilliam,
1976). Sedangkan α merupakan kemampuan fase diam dalam memisahkan
dua komponen A dan B, dimana komponen B adalah komponen yang labih
kuat teretensi. Nilai α dinyatakan sebagai rasio relatif dari kedua komponen
yang terpartisi atau terdistribusi. Separation factor (α) merupakan fungsi dari
retensi relatif dari masing-masing komponen terhadap fase diamnya
(Braithwait and Smith, 1999).
F. Perolehan Kembali
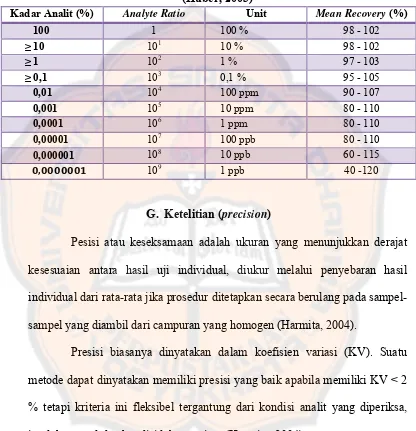
Perolehan kembali (recovery) dapat digunakan untuk menyatakan
ketepatan dari metode. Ketepatan adalah ukuran yang menunjukkan derajat
kedekatan hasil analisis dengan kadar analit yang sebenarnya. (Harmita,
yang diambil dari rentang uji (The British Pharmacopoeia Commission, 2011).
Kriteria penerimaan persen (%) perolehan kembali tertera pada tabel III:
Tabel III. Kriteria Penerimaan Akurasi pada Konsentrasi Analit yang Berbeda (Huber, 2003)
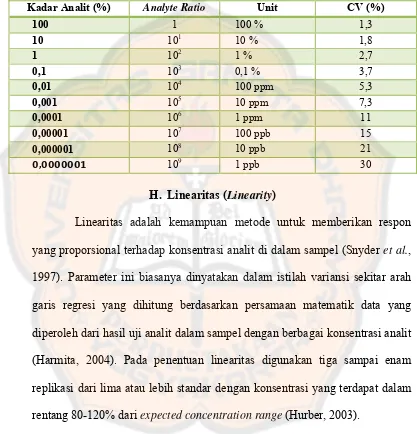
G. Ketelitian (precision)
Pesisi atau keseksamaan adalah ukuran yang menunjukkan derajat
kesesuaian antara hasil uji individual, diukur melalui penyebaran hasil
individual dari rata-rata jika prosedur ditetapkan secara berulang pada
sampel-sampel yang diambil dari campuran yang homogen (Harmita, 2004).
Presisi biasanya dinyatakan dalam koefisien variasi (KV). Suatu
metode dapat dinyatakan memiliki presisi yang baik apabila memiliki KV < 2
% tetapi kriteria ini fleksibel tergantung dari kondisi analit yang diperiksa,
jumlah sampel dan kondisi laboratorium (Harmita, 2004).
Ketelitian adalah derajat kesesuaian antara hasil uji individual yang
diperoleh dari pengambilan sampel yang berulang suatu sampel yang
homogen dengan menggunakan suatu metode analisis. Presisi umumnya
(RSD), seperti yang tertera pada tabel IV (United States Pharmacopeial
Convention, 2005):
Tabel IV. Kriteria Penerimaan Presisi pada Konsentrasi Analit yang Berbeda (Huber, 2003)
H. Linearitas (Linearity)
Linearitas adalah kemampuan metode untuk memberikan respon
yang proporsional terhadap konsentrasi analit di dalam sampel (Snyder et al.,
1997). Parameter ini biasanya dinyatakan dalam istilah variansi sekitar arah
garis regresi yang dihitung berdasarkan persamaan matematik data yang
diperoleh dari hasil uji analit dalam sampel dengan berbagai konsentrasi analit
(Harmita, 2004). Pada penentuan linearitas digunakan tiga sampai enam
replikasi dari lima atau lebih standar dengan konsentrasi yang terdapat dalam
rentang 80-120% dari expected concentration range (Hurber, 2003).
Penggambaran linearitas secara visual biasanya dilakukan dengan
memplotkan signal yang muncul sebagai fungsi dari konsentrasi analit.
bantuanmetodestatistik,misalnyadenganperhitungangarisregresi(TheBritish
Pharmacopoeia Commission, 2011).
Koefisien korelasi, y-intercept, dan kemiringan garis regresi (slope)
harus dihitung. Sebagai tambahan, plot data harus digambarkan. Analisis
penyimpangan titik data aktual dari garis regresi juga dapat membantu untuk
mengevaluasi linearitas (The British Pharmacopoeia Commission, 2011).
Korelasi tidak membutuhkan variabel bebas. Dengan korelasi, dua
atau lebih variable dapat dibandingkan dan ditentukan apakah memiliki
hubungan, serta dapat diukur kekuatan dari hubungan tersebut. Korelasi hanya
menggambarkan hubungan kekuatan antara 2 variabel x dan y. Koefisien
korelasi (r) merupakan indeks matematika yang mendifinisikan dengan tepat
ukuran kekuatan dari hubungan tersebut. Secara umum, y merupakan nilai
variabel tergantung yang di plotkan pada aksis vertical grafik, disebut ordinat
dan x merupakan nilai variabel bebas yang diplotkan pada aksis horisontal
grafik, disebut absis (De Muth, 1999).
Tabel V. Hubungan dan Arah Koefisien Korelasi
Koefisien Korelasi Korelasi
+ 0,1 Perfect Positive Correlation
0,0 No Correlation
- 0,1 Perfect Negative Correlation
Apabila terdapat perfect correlation (nilai koefisien korelasi +1,0
atau -1,0), maka semua titik data akan terdapat dalam suatu garis lurus. Makin
besar interval perubahan y pada interval tetap x, maka makin curam
variabel (nilai koefisien korelasi mendekati 1), titik-titik data akan berada di
dekat garis. Semakin nilai koefisien korelasi mendekati 0, deviasi titik data
akan semakin jauh dari garis (De Muth, 1999).
Tabel VI. Kekuatan Hubungan Berdasarkan Nilai Koefisien Korelasi
Koefisien Korelasi
Kekuatan Hubungan
Menurut Guilford (1956) Menurut Roundtree (1981) < 0,20 Sedikit, hampir tidak ada hubungan Sangat lemah, dapat diabaikan 0,20 – 0,40 Rendah, definite but small Lemah, rendah
0,40 – 0,70 Cukup, subtansial Moderate, cukup 0,70 – 0,90 Tinggi, marked Kuat, tinggi, marked
> 0,90 Sangat tinggi, Sangat kuat, sangat tinggi
Regresi liner merupakan suatu metode statistik untuk mengevaluasi
bagaimana pengaruh satu atau lebih variabel bebas (predictor) pada satu
continuous dependent variable (respon) melalui suatu hubungan linear.
Regresi linier melibatkan suatu garis lurus atau fungsi linier. Garis ini
merupakan estimasi dari data sampel. Analisis dengan regresi linier dilakukan
dengan menggambarkan garis yang tepat diantara titik-titik data. Dari sini
kemudian akan diketahui kemiringan garis dan nilai dari y-interceptnya yang
kemudian dapat digunakan untuk perhitungan, dirumuskan dengan y=Bx+A.
Dimana y adalah variabel tergantung, B adalah nilai slope (kemiringan) garis,
x adalah variabel bebas dan A adalah y-intercept (De Muth, 1999).
Hubungan antara titik-titik data dengan garis linier dari regresi linier
disebut dengan koefisien determinasi (r2). Koefisien determinasi dapat
didefinisikan sebagai kedekatan tiap titik data pada garis linier. Semakin dekat
titik-titik data dengan garis linier, semakin kuat hubungan korelasinya.
(titik-titik data berhimpit dengan garis). Faktanya, akar dari koefisien determinasi
adalah koefisien korelasi (r = √r2) (De Muth, 1999). Suatu metode memiliki
linearitas yang baik jika nilai koefisien determinasi (r2) ≥ 0,997 (Chan, 2004).
I. Rentang (range)
Rentang dalam suatu metode analisis merupakan interval antara
konsentrasi analit tertinggi dan konsentrasi analit terendah yang memenuhi
persyaratan linearitas, % perolehan kembali, dan presisi. Dalam suatu assay
biasanya menggunakan rentang tidak kurang dari 80%-120% dari konsentrasi
sampel dan untuk penetapan keseragaman kadar biasanya digunakan rentang
tidak kurang dari 70%-130% (The British Pharmacopoeia Commission, 2011).
J. Landasan Teori
Metode KLT densitometri dapat digunakan untuk memisahkan
beberapa campuran asam salisilat dan eugenol karena adanya perbedaan
interaksi dan partisi antara senyawa-senyawa tersebut dengan fase diam dan
fase gerak yang digunakan. Metode ini memberikan fleksibilitas yang tinggi
dalam pemilihan fase gerak.
Hasil optimasi metode pemisahan asam salisilat dan eugenol dengan
metode Kromatografi Lapis Tipis (KLT)-Densitometri dengan fase diam silika
gel60F254danfasegeraktoluen:etilasetat:metanol(65,2:2,4: 32,4) yang
sebelumnya telah dilakukan menghasilkan pemisahan peak yang optimum dan
benar-benar terpisah akan memudahkan pengukuran kuantitatif dari respon yang
dihasilkan tetapi hasil optimasi ini tidaklah cukup menjamin metode ini baik
bila diaplikasikan pada penetapan kadar. Oleh karena itu perlu dilakukan uji
kemampuan pemisahan pada metode ini.
Parameter uji kemampuan pemisahan didasarkan antara lain pada
selektivitas, ulangan standart, presisi,dan linearitas. Dalam hal ini, selektivitas
akan dianalisis berdasarkan perbandingan nilai Rf kedua campuran, yang
ditunjukkan dengan nilai α > 1 dan nilai resolusi > 1,5, linearitas dianalisis
berdasarkan koefisien determinasi (r2) ≥ 0,997, untuk asam salisilat perolehan
kembali dianalisis berdasarkan mean % recovery antara 98 - 102% dan presisi
dianalisis berdasarkan CV (Coefficient of Variation) ≤ 1,8%, sedangkan untuk
eugenol ulangan standart dianalisis berdasarkan mean % recovery antara
97-103% dan presisi dianalisis berdasarkan CV ≤ 2,7%.
K. Hipotesis
Berdasarkan landasan teori di atas, dapat disusun hipotesis bahwa
metode analisis Kromatografi Lapis Tipis (KLT)–Densitometri yang
dikembangkan untuk analisis pemisahan asam salisilat dan eugenol dengan
fase diam silikagel60F254danfasegeraktoluen: etilasetat:metanol(65,2:
2,4:32,4) memiliki kemampuan pemisahan yang baik berdasarkan parameter
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian non-eksperimental dengan
rancangan penelitian deskriptif, karena dalam penelitian ini tidak dilakukakn
manipulasi terhadap subyek uji, penelitian hanya mendeskripsikan keadaan yang
ada.
B. Variabel Penelitian
1. Variabel bebas dalam penelitian ini adalah metode yang digunakan untuk
melakukan analisis yaitu sistem KLT yang telah dioptimasi, dengan fase diam
silikagel60F254danfasegeraktoluena:etilasetat:metanol(65,2:2,4:32,4).
2. Variabel tergantung dalam penelitian ini adalah parameter uji kemampuan
metode yaitu selektivitas, uji perolehan kembali, presisi, linearitas, dan
rentang.
3. Variabel pengacau terkendali dalam penelitian ini adalah
a. Pelarut, untuk mengatasinya digunakan pelarut pro analysis (p.a) yang
memiliki kemurnian tinggi.
b. Senyawa baku yang digunakan, untuk mengatasinya digunakan senyawa
baku yang memiliki Certificate of Analysis (CoA).
c. Paparan cahaya terkait dengan sifat eugenol yang sedikit fotosensitif,
untuk mengatasinya pada saat preparasi semua peralatan gelas yang akan
digunakan dilapisi dengan aluminium foil.
C. Definisi Operasional
1. Sistem KLT yang digunakan dalam penelitian adalah fase diam silika gel 60
F254 dan fase gerak toluena : etil asetat : metanol (65,2 : 2,4 : 32,4).
2. Kadar asam salisilat dan eugenol dinyatakan dalam part per million (ppm).
3. Parameter uji kemampuan metode yang digunakan yaitu selektivitas, uji
perolehan kembali, presisi, linearitas, dan rentang.
D. Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah asam slisilat for
synthesis (E. Merck, kemurnian 99,8%), eugenol for R&D (Sigma-Aldrich,
kemurnian 99%), metanol pro analysis (E. Merck), etanol pro analysis (E.
Merck), toluen pro analysis (E. Merck), etil asetat pro analysis (E. Merck), plat
KLT silika gel 60 F254 (E. Merck).
E. Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah seperangkat
komputer merek HP xw4600 Workstation s/n : SGH75203QM, p/n : RV724AV,
OS : GH544AV Linux, printer Canon BJC-255SSP Color bubble Jet Printer,
seperangkat alat densitometer (CAMAG TLC Scanner 3 CAT. No. 027.6485 SER.
170610), Syringe (CAMAG Linomat Syringe 695.0014), UV lamp cabinet
(CAMAG), perangkat lunak WinCats (V.1.4.4), chamber (DESAGA, Germany
dimensi 23x23x10 cm), Oven (Marius Instrumenten, postbus 7018-3502 Utrecht,
Hollantlaan 18-3526 Am utrech), mikropipet 100-1000 µL (Socorex ACURA
825), neraca analitik (Ohaus SN 8331120093; PAJ 1003; N13123;MC 173467;
max 1050 ct; readability 0,001 ct), dan seperangkat alat-alat gelas (Pyrex Iwaki
dan Herma).
F. Tata Cara Penelitian 1. Pembuatan Fase Gerak
Fasegerakyangdibuatadalahfasegerakyangtelahdidapatdarihasiloptimasi
pada penelitian sebelumnya yaitu toluena : etil aseat : metanol (65,2 : 2,4 :
32,4). Fase gerak ini dibuat sebanyak 25 mL menggunakan prinsip volume
portion dengan teknik doubling (Shimadzu corporation, 2012).
2. Penjenuhan Chamber
Chamber dimensi 23x23x10 cm diisi dengan fase gerak yang telah dibuat
kemudiandijenuhkan denganbantuankertassaring(Munson, 1984). Kondisi
chamber dikatakan telah terjenuhkan apabila kertas saring telah terbasahi
seluruhnyaolehfasegerak.
3. Pengaktifan Fase diam
Fase diam berupa plat KLT silika gel 60 F254 dipanaskan dalam oven selama
4. Pembuatan larutan baku asam salisilat
a. Pembuatan larutan stok asam salisilat 20000 ppm
Serbuk baku asam salisilat ditimbang sebanyak 0,2004 gram kemudian
dimasukkan ke dalam labu takar 10 mL. Serbuk tersebut kemudian
dilarutkan dengan etanol p.a hingga tanda dan digojog agar homogen.
b. Pembuatan seri larutan baku asam salisilat 816; 884, 952, 1020; 1088, 1156 dan 1224 ppm
Larutan stok asam salisilat 20000 ppm diambil sebanyak 204, 221, 238,
255, 272, 289 dan 306 μL menggunakan mikropipet kemudian
masing-masing dimasukkan ke dalam labu takar 5 mL. Larutan tersebut
diencerkan dengan etanol p.a hingga tanda dan digojog agar homogen.
Seri larutan baku dibuat sebanyak tiga replikasi.
5. Pembuatan larutan baku eugenol
a. Pembuatan larutan stok eugenol 20000 ppm
Larutan baku eugenol diambil sebanyak 189 μL menggunakan mikropipet
kemudian dimasukkan ke dalam labu takar 10 mL dan dilarutkan dengan
etanol p.a hingga tanda dan digojog agar homogen.
b. Pembuatan seri larutan baku eugenol 560, 600, 640, 680, 720, 760 dan 800 ppm
Larutan stok eugenol 20000 ppm diambil sebanyak 140, 150, 160, 170,
180, 190 dan 200 μL menggunakan mikropipet kemudian masing-masing
dengan etanol p.a hingga tanda dan digojog agar homogen. Seri larutan
baku dibuat sebanyak tiga replikasi.
6. Pembuatan larutan baku tunggal asam salisilat dan eugenol a. Pembuatan larutan baku tunggal asam salisilat
Larutan stok baku asam salisilat diambil sebanyak 204, 255 dan 306 μL
menggunakan mikropipet kemudian dimasukkan ke dalam labu takar 5
mL. Larutan tersebut diencerkan dengan etanol p.a hingga tanda dan
digojog agar homogen. Seri larutan baku dibuat sebanyak lima replikasi.
b. Pembuatan larutan baku tunggal eugenol
Larutan stok baku eugenol diambil sebanyak 140, 170 dan 200 μL
menggunakanmikropipetkemudiandimasukkankedalamlabutakar5mL.
Larutan tersebut diencerkan dengan etanol p.a hingga tanda dan digojog
agarhomogen.Larutanbakutungaldibuatsebanyaklimareplikasi.
7. Pembuatan larutan baku campuran asam salisilat dan eugenol
Larutan stok baku asam salisilat diambil sebanyak 204, 255 dan 306 μL dan
larutan stok baku eugenol diambil sebanyak 140, 170 dan 200 μL
menggunakan mikropipet kemudian dimasukkan ke dalam labu takar 5 mL.
Campuran larutan lalu diencerkan dengan etanol p.a hingga tanda dan digojog
agar homogen. Pembuatan larutan campuran baku eugenol dan asam salisilat
dilakukan sebanyak lima kali replikasi.
8. Penetapan panjang gelombang pengamatan
Larutan baku campuran ditotolkan dengan volume penotolan 2 µL pada plat
kering dikembangkan dalam bejana kromatografi yang telah dijenuhi dengan
fase gerak dengan jarak pengembangan 15 cm. Setelah mencapai jarak rambat
15 cm, plat dikeluarkan dari bejana dan dikeringkan. Plat hasil
pengembangan secepatnya discanning pada panjang gelombang pengamatan
250-330 nm menggunakan alat TLC scanner.
9. Penetapan kurva baku asam salisilat dan eugenol dan pengamatan nilai Retardation Factor (Rf) asam salisilat dan eugenol
Seri larutan baku masing-masing ditotolkan dengan volume penotolan 2 µL
pada plat KLT dengan fase diam silika gel 60 F254 yang telah diaktifkan dan
setelah kering dikembangkan dalam bejana kromatografi yang telah dijenuhi
dengan fase gerak dengan jarak pengembangan 15 cm. Setelah mencapai
jarak rambat 15 cm, plat dikeluarkan dari bejana dan dikeringkan. Plat hasil
pengembangan diukur Area Under Curve (AUC) dan tinggi puncaknya
dengan alat TLC scanner pada panjang gelombang pengamatan (288 nm).
Replikasi dilakukan sebanyak tiga kali. Selanjutnya dihitung persamaan
kurva baku, nilai koefisien determinasi dan nilai koefisien korelasinya,
kemudian diplotkan dalam grafik kadar vs AUC.
10. Penentuan selektivitas, uji perolehan kembali, presisi, linearitas, dan rentang
Larutan baku tunggal dan campuran masing-masing ditotolkan dengan
volume penotolan 2 µL pada plat KLT dengan fase diam silika gel 60 F254
yang telah diaktifkan dan setelah kering dikembangkan dalam bejana
pengembangan 15 cm. Setelah mencapai jarak rambat 15 cm, plat dikeluarkan
dari bejana dan dikeringkan. Plat hasil pengembangan diukur Area Under
Curve (AUC) dan tinggi puncaknya dengan alat TLC scanner pada panjang
gelombang pengamatan (288 nm). Replikasi dilakukan sebanyak lima kali.
Kadar terukur dihitung dengan menggunakan persamaan kurva baku yang
telah didapat.
G. Analisis Hasil
Uji Kemampuan yang dilakukan dalam pemisahan asam salisilat dan
eugenolpadapenelitianinidapatditentukanberdasarkanparameterberikut:
1. Selektivitas
Selektivitas ditentukan dengan membandingkan nilai Rf dari kedua senyawa.
Selektivitas ditunjukkan dengan nilai α dan resolusi (R) > 1,5 (Gandjar dan
Rohman, 2007). Resolusi dapat dihitung dengan cara berikut:
α = (2) (Braithwait and Smith, 1999).
Resolusi = R R
W W (3) (Watson, 1999).
2. Linearitas
Linearitas dilihat dari harga r2 (koefisien determinasi) hasil pengukuran seri
baku eugenol dan asam salisilat. Suatu metode memiliki linearitas yang baik
jika nilai koefisien determinasi (r2
) ≥ 0,997 (Chan, 2004). 3. Uji Perolehan Kembali
Uji Perolehan kembali metode analisis dinyatakan dengan recovery yang dapat
x 100%
Recovery = (4) (Harmita, 2004).
4. Presisi
Presisi metode analisis dinyatakan dengan KV (koefisien variasi) yang dapat
dihitung dengan cara berikut :
KV = S
H x 100% (5) (Harmita, 2004).
5. Rentang
Rentang merupakan interval konsentrasi analit yang memenuhi persyaratan
BAB IV
HASIL DAN PEMBAHASAN
A. Sistem Kromatografi
Sistem kromatogafi yang digunakan dalam penelitian ini adalah sistem
kromatografi adsorbs-partisi fase normal, di mana fase gerak yang digunakan
memiliki sifat yang lebih non polar dibandingkan dengan sifat fase diam yang
digunakan.
Fase gerak yang digunakan dalam penelitian ini menggunakan fase gerak
yang didapat dari penelitan oleh Ediningtyas (2012), yaitu toluena : etil asetat :
metanol (65,2 : 2,4 : 32,4). Campuran fase gerak ini bersifat lebih non polar
apabila dibandingkan dengan fase diamnya, memiliki nilai indeks polaritas
sebesar 3,3228 dan merupakan fase gerak yang dapat memisahkan asam salisilat
dan eugenol secara optimal. Campuran fase gerak ini disebut non-polar karena
memiliki nilai indeks polaritas yang rendah, dimana semakin rendah nilai indeks
polaritas suatu fase gerak, maka semakin non-polar sifatnya.
Prinsip pembuatan dan pencampuran ketiga larutan fase gerak tersebut
menggunakan prinsip volume portion dengan teknik doubling dimulai dari fase
gerak yang memiliki volum terkecil lalu ditambah larutan fase gerak selanjutnya
sebanyak volum di dalam wadah, begitu seterusnya. Prinsip volume portion
dengan teknik doubling dilakukan untuk mempermudah pencampuran ketiga jenis
larutan fase gerak yang digunakan sehingga ketiganya dapat tercampur dengan
sempurna.
Fase diam yang digunakan adalah silika gel 60 F254. Fase diam yang
berupa silika ini menempel pada plat aluminium, memiliki ukuran pori sebesar 60
μm dan dapat berfluoresensi pada panjang gelombang 254 nm. Plat silika ini
memiliki sifat yang lebih polar dibandingkan dengan fase gerak yang digunakan.
Fase gerak dan fase diam yang digunakan dalam penelitian akan
memiliki afinitas tertentu terhadap senyawa analit. Afinitas ini timbul akibat
terbentuknya interaksi antara senyawa analit dengan fase diam dan fase gerak
yang digunakan. Interaksi yang terbentuk akan berbeda antara senyawa analit
dengan fase diam dan fase gerak yang digunakan. Adanya perbedaan afinitas
antara senyawa analit dengan fase gerak dan fase diam inilah yang dapat
mengakibatkan perbedaan migrasi solut atau bercak yang ditotolkan sehingga
mampu memisahkan komponen senyawa dalam bercak. Interaksi antara senyawa
analit dengan fase diam dan fase gerak yang digunakan akan dibahas pada
sub-bahasan E.
B. Pembuatan Larutan Baku Asam Salisilat dan Eugenol
Larutan baku yang dibuat adalah larutan baku tunggal asam salisilat dan
larutan baku tunggal eugenol, serta larutan baku campuran asam salisilat-eugenol.
Larutan stok baku asam salisilat dan eugenol dibuat dengan melarutkan baku
asam salisilat dan baku eugenol dengan menggunakan etanol sehingga didapatkan
konsentrasi 20.000 ppm untuk masing masing larutan stok baku asam salisilat dan
eugenol.Etanol dipilih sebagai pelarut karena baik asam salisilat maupun eugenol
Penelitian ini menggunakan perbandingan kadar asam salisilat dan
eugenol 1,5:1 dimana peak yang dihasilkan memiliki bentuk yang cukup simetris
dan runcing dengan nilai Rf antara 0,2-0,8 (Ediningtyas, 2012), dimana nilai Rf
asam salisilat adalah 0,25 dan nilai Rf eugenol adalah 0,66. Selain itu, dengan
perbandingan kadar 1,5:1 didapatkan respon detektor terhadap sinyal yang cukup
besar sehingga signal yang terbentuk tidak terganggu oleh noise yang dihasilkan
oleh alat sehingga tidak mengganggu pengamatan kadar analit.
Dari larutan stok baku, kemudian dibuat seri konsentrasi larutan baku.
Seri konsentrasi larutan baku dibuat dalam tujuh tingkat konsentrasi dengan
perbandingan konsentrasi asam salisilat-eugenol 1,5:1. Seri konsentrasi larutan
baku yang digunakan berturut-turut untuk asam salisilat adalah 816 ppm, 884
ppm, 952 ppm, 1020 ppm, 1088 ppm, 1156 ppm dan 1224 ppm, sedangkan untuk
eugenol adalah 560 ppm, 600 ppm, 640 ppm, 680 ppm, 720 ppm, 760 ppm dan
800 ppm. Ketujuh seri konsentrasi larutan baku ini digunakan sebagai kurva baku.
Larutan baku tunggal baik asam salisilat maupun eugenol dibuat dalam
tiga tingkat kosentrasi, yaitu konsentrasi rendah (low) dengan konsentrasi asam
salisilat 816 ppm dan konsentrasi eugenol 560 ppm, konsentrasi tengah (medium)
dengan konsentrasi asam salisilat 1020 ppm dan konsentrasi eugenol 680 ppm,
dan konsentrasi tinggi (high) dengan konsentrasi asam salisilat 1224 ppm dan
konsentrasi eugenol 800 ppm. Ketiga tingkat konsentrasi ini dibuat dalam lima
replikasi dan akan digunakan untuk data presisi dan akurasi larutan baku tunggal.
Larutan baku campuran asam salisilat-eugenol dibuat dalam tiga tingkat
ppm - eugenol 560 ppm, konsentrasi tengah (medium) dengan konsentrasi asam
salisilat 1020 ppm - eugenol 680 ppm, dan konsentrasi tinggi (high) dengan
konsentrasi asam salisilat 1224 ppm - eugenol 800 ppm. Ketiga tingkat
konsentrasi ini dibuat dalam lima replikasi dan akan digunakan untuk data presisi
dan akurasi larutan baku campuran.
C. Penetapan Panjang Gelombang Pengamatan
Penentuan panjang gelombang pengamatan bertujuan untuk mengetahui
panjang gelombang yang menghasilkan serapan optimal terhadap asam salisilat
dan eugenol ketika dilakukan pemindaian secara bersamaan sehingga sensitivitas
pengukuran kadar meningkat dan meminimalkan kesalahan pengukuran. Larutan
yang digunakan untuk menentukan panjang gelombang pengamatan adalah
larutan baku campuran asam salisilat-eugenol konsentrasi rendah (816:560),
tengah (1020:680) dan tinggi (1224:800). Ketiga tingkat konsentrasi larutan baku
campuran yang telah dibuat ditotolkan dalam satu lempeng plat silika sehingga
mendapatkan kondisi kromatografi yang sama. Penggunaan konsentrasi rendah,
tengah, dan tinggi diasumsikan dapat mewakili seri konsentrasi larutan baku yang
digunakan.
Panjang gelombang maksimum adalah panjang gelombang ketika analit
memberikan respon yang maksimum, adanya perubahan konsentrasi zat sedikit
saja akan memberikan pengaruh yang cukup signifikan pada respon, sehingga
kepekaan analisis maksimal dan dapat meminimalkan kesalahan sewaktu
adalah 300 nm (Ahlneck and Alderborn, 1988), sedangkan panjang gelombang
maksimum eugenol adalah 282 nm (Clarke, 1971), oleh karena itu pembacaan
serapan dilakukan pada rentang panjang gelombang 250-330 nm dengan
menggunakan detektor UV pada densitometer, karena rentang panjang gelombang
maksimum asam salisilat dan eugenol terletak pada rentang panjang gelombang
daerah UV (200-400 nm).
Detektor pada densitometer adalah lampu D2 yang menghasilkan sinar
UV. Suatu senyawa dapat diukur serapannya pada daerah UV jika memiliki gugus
kromofor yang dapat menyerap radiasi sinar pada daerah UV. Pada gugus
kromofor terdapat ikatan rangkap terkonjugasi yang mengandung elektron π yang
jika diberi radiasi elektromagnetik mudah tereksitasi ke tingkat energi lebih
tinggi.
Asam salisilat dan eugenol memiliki gugus kromofor sehingga dapat
menyerap radiasi sinar pada daerah UV. Berikut gambar struktur kromofor dan
auksokrom pada asam salisilat dan eugenol.
b
a
= auksokrom = kromofor
Gambar 5. Kromofor dan auksokrom dari asam salisilat (a) dan eugenol (b)
Asam salisilat memiliki dua gugus auksokrom yang terikat langsung
dengan kromofor, adanya gugus auksokrom ini dapat meningkatkan intensitas
(pergeseran batokromik). Eugenol memiliki kromofor yang lebih pendek
dibandingkan dengan asam salisilat dan memiliki dua gugus auksokrom yang
berikatan langsung pada kromofor sehingga panjang gelombang yang dimilikinya
lebih rendah daripada asam salisilat.
Hasil pengukuran panjang gelombang pengamatan menunjukkan panjang
gelombang maksimum asam salisilat pada 298 nm sedangkan eugenol pada 282
nm.Hasiltersebutbiladibandingkandenganpanjanggelombangteoritismengalami
sedikit perbedaan sekitar 2 nm. Pergeseran ini masih memenuhi ketentuan yang
ditetapkan dalam Farmakope Indonesia edisi IV (1995) penyimpangan hingga
batas ± 2 nm dari panjang gelombang maksimum teoritis masih dapat diterima.
Untuk analisis multikomponen cara yang biasa digunakan dalam
menentukan panjang gelombang pengamatan adalah dengan menumpang
tindihkan spektra masing-masing senyawa dan memilih panjang gelombang
perpotongan kedua spektra (λ overlapping). Panjang gelombang pengamatan
untuk asam salisilat dan eugenol adalah sebesar 288 nm. Selanjutnya, panjang
gelombang tersebutlah yang digunakan selama penelitian untuk mendapatkan
serapan yang optimal dari asam salisilat dan eugenol ketika dilakukan pemindaian
λ
λmmaakkssaassaammssaalliissllllaatt229988nnmm
λ
λmmaakksseeuuggeennooll228822nnmm
Gambar 6. Spektra baku campuran asam salisilat-eugenol (816:560) ppm
D. Analisis Kualitatif
Retardation factor (Rf) suatu senyawa pada kondisi tertentu bersifat
spesifik sehingga dapat digunakan untuk analisis kualitatif. Pengamatan nilai Rf
dalam penelitian ini berfungsi sebagai parameter analisis kualitatif untuk
mengetahui sesuai tidaknya jenis analit yang didapat dari sampel dengan senyawa
target yang akan diteliti, dengan cara membandingkan nilai Rf sampel dengan
nilai Rf baku. Larutan yang digunakan adalah larutan baku tunggal asam salisilat
1020 ppm dan larutan baku tunggal eugenol 680 ppm serta larutan sampel yang
masing-masing ditotolkan sebanyak 2 μL.
Pada sistem KLT-densitometri ini asam salisilat baku memiliki Rf 0,25
lebih rendah dibandingkan dengan eugenol baku yang memiliki Rf 0,66, seperti
λ
pada gambar 7 dan 8. Nilai Rf asam salisilat larutan baku campuran adalah 0,25
dan nilai Rf eugenol larutan baku campuran adalah 0,66, seperti pada gambar 9.
Gambar 7. Densitogram asam salisilat baku 1020 ppm Rf 0,25
Gambar 8. Densitogram eugenol baku 680 ppm Rf 0,66
Gambar 9. Densitogram asam salisilat-eugenol baku (1020:680) ppm Rf asam salisilat 0,25 Rf eugenol 0,66
Dari gambar 9 dapat dipastikan bahwa asam salisilat dan eugenol
terpisah sempurna dengan nilai resolusi (R) sekitar 5,125 dan nilai α sekitar 5,825.