OPTIMASI METODE KROMATOGRAFI LAPIS TIPIS (KLT) – DENSITOMETRI PADA PENETAPAN KADAR METIL SALISILAT DAN
EUGENOL DALAM SEDIAAN KRIM ‘X’
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Vinsensia Vica Dwi Ediningtyas NIM: 088114176
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
i
OPTIMASI METODE KROMATOGRAFI LAPIS TIPIS (KLT) – DENSITOMETRI PADA PENETAPAN KADAR METIL SALISILAT DAN
EUGENOL DALAM SEDIAAN KRIM ‘X’
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Vinsensia Vica Dwi Ediningtyas NIM: 088114176
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
iv
HALAMAN PERSEMBAHAN
Bingkisan kecil yang tak berpita ini aku persembahkan untuk
Bapak, Ibu, Mas Yosef
Orang-orang yang menyayangiku, dan
vii PRAKATA
Puji syukur penulis panjatkan kepada Tuhan yang Maha Pengasih atas segala berkat dan pendampingan-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Optimasi Metode Kromatografi Lapit Tipis (KLT) -Densitometri Pada Penetapan Kadar Metil Salisilat dan Eugenol Dalam Sediaan Krim ‘X’” dengan baik dan lancar. Skripsi ini disusun untuk memenuhi salah satu persyaratan memperoleh gelar Sarjana Strata Satu Program Studi Farmasi (S. Farm).
Penulis menyadari bahwa selama menuntut ilmu S1 di Fakultas Farmasi dan penyusunan skripsi ini mendapat banyak bantuan, saran, bimbingan, nasihat, kritikan, dan dukungan dari berbagai pihak sehingga segalanya dapat berjalan dengan baik dan lancar. Pada kesempatan ini, penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada :
1. Bapak Ipang Djunarko, M.Sc., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma
2. Bapak Jeffry Julianus, M.Si., selaku Dosen Pembimbing Akademik dan dosen pembimbing skripsi yang telah memberikan masukan, meluangkan waktu untuk diskusi dan selalu mendampingi selama masa studi.
3. Ibu Christine Patramurti, M.Si., Apt. yang telah meluangkan waktu untuk diskusi, masukan, dan kritikan selama pembuatan skripsi ini.
viii
5. Ibu Prof. Dr. Sri Noegrohati, Apt., selaku dosen penguji yang telah memberikan masukan dan saran selama penyusunan skripsi.
6. Mas Bimo, Pak Parlan, dan Pak Kethul yang telah banyak membantu dan selalu memberikan canda tawa selama penulis melakukan penelitian. 7. Segenap dosen dan karyawan atas ilmu dan pengalaman yang berharga
sehingga berguna dalam proses penyusunan skripsi dan kehidupan sehari-hari.
8. Seluruh staff laboratorium, keamanan, dan kebersihan di Fakultas Farmasi Universitas Sanata Dharma.
9. Bapak YB. Sukardi dan Ibu Margareta Sriwidiyati, orang tua tercinta yang telah bekerja keras demi pendidikan penulis dan selalu mendoakan serta memberi semangat sehingga penulis dapat menyelesaikan pendidikan di Fakultas Farmasi Universitas Sanata Dharma.
10.Mas Yosef Wismo Eko Subroto, kakak yang paling cuek tapi baik hati dan perhatian yang selalu memberikan dukungan dan masukan.
11.Vincentkaun Sanggraha M.T. yang selalu ada untuk penulis, memberikan perhatian, selalu mendukung dan menyemangati penulis, terutama ketika rasa jenuh melanda.
12.Rosita Secoadi dan Dhimas Bayu Kinasih, sahabat sekaligus rekan skripsi yang sangat hebat dan luar biasa.
ix
14.Kelompok AntiStress : Velly, Novie, Heppy, Ike, Yuni, Paul, Adi, Elisa, dan Sasa atas kebersamaan, kebahagiaan, semangat, dan masukan yang selalu diberikan.
15.Dian, Anna, Pius, Agnes dan teman-teman kelompok praktikum C atas dukungan, kebersamaan, dan keceriaan selama ini.
16.Teman-teman angkatan 2008, khususnya kelas C dan FST B, karena bersama kalian penulis belajar, bertumbuh, dan berkembang menjadi lebih baik.
17.Intan, Tyas, Ines, Monik, Evy, Etha, Lina, dan penghuni kost Palem lainnya, yang selalu menemani, memberikan keceriaan dan mendengarkan segala keluh kesah penulis.
18.Kelompok KKN 29 : Ratih, Aldo, Intan, Fajar, Steffi, Gita, Valent, dan Helga atas keceriaan dan kebersamaan dari KKN hingga saat ini.
19.Dhom-dhom, Yenny, Asdo, dan David untuk persahabatan dan kebersamaan yang penulis rasakan dari SMA hingga sekarang.
20.Semua pihak yang tidak dapat penulis sebutkan satu persatu atas segala bantuan dan semangatnya selama masa studi dan penyusunan skripsi ini.
Penulis menyadari bahwa masih banyak kekurangan dalam skripsi ini sehingga segala kritik dan saran dari semua pihak demi perkembangan selanjutnya sangat penulis harapkan. Akhir kata semoga skripsi ini dapat bermanfaat bagi semua pihak, terutama dalam dunia Kefarmasian.
x DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ... vi
xii
F. Tata Cara Penelitian ... 22
1. Pembuatan Fase Gerak ... 22
2. Pembuatan Larutan Baku Asam Salisilat ... 23
3. Pembuatan Larutan Baku Eugenol ... 23
4. Pembuatan Larutan Baku Campuran Asam Salisilat dan Eugenol ... 24
5. Penentuan Panjang Gelombang Maksimum Asam Salisilat dan Eugenol ... 24
6. Preparasi Sampel ... 25
7. Optimasi Metode KLT-Densitometri ... 25
G. Analisis Hasil ... 27
BAB IV HASIL PEMBAHASAN... 29
A. Pembuatan Larutan Baku ... 29
B. Preparasi Sampel ... 30
C. Jenis Dan Komposisi Fase Gerak ... 31
D. Penentuan Panjang Gelombang Pengamatan Eugenol dan Asam Salisilat ... 32
E. Optimasi Pemisahan Asam Salisilat dan Eugenol dengan Metode KLT-Densitometri ... 34
BAB V KESIMPULAN DAN SARAN... 47
A. Kesimpulan ... 47
B. Saran ... 47
xiii
xiv
DAFTAR TABEL
Tabel I. Indeks polaritas pelarut ... 10 Tabel II. Parameter aplikasi penotolan yang direkomendasikan... 11 Tabel III. Komposisi dan jenis fase gerak ... 23 Tabel IV. Nilai Rf dan As pada asam salisilat dan eugenol dengan
metode KLT-densitometri pada berbagai jenis dan komposisi fase gerak ... 37 Tabel V. Nilai Rf, As, dan Rs pada larutan baku campuran asam salisilat
dan eugenol dengan tiga seri konsentrasi dan tiga kali replikasi menggunakan fase gerak toluena p.a : etil asetat p.a : metanol
p.a (65,2 : 2,4 : 32,4) ... 44 Tabel VI. Nilai % KV dari Rf asam salisilat dan eugenol, As puncak
asam salisilat dan eugenol, serta Rs pada tiga konsentrasi seri larutan baku campuran dengan tiga kali replikasi ... 44 Tabel VII. Nilai Rf, As, dan Rs pada larutan sampel dari krim Counterpain®
tiga kali replikasi menggunakan fase gerak toluena p.a : etil asetat p.a: metanol p.a (65,2 ; 2,4 : 32,4) ... 45 Tabel VIII. Nilai % KV (Rf, As, dan Rs) larutan sampel dari krim
xv
Gambar 6. Perhitungan nilai Rs pada puncak yang berdekatan ... 14
Gambar 7. Ilustrasi pengaruh lintasan ganda (multiple-path effect), longitudinal or axiak diffusion, dan transfer massa ... 15
Gambar 8. Puncak asimetri ... 16
Gambar 9. Perhitungan Nilai As 10 % dari bagian bawah puncak ... 16
Gambar 10. Perhitungan Nilai As ... 27
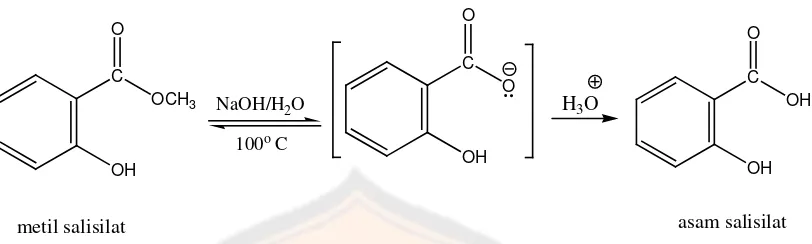
Gambar 11. Reaksi metil salisilat menjadi asam salisilat dan reaksi eugenol menjadi bentuk garam dan molekul utuh ... 30
Gambar 12. Auksokrom dan kromofor ... 32
Gambar 13. Spektra pada konsentrasi sedang ... 33
Gambar 14. Interaksi hidrogen dengan fase diam ... 35
Gambar 15. Bagian polar dan non polar ... 35
Gambar 16. Densitogram hasil elusi menggunakan fase gerak toluena p.a : etil asetat p.a : metanol p.a (65,2 : 2,4 : 32,4) ... 40
xvi
Gambar 18. Densitogram hasil elusi larutan baku campuran asam salisilat
xvii
DAFTAR LAMPIRAN
Lampiran 1. Certificate of Analysis Baku Asam Salisilat for Synthesis ... 53
Lampiran 2. Certificate of Analysis Baku Eugenol for R & D ... 54
Lampiran 3. Data Penimbangan dan Pengambilan Baku dan Sampel serta Contoh Perhitungan Konsentrasi Baku ... 54
Lampiran 4. Contoh Perhitungan Indeks Polaritas Fase Gerak ... 56
Lampiran 5. Sistem KLT-Densitometri yang digunakan ... 57
Lampiran 6. Hasil Scanning Penentuan Panjang Gelombang Maksimum Asam Salisilat dan Eugenol ... 58
Lampiran 7. Densitogram Hasil Elusi Menggunakan Fase Gerak Metanol p.a. : Air : Asam Asetat Glasial p.a. (40 : 60 : 1) ... 59
Lampiran 8. Densitogram Hasil Elusi Menggunakan Fase Gerak Toluena p.a. : Etil Asetat p.a. (95 : 5) ... 60
Lampiran 9. Densitogram Hasil Elusi Menggunakan Fase Gerak Toluena p.a. : Etil Asetat p.a. : Metanol p.a. (25 : 50 : 25) ... 61
Lampiran 10. Densitogram Hasil Elusi Menggunakan Fase Gerak Toluena p.a. : Etil Asetat p.a. : Metanol p.a. (30 : 45 : 25) ... 62
Lampiran 11. Densitogram Hasil Elusi Menggunakan Fase Gerak Toluena p.a. : Etil Asetat p.a. : Metanol p.a. (30 : 50 : 20) ... 63
Lampiran 12. Densitogram Reprodusibilitas Baku ... 64
Lampiran 13. Densitogram Reprodusibilitas Sampel ... 68
xviii
Lampiran 15. Contoh Perhitungan Nilai Rs (Resolusi) Puncak Asam Salisilat dan Eugenol ... 72 Lampiran 16. Contoh Perhitungan Nilai Asymmetry Factor (Aa) Puncak
xix INTISARI
Penelitian ini bertujuan untuk mendapatkan kondisi yang optimal dari pemisahan metil salisilat yang dihidrolisis terlebih dahulu menjadi asam salisilat dan eugenol menggunakan metode KLT-densitometri. Metode KLT-densitometri pada penelitian ini menggunakan fase diam silika gel F254 dengan beberapa komposisi dan jenis fase gerak, yaitu metanol p.a : air : asam asetat glasial p.a (40:60:1); toluena p.a : etil asetat p.a (95:5); toluena p.a : etil asetat p.a : metanol p.a (25:50:25); toluena p.a : etil asetat p.a : metanol p.a (30:45:25); toluena p.a : etil asetat p.a : metanol p.a (30:50:20) dan toluena p.a : etil asetat p.a : metanol p.a (65,2 : 2,4 : 32,4) serta panjang gelombang 288 nm untuk mendeteksi dengan densitometer. Parameter pemisahan yang baik, yaitu nilai asymmetry factor (As) 0,95–1,1; nilai resolusi (Rs) > 1,5; nilai Rf 0,2-0,8 dan %KV nilai Rf ≤ 2.
Kondisi optimal metode KLT-densitometri diperoleh dengan menggunakan fase gerak toluena p.a : etil asetat p.a (65,2:2,4:32,4) menghasilkan nilai Rf 0,23 untuk asam salisilat dan 0,61 untuk eugenol, nilai As kedua puncak 1, nilai Rs kedua puncak antara 4,35 – 5,20 serta %KV Rf 1,361 untuk asam salisilat dan 0,514 untuk eugenol.
xx ABSTRACT
There are many creams to relieve pain with main component is methyl salicylate that is an ester and phenolic group can acts as analgesic. Besides that, there are eugenol that also a phenol group and can act as analgesic. The purpose of this study to obtain the optimal conditions of separation of methyl salicylate and eugenol using TLC-densitometry method, in which methyl salicylate first hydrolyzed into salicylic acid. Therefore, the standard used is salicylic acid and eugenol.
TLC-densitometric method in this study using silica gel F254 stationary
phase with a mobile phase composition and type, is methanol p.a : water : glacial acetic acid p.a (40 : 60 : 1); toluene p.a : ethyl acetate p.a (95 : 5); toluene p.a : ethyl acetate p.a : methanol p.a (25 : 50 : 25); toluene p.a : ethyl acetate p.a : methanol p.a (30 : 45 : 25); toluene p.a : ethyl acetate p.a : methanol p.a (30 : 50 : 20); and toluene p.a : ethyl acetate p.a : methanol p.a (65,2 : 2,4 : 32,4) and 288 nm wavelength to detect with the densitometer. Good separation parameters is the asymmetry factor (As) between 0,95 to 1,1; the resolution (Rs) > 1,5; Rf values
between 0,2-0,8 and % CV of Rf value of salicylic acid and eugenol ≤ 2.
Optimal conditions of the TLC-densitometric method for analyzing methyl salicylate and eugenol in ‘X’ cream obtained in this study using silica gel F254 stationary phase and mobile phase toluene p.a : ethyl acetate p.a : methanol
p.a (65,2 : 2,4 : 32,4). Optimal conditions resulted in the value of Rf 0,23 for
salicylic acid and 0,61 for eugenol, the peak value of As 1, the value of Rs two
peaks between 4,35 to 5,20 and % CV Rf 1,361 for salicylic acid and 0,514 for
eugenol .
1 BAB I PENGANTAR
A. Latar Belakang
Aktivitas yang tinggi dari masyarakat menyebabkan timbulnya rasa nyeri pada otot dan sendi. Nyeri merupakan rasa sensorik tidak nyaman yang berhubungan dengan kerusakan atau adanya potensi untuk terjadinya kerusakan jaringan (Ibrahim, 2011).
Banyak obat yang beredar untuk mengurangi rasa nyeri yang biasanya berupa krim dan digunakan secara topikal. Krim topikal ini biasanya digunakan
untuk pengobatan awal kaku di leher, tegang, dan sakit otot. Salah satu krim yang banyak digunakan oleh masyarakat memiliki komponen utama metil salisilat sebesar 102 mg/g yang merupakan golongan fenol. Selain metil salisilat, terdapat golongan fenol yang juga bertindak sebagai analgesik yaitu eugenol sebanyak 13,2 mg/g.
peranan penting sebagai bahan dasar pembuatan produk dalam industri farmasi. Selain itu, eugenol dapat diproses menjadi isoeugenol, eugenol asetat, dan vanilin yang dapat digunakan sebagai bahan baku dalam industri parfum dan makanan (Harnani, 2010).
salisilat yang terhidrolisis (Gearin and Grabowski, 1969) sehingga kadar asam salisilat hasil hidrolisis akan ekivalen dengan kadar metil salisilat di dalam sampel krim.
Sebelum dilakukan penetapan kadar, perlu dilakukan optimasi untuk memperoleh sistem yang optimal. Optimasi yang akan dilakukan adalah optimasi jenis dan komposisi fase gerak yang akan digunakan dalam sistem KLT-densitometri supaya dapat dihasilkan pemisahan yang baik dari campuran eugenol dan asam salisilat (hasil hidrolisis metil salisilat pada sampel) dengan nilai asymmetry factor (As) pada rentang 0,95 – 1,1, nilai Rs >1,5, nilai Rf antara 0,2 –
0,8, dan %KV ≤ 2.
1. Permasalahan
Bagaimanakah kondisi optimal dalam pemisahan metil salisilat dan eugenol pada krim ‘X’ menggunakan metode KLT-densitometri?
2. Keaslian Penelitian
Sejauh yang peneliti ketahui, optimasi metode KLT-densitometri untuk penetapan kadar metil salisilat dan eugenol dalam sediaan krim ‘X’ belum pernah dilakukan. Penelitian terdahulu terkait penelitian yaitu Densitometric Determination of Betamethasone Dipropionate and Salicylic Acid in Lotions, and
Validation of the Method oleh Wulandari dan Indrayanto (2000) menggunakan
fase gerak etanol : toluena : kloroform : asam asetat glasial (6 : 2 : 14 : 0,5) dan Quantitive HPTLC Analysis of the Eugenol Content Leaf Powder and a Capsule
Penelitian lain menggunakan metode spektrofotometri yaitu Determination of Benzoic Acid and Salicylic Acid in Commercial Benzoic and Salicylic Acid
Ointments by Spectrophotometric Method oleh Ahmad and Vaid (2009).
3. Manfaat penelitian
a. Manfaat praktis. Penelitian ini dapat memberikan informasi mengenai sistem yang optimal untuk validasi dan penetapan kadar campuran metil salisilat dan eugenol dalam sediaan krim ‘X’.
b. Manfaat metodologis. Penelitian ini dapat dijadikan salah satu acuan untuk melakukan validasi metode dan penetapan kadar metil salisilat dan eugenol dalam sediaan krim ‘X’.
B. Tujuan Penelitian
5 BAB II
PENELAAHAN PUSTAKA
A. Krim
Krim adalah sediaan setengah padat berupa emulsi yang mengandung bahan obat terlarut dan terdiri dari tidak lebih dari 60% air (Syamsuni, 2006). Sediaan krim diaplikasikan pada kulit dan mukus membran untuk tujuan melindungi, terapi, atau mencegah penyakit(The Department of Health, 2010b).
Krim diformulasi sebagai emulsi minyak dalam air atau air dalam minyak. Saat ini krim lebih diarahkan untuk produk minyak dalam air atau dispersi mikrokristal asam-asam lemak atau alkohol berantai panjang dalam air yang dapat dicuci dengan tujuan estetika dan untuk penggunaan kosmetika (Departemen Kesehatan Republik Indonesia, 1995). Stabilitas krim akan rusak apabila terjadi perubahan suhu dan komposisi. Pengenceran krim dilakukan bila sesuai dengan pengenceran yang cocok dan dilakukan secara aseptis. Penggunaan krim yang telah diencerkan harus dalam waktu satu bulan (Syamsuni, 2006).
B. Metil salisilat
Metil salisilat terdiri dari tidak kurang 99,0% b/b dan tidak lebih dari 100,5 % b/b metil 2-hidroksibenzoat, tidak berwarna atau kuning terang, sangat larut dalam air, larut dalam alkohol, minyak lemak dan minyak esensial (The
Department of Health, 2010a). Nilai dalam etanol sekitar 570 pada λmaks 238 nm dan 280 pada λmaks 306 nm (Clarke, 1971). Metil salisilat memiliki titik didih 221oC, nilai log (koefisien partisi oktanol-air) 2,55 (Rhodia, 2011), water solubility 7400 mg/L pada suhu 30oC, dan konstanta Henry 9,3 x 10-7 atmm3/ mol (Toxnet, 1994)
Metil salisilat merupakan komponen utama minyak wintergreen, yang merupakan minyak dengan harum alami. Metil salisilat dapat diperoleh dari destilasi daun Gaultheria procumbens Lime atau dari kulit kayu Betula lenta. Biasanya metil salisilat digunakan sebagai analgesik, counterirritant¸ pestisida dan parfum (Environmental Protection Agency, 2005).
C
Gambar 2. Pembentukan asam salisilat (Newton, 2011)
Asam salisilat sukar larut dalam air dan mudah larut dalam alkohol (The Department of Health, 2010a), memiliki titik didih 211o C, tekanan uap 3,19
Gambar 3. Struktur asam salisilat
C. Eugenol
Nama lain dari eugenol adalah 2-metoksi-4(prop-2-enil)fenol. Eugenol memiliki kelarutan dalam alkohol (70% v/v), asam asetat glasial dengan alkohol, minyak lemak dan metilklorida. Akan tetapi, tidak dapat larut dalam air dan gliserol. Eugenol tidak berwarna atau berwarna kuning pucat, berbentuk cairan, menjadi gelap apabila terpapar oleh cahaya dan berbau daun yang kuat (The Department of Health, 2010c). Eugenol memiliki titik didih 248oC, nilai 2,7, tekanan uap 1 mmHg pada suhu 78,4 oC (TCI America, 2008), konstanta Henry 2 x 10-6 atm m3/mol pada suhu 25 oC, dan water solubility 0,0398 mol/L (National
Toxicology Program, 2012) Nilai eugenol dalam etanol sebesar 406 dengan λmaks 231,5 nm dan 193 pada λmaks 282 nm serta dalam 0,1 N N aOH sebesar 552
pada λmaks 246 nm dan 262 pada λmaks 296 nm (Clarke, 1971).
Eugenol merupakan komponen utama dari minyak cengkeh yaitu sebesar 70-80% yang bersifat sebagai anestetik lokal, karminatif, stimulan, antiseptik, antipasmodik, analgesik, antiemetik dan penambah aroma. Oleh sebab itu, eugenol dapat digunakan dalam pembuatan sabun, detergen, pasta gigi, parfum dan produk farmasi. Penggunaan eugenol dalam produk farmasi di antaranya balsam untuk mengurangi rasa nyeri, obat sakit gigi, dan bahan campuran untuk menambal gigi (Nurdjannah, 2004).
D. Kromatografi Lapis Tipis 1. Tinjauan Umum
kromatografi, di mana pemisahan dapat dilihat dari bercak-bercak yang ditimbulkan (Braithwaite and Smith, 1999). Dalam pelaksanaannya, KLT lebih murah, lebih mudah, dan peralatannya lebih sederhana dibandingkan dengan kromatografi kolom. Keuntungan lainnya adalah sebagai berikut :
a. KLT banyak digunakan untuk tujuan analisis.
b. Pemisahan analit dapat diidentifikasi dengan menggunakan pereaksi warna, fluoresensi, atau radiasi menggunakan sinar UV.
c. Elusi dapat dilakukan dengan cara menaik, menurun atau elusi 2 dimensi.
d. Analit yang ditentukan merupakan bercak yang tidak bergerak sehingga ketepatan penentuan kadar akan lebih baik (Gandjar dan Rohman , 2007).
2. Fase diam
3. Fase gerak
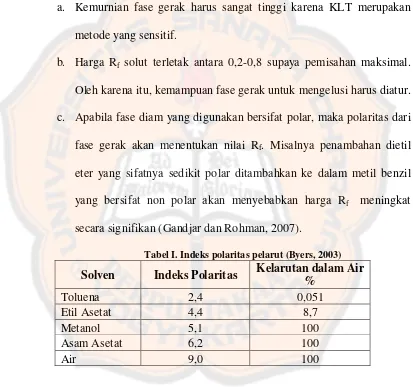
Fase gerak dalam KLT dapat menggunakan pustaka atau dengan mencoba-coba. Fase gerak yang paling sederhana jika menggunakan 2 pelarut organik karena daya elusi dapat diatur sehingga pemisahan akan optimal. Beberapa hal yang perlu diperhatikan dalam memilih fase gerak :
a. Kemurnian fase gerak harus sangat tinggi karena KLT merupakan metode yang sensitif.
b. Harga Rf solut terletak antara 0,2-0,8 supaya pemisahan maksimal. Oleh karena itu, kemampuan fase gerak untuk mengelusi harus diatur. c. Apabila fase diam yang digunakan bersifat polar, maka polaritas dari fase gerak akan menentukan nilai Rf. Misalnya penambahan dietil eter yang sifatnya sedikit polar ditambahkan ke dalam metil benzil yang bersifat non polar akan menyebabkan harga Rf meningkat secara signifikan (Gandjar dan Rohman, 2007).
Tabel I. Indeks polaritas pelarut (Byers, 2003)
akan ditotolkan lebih dari 15µL karena dapat menyebabkan terjadinya pelebaran bercak dan puncak ganda (Adamovics, 1997).
Tabel II. Parameter aplikasi penotolan yang direkomendasikan (Adamovics, 1997)
Tujuan Diameter Bercak (mm)
Konsentrasi Sampel
(%) Jumlah Sampel (µg) Densitometer 2 mm untuk volume
sampel 0,5 µL 0,02-0,2
0,1-1(plat KLT-KT) 1-10 (konvensional) Identifikasi 3 mm untuk volume
sampel 1 µL 0,1-1 1-20
Uji kemurnian 4 mm untuk volume
sampel 2 µL 5 100
Reprodusibilitas aplikasi penotolan secara manual dapat diperoleh apabila sampel yang ditotolkan paling sedikit 0,5 µL. Jika volume yang akan ditotolkan lebih dari 2-10 µL maka penotolan harus dilakukan secara bertahap dengan dilakukan pengeringan antar totolan (Adamovics, 1997).
Gambar 5. Automatic TLC sampler (Sherma, 2002)
5. Pengembangan
pengembangan secara menaik (ascending) dan secara menurun (descending). Namun, cara yang paling popular adalah cara pengembangan secara menaik (Gandjar dan Rohman, 2007).
6. Deteksi
Pada umumnya bercak pada KLT merupakan bercak yang tidak berwarna sehingga untuk mendeteksinya dapat dilakukan secara fisika, kimia, dan biologi. Secara fisika yang biasa digunakan adalah dengan flouresensi di bawah sinar ultraviolet yang akan membuat bercak terlihat jelas. Namun, jika senyawa tidak dapat berfluoresensi, fase diam perlu diberi indikator supaya dapat berfluoresensi sehingga bercak akan kelihatan hitam (Gandjar dan Rohman, 2007).
Deteksi bercak juga dapat menggunakan cara kimia yaitu dengan cara : a. Menyemprot plat dengan reagen yang akan bereaksi dengan analit
sehingga bercak yang muncul akan berwarna.
b. Plat dilihat di bawah lampu UV dengan panjang gelombang 254 atau 366 nm untuk menampakkan solut sebagai bercak yang gelap.
c. Plat disemprot dengan asam sulfat pekat atau asam nitrat pekat dan dipanaskan supaya analit organik teroksidasi sehingga akan muncul bercak coklat hingga kehitaman.
d. Plat dipaparkan dengan uap iodium pada chamber tertutup.
7. Penilaian Kromatogram
Pada KLT hasil yang diperoleh diterangkan dengan nilai Rf (retardation factor) yang merupakan parameter fundamental karena menggambarkan posisi
bercak pada kromatogram (Lepri and Cincinelli, 2002).
(1)
Beberapa variabel dapat mempengaruhi nilai Rf , di antaranya komposisi pelarut, suhu, ukuran chamber, dan lapisan sorbent (Braithwaite and Smith, 1999). Nilai Rf memiliki nilai maksimum adalah 1 yang diperoleh ketika perbandingan antara distribusi (D) dan faktor retensi (k’) sama dengan nol yang berarti solut dan fase gerak memiliki kecepatan migrasi yang sama. Sedangkan, nilai minimum Rf adalah 0 yang berarti solut berada pada titik penotolan atau dengan kata lain tertahan pada fase diam (Gandjar dan Rohman, 2007). Dalam analisis kuantitaif dengan metode KLT, nilai Rf berada antara 0,2 dan 0,8 (Prus and Kowalska, 2003).
Resolusi (Rs) menggambarkan pemisahan antar puncak yang berdekatan. Puncak yang overlapping memiliki nilai resolusi yang kecil. Pemisahan antar puncak yang berdekatan apabila memiliki nilai Rs > 1,5. Cara perhitungan nilai Rs sebagai berikut :
(2)
Gambar 6. Perhitungan nilai Rs pada puncakyang berdekatan (Snyder, Kirkland, and
Glaich, 2010)
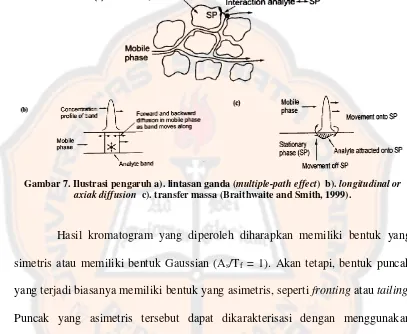
Selama pemisahan krmatografi, kromatogram akan memiliki bentuk yang simetris atau dikenal dengan bentuk Gaussian. Namun, terkadang akan terjadi pelebaran puncak karena solut-solut akan bermigrasi ke fase diam sehingga akan membentuk puncak yang asimetri. Prinsip yang mendasari bentuk dan pelebaran puncak sebagai berikut :
a. Proses pemindahan solut dari fase gerak ke fase diam (sorpsi) dan sebaliknya (desorpsi) yang terjadi terus menerus dapat menyebabkan pelebaran puncak.
b. Pengaruh lintasan ganda (multiple-path effect) yang menyebabkan solut memiliki perjalanan yang sedikit berbeda dalam melewati fase diam sehingga puncak melebar secara simetris.
c. Solut akan berdifusi di dalam fase gerak dengan arah yang sama dan berlawanan dengan aliran fase gerak (longitudinal or axiak diffusion) sehingga akan terjadi pelebaran puncak secara simetris.
terikat sedikit pada fase diam dibanding pada fase gerak akan menghasilkan puncak yang asimetris (Gandjar dan Rohman, 2007).
Gambar 7. Ilustrasi pengaruh a). lintasan ganda (multiple-path effect) b). longitudinal or axiak diffusion c). transfer massa (Braithwaite and Smith, 1999).
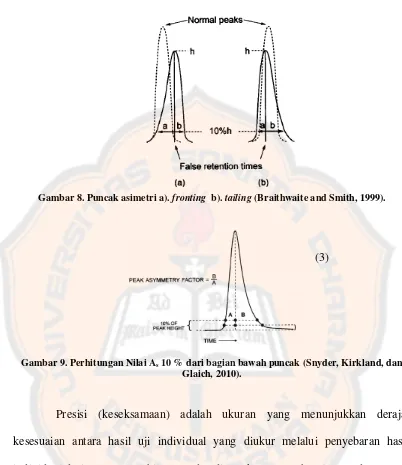
Gambar 8. Puncak asimetri a). fronting b). tailing (Braithwaite and Smith, 1999).
Gambar 9. Perhitungan Nilai As 10 % dari bagian bawah puncak (Snyder, Kirkland, dan
Glaich, 2010).
Presisi (keseksamaan) adalah ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual yang diukur melalui penyebaran hasil individual dari rata-rata apabila prosedur diterapkan secara berulang pada sampel-sampel yang diambil dari campuran yang homogen. Kriteria presisi diperoleh apabila metode memliki simpangan baku relatif atau koefisien variasi ≤ 2 % (Harmita, 2004). Simpangan baku relatif atau koefisien variansi (KV) adalah sebagai berikut :
E. Densitometri
Densitometri merupakan kuantifikasi secara langsung pada KLT dengan tujuan mendapatkan akurasi, preparasi dan sensitivitas yang optimal (Cimpan, 2004). Adanya interaksi radiasi elektromagnetik dengan bercak yang ada pada KLT adalah dasar dari densitometri (Gandjar dan Rohman, 2007).
Densitometer memiliki kemampuan untuk mengukur jarak migrasi dengan akurat dan memeriksa spektra UV-Vis pada bercak secara in situ (Cimpan, 2004). Densitometer mengukur perbedaan absorbansi atau sinyal fluoresensi antara bercak dan plat dan pengukuran sinyaldari seri standar hingga sampel yang diidentifikasi. Densitometer dengan komputer modern bisa menghasilkan kurva kalibrasi yang menguhubungkan antara absorbansi atau fluoresensi dengan besar atau konsentrasi standar dan menetapkan kadar yang tidak diketahui dengan interplasi otomatis dari kurva. Pada densitometer terdapat 2 lampu, yaitu tungsten atau lampu halogen yang digunakan untuk membaca panjang gelombang antara 400-800 nm (absorpsi visibel) dan lampu deuterium untuk membaca panjang gelombang antara 190-450 (absorpsi ultraviolet) (Sherma, 2002).
F. Analisis Kuantitatif
Penyiapan sampel dan proses kromatografi dalam analisis kuantitatif harus dalam keadaan stabil, sehingga beberapa syarat yang harus dipenuhi :
b. Standar yang digunakan harus telah diketahui dan memiliki kemurnian yang tinggi.
c. Prosedur kalibrasi harus digunakan (Gandjar dan Rohman, 2007).
Kuantifikasi pada kromatografi planar, seperti KLT dan kromatografi kertas dapat dilakukan dengan dua cara, yaitu :
a. Metode in situ, yaitu mengukur bercak pada plat dengan menggunakan densitometer yang akan menghasilkan kromatogram.
b. Mengkerok bercak senyawa yang akan dianalisis pada plat dan dimasukkan ke dalam tabung. Setelah itu, ditambahkan pelarut yang dapat melarutkan senyawa tersebut dan dilakukan sentrifugasi. Supernatan yang terbentuk diambil dan dianalisis dengan teknik kuantitatif, seperti spektrometri ultraviolet, visibel atau fluoresensi atau dengan kromatografi gas atau cair (Jeffery et al., 1989).
G. Landasan Teori
Sediaan krim ‘X’ dengan komponen utama metil salisilat yang merupakan golongan fenol banyak digunakan oleh masyarakat untuk mengatasi nyeri otot. Selain metil salisilat, terdapat pula komponen lain yang termasuk golongan fenol yaitu eugenol dan juga bertindak sebagai analgesik.
untuk memecah matriks krim ‘X’. Metil salisilat merupakan komponen utama minyak wintergreen sedangkan eugenol merupakan komponen utama dalam minyak cengkeh.
20
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian yang berjudul “ Optimasi Metode Kromatografi Lapis Tipis
(KLT) – Densitometri Pada Penetapan Kadar Campuran Metil Salisilat dan
a. Kemurnian pelarut yang digunakan. Penelitian menggunakan pelarut
b. Kemurnian bahan baku yang digunakan. Penelitian menggunakan
bahan baku asam salisilat for synthesis dengan kemurnian 99,8% dan eugenol for
R & D dengan kemurnian 99% yang dibuktikan dengan adanya Certificate of
Analysis.
c. Paparan cahaya akan mempengaruhi stabilitas eugenol dan asam
salisilat sehingga saat preparasi ditutup dengan aluminium foil.
C. Definisi Operasional
1. Metil salisilat dan eugenol merupakan senyawa yang terdapat dalam sediaan
krim ‘X’.
2. Sistem Kromatografi Lapis Tipis (KLT) yang digunakan adalah seperangkat
alat KLT dan densitometri dengan fase diam silika gel60 F254 dan fase gerak
metanol p.a : air : asam asetat glasial p.a (40 : 60 : 1); toluena p.a : etil asetat
p.a (95 : 5); toluena p.a : etil asetat p.a : metanol p.a (25 : 50 : 25); toluena
p.a : etil asetat p.a : metanol p.a (30 : 45 : 25); toluena p.a : etil asetat p.a :
metanol p.a (30 : 50 : 20) dan toluena p.a : etil asetat p.a : metanol p.a (65,2 :
2,4 : 32,4).
3. Optimasi dilakukan dengan mengubah-ubah jenis dan komposisi fase gerak.
4. Parameter pemisahaan yang optimal dengan metode KLT dilihat dari bentuk
D. Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian adalah baku asam salisilat
for synthesis (E. Merck), baku eugenol for R&D (Aldrich), etanol pro analysis (E.
Merck), toluena pro analysis (E. Merck), etil asetat pro analysis (E. Merck),
metanol pro analysis (E. Merck), asam asetat glasial pro analysis (E. Merck),
NaOH pro analysis (E. Merck), HCl pro analysis (E. Merck), aquadest, metanol
teknis (Alfa Kimia), kloroform teknis (Bratachem), dan plat KLT silika gel 60
F254 (E. Merck).
E. Alat Penelitian
Seperangkat alat densitometer (CAMAG TLC Scanner 3 CAT. No.
0277.6485 SER. No. 160602), autosampler (CAMAG Linomat 5 CAT. No.
027.7808. SER. No. 170610), neraca kasar, neraca analitik (Scaltec SBC 22 max
60/210 g; min 0,001 g; d=0,01/0,1 mg; e=1 mg), seperangkat komputer merk Dell
B6RDZ1S Connexant System RD01-D850 A03-0382 JP France S.A.S, printer HP
Deskjet D2566 HP-024-000 625 730, seperangkat alat gelas (Pyrex), indikator
PH, termometer, chamber, oven (POSTBUS 7018-3502 KA Utrecht), dan
mikropipet 100 – 1000 µL(Socorex ACURA 825)
F. Tata Cara Penelitian
1. Pembuatan Fase Gerak
Fase gerak dibuat dalam labu takar 25 mL kemudian digojog homogen
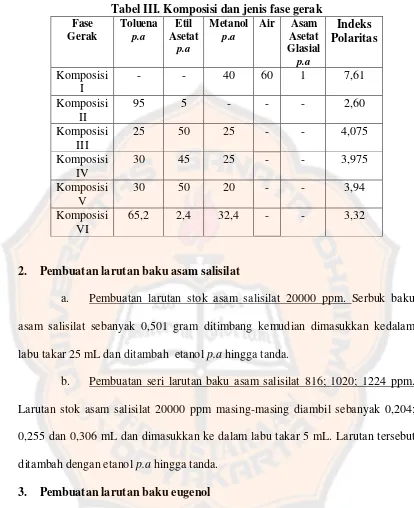
Tabel III. Komposisi dan jenis fase gerak
2. Pembuatan larutan baku asam salisilat
a. Pembuatan larutan stok asam salisilat 20000 ppm. Serbuk baku
asam salisilat sebanyak 0,501 gram ditimbang kemudian dimasukkan kedalam
labu takar 25 mL dan ditambah etanol p.a hingga tanda.
b. Pembuatan seri larutan baku asam salisilat 816; 1020; 1224 ppm.
Larutan stok asam salisilat 20000 ppm masing-masing diambil sebanyak 0,204;
0,255 dan 0,306 mL dan dimasukkan ke dalam labu takar 5 mL. Larutan tersebut
ditambah dengan etanol p.a hingga tanda.
3. Pembuatan larutan baku eugenol
a. Pembuatan larutan stok eugenol 20000 ppm. Larutan baku eugenol
diambil sebanyak 0,473 mL dimasukkan kedalam labu takar 25 mL dan ditambah
dengan etanol p.a hingga tanda.
b. Pembuatan seri larutan baku eugenol 560; 680; 800 ppm. Larutan
mL dimasukkan ke dalam labu takar 5 mL dan ditambah dengan etanol p.a hingga
tanda.
4. Pembuatan larutan baku campuran asam salisilat dan eugenol
Larutan stok baku asam salisilat dan eugenol diambil masing-masing
sebanyak 0,204 mL dan 0,140 mL; 0,255 mL dan 0,170 serta 0,306 mL dan 0,200
mL dimasukkan ke dalam labu takar 5 mL. Campuran larutan lalu ditambah
dengan etanol p.a hingga tanda. Pembuatan larutan campuran baku eugenol dan
asam salisilat dilakukan sebanyak 3 kali replikasi.
5. Penentuan panjang gelombang maksimum asam salisilat dan eugenol
Larutan baku asam salisilat dengan konsentrasi 816; 1020 dan 1224 ppm
dan larutan baku eugenol dengan konsentrasi 560; 680 dan 800 ppm
masing-masing ditotolkan sebanyak 2 µL dengan menggunakan autosampler pada plat
silika gel 60 F254 dengan ukuran 8 x 20 cm. Plat yang telah ditotolkan lalu
dikeringkan dan dikembangkan dalam chamber kromatografi yang telah jenuh
dengan fase gerak toluena p.a : etil asetat p.a : metanol p.a perbandingan 65,2 :
2,4 : 32,4 dengan jarak pengembangan 15 cm. Setelah jarak pengembangan
tercapai, plat diambil dan dikeringkan. Plat lalu di scanning pada panjang
gelombang 250 – 330 nm dengan menggunakan TLC scanner. Data densitogram
yang diperoleh dari masing-masing zat dibandingkan dan ditentukan panjang
6. Preparasi Sampel
Preparasi sampel dilakukan dua kali yaitu untuk menganalisis eugenol dan
asam salisilat.
a. Larutan sampel untuk analisis eugenol. Sampel krim ‘X’
dikeluarkan dan dicampur homogen kemudian ditimbang lebih kurang 1 gram
dengan neraca analitik dan dimasukkan ke dalam labu alas bulat 100 mL
kemudian ditambah NaOH 6 M 25 mL. Campuran direfluks dengan menggunakan
mantel heater pada suhu antara 800C - 1000C selama 3 jam. Larutan yang
diperoleh disaring dengan menggunakan kertas saring dan ditambah HCL 6 M
hingga pH 2. Larutan diekstraksi dengan kloroform sebanyak 4 x @ 10 mL . Hasil
ekstraksi dikeringkan kemudian ekstrak yang sudah kering dilarutkan kembali
dengan 5 mL etanol p.a (Campuran A).
b. Larutan sampel untuk menganalisis asam salisilat. Campuran A
diambil sebanyak 0,7 mL dimasukkan ke dalam labu takar 10 mL, ditambah
etanol p.a hingga tanda (Campuran B).
7. Optimasi Metode KLT-Densitometri
a. Optimasi fase gerak dalam pemisahan asam salisilat dan eugenol.
Larutan baku asam salisilat dengan konsentrasi 816; 1020 dan 1224 ppm dan
larutan baku eugenol dengan konsentrasi 560; 680; dan 800 ppm masing-masing
sebanyak 2 µL ditotolkan pada plat silika gel 60 F254 ukuran 8 x 20 cm dengan
menggunakan autosampler. Plat yang telah ditotol dikeringkan dan dimasukkan
ke dalam chamber yang telah jenuh dengan fase gerak metanol p.a : air : asam
asetat p.a : metanol p.a (25 : 50 : 25); toluena p.a : etil asetat p.a : metanol p.a (30
: 45 : 25); toluena p.a : etil asetat p.a : metanol p.a (30 : 50 : 20) dan toluena p.a :
etil asetat p.a : metanol p.a (65,2 : 2,4 : 32,4) dengan jarak pengembangan 15 cm.
Setelah itu, plat dikeluarkan dan dikeringkan kemudian di scanning pada panjang
gelombang maksimum.
b. Reprodusibilitas resolusi sampel dari fase gerak hasil optimasi.
Seri larutan baku campuran asam salisilat dan eugenol dengan 3 tingkat
konsentrasi dan larutan sampel (campuran A dan campuran B) yang
masing-masing telah dipreparasi sebanyak tiga kali ditotolkan pada plat silika gel 60 F254
ukuran 17 x 20 cm dengan menggunakan autosampler. Plat yang telah ditotol
dikeringkan dan dimasukkan ke dalam chamber yang telah jenuh oleh fase gerak
hasil optimasi (point 7a) dengan jarak pengembangan 15 cm. Setelah itu, plat
dikeluarkan dan dikeringkan kemudian di scanning pada panjang gelombang
maksimum. Densitogram hasil pemisahan campuran baku asam salisilat dan
G. Analisis Hasil
Hasil optimasi metode untuk pemisahan metil salisilat dan eugenol dalam
krim ‘X’ ditentukan dengan melihat bentuk puncak(nilai As), nilai Rs, nilai Rf dan
%KV.
1. Bentuk peak yang baik adalah simetris yang diperoleh dengan menghitung
asymmetry factor (As) menggunakan cara sebagai berikut :
Gambar 10. Perhitungan Nilai As (Snyder, Kirkland, dan Glaich, 2010)
di mana : As = asymmetry factor
a = lebar sebelum puncak yang diukur pada ketinggian 10% dari bawah
b = lebar setelah puncak yang diukur pada ketinggian 10% dari bawah
2. Nilai resolusi diperoleh dengan cara sebagai berikut :
=
( ) (5)di mana : Rs = nilai Resolusi
t1 = jarak geometrik bagian tengah pada puncak 1 t2 = jarak geometrik bagian tengah pada puncak2 W1 = lebar puncak pada puncak 1
3. Nilai Rf diperoleh dengan cara sebagai berikut :
=
(6)4. Nilai %KV diperoleh dengan cara sebagai berikut :
=
100%
(7)29
BAB IV
HASIL PEMBAHASAN
A. Pembuatan Larutan Baku
Larutan baku tunggal dan campuran dibuat dari baku asam salisilat dan
eugenol dengan menggunakan pelarut etanol karena kedua analit tersebut larut di
dalam etanol. Larutan baku tunggal dibuat untuk memastikan bahwa analit yang
akan dianalisis berada dalam sampel dengan melihat kesamaan atau kedekatan
nilai Rf peak baku dengan sampel. Larutan baku campuran dibuat sebagai
simulasi keadaan analit yang berada dalam sediaan krim ‘X’.
Larutan baku masing-masing dibuat dalam tiga konsentrasi untuk
melihat kenaikan respon detektor yang dinyatakan dengan AUC (Area Under
Curve) apabila konsentrasi analit ditingkatkan. Seri konsentrasi yang dibuat yaitu
816 ppm, 1020 ppm, dan 1224 ppm untuk asam salisilat serta 560 ppm, 680 ppm,
dan 800 ppm untuk eugenol. Larutan baku juga dibuat sebanyak tiga kali
replikasi untuk melihat keterulangan respon detektor (AUC) dari masing-masing
analit. Perbandingan seri konsentrasi antara asam salisilat dengan eugenol
memiliki perbandingan 3 : 2. Seharusnya pembuatan larutan baku mengikuti
perbandingan asam salisilat dengan eugenol yang berada dalam larutan sampel
krim ‘X’ yaitu 7,4 : 1 namun pada saat orientasi,. eugenol tidak dapat dibaca
B. Preparasi Sampel
Sampel krim yang telah dicampur homogen ditimbang sebanyak 1 gram
sampel dilarutkan dengan 25 mL 6 N NaOH dan dipanaskan dengan refluks pada
suhu 800C - 1000C selama 3 jam untuk memecah matriks sampel dan
menghidrolisis metil salisilat menjadi Na salisilat. Selain itu, untuk mengubah
eugenol menjadi bentuk garamnya sehingga dapat larut di dalam air. Penggunaan
refluks untuk mempercepat reaksi dengan jalan pemanasan tanpa mengurangi
jumlah zat yang ada karena adanya kondensasi kembali pelarut dan hasil reaksi
yang menguap.
Langkah selanjutnya, hasil refluks disaring untuk memisahkan matriks
pada krim yang tidak larut. Setelah itu, dilakukan penambahan 6 N HCl hingga
pH 2 untuk membentuk Na salisilat menjadi asam salisilat dan mengembalikan
eugenol ke bentuk molekul utuh. Kemudian sampel diekstraksi dengan
menggunakan kloroform untuk memisahkan asam salisilat dan eugenol dari
komponen-komponen vanishing cream. Penggunaan kloroform karena asam
salisilat dan eugenol dapat larut di dalam kloroform.
O
Gambar 11. Reaksi yang terjadi pada preparasi sampel a.) metil salisilat menjadi asam salisilat b.) eugenol
A
Fraksi kloroform yang telah dikumpulkan kemudian diuapkan sehingga
yang tersisa tinggal asam salisilat dan eugenol. Asam salisilat dan eugenol
memiliki titik didih yang tinggi sehingga tidak akan ikut menguap bersama
kloroform. Setelah kloroform menguap, asam salisilat dan eugenol dilarutkan
dengan menggunakan etanol.
C. Jenis dan Komposisi Fase Gerak
Pemisahan asam salisilat dan eugenol dipengaruhi oleh jenis dan
komposisi fase gerak sehingga untuk mendapatkan pemisahan yang optimal, perlu
dilakukan optimasi jenis dan komposisi fase gerak. Selain itu, optimasi dilakukan
dalam metode KLT karena metode ini belum pernah dilakukan sebelumnya untuk
pemisahan eugenol dan asam salisilat.
Jenis dan komposisi fase gerak I campuran metanol p.a.: air : asam asetat
glasial p.a. (40 : 60 :1) merupakan fase gerak yang dapat digunakan untuk
mengelusi asam salisilat (The Department of Health, 2010a). Jenis dan komposisi
fase gerak II campuran toluena p.a.: etil asetat p.a. (95 : 5) merupakan fase gerak
yang dapat digunakan untuk mengelusi eugenol (The Department of Health,
2010c).
Jenis dan komposisi fase gerak III, IV, V, dan VI merupakan hasil
modifikasi untuk mendapatkan indeks polaritas yang sesuai dengan analit
sehingga bisa diperoleh pemisahan yang paling baik untuk asam salisilat dan
D. Penentuan Panjang Gelombang Pengamatan Eugenol dan Asam Salisilat
Penentuan panjang gelombang (λ) pengamatan asam salisilat dan eugenol
bertujuan untuk menentukan panjang gelombang yang optimal dalam mendeteksi
bercak masing-masing analit oleh densitometer. Penentuan panjang gelombang
maksimum dilakukan dengan mendeteksi bercak ketiga tingkat konsentrasi
masing-masing larutan baku asam salisilat dan eugenol yang telah dielusi dengan
fase gerak toluena p.a : etil asetat p.a : metanol p.a (65,2 : 2,4 : 32,4) pada λ 250 –
330 nm dengan menggunakan densitometer. Syarat senyawa yang dapat diukur
dengan panjang gelombang ultraviolet adalah adanya kromofor dan auksokrom.
OH
Gambar 12. Auksokrom dan kromofor pada a). asam salisilat b). eugenol ... = kromofor
= auksokrom
Dalam menentukan λ pengamatan asam salisilat dan eugenol dipengaruhi
oleh nilai yang menyatakan nilai serapan pada konsentrasi 1 g/100 mL
dengan tebal kuvet 1 cm. Berikut adalah profil spektra asam salisilat dan eugenol
pada konsentrasi sedang (680 ppm eugenol dan 1020 ppm asam salisilat) :
Gambar 13. Spektra asam salisilat (a) dan eugenol (b) pada konsentrasi sedang
Gambar 13 menunjukkan bahwa pada konsentrasi sedang asam salisilat
memliki panjang gelombang serapan maksimal (λmaks) sebesar 298 nm. Eugenol,
jika dilihat dari spektra yang diperoleh (gambar 13) memiliki λmaks sebesar 282
nm. λmaks ini sesuai dengan literatur yang mengatakan bahwa eugenol memiliki
serapan maksimal dalam etanol sebesar 282 nm (Clarke, 1971).
Panjang gelombang pengamatan ditentukan dengan melihat spektra hasil
perpotongan asam salisilat dan eugenol berdasarkan gambar 13, maka panjang
gelombang pengamatan yang digunakan adalah 288 nm dengan pertimbangan
bahwa pada panjang gelombang tersebut dapat membaca serapan kedua analit,
yaitu asam salisilat dan eugenol dalam satu kali deteksi.
B
282 nm
A 298 nm
E. Optimasi Pemisahan Asam Salisilat dan Eugenol dengan Metode
KLT-Densitometri
Optimasi pemisahan asam salisilat dan eugenol menggunakan
konsentrasi tengah, yaitu 1020 ppm untuk asam salisilat dan 680 ppm untuk
eugenol yang dianggap dapat mewakili seri konsentrasi rendah hingga tinggi. Fase
diam yang digunakan adalah silika gel F254 karena silika gel memiliki ukuran
partikel yang kecil dan seragam sehingga dapat dihasilkan resolusi serta
pemisahan yang efisien.
Permukaan silika gel terdiri atas gugus Si-O-Si dan gugus Si-OH
(silanol). Adanya gugus silanol dapat membentuk interaksi hidrogen dengan
analit. Selain dengan analit, gugus silanol juga dapat membentuk interaksi
hidrogen dengan air yang membuat silka gel terdeaktivasi sehingga sebelum
digunakan, silika gel perlu dipanaskan pada suhu 120oC selama 30 menit. Hal ini
dilakukan untuk mengaktivasi kembali permukaan silika gel sehingga gugus
silanol dapat berinteraksi dengan analit. F254 menunjukkan bahwa senyawa
fluoresense yang ditambahkan dalam plat memiliki panjang gelombang eksitasi
254 nm. Senyawa yang ditambahkan biasanya berupa seng silikat yang teraktivasi
O
Gambar 14. Interaksi hidrogen a). asam salisilat b). eugenol dengan fase diam --- = interaksi hidrogen
Pada gambar 14, dapat dilihat bahwa asam salisilat dan eugenol dapat
berinteraksi hidrogen dengan fase diam. Interaksi hidrogen antara asam salisilat
dengan fase diam lebih banyak dibandingkan interaksi antara eugenol dan asam
salisilat. Oleh karena banyaknya atom O pada asam salisilat yang dapat
membentuk interaksi hidrogen dengan fase diam, maka asam salisilat akan
tertahan lebih lama pada fase diam jika dibandingkan dengan eugenol.
HO
Komposisi fase gerak I berdasarkan pada British Pharmacopoeia 2011
yang digunakan untuk mengelusi asam salisilat dengan indeks polaritas 7,61.
Hasil pemisahan asam salisilat dan eugenol setelah dielusi dengan fase gerak ini
menunjukkan bahwa asam salisilat dapat terelusi dengan nilai Rf 0,88 dengan
peak yang simetris, namun eugenol tidak dapat terelusi dengan baik karena
eugenol masih tertahan pada fase diam. Komposisi fase gerak II berdasarkan pada
British Pharmacopoeia 2011 yang digunakan untuk mengelusi eugenol dengan
indeks polaritas 2,60. Hasil pemisahan asam salisilat dan eugenol setelah dielusi
menunjukkan bahwa eugenol dapat terelusi dengan baik karena memiliki nilai Rf
0,39 dengan peak yang simetris, namun asam salisilat tidak dapat terelusi dengan
baik dilihat dari nilai Rf yang hanya sebesar 0,02 atau dengan kata lain tertahan di
fase diam. Masih tertahannya asam salisilat pada fase diam dikarenakan kepolaran
yang kurang cocok dengan analit. Kedua komposisi ini digunakan untuk melihat
sejauh mana asam salisilat dan eugenol terelusi jika menggunakan fase gerak
masing-masing dan dapat digunakan untuk memodifikasi jenis dan komposisi fase
Hasil pemisahan asam salisilat dan eugenol menggunakan jenis dan
komposisi fase gerak yang dioptimasi dapat dilihat pada tabel berikut :
Tabel IV. Nilai Rf dan As pada asam salisilat dan eugenol dengan metode KLT-densitometri
pada berbagai jenis dan komposisi fase gerak
No Jenis dan Komposisi Asam asetat glasial p.a
Pemilihan jenis dan komposisi fase gerak berdasarkan nilai indeks
polaritasnya caranya dengan meningkatkan fase gerak berdasarkan kepolarannya.
Oleh karena itu ditambahkan metanol yang memiliki kepolaran (IP = 5,1) dan
eluent strength (0,7) yang lebih besar dari toluena dan etil asetat sehingga
diharapkan dapat menghasilkan pemisahan yang baik untuk campuran asam
salisilat dan eugenol.
Fase gerak yang ke III merupakan hasil modifikasi jenis dan komposisi
fase gerak dengan indeks polaritas 4,07. Hasil pemisahan asam salisilat
menggunakan jenis dan fase gerak ini menunjukkan bahwa asam salisilat dan
eugenol dapat terelusi dengan nilai Rf masing-masing 0,36 dan 0,89 dengan nilai
As 2,57 untuk asam salisilat dan 1 untuk eugenol. Hasil ini menunjukkan bahwa
fase gerak komposisi III bukan merupakan komposisi fase gerak yang optimal
sehingga masih perlu dilakukan modifikasi komposisi fase gerak supaya dapat
diperoleh pemisahan asam salisilat dan eugenol yang baik.
Hasil modifikasi komposisi fase gerak, yaitu fase gerak IV memiliki
indeks polaritas 3,975. Setelah dielusi, asam salisilat dan eugenol dapat memiliki
nilai Rf masing-masing 0,30 dan 0,74 dengan nilai As 1,71 untuk asam salisilat
dan 1 untuk eugenol. Hasil ini menunjukkan bahwa fase gerak komposisi IV
bukan merupakan komposisi fase gerak yang optimal sehingga masih perlu
dilakukan modifikasi komposisi fase gerak supaya dapat diperoleh pemisahan
asam salisilat dan eugenol yang baik.
Komposisi fase gerak V merupakan hasil modifikasi fase gerak
eugenol setelah dielusi dengan fase gerak ini menghasilkan nilai Rf
masing-masing 0,25 dan 0,73 dengan nilai As 1,5 untuk asam salisilat dan 1 untuk
eugenol. Hasil ini menunjukkan bahwa fase gerak komposisi V bukan merupakan
komposisi fase gerak yang optimal sehingga masih perlu dilakukan modifikasi
komposisi fase gerak supaya dapat diperoleh pemisahan asam salisilat dan
eugenol yang baik.
Pada komposisi III – V asam salisilat dan eugenol sudah dapat terelusi
dengan baik akan tetapi masih menghasilkan puncak yang asimetris sehingga
perlu dilakukan modifikasi dengan menurunkan indeks polaritas dari fase gerak
yang diharapkan dapat menghasilkan pemisahan asam salisilat dan eugenol yang
baik. Modifikasi komposisi fase gerak selanjutnya memiliki indeks polaritas 3,32.
Gambar 16 menunjukkan bahwa jenis dan komposisi fase gerak VI mampu
menghasilkan pemisahan yang optimal. Asam salisilat dan eugenol dapat terelusi
dengan baik karena memiliki Rf masing-masing sebesar 0,23 dan 0,61. Puncak
yang dihasilkan sempit dan simetris dengan As = 1 untuk puncak kedua analit.
Nilai resolusi untuk keduanya > 1,5. Nilai Rf , As, dan Rs yang dihasilkan telah
sesuai dengan syarat pemisahan yang optimal sehingga dapat dikatakan bahwa
Hasil pemisahan asam salisilat dan eugenol setelah dielusi dengan fase
gerak toluena p.a : etil asetat p.a : metanol p.a (62,5 : 2,4 : 32,4) sebagai berikut :
Gambar 16. Densitogram hasil elusi asam salisilat dan eugenol menggunakan fase gerak toluena p.a. : etil asetat p.a : metanol p.a (65,2 : 2,4 : 32,4)
(a). asam salisilat ; (b). eugenol ; (c). fase gerak
A
B
Interaksi antara asam salisilat dan eugenol dengan fase gerak toluene : etil asetat :
= interaksi van der Waals --- = interaksi hidrogen
A
Jika dilihat dari gambar 17, interaksi antara eugenol dengan fase gerak lebih
banyak dibandingkan interaksi antara asam salisilat dengan fase gerak sehingga
eugenol akan lebih mudah terbawa oleh fase gerak dan memiliki nilai Rf lebih
besar dibandingkan nilai Rf asam salisilat.
Nilai Rf eugenol yang lebih tinggi dibandingkan asam salisilat juga dapat
dilihat dari nilai log yang dimiliki antara asam salisilat dan eugenol, eugenol
memiliki nilai log lebih besar yaitu 2,7 sedangkan asam salisilat 2,26. Nilai
log ini menunjukkan bahwa eugenol akan lebih mudah larut dalam pelarut
organik (fase gerak) dibandingkan asam salisilat sehingga eugenol akan lebih
mudah terbawa oleh fase gerak. Bagian polar dari fase gerak akan berinteraksi
dengan bagian polar dari analit, sedangkan bagian non polar akan berinteraksi
dengan bagian non polar dari analit.
Hasil optimasi jenis dan komposisi fase gerak VI dipastikan dengan uji
reprodusibilitas. Pada uji reprodusibilitas ini menggunakan larutan baku campuran
asam salisilat dan eugenol dengan konsentrasi rendah, sedang, dan tinggi serta
larutan sampel sebanyak tiga kali replikasi. Penggunaan larutan sampel yang
berasal dari krim ‘X’ pada uji reprodusibilitas bertujuan untuk melihat jenis dan
komposisi fase gerak VI ini benar-benar dapat memisahkan asam salisilat dan
eugenol yang berada dalam sampel sehingga ketika digunakan pada tahapan
selanjutnya yaitu validasi dan penetapan kadar dapat memberikan hasil yang
Densitogram hasil elusi larutan baku campuran asam salisilat dan
eugenol menggunakan fase gerak toluena p.a : etil asetat p.a : metanol p.a (65,2 :
2,4 : 32,4) sebagai berikut :
Gambar 18. Densitogram hasil elusi larutan baku campuran asam salisilat dan eugenol a). asam salisilat seri menengah 1020 ppm ; b). eugenol seri menengah 680 ppm ; c). fase
gerak
Densitogram hasil elusi larutan sampel menggunakan fase gerak toluena
p.a : etil asetat p.a : metanol p.a (65,2 : 2,4 : 32,4) sebagai berikut :
Gambar 19. Densitogram hasil elusi larutan sampel a). asam salisilat; b). eugenol; c). fase gerak
A
B C
A
B
Berikut rangkuman hasil elusi dari baku campuran asam salisilat dan
eugenol :
Tabel V. Nilai Rf, As, dan Rs pada larutan baku campuran asam salisilat dan eugenol dengan
tiga seri konsentrasi dan tiga kali replikasi menggunakan fase gerak toluene : etil asetat : metanol (65,2 ; 2,4 : 32,4)
Replikasi Seri Analit Konsentrasi
(ppm) Rf As Rs
Tabel VI. Nilai % KV dari Rf asam salisilat dan eugenol pada tiga konsentrasi seri larutan
baku campuran dengan tiga kali replikasi
Analit %KV Rf
Asam Salisilat 1,361
Tabel V dan VI menggambarkan bahwa telah diperoleh pemisahan yang
optimal antara asam salisilat dan eugenol dengan menggunakan fase gerak toluena
p.a : etil asetat p.a : metanol p.a (65,2 : 2,4 : 32,4). Nilai Rf yang dihasilkan untuk
asam salisilat dan eugenol sudah berada pada rentang 0,2 – 0,8 (0,23 untuk asam
salisilat dan 0,61 untuk eugenol) dengan %KV 1,361 untuk asam salisilat dan
0,514 untuk eugenol. Puncak asam salisilat dan eugenol yang dihasilkan simetris
dengan nilai As 1. Selain itu antara puncak asam salisilat dan eugenol telah
terpisah dengan nilai Rs > 1,5. Puncak-puncak pengotor (gambar 18 C) yang
berasal dari fase gerak tidak mengganggu puncak analit karena puncak asam
salisilat dan eugenol terpisah dari puncak pengotor terdekat yang berasal dari fase
gerak yang ditunjukkan oleh nilai resolusi yang lebih dari 1,5.
Rangkuman hasil elusi tiga replikasi sampel asam salisilat dan eugenol
adalah sebagai berikut :
Tabel VIII. Nilai % KV dari Rf asam salisilat dan eugenol pada tiga konsentrasi seri larutan
baku campuran dengan tiga kali replikasi
Analit %KV Rf
Asam Salisilat 0
Pada tabel VII dan VIII menggambarkan bahwa komposisi dan jenis fase
gerak ketika diaplikasikan ke dalam sampel menghasilkan densitogram dengan Rf
antara 0,2 – 0,8. Bentuk puncak kedua analit simetris dengan nilai As 1 dan nilai
Rs sampel I dan III > 1,5. Nilai Rs pada sampel II tidak memenuhi syarat karena
puncak asam salisilat yang terlalu melebar. Nilai % KV untuk Rf telah memenuhi
persyaratan yaitu 0 untuk asam salisilat dan 0,777 untuk eugenol. Hal ini
menunjukkan bahwa fase gerak ini dapat memisahkan asam salisilat dan eugenol
47 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Metode KLT-densitometri dengan fase diam silika gel F254 dan fase gerak toluena p.a : etil asetat p.a : metanol p.a perbandingan 65,2 : 2,4 : 32,4 dapat menghasilkan pemisahan asam salisilat dan eugenol yang optimal dengan nilai Rf 0,23 untuk asam salisilat dan 0,61 untuk eugenol, nilai As kedua puncak 1, nilai Rs kedua puncak antara 4,35 – 5,20 serta nilai %KV Rr 1,361 untuk asam salisilat dan 0,514 untuk eugenol.
B. Saran
48
DAFTAR PUSTAKA
Adamovics, J.A., 1997, Chromatographic Analysis of Pharmaceuticals, 2nd edition, Marcel Dekker, Inc., New York, pp. 57-60
Ahmad, I., and Vaid F.HM., 2009, Determination of Benzoic Acid and Salicylic Acid in Commercial Benzoic and Salicylic Acids Ointments by Spectrophotometric Method, Pak. J. Pharm. Sci., vol. 22, 18-22
Ameen, O.M., and Olantuji, G.A., 2009, The Preparation of Methyl Benzoate and Methyl Salicylate on Silca Gel Column, African Journal of Pure and Applied Chemistry, vol. 3, 120-121
Braithwaite, A. and Smith, F.J., 1999, Chromatographic Methods, 5th ed., Kluwer Academic Publishers, Netherlands, pp. 29, 39, 44-46
Byers, 2003, Solvent Polarity and Miscibility, http://www.chemical-ecology.net/java/solvents.htm, diakses 22 September 2011
Cimpan, G., 2004, Solute Identification in TLC, in Cazes, Jack, (Ed.), Encyclopedia of Chomatography, Marcel Dekker, Inc., New York,
pp.1430
Clarke, E.G.C, 1971, Isolation and Identification of Drugs, 343, 42, 539, The Pharmaceutical Press, London, pp. 42, 343, 539
Departemen Kesehatan Republik Indonesia, 1995, Farmakope Indonesia, edisi IV, Direktorat Jenderal Pengawasan Obat dan Makanan Departemen Kesehatan RI, pp. 6
Environmental Protection Agency, 2005, Biopesticide Registration Action Document : Methyl Salicilate, US Environmental Protection Agency
Gandjar, I.G., dan Rohman , A., 2007, Kromatografi Untuk Analisis Obat, Graha Ilmu, Yogyakarta, pp. 353-363
Gearin, J.E., and Grabowski B.F., 1969, Methods of Drug Analysis, Lea & Febiger, USA, pp. 74
Harmita, 2004, Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya, Majalah Ilmu Kefarmasian, vol. I, No. 3, 122
Harnani, E. D., 2010, Perbandingan Kadar Eugenol Minyak Atsiri Bunga Cengkeh (Szygium aromaticum (L.) Meer. & Perry) dari Maluku, Sumatera, Sulawesi, dan Jawa dengan Metode GC-MS
Ibrahim, N., 2011, Fisiologi Nyeri, Departemen Fisiologi Fakultas Kedokteran Universitas Indonesia, Jakarta
Indrayanto, G., and Yuwono, M., 2003, Validation of TLC Analyses, in Cazes, Jack, (Ed.), Encyclopedia of Chomatography, Marcel Dekker, Inc., New York, pp.1634
Jeffery, G.H., Bassett, J., Mendham. J., and Denney, R.C., 1989, Vogel's: Textbook of Quantitative Chemical Analysis, 5th ed., John Wiley & Sons, Inc., New York, pp. 229, 231
Lalla, J.K., Hamrapurkar, P.D., and Singh A., 2007, Quantitative HPTLC Analysis of the Eugenol Content of Leaf Powder and a Capsule Formulation of Ocimum sanctum, Journal of Planar Chromatography 20, 135-139
Lepri, L, and Cincinelli, A, Rf, in Cazes, Jack, (Ed.), Encyclopedia of Chomatography, Marcel Dekker, Inc., New York, pp.1307
National Toxicology Program, 2012, http://ntp.niehs.nih.gov/index.cfm?objectid=E8848B15-BDB5-82F8-F2450B0677EFC801, diakses pada 10 Juni 2012
Newton, J., 2011, Condensation Reactions of Esters, The University of Southern Maine, South Chicago
Nurdjannah, N., 2004, Difersifikasi Penggunaan Cengkeh, Balai Besar Penelitian dan Pengembangan Pasca Panen Pertanian, Bogor
Oketips, 2010, http://oketips.com/8797/tips-sejarah-manfaat-efek-samping-asam-salisilat/, diakses pada 16 Juni 2012
Prus, W., and Kowalska, T., 2003, Optimization of Thin –Layer Chromatography, in Cazes, Jack, (Ed.), Encyclopedia of Chomatography, Marcel Dekker, Inc., New York, pp.1009
RSC, 2012, Salicylic Acid, http://www.chemspider.com/Chemical-Structure.331.html, diakses pada 10 Juni 2012
Sherma., J., 2002, Optical Quantification (Densitometry) in TLC, in Cazes, Jack, (Ed.), Encyclopedia of Chomatography, Marcel Dekker, Inc., New York, pp.1004
Snyder, Kirkland, and Glaich, 2010, Practical HPLC Method Development, 2nd edition, pp. 23-24
Syamsuni, H., 2006, Farmasetika Dasar dan Hitungan Farmasi , Penerbit Buku Kedokteran EGC, Jakarta, pp. 102
TCI America, 2008, Material Safety Data Sheet A0232, https://www.spectrumchemical.com/MSDS/TCI-A0232.pdf, diakses pada 5 Juni 2012
The Department of Health, 2010b, British Pharmacopoeia 2011, Volume 2, The Department of Health, London, pp. 1425
The Department of Health, 2010c, British Pharmacopoeia 2011, Volume 3, The Department of Health, London, pp. 2376
Toxnet, 1994, Methyl Salicylate, http://toxnet.nlm.nih.gov/cgi-bin/sis/search/a?dbs+hsdb:@term+@DOCNO+1935, diakses pada 10 Juni 2012
Vijon, 2008, Material Safety Data Sheet,
http://www.vijon.com/data/resources/219.pdf, diakses pada 5 Juni 2012
Wulandari, L., dan Indrayanto, G., 2000, Densitometric Determination of Betamethasone Dipripionate and Salicylic Acid in Lotions, and
Validation of the Method,
52
Lampiran 2. Certificate of Analysis Baku Eugenol for R & D
Lampiran 3. Data Penimbangan dan Pengambilan Baku dan Sampel serta Contoh Perhitungan Konsentrasi Baku
1. Penimbangan Baku Asam Salisilat
Bobot Asam Salisilat
Replikasi I Replikasi II Replikasi III
Gram 0,5010 0,5010 0,5010
Baku asam salisilat memiliki kemurnian 99,8 %, sehingga di dalam 0,5010 gram serbuk baku asam salisilat terdapat 0.5000 gram asam salisilat
Contoh perhitungan kadar seri larutan baku asam salisilat
Konsentrasi seri baku yang dibuat :
2. Pengambilan Baku Eugenol (berat jenis = 1,067 g/mL)
Volume Eugenol
Replikasi I Replikasi II Replikasi III
mL 0,473 0,473 0,473
Baku eugenol memiliki kemurnian 99%, sehingga di dalam 0,773 mL baku eugenol yang diambil terdapat 0,5000 gram eugenol
Contoh perhitungan kadar seri larutan baku eugenol
Konsentrasi stok = = 20000 ppm
Konsentrasi seri baku yang dibuat : a. V1 C1 = V2 C2
b. V1 C1 = V2 C2
0,170 mL . 20000 ppm = 5 mL . C2 C2 = 680 ppm
c. V1 C1 = V2 C2
0,200 mL . 20000 ppm = 5 mL . C2 C2 = 800 ppm
3. Penimbangan Sampel
Bobot Replikasi
I II III
Gram 1,1044 1,1049 1,1052
Lampiran 4. Contoh Perhitungan Indeks Polaritas Fase Gerak Indeks polaritas dari : Air = 9,0
Asam asetat glasial = 6,2
Metanol = 5,1
Etil Asetat = 4,4
Toluena = 2,4
a. Metanol p.a : air : asam asetat glasial p.a (40 : 60 : 1)
Indeks polaritas = x 5,1 + x 9,0 + x 6,2 = 7,61
b. Toluena p.a : etil asetat p.a (95 : 5)
c. Toluena p.a : etil asetat p.a : methanol p.a (65,2 : 2,4 : 32,4)
Indeks polaritas = x 2,4 + x 4,4 + x 5,1 = 3,32
Lampiran 6. Hasil Scanning Penentuan Panjang Gelombang Maksimum Asam Salisilat dan Eugenol
Asam Salisilat
282 nm
Eugenol 300 nm
Lampiran 7. Densitogram Hasil Elusi Menggunakan Fase Gerak Metanol
p.a : Air : Asam Asetat Glasial p.a (40 : 60 : 1) 1. Densitogram asam salisilat
Lampiran 8. Densitogram Hasil Elusi Menggunakan Fase Gerak Toluena
p.a : Etil Asetat p.a (95 : 5) 1. Densitogram asam salisilat
Lampiran 9. Densitogram Hasil Elusi Menggunakan Fase Gerak Toluena
p.a : Etil Asetat p.a : Metanol p.a (25 : 50 : 25) 1. Densitogram asam salisilat
Lampiran 10. Densitogram Hasil Elusi Menggunakan Fase Gerak Toluena
p.a : Etil Asetat p.a : Metanol p.a (30 : 45 : 25) 1. Densitogram asam salisilat