OPTIMASI METODE PENETAPAN KADAR KURKUMIN DALAM SEDIAAN CAIR OBAT HERBAL TERSTANDAR (OHT) MERK “KIRANTI®” DENGAN METODE KROMATOGRAFI LAPIS TIPIS
(KLT)-DENSITOMETRI
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Dewi Elizabeth Himawan NIM : 078114077
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Dewi Elizabeth Himawan NIM : 078114077
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
Halaman Persembahan
Ability is what you're capable of doing. Motivation determines what
you do. Attitude determines how well you do it. -Lou Holtz! ~
Upsets and failures always contain the gift of
learning. Stay strong to unwrap the package. Be
thankful and keep moving! JC bless
God is a friend who is close beside us. Everytime you’re feeling lost, Keep your faith strong and believe that His light will surely guide you!
Karya ini aku dedikasikan kepada:
My Great DAD and MOM
My lovely brother, Adde
Almamaterku
v
Nya yang penuh kasih, sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi berjudul ”Optimasi Metode Penetapan Kadar Kurkumin dalam Sediaan Cair Obat Herbal Terstandar (OHT) Merk Kiranti® dengan Metode Kromatografi Lapis Tipis (KLT)-Densitometri”.
Penulis menyadari bahwa penulis tidak dapat menyelesaikan skripsi ini sendiri tanpa bantuan, dukungan, bimbingan, arahan, kritik, dan saran dari berbagai pihak. Maka pada kesempatan ini penulis hendak menyampaikan ungkapan terimakasih yang sebesar-besarnya kepada:
1. Bapak Ipang Djunarko, M. Sc., Apt., selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
2. Ibu Christine Patramurti, M.Si., Apt selaku dosen pembimbing skripsi yang telah memberikan bimbingan, saran dan evaluasi kepada penulis sejak penyusunan proposal hingga selesainya penulisan skripsi ini.
3. Jeffry Julianus, M.Si., selaku dosen penguji, atas bimbingan, arahan, dan penjelasannya.
4. Yohanes Dwiatmaka, M.Si., selaku dosen penguji dan dosen pembimbing akademik yang telah memberi bimbingan dan arahan pada penulis selama menjalani masa kuliah.
vi
6. Dr. C.J. Soegihardjo, Apt. yang telah bersedia meluangkan waktunya untuk berdiskusi.
7. Segenap dosen dan karyawan atas ilmu dan pengalaman yang berharga sehingga berguna dalam proses penyusunan skripsi.
8. Yunita dan Veny sebagai rekan kerja, terima kasih atas kerja sama yang solid, atas kebersamaannya untuk membantu kerja penulis di laboratorium. 9. Seno, Tere, Lilis, Pakdhe, Katrin, Upil, Pace, Benny, Lala sebagai teman satu lantai yang sering melakukan penelitian bersama, terima kasih atas kebersamaan dan dukungan yang diberikan.
10. Mas Bimo, Mas Wagiran, Mas Parlan, Mas Kunto dan seluruh staf laboran yang telah bersedia membantu penulis mengerjakan penelitian.
11. Venny, Nana, Vivi, Sasa, Frissa, Helen, terima kasih telah menjadi sahabat yang baik penulis dan atas semangat dan pengertian yang telah diberikan dari awal perkuliahan hingga penyusunan skripsi.
12. Ci Eva telah menjadi kakak kos yang baik dan atas berbagai pengalaman yang telah dibagikan pada penulis.
13. Nana, Evina, Mala, Daniel, Ridho, Andy, Wawan, Mba Ririn sebagai teman yang sering satu kelompok telah memberikan pengetahuan, pengalaman berharga dan semangat.
14. Teman-teman FST 07 yang luar biasa kekompakannya, serta terima kasih atas kebersamaan dan kegilaan bersama kalian, kalian memberi warna dalam hidupku.
vii
17. Teman-teman KKN kel 1 XL yang telah menjadi teman yang baik selama 1 bulan KKN di Pailihan, Bantul.
18. Seluruh teman angkatan 2007, atas suka duka, kenangan dan kebersamaan yang membuat saat-saat kuliah menjadi saat-saat yang indah.
19. Semua pihak yang tidak dapat disebutkan satu persatu, atas segala bantuannya hingga penulis menyelesaikan skripsi ini, terima kasih atas semua bantuannya.
Penulis menyadari bahwa penulis tidak luput dari kekurangan dalam penulisan naskah skripsi ini mengingat segala keterbatasan wawasan dan kemampuan penulis. Untuk itu, penulis membuka diri untuk adanya kritik dan saran yang membangun sehingga skripsi ini menjadi lebih baik. Akhir kata, dengan segala kerendahan hati penulis berharap semoga tulisan ini berguna bagi semua pihak, terutama untuk kemajuan pengetahuan dalam bidang ilmu Farmasi.
viii DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ... vi
PRAKATA... vii
DAFTAR ISI... x
DAFTAR TABEL... xii
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN... xivi
INTISARI... xvi
ABSTRACT... xvii
BAB I PENGANTAR ... 1
A. Latar Belakang ... 1
1. Perumusan Masalah ... 4
2. Keaslian Penelitian ... 4
3. Manfaat Penelitian ... 5
ix
B. Obat Herbal Terstandar (OHT) ... 11
1. Tinjauan Umum ... 11
2. Standarisasi Simplisia ... 12
C. Kiranti® ... 13
D. Kromatografi Lapis Tipis (KLT) ... 13
1. Tinjauan Umum ... 13
2. Kromatografi Lapis Tipis ... 14
3. Sistem KLT ... 16
4. KLT-Densitometri ... 19
5. Optimasi Metode ... 19
E. Landasan Teori ... 23
F. Hipotesis ... 24
BAB III METODOLOGI PENELITIAN... 25
A. Jenis dan Rancangan Penelitian ... 25
B. Variabel Penelitian ... 25
C. Definisi Operasional ... 26
D. Bahan dan Alat Penelitian... 26
x
2. Alat penelitian... 27
E. Tata Cara Penelitian ... 27
1. Pembuatan Fase Gerak... 27
2. Pembuatan Metanolp.a. pH 4 ... 28
3. Pembuatan Larutan Baku Kurkumin ... 28
4. Penentuan Panjang Gelombang Maksimum ... 28
5. Preparasi Sampel ... 29
6. Optimasi Metode Kromatografi Lapis Tipis Densitometri ... 29
F. Analisis Data... 30
BAB IV HASIL DAN PEMBAHASAN ... 32
A. Pembuatan Fase Gerak... 32
B. Pembuatan Metanolp.a. pH 4 ... 34
C. Pembuatan Larutan Baku Kurkumin ... 35
D. Optimasi Pemisahan Kurkumin dalam Sampel OHT Cair Merk “Kiranti®” secara KLT-Densitometri... 36
1. Penentuan Panjang Gelombang Maksimum Kurkumin ... 36
2. Preparasi Sampel ... 39
xi
Asetat Glasialp.a. dengan Perbandingan 9,75:0,25 ... 43
c. Pemisahan Kurkumin dengan Fase Gerak Kloroform p.a. : Asam Asetat Glasialp.a. dengan Perbandingan 9,50:0,50 ... 44
d. Pemisahan Kurkumin dengan Fase Gerak Kloroform p.a. : Asam Asetat Glasial p.a. : Heksana p.a. dengan Perbandingan 8,50:1,00:0,50 ... 45
BAB V KESIMPULAN DAN SARAN... 50
A. Kesimpulan ... 50
B. Saran ... 50
DAFTAR PUSTAKA ... 51
LAMPIRAN... 55
xii
DAFTAR TABEL
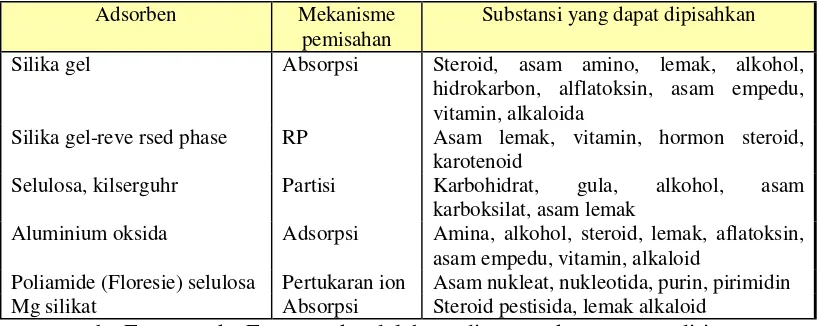
Tabel I. Fase Diam dan Substansi yang Dipisahkan ... 17
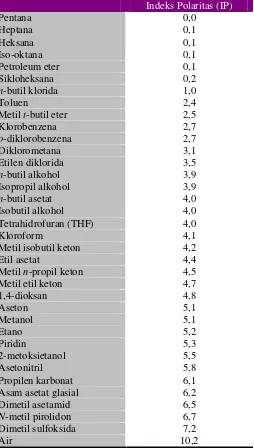
Tabel II. Indeks Polaritas Larutan Kimia... 18
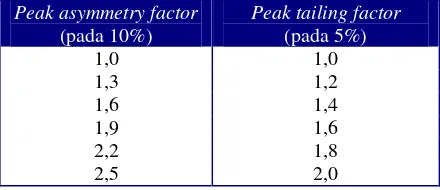
Tabel III. Hubungan antaraPeak Asymmetry FactordanTailing Factor... 21
Tabel IV. Perbandingan Fase Gerak... 27
Tabel V. Perbandingan Fase Gerak dan Indeks Polaritas... 32
xiii
Gambar 3. Struktur kimia kurkumin dalam berbagai pH... 8
Gambar 4. Contoh produk degradasi kurkumin pada pH alkali …………... 9
Gambar 5. Produk fotodegradai kurkumin... 10
Gambar 6. Logo obat herbal terstandar (OHT)... 12
Gambar 7. Sampel OHT cair merk “Kiranti®”... 13
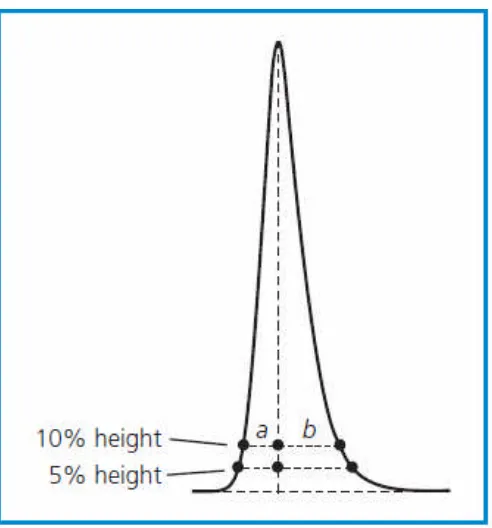
Gambar 8. Pengukurantailing peak..... 20
Gambar 9. Pemisahan dua senyawa... 22
Gambar 10. Gugus metilen aktif pada kurkumin ... 35
Gambar 11. Gugus kromofor dan auksokrom pada kurkumin... 37
Gambar 12. Pola spektra seri larutan baku pada pengukuran panjang gelombang maksimum ... 38
Gambar 13. Gugus nonpolar dan polar kurkumin... 40
Gambar 14. Interaksi kurkumin dengan fase diam ... 40
Gambar 15. Pemisahan kurkumin dari berbagai senyawanya dengan fase gerak kloroformp.a. : etanolp.a: aquadest (25:0,96:0,04) ... 42
Gambar 16. Pemisahan kurkumin dari berbagai senyawanya dengan fase gerak kloroformp.a. : asam asetat glasialp.a(9,75:0,25) ... 43
Gambar 17. Pemisahan kurkumin dari berbagai senyawanya dengan fase gerak kloroformp.a. : asam asetat glasialp.a.(9,50:0,50) ...45
Gambar 18. Pemisahan kurkumin dari berbagai senyawanya dengan fase gerak kloroformp.a. : asam asetat glasialp.a: heksanap.a. (8,50:1,00:0,50)... 46
Gambar 19. Pemisahan kurkumin dari berbagai senyawanya dengan fase gerak kloroformp.a. : asam asetat glasialp.a. (9,50:0,50) ... 48
xiv
DAFTAR LAMPIRAN
Lampiran 1. Surat Pernyataan Jaminan Keaslian Bahan Kurkumin Standar Hasil
Sintesis... 56
Lampiran 2. Data Penimbangan Bahan... 57
Lampiran 3. Spektrum Stabilitas Kurkumin pada pH 4... 58
Lampiran 4. Perhitungan Kepolaran Fase Gerak ...……... 60
Lampiran 5. Sistem KLT-Densitometri yang Digunakan... 61
Lampiran 6. Kromatogram pada Fase Gerak Kloroformp.a. : Etanolp.a. : Aquadest (25: 0,96 : 0,04)... 63
Lampiran 7. Kromatogram pada Fase Gerak Kloroformp.a. : Asam Asetat Glasial p.a. (9,75 : 0,25) ... 65
Lampiran 8. Kromatogram pada Fase Gerak Kloroformp.a. : Asam Asetat Glasial p.a. (9,50 : 0,50) ... 67
Lampiran 9. Kromatogram pada Fase Gerak Kloroformp.a. : Asam Asetat Glasial p.a. : Heksanap.a. (8,50 : 1,00 : 0,50) ... 69
Lampiran 10. Kromatogram Pemisahan Kurkumin dengan Fase Gerak Optimum Kloroformp.a. : Asam Asetat Glasialp.a. (9,50 : 0,50) Replikasi I.. 71
Lampiran 11. Kromatogram Pemisahan Kurkumin dengan Fase Gerak Optimum Kloroform p.a. : Asam Asetat Glasial p.a. (9,50 : 0,50) Replikasi II ... 73
Lampiran 12. Kromatogram Pemisahan Kurkumin dengan Fase Gerak Optimum Kloroform p.a. : Asam Asetat Glasial p.a. (9,50 : 0,50) Replikasi III ... ... ... 75
xv
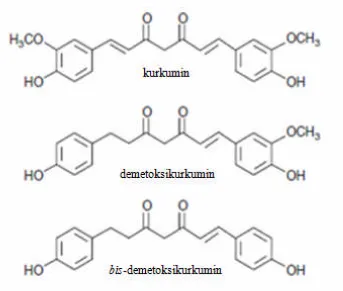
untuk mengatasi analgesik misalnya nyeri haid. Kurkuminoid terdiri dari tiga senyawa yaitu kurkumin, demetoksikurkumin dan bis-demetoksikurkumin. Dari ketiga senyawa kurkuminoid tersebut, kurkumin merupakan senyawa terbesar, yaitu 50- 60% dari total kurkuminoid. Kurkumin memiliki sifat fisika-kimia yang kurang stabil terhadap suhu, cahaya dan pH.
Penelitian ini merupakan penelitian eksperimental deskriptif dua tingkat karena pada subyek uji diberikan dua perlakuan berupa perbedaan jenis dan perbandingan komposisi fase gerak. Sistem KLT yang digunakan adalah fase normal menggunakan fase diam lempeng KLT silika gel G60 dan fase gerak berupa kloroform p.a. : asam asetat glasial p.a. dan kloroform p.a. : asam asetat glasialp.a.: heksanap.a.dengan berbagai komposisi.
Parameter yang dioptimasi adalah jenis dan komposisi fase gerak. Kondisi optimum hasil penelitian yang diperoleh adalah fase gerak kloroformp.a.
: asam asetat glasial p.a. (9,5 : 0,5) ditunjukkan dengan bentuk peak
kromatogram yang runcing dilihat dari nilai peak asymmetry factor (As) antara 0,9-1,2, nilai retardasi faktor (Rf) antara 0,2-0,8 , resolusi≥1,5 dan CV≤2.
xvi ABSTRACT
Curcumin is the yellow pigment derived from turmeric plant (Curcumae domesticaeVal.). In turmeric rhizome contained active compounds that are often used as traditional medicine in the form of curcuminoids are useful to overcome the analgesic such as menstrual pain. Curcuminoids consists of three components, namely curcumin, demetoksikurkumin and bisdemetoksikurkumin. Of the three compounds are curcuminoids, curcumin is the largest component, 50-60% of total curcuminoids. Curcumin has the physical-chemical properties that are less stable to temperature, light and pH.
This study is a descriptive experimental two levels because the test subjects are given two treatments consisted of different types and comparison of mobile phase composition. TLC system used was a normal phase using the stationary phase TLC plate silica gel G60 and a mobile phase chloroform p.a. : acetic acid glacial p.a. and chloroform p.a. : acetic acid glacial p.a. : hexane p.a. with various compositions.
The parameters optimized are the type and composition of mobile phase. The optimum conditions obtained research results are a mobile phase of chloroform p.a. : acetic acid glacial p.a. (9,5 : 0,5), indicated by the shape of a pointy peak chromatogram that the value of peak asymmetry factor (As) between 0.9-1.2, the value of retardation factor (Rf) between 0.2 to 0.8, resolution ≥ 1.5
and CV≤2.
1
Kurkumin merupakan zat warna kuning yang berasal dari tanaman kunyit (Curcumae domesticae Val.) (Chattopadhyay, Biswas, Bandyopadhyay, Banerjee, 2004). Dalam tanaman kunyit khususnya pada rimpang kunyit terdapat senyawa aktif yang sering digunakan sebagai obat tradisional berupa kurkuminoid
yang terdiri dari 3 senyawa yaitu kurkumin (diferuloilmetan), demetoksikurkumin
danbis-demetoksikurkumin yang diindikasikan sebagai analgesik (Gaikar, Dandekar,
2001). Pemakaian kurkuminoid sebagai bahan obat sudah dikenal sejak dahulu dalam berbagai sediaan obat tradisional dan telah dikonsumsi oleh masyarakat luas misalnya untuk mengurangi nyeri haid (Orang Tua Group, 2005).
Penggunaan kurkumin sebagai bahan obat atau campuran obat dalam sediaan obat tradisional harus diberikan dengan dosis tepat mengingat kebanyakan sediaan obat tradisional yang beredar di pasaran hanya mencantumkan jumlah simplisia dalam satuan bobot tertentu sehingga tidak diketahui secara pasti kandungan kurkumin yang memberikan aktivitas farmakologis. Selain itu, kurkumin memiliki sifat fisika-kimia yang kurang stabil terhadap cahaya dan pH. Oleh karena itu, harus diketahui kadar kurkumin secara tepat dengan menggunakan metode analisis yang tepat (Martono, 1996).
2
pemanfaatan obat tradisional (OT) yang berupa sediaan obat bahan alam yang telah dibuktikan keamanan dan khasiatnya secara ilmiah dengan uji praklinik dan bahan bakunya telah distandarisasi. Kiranti® merupakan sediaan cair yang mengandung berbagai ekstrak yaitu Curcumae domesticae Rhizoma (30g),
Tamarindi Pulpa (6g), Kaempferiae Rhizoma (3g), Arengae pinnata Fructose
(3g), Zingiberis Rhizoma (0,8g), Paullinia cupana (0,23g) dan Cinnamomi Cortex (0,1g). Dalam OHT cair merk “Kiranti®” belum dilakukan penjaminan mutu berupa penetapan kadar bahan berkhasiatnya yaitu kadar kurkumin. Dengan adanya alasan tersebut, maka perlu dilakukan analisis terhadap kadar kurkumin dalam OHT cair merk “Kiranti®”. Penjaminan mutu perlu dilakukan agar kadar kurkumin dalam OHT yang telah diuji praklinik dapat memenuhi persyaratan kadar sehingga dapat dipertanggungjawabkan khasiat dan keamanannya.
Metode yang dapat digunakan untuk menetapkan kadar kurkumin yang terdapat dalam ekstrak Curcumae domesticae Rhizoma adalah metode Kromatgrafi Lapis Tipis (KLT)-Densitometri dan Kromatografi Cair Kinerja Tinggi atau lebih dikenal dengan High Performance Liquid Chromatography
Sebelum dilakukan penetapan kadar kurkumin yang terdapat dalam sampel, perlu dilakukan optimasi untuk mengetahui sistem optimum untuk penetapan kadar kurkumin dari berbagai senyawa dalam OHT cair merk “Kiranti®”. Penelitian ini merupakan penelitian berkelanjutan berupa optimasi, validasi dan penetepan kadar kurkumin dalam sediaan cair OHT merk “Kiranti®” secara KLT - Densitometri.
Optimasi ini perlu dilakukan terutama karena dalam penelitian ini menggunakan metode KLT-Densitometri dengan sistem yang baru yaitu penggunaan komposisi fase gerak yang belum pernah dilakukan sebelumnya. Hal tersebut karena OHT cair merk “Kiranti®” yang digunakan sebagai sampel belum pernah diteliti sebelumnya sehingga untuk pemisahan kurkumin dari senyawa lain dibutuhkan sistem baru pula. Kondisi sistem KLT-Densitometri yang optimum perlu dicari agar diperoleh hasil pemisahan yang baik dari campuran kurkumin dan senyawa lain. Kondisi optimum dapat diperoleh dengan optimasi fase gerak yang digunakan dalam sistem KLT-Densitometri. Optimasi fase gerak yang dalam hal ini adalah optimasi jenis dan komposisi dari fase gerak.
4
kepolaran dengan penambahan heksana p.a. atau peningkatan kepolaran dengan penambahan aquadest atau asam asetat glasialp.a.
Parameter dari kondisi optimum dari sistem KLT yang diteliti adalah diperoleh hasil peak kromatogram runcing dilihat dari harga peak asymmetry factor (As = b/a) antara 0,9-1,2 (Synder, Kirkland, Glajh, 1997), kemiripan Rf
sampel-baku dan nilai Rf antara 0,2-0,8 (Sherma,J., et.al., 2003). Dari Rf sampel
didapat resolusi ≥1,5 (Sherma,J.,et.al., 2003) serta dari resolusi dihitung CV≤2 (Harmita, 2004) pada tiga kali replikasi pada komposisi fase gerak optimum yang didapat.
1. Perumusan masalah
Berdasarkan latar belakang di atas, maka permasalahan yang muncul adalah bagaimana jenis dan perbandingan komposisi fase gerak dari sistem KLT yang diteliti sehingga didapatkan parameter optimum berupa bentuk peak
kromatogram yang runcing dilihat dari nilai peak asymmetry factor (As) antara 0,9-1,2, Rf antara 0,2-0,8, resolusi (Rs) ≥ 1,5, dan CV ≤ 2 untuk memisahkan
kukumin dari berbagai senyawa dalam OHT cair merk “Kiranti®”.
2. Keaslian penelitian
aquadest (25:0,96:0,04) dan fase diam silica gel 60 F254 diketahui memiliki selektivitas, sensitivitas dan ketelitian yang cukup tinggi. Paramasivam et al.
(2008) pernah melakukan penelitian mengenai Occurrence of curcuminoids in Curcuma longa : A quality standardization by HPTLC. Gupta et al. (1999) melakukan penelitian tentang Simultaneous determination of curcuminoids in curcuma samples using HPTLC. Penelitian mengenai kurkumin dalam OHT cair “Kiranti®” menggunakan metode KLT-Densitometri belum pernah dilakukan.
3. Manfaat penelitian
a. Manfaat metodologis. Hasil penelitian ini diharapkan mampu menambah khasanah pengetahuan mengenai penggunaan metode penetapan kadar kurkumin secara KLT-Densitometri khususnya optimasi.
b. Manfaat praktis. Hasil penelitian ini diharapkan dapat digunakan sebagai metode untuk analisis campuran multikomponen kurkuminoid dalam suatu obat tradisional.
B. Tujuan Penelitian
Berdasarkan latar belakang dan permasalahan yang muncul maka penelitian ini bertujuan untuk mengetahui jenis dan perbandingan komposisi fase gerak dari sistem KLT yang diteliti sehingga didapatkan parameter optimum berupa bentuk peakkromatogram yang runcing dilihat dari nilai peak asymmetry factor(As) antara 0,9-1,2, Rf antara 0,2-0,8, resolusi (Rs)≥1,5, dan CV≤2 untuk
6 BAB II
PENELAAHAN PUSTAKA
A. Kurkumin
Kurkumin merupakan zat warna kuning yang berasal dari tanaman kunyit (Curcumae domesticae Val.). Kurkumin (diferuloilmetan) memiliki turunan/ derivat berupa demetoksikurkumin dan bis-demetoksikurkumin. Ketiga senyawa ini disebut kurkuminoid secara keseluruhan. Dalam kurkuminoid, kandungan kurkumin sebesar 77%, demetoksikurkumin 17% danbis-demetoksikurkumin 3% (Anggarwal, 1995). Sifat kepolaran dari yang paling polar sampai yang non polar adalah sebagai berikut kurkumin, demetoksikurkumin, kemudian bis -demetoksikurkumin (Aggarwal,et.al., 2006).
Kurkumin yang memiliki nama lain 1,7-bis-(4`-hidroksi-3`-metoksifenil) -1,6-heptadiena-3,5-dion, merupakan senyawa hasil isolasi dari tanamanCurcuma sp dan telah berhasil dikembangkan sintesisnya oleh Pabon (1964). Kurkumin telah diketahui memiliki aktivitas biologis seperti analgesik, antioksidan, antikanker dan antimutagenik (Gaikaret al.,2001).
Sifat-sifat kurkumin adalah memiliki berat molekul = 368,37 g/mol (C = 68,47 %; H = 5,47 %; O = 26,06 %), berwarna kuning muda, titik lebur 1830 C dan larut dalam pelarut organik (metanol, etanol atau benzena), asam asetat glasial serta tidak larut dalam air (Tonnesen, Karlsen, 1985).
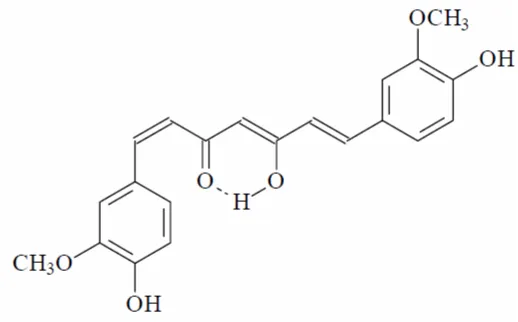
Selain konstituen mayor (kurkumin, demetoksi kurkumin dan bis
demetoksi kurkumin), konstituen minor juga dapat diisolasi yang memiliki bentuk isomer geometrikal dari bis-demetoksikurkumin (Gambar 1). Satu diantaranya berbentuk isomer geometrik cis-trans (Gambar 2) memiliki titik lebur, stabilitas dalam larutan dan cahaya yang lebih rendah (Stankovic, 2004).
Gambar 2. Isomer geometrikcis-transdaribis-demetoksikurkumin (Stankovic, 2004)
8
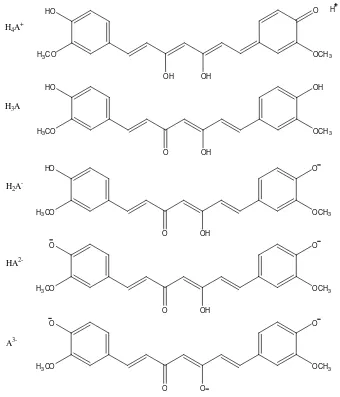
berwarna merah yang diindikasikan terjadi protonasi dengan membentuk (H4A+). Pada pH 1-7, sebagian besar diferuloilmetan berada dalam bentuk netral (H3A). Pada pH ini kelarutannya dalam air sangat rendah dan larutan berwarna kuning. Pada pH >7,5 warna berubah menjadi merah. Nilai pKa untuk disosiasi tiga proton asam pada senyawa kurkumin (bentuk H2A-, HA2-dan A3-) secara berturut-turut adalah 7,8; 8,5 dan 9,0 (Stankovic, 2004).
OH
Gambar 3. Struktur kimia kurkumin dalam berbagai pH (Stankovic, 2004)
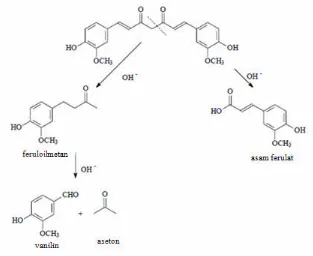
kimia pada pH basa terhadap senyawa kurkumin (Tonnesen,et.al., 1985), produk dekomposisi pada pH 7-10 ditentukan secara HPLC. Produk degradasi terbentuk setelah 5 menit dan kromatogram diperoleh setelah 28 jam pada pH 8,5 menunjukkan degradasi alkali sehingga terbentuk asam ferulat dan feruloilmetan. Feruloilmetan secara cepat terbentuk produk kondensasi warna kuning sampai kuning kecoklatan. Produk degradasi pada pH alkali yang terbentuk adalah feruloilmetan adalah vanilin dan aseton serta jumlahnya meningkat seiring bertambahnya waktu (Stankovic, 2004).
Gambar 4. Contoh produk degradasi kurkumin pada pH alkali (Stankovic, 2004)
10
fotodegradasi kurkumin misalnya adalah asam vanilat, vanilin dan asam ferulat (Sasaki, Sat, Abe, Sugimoto, Maitani, 1998).
Gambar 5. Produk fotodegradasi kurkumin (Tonnesen, Greenhill, 1992)
Karena sifatnya yang tidak stabil, kurkumin harus segera diukur menggunakan densitometer (TLC Scanner) sesaat setelah pengembangan selesai. Analisis penetapan kadar kurkumin dilakukan pada panjang gelombang
maksimum (λmaks) visibel yaitu pada 425 nm (Mohammad, Ahmad, Daud, 2007).
Pengukuran pada daerah visibel dikarenakan kurkumin memiliki warna (kuning)
sehingga panjang gelombang terletak antara 400-800 nm, memiliki gugus kromofor
B. Obat Herbal Terstandar (OHT) 1. Tinjauan Umum
Obat herbal terstandar (Scientific based herbal medicine) adalah sediaan obat bahan alam yang telah dibuktikan keamanan dan khasiatnya secara ilmiah dengan uji praklinik dan bahan bakunya telah distandarisasi. OHT harus memenuhi kriteria:
a. Aman sesuai dengan persyaratan yang ditetapkan. Aman memiliki arti berada di dalam jendela terapi antara kadar efek maksimum (KEM) dan kadar toksik minimum (KTM).
b. Klaim khasiat dibuktikan secara ilmiah/pra-klinik. Pembuktian ilmiah ini berupa penelitian pra-klinik meliputi standarisasi kandungan bahan berkhasiat, standarisasi pembuatan ekstrak tanaman obat, standarisasi pembuatan obat tradisional yang higienis serta uji toksisitas akut maupun kronis.
c. Telah dilakukan standardisasi bahan baku yang digunakan dalam produk jadi. d. Memenuhi persyaratan mutu yang berlaku.
e. Jenis klaim penggunaan sesuai dengan tingkat pembuktian yaitu tingkat pembuktian umum dan medium (Badan POM RI, 2004).
Standarisasi dan pengukuran regulasi digunakan untuk kontrol kualitas dari OHT. Mutu suatu sediaan obat bahan alam tidak dapat terjadi begitu saja tetapi perlu dilakukan suatu langkah yang menyeluruh meliputi :
12
b. Mutu harus dibangun selama proses fabrikasi berjalan, yaitu sejak dari bahan baku sampai terbentuknya sediaan obat bahan alam yang dimaksud.
c. Melakukan kontrol (Depkes RI, 1987).
Gambar 6. Logo obat herbal terstandar (OHT) (PT Phapros, 2010)
2. Standarisasi Simplisia
Salah satu cara untuk mengendalikan mutu simplisia adalah dengan melakukan standarisasi simplisia dan ekstrak (sediaan galenik), karena khasiat suatu tanaman tergantung pada kandungan kimianya, dimana kandungan kimia ini dipengaruhi oleh banyak faktor antara lain tempat tumbuh, iklim, curah hujan, panen. Standarisasi diperlukan agar dapat diperoleh bahan baku yang seragam yang akhirnya dapat menjamin efek farmakologi tanaman tersebut (Hanani, 2009).
Standarisasi bahan baku simplisia yang dilakukan meliputi penetapan kadar minyak atsiri, penetapan kadar abu, penetapan kadar abu yang tidak larut dalam asam, penetapan kadar abu larut air, penetapan kadar air, penetapan susut pengeringan, penetapan kadar sari yang larut dalam air, penetapan kadar sari yang larut dalam etanol, penetapan bahan organik asing dan penetapan kadar tanin (Dirjen POM RI, 1995b).
akhir mempunyai nilai parameter tertentu yang konstan dan ditetapkan terlebih dahulu (Badan POM RI, 2005).
C. Kiranti®
Kiranti®merupakan Obat Herbal Terstandar yang memiliki indikasi untuk mengatasi rasa nyeri, perasaan letih, bau badan tak sedap saat haid serta keputihan (Orang Tua Group, 2010).
Gambar 7. Sampel OHT cair merk “Kiranti®” (Orang Tua Group, 2010)
Kiranti merupakan sediaan cair yang mengandung berbagai ekstrak yaitu
Curcumae domesticae Rhizoma (30g), Tamarindi Pulpa (6g), Kaempferiae Rhizoma (3g), Arengae pinnata Fructose (3g), Zingiberis Rhizoma (0,8g),
Paullinia cupana (0,23g) dan Cinnamomi Cortex (0,1g) (Orang Tua Group, 2010).
D. Kromatografi Lapis Tipis (KLT) 1. Tinjauan Umum
14
tertentu dan di dalamnya zat-zat itu menunjukkan perbedaaan mobilitas disebabkan perbedaan dalam adsorpsi, partisi, kelarutan, tekanan uap, ukuran molekul, atau kerapatan muatan ion (Dirjen POM RI, 1995a).
Teknik kromatografi umumnya membutuhkan zat terlarut terdistribusi di antara dua fase, satu diantaranya diam (fase diam), yang lainnya bergerak (fase gerak). Fase gerak membawa zat terlarut melalui media, hingga terpisah dari zat terlarut lainnya, yang terelusi lebih awal atau lebih akhir. Umumnya zat terlarut dibawa melalui media pemisah oleh aliran suatu pelarut berbentuk cairan atau gas yang disebut eluen. Fase diam dapat menjadi zat penjerap, seperti halnya penjerap alumina yang diaktifkan, silika gel dan resin penukar ion. Dalam praktek, sering kali pemisahan disebabkan oleh suatu kombinasi efek adsorpsi dan partisi (Dirjen POM RI, 1995a).
Kromatografi merupakan cara pemisahan yang berdasarkan partisi cuplikan antara fase gerak dan fase diam. Kromatografi mempunyai beberapa keuntungan antara lain:
a. Metode pemisahan cepat dan mudah
b. Menggunakan peralatan yang murah dan sederhana c. Membutuhkan campuran cuplikan yang sedikit d. Pekerjaan dapat diulang (Hardjono, 1983). 2. Kromatografi Lapis Tipis
kromatografi lapis tipis (KLT) sering digunakan karena prosedurnya sederhana, pemisahan lebih cepat dan baik serta dapat memisahkan dalam jumlah yang relatif kecil sampai beberapa mikrogram (Stahl, 1969).
Dalam pemisahan suatu senyawa harus dipilih fase diam, fase gerak dan cara kerja yang sesuai. Pemisahan yang lebih baik dapat diperoleh dengan mengadakan perubahan-perubahan pada fase diam, fase gerak dan cara kerja yang antara lain meliputi kejenuhan, temperatur dalam bejana kromatografi, cara pengembangan dan keadaan permukaan (Stahl, 1969).
Fase diam yang digunakan dalam KLT adalah bahan penjerap (adsorbent). Dua sifat penting yang harus diperhatikan untuk KLT adalah besar dan kecilnya partikel penyerap serta homogenitasnya. Sebab daya lekat pada pendukung sangat ditentukan oleh kedua sifat tersebut. Fase gerak adalah suatu medium angkut dan terdiri atas satu atau beberapa pelarut. Pemilihan suatu pelarut untuk digunakan sebagai fase gerak sama pentingnya dengan pemilihan fase diam. Fase gerak tidak hanya tersusun sebagai sarana pengangkutan tetapi juga mempengaruhi koefisien pembagian melalui daya larutnya. Di samping kelarutan relatif zat terlarut dalam fase gerak perlu dipertimbangkan pula persaingan antara zat terlarut dengan pelarut terhadap bidang adsorbsi pada permukaan fase diam. Pelarut yang mengelusi terlalu cepat tidak akan dapat memisahkan dengan baik, sebaliknya pelarut yang bergerak terlalu lambat akan memberikan waktu elusi yang terlalu panjang (Stahl, 1969).
16
jarak migrasi senyawa dengan jarak migrasi fase gerak. Baik untuk analisis kualitatif maupun kuantitatif dapat ditentukan kebenaran analit dengan membandingkan harga Rf standar dan baku. Harga Rf ini adalah tetapan fisika
yang dipengaruhi oleh beberapa faktor seperti tebal lapisan, kelembaban udara, fase gerak, bahan penyerap, dan suhu (Sastrohamidjojo, 1985). Harga Rf dapat
ditentukan dengan:
Angka Rf berkisar antara 0,00 dan 1,00 dan hanya dapat ditentukan dua
desimal. hRf adalah angka Rf dikalikan faktor 100 (h), menghasilkan nilai
berjangka 0 sampai 100 (Stahl, 1985). 3. Sistem KLT
a. Fase diam. Fase diam yang sering digunakan dalam KLT adalah bahan penjerap (adsorben). Silika gel merupakan penjerap yang paling banyak digunakan dalam KLT. Pada umumnya ditambah dengan bahan pengikat untuk memberikan kekuatan perlekatan pada pendukungnya. Bahan pengikat yang sering digunakan adalah gipsum, dan silika gel yang diberikan tambahan senyawa, ini dikenal dengan istilah ”silika gel G”. Bahan penjerap lain yang digunakan adalah alumina, selulosa, sefadex, poliamida, kieselguhr, dan amilum (Harborne, 1973).
Tabel I. Fase diam dan substansi yang dipisahkan (Mulja, Suharman, 1995)
Adsorben Mekanisme pemisahan
Substansi yang dapat dipisahkan
Silika gel Absorpsi Steroid, asam amino, lemak, alkohol, hidrokarbon, alflatoksin, asam empedu, vitamin, alkaloida
Silika gel-reve rsed phase RP Asam lemak, vitamin, hormon steroid, karotenoid
Selulosa, kilserguhr Partisi Karbohidrat, gula, alkohol, asam karboksilat, asam lemak
Aluminium oksida Adsorpsi Amina, alkohol, steroid, lemak, aflatoksin, asam empedu, vitamin, alkaloid
Poliamide (Floresie) selulosa Pertukaran ion Asam nukleat, nukleotida, purin, pirimidin Mg silikat Absorpsi Steroid pestisida, lemak alkaloid
b. Fase gerak. Fase gerak adalah medium angkut yang terdiri atas satu atau beberapa pelarut. Fase gerak bergerak di dalam fase diam yaitu lapisan berpori karena ada gaya kapiler. Yang digunakan adalah pelarut bertingkat mutu analitik dan bila diperlukan sistem pelarut multikomponen, maka harus berupa suatu campuran sederhana terdiri atas maksimum tiga komponen (Stahl, 1985).
Komposisi fase gerak yang digunakan dapat mempengaruhi variasi retensi analit untuk pemisahan yang optimum. Sehingga fase gerak dapat disesuaikan komposisinya agar diperoleh kepolaran relatif yang mirip dengan sampel untuk memperoleh pemisahan yang optimum (Willard, Merrit, Dean, Settle, 1988).
Kepolaran pelarut merupakan ukuran kekuatan pelarut untuk mengelusi suatu senyawa. Kepolaran pelarut dinyatakan dalam bentuk indeks polaritas (IP). Besarnya polaritas campuran pelarut dapat dihitung dengan persamaan berikut:
18
Tabel II. Indeks Polaritas Larutan Kimia (Burdick, Jackson, 2010)
Indeks Polaritas (IP)
n-butil klorida 1,0
Toluen 2,4
Metilt-butil eter 2,5
Klorobenzena 2,7
o-diklorobenzena 2,7
Diklorometana 3,1
Etilen diklorida 3,5
n-butil alkohol 3,9 Isopropil alkohol 3,9
n-butil asetat 4,0 Isobutil alkohol 4,0 Tetrahidrofuran (THF) 4,0
Kloroform 4,1
Metil isobutil keton 4,2
Etil asetat 4,4
Metiln-propil keton 4,5 Metil etil keton 4,7
1,4-dioksan 4,8 Asam asetat glasial 6,2 Dimetil asetamid 6,5
N-metil pirolidon 6,7 Dimetil sulfoksida 7,2
Air 10,2
Untuk KLT fase normal, kekuatan interaksi dari pelarut dilakukan dengan pengurangan kepolaran dengan pelarutan heksana p.a. atau peningkatan dengan penambahan air atau asam asetat glasialp.a.sehingga nilai Rf berada dalam range
4. KLT-Densitometri
KLT-Densitometri merupakan salah satu metode analisa kuantitatif. Penetapan kadar suatu senyawa dengan metode ini dilakukan dengan mengukur kerapatan bercak senyawa yang dipisahkan dengan cara KLT. Pada umumnya pengukuran kerapatan bercak tersebut dibandingkan dengan kerapatan bercak senyawa standar yang dielusi bersama-sama (Hardjono, 1985).
Metode densitometri mempunyai cara kerja yang sederhana dan cepat. Pada metode densitometri diperlukan adsorben dan fase gerak yang murni. Untuk memperoleh hasil yang baik lazimnya digunakan adsorben siap pakai yang telah mengalami pra pencucian (Gritter, 1991).
Penelusuran bercak akan mendapatkan hasil yang baik apabila dilakukan pada panjang gelombang maksimum, karena perubahan konsentrasi pada bercak sedikit saja sudah terdeteksi (Mintarsih, 1990). Bercak yang kecil dan intensif akan menghasilkan suatu puncak kurva absorbsi yang sempit dan tajam, sebaliknya bercak yang lebar akan menghasilkan puncak kurva absorbsi yang melebar dan tumpul (Sudjadi, 1988).
5. Optimasi Metode
Parameter – parameter yang digunakan untuk optimasi metode dalam KLT-Densitometri adalah :
a. Sensitivitas (sensitivity) adalah kemampuan untuk mendeteksi atau mengukur analit yang berukuran mikro (kecil).
20
c. Efisiensi (efficiency)adalah keruncinganpeakdibandingkan panjangnya waktu dari senyawa kontak dengan fase diam. Analisis KLT-Densitometri mencari kondisi yang menghasikan puncak simetris karena puncak yang asimetris dapat menghasilkan perhitungan yang tidak teliti, penurunan derajat resolusi serta waktu keluarnyapeakyang tidak reprodusibel.
Gambar 8. Pengukurantailing peak (Synderet.al.,1997)
Parameter yang digunakan untuk menilai bentuk peak kromatogram adalah peak asymmetry factor (As)yang diukur pada 10% tinggi puncak.
Untuk nilai keasimetrisan kurang dari 2, As dan Tf nilainya mirip. Berikut tabel hubungan antaraAsdanTf (Synderet.al., 1997).
Tabel III. Hubungan antarapeak asymmetry factordantailing factor(Synder, et.al., 1997)
Peak asymmetry factor
d. Nilai retardasi faktor (Rf) adalah nilai rasio dari jarak migrasi center of a zone
analit dibagi jarak migrasi pelarut, keduanya diukur dari permulaan perambatan. Rfdapat dihitung dengan persamaan:
Harga Rf yang baik antara 0,2-0,8. Hal ini dikarenakan pada Rf ini didapatkan
resolusi optimum dimana peningkatan resolusi pada KLT dalam pengembangan satu dimensi untuk meningkatkan selektivitas dengan berbagai komposisi fase gerak (Sherma,et.al.,2003).
e. Faktor resolusi (Rs) adalah ukuran pemisahan dari dua puncak yang berdekatan dapat diukur dengan persamaan:
22
Gambar 9. Pemisahan dua senyawa (Johnson dan Stevenson, 1978)
Harga Rs≥1,5 disebutbaseline resolution, yaitu pemisahan sempurna dari dua puncak yang berdekatan. Dalam prakteknya, pemisahan dengan harga Rs = 1,0 (kedua puncak berhimpit lebih kurang 2%) dianggap memadai (Pescok, Shields, Caims, 1976). Untuk pemisahan yang baik Rs harus ≥ 1,5 karena berarti pemisahan kedua senyawa≥99,7% (Sastrohamidjojo, 2002).
f. Coefficient of corelation(CV) adalah nilai absolut dari standar deviasi, nilainya biasa dalam bentuk persentase. CV ini biasa digunakan dalam kimia analisis untuk mengekspresikan presisi dan keterulangan dari suatu analisis. Cara menghitungnya adalah standar deviasi dari seri replikasi analisis sampel dibagi rata-rata, hasilnya dikali 100. Rumusnya :
E. Landasan Teori
Kurkumin merupakan zat warna kuning yang terdapat dalam tanaman kunyit. Stabilitas dari kurkumin sangat dipengaruhi oleh pH lingkungan dan cahaya sehingga kurkumin harus dijaga pada pH kurang dari 7 dan diperhatikan sensitivitasnya terhadap cahaya. Kurkumin merupakan salah satu contoh senyawa kimia yang terkandung dalam OHT. Kurkumin banyak digunakan dalam OHT karena memiliki aktivitas farmakologis yang bermacam-macam, misalnya analgesik, antioksidan, antikanker dan antimutagenik. OHT dapat dibuktikan keamanan dan khasiatnya secara ilmiah dengan uji praklinik, telah mengalami standarisasi bahan baku, memenuhi kriteria aman, memenuhi persyaratan mutu yang berlaku serta jenis klaim penggunaan sesuai tingkat pembuktian umum dan medium. Kiranti® merupakan OHT cair yang mengandung kurkumin sebagai senyawa aktif dan diindikasikan sebagai analgesik.
Kurkumin yang terdapat dalam OHT cair merk “Kiranti®” dianalisis menggunakan metode KLT-Densitometri, yang merupakan metode analisis kualitatif dan kuantitatif yang dapat digunakan untuk analisis senyawa multikomponen dalam sampel yang berupa campuran senyawa. Metodenya sederhana, kecepatan pemisahan tinggi, sensitif artinya dapat menganalisis suatu senyawa dengan kadar yang sangat kecil dan selektif terhadap senyawa yang akan dianalisis. Parameter yang optimum dari optimasi metode ini adalah hasil peak
24
F. Hipotesis
Kurkumin yang terdapat dalam OHT cair merk “Kiranti®” dapat dipisahkan dari berbagai senyawa lainnya dengan metode KLT-Densitometri dengan menggunakan jenis dan perbandingan komposisi fase gerak optimum dari sistem KLT yang diteliti dengan parameter bentuk peak kromatogram yang runcing dilihat dari nilai peak asymmetry factor (As) antara 0,9-1,2; nilai Rf
25
Penelitian ini termasuk jenis penelitian eksperimental deskriptif dua tingkat karena pada subyek uji diberikan dua perlakuan berupa perbedaan jenis dan perbandingan komposisi fase gerak.
B. Variabel Penelitian 1. Variabel bebas
Variabel bebas pada penelitian ini adalah jenis dan perbandingan komposisi fase gerak yaitu kloroformp.a.: asam asetat glasialp.a.dan kloroform
p.a.: asam asetat glasialp.a.: heksanap.a.
2. Variabel tergantung
Variabel tergantung pada penelitian ini adalah bentukpeak kromatogram yang runcing dilihat dari nilai peak asymmetry factor (As) antara 0,9-1,2, nilai retardasi faktor (Rf) antara 0,2-0,8, resolusi≥1,5, dan CV≤2.
3. Variabel pengacau terkendali
Variabel pengacau terkendali pada penelitian ini adalah:
a. Kemurnian pelarut. Untuk mengatasinya, digunakan pelarut pro analysis yang memiliki kemurnian tinggi.
26
c. Cahaya. Untuk mengatasinya, pengerjaan dilakukan diruangan dengan intensitas cahaya yang terbatas serta dengan penggunaan alumunium foil.
C. Definisi Operasional
1. Sistem KLT fase normal yang digunakan dalam penelitian adalah fase diam berupa lempeng KLT silika gel G60 dan fase gerak dengan perbandingan kloroform p.a.: asam asetat glasial p.a.(9,75: 0,25; 9,50: 0,50; dan 9,00:1,00) serta kloroformp.a.: asam asetat glasialp.a.: heksanap.a.(9,75: 0,125:0,125; 9,25: 0,25: 0,50; 8,50: 1,00: 0,50; dan 8,00: 0,50: 1,50).
2. Kadar kurkumionid yang terhitung sebagai kadar kurkumin dinyatakan dalam satuanpart per million(ppm).
3. Parameter optimasi yang digunakan adalah bentuk peak kromatogram yang runcing dilihat dari nilai peak asymmetry factor (As) antara 0,9-1,2, nilai retardasi faktor (Rf) antara 0,2-0,8, resolusi≥1,5, dan CV≤2.
D. Bahan dan Alat Penelitian 1. Bahan penelitian
EMPARTA®ACS(E. Merck), heksanap.a.EMSURE®ACS(E. Merck), lempeng KLT silika gel G60 (E. Merck), aquadest, metanol teknis, sampel OHT cair merk “Kiranti®” yang mengandung kurkumin.
2. Alat penelitian
Alat yang digunakan dalam penelitian ini adalah neraca analitik (Scaltec
SBC 22 max 60/210 g; min 0,001 g; d=0,01/0,1 mg; e=1 mg), ultrasonikator (Retsch tipe T460 Schwing1 PXE, FTZ-Nr.C-066183, HF-Freq = 35 kHz), fase diam lempeng KLT silika gel G60 (E. Merck), bejana kromatografi, densitometer (CAMAC TLC Scanner 3 CAT. No. 027.6485 SER. No.160602), pipet mikro 1-5 µL, pipet mikro 100-1000 µL, pipet mikro 0,5-5 ml, labu ukur 5 ml (Pyrex), labu ukur 10 ml (Pyrex), labu ukur 25 ml (Pyrex), flakon, pengaduk, gelas arloji, pipet tetes, corong, Beakerglass,magnetic stirer danHotplate Stirer Lab. Tech Model: LMS-1003, V OHS = 220 V 50 Hz, Wats = 500 W 3A. Serial No. 08210004.
E. Tata Cara Penelitian 1. Pembuatan fase gerak
Pada penelitian ini perbandingan jenis dan komposisi fase gerak yang digunakan untuk optimasi adalah sebagai berikut:
Tabel IV. Perbandingan Fase Gerak
28
2. Pembuatan metanolp.a. pH 4
Membuat metanol p.a. pH 4 sebagai pelarut dengan perbandingan metanol p.a. : asam asetat glasial p.a. (9:1), kemudian diukur pH menggunakan kertas indikator pH. Apabila pH masih > 4 maka ditambahkan asem asetat glasial
p.a.hingga pH 4, sebaliknya bila pH < 4 ditambahkan metanolp.a.
3. Pembuatan larutan baku kurkumin
a. Pembuatan larutan stok. Menimbang seksama lebih kurang 10,0 mg baku kurkumin dilarutkan dengan metanol p.a. pH 4 dalam labu takar 10,0 ml hingga tanda.
b. Pembuatan seri larutan baku. Membuat konsentrasi seri larutan baku kurkumin rendah, sedang, tinggi (25, 100, 175 ppm) dengan mengambil 0,125, 0,500, dan 0,875 ml larutan baku kurkumin, masukkan masing-masing dalam labu takar 5,0 ml dilarutkan dengan metanolp.a. pH 4 hingga tanda.
4. Penentuan panjang gelombang maksimum
panjang gelombang 400-500 nm. Didapatkan panjang gelombang maksimum larutan baku kurkumin pada berbagai konsentrasi.
5. Preparasi sampel
Sebanyak 1,0 ml sampel OHT cair merk “Kiranti®” yang sudah dihomogenkan menggunakan stirer selama 15 menit dimasukkan ke dalam labu takar 10,0 ml kemudian diencerkan dengan metanol p.a. pH 4 hingga tanda. Larutan kemudian disari menggunakan ultrasonikator selama 15 menit dan disaring kemudian diencerkan dengan metanolp.a.pH 4 dalam labu takar 10,0 ml hingga tanda.
6. Optimasi metode Kromatografi Lapis Tipis Densitometri
Larutan baku kurkumin dengan konsentrasi 25, 100, 175 ppm dan sampel ditotolkan sebanyak 3 μl pada lempeng KLT silika gel G60 kemudian segera dikembangkan dalam bejana kromatografi yang telah dijenuhi fase gerak yang sudah dibuat pada point 1. Pengembangan dilakukan setinggi 10 cm. Segera keluarkan lempeng KLT silika gel G60, dikeringkan dan secepatnya discanning dengan KLT-densitometer pada panjang gelombang maksimum yang diperoleh pada point 4. Data kromatogram yang didapat, dilihat kemiripan antara Rf baku
dan Rf sampel. Pada kromatogram larutan sampel dianalisis sehingga didapat
30
kromatogram yang runcing dilihat dari nilaipeak asymmetry factorantara 0,9-1,2, Rf antara 0,2-0,8 serta resolusi≥1,5.
Komposisi fase gerak optimum yang didapat dilakukan replikasi sebanyak 3 kali untuk melihat keterulangan sistem KLT yang digunakan. Paramater untuk melihat keterulangan sistem KLT yang digunakan adalah nilai koefisien korelasi (CV)≤2.
F. Analisis Data
Data hasil optimasi pemisahan kurkumin dalam OHT merk “Kiranti®” dengan berbagai jenis dan komposisi fase gerak dapat dianalisis dengan :
1. Dipilih hasil kromatogram yang memberikan peak paling runcing dengan menghitung nilai peak asymmetry factor (As) yang diukur pada 10% tinggi puncak. Puncak yang simetri memiliki nilai As sama dengan 1, namun puncak dengan nilaiAspada rentang 0,9-1,2 masih dikatakan baik.
2. Kemiripan nilai Rfsampel dan nilai Rfbaku dengan nilai Rfantara 0,2-0,8.
32 BAB IV
HASIL DAN PEMBAHASAN
A. Pembuatan Fase Gerak
Sistem kromatografi yang digunakan dalam analisis senyawa kurkumin dari berbagai senyawa lainnya dalam OHT cair merk “Kiranti®” adalah sistem kromatografi fase normal yang artinya fase diam lebih polar daripada fase gerak. Kurkumin merupakan analit yang bersifat non polar sehingga mempunyai afinitas yang lebih besar terhadap fase gerak dibandingkan dengan fase diam dan akan dielusi lebih cepat daripada analit yang bersifat polar. Fase gerak yang akan dioptimasi dalam penelitian ini ada empat yaitu:
Tabel V. Perbandingan Fase Gerak dan Indeks Polaritas
Komposisi
Komposisi IV 8,50 0,50 1,00 4,11
(20:2:1) memiliki IP=4,45 dan kloroform p.a. : etanol p.a. : aquadest (30:1:1) yang memiliki IP=4,32. Pada pembuatan kedua fase gerak ini telah dilakukan tiga kali, tetapi campuran fase gerak yang dihasilkan membentuk emulsi sehingga modifikasi komposisi fase gerak tidak dapat dilakukan.
Menurut Sherma, et.al., (2003) pada sistem KLT fase normal, kekuatan interaksi dari fase gerak dilakukan dengan pengurangan kepolaran dengan pelarutan heksana p.a. atau peningkatan dengan penambahan air atau asam asetat glasial p.a. sehingga nilai Rf berada dalam range optimum antara 0,2-0,8. Untuk
melakukan modifikasi fase gerak, peneliti mencari fase gerak lain yang memiliki indeks polaritas sama dengan indeks polaritas Martono (1996) yaitu berupa kloroform p.a. : asam asetat glasial p.a. (9,75:0,25) yang memiliki indeks polaritas 4,15. Pada fase gerak kedua ini dihasilkan peak yang tidak runcing sehingga dilakukan modifikasi dengan menambah kepolaran yaitu fase gerak kloroform p.a. : asam asetat glasial p.a. (9,50:0,50) dengan IP=4,21. Pada fase gerak keempat dilakukan penelitian dengan penambahan heksana p.a. untuk menaikkan kenonpolaran dari fase gerak. Hal ini hubungannya dengan sampel yang bersifat non polar sehingga lebih banyak berinteraksi dengan fase gerak yang menyebabkan makin cepat terelusi. Pada optimasi metode dicari kondisi optimum dari sistem KLT untuk pemisahan kurkumin, sehingga diperlukan optimasi kombinasi dari fase gerak non polar dan polar. Jika hanya memakai fase gerak polar atau non polar maka polaritas tidak sesuai kurkumin.
34
pelarut polar akan larut/bercampur dengan pelarut polar, demikian sebaliknya pada pelarut non polar akan larut/bercampur dengan pelarut non polar. Pada prinsip perbandingan volume, pembuatan campuran fase gerak berdasarkan volume dimana fase gerak yang memilki volume paling kecil terlebih dahulu dimasukkan labu takar sebagai tempat pembuatan fase gerak. Sedangkan pada teknik doubling pada pembuatan fase gerak adalah penambahan salah satu komposisi larutan fase gerak dalam labu takar dalam jumlah yang sama banyak hingga pembuatan fase gerak selesai.
B. Pembuatan Metanolp.a. pH 4
Pada penggunaan metanol p.a. sebagai pelarut untuk larutan baku dan larutan sampel diperlukan pengaturan pada pH 4 karena menurut Stankovic (2004) kurkumin stabil pada pH 1-7. Berdasar data orientasi stabilitas kurkumin terhadap 3 variasi pH yaitu 3,4 dan 5 pada larutan konsentrasi rendah, sedang dan tinggi yaitu 0,4 ppm, 1,0 ppm dan 1,6 ppm menggunakan alat Milton Ray Spectronic 3000 Arraydiperoleh hasil kurkumin paling stabil pada pH 4. Pada pH 4 ketiga konsentrasi diperoleh panjang gelombang yang stabil. Pengaturan metanol pada pH 4 dilakukan dengan menambahkan asam asetat glasial p.a. ke dalam metanolp.a. dengan perbandingan (9:1).
resonansi ini, gugus metilen aktif menjadi mudah bereaksi dengan gugus hidroksi dari basa sehingga menyebabkan kurkumin terdegradasi menjadi asam ferulat dan feruloil metana. Apabila kurkumin terdegradasi, maka kadar yang diperoleh berkurang sehingga tidak dapat merepresentasikan kadar yang sebenarnya.
Gambar 10. Gugus metilen aktif pada kurkumin
Penggunaan metanol p.a. sebagai pelarut karena dapat melarutkan dengan baik kurkumin dan berbagai senyawanya dalam OHT cair merk “Kiranti®”. Selain itu, metanol p.a. akan menguap setelah penotolan serta memiliki panjang gelombang 205 nm yang berbeda dengan panjang gelombang kurkumin 425 nm sehingga tidak ikut terdeteksi pada alat densitometer.
C. Pembuatan Larutan Baku Kurkumin
Larutan baku kurkumin dibuat dengan melarutkan baku kurkumin dalam pelarut metanol p.a. yang telah diatur pada pH 4 untuk menjaga stabilitas kurkumin. Pembuatan larutan baku kurkumin berupa larutan stok dan seri larutan baku. Seri larutan baku dibuat pada tiga level konsentrasi yaitu rendah, sedang dan tinggi (25,100, 175 ppm). Pembuatan tiga level konsentrasi seri larutan baku ini dilakukan untuk melihat respon detektor terhadap sinyal (peak) yang dihasilkan. Apabila sinyal yang dihasilkan terlalu kecil maka sinyal tersebut dapat terganggu oleh noise yang dihasilkan oleh alat. Sehingga pemilihan konsentrasi harus melihat rasio analit terhadap sinyal (respon detektor). Selain itu, untuk
H
3CO
HO
36
mengetahui bahwa pada ketiga level konsentrasi diperoleh hasil pemisahan kurkumin yang baik dan reprodusibel dengan menganalisis bentuk peak
kromatogram yang runcing dilihat dari nilai peak asymmetry factor serta kemiripan nilai Rf pada berbagai konsentrasi. Larutan baku yang dibuat ini
digunakan untuk analisis pemisahan campuran kurkumin dari berbagai senyawanya dengan metode KLT-Densitometri fase normal.
D. Optimasi Pemisahan Kurkumin dalam Sampel OHT Cair Merk “Kiranti®” secara KLT-Densitometri
1. Penentuan panjang gelombang maksimum kurkumin
Panjang gelombang yang digunakan untuk analisis kualitatif dan kuantitatif adalah panjang gelombang yang mempunyai absorbansi maksimal. Alasan penggunaan panjang gelombang maksimal(λmaks), yaitu :
a. Pada panjang gelombang maksimal, kepekaannya juga maksimal karena pada panjang gelombang maksimal tersebut, perubahan absorbansi untuk setiap satuan konsentrasi adalah yang paling besar.
b. Disekitar panjang gelombang maksimal, bentuk kurva absorbansi datar dan pada kondisi tersebut hukum Lambert-Beer akan terpenuhi.
c. Jika dilakukan pengukuran ulang maka kesalahan yang disebabkan oleh pemasangan ulang panjang gelombang akan kecil sekali.
reprodusibel. Pengukuran λmaks dilakukan pada salah satu fase gerak kloroform
p.a. : etanol p.a. : aquadest (25:0,96:0,04) karena yang diukur hanya satu analit berupa baku kurkumin yang akan menghasilkan satu bercak dari satu totolan dan didapatkan satu panjang gelombang.
Penentuan λmaksdengan cara mengukur pada daerah panjang gelombang
400-500 nm dengan detektor sinar visibel. Hasil pengukuran dibandingkan dengan panjang gelombang maksimum literatur yaitu 425 nm (Mohammad, dkk., 2007). Suatu senyawa dapat diukur dengan spektrofotometri visibel jika senyawa tersebut berwarna, panjang gelombang 400-800 nm, memiliki kromofor yang panjang, memiliki auksokrom serta memiliki bentuk molekul. Gambar gugus kromofor dan auksokrom dari kurkumin dapat dilihat pada gambar berikut:
Gambar 11. Gugus kromofor dan auksokrom pada kurkumin
= gugus kromofor = gugus auksokrom
38
Gambar 12. Pola spektra seri larutan baku pada pengukuran panjang gelombang maksimum
Tabel VI. Hasil pengukuran panjang gelombang maksimum pada seri larutan baku
panjang gelombang teoritis. Sehingga dapat dipastikan senyawa tersebut adalah kurkumin.
2. Preparasi Sampel
Sampel “Kiranti®” yang terdiri dari kurkumin dan berbagai senyawanya yaitu Curcumae domesticae Rhizoma, Tamarindi Pulpa, Kaempferiae Rhizoma,
Arengae pinnata Fructose, Zingiberis Rhizoma, Paullinia cupana dan
Cinnamomi Cortex perlu diisolasi terlebih dahulu sebelum dilakukan analisis. Oleh karenanya, perlu dilakukan preparasi sampel. Tujuan dari preparasi sampel adalah untuk mendapatkan sampel OHT cair merk “Kiranti®” dengan konsentrasi tertentu yang homogen. Untuk menghomogenkan sampel dilakukan pengadukan menggunakan magnetic stirer selama 15 menit. Pada sampel perlu dilakukan penarikan senyawa kimia berupa kurkumin sehingga sampel disari menggunakan ultrasonikator selama 15 menit. Tujuan dari menyari adalah penarikan senyawa kimia dalam sampel OHT cair merk “Kiranti®” yang dapat larut sehingga terpisah
dari bahan yang tidak dapat larut.
3. Optimasi pemisahan kurkumin pada masing-masing fraksi metanol OHT cair merk “Kiranti®”
40
yang digunakan adalah fase normal. Berikut ini gambar gugus nonpolar dan gugus polar dari kurkumin:
Gambar 13. Gugus nonpolar dan polar kukumin Keterangan : = gugus non polar
= gugus polar
Kurkumin memiliki sifat non polar dikarenakan bentuknya simetris antara kanan dan kiri struktur sehingga memiliki momendipol nol. Polaritas kurkumin sesuai dengan polaritas komposisi fase gerak optimum yaitu kloroform
p.a. : asam asetat glasial p.a. (9,50:0,50) yang dapat memisahkan kurkumin dengan parameter-parameter optimum.
Pemisahan dalam kromatografi dipengaruhi oleh interaksi suatu analit dengan fase diam dan fase geraknya. Interaksi kurkumin dengan fase diam sebagai berikut:
Gambar 14. Interaksi kurkumin dengan fase diam
Mengacu pada gambar 14 dapat diketahui bahwa terjadi interaksi antara kurkumin dengan fase diam berupa lempeng KLT silika gel G60. Kurkumin memiliki gugus polar dan gugus non polar. Gugus polar dari kurkumin akan berinteraksi dengan fase diamnya berupa silika gel G60 dengan ikatan hidrogen. Antara kurkumin dengan fase diam terdapat banyak interaksi hidrogen sehingga diperlukan fase gerak yang lebih banyak interaksi dengan kurkumin sehingga dapat membawa analit dan waktu elusi lebih cepat. Berbagai komposisi fase gerak dan pengaruhnya terhadap sampel akan dijelaskan lebih lanjut pada tabel VII.
Tabel VII. Tabel nilai Rfdan resolusi larutan sampel kurkumin pada berbagai
komposisi fase gerak aquadest (25 : 0,96
: 0,04)
0,5 0,43 1,71 Hasilpeakkromatogram asimetris belum memenuhi
syaratAsantara 0,9-1,2, belum tercapaibaseline
kloroformp.a. : asam asetat glasial
p.a. (9,75 :0:25)
0,8 0,52 2,71 Hasilpeakkromatogram asimetris belum memenuhi
syaratAsantara 0,9-1,2, belum tercapaibaseline
kloroformp.a. : asam asetat glasial
p.a. (9,5 :0:5)
0,95 0,50 2,00 Hasilpeakkromatogram simetris, runcing memenuhi
syaratAsantara 0,9-1,2, tercapaibaseline, Rfantara
0,2-0,8,
0,67 0,62 1,92 Hasilpeakkromatogram asimetris belum memenuhi
syaratAsantara 0,9-1,2, tidak tercapaibaseline
Berikut ini kondisi yang digunakan untuk pemisahan senyawa kurkumin dan berbagai senyawanya:
42
turunan demetoksinya dalam sampel serbuk kunyit dan E. Merck menggunakan fase gerak campuran kloroform p.a. : etanol p.a. : aquadest (25:0,96:0,04) yang memiliki indeks polaritas 4,15.
Gambar 15. Pemisahan kurkumin dari berbagai senyawa dalam OHT “Kiranti” dengan fase gerak kloroformp.a. : etanolp.a: aquadest (25:0,96:0,04)
i. Baku kurkumin konsentrasi 175 ppm (konsentrasi tinggi) ii. Sampel OHT merk “Kiranti®” yang mengandung kurkumin
Pemisahan kurkumin dari berbagai senyawanya dengan fase gerak kloroform p.a. : etanol p.a : aquadest dengan perbandingan 25:0,96:0,04 didapatkan hasil pemisahan yang kurang sempurna pada kromatogram sampel. Pada keruncingan peak diperoleh nilai peak asymmetry factor (As) sebesar 0,5 (tidak memenuhi syarat As yang baik 0,9-1,2). Nilai Rf sudah baik terletak antara
0,2-0,8. Resolusi yang didapat juga sudah cukup baik (≥ 1,5). Kesimpulannya
B
B
i
perlu dilakukan modifikasi fase gerak agar didapat peak yang runcing. Pada penelitian ketika dilakukan modifikasi komposisi fase gerak diperoleh emulsi pada pencampuran fase gerak sehingga tidak dapat dilakukan modifikasi.
b. Pemisahan kurkumin dengan fase gerak kloroform p.a. : asam asetat glasial p.a dengan perbandingan 9,75:0,25. Pemilihan fase gerak ini dilakukan berdasarkan penelitian sebelumnya menggunakan kloroform : etanol : aquadest (25 : 0,96 : 0,04) yang sama-sama memiliki indeks polaritas 4,15. Pemilihan kloroform p.a. dan asam asetat glasial p.a dikarenakan sifat dari kloroform p.a. dan asam asetat glasial p.a. yang dapat melarutkan kurkumin dan kenonpolarannya untuk mengelusi kurkumin.
Gambar 16. Pemisahan kurkumin dari berbagai senyawa dalam OHT “Kiranti” dengan fase gerak kloroformp.a. : asam asetat glasialp.a(9,75:0,25)
i. Baku kurkumin konsentrasi 175 ppm (konsentrasi tinggi) ii. Sampel OHT merk “Kiranti®” yang mengandung kurkumin
ii
B
B
44
Penggunaan fase gerak kloroform p.a : asam asetat glasial p.a. dengan perbandingan 9,75:0,25 seperti tampak pada gambar 16 menunjukkan hasil pemisahan yang kurang baik. Komposisi fase gerak yang kurang cocok menyebabkan analit tidak terelusi secara serentak sehingga tidak tercapai
baseline. Peak yang keluar terlalu cepat atau keluar dalam waktu yang hampir bersamaan akan membentuk peak-peak kromatogram yang hampir menyatu yang juga menyebabkan tidak tercapai baseline. Baseline menandakan analit sudah habis terelusi. Pada baku kurkumin terdapat peak kecil selain kurkumin dikarenakan adanya pengotor pada plat KLT. Pada sampel dihasilkan peak
kurkumin yang asimetris dan bentuk tidak runcing dengan nilai As = 0,8 (tidak memenuhi syarat antara 0,9-1,2). Nilai Rf yang diperoleh sudah memenuhi syarat
antara 0,2-0,8. Resolusi juga sudah memenuhi syarat (≥ 1,5). Perlu dilakukan modifikasi dengan meningkatkan kepolaran agar pemisahan analit memenuhi parameter optimum.
Gambar 17. Pemisahan kurkumin dari berbagai senyawa dalam OHT “Kiranti” dengan fase gerak kloroformp.a. : asam asetat glasialp.a(9,50:0,50) i. Baku kurkumin konsentrasi 175 ppm (konsentrasi tinggi)
ii. Sampel OHT merk “Kiranti®” yang mengandung kurkumin
Pada pemisahan kurkumin dari berbagai senyawanya menggunakan fase gerak kloroformp.a. : asam asetat glasialp.a. (9,50:0,50) dengan indeks polaritas 4,21 diperoleh hasil yang baik dan tercapai baseline karena analit terelusi secara serentak. Data kromatogram menunjukkan peak baku kurkumin hanya terdapat satu peakdan pada sampel didapat peak kurkumin yang runcing dilihat dari nilai
As = 0,95 (memenuhi syarat 0,9-1,2) dengan Rf antara 0,2-0,8. Resolusi yang
diperoleh pada sampel OHT cair merk “Kiranti®” adalah 2 (sudah memenuhi parameter optimum).
B
B
i
46
d. Pemisahan kurkumin dengan fase gerak kloroform p.a. : asam asetat glasial p.a : heksana p.a. dengan perbandingan 8,50:1,00:0,50. Pada fase gerak keempat dilakukan perubahan komposisi fase gerak dengan penambahan heksana
p.a. Hal ini dilakukan untuk meningkatkan kenonpolaran fase gerak (IP = 4,11). Analit kurkumin bersifat non polar sehingga diharapkan lebih banyak berinteraksi dengan fase gerak yang menyebabkan makin cepat terelusi. Pada optimasi metode dicari kondisi optimum dari sistem KLT untuk pemisahan kurkumin, sehingga diperlukan optimasi kombinasi dari fase gerak non polar dan polar. Jika hanya memakai fase gerak polar atau non polar maka polaritas tidak sesuai kurkumin.
Gambar 18. Pemisahan kurkumin dari berbagai senyawa dalam OHT “Kiranti” dengan fase gerak kloroformp.a. : asam asetat glasialp.a: heksanap.a. (8,50:1,00:0,50)
i. Baku kurkumin konsentrasi 175 ppm (konsentrasi tinggi) ii. Sampel OHT merk “Kiranti®” yang mengandung kurkumin
B
Pemisahan dengan fase gerak ini diperoleh hasil peak kromatogram kurkumin yang tidak runcing dan tidak tercapai baseline baik pada standar maupun sampel kurkumin. Pada sampel kurkumin diperoleh nilaiAs= 0,67 (tidak memenuhi syarat antara 0,9-1,2). Nilai Rfdan resolusi yang diperoleh pada sampel
kurkumin adalah 0,62 dan 1,92 (sudah memenuhi syarat). Pada polaritas yang lebih rendah dengan adanya kombinasi heksanap.a., menurut teori, baku maupun sampel kurkumin seharusnya terelusi lebih cepat tetapi hasil yang diperoleh sebaliknya. Hal ini dikarenakan pada fase gerak komposisi empat memiliki polaritas yang lebih rendah daripada polaritas kurkumin. Komposisi fase gerak kloroformp.a. : asam asetat glasialp.a: heksanap.a. (8,50:1,00:0,50) tidak sesuai untuk mengelusi kurkumin karena tidak dapat membawa kurkumin dengan baik. Sehingga metode dengan komposisi fase gerak kloroformp.a. : asam asetat glasial
p.a: heksanap.a. (8,50:1,00:0,50) tidak dapat diaplikasikan untuk OHT cair merk “Kiranti®”.
Berdasarkan data hasil optimasi fase gerak diperoleh kesimpulan bahwa fase gerak komposisi kloroform : asam astetat (9,50:0,50) memenuhi parameter optimasi berupa hasil peak kromatogram yang runcing dengan nilai peak asymmetry factor antara 0,9-1,2, Rf antara 0,2-0,8. nilai resolusi = 2,00. Oleh karenanya dilakukan replikasi tiga kali untuk melihat reprodusibilitasnya. Berikut ini hasil pemisahan kurkumin dari berbagai senyawanya dalam bentuk kromatogram dengan fase gerak kloroform p.a. : asam asetat glasial p.a
48
Replikasi 2
Replikasi 3
Gambar 19. Pemisahan kurkumin dari berbagai senyawa dalam OHT “Kiranti” dengan fase gerak kloroformp.a. : asam asetat glasialp.a(9,50:0,50)
i. Replikasi I ii. Replikasi II iii. Replikasi III
i
ii
Pada tiga kali replikasi diperoleh nilai As dan Rf dari sampel kurkumin
berturut-turut adalah 0,95; 0,90 dan 0,91 serta 0,50; 0,48 dan 0,49. Resolusi untuk ketiga replikasi adalah 2,00 sehingga diperoleh nilai CV 0% (memenuhi syarat kurang dari 2%). Jadi dapat disimpulkan fase gerak komposisi III yaitu kloroform
p.a. : asam asetat glasial p.a.(9,50:0,50) merupakan jenis dan perbandingan komposisi fase gerak optimum dari sistem KLT yang diteliti.
Gambar 20. Interaksi kurkumin dengan fase gerak kloroformp.a. : asam asetat glasial
p.a(9,50:0,50)
Gugus non polar kurkumin akan berinteraksi dengan fase gerak kloroform p.a. melalui interaksi Van der Waals, sedangkan asam asetat glasial
p.a. berinteraksi hidrogen dengan gugus polar dari kurkumin seperti tampak pada gambar 20. Fungsi dari asam asetat untuk mempertahankan stabilitas kurkumin. Dari keseluruhan interaksi kurkumin dengan fase diam dan fase geraknya dapat diketahui bahwa interaksi dengan fase gerak lebih kuat dibanding dengan fase diam. Analit kurkumin sifatnya non polar sehingga interaksi dengan fase gerak semakin kuat dan terelusi secara serentak sehingga terbentukpeakyang simetris.
OCH3 dengan asam asetat glasial
50 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan hasil penelitian, dapat diambil kesimpulan bahwa metode KLT-Densitometri dapat digunakan untuk memisahkan kurkumin dari berbagai senyawanya dalam OHT cair merk “Kiranti®” dengan menggunakan perbandingan komposisi fase gerak kloroform p.a. : asam asetat glasial p.a. (9,50:0,50) dengan parameter bentukpeakkromatogram yang runcing dilihat dari nilaipeak asymmetry factorberturut – turut 0,95, 0,90 dan 0,91; nilaiRf 0,50, 0,48
dan 0,49; resolusi 2,00 dan CV 0%.
B. Saran
Perlu dilakukan validasi metode dan penetapan kadar kurkumin dari berbagai senyawanya dalam OHT cair merk “Kiranti®” dengan menggunakan metode KLT-Densitometri dengan perbandingan komposisi fase gerak kloroform
DAFTAR PUSTAKA
Aggarwal, B.B., 1995, Curcumin Analogues of Curcumin and Novel Uses Thereof, http://www.thepowerhour.com/curcumin/Turmeric.pdf, diakses tanggal 20 September 2010
Aggarwal, B., Bhatt,I.D., Ichikawa, H., Ahn, K.S., Sethi, G., Sandur,
S.K., Sundaram, C., Seeram, N., Shishodia, S., 2006,Curcumin – Biological and Medicinal Properties, http:www.sabinsa.com/products/circumin_book.htm; Piscataway,NJ, diakses tanggal 20 September 2010
Badan POM RI, 2004,SK Kepala Badan Pengawas Obat dan Makanan Republik Indonesia, Nomor HK.00.05.4.2411, Departemen Kesehatan RI, Jakarta Badan POM RI, 2005, Standarisasi Ekstrak Tumbuhan Obat Indonesia, Salah
Satu Tahapan Penting dalam Pengembangan Obat Asli Indonesia, Info POM, 6(4), 1-5
Burdick, Jackson, 2010, Tabel Indeks Polaritas Larutan Kimia, http://macro.lsu.edu/howto/solvents/Polarity%20index.htm, diakses tanggal 9 Desember 2010
Chattopadhyay L., Biswas K., Bandyopadhyay U., Banerjee R. K., 2004, Turmeric And Curcumin:Biological Actions And Medicinal Applications. Curr. Sci., 87, 44-53, http://www.charakayurveda.com/Article/SPICE%20OF%20LIFE.pdf, ;diakses tanggal 28 November 2010
Depkes RI, 1987,Analisis Obat Tradisional, jilid I, Dirjen POM, Jakarta, 1-131 Direktorat Jenderal Pengawasan Obat dan Makanan RI, 1995a, Farmakope
Indonesia,jilid IV, Departemen Kesehatan RI, Jakarta, 1002-1005
Direktorat Jenderal Pengawasan Obat dan Makanan RI, 1995b, Materia Medika Indonesia, edisi VI, Departemen Kesehatan RI, Jakarta, 148-152
Gaikar, V.G., and Dandekar, D.V., 2001, Process for Extraction of Curcuminoids from Curcuma Species,United States Patent, 6, 224,87
Gritter, R. J., Bobbit, J. M., Schwarting, A. E., 1991, Pengantar Kromatografi, diterjemahkan oleh Kosasih Padmawinata, terbitan ke-2, ITB Press, Bandung, 107-155
Gupta, A. P., dkk, 1999,Simultaneous determination of curcuminoids in curcuma samples using high performance thin layer chromatography,
52
atography_Related_Technologies_22_1561.pdf , diakses tanggal 10 Februari 2010
Hanani, 2009, Standarisasi Simplisia dan Ekstrak Daun Handeuleum
(Graptophyllum Pictum),
http://www.lontar.ui.ac.id//opac/themes/libri2/detail.jsp?id=76802&lokasi=l okal, diakses tanggal 24 Januari 2010
Harborne, 1973, Phtochemical methods, diterjemahkan oleh Kosasih Padmawinata dan Iwang Soediro, Terbitan II, Institut Teknologi Bandung, Bandung, 10-11
Hardjono, S., 1983, Kromatografi, Laboratorium Analisa Kimia Fisika Pusat, UGM, Yogyakarta, 32-34
Harmita, 2004, Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya,
Majalah Ilmu Kefarmasian, 121-126
Kementerian Kesehatan RI, 1994, Keputusan Menteri Kesehatan RI Nomor:661/MENKES/VII/1994, Departemen Kesehatan RI, Jakarta.
Khopkar, 1990, Concepts of Analytical Chemistry, diterjemahkan oleh Sapto Raharjo, UI Press, Jakarta
Majeed, M., Badmaev, V., Shirakumar U., and Rajendran, R., 1995,
Curcuminoids antioxidant phytonutrients, NutriScience Publisher Inc., PisCataway, New Jersey, pp.3-80
Martono, S., 1996, Penentuan Kadar Kurkumin secara Kromatografi Lapis Tipis Densitometri,Buletin ISFI, DIY 2 (4), 11-21
Mintarsih, 1990, Penetapan Kadar Alkaloid Kininda dalam Akar, Batang, dan Daun Chinchona Succirubra Pavon et Klotzsch dari Daerah Kaliurang Secara Spektrodensitometri (TLC-Scanner), Skripsi, Universitas Gadjah Mada, Yogyakarta
Mohammad, R., Ahmad, M., Daud, J.M., 2007, Potensi Kurkumin Sebagai Penunjuk pH Semulajadi Untuk Pembangunan Sensor Optik pH, The Malaysian Journal of Analytical Science, Vol 11 No 2, 351-360
Mulja, H.M. dan Suharman, 1995, Analisis Instrumental, Airlangga University Press, Surabaya
Orang Tua Group, 2005, Kiranti Sehat Datang Bulan,