xviii
INTISARI
Metode Kromatografi Lapis Tipis (KLT) Densitometri merupakan metode yang dapat digunakan untuk penetapan kadar asam salisilat dan eugenol dalam sediaan krim topikal. Validasi metode dilakukan ntuk memberikan hasil yang dapat dipercaya sebelum dilakukan proses penetapan kadarnya.
Penelitian ini merupakan penelitian non eksperimental-deskriptif. Asam salisilat dan eugenol dipisahkan dengan metode KLT dengan fase diam silika gel 60 F254 dan fase gerak toluena : etil asetat : metanol (65,2 : 2,4 : 32,4), serta
dengan jarak pengembangan sejauh 15 cm. Setelah pemisahan senyawa dengan metode KLT, kemudian dilakukan analisis kuantitatif dengan densitometer pada panjang gelombang 288 nm. Parameter validasi metode yang diteliti adalah selektivitas, linearitas, perolehan kembali, presisi, danrange.
Hasil penelitian menunjukkan metode ini memiliki selektivitas dengan nilai resolusi 5,125. Nilai linearitas untuk asam salisilat dengan nilai r20,9972 dan untuk eugenol dengan nilai r2 0,9972, nilai rata-rata % recovery 91,958% untuk asam salisilat dan 42,595% untuk eugenol, nilai %CV untuk level kadar rendah, sedang dan tinggi berturut-turut adalah 2,3360%; 0,9778%; 0,8958% untuk asam salisilat dan untuk eugenol berturut-turut adalah 1,0065%; 1,2278%; dan 0,8365%. Berdasarkan hasil tersebut maka metode KLT-Densitometri ini memiliki kemampuan yang kurang baik untuk memisahkan asam salisilat dan eugenol.
xix
ABSTRACT
A simple and rapid thin layer chromatography (TLC) densitometry method can be use to determine the concentration of methyl salicilate and eugenol in topical cream. To guarantees the method used provide reliable results, it is necessary to validate this methode.
In this non-experimental descriptive research. Salicylate acid and eugenol in the sample are determined by indirectly measure method. The sampel extracts were spotted on TLC silica gel F254plates, which were developed with a mixture
of toluene, ethyl acetate and methanol 65,2 : 2,4 : 32,4 (v/v). Quantitative spots at 288 nm. Validation parameters are selectivity, linearity, recovery, precision and range.
The result showed resolution value 5,125, linearity which is showed on coefficient of determination 0,9972 for salicylic acid and 0,9972 for eugenol mean of recovery is 91,958% for salicylate acid and 42,595% for eugenol, the %CV value for low, medium and high concentration respectively are 2,3360%; 0,9778%; 0,8958% for salicylate acid and 1,0065%; 1,2278%; dan 0,8365% for eugenol. Base from the result, this method have not good capabilities for separate salicylate acid and eugenol.
i
VALIDASI METODE ANALISIS PADA CAMPURAN EUGENOL DAN METIL SALISILAT DALAM SEDIAAN KRIM MEREK “X”
MENGGUNAKAN METODE KLT-DENSITOMETRI
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh:
Dhimas Bayu Kinasih NIM: 088114180
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
Halaman Persembahan
Hidup itu pilihan....
Yang harus kita tentukan arah dan tujuannya...
Dio has Belissimo piano nella mia vita, e’ credo io
Aku persembahkan karya ku ini untuk:
Papa dan mama ku tercinta beserta kakak dan adikku
vii PRAKATA
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala
perlindungan dan berkat yang telah diberikan sehingga skripsi berjudul “Validasi
Metode Analisis Pada Campuran Eugenol dan Metil Salisilat dalam Sediaan Krim
Merek “x” Menggunakan Metode KLT-Densitometri” yang disusun untuk
memenuhi persyaratan memperoleh gelar Sarjana Strata Satu Program Studi
Farmasi (S.Farm.) dapat dikerjakan dengan baik dan lancar.
Penulis menyadari bahwa penulisan skripsi ini tidak terlepas dari
berbagai pihak. Kesempatan ini penulis pergunakan untuk mengungkapkan rasa
terima kasih kepada:
1. Ipang Djunarko, M.Sc., Apt. selaku dekan Universitas Sanata Dharma yang
telah mengijinkan penulis menjalankan pembelajaran selama masa studi.
2. Jeffry Julianus, M.Si., selaku Dosen Pembimbing Skripsi dan Dosen
Pembimbing Akademik yang telah mendampingi dan memberikan saran
selama pembuatan tugas akhir ini.
3. Lucia Wiwid Wijayanti, M.Si., selaku dosen penguji yang bersedia
memberikan waktu untuk diskusi serta kritik dan saran selama penyusunan
skripsi.
4. Dra. M. M. Yetty Tjandrawati, M.Si., selaku dosen penguji yang telah
viii
5. Mas Bimo, Mas Parlan, dan Mas Kunto selaku staff laboratorium Fakultas
Farmasi Universitas Sanata Dharma yang telah membantu penulis dalam
pengerjaan penelitian di laboratorium.
6. Segenap dosen dan karyawan atas ilmu yang diberikan.
7. A.J. Bambang Budiono, E. Ambar Setyaningsih, Purwaningtyas Permata Sari
dan Intan Kurnia Christiani yang selalu memberikan semangat dan doa nya
kepada penulis.
8. Vica dan Seco sebagai sahabat dan rekan kerja yang telah menyediakan
waktu untuk memberikan saran dan kritik baik dalam hal penyusunan tugas
akhir maupun hal-hal lainnya serta bekerja bersama di laboratorium.
9. Christiana Lambang Kristanti yang selalu mendukung penulis dalam
pembuatan tugas akhir ini, terutama di saat penulis sedang kehilangan
semangat.
10. Teman-teman FST dan FKK 2008 yang selalu menyemangati penulis dalam
pembuatan tugas akhir ini.
11. Tante Usi, Satya, Brian, Kak Cos, Aga, Mbak Dju, Cici, yang selalu
memberikan semangat dan penghiburan selama ini.
12. Happy, Velly, Paul, Adi yang selalu bersedia untuk berdiskusi.
13. Seluruh teman, baik di Fakultas Farmasi maupun teman-teman lain atas
dukungannya.
14. Semua pihak yang tidak dapat penulis sebutkan satu per satu sehingga penulis
ix
Penulis menyadari bahwa tugas akhir ini belum sempurna dan masih
banyak kekurangan sehingga penulis berharap kritik dan saran dari semua pihak.
Akhir kata, penulis berharap semoga tugas akhir ini dapat bermanfaat bagi semua
pihak terutama di bidang ilmu Farmasi.
x DAFTAR ISI
HALAMAN JUDUL... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN PENULIS ... v
LEMBAR PERNYATAN PERSETUJUAN PUBLIKASI KARYA ... vi
PRAKATA... vii
DAFTAR ISI... x
DAFTAR TABEL... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvii
INTISARI... xix
ABSTRACT... xx
BAB I PENGANTAR ... 1
A. Latar Belakang ... 1
1. Rumusan Permasalahan ... 4
2. Keaslian Penelitian... 4
3. Manfaat Penelitian ... 5
B. Tujuan Penelitian ... 5
BAB II PENELAAHAN PUSTAKA... 6
A. Eugenol ... 6
xi
C. Krim ... 11
D. Kromatografi Lapis Tipis Densitometri ... 15
a. Kromatografi Lapis Tipis ... 15
b. Fase Diam ... 16
c. Fase Gerak ... 18
d. Penotolan sampel ... 18
e. Pengembangan... 19
f. Analisis Kualitatif dan Kuantitatif ... 19
g. Densitometri... 20
E. Validasi Metode Analisis………... 21
a. Selektivitas (selectivity)………... 23
b. Ketepatan (accuracy)………. . 24
c. Ketelitian (precision)………... 25
d. Linearitas (linearity)……….... 26
e. Rentang (range)………... 27
f. Batas deteksi (limit of detection)………. .... 27
g. Batas kuantifikasi (limit of quantification)………... .. 28
i. Ketangguhan metode……….... 28
j.Kekuatan (robustness)………... 28
F. Landasan Teori ... 29
G. Hipotesis ... 30
BAB III METODOLOGI PENELITIAN... 31
xii
1. Variabel Penelitian ... 31
2. Variabel bebas ... 31
3. Variabel terkendali ... 31
4. Variabel pengacau terkendali ... 31
B. Definisi Operasional ... 32
C. Bahan Penelitian ... 32
D. Alat Penelitian ... 33
E. Tata Cara Penelitian ... 33
1. Pembuatan Fase Gerak ... 33
2. PenjenuhanChamber... 33
3. Pengaktifan fase diam... 34
4. Pembuatan larutan baku tunggal asam salisilat ... 34
5. Pembuatan larutan baku tunggal eugenol ... 34
6. Pembuatan larutan baku campuran asam salisilat dan eugenol ... 35
7. Penetapan panjang gelombang pengamatan ... 35
8. Penetapan kurva baku asam salisilat dan eugenol dan pengamatan nilaiRetardation Factor(Rf) asam salisilat dan eugenol ... 36
9. Validasi Metode ... 36
10. Preparasi sampel………. 37
F. Analisis hasil ... 38
BAB IV HASIL DAN PEMBAHASAN ... 40
xiii
B. Fase Gerak ... 46
C. Pembuatan Larutan Baku ... 47
D. Penentuan Panjang Gelombang Pengamatan Asam Salisilat dan Eugenol 48 E. Analisa Kualitatif ... 49
F. Penetapan Kurva Baku Asam Salisilat dan Eugenol ... 51
G. Validasi Metode………. 54
1. Selektifitas... 55
2. Uji Perolehan Kembali (Recovery) ... 56
3. Presisi……… 57
4. Linearitas……….. 59
5. Rentang……….. 59
BAB V KESIMPULAN ... 60
Kesimpulan ... 60
Saran... . 61
DAFTAR PUSTAKA ... 62
LAMPIRAN ... 66
xiv
DAFTAR TABEL
Tabel I. Tata Nama Lempeng KLT... 16
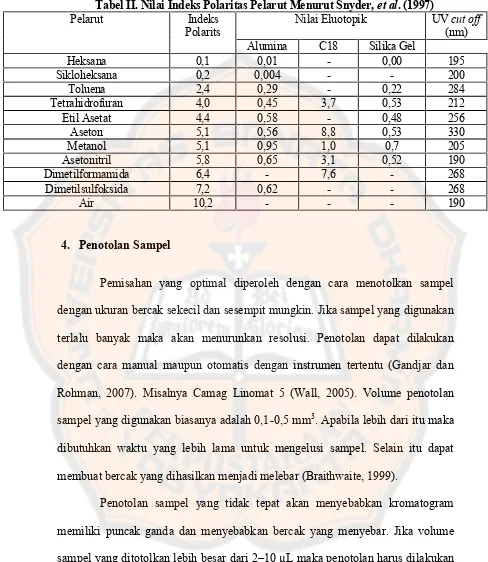
Tabel II. Nilai Indeks Polaritas Pelarut ... 17
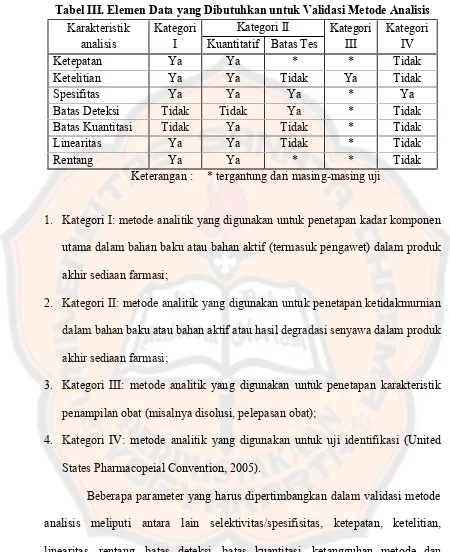
Tabel III. Elemen Data yang Dibutuhkan untuk Validasi Metode Analisis……… .... 21
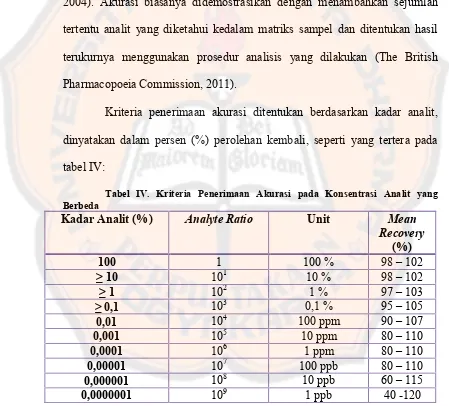
Tabel IV. Kriteria Penerimaan Akurasi pada Konsentrasi Analit yang Berbeda ... 24
Tabel V. Kriteria Penerimaan Presisi pada Konsentrasi Analit yang Berbeda... 25
Tabel VI. Konsentrasi Asam salisilat vs AUC ... 53
Tabel VII. Konsentrasi Eugenol vs AUC... 54
Tabel VIII. Perbandingan Nilai Resolusi dan Nilai Rfpada Baku Asam Salisilat dan Eugenol………... 56
Tabel IX. Data % KV Asam Salisilat Tunggal………. 59
Tabel X. Data % KV Eugenol Tunggal... 59
xv
DAFTAR GAMBAR
Gambar 1. Struktur Eugenol... 6
Gambar 2. Struktur Metil Salisilat ... 9
Gambar 3. Struktur silika gel ... 15
Gambar 4. Interaksi hidrogen antara gugus silanol dengan air membentuk lapisan air multilayer ... 16
Gambar 5. Alat densitometri ... 20
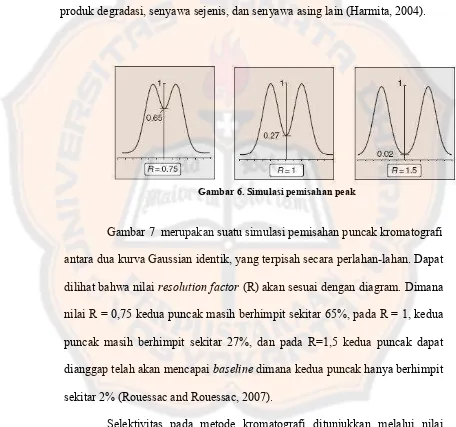
Gambar 6. Simulasi pemisahan peak ... 22
Gambar 7. Reaksi hidrolisis metal salisilat menjadi asam salisilat ... 42
Gambar 8. Reaksi pembentukan garam natrium eugenol... 43
Gambar 9. Densitogram pemanasan sampel selama 1 jam ... 44
Gambar 10. Densitogram pemanasan sampel selama 2 jam ... 44
Gambar 11. Densitogram pemanasan sampel selama 3 jam ... 45
Gambar 12. Densitogram pemanasan sampel selama 4 jam ... 45
Gambar 13. Reaksi pembentukan eugenol dari garam natrium eugenol.. 46
Gambar 14. Profil spectra baku analit……… . 49
Gambar 15. Densitogram baseline, baku asam salisilat, baku eugenol dan baku campuran asam salisilat dan eugenol……… .. 51
Gambar 16. Gambar bagian non polar dari eugenol dan asam salisilat………... 52
Gambar 17. Kurva baku hubungan konsentrasi asam salisilat vs AUC .. 54
xvi
DAFTAR LAMPIRAN
Lampiran 1. Certificate of AnalysisBaku Asam Salisilat ... 67
Lampiran 2. Certificate of AnalysisBaku Eugenol ... 68
Lampiran 3. Data Pengambilan Bahan dan Perhitungan Konsentrasi Sebenarnya………... .. 68
Lampiran 4. Perhitungan Indeks Polaritas Fase Gerak ... 73
Lampiran 5. Spektra Panjang Gelombang Asam Salisilat dan Eugenol dengan Perbandingan 1,5 : 1 pada Tiga Tingkat Konsentrasi Rendah, Sedang, dan Tinggi ... 74
Lampiran 6. Standar Operasional Prosedur (SOP) Analisis Kuantitatif . 75 Lampiran 7. Densitogram Seri Kurva Baku Asam Salisilat Replikasi 1 76 Lampiran 8. Densitogram Seri Kurva Baku Asam Salisilat Replikasi 2 79 Lampiran 9. Densitogram Seri Kurva Baku Asam Salisilat Replikasi 3 81 Lampiran 10. Data Penentuan Kurva Baku Asam Salisilat ... 83
Lampiran 11.Persamaan Regresi Linear dan Gambar Grafik Seri Kurva Baku Asam Salisilat ... 84
Lampiran 12. Densitogram Seri Kurva Baku Eugenol Replikasi 1 ... 85
Lampiran 13. Densitogram Seri Kurva Baku Eugenol Replikasi 2 ... 88
Lampiran 14. Densitogram Seri Kurva Baku Eugenol Replikasi 3 ... 91
Lampiran 15. Data Penentuan Kurva Baku Eugenol ... 93
xvii
Lampiran 17. Densitogram Baku Tunggal Asam Salisilat
(Validasi Metode Analisis) ... 94
Lampiran 18. Densitogram Baku Tunggal Eugenol
(Validasi Metode Analisis)... 99
Lampiran 19. Densitogram Baku Campuran Asam Salisilat
dan Eugnol gfg (Validasi Metode Analisis) ... 103
xviii INTISARI
Metode Kromatografi Lapis Tipis (KLT) Densitometri merupakan metode yang dapat digunakan untuk penetapan kadar asam salisilat dan eugenol dalam sediaan krim topikal. Validasi metode dilakukan ntuk memberikan hasil yang dapat dipercaya sebelum dilakukan proses penetapan kadarnya.
Penelitian ini merupakan penelitian non eksperimental-deskriptif. Asam salisilat dan eugenol dipisahkan dengan metode KLT dengan fase diam silika gel 60 F254 dan fase gerak toluena : etil asetat : metanol (65,2 : 2,4 : 32,4), serta dengan jarak pengembangan sejauh 15 cm. Setelah pemisahan senyawa dengan metode KLT, kemudian dilakukan analisis kuantitatif dengan densitometer pada panjang gelombang 288 nm. Parameter validasi metode yang diteliti adalah selektivitas, linearitas, perolehan kembali, presisi, danrange.
Hasil penelitian menunjukkan metode ini memiliki selektivitas dengan nilai resolusi 5,125. Nilai linearitas untuk asam salisilat dengan nilai r20,9972 dan untuk eugenol dengan nilai r2 0,9972, nilai rata-rata % recovery 91,958% untuk asam salisilat dan 42,595% untuk eugenol, nilai %CV untuk level kadar rendah, sedang dan tinggi berturut-turut adalah 2,3360%; 0,9778%; 0,8958% untuk asam salisilat dan untuk eugenol berturut-turut adalah 1,0065%; 1,2278%; dan 0,8365%. Berdasarkan hasil tersebut maka metode KLT-Densitometri ini memiliki kemampuan yang kurang baik untuk memisahkan asam salisilat dan eugenol.
xix ABSTRACT
A simple and rapid thin layer chromatography (TLC) densitometry method can be use to determine the concentration of methyl salicilate and eugenol in topical cream. To guarantees the method used provide reliable results, it is necessary to validate this methode.
In this non-experimental descriptive research. Salicylate acid and eugenol in the sample are determined by indirectly measure method. The sampel extracts were spotted on TLC silica gel F254plates, which were developed with a mixture of toluene, ethyl acetate and methanol 65,2 : 2,4 : 32,4 (v/v). Quantitative spots at 288 nm. Validation parameters are selectivity, linearity, recovery, precision and range.
The result showed resolution value 5,125, linearity which is showed on coefficient of determination 0,9972 for salicylic acid and 0,9972 for eugenol mean of recovery is 91,958% for salicylate acid and 42,595% for eugenol, the %CV value for low, medium and high concentration respectively are 2,3360%; 0,9778%; 0,8958% for salicylate acid and 1,0065%; 1,2278%; dan 0,8365% for eugenol. Base from the result, this method have not good capabilities for separate salicylate acid and eugenol.
1 BAB I
PENGANTAR
A. Latar Belakang
Masalah otot yang sering menyerang banyak orang merupakan hal yang
sudah sering terjadi. Hal tersebut dapat membuat ketidaknyamanan dari penderita.
Untuk meredakan masalah tersebut biasanya digunakan obat gosok ataupun
sediaan topikal yang dapat memberikan sensasi panas ketika digunakan dan dapat
meredakan rasa sakit yang terjadi pada otot. Salah satu sediaan topikal yang
sering digunakan untuk meredakan masalah otot tersebut adalah krim merek “x”
yang didalamnya terdapat senyawa eugenol dan metil salisilat serta menthol yang
dapat berfungsi sebagai analgesik sehingga dapat meredakan rasa sakit tersebut.
Eugenol dan metil salisilat dapat memberikan efek analgesik, oleh sebab
itu eugenol dan metil salisilat biasa digunakan dalam sediaan krim analgesik.
Eugenol merupakan senyawa aktif bahan alam yang merupakan kandungan utama
dari minyak cengkeh. Senyawa tersebut merupakan golongan fenol yang tak larut
air, namun akan berubah menjadi bentuk garam fenolik yang larut air oleh
penambahan basa seperti natrium hidroksida (NaOH) dan kalium hidroksida
(KOH).
Metil salisilat dapat diklasifikasikan sebagai analgesik topikal yang biasa
ditambahkan dalam krim analgesik untuk mengurangi rasa nyeri yang merupakan
golongan fenol ester yang dapat mengalami hidrolisis pada esternya karena
Perlakuan yang dilakukan selama preparasi sampel dapat mengubah
metil salisilat dalam sediaan menjadi asam salisilat karena metil salisilat dapat
mudah terhidrolisis dengan adanya air. Hal ini menimbulkan permasalahan
tersendiri sehingga perlu dilakukan penetapan kadar pada produk tersebut.
Pemanasan menggunakan refluks serta pemecahan sampel menggunakan natrium
hidroksida dapat membuat ester yang ada dalam metil salisilat tersebut
terhidrolisis menjadi garam karboksilat melalui reaksi saponifikasi. Penetralan
kembali menggunakan asam klorida (HCl) dapat merubah garam karboksilat
tersebut menjadi suatu asam, sehingga senyawa metil salisilat tersebut dapat
berubah menjadi asam salisilat. Oleh karena itu pada proses penetapan kadar metil
salisilat ini merupakan penetapan kadar secara tidak langsung.
Dalam krim merek “x” tersebut terdapat kandungan eugenol sebesar 13,6
mg dan metil salisilat sebesar 102 mg. Penggunaan eugenol dan metil salisilat
yang tidak sesuai dengan dosis yang dianjurkan dapat menyebabkan iritasi pada
kulit. Adanya cahaya dapat membuat kestabilan dari eugenol akan berubah
sedangkan suhu akan mempengaruhi kestabilan dari metil salisilat. Akibat dari
perubahan kestabilan dari eugenol dan metil salisilat maka akan menyebabkan
perubahan kadar yang ada pada sediaan tersebut. Sehingga efek farmakologi yang
diharapkan bisa tidak tercapai. Untuk menjamin mutu dan kualitas dari sediaan
krim merek “x” tersebut perlu dilakukan penetapan kadar eugenol dan metil
salisilat yang ada dalam produk krim merek “x” tersebut. Sebelum dilakukan
menjamin metode yang akan digunakan telah memenuhi parameter yang
dipersyaratkan sehingga hasilnya dapat dipercaya.
Validasi metode yang dilakukan pada penelitian ini menggunakan
metode Kromatografi Lapis Tipis (KLT) Densitometri. Dipilih metode
KLT-densitometri karena merupakan metode yang sederhana dalam pemisahan suatu
senyawa dalam campuran. Dibandingkan dengan kromatografi kolom,
kromatografi lapis tipis memberikan fleksibilitas yang lebih besar, dalam memilih
fase gerak. Selain itu pada KLT semua komponen dalam sampel dapat dideteksi
(Rohman, 2009).
Pada penelitian ini, penulis mengacu kepada penelitian yang dilakukan
oleh Ediningtyas (2012) dengan judul Optimasi Metode KLT-Densitometri pada
Penetapan Metil salisilat dan Eugenol dalam sediaan krim merek “x”. Pada
penelitian tersebut pemisahan asam salisilat dan eugenol yang optimum diperoleh
dengan menggunakan fase gerak toluena : etil asetat : metanol (65,2 : 2,4 : 32,4)
dan fase diam silika gel 60 F254. Untuk dapat memastikan apakah metode tersebut
dapat digunakan untuk penetapan kadar perlu dilakukan validasi metode analisis.
Metode tersebut harus sesuai dengan persyaratan yang telah ditetapkan
berdasarkan parameter-parameter validasi yakni selektivitas, presisi, linearitas,
dan nilai perolehan kembali (recovery).
1. Rumusan Permasalahan
Berdasarkan latar belakang di atas, maka dapat disusun permasalahan
sebagai berikut: apakah metode KLT-Densitometri dengan fase diam silika gel 60
validitas yang baik untuk menetapkan kadar metil salisilat dan eugenol dalam
sediaan krim merek “x” yang didasarkan pada parameter selektivitas, akurasi,
presisi, linearitas, dan rentang?
2. Keaslian Penelitian
Berbagai penelitian mengenai eugenol dan metil salisilat telah banyak
dilakukan namun penelitian mengenai penetapan kadar eugenol dan metil salisilat
dalam sediaan krim merek “x” dengan menggunakan metode KLT-Densitometri
belum pernah dilakukan.
Penelitian yang pernah dilakukan adalah Perbandingan Kadar Eugenol
Minyak Atsiri Bunga Cengkeh ( Syzygium aromaticum (L.) Meer. & Perry) dari
Maluku, Sulawesi, Jawa dan Sumatra dengan Metode GC-MS oleh Harnani
(2010). Penelitian selanjutnya yang pernah dilakukan adalahHigh-pressure liquid chromatographic determination of acetylsalicylic acid, salicylic acid, diflunisal, indomethacin, indoprofen and indobufenyang dilakukan oleh Bollet al.,(1981).
Namun metode Kromatografi Lapis Tipis densitometri menggunakan
fase gerak toluena : etil asetat : metanol (65,2 : 2,4 : 32,4) belum pernah dilakukan
untuk menetapkan kadar eugenol dan metil salisilat dalam krim merek “x”.
3. Manfaat Penelitian
a. Manfaat praktis. Dapat memberikan pengetahuan mengenai kualitas
dan mutu sediaan krim topikal yang berhubungan dengan keamanan dan khasiat
b. Manfaat teoritis. Dapat menjadi salah satu acuan dalam penetapan
kadar eugenol dan metil salisilat dalam sediaan krim dengan menggunakan
metode KLT-Densitometri.
B.Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui validitas metode
KLT-Densitometri dengan fase diam silika gel 60 F254dan fase gerak toluen : etil asetat
: metanol (65,2 : 2,4 : 32,4) yang digunakan untuk analisis kadar metil salisilat
dan eugenol dalam sediaan krim merek “x” yang didasarkan pada parameter
6 BAB II
PENELAAHAN PUSTAKA
A. Eugenol
Komponen utama yang dimiliki oleh minyak cengkeh adalah eugenol
yang merupakan minyak atsiri yang berbentuk cairan tidak berwarna atau kuning
pucat, memiliki bobot molekul 164,20 g/mol. Kelarutan senyawa ini baik dalam
etanol, kloroform, eter, dan minyak lemak, namun sukar larut dalam air. Senyawa
ini memiliki bau khas cengkeh yang kuat, menusuk dan rasa pedas. Bobot jenis
eugenol antara 1,064 g/mL - 1,070 g/mL (Budavari, 2001). Nilai dari
eugenol dalam etanol sebesar 406 dengan λmaks 231,5 nm dan 193 pada λmaks
282 nm (Clarke, 1971). Eugenol memiliki nama lain
2-metoksi-4-(prop-2-enil)fenol yang akan menghitam apabila terpapar oleh udara atau dengan bau yang
sangat kuat. Rumus bangun dari eugenol adalah C10H12O2 (The Department of
Health, 2010a ).
Gambar 1. Struktur eugenol (The Department of Health, 2010a)
Eugenol selain memiliki harum yang khas juga memiliki aktifitas sebagai
analgesik (Thompson et al., 1988). Selain digunakan untuk bahan penambah
aroma, eugenol juga mempunyai sifat stimulant, anestetik lokal, karminatif,
pasta gigi, parfum dan produk farmasi. Penggunaan eugenol dalam produk
farmasi di antaranya balsam untuk mengurangi rasa nyeri, obat sakit gigi, dan
bahan campuran untuk menambal gigi (Nurdjannah, 2011).
Senyawa ini dapat dengan mudah dipisahkan dari senyawa-senyawa
bukan fenolat dengan mengekstraksi minyak daun cengkeh dengan larutan
natrium hidroksida. Pengasaman larutan alkali menghasilkan kembali eugenol
(Nurdjannah, 2011).
Eugenol memiliki nilai konstanta Henry sebesar 0,2 Pa.m3/mol (EFSA,
2012). Volatilitas dapat menyebabkan senyawa organik memiliki tendensi untuk
melepaskan diri dari fase cairan menuju fase gas. Parameter volatilitas mengacu
pada hukum Henry. Hukum Henry tersebut adalah:
H’ = KD =
Dari persamaan tersebut diketahui bahwa hukum Henry (H) atau bisa
disebut sebagai perbandingan distribusi (KD) dipengaruhi oleh perbandingan
antara fase gas suatu senyawa (Xg) dengan fase cairan dari suatu senyawa (Xl).
Semakin besar fase gas suatu senyawa dibandingkan dengan fase cairan suatu
senyawa akan membuat nilai hukum Henry akan semakin besar, sehingga
kemungkinan senyawa tersebut menguap dari suatu larutan akan semakin besar.
Menurut persamaan itu pula nilai hukum Henry dapat diperkirakan apabila
konsentrasi senyawa pada fase gas berada dalam keadaan seimbang dengan fase
cairannya.
1. Nonvolatile: nilai volatilitas berdasarkan hukum Henry sebesar H < 3 x 10-7
atm.m3/mol.
2. Semivolatile: nilai volatilitas diantara 3 x 10-7 atm.m3/mol < H < 10-5
atm.m3/mol.
3. Volatile: nilai volatilitas antara 10-5atm.m3/mol < H < 10-3atm.m3/mol.
4. Highvolatile: nilai volatilitas sebesar H > 10-3atm.m3/mol (Mitra, 2003).
Hasil konversi satuan dari atm menjadi pascal (1 atm = 101325 pa) adalah
sebagai berikut:
1. Nonvolatile: 3 x 10-7 atm.m3/mol menjadi 0,03039 Pa.m3/mol. Nilai H <
0,03039 Pa.m3/mol.
2. Semivolatile: 10-5 atm.m3/mol menjadi 1,013 Pa.m3/mol sehingga nilai
volatilitas antara 0,03039 Pa.m3/mol < H < 1,013 Pa.m3/mol.
3. Volatile: 10-3 atm.m3/mol menjadi 101,325 Pa.m3/mol sehingga nilai
volatilitas antara 3,0398 Pa.m3/mol < H < 101,325 Pa.m3/mol.
4. Highvolatile:H > 101,325 Pa.m3/mol.
Dari hasil konversi tersebut, eugenol dapat dimasukkan dalam kategori
semivolatilekarena memiliki nilai volatilitas sebesar 0,2 Pa.m3/mol.
B. Metil Salisilat
Metil salisilat biasa ditemukan dalam tanamanwintergreen,namun untuk
saat ini keberadaan dari metil salisilat telah banyak ditemukan karena sudah dapat
dibuat sintesis dari asam salisilat (Astuti, 2006).
Zat tersebut terdiri dari tidak kurang 99,0% b/b dan tidak lebih dari
larut dalam air, larut dalam alkohol, minyak lemak dan minyak esensial (The
Department of Health, 2010b ).
Senyawa ini berbentuk cair tak berwarna, kekuningan atau kemerahan
dengan bau khas seperti gandapura (Direktorat Jenderal Pengawasan Obat dan
Makanan RI, 1995).
Nilai dari metil salisilat dalam etanol sekitar 570 pada λmaks 238
nm dan 280 pada λmaks 306 nm, sedangkan nilai dari asam salisilat dalam
0,5 N natrium hidroksida (NaOH) sebesar 260 pada λmaks 300 nm (Clarke, 1971)
dan dalam etanol 95% sebesar 262 pada λmaks 300 nm (Ahlneck and Alderborn,
1988).
Dalam dunia pengobatan, metil salisilat digunakan sebagai analgesik
topikal yang biasa digunakan untuk menghilangkan rasa nyeri arthritis dan biasa
digunakan pada produk-produk farmasetik maupun kosmetik. Biasanya pada
produk-produk farmesetik ini, penggunaan metil salisilat ditambahkan dengan
mentol untuk memberikan daya analgesik yang lebih kuat. Produk akhirnya bisa
berupa balsam, krim, minyak atau salep (Rhodia, 2011).
Gambar 2. Struktur Metil Salisilat ( The Departement of Health, 2010b)
Keberadaan air dalam sediaan metil salisilat dapat menyebabkan senyawa
ini mengalami hidrolisis pada bagian ester pada senyawa tersebut. Asam
sebagai hidrolisis basa. Prosedur umum pembentukan asam karboksilat
melibatkan refluks ester dalam NaOH 6M sampai campuran menjadi homogen,
menunjukkan garam karboksilat larut dalam air, RCO2-. Pengasaman campuran
selama work-up menghasilkan asam karboksilat (Newton, 2011). Hidrolisis
dilakukan dengan menggunakan refluks ketika senyawa yang akan dihidrolisis
tersebut merupakan senyawa yang volatil sehingga dapat meminimalkan jumlah
ester yang hilang (Gearien and Grabowski, 1969).
Ester yang mengalami hidrolisis biasanya akan berubah menjadi alkohol
ataupun asam bebas oleh adanya air. Kecepatan dari reaksinya akan meningkat
oleh adanya peningkatan suhu dan dengan penambahan katalis asam atau basa.
Penambahan basa tidak hanya mengkatalis proses hidrolisis, tapi juga bereaksi
dengan produk asam bebas yang terbentuk dan menghasilkan bentuk garam
(Gearien and Grabowski, 1969). Metil salisilat yang dihidrolisis dengan larutan
basa, maka setiap mol garam salisilat yang terbentuk setara dengan jumlah mol
ester yang terhidrolisis. Penambahan basa NaOH akan mengubah metil salisilat
menjadi bentuk garam natrium salisilat. Penggunaan asam dibutuhkan untuk
membentuk senyawa asam bebas hasil dari reaksi hidrolisis dan menetralkan sisa
basa yang tidak bereaksi.
C. Krim
Krim adalah sediaan setengah padat berupa emulsi yang mengandung
Sediaan krim biasa digunakan untuk kulit dan mukus membran yang bertujuan
untuk melindungi, terapi dan mencegah penyakit (The Department of Health,
2010c).
Sediaan semisolid ini diformulasi sebagai emulsi minyak dalam air atau
air dalam minyak. Saat ini krim lebih diarahkan untuk produk minyak dalam air
atau dispersi mikrokristal asam-asam lemak atau alkohol berantai panjang dalam
air yang dapat dicuci dengan tujuan estetika dan untuk penggunaan kosmetika
(Direktorat Jenderal Pengawasan Obat dan Makanan RI, 1995). Vanishing
creams, merupakan salah satu basis yang sering digunakan dalam formulasi
produk farmasetik dan kosmetik (ScienceLab, 2005a).
Komponen-komponen vanishing creams terdiri atas asam stearat, basa,
poli-ol dan air. Basa yang digunakan akan membentuk sabun dengan asam stearat
sehingga membentuk emulsi. Poli-ol seperti gliserin akan membuat krim menjadi
lebih mudah disebarkan (spreadable) dan juga berperan sebagai humektan yang
menjaga kelembaban krim dan pecahnya krim selama penyimpanan dalam
container. Packaging krim dilakukan dalam screwtop jar atau tube yang juga
berperan dalam mempertahankan kandungan air dalam krim (Bennett, 2012).
Komposisi dari vanishing creams adalah Stearyl alcohol, Cetyl alcohol,
Myristic alcohol, Dodecyl alcohol, Glycerol monostearate, Polyoxyl 20
cetostearyl ether, Sorbitol, Isopropyl palmitate, Methyl paraben, Propyl paraben,
Pada emulsi, pelepasan minyak dari emulsi oil in water (O/W) dan
pemisahan minyak dengan air menjadi dua fase merupakan suatu proses yang
biasa disebut demulsifikasi (Rajaković and Skala, 2004).
Teknik demulsifikasi dapat dilakukan dengan beberapa metode sebagai
berikut:
1. Pemanasan, pendinginan, penambahan surface active material, penyaringan, penambahan fase luar secara berlebihan.Adanya pemanasan
dapat meningkatkan driving force molekul emulsi sehingga bisa
menggabungkan molekul yang sejenis. Pendinginan menyebabkan lepasnya
air dari emulsi. Penambahan surface active material dapat menyebabkan
koalesensi karena adanya perubahan tegangan antar muka. Penyaringan akan
menyebabkan butir-butir fase intern akan menggumpal menjadi satu.
Penambahan fase luar secara berlebihan akan menyebabkan memodifikasi
viskositas dari fase luar. Ketika viskositas fase luar menurun maka ukuran
droplet akan meningkat sehingga proses koagulasi akan lebih mudah terjadi
(Anief, 2000).
2. Pengadukan mekanis dan sentrifugasi dengan kecepatan tinggi. Adanya
pengadukan mekanis dapat merusak struktur molekul emulsifier atau merubah
posisi molekul emulsifier yang sudah mapan pada lapisan antarmuka sehingga
hal ini memungkinkan terjadinya penggabungan kembali molekul-molekul
fase yang sejenis. Sentrifugasi berkecepatan tinggi akan menyebabkan fase
jenis lebih besar berada di bawah. Hal ini mengakibatkan terbentuknya lapisan
minyak di bagian permukaan krim (Beall, 1984).
3. Radiasi microwave. Radiasi ini ditujukan untuk tipe emulsi W/O dengan tujuan untuk memisahkan air dari minyak. Ketika emulsi W/O dipanaskan
dengan radiasi maka peningkatan suhu mengakibatkan penurunan viskositas
dan koalesensi. Viskositas minyak yang merupakan fase luar sangat sensitif
terhadap perubahan suhu. Ketika viskositas menurun, ukuran droplet akan
meningkat. Suhu yang meningkat dan viskositas yang menurun akan membuat
proses koagulasi lebih mudah terjadi (Fang, Chang, Lai, and Klaila, 1988).
4. Pengaliran listrik bertegangan.Proses ini dilakukan dengan mengaliri listrik
bertegangan pada emulsi sehingga menimbulkan panas. Adanya panas akan
meningkatkan pergerakan molekul, tabrakan antara molekul sejenis akan
menyebabkan terpecahnya emulsi (Larson, Raghuraman, and Wiencek, 1994).
5. Penambahan magnetik ampifilik. Proses demulsifikasi ini hanya dapat
digunakan untuk tipe emulsi O/W. Magnetik ampifilik terdiri dari 2 matriks
yaitu hidrofilik (SiO2 dan Al2O3) dan lipofilik yang berukuran nano (carbon
nanotubes dan nanofibers). Partikel ampifilik akan terdifusi pada permukaan
droplet emulsi O/W. Keberadaan dari magnet nanohybrid akan menarik dan
membawa droplet minyak untuk menghasilkan demulsifikasi yang sempurna
sehingga akan memisahkan minyak dari air (Oder, 2005).
6. Penambahan senyawa kimia. Proses ini hanya digunakan untuk tipe emulsi
O/W. Senyawa kimia yang ditambahkan dalam emulsi dapat memecah emulsi.
muka, menetralkan muatan pada surfaktan, menarik fase air dan membuat
presipitasi surfaktan. Senyawa kimia yang biasa digunakan untuk
demulsifikasi adalah asam kuat, basa kuat (Beall, 1984).
D. Kromatografi Lapis Tipis-Densitometri
1. Kromatografi Lapis Tipis
Kromatografi Lapis Tipis (KLT) merupakan teknik pemisahan campuran
dengan menggunakan suatu plat fase diam yang nantinya fase diam tersebut akan
secara seragam tersebar diatas permukaan plat tersebut yang kemudian fase gerak
akan bergerak sepanjang fase diam karena pengaruh gaya kapiler pada
pengembangan menaik (ascending) atau karena gaya gravitasi pada
pengembangan secara menurun (descending) (Gandjar dan Rohman, 2007).
Perbedaan antara kromatografi lapis tipis (KLT) dengan kromatografi
kolom dalam hal ini kromatografi cair kinerja tinggi (KCKT) adalah teknik utama
dalam pemisahan analit daripada fenomena fisik dalam hal ini adalah adsorbsi dan
partisi.
Pada KLT, fase diam terdiri dari lapisan tipis yang mengandung silika
gel atau serbuk selulosa yang bersifat inert dan rigid. Pada KLT terdapat banyak
variasi dari material pelapis, namun yang sering digunakan adalah silika gel.
Silika gel merupakan adsorben yang penyebarannya seragam diatas plat yang
banyak digunakan untuk KLT.
Kromatografi lapis tipis dapat digunakan jika:
b. Senyawa yang dianalisis memiliki kepolaran tinggi, sedang maupun
kepolaran rendah atau ionic.
c. Sampel yang akan dianalisis harus secara berkelanjutan.
d. Sampel yang akan dianalisis dapat merusak kolom dari kromatografi cair atau
kromatografi gas (Deinstrop, 2007).
2. Fase Diam
Fase diam yang sering digunakan adalah silika gel. Silika gel yang
digunakan diberi pengikat dengan tujuan memberikan kekuatan pada lapisan.
Biasanya telah ditambahkan oleh industri sehingga tidak perlu ditambahkan
sendiri, diberi nama dengan logo silika gel G (Sastrohamidjojo, 2005). Struktur
dari silika gel adalah sebagai berikut
Gambar 3. Struktur silika gel (Braithwaite dan Smith, 1999)
Lapisan ketebalan adsorben yang dianjurkan adalah antara 150 - 250 µm,
setelah dikeringkan semalam pada udara biasa atau pada pengeringan oven pada
suhu 1050C selama 30 menit lalu siap untuk digunakan sebagai fase diam dalam
metode KLT (Vogel, 1989). Pemanasan ini dilakukan untuk mengaktivasi silika
yang akan digunakan sehingga silika tersebut dapat digunakan dengan baik
sebagai fase diam. Dengan ini diharapkan air yang menutupi silika dapat hilang
Gambar 4. Interaksi hidrogen antara gugus silanol dengan air membentuk lapisan air multilayer (Wall, 2005)
Fase diam yang dijual dipasaran memiliki tata nama yang berbeda-beda.
Tata nama lempeng KLT yang dijual di pasaran adalah sebagai berikut ini
Tabel I. Tata nama lempeng KLT (Gandjar dan Rohman, 2007)
Singkatan / simbol Arti
“Sil” Produk mengandung silika gel seperti Anasil
G Pengikat (lapisan halus) gipsum (CaSO4. H2O)
F atau UV Ditambahkan bahan yang berfluoresensi seperti seng silikat teraktivasi mangan
254 dan 366 Setelah simbol F atau UV, untuk menunjukkan panjang gelombang eksitasi senyawa berfosforisensi yang ditambahkan
3. Fase Gerak
Fase gerak merupakan salah satu bagian yang penting dalam analisis
pemisahan senyawa menggunakan KLT karena polaritas dari fase gerak dapat
menentukan pemisahan. Oleh karena itulah perlu dilakukan pencarian terhadap
komposisi dan jenis fase gerak yang digunakan sehingga dapat memberikan
pemisahan yang baik. Fase gerak tersebut bisa didapatkan dari pustaka mengenai
senyawa yang akan dianalisis baru kemudian di optimasi lagi komposisinya agar
mendapat hasil pemisahan yang baik. Dapat berupa senyawa tunggal atau
Tabel II. Nilai Indeks Polaritas Pelarut Menurut Snyder,et al. (1997)
Pelarut Indeks Polarits
Nilai Eluotopik UVcut off
(nm) Alumina C18 Silika Gel
Heksana 0,1 0,01 - 0,00 195
Sikloheksana 0,2 0,004 - - 200
Toluena 2,4 0,29 - 0,22 284
Tetrahidrofuran 4,0 0,45 3,7 0,53 212
Etil Asetat 4,4 0,58 - 0,48 256
Aseton 5,1 0,56 8,8 0,53 330
Metanol 5,1 0,95 1,0 0,7 205
Asetonitril 5,8 0,65 3,1 0,52 190
Dimetilformamida 6,4 - 7,6 - 268
Dimetilsulfoksida 7,2 0,62 - - 268
Air 10,2 - - - 190
4. Penotolan Sampel
Pemisahan yang optimal diperoleh dengan cara menotolkan sampel
dengan ukuran bercak sekecil dan sesempit mungkin. Jika sampel yang digunakan
terlalu banyak maka akan menurunkan resolusi. Penotolan dapat dilakukan
dengan cara manual maupun otomatis dengan instrumen tertentu (Gandjar dan
Rohman, 2007). Misalnya Camag Linomat 5 (Wall, 2005). Volume penotolan
sampel yang digunakan biasanya adalah 0,1-0,5 mm3. Apabila lebih dari itu maka
dibutuhkan waktu yang lebih lama untuk mengelusi sampel. Selain itu dapat
membuat bercak yang dihasilkan menjadi melebar (Braithwaite, 1999).
Penotolan sampel yang tidak tepat akan menyebabkan kromatogram
memiliki puncak ganda dan menyebabkan bercak yang menyebar. Jika volume
sampel yang ditotolkan lebih besar dari 2–10 µL maka penotolan harus dilakukan
terlebih dahulu sebelum kemudian dicelupkan ke dalam fase gerak (Gandjar dan
Rohman, 2007).
5. Pengembangan
Plat yang telah ditotol oleh sampel kemudian dikembangkan dalam
bejana kromatografi yang telah jenuh oleh fase gerak. Tinggi fase gerak dalam
bejana harus di bawah lempeng yang telah ditotol oleh sampel. Bejana
kromatografi harus tertutup dengan rapat saat sedang mengelusi sampel.
Penjenuhan bejana dilapisi dengan kertas saring. ada beberapa macam teknik
melakukan pengembangan yakni menaik (ascending) dan menurun (denscending)
melingkar dan mendatar (Gandjar dan Rohman, 2007).
6. Analisis Kualitatif dan Kuantitatif
Metode KLT dapat digunakan untuk uji identifikasi suatu senyawa dalam
campuran (sampel). Parameter yang digunakan adalah nilai Rf. Dua senyawa
dikatakan identik jika memiliki nilai Rf yang sama jika diukur pada kondisi KLT
sama.
Setelah pengembangan sampel akan diperoleh nilai Rf yang
menggambarkan migrasi relatif komponen senyawa terhadap pelarut dan
berhubungan dengan koefisien distribusi komponen (Braithwaite, 1999). Nilai Rf
dapat dihitung dengan cara sebagai berikut:
Rf
Dalam analisis kuantitatif dengan metode KLT, nilai Rf diharapkan berada antara
Analisis kuantitatif dapat dilakukan dengan dua cara yakni mengukur
bercak secara langsung pada lempeng dengan menggunakan ukuran luas atau
dengan menggunakan teknik densitometri. Cara yang kedua adalah dengan cara
mengerok bercak kemudian menetapkan kadar senyawa dalam sampel dengan
metode analisis lain, misalnya metode spektrofotometri. Tetapi terdapat
kelemahan pada cara kedua yakni dapat terjadi kesalahan dalam pemindaian
bercak sehingga kadar yang diukur bukan merupakan kadar sebenarnya (Gandjar
dan Rohman, 2007).
7. Densitometri
Dasar dari densitometri adalah berkas radiasi eletromagnetik dari panjang
gelombang tertentu ( biasanya UV dari 190-800 nm) yang bergerak mendeteksi
bercak analit pada fase diam, di mana fase gerak diletakkan pada suatu wadah
yang digerakan oleh motor. Kromatogram yang terbentuk sangat mirip dengan
yang diperoleh dalam HPLC, biasanya menampilkan serangkaian puncak dengan
baseline(Sastrohamidjojo, 2005).
Densitometri dapat mendeteksi lokasi puncak secara otomatis,
mengoptimasi kondisi pengukuran luas bawah kurva, scanning seluruh totolan
pada plat secara langsung, merekam spektra analit, scanning λ analit, kompensasi
baseline otomatis untuk menghilangkan sinyal palsu yang disebabkan
oleh interfensi pada plat fase diam, kalibrasi, pelaporan data, dan penyimpanan
data untuk perhitungan kembali (Sherma, 1996). Densitometer memiliki sumber
cahaya, monokromator untuk memilih λ yang cocok, serta sistem yang dapat
Gambar 5. Alat Densitometri
E. Validasi Metode Analisis
Validasi metode analisis merupakan suatu tindakan penilaian terhadap
parameter tertentu berdasarkan percobaan laboratorium, untuk membuktikan
bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita,
2004).
Prosedur validasi metode analisis digunakan untuk membuktikan bahwa
metode analisis tersebut dapat memberikan hasil seperti yang diharapkan dengan
kecermatan dan ketelitian yang memadai. Metode analisis instrumen merupakan
metode yang terpilih dan memadai untuk mengantisipasi persoalan analisis yaitu
sangat kecilnya kadar senyawa yang dianalisis (Mulja dan Suharman, 1995).
Metode uji yang berbeda membutuhkan validasi yang berbeda. Kategori
metode pengujian dengan validasi metode yang diperlukan adalah sebagai berikut,
seperti yang juga dicantumkan dalam Tabel III (United States Pharmacopeial
Tabel III. Elemen Data yang Dibutuhkan untuk Validasi Metode Analisis
Ketepatan Ya Ya * * Tidak
Ketelitian Ya Ya Tidak Ya Tidak
Spesifitas Ya Ya Ya * Ya
Batas Deteksi Tidak Tidak Ya * Tidak
Batas Kuantitasi Tidak Ya Tidak * Tidak
Linearitas Ya Ya Tidak * Tidak
Rentang Ya Ya * * Tidak
Keterangan : * tergantung dari masing-masing uji
1. Kategori I: metode analitik yang digunakan untuk penetapan kadar komponen
utama dalam bahan baku atau bahan aktif (termasuk pengawet) dalam produk
akhir sediaan farmasi;
2. Kategori II: metode analitik yang digunakan untuk penetapan ketidakmurnian
dalam bahan baku atau bahan aktif atau hasil degradasi senyawa dalam produk
akhir sediaan farmasi;
3. Kategori III: metode analitik yang digunakan untuk penetapan karakteristik
penampilan obat (misalnya disolusi, pelepasan obat);
4. Kategori IV: metode analitik yang digunakan untuk uji identifikasi (United
States Pharmacopeial Convention, 2005).
Beberapa parameter yang harus dipertimbangkan dalam validasi metode
analisis meliputi antara lain selektivitas/spesifisitas, ketepatan, ketelitian,
linearitas, rentang, batas deteksi, batas kuantitasi, ketangguhan metode dan
kekuatan (Harmita, 2004).
Selektivitas suatu metode analisis adalah kemampuan untuk
mengukur analit secara cermat dan seksama dengan adanya komponen yang
mungkin ada dalam matrik sampel (Yuwono dan Indrayanto, 2005).
Selektivitas sering dapat dinyatakan sebagai derajat penyimpangan metode
terhadap sampel yang mengandung bahan yang ditambahkan berupa cemaran,
produk degradasi, senyawa sejenis, dan senyawa asing lain (Harmita, 2004).
Gambar 6. Simulasi pemisahan peak
Gambar 7 merupakan suatu simulasi pemisahan puncak kromatografi
antara dua kurva Gaussian identik, yang terpisah secara perlahan-lahan. Dapat
dilihat bahwa nilai resolution factor (R) akan sesuai dengan diagram. Dimana
nilai R = 0,75 kedua puncak masih berhimpit sekitar 65%, pada R = 1, kedua
puncak masih berhimpit sekitar 27%, dan pada R=1,5 kedua puncak dapat
dianggap telah akan mencapaibaselinedimana kedua puncak hanya berhimpit
sekitar 2% (Rouessac and Rouessac, 2007).
Selektivitas pada metode kromatografi ditunjukkan melalui nilai
resolusi (daya pisah) antara analit yang dituju dengan pengganggu lainya
resolution, yaitu pemisahan sempurna dari dua puncak dengan ukuran yang
sama (Pecsok, Shield, Cairns and McWilliam, 1976).
2. Ketepatan (accuracy)
Ketepatan adalah ukuran yang menunjukkan derajat kedekatan hasil
analisis dengan kadar analit yang sebenarnya. Biasanya dinyatakan sebagai
persen perolehan kembali (recovery) analit yang ditambahkan (Harmita,
2004). Akurasi biasanya didemostrasikan dengan menambahkan sejumlah
tertentu analit yang diketahui kedalam matriks sampel dan ditentukan hasil
terukurnya menggunakan prosedur analisis yang dilakukan (The British
Pharmacopoeia Commission, 2011).
Kriteria penerimaan akurasi ditentukan berdasarkan kadar analit,
dinyatakan dalam persen (%) perolehan kembali, seperti yang tertera pada
tabel IV:
Tabel IV. Kriteria Penerimaan Akurasi pada Konsentrasi Analit yang Berbeda
Kadar Analit (%) Analyte Ratio Unit Mean
3. Ketelitian (precision)
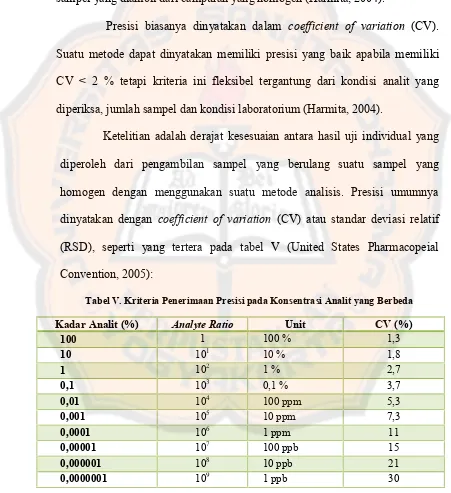
Pesisi atau keseksamaan asalah ukuran yang menunjukkan derajat
kesesuaian antara hasil uji individual, diukur melalui penyebaran hasil
individual dari rata-rata jika prosedur ditetapkan secara berulang pada
sampel-sampel yang diambil dari campuran yang homogen (Harmita, 2004).
Presisi biasanya dinyatakan dalam coefficient of variation (CV).
Suatu metode dapat dinyatakan memiliki presisi yang baik apabila memiliki
CV < 2 % tetapi kriteria ini fleksibel tergantung dari kondisi analit yang
diperiksa, jumlah sampel dan kondisi laboratorium (Harmita, 2004).
Ketelitian adalah derajat kesesuaian antara hasil uji individual yang
diperoleh dari pengambilan sampel yang berulang suatu sampel yang
homogen dengan menggunakan suatu metode analisis. Presisi umumnya
dinyatakan dengan coefficient of variation (CV) atau standar deviasi relatif
(RSD), seperti yang tertera pada tabel V (United States Pharmacopeial
Convention, 2005):
Tabel V. Kriteria Penerimaan Presisi pada Konsentrasi Analit yang Berbeda
Kadar Analit (%) Analyte Ratio Unit CV (%)
4. Linearitas (linearity)
Linearitas merupakan kemampuan metode untuk memberikan respon
yang proporsional terhadap konsentrasi analit di dalam sampel (Snyder et al.,
1997).
Penggambaran linearitas secara visual biasanya dilakukan dengan
memplotkan signal yang muncul sebagai fungsi dari konsentrasi analit. Apabila
terdapat hubungan yang linier, hasil uji harus dievaluasi dengan bantuan
metode statistik, misalnya dengan perhitungan garis regresi (The British
Pharmacopoeia Commission, 2011).
Regresi liner merupakan suatu metode statistik untuk mengevaluasi
bagaimana pengaruh satu atau lebih variabel bebas (predictor) pada satu
continuous dependent variable(respon) melalui suatu hubungan linear. Regresi
linier melibatkan suatu garis lurus atau fungsi linier. Garis ini merupakan
estimasi dari data sampel. Analisis dengan regresi linier dilakukan dengan
menggambarkan garis yang tepat diantara titik-titik data. Dari sini kemudian
akan diketahui kemiringan garis dan nilai dari y-interceptnya yang kemudian
dapat digunakan untuk perhitungan, dirumuskan dengan y=Bx+A. Dimana y
adalah variabel tergantung, B adalah nilai slope (kemiringan) garis, x adalah
variabel bebas dan A adalah y-intercept (De Muth, 1999). Hubungan antara
garis linear dengan regresi linear disebut sebagai koefisien determinasi (r2).
Koefisien determinasi menggambarkan kedekatan titik dengan garis linear,
semakin dekat titik dengan garis berarti semakin dekat hubungan korelasinya.
Muth, 1999). Suatu metode memiliki linearitas yang baik jika nilai koefisien
determinasi (r2) ≥ 0,997 (Chan, 2004).
Menurut De Muth (1999) linearitas ditunjukkan dengan nilai
koefisien determinasi (r2) dan koefisien korelasi (r) yang didapat dari
perhitungan regresi linear. Dimana koefisien determinasi (r2) menunjukkan
hubungan antara garis linear dengan respon dan koefisien korelasi (r)
menunjukkan hubungan antara konsentrasi dan respon pengukuran. Semakin
dekat nilai respon dengan garis linear, semakin linear data tersebut dan
semakin kuat hubungan korelasinya. Suatu metode dikatakan memiliki
linearitas yang baik apabila memiliki nilai r2≥ 0,997 (Chan, 2004).
5. Rentang (range)
Rentang dalam suatu metode analisis merupakan interval antara
konsentrasi analit tertinggi dan konsentrasi analit terendah yang memenuhi
persyaratan linearitas, akurasi, dan presisi. Dalam suatu assay biasanya
menggunakan rentang tidak kurang dari 80%-120% dari konsentrasi sampel
dan untuk penetapan keseragaman kadar biasanya digunakan rentang tidak
kurang dari 70%-130% (The British Pharmacopoeia Commission, 2011).
6. Batas deteksi (Limit of Detection)
Batas deteksi merupakan parameter uji batas yang diartikan sebagai
jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih
memberikan respon signifikan dibandingkan dengan blangko (Harmita,
7. Batas kuantifikasi (Limit of Quantification)
Batas kuantifikasi (LOQ) merupakan parameter dari suatu
quantitative assay untuk level rendah dari komponen didalam sampel,
biasanya digunakan untuk penentuan impurities dan/atau produk yang telah
terdegradasi. LOQ diartikan sebagai batas terendah dari jumlah analit dalam
sampel yang masih dapat ditentukan secara kuantitatif dan memberikan
akurasi dan presisi yang baik. (The British Pharmacopoeia Commission,
2011). Menurut Harmita (2004), Batas kuantitasi merupakan parameter pada
analisis renik dan diartikan sebagai kuantitas terkecil analit dalam sampel
yang masih dapat memenuhi kriteria cermat dan seksama.
8. Ketangguhan metode
Ketangguhan metode adalah derajat ketertiruan hasil uji yang
diperoleh dari analisis sampel yang sama dalam berbagai kondisi uji normal,
seperti laboratorium, analisis, instrumen, bahan pereaksi, suhu, hari yang
berbeda, dll. Ruggednessbiasanya dinyatakan sebagai tidak adanya pengaruh
perbedaan operasi atau lingkungan kerja pada hasil uji (Harmita, 2004).
9. Kekuatan (robustness)
Robustness suatu prosedur analisis adalah ukuran kapasitas untuk
tetap tidak terpengaruh oleh variasi kecil tapi disengaja dalam parameter
metode dan memberikan indikasi keandalannya selama penggunaan normal.
Biasanya ditunjukkan dengan melakukan perubahan kecil yang disengaja
membandingkan hasilnya dengan yang diperoleh menggunakan metode yang
sesuai prosedur (The British Pharmacopoeia Commission, 2011).
Untuk memvalidasi kekuatan suatu metode perlu dibuat perubahan
metodologi yang kecil dan terus menerus dan mengevaluasi respon analitik
dan efek presisi dan akurasi. Identifikasi sekurang-kurangnya 3 faktor analisis
yang dapat mempengaruhi hasil bila diganti atau diubah. Faktor orisinal ini
dapat diidentifikasi sebagai A, B, dan C. Perubahan nilai faktor-faktor ini
dapat diidentifikasi dengan a, b, dan c. Lakukan analisis pada kondisi yang
telah disebutkan pada pemeriksaan ketangguhan (Harmita, 2004).
F. Landasan Teori
Krim merek “x” merupakan salah satu obat yang sering digunakan oleh
masyarakat sebagai analgesik untuk meredakan nyeri sendi, keseleo dan kram
otot. Dalam setiap gram produk krim merek “x” tersebut mengandung senyawa
aktif metil salisilat 102 mg, eugenol 13,6 mg dan mentol 54,4 mg.
Metil salisilat dan eugenol merupakan senyawa golongan fenol yang
terdapat dalam produk tersebut. Keduanya memiliki kelarutan yang baik dalam
etanol, eter dan kloroform serta mempunyai serapan maksimum pada daerah UV
yang berdekatan yaitu 300 nm dan 282 nm. Berdasarkan sifat fisika dan kimia
senyawa, dan jumlah komponen zat aktif yang lebih dari satu maka analisis untuk
menetapkan kadar dapat dilakukan dengan metode kromatografi lapis tipis
(KLT)-densitometri. Eugenol memiliki sifat yang merupakan semivolatil. Hal ini dapat
Metode KLT dapat memisahkan beberapa campuran senyawa karena
adanya perbedaan interaksi antara senyawa-senyawa tersebut dengan fase diam
dan fase gerak yang digunakan. Metode KLT ini masih dapat digunakan untuk
senyawa yang memiliki sifat semivolatil sehingga untuk menetapkan kadar dari
eugenol yang besifat semivolatil masih dapat digunakan. Bercak analit hasil
pemisahan KLT dapat dianalisis kuantitatif dengan Densitometer.
Parameter validasi metode didasarkan antara lain pada selektivitas, nilai
perolehan kembali, presisi dan linearitas. Dalam hal ini, selektivitas akan
dianalisis berdasarkan perbandingan nilai Rf kedua campuran, yang ditunjukkan
dengan nilai resolusi > 1,5, linearitas dianalisis berdasarkan koefisien determinasi
(r2) ≥ 0,997, untuk asam salisilat perolehan kembali dianalisis berdasarkan mean
% recoveryantara 90-107% dan presisi dianalisis berdasarkan CV (Coefficient of
Variation) ≤ 1,8%, sedangkan untuk eugenol ulangan standart dianalisis
berdasarkan mean % recovery antara 90-107% dan presisi dianalisis berdasarkan
CV ≤ 2,7%.
G. Hipotesis
Berdasarkan landasan teori di atas, dapat disusun hipotesis bahwa metode
analisis Kromatografi Lapis Tipis (KLT)–Densitometri yang dikembangkan untuk
analisis kadar metil salisilat dan eugenol dengan fase diam silika gel 60 F254 dan
fase gerak toluen : etil asetat : metanol (65,2 : 2,4 : 32,4) memiliki validitas yang
30 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian non eksperimental deskriptif,
karena tidak dilakukan perlakuan pada subjek uji krim analgesik merek “x”.
B. Variabel Penelitian
1. Variabel bebas
Variabel bebas dalam penelitian ini adalah metode yang digunakan untuk
melakukan analisis yaitu sistem KLT yang telah dioptimasi dengan fase diam
silika gel 60 F254 dan fase gerak toluena : etil asetat : metanol (65,2 : 2,4 :
32,4).
2. Variabel tergantung
Variabel tergantung pada penelitian ini adalah parameter validasi yaitu
selektivitas, akurasi, presisi, linearitas, dan rentang.
3. Variabel pengacau terkendali
a. Pelarut, untuk mengatasinya digunakan pelarut pro analysis (p.a) yang
memiliki kemurnian tinggi.
b. Senyawa baku yang digunakan, untuk mengatasinya digunakan senyawa
baku asam salisilat untuk sintesis dan senyawa baku eugenol untuk
c. Paparan cahaya terkait dengan sifat eugenol yang fotosensitif, untuk
mengatasinya pada saat preparasi semua peralatan gelas yang akan
digunakan dilapisi denganaluminium foil.
C. Definisi Operasional
1. Krim merek “x” adalah sedian krim topikal dalam kemasan tube ukuran 5
gram mengandung senyawa aktif metil salisilat sebanyak 102 mg, eugenol
sebanyak 13,6 mg dan mentol sebanyak 54,4 mg dengan nomor Batch
1K3161.
2. Sistem KLT yang digunakan dalam penelitian adalah fase diam silika gel 60
F254dan fase gerak toluena : etil asetat : metanol (65,2 : 2,4 : 32,4).
3. Kadar metal salisilat, asam salisilat dan eugenol dinyatakan dalam part per
million(ppm).
4. Parameter validasi yang digunakan yaitu selektivitas, akurasi, presisi,
linearitas, dan rentang.
D. Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah asam slisilatfor
synthesis (E. Merck, kemurnian 99,8%), eugenol for R&D (Sigma-Aldrich,
kemurnian 99%), metanol p.a (E. Merck), etanolp.a (E. Merck), toluenp.a (E.
Merck), etil asetat p.a (E. Merck), NaOH 6M, HCl 6M, kloroform teknis
(Bratachem), Krim merk X (netto: 5 gram, No. batch : 1K3161) , plat KLT silika
E. Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah seperangkat
komputer merk Dell B6RDZ1S Connexant System RD01-D850 A03-0382 JP
France S.A.S, printer HP Deskjet D2566 HP-024-000 625 730, seperangkat alat
densitometer (CAMAG TLC Scanner 3 CAT. No. 027.6485 SER. No.160602),
autosampler (CAMAG Linomat 5 CAT. No. 027.7808. SER. No. 170610), UV
cabinet (CAMAG), perangkat lunak WinCats (V.1.4.4), chamber (DESAGA,
Germanydimensi 23x23x10 cm), Oven (Marius Instrumenten, postbus 7018-3502
Utrecht, Hollantlaan 18-3526 Am utrech), mantel heater, pendingin alin,
termometer, indikator pH, kertas saring, mikropipet 20 -200 µL dan 100-1000 µL
(Socorex ACURA 825), makropipet 1-10 mL (Socorex ACURA 825), neraca
analitik (ScaltecSBC 22 max 60/210 g; min 0,001 g; d=0,01/0,1mg; e=1mg), dan
seperangkat alat gelas (Pyrex).
F. Tata Cara Penelitian
1. Pembuatan Fase Gerak
Fase gerak yang digunakan adalah fase gerak yang telah didapat dari hasil
optimasi pada penelitian sebelumnya yaitu toluena : etil aseat : metanol (65,2 :
2,4 : 32,4). Fase gerak ini dibuat sebanyak 25 mL menggunakan prinsip
volume portiondengan teknikdoubling(Shimadzu corporation, 2012).
2. PenjenuhanChamber
Chamber dimensi 23x23x10 cm diisi dengan fase gerak yang telah dibuat
chamber dikatakan telah terjenuhkan apabila seluruh kertas saring telah
terbasahi oleh fase gerak.
3. Pengaktifan Fase diam
Fase diam berupa plat KLT silika gel 60 GF254dipanaskan dalam oven selama
30 menit dengan suhu optimal 1200C (Braithwait and Smith, 1999).
4. Pembuatan larutan baku tunggal asam salisilat
a. Pembuatan larutan stok asam salisilat 20 ppb. Serbuk baku asam
salisilat ditimbang sebanyak 0,2004 gram kemudian dimasukkan ke dalam labu
takar 10 mL. Serbuk tersebut kemudian dilarutkan dengan etanolp.ahingga tanda
dan digojog agar homogen.
b. Pembuatan seri larutan baku asam salisilat 816; 884, 952, 1020; 1088,
1156 dan 1224 ppm. Larutan stok asam salisilat 20 ppb diambil sebanyak 204,
221, 238, 255, 272, 289 dan 306 μL menggunakan mikropipet kemudian
masing-masing dimasukkan ke dalam labu takar 5 mL. Larutan tersebut diencerkan
dengan etanol p.a hingga tanda dan digojog agar homogen. Seri larutan baku
dibuat sebanyak tiga replikasi.
5. Pembuatan larutan baku tunggal eugenol
a. Pembuatan larutan stok eugenol 20 ppb. Larutan baku eugenol diambil
sebanyak 189 μL dengan mikropipet kemudian dimasukkan ke dalam labu takar
10 mL dan dilarutkan dengan etanolp.ahingga tanda dan digojog agar homogen.
b. Pembuatan seri larutan baku eugenol 560, 600, 640, 680, 720, 760 dan
800 ppm. Larutan stok eugenol 20000 ppm diambil sebanyak 140, 150, 160, 170,
dimasukkan ke dalam labu takar 5 mL. Larutan tersebut diencerkan dengan etanol
p.a hingga tanda dan digojog agar homogen. Seri larutan baku dibuat sebanyak
tiga replikasi.
6. Pembuatan Larutan Baku Campuran Asam Salisilat dan Eugenol
Larutan stok baku asam salisilat diambil sebanyak 204, 255 dan 306 μL
dan larutan stok baku eugenol diambil sebanyak 140, 170 dan 200 μL
menggunakan mikropipet kemudian dimasukkan ke dalam labu takar 5 mL.
Campuran larutan lalu diencerkan dengan etanol p.a hingga tanda dan digojog
agar homogen. Pembuatan larutan campuran baku eugenol dan asam salisilat
dilakukan sebanyak lima kali replikasi.
7. Penetapan Panjang Gelombang Pengamatan
Larutan baku asam salisilat kadar 816; 952 dan 1224 ppm dan larutan
baku eugenol kadar 560; 640 dan 800 ppm masing-masing tiga kali replikasi
ditotolkan sebanyak 2 µL pada plat KLT dengan fase diam silika gel 60 F254.Hasil
penotolan dikembangkan dalam bejana kromatografi yang telah jenuh dengan fase
gerak, dengan jarak pengembangan 15 cm. Lempeng hasil pengembangan
dikeluarkan dari bejana lalu dikeringkan. Plat hasil pengembangan discanning
pada panjang gelombang pengamatan 250-330 nm menggunakan alat TLC
scanner.
8. Penetapan kurva baku asam salisilat dan eugenol dan pengamatan nilai
Seri larutan baku masing-masing ditotolkan dengan volume penotolan 2
μL pada plat KLT dengan fase diam silika gel 60 F254yang telah diaktifkan dan
setelah kering dikembangkan dalam bejana kromatografi yang telah dijenuhi
dengan fase gerak dengan jarak pengembangan 15 cm. Setelah mencapai jarak
rambat 15 cm, plat dikeluarkan dari bejana dan dikeringkan. Plat hasil
pengembangan diukur Area Under Curve (AUC) dan tinggi puncaknya dengan
alat TLC scanner pada panjang gelombang pengamatan (288 nm). Replikasi
dilakukan sebanyak tiga kali. Selanjutnya dihitung persamaan kurva baku, nilai
koefisien determinasi dan nilai koefisien korelasinya, kemudian diplotkan dalam
grafik kadar vs AUC.
9. Validasi Metode
a. Penentuan nilai selektivitas, presisi, linearitas dan rentang. Seri larutan
tunggal dan campuran baku asam salisilat dan eugenol ditotolkan dengan volume
penotolan 2 µL pada plat KLT dengan fase diam silika gel 60 GF254 dan setelah
kering dikembangkan dalam bejana kromatografi yang telah dijenuhi dengan fase
gerak. Setelah mencapai jarak rambat 15 cm, plat dikeluarkan dari bejana dan
dikeringkan. Plat hasil pengembangan diukur Area Under Curve (AUC) dan
tinggi puncaknya dengan alatTLC scanner pada panjang gelombang pengamatan
(288 nm). Replikasi dilakukan sebanyak lima kali. Kadar terukur dihitung dengan
menggunakan persamaan kurva baku yang telah didapat.
b. Penentuan nilai perolehan kembali. Konsentrasi rendah, sedang dan
tinggi dari baku eugenol dan asam salisilat ditambahkan pada ± 1 gram sampel,
dengan menggunakan mantel heater dengan suhu di jaga antara 800C-1000C
selama 3 jam. Larutan yang diperoleh disaring dengan menggunakan kertas saring
dan ditambah HCL 6M hingga pH 2. Larutan diekstraksi sebanyak 4 x @ 10 mL
kloroform. Hasil ekstraksi dikeringkan dan setelah kering dilarutkan kembali
dengan 5 mL. Hasil tersebut ditotolkan sebanyak 2 µL pada plat KLT dengan
jarak rambat 15 cm, plat dikeluarkan dari bejana dan dikeringkan. Plat hasil
pengembangan diukur Area Under Curve (AUC) dan tinggi puncaknya dengan
alat TLC scanner pada panjang gelombang pengamatan (288 nm). Replikasi
dilakukan sebanyak dua kali pada tiap konsentrasi baku. Kadar terukur dihitung
dengan menggunakan persamaan kurva baku yang telah didapat.
10. Preparasi Sampel
Sampel didapatkan dari 4 apotek pendidikan di Yogyakarta yang
memiliki nomor batch yang sama sebanyak 50 sampel. Dari 50 sampel tersebut
diambil 20 sampel secara acak yang akan mendapatkan perlakuan. Dari 20 sampel
tersebut dikeluarkan semua kemudian diletakkan dalam satu wadah yang sama
dan dihomogenkan.
Sampel ditimbang lebih kurang 1 gram dengan seksama kemudian
dimasukkan kedalam labu alas datar 100 mL, NaOH 6 M ditambahkan sebanyak
25 mL. Dilakukan pemanasan dengan refluks dengan menggunakanmantel heater
dengan suhu di jaga antara 800C-1000C selama 3 jam. Larutan yang diperoleh
disaring dengan menggunakan kertas saring dan ditambah HCL 6M hingga pH 2.
dan setelah kering dilarutkan kembali dengan 5 mL etanol sehingga didapatkan
sampel untuk eugenol tanpa pengenceran. Sampel dibuat sebanyak 5 kali.
Sampel yang telah jadi tersebut digunakan untuk sampel eugenol,
sedangkan untuk sampel asam salisilat didapatkan dari sampel eugenol yang akan
diencerkan dengan mengambil 1 mL sampel eugenol menggunakan pipet volume
kemudian dimasukkan kedalam labu takar 10 mL larutan tersebut diencerkan
dengan etanol p.a hingga tanda dan digojog agar homogen. Sampel dibuat
sebanyak 5 kali.
G. Analisa Hasil
Pada analisis campuran eugenol dan metil salisilat ini dilakukan
pemisahan antara metil salisilat dengan eugenol berdasarkan parameter berikut
ini:
1. Selektivitas
Selektivitas ditentukan dengan membandingkan nilai Rfdari kedua senyawa.
Selektivitas ditunjukkan dengan resolusi (R) > 1,5 (Gandjar dan Rohman,
2007). Resolusi dapat dihitung dengan cara berikut:
Resolusi = (Watson, 1999).
2. Linearitas
Linearitas dilihat dari nilai r2 (koefisien determinasi) yang didapatkan dari
persamaan kurva baku. Suatu metode memiliki linearitas yang baik jika nilai
koefisien determinasi (r2) ≥ 0,997 (Chan, 2004).
3. Nilai perolehan kembali
Nilairecoverydidapatkan dari rumus x 100%
4. Presisi
Nilai presisi pada metode analisis dinyatakan dalam bentuk KV (koefisien
variasi) yang dapat diperoleh dengan cara:
KV = x 100% (Harmita, 2004).
5. Rentang
Rentang merupakan interval konsentrasi analit yang memenuhi persyaratan