0 E-mail :Info@tekmira.esdm.go.id
LAPORAN AKHIR TAHUN ANGGARAN 2014
Kelompok Teknologi Pengolahan dan Pemanfaatan MineralOPTIMALISASI EKSTRAKSI LOGAM TANAH JARANG
BERBASIS MINERAL MONASIT DAN PASIR ZIRKON
(1912.004.001) Oleh : Isyatun Rodliyah Suganal Siti Rochani Ngurah Ardha Datin Fatia Umar Muchtar Aziz Wahyu Agus Setiawan Yuhelda Azhari Hadi Purnomo Sariman Yayah Rohayati Nuryadi Saleh Dessy Amalia Jafril Yudo Supriyantono Astuti Rahayu Jejen Edi Suyatno
PUSLITBANG TEKNOLOGI MINERAL DAN BATUBARA (PUSLITBANG tekMIRA) Tahun 2014
1 1.1. Dasar Hukum
a) Undang-undang Nomor 4 Tahun 2009 tentang Pertambangan Mineral dan Batubara
1) Pasal 95 huruf c: pemegang IUP dan IUPK wajib meningkatkan nilai tambah;
2) Pasal 102: pemegang IUP dan IUPK wajib meningkatkan nilai tambah dalam pelaksanaan penambangan, pengolahan/pemurnian, dan pemanfaatan minerba;
3) Pasal 103: pemegang IUP dan IUPK wajib melakukan pengolahan/ pemurnian hasil penambangan di dalam negeri
b) Undang-undang No. 30 Tahun 2007 tentang Energi
c) Peraturan Pemerintah Nomor 23 Tahun 2010 tentang Pelaksanaan Kegiatan Usaha Pertambangan Mineral dan Batubara
1) Pasal 93: pemegang IUP Operasi Produksi dan IUPK Operasi Produksi mineral wajib melakukan pengolahan/pemurnian untuk meningkatkan nilai tambah, langsung atau kerja sama dengan perusahaan pemegang IUP dan IUPK lainnya;
2) Pasal 94: pemegang IUP Operasi Produksi dan IUPK Operasi Produksi batubara wajib melakukan pengolahan untuk meningkatkan nilai tambah, langsung atau kerja sama dengan perusahaan pemegang IUP dan IUPK lainnya;
3) Pasal 95: komoditas tambang yang ditingkatkan nilai tambahnya adalah mineral logam, bukan logam, batuan, atau batubara;
4) Pasal 96 : ketentuan tentang tata cara peningkatan nilai tambah mineral dan batubara diatur dengan Peraturan Menteri.
d) Peraturan Presiden Republik Indonesia Nomor 5 Tahun 2006 tentang Kebijakan Energi Nasional
e) Peraturan Pemerintah No.1 Tahun 2014 tentang Pelaksanaan Kegiatan Usaha Pertambangan Mineral dan Batubara
2 Renstra ESDM 2010-2014, a.l memuat peningkatan nilai tambah pertambangan g) Peraturan Menteri ESDM No. 1 Tahun 2014 tentang peningkatan nilai tambah
mineral melalui kegiatan pengolahan dan pemurnian mineral khususnya pada Bab II pasal 5 ayat (2) yang menyatakan bahwa produk samping/sisa hasil pengolahan dan/atau pemurnian komoditas tambang mineral logam timah berupa zirkon, ilmenit, rutil, monasit, senotim, dan terak wajib dilakukan pengolahan dan/atau pemurnian di dalam negeri.
h) Kepmen Ristek No. 193/M/Kp/IV/2010 tgl. 30 April 2010 tentang Agenda Ristek Nasional 2010-2014
1.2. Latar Belakang
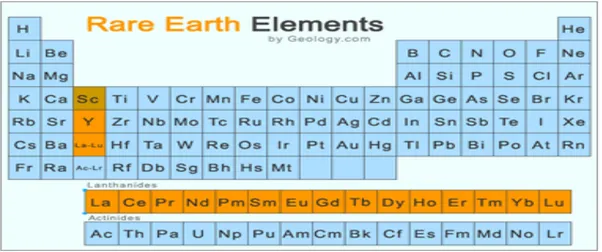
Logam tanah jarang (LTJ) merupakan kelompok logam yang keberadaannya berasosiasi dengan unsur logam yang lain dalam jumlah yang kecil. Kelompok logam tanah jarang merupakan kelompok lantanida dalam periodik unsur yang memiliki anggota 14 unsur yaitu: Ce-Pr-Nd-Pm-Sm-Eu-Gd-Tb-Dy-Ho-Tr-Tm-Yb-Lu. Logam grup lain yang sering berasosiasi dalam mineral yang sama adalah Sc-Y-La (Castor dan Hendrick, 2011). Keberadaan unsur logam tanah jarang dalam sistem tabel periodik unsur seperti terlihat pada Gambar 1.1. Logam tanah jarang diklasifikasikan menjadi dua, yaitu logam tanah jarang ringan atau grup cerium (Ce, Pr, Nd, Pm, Sm, Eu) dan logam tanah jarang berat (Gd, Tb, Dy, Ho, Tr, Tm, Yb, Lu). Logam tanah jarang ringan lebih banyak keberadaannya dibandingkan dengan logam tanah jarang berat. Pada kenyataannya LTJ keberadaan di lapisan bumi tidaklah jarang. Cerium, lantanum, neodymium, dan ytrium sebenarnya lebih umum kelimpahannya dibandingkan timbal dan perak (Atmawinata, 2011).
3 Gambar 1.1. Keberadaan unsur LTJ (warna kuning) dalam sistem periodik unsur Oksida logam tanah jarang memegang peranan yang sangat penting dalam kebutuhan material produksi modern seperti superkonduktor, laser, optik elektronik, aplikasi LED dan iPAD, glass dan keramik. Kebutuhan industri oksida LTJ dunia lebih dari 90% disupply oleh Cina. Sejak tahun 2004 Cina mengurangi ekspor LTJ untuk memasok kebutuhan dalam negerinya, sedangkan kebutuhan terhadap oksida LTJ di dunia dari tahun ke tahun semakin meningkat, sehingga supply LTJ dari sumber-sumber negara lain sangat dibutuhkan termasuk Indonesia karena memiliki potensi mineral tanah jarang yang sangat besar.
Di Indonesia mineral yang mengandung logam tanah jarang terdapat sebagai mineral ikutan pada komoditas utama terutama emas dan timah aluvial yang mempunyai peluang untuk diusahakan sebagai produk sampingan yang dapat memberikan nilai tambah dari seluruh potensi bahan galian. Potensi endapan emas aluvial tersebut relatif melimpah dapat dijumpai tersebar di sebagian pulau-pulau besar di Indonesia. Sedangkan pada Jalur Timah Asia Tenggara yang mengandung sebagian besar sumber daya timah dunia melewati wilayah Indonesia mulai dari Kepulauan Karimun, Singkep sampai Bangka dan Belitung merupakan potensi strategis yang dapat memberikan kontribusi besar kepada pembangunan nasional. Mineral pembawa logam tanah jarang yang paling bayak dijumpai di Indonesia adalah monasit, senotim dan zirkon.
1. Monasit ((Ce,La,Y,Th)PO3) merupakan senyawa fosfat logam tanah jarang
4 endapan pada timah aluvial bersama dengan zirkon dan xenotim. Monasit memiliki kandungan thorium yang cukup tinggi. Sehingga mineral tersebut memiliki sinar bersifat radioaktif. Thorium memancarkan radiasi tingkat rendah, dengan menggunakan selembar kertas saja, akan terhindar dari radiasi yang dipancarkan.
2. Senotim (YPO4
3. Zirkon, merupakan senyawa zirkonium silikat yang didalamnya dapat terkandung thorium, yttrium dan cerium.
) merupakan senyawa yttrium fosfat yang mengandung 54-65% LTJ termasuk erbium, cerium dan thorium. Xenotim juga mineral yang ditemukan dalam pasir mineral berat, serta dalam pegmatit dan batuan beku.
Berdasarkan hasil studi BATAN di daerah produksi timah, ada beberapa daerah potensi deposit monasit, senotim dan pasir zirkon yaitu; Bangka Belitung, Karimata/Ketapang, Rirang-Tanah Merah.Potensi ini telah diketahui oleh Cina dan Cina berminat untuk membelinya bahkan dengan harga puluhan juta per kilogramnya (Atmawinata, 2011).
Bijih timah mengandung mineral utama kasiterit (SnO2) dan mineral ikutan seperti
kolumbit-tantalit [(Fe,Mn)(Ta,Nb)2O6], zirkon (ZrSiO4), ilmenit (FeTiO3), rutil (TiO2),
kwarsa (SiO2), pirit (FeS2), senotim (YPO4), dan monasit (Ce,La,Y,Th)PO4. Khusus
untuk zirkon selain dari bijih timah juga banyak terkandung di dalam emas aluvial dengan kadar ± 5%. Hingga kini unsur logam tersebut di atas belum diketahui nilai keekonomian dari faktor pengusahaannya, walaupun bila dilihat dari perkembangan harga unsur logam ini cukup tinggi. Dengan kondisi tidak diketahuinya jenis dan jumlah serta potensi mineral logam jarang sebagai hasil proses pengolahan mineral utama seperti tembaga, nikel dan emas, maupun yang belum diolah di dalam negeri mengakibatkan pemerintah tidak mampu melakukan pengelolaan dan pengawasan. Tetapi dengan dikeluarkannya PP No.9 tahun 2012 tentang Penerimaan Negara Bukan Pajak (PNBP) sebagai revisi dari PP No.45 Tahun 2003 mineral ikutan yang selama ini belum dikenakan royalti, maka dengan dikeluarkannya PP ini maka mineral-mineral ikutan yang terkandung di dalam mineral utama dan bernilai ekonomis akan dikenakan royalti.
5 Di Indonesia, pemanfaatan batubara sebagai sumber energi telah meningkat pada tahun-tahun belakangan ini. Dengan naiknya harga bahan bakar minyak (BBM) di pasaran dunia yang menyebabkan naiknya harga BBM di dalam negeri menjadikan batubara sebagai sumber energi alternatif utama. Pada saat ini penggunaan batubara terbesar di dalam negeri adalah sebagai bahan bakar pada pembangkit listrik tenaga uap (PLTU). Dengan meningkatnya taraf hidup masyarakat, maka keperluan akan listrik juga akan meningkat. Hal ini terlihat dengan bertambahnya pembangunan unit-unit baru pembangkit listrik yang menggunakan batubara.
Dampak penggunaan batubara sebagai bahan bakar untuk sumber energi, adalah sisa bahan bakar yang berupa abu terbang (fly ash) dan abu dasar (bottom ash), dimana sisa-sisa pembakaran ini cukup besar tergantung pada besar kecilnya kadar abu batubara yang digunakan. Sebagai contoh, PLTU Suralaya dengan kapasitas total 3400 MW menghasilkan abu batubara sebanyak 1200 ton per hari dengan kehalusan 200 mesh. Abu ini merupakan hasil pembakaran batubara Indonesia yang rata-rata memiliki kadar abu sebesar 1,1%. Jumlah tersebut cukup besar, sehingga memerlukan pengelolaan agar tidak menimbulkan masalah lingkungan, seperti pencemaran udara, perairan dan penurunan kualitas ekosistem.
Salah satu penanganan lingkungan yang dapat diterapkan adalah memanfaatkan limbah tersebut untuk keperluan bahan bangunan seperti batako dan paving blok serta pembenah lahan pertanian. Namun, hasil pemanfaatan tersebut belum dapat dimasyarakatkan, karena berdasarkan PP No. 85 Tahun 1999 tentang Perubahan Atas Peraturan Pemerintah No. 18 Tahun 1999 Tentang Pengelolaan Limbah Bahan Berbahaya Dan Beracun, abu terbang dikategorikan sebagai limbah B3 karena terdapat kandungan oksida logam berat yang akan mengalami pelindian secara alami dan mencemari lingkungan.
Sifat-sifat abu batubara tergantung pada komposisi batubara dan kondisi-kondisi operasional pabrik/PLTU. Abu batubara pada umumnya mengandung sejumlah besar unsur logam dan komponen-komponen yang dapat mempengaruhi pemanfaatan dan penanganan limbah tersebut. Selain itu abu batubara juga
6 jumlah kecil, namun mempunyai nilai ekonomi yang tinggi. Mineral LTJ dalam abu batubara yang utama adalah monasit (Ce, La, Y, Th) fosfat.
Sesuai kebijakan peningkatan nilai tambah, beberapa mineral logam yang saat ini diusahakan banyak diketemukan mineral logam jarang yang belum diolah di dalam negeri, bila hal tersebut dikelola dan diatur pemanfaatannya maka diharapkan dapat meningkatlan nilai tambah sekaligus meningkatkan penerimaan negara, oleh karena itu proses pengolahan hasil tambang dan mineral ikutannya diharapkan kewenangannya dapat ditangani oleh Sektor ESDM yang memahami aspek teknis pertambangan.
Mineral pembawa logam tanah jarang tersebut belum diolah lebih lanjut untuk memperoleh logam-logam tanah jarang murni atau dalam bentuk oksidanya, karena penguasaan kita tentang teknologi pengolahannya masih perlu ditingkatkan dan dimantapkan. Sebagai contoh didalam mineral monasit dan abu batu bara banyak terdapat LTJ. Hal ini dapat dilihat dari tipikal komposisi oksida dalam sampel monasit Bangka seperti terlihat pada Tabel 1.1. Sedangkan komposisi LTJ dalam abu batubara dapat dilihat pada Tabel 1.2. Dibutuhkan jalur ekstraksi yang panjang untuk menghasilkan oksida LTJ. Sehingga perlu dilakukan penelitian tentang ekstraksi logam tanah jarang dari mineral monasit, senotim, pasir zirkon dan abu batubara untuk mendorong pengolahan dan pemurnian LTJ di dalam negeri.
Tabel 1.1. Tipikal komposisi oksida dalam sampel monasit Bangka (Soepriyanto dan Buchari, 2010)
Oksida Jumlah (%) Oksida Jumlah (%)
P2O5 13,59 SnO 7,81 ZrO2 12,93 La2O3 6,99 SiO2 8,42 Nd2O3 6,72 TiO2 6,26 Y2O3 3,49 Fe2O3 4,91 Sm2O3 0,92 ThO2 3,17 Gd2O3 0,67 Al2O3 1,78 Dy2O3 0,53 HfO2 0,33 Er2O3 0,39 Cr2O3 0,28 Yb2O3 0,34
7 Tabel 1.2. Komposisi LTJ dalam abu batubara (Smith, dkk, 2012)
Penelitian mengenai pengolahan logam tanah jarang sudah dilakukan oleh beberapa instansi di Indonesia diantaranya oleh BATAN. PTAPB-BATAN Yogyakarta telah melakukan penelitian ekstraksi logam tanah jarang dari mineral monasit dan senotim Bangka dengan metode asam hingga memperoleh oksida logam LTJ berupa Ce2O3 dengan kadar 99,98%, Y2O3, La2O3, Nd2O3
Penelitian yang dilakukan oleh tekMIRA ini bekerjasama dengan BATAN, Unpad dan PT. Timah. BATAN bekerjasama dalam penyediaan oksida logam tanah jarang, Unpad dalam teknologi dasar ekstraksi gadolinium dan SDMnya serta PT. Timah dalam penyediaan sampel monasit dan senotim. Penelitian ini merupakan penelitian
dengan kadar >80%. PPGN-BATAN Jakarta telah melakukan penelitian juga terkait ekstraksi logam tanah jarang dari mineral monasit dan senotim Bangka dengan metode alkali/basa hingga diperolehnya campuran logam tanah jarang oksida (RE-OH) dengan kadar 85,6%. Penelitian ekstraksi LTJ ini juga telah dilakukan oleh beberapa perguruan tinggi diantaranya Universitas Padjajaran Bandung. Unpad telah berhasil memisahkan LTJ-berat, LTJ-sedang, dan LTJ-ringan. Sedangkan untuk pemisahan unsurnya, Unpad telah berhasil memisahkan unsur gadolinium (Gd) dalam skala laboratorium dan telah bekerjasama dengan Kimia Farma dalam penggunaannya di bidang kesehatan. Dengan kondisi penelitian LTJ di Indonesia ini, maka masih diperlukan penelitian terkait pengolahan LTJ di Indonesia hingga diperolehnya teknologi untuk memisahkan semua unsur yang temasuk dalam golongan Lantanida dan juga masih terbuka penelitian hingga sampai pada tahap logamnya.
Nama LTJ Komposisi, ppm Ce La Nd Yb Th Dy Sm Eu Tb 112,5 56,97 48,35 33,35 28,75 6,75 7,44 1,60 1,14
8 mengenai profil investasi pembangunan pengolahan dan pemurnian monasit (cerium dan ytrium), sedangkan penelitian teknis difokuskan untuk reduksi Ce2O3
dan Y2O3 menjadi logam Ce dan Y. Dari kajian lingkungan di fokuskan pada kajian
lingkungan hasil proses yang sudah dilakukan BATAN dengan metode asam dan basa. Pada tahun anggaran 2014 penelitian difokuskan pada optimasi reduksi Ce2O3
dan Y2O3 menjadi logam Ce dan Y, reduksi La2O3 dan Nd2O3 menjadi logam La dan
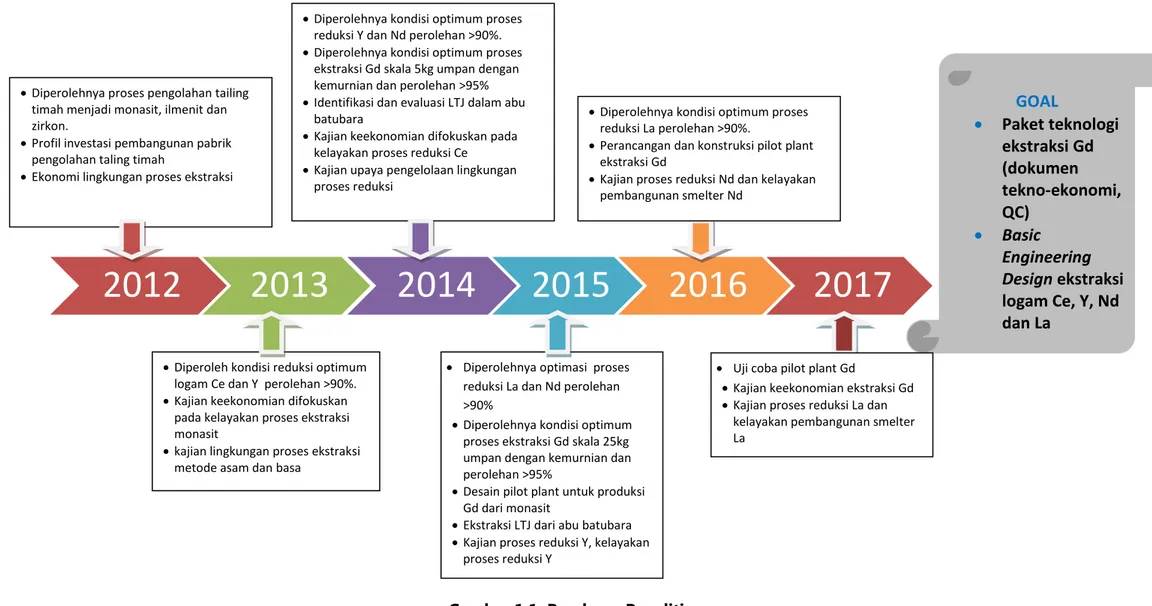
Nd, optimasi ekstraksi gadolinium, dan identifikasi serta ekstraksi LTJ dari abu batubara. Dari kebijakan difokuskan pada kajian nilai kelayakan dan kebijakan pembangunan pengolahan dan pemurnian monasit (Ce, Y, La, dan Nd). Dari segi lingkungan adalah penanganan limbah hasil ekstraksi LTJ metode basa untuk dibuat pupuk super fosfat dan tripel super posfat (TSP). Pada tahun anggaran 2015 penelitian optimasi proses pengolahan LTJ (Ce, Y, La, dan Nd) menjadi logamnya . Roadmap penelitian ini dapat dilihat pada Gambar 1.2.
Walaupun penelitian mengenai pengolahan LTJ di Indonesia sudah dilakukan oleh beberapa instansi pemerintah dan universitas, namun, pada umumnya penelitian tersebut masih sebatas laboratorium dan belum ada sinergi/kerjasama antar lembaga yang bergerak dalam bidang penelitian LTJ. Adanya kerjasama/sinergi penelitian LTJ akan dapat menghasilkan capaian hasil penelitian yang lebih optimal. Salah satu cara untuk melakukan sinergi dan kerjasama adalah dengan diadakannya
Forum Group Discussion (FGD) antara peneliti yang menekuni LTJ dan perusahaan
yang bergerak dalam pengolahan mineral pembawa LTJ, seminar dan sosialisasi ke media terkait hasil yang telah dicapai dalam penelitian LTJ di Indonesia sehingga industri pengolahan LTJ di Indonesia dapat segera terwujud. Penelitian LTJ yang sudah dihasilkan oleh tekMIRA dan instansi lainnya harus disosialisasikan salah satunya adalah melalui seminar-seminar dan media cetak. Hal tersebut dapat mendorong pemerintah untuk membuat kebijakan terkait pengolahan LTJ harus dilakukan di Indonesia.
9
Gambar 1.1. Roadmap Penelitian
2012
2013
2014
2015
2016
2017
GOAL
•
Paket teknologi
ekstraksi Gd
(dokumen
tekno-ekonomi,
QC)
•
Basic
Engineering
Design ekstraksi
logam Ce, Y, Nd
dan La
•Diperoleh kondisi reduksi optimum logam Ce dan Y perolehan >90%. •Kajian keekonomian difokuskan
pada kelayakan proses ekstraksi monasit
•kajian lingkungan proses ekstraksi metode asam dan basa
reduksi Y dan Nd perolehan >90%. •Diperolehnya kondisi optimum proses
ekstraksi Gd skala 5kg umpan dengan kemurnian dan perolehan >95% •Identifikasi dan evaluasi LTJ dalam abu
batubara
•Kajian keekonomian difokuskan pada kelayakan proses reduksi Ce •Kajian upaya pengelolaan lingkungan
proses reduksi
• Diperolehnya optimasi proses reduksi La dan Nd perolehan >90%
•Diperolehnya kondisi optimum proses ekstraksi Gd skala 25kg umpan dengan kemurnian dan perolehan >95%
•Desain pilot plant untuk produksi Gd dari monasit
•Ekstraksi LTJ dari abu batubara •Kajian proses reduksi Y, kelayakan
proses reduksi Y •Diperolehnya proses pengolahan tailing
timah menjadi monasit, ilmenit dan zirkon.
•Profil investasi pembangunan pabrik pengolahan taling timah
•Ekonomi lingkungan proses ekstraksi
• Uji coba pilot plant Gd
•Kajian keekonomian ekstraksi Gd •Kajian proses reduksi La dan
kelayakan pembangunan smelter La
•Diperolehnya kondisi optimum proses reduksi La perolehan >90%.
•Perancangan dan konstruksi pilot plant ekstraksi Gd
•Kajian proses reduksi Nd dan kelayakan pembangunan smelter Nd
9 1.3. Ruang Lingkup Kegiatan
Pada kegiatan tahun 2014 penelitian difokuskan pada optimasi proses reduksi logam Y dan Nd, ekstraksi Gd dan identifikasi LTJ dalam abu batubara dengan ruang lingkup kegiatan sebagai berikut :
a) Pengambilan contoh monasit, senotim, pasir zirkon, dan abu batubara.
b) Proses reduksi oksida logam tanah jarang menjadi logamnya dan ekstraksi Gd; 1) optimasi proses reduksi Y2O3
2) Proses reduksi Nd
menjadi logam Y
2O3
3) Ekstraksi Gd dari monasit.
menjadi logam Nd c) Identifikasi LTJ dalam abu batubara.
d) Analisis kajian proses reduksi Ce.
e) Penanganan limbah dari proses pengolahan monasit metode basah untuk pupuk TSP (triple super fosfat).
f) FGD tentang kemajuan dan kendala penelitian LTJ di Indonesia dengan instansi lain (BATAN, UI, BPPT, Kemenperin, PT. Timah, dll).
g) Sosialisasi hasil penelitian melalui seminar dan media cetak terkait logam tanah jarang di Indonesia.
h) Pembuatan laporan akhir. 1.4 Tujuan
1) Penguasaan teknologi proses reduksi LTJ khususnya Y dan Nd. 2) Penguasaan teknologi proses ekstraksi Gd dari monasit.
3) Identifikasi LTJ dalam abu batubara sehingga diketahui potensi LTJ yang merupakan material masa depan.
4) Tersedianya data kajian proses reduksi Ce.
5) Penguasaan teknologi penanganan dampak lingkungan pengolahan monasit dengan metode basa.
6) Mensinergikan aktivitas penelitian dan pengembangan LTJ guna mewujudkan industri LTJ di Indonesia.
10 1.5 Sasaran
a) Mendapatkan hasil yang optimal pada proses reduksi oksida logam tanah jarang menjadi logamnya khususnya Y dan Nd dengan perolehan >90%.
b) Mendapatkan hasil yang optimal pada proses ekstraksi Gd dari monasit dengan perolehan >95%.
c) Mendapatkan data identifikasi LTJ dalam abu batubara. d) Menghitung basic engineering design proses reduksi Ce.
e) Mengetahui penanganan dampak lingkungan proses pengolahan LTJ.
f) Terwujudnya konsorsium-konsorsium terkait penelitian LTJ untuk mendorong terwujudnya industri LTJ di Indonesia.
g) Tersosialisasikannya penelitian tentang pengolahan LTJ di media cetak dan seminar.
1.6 Lokasi/ Tempat Pelaksanaan Kegiatan
Lokasi pengambilan contoh monasit, senotim, dan pasir zirkon dilakukan di Propinsi Bangka Belitung. Pengambilan contoh abu batubara akan dilakukan di 3 (tiga) lokasi, yaitu di PLTU Ombilin, Sumatera Barat, PLTU Suralaya, Banten dan PLTU Cirebon, Jawa Barat. Sedangkan percobaan penelitian dilakukan di laboratorium Teknologi Pengolahan Mineral, Puslitbang Teknologi Mineral dan Batubara (tekMIRA) Bandung, Laboratorium PSTA dan PTBGN Batan. dan Laboratorium Kimia Analitik Universitas Padjajaran Bandung.
1.7Penerima Manfaat
Penelitian ini dapat memberikan manfaat khususnya bagi peneliti tekMIRA sendiri terkait dengan penguasaan teknologi ekstraksi logam-logam tanah jarang khususnya Ce, Y, La dan Nd. Sedangkan bagi eksternal tekMIRA yaitu Ditjen Minerba dapat dijadikan referensi atau acuan dalam mengambil kebijakan terkait dengan pengolahan LTJ di dalam negeri. Sedangkan bagi industri, dapat dijadikan sebagai acuan teknologi pengolahan LTJ dan profil investasi pengusahaan pembangunan pabrik pengolahan dan pemurnian mineral LTJ di dalam negeri.
11 II. TINJAUAN PUSTAKA
Monasit merupakan sumber utama logam tanah jarang ringan, diperoleh sebagai produk samping dari penambangan dan pengolahan mineral berat seperti ilmenit, rutil, dan zirkon (Australia, Brazilia, Cina dan India); serta kasiterit, ilmenit dan Zirkon (Malaysia, Thailand dan Indonesia).
Di Indonesia, berdasarkan hasil studi BATAN terdapat beberapa daerah potensi deposit monasit, yaitu Bangka Belitung, Karimata/Ketapang, Rirang-Tanah Merah (Atmawinata, 2011)
Logam tanah jarang tidak ditemukan berupa unsur bebas dalam lapisan kerak bumi, tetapi berbentuk senyawa kompleks. Untuk mendapatkan unsurnya, perlu dilakukan proses pemisahan terlebih dahulu dari senyawa kompleks tersebut. Jalur proses produksi logam tanah jarang dari bijih dapat dilihat pada Gambar 2.1.
Gambar 2.1. Jalur proses produksi LTJ dari bijih (Iags, 2012) 2.1. Ekstraksi LTJ dari Monasit
12 Ekstraksi LTJ dari monasit dapat dilakukan dengan 2 cara, yaitu: metode soda api (melarutkan konsentrat monasit dalam larutan asam (metode asam) dan larutan alkali (metode soda api).
2.1.1. Metode Asam
Metode asam dilakukan dengan pelindian bertekanan dalam autoclave menggunakan asam sulfat pada suhu 200 – 220 oC dilanjutkan dengan pelarutan
menggunakan air untuk membentuk larutan stabil dari LTJ-sulfat, Th-sulfat, dan U-sulfat. Residu yang dihasilkan mengandung silika dan mineral pengotor lainnya. Penambahan natrium sulfat menyebabkan LTJ mengendap sebagai endapan disulfat (RE2(SO4)3.Na2SO4.3H2O) yang merupakan LTJ-ringan. Thorium, beberapa LTJ-berat
dan pengotor lainnya seperti besi dan uranium tetap tertinggal sebagai larutan. Namun, thorium dalam jumlah yang signifikan juga ikut mengendap dengan LTJ-disulfat, sehingga membutuhkan proses pemurnian yang kompleks. Alasan tersebut menyebabkan metode asam ini tidak digunakan karena tidak menghasilkan produk yang murni. Diagram alir proses ekstraksi LTJ dengan metode asam dapat dilihat pada Gambar 2.2. Metode asam sulfat ini telah digunakan secara komersil di masa lalu tetapi saat ini metode tersebut sudah tidak digunakan karena tidak menghasilkan produk yang murni.
Konsentrat monasit Pelindian bertekanan H2SO4 panas filtrat quenching air es residu Mineral pengotor filtrat Pengendapan LTJ-disulfat Na2SO4
13 Gambar 2.2. Diagram alir proses ekstraksi LTJ metode asam
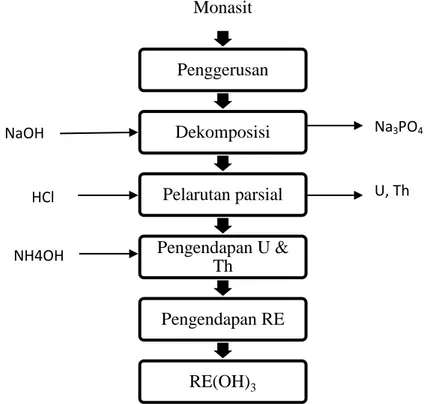
2.1.2. Metode Soda api
Metode soda api meliputi pelindian bertekanan menggunakan larutan natrium hidroksida pada suhu 140 – 150 oC selama 3 - 9 jam dalam 60 - 70% larutan natrium
hidroksida. Dibutuhkan natrium hidroksida sebanyak 0,75 kg/1 kg monasit untuk sempurnanya reaksi. Reaksi ini akan mengubah LTJ dan thorium dalam bentuk hidroksida. Senyawa fosfat dipisahkan dengan melarutkan LTJ dan thorium hidroksida dalam air panas sehingga akan membentuk larutan trisodium fosfat (Na3PO4), sedangkan LTJ dan thorium-hidroksida dalam bentuk padatan. Reaksi
yang terjadi dalam proses ini adalah (Shwe, et al, 2008):
RE(PO4) (s) + 3NaOH (aq) ⟶ RE(OH)2 (s) + Na3PO4 (aq)
Th3(PO4)4 (s) + 12NaOH (aq) ⟶ 3Th(OH)4 (s) + 4Na3PO4 (aq)
Larutan trisodium fosfat yang dihasilkan dari reaksi ini mengandung campuran fosfat 99,7% dan natrium hidoksida dengan konsentrasi 47%. Larutan selanjutnya diproses dalam evaporator vakum untuk membentuk kristal Na3PO4. Kristal selanjutnya
dipisahkan dari larutan NaOH dengan sentrifugal dan dikeringkan dengan hot air
pneumatic conveyor’ , menghasilkan produk yang mengandung P2O5 dengan kadar
17,5-19%. kalsinasi konsentrat LTJ-oksida filtrat Pelindian bertekanan NaOH padatan
14 Padatan yang mengandung campuran hidroksida dari LTJ, Th bersama-sama dengan uranium, besi, dan titanium ditambahkan larutan HCl 30% dengan mengatur pH pulp pada 3-4 dan suhu 70-80oC. Dengan perbedaan kebasaan dari masing-masing
senyawa, sebagian besar LTJ (97,7%) larut sebagai klorida dan sebagian besar senyawa-senyawa lainnya akan menjadi padatan hidroksida. Reaksi yang terjadi dalam proses ini adalah (Shwe, et al, 2008):
RE(OH)3 (s) + 3HCl (aq) ⟶ RECl3 (aq) + H2O (aq)
Larutan LTJ-klorida masih mengandung pengotor seperti thorium, uranium, besi dan radium. Pengotor tersebut dapat dihilangkan dengan menambahkan natrium hidroksida dan mengaturn pH pada 5,8, sehingga thorium, uranium, dan besi mengendap. Diagram alir proses ekstraksi LTJ dengan metode soda api ditunjukkan pada Gambar 2.3. Metode soda api ini lebih disukai dan paling banyak digunakan di dunia karena lebih ekonomis, mudah dalam penanganannya dan dapat menghasilkan produk samping yang dapat dijual yaitu fosfat, sedangkan pada metode asam fosfat akan hilang.
Gambar 2.3. Diagram alir proses ekstraksi LTJ dengan metode soda api
Monasit
Penggerusan
Dekomposisi
Pelarutan parsial
Pengendapan U &
Th
Pengendapan RE
RE(OH)
3 NaOH Na3PO4 HCl U, Th NH4OH15 2.2. Reduksi Oksida LTJ menjadi logam
Logam-logam tanah jarang dapat dipisahkan dengan mereduksi oksidanya menjadi logam dengan kemurnian hampir 95% tergantung dari pengotornya. Metode untuk mereduksi oksida-LTJ dapat dilakukan melalui:
1. Proses elektrolisis 2. Proses metalotermik 1. Proses elektrolisis
Proses ini dibagi menjadi dua : • Dekomposisi dari RE-Cl3
• Dekomposisi RE-oksida dengan melarutkannya dalam garam flourida. dengan melarutkannya dalam lelehan garam alkali atau alkali tanah.
Metode elektrolisis ini memiliki beberapa kelemahan, yaitu: penggunaan elektroda yang mahal dan cukup konsumtif, penggunaan garam klorida atau flourida untuk mencegah pembentukan garam REOCl yang tidak diinginkan, membutuhkan suhu yang tinggi (>1000oC), perolehan logam rendah (<40%), dan proses reduksi RE-Cl
3
2. Proses Metalotermik
akan menghasilkan gas klorin yang sangat korosif. Sedangkan kelebihannya adalah proses ini dapat dilakukan secara kontinu.
Proses ini dibagi menjadi dua, yaitu: • Reduksi RE-F3
• Reduksi RE-O
dengan logam Ca (calciothermic process).
2
Proses metalotermik ini memiliki kerugian yaitu: suasana proses non-oksidasi dan membutuhkan energi yang tinggi. Sedangkan kelebihannya perolehan logam yang dihasilkan >90%. Proses metalotermik yang sedang dikembangkan saat ini adalah
Ames Process yang dikembangkan di Amerika. Ames Process ditujukan untuk
membuat logam tanah jarang dengan kemurnian yang tinggi dan mendapatkan uranium untuk Proyek Manhattan melalui reduksi metalotermik dari garam-logam menggunakan logam alkali tanah.
dengan logam Ca.
16 Dalam proses ini, tanah jarang flourida (RF3) direduksi dengan logam Ca
menghasilkan logam tanah jarang dan terak kalsium flourida. RF3 dihasilkan dengan
mereaksikan tanah jarang oksida (R2O3) dengan asam flourida (HF) sesuai dengan
reaksi dibawah ini:
R2O3 + 6HF -> 2RF3 + 3H2O
Selain itu, Proses Ames juga mencakup reduksi langsung dari oksida tanah jarang dengan lantanum untuk empat logam tanah jarang yang memiliki tekanan uap yang sangat tinggi yaitu; Sm, Eu, Tm, dan Yb.
R2O3 + 2La -> La2O3 + 2R(g)
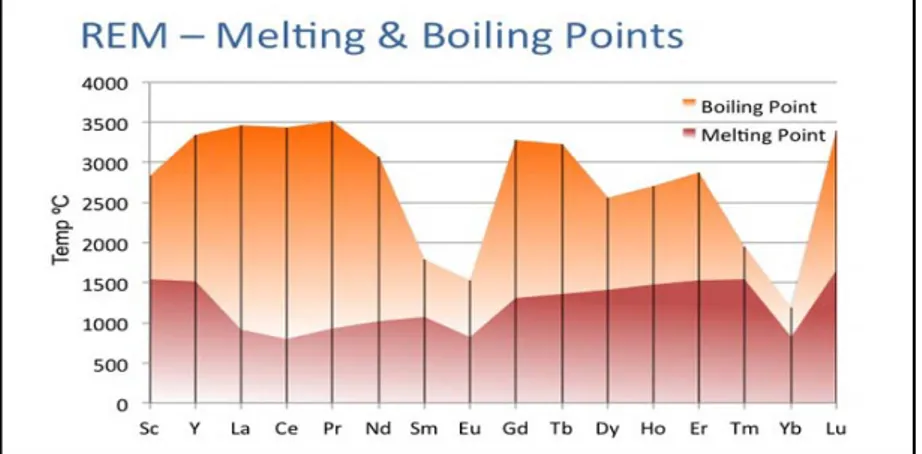
Penggunaaan logam lantanum untuk mereduksi langsung oksida tanah jarang, spesies yang memiliki tekanan uap tinggi dipisahkan dengan cara sublimasi, sehingga keluar sebagai gas yang terkondensasi kemudian dipadatkan dalam kondensor. Pemilihan metode untuk mereduksi oksida tanah jarang dapat ditentukan berdasarkan titik leleh-didih logam tanah jarang yang dapat dilihat pada
Gambar 2.4. Grafik grafik di Gambar 2.4.
titik leleh-didih logam tanah jarang(Riedenman, 2011) Dari grafik terlihat jelas titik didih dan leleh dari tiap-tiap logam tanah jarang. Titik didih merupakan indikator tekanan uap relatif terhadap masing-masing logam. Jika grafik tersebut disusun ulang berdasarkan kenaikan berat atom terhadap kenaikan titik didih maka akan diperoleh grafik seperti pada Gambar 2.5.
17 Gambar 2.5. Grafik titik didih- leleh LTJ berdasarkan kenaikan berat atomnya
( 4 ) Titik leleh rendah, tekanan uap logam rendah. • Reduksi dengan logam kalsium dari fluoridanya.
(Riedenman, 2011)
Jalur proses untuk membuat logam tanah jarang dapat ditentukan berdasarkan 4 (empat) jalur proses seperti pada grafik diatas. Keempat jalur proses tersebut: ( 1 ) Titik leleh rendah ke leleh tinggi, sangat tinggi tekanan uap logam. • Reduksi langsung oksidanya/sublimasi.
• Pemurnian dilakukan dengan sublimasi.
( 2 ) Titik leleh tinggi, cukup tinggi tekanan uap logam. • Reduksi dengan logam kalsium dari bentuk fluoridanya.
• Vacuum casting untuk menghilangkan pengotor yang mudah menguap.
• Sublimasi untuk menghilangkan spesi yang tidak menguap.
( 3 ) Titik leleh sedang ke titik leleh tinggi, tekanan uap logam sedang. • Reduksi dengan logam kalsium dari bentuk flouridanya.
• Vacuum casting untuk menghilangkan pengotor yang mudah menguap.
18
• Vacuum casting untuk menghilangkan pengotor yang mudah menguap.
• pengendapan Tantalum (Ta).
Pada proses ke-4, tekanan uap menurun ke tingkat yang rendah sehingga tidak dapat dilakukan proses sublimasi atau distilasi. Neodymium (Nd) memiliki tekanan uap yang mendekati Skandium (Sc). Namun, Nd memiliki kelarutan yang jauh lebih rendah dari Ta, sehingga kemurnian Nd tinggi untuk proses ke-4 ini.
2.3. Pengolahan Limbah dari Ekstraksi Monasit
Ekstraksi LTJ dari monasit dengan metode asam ataupun basa (seperti yang telah diuraikan pada 2.1.) semuanya akan menghasilkan limbah cairan. Pengolahan limbah cair ekstraksi LTJ yang menggunakan metode asam telah ditemukan dan dipatenkan. Diantaranya oleh Guoping (2013), Tancui Li dkk (2013) dan Zhiqiang dkk (2012). Pada intinya, mereka berhasil memisahkan antara asam dengan bahan lainnya seperti minyak dan oksalat. Proses daur ulang yang dilakukan menghasilkan asam yang dapat digunakan kembali untuk mengekstraksi LTJ. Metode basa untuk mengekstraksi LTJ menghasilkan limbah cair yang bersifat basa. Kandungan utama limbah cair tersebut adalah Na3PO4. Penelitian yang telah dilakukan untuk
menangani limbah ini adalah dengan memurnikan kristal Na3PO4. Na3PO4 hasil
penyaringan dimurnikan dengan melarutkan dalam air sambil diaduk selama 5 menit dan didiamkan selama 12 jam sampai Kristal Na3PO4 terbentuk (Waluyo, 2005). Hasil
penelitian tersebut dilanjutkan dengan merancang peralatan pemurniannya. Rancangan alat pemurnian kristal Na3PO4
Senyawa fosfat yang berasal dari limbah cair hasil ekstraksi LTJ secara basa, mempunyai potensi untuk dikembangkan sebagai bahan dasar pembuatan pupuk berbasis fosfat. Senyawa fosfat merupakan salah satu nutrisi utama tanaman disamping nitrogen dan kalium.fosfat dapat memacu pertumbuhan akar dan generatif tanaman. Indonesia sebagai negara agraris sangat membutuhkan pupuk.
terdiri dari 2 tangki pelarutan dan 2 tangki pengendapan (Nuri, 2009).
19 Biasanya pupuk fosfat dibuat dari batuan fosfat alam. Namun karena kandungan fosfat didalamnya tidak memenuhi spesifikasi sebagai bahan pembuat pupuk, maka perlu ditambahkan bahan lain, misalnya asam sulfat atau asam fosfat. Selain untuk mempertinggi kandungan fosfat agar memenuhi spesifikasi yang dibutuhkan (Tabel 2.1), penambahan bahan asam ini juga dimaksudkan agar pupuk menjadi mudah larut dalam air.
Table 2.1. Kategori pupuk super fosfat. Kategori pupuk Kandungan P2O5, % Single super fosfat Minimal 13 Double super fosfat Minimal 38 Triple super fosfat Minimal 43
Sumber : Standar Industri Indonesia (SII) No. 0029 tahun1973
Pembuatan pupuk super fosfat pada prinsipnya adalah mengubah senyawa trikalsium fosfat yang tidak larut dalam air menjadi senyawa yang mudah larut dalam air sehingga dapat dimanfaatkan oleh tanaman. Pengubahan senyawa kalsium fosfat menjadi senyawa yang mudah larut dalam air dapat dilakukan dengan dua cara pengasaman, yaitu menggunakan asam sulfat dan asam fosfat (Ridwan, 2011). Pengasaman dengan asam sulfat terdiri dari dua tahap. Pertama adalah difusi asam sulfat ke dalam senyawa fosfat (Ca3PO4) disertai dengan reaksi kimia yang
berlangsung cepat pada permukaan partikel. Selanjutnya adalah habisnya seluruh asam sulfat dan terjadinya kristalisasi kalsium sulfat, sesuai reaksi kimia berikut :
Ca3(PO4)2 + 2 H2SO4 + H2O Ca(H2PO4)2H2O + 2 CaSO
Ca
4
Tahap kedua adalah difusi asam fosfat ke dalam pori-pori partikel batuan fosfat yang tak terdekomposisi, sesuai reaksi kimia berikut:
20 Pupuk triple super phosphate (TSP) dibuat dengan tanpa penambahan asam sulfat. TSP dengan kandungan P2O5 antara 44-52% tentunya lebih baik jika dibandingkan
dengan super phosphate lainnya yang hanya mengandung P2O5
2.4. Identifikasi LTJ dalam Abu Batubara
kurang dari 36%. Pupuk TSP dibuat berbentuk granular agar memudahkan petani dalam pemupukan. Selain itu dimaksudkan pula agar pupuk tersebut tidak langsung larut dan terbuang percuma bila terkena air di lahan pertanian.
Abu Batubara
Abu batubara merupakan hasil samping dari proses pembakaran batubara pada boiler pembangkit listrik tenaga uap (PLTU). Pada proses pembakaran batubara, beberapa batubara yang terbakar jatuh dan terkumpul pada bagian bawah boiler serta sebagian turut terbawa oleh gas buang lalu ditangkap oleh presipitator elektrostatik (Electrostatic Precipitator/ESP) yang selanjutnya dilepaskan ke batangan berbentuk saringan, sehingga partikel halus yang lewat dapat dikumpulkan secara proses mekanik. Dari peristiwa tersebut maka hasil samping pembakaran batubara dibedakan menjadi 4 macam, yaitu:
• Abu terbang (fly ash)
Abu terbang merupakan abu batubara paling halus dan terbentuk dari bahan mineral batubara yang terdiri dari bahan-bahan yang tidak terbakar ditambah sejumlah kecil sisa karbon dari pembakaran yang tidak sempurna. Abu terbang memiliki warna lebih terang dan memiliki butiran bundar amorf dan bersifat semen
(cementitious) atau pozzolan (Pozzolanic). Bahan bersifat semen adalah bahan yang
bila dicampur dengan air akan mengeras, sedangkan bahan bersifat pozzolan akan mengeras apabila dicampur air setelah diaktivasi dengan senyawa alkali seperti kapur. Dengan adanya sifat tersebut, abu terbang dapat dimanfaatkan untuk berbagai keperluan bangunan.
Sifat-sifat abu terbang tergantung pada komposisi batubara dan kondisi-kondisi operasional pabrik/PLTU. Komponen utama abu terbang secara umum tercantum
21 pada tabel 2.2, sedangkan unsur-unsur lainnya dengan jumlah kurang dari 0,1 % dikenal sebagai unsur-unsur runutan (Tabel 2.3).
Tabel 2.2. Komposisi Kimia rata-rata dari Abu Terbang % berat
Komponen Bituminus Subbituminus Lignit
SiO2 20 - 60 40 - 60 15 - 45 Al2O3 5 - 35 20 - 30 10 - 25 Fe2O3 10 - 40 4 - 10 4 - 15 CaO 1 - 12 5 - 30 15 - 40 MgO 0 - 5 1 - 6 3 - 10 SO3 0 - 4 0 - 2 0 - 10 Na2O 0 - 4 0 - 2 0 - 6 K2O 0 - 3 0 - 4 0 - 4 LOI 0 - 15 0 - 3 0 - 5
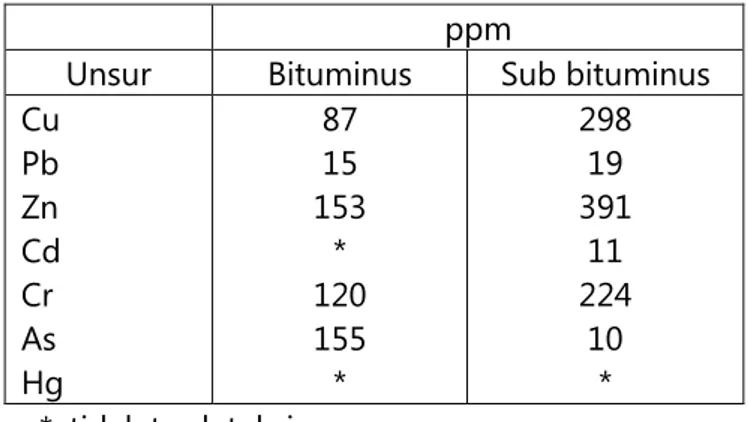
Tabel 2.3. Hasil Analisis Kimia Unsur Runutan Abu Batubara ppm
Unsur Bituminus Sub bituminus Cu Pb Zn Cd Cr As Hg 87 15 153 * 120 155 * 298 19 391 11 224 10 * *: tidak terdeteksi
• Abu dasar (bottom ash)
Abu terbang dan abu dasar batubara sangat berbeda secara fisik, mineralogi, dan kimia. Abu dasar merupakan fraksi kasar, butiran, hasil samping tidak terbakar yang dikumpulkan dari bagian bawah tungku (furnace) tempat pembakaran batubara dari
22 generator uap, pembangkit listrik, atau keduanya. Abu dasar lebih kasar dari abu terbang dengan ukuran antara pasir dan kerikil serta memiliki warna abu-abu gelap. Berdasarkan sifatnya, abu dasar ini dapat digunakan sebagai campuran agregat atau sebagai bahan pengisi (filler). Jenis abu dasar yang dihasilkan tergantung tipe tungku yang dipakai untuk membakar abu batubara.
• Boiler slag (terak)
Boiler slag adalah serbuk lebih kasar dari abu terbang yang biasa dan terbentuk
dalam siklon-siklon boiler yang menghasilkan debu-debu cair yang didinginkan dengan air. Umumnya, boiler slag merupakan butiran kasar berwarna hitam yang dapat dimanfaatkan untuk berbagai keperluan teknik (engineering).
• Flue gas desulfurization (FGD) gipsum
FGD gipsum juga dikenal sebagai scrubber gypsum. FGD adalah hasil samping dari sistem kontrol polusi udara yang melepaskan sulfur dari gas cerobong ke dalam kalsium memakai sistem scrubbing, sehingga komposisinya paling banyak adalah kalsium sulfat. FGD gipsum banyak digunakan untuk keperluan pertanian dan produksi papan gipsum.
Dari keempat jenis hasil samping pembakaran batubara tersebut, abu terbang dan abu dasar yang banyak dihasilkan dalam jumlah besar, sehingga diperlukan pengelolaan agar tidak mencemari lingkungan.
III. PROGRAM KEGIATAN
Kegiatan tahun 2014 terdiri dari 6 (enam) tahapan terdiri dari persiapan, pengambilan contoh, proses ekstraksi LTJ, kajian lingkungan proses ekstraksi dan FGD. serta pembuatan laporan akhir. Rincian masing-masing tahapan sebagai berikut :
23 a. Studi literatur/koordinasi ke instansi terkait
Studi literatur dilakukan untuk memperoleh data sekunder tentang teknologi proses yang sudah ada serta penelitian yang sudah pernah dilakukan yang berkaitan dengan kegiatan. Sumber literatur diperoleh dari perpustakaan-perpustakaan instansi terkait, jurnal elektronik dan laman-laman jaringan elektronik. Koordinasi dilakukan dengan instansi-instansi yang telah melakukan penelitian LTJ yaitu; PTAPB-BATAN yogyakarta, PPGN-BATAN Jakarta, Universitas Indonesia, BPPT, Balai Besar Logam dan Mesin, PT. Timah, Universitas Padjajaran. b. Pembuatan Rencana Operasional
Pembuatan rencana operasional dilakukan dari hasil studi literatur dengan bantuan alat-alat tulis kantor.
c. Persiapan peralatan
Peralatan yang tersedia di laboratorium pengolahan mineral Puslitbang tekMIRA yang hendak digunakan disiapkan sehingga dalam kondisi siap pakai. Persiapan peralatan dilakukan oleh para anggota pelaksana kegiatan.
Output dari tahap persiapan adalah tersusunnya Rencana Operasional yang berasal dari penelusuran literatur berupa buku teknis dan ekonomi, dan jurnal elekronik. Selain itu peralatan laboratorium siap pakai.
3.2.Pengambilan contoh
Pengambilan contoh bertujuan untuk memperoleh data primer maupun sekunder. Data primer meliputi informasi langsung dari perusahaan–perusahaan penghasil/sumber LTJ, pengambilan dan sampling contoh monasit, senotim, pasir zirkon dan abu batubara. Pengambilan contoh dilakukan di lokasi Bangka, PLTU Ombilin, Sumatera Barat, PLTU Suralaya, Banten dan PLTU Cirebon, Jawa Barat. Untuk seluruh kegiatan lapangan di koordinir langsung oleh ketua dan Wakil Ketua Tim, surat menyurat dan administrasi dilakukan oleh sekretaris tim.
24 Output dari kegiatan ini adalah diperolehnya bahan baku berupa contoh monasit, senotim, pasir zirkon dan abu batubara.
3.3. Proses Ekstraksi LTJ
1. Karakterisasi bahan baku
Bahan baku yang berupa monasit, senotim, dan pasir zirkon serta abu batubara dikarakterisasi dengan melakukan analisis kimia dan fisika menggunakan ICP, TGA, dan SEM untuk mengetahui kandungan/komponen khususnya LTJ baik yang berkadar tinggi maupun yang sangat kecil yang terkandung dalam monasit.
2. Karakterisasi oksida logam tanah jarang dari BATAN
Bahan baku untuk proses reduksi berupa oksida logam tanah jarang diperoleh dari PTAPB-BATAN dikarakterisasi dengan melakukan analisis kimia dan fisika menggunakan ICP, TGA, dan SEM untuk mengetahui kandungan/komponen dalam oksida logam tanah jarang.
3. Proses Reduksi oksida logam tanah jarang menjadi logam
Proses reduksi dilakukan dengan jalur pirometalurgi melalui proses reduksi dengan aluminium, natrium dan magnesium untuk mendapatkan logam tanah jarangnya.
4. Proses ekstraksi Gd dari monasit
Proses ekstraksi dilakukan dengan ektraksi pelarut menggunakan ligan khusus. Output tahap ini adalah diperoleh kondisi proses yang optimum dan recoveri Y, Nd dan Gd yang tertinggi.
3.4. Kajian lingkungan proses ekstraksi
Kajian lingkungan dilakukan dengan mengolah limbah larutan hasil pengolahan monasit menjadi LTJ-hidroksida yang telah dilakukan oleh PTBGN-Batan.
25 Output dari tahap ini adalah teknologi proses pengolahan limbah proses ekstraksi LTJ.
3.5. Forum Group Discussion (FGD) logam tanah jarang
FGD logam tanah jarang dilakukan untuk mensinergikan kegiatan/data; potensi, teknologi, kebijakan, dan industri.
Output tahap ini adalah adanya sinergi dalam bentuk penelitian bersama tentang logam tanah jarang
3.6. Pembuatan laporan akhir
Seluruh pelaksanaan dan hasil kegiatan penelitian dituangkan dalam satu laporan akhir yang disertai ringkasan eksekutif.
Output tahap ini adalah laporan akhir dan ringkasan eksekutif serta tulisan ilmiah yang siap dipublikasikan.
IV. METODOLOGI 4.1. Peralatan
Penggunaan peralatan disesuaikan dengan tahapan kegiatan reduksi oksida logam tanah jarang yang dilakukan. Tahapan kegiatan terdiri dari 2 (dua) yaitu preparasi bahan baku, proses reduksi oksida LTJ menjadi logamnya. Peralatan yang dipakai untuk setiap tahapan kegiatan adalah sebagai berikut :
1) Preparasi sampel, oksida logam tanah jarang yang digunakan dilakukan penggerusan dengan ring mill. Peralatan pendukung lain yang diperlukan adalah kuas, splitter, timbangan dan plastik untuk wadah sampel;
2) Proses reduksi oksida-LTJ dilakukan dengan alat-alat peleburan menggunakan resistance furnace, muffle furnace. Selain itu diperlukan masker, sarung tangan sebagai alat bantu keamanan kerja;
26 4.2. Bahan
Bahan-bahan yang diperlukan untuk kegiatan penelitian adalah sebagai berikut : 1) ferosilikon; 2) aluminium powder; 3) kalsium klorida; 4) magnesium powder; 5) natrium powder; 6) grafit;
7) asam sulfat teknis; 8) NaOH teknis; 9) amonia teknis; 10)asam oksalat teknis; 11)asam nitrat teknis; 12)KBrO3 13)ammonium vanadat; ; 14) ammonium molibdat; 15) EDTA; 16) H3PO4 17) kalsium hidroksida; ; 18) gadolinium oksida; 19) etil asetat; 20) metanol; 21)P2S5 22)natrium asetat; ; 23)HCl; 24)n-butanol; 25)n-heksana; 4.3. Metode
27 oksida-LTJ penggerusan -150 mesh reduksi logam LTJ
Metode yang dilakukan pada proses reduksi Y dan Nd di dalam penelitian secara garis dapat dilihat pada Gambar 4.1
Gambar 4.1. Diagram alir proses penelitian 4.3.2. Pengolahan Limbah Proses Ekstraksi LTJ
Metode penelitian untuk pengolahan limbah proses ekstraksi yang dimanfaatkan untuk pembuatan pupuk fosfat dari Na3PO4 (limbah ekstraksi logam tanah jarang
dengan metode basa) tersaji pada Gambar 4.2.
Pengadukan
Penyaringan
Bahan baku Na3PO4 Ca(OH)2
NaOH
28 Gambar 4.2. Pengolahan limbah proses ekstraksi yang dimanfaatkan untuk
pembuatan pupuk fosfat 4.3.3. Ekstraksi Gd-Oksida
Metode yang dilakukan untuk proses ekstraksi Gd-oksida dapat dilihat pada Gambar 4.3.
Pengadukan
Penyaringan
Pengadukan
Penyaringan
Super Fosfat Tripel Super Fosfat
LTJ-oksida
Pelarutan & pengendapan
LTJ-berat (Dy, Tb, Y) LTJ-sedang (Gd, Sm, Eu) LTJ-ringan (Ce, La, Pr, Nd)
29 Gambar 4.3. Diagram alir proses untuk mendapatkan Gd-oksida dari LTJ-oksida
V. HASIL DAN PEMBAHASAN
Hasil dan Pembahasan ini dibagi menurut kegiatan penelitiannya, yaitu; pemanfaatn limbah proses pengolahan monasit menjadi LTJ-hidroksida, karakterisasi LTJ dalam abu batubara, ekstraksi gadolinium oksida, dan reduksi serium oksida dan yttrium oksida menjadi logam Ce dan Y.
5.1.
Pemanfaatan Limbah Proses Pengolahan Monasit menjadi LTJ-hidroksida Contoh limbah cair yang digunakan dalam penelitian ini berasal dari limbah cair pengolahan LTJ dari monasit secara basa yang dilakukan oleh Pusat Teknologi Bahan Galian Nuklir BATAN, Jakarta. Hasil analisis kimia contoh limbah cair tersebut ditunjukkan pada Tabel 5.1.Kompleks Gd Sm Eu
30 Gambar 5.1. Contoh limbah
Tabel 5.1. Kandungan kimia limbah
Derajat keasaman contoh menunjukkan bahwa contoh bersifat sangat basa dengan pH 13. Ini menunjukkan bahwa proses dekomposisi yang menggunakan NaOH dilakukan berlebih. Sisa NaOH menyebabkan derajat keasaman contoh menunjukkan 13. Bila contoh limbah ini dibuang secara langsung ke badan air, tentunya akan merusak ekosistem. Nilai derajat keasaman contoh limbah jauh lebih tinggi bila dibandingkan dengan aturan yang berlaku. Nilai ambang batas derajat keasaman sesuai dengan Peraturan Pemerintah Nomor 82 tahun 2001 tentang pengelolaan kualitas air dan pengendalian pencemaran air adalah 6-9. Oleh karenanya limbah ini harus diolah agar tidak mencemari lingkungan.
Unsur Satuan Nilai
PO4 mg/l 361,1
Si g/l 0,36
Na g/l 60,60
U mg/l 15,885
31 Kandungan Na dan Si dalam contoh besar. Hal ini disebabkan Si yang terdapat dalam mineral monasit terlarut saat proses dekomposisi menggunakan NaOH membentuk senyawa natrium silikat, sesuai reaksi kimia :
2 NaOH + SiO2 Na2SiO3 + H2O
Hasil analisis juga menunjukkan bahwa contoh mengandung unsur radioaktif, yaitu uranium (U) dan thorium (Th). Metode penanganan unsur radioaktif telah banyak dilakukan. Salah satu metode penanganan zat radioaktif adalah metode adsorpsi menggunakan lempung (Sunardi dkk, 2011). Hasil penelitiannya menunjukkan angka faktor dekontaminasi yang menunjukkan perbandingan aktifitas sebelum dan sesudah diolah mencapai 98,1300. Metode lainnya dan telah dipatenkan adalah dengan menggunakan hidrogen peroksida pada suhu 60-90oC (Masami dkk, 1985).
Kandungan fosfat dalam contoh limbah adalah berasal dari mineral monasit. Monasit merupakan senyawa fosfat logam tanah jarang yang mengandung 50-70% oksida LTJ. Terdapat 3 jenis monasit, yaitu monasit-Ce (Ce, La, Nd, Th, Y)PO4,
monasit-La (La, Ce, Nd)PO4 dan monasit Nd (Nd, La, Ce)PO4 (Suprapto, 2009). Fosfat
akan terlarut saat dekomposisi monasit dengan NaOH membentuk senyawa Na3PO4
5.1.1. Variasi Penambahan Kalsium Klorida .
Kalsium klorida (CaCl2) digunakan sebagai bahan pengendap senyawa fosfat dalam
contoh limbah. Reaksi kedua bahan tersebut akan menghasilkan endapan kalsium fosfat sesuai reaksi kimia berikut :
32
a. b. c.
Gambar 5.2. Proses pengendapan contoh: a. sesaat setelah penambahan CaCl2, b.
setelah pengadukan selama 45 menit, c. setelah pengadukan selesai.
Pengendapan contoh dilakukan sambil diaduk dengan kecepatan putar 450-500 rpm. Hasil pengamatan menunjukkan terjadi penggumpalan sesaat setelah penambahan CaCl2. Penggumpalan ini diperkirakan terjadi karena ukuran partikel
terdispersi yang cukup besar. Biasanya berukuran lebih dari 1000 nm. Fenomena ini dikenal dengan sol yaitu sistem koloid dari partikel padat yang terdispersi dalam zat cair. Contoh limbah menjadi homogen setelah pengadukan berlangsung selama 45 menit dan akan mengendap sempurna setelah didiamkan selama 1 malam (Gambar 5.2.).
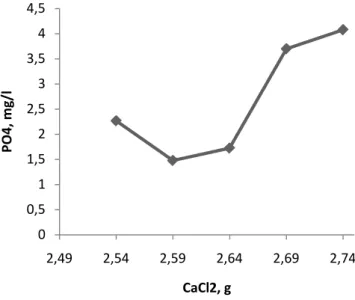
Sesuai dengan perhitungan stoikhiometri dari reaksi kimia diatas, maka dibutuhkan paling sedikit 2,5438 g CaCl2. Hasil pengujian kadar fosfat dalam filtrat terhadap
33 Gambar 5.3. Hasil pengujian kadar fosfat terhadap variasi penambahan CaCl2.
Tabel 5.2. Perolehan senyawa fosfat CaCl2, g Perolehan, % 2,54 99,37 2,59 99,59 2,64 99,52 2,69 98,89 2,74 98,87
Penambahan CaCl2 yang optimum adalah sebesar 2,59 g, yaitu saat perolehan
maksimum mencapai 99,59%. Setelah penambahan CaCl2 2,59 g, terjadi peningkatan
kandungan fosfat dalam filtrat. Penaikan kadar fosfat setelah melewati titik optimumnya dimungkinkan oleh adanya pengaruh kelarutan dari senyawa kalsium fosfat. Kelarutan senyawa kalsium fosfat pada suhu 25oC dengan nilai konstanta hasil
kali kelarutan atau Konstanta solubility product (Ksp) 1.10-26 adalah 3,08.10-6 mol/l (=
�1.10−2636 5 ). 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 2,49 2,54 2,59 2,64 2,69 2,74 PO 4, m g/ l CaCl2, g
34 2 Na3PO4 + 3 CaCl2 6 NaCl + Ca3(PO4)2
3 Ca2+ + 2 PO
4
-Gambar 5.4. Kalsium fosfat hasil pengendapan Tabel 5.3. Hasil analisis kalsium fosfat
Hasil analisis kimia terhadap endapan kalsium fosfat menunjukkan kandungan rata-rata kalsium dan fosfat dari penambahan 10,36 g CaCl2 ke dalam 400 ml contoh
berturut-turut adalah 24,8 dan 41,0% (Tabel 5.3.). Kemurnian kalsium fosfat hanya 65,8 %. Ini menunjukkan bahwa masih terdapat pengotor dalam senyawa kalsium fosfat. Oleh karena itu perlu dilakukan peningkatan kadar kalsium fosfat.
Kode contoh Ca, % PO4, % CP-1 25,3 41,1 CP-2 24,0 40,0 CP-3 25,1 41,9
5.1.2. Pemurnian Kalsium Fosfat
Kemurnian kalsium fosfat yang terbentuk dari penambahan CaCl2 masih belum
35 kandungan silika dalam contoh limbah tinggi. Silika akan bereaksi dengan kalsium dari CaCl2 yang ditambahkan membentuk kalsium silikat.
Na2SiO3 + CaCl2 2 NaCl + CaSiO3
Terdapat berbagai cara untuk memisahkan silika. Diantaranya dengan memakai bahan kimia pelarut silika seperti asam fluoride (HF). Asam ini sangat spesifik untuk melarutkan silika. SiF4 akan mudah dibuang melalui pemanasan.
SiO2 + 4 HF SiF4 + 2 H2O
Namun cara tersebut tidak dilakukan karena HF adalah bahan berbahaya. Material
Safety Data Sheet dengan kode SLH2227 menjelaskan bahwa HF dapat
menyebabkan bahaya akut bila mengenai kulit, mata dan merusak tenggorokan. HF juga bersifat toksik terhadap paru-paru, selaput lendir, kulit, mata, tulang dan gigi yang menyebabkan bahaya kronis.
Untuk itu kemurnian kalsium fosfat dapat ditingkatkan dengan memilih cara yang paling aman. Caranya yaitu dengan menambahkan sejumlah air ke dalam kalsium fosfat, diaduk dan dibiarkan mengendap. Setelah diaduk, pengotor akan lebih lama mengendap dibandingkan dengan kalsium fosfat. Ini disebabkan berat molekul pengotor (CaSiO3 = 116,09) jauh lebih kecil dibandingkan berat molekul Ca3(PO4)2
yaitu 308. Ilustrasi ini lebih jelas terlihat pada Gambar 5.5.
36 b.
Gambar 5.5. Pemisahan pengotor dari kalsium fosfat : a. saat pengadukan. b. setelah pengadukan selesai dan didiamkan selama 5 menit.
Pencucian dilakukan hingga derajat keasaman yang semula basa (pH = 12) turun menjadi netral (pH =7). pH basa dalam kalsium fosfat dimungkinkan karena adanya anion OH- dari Ca2+ atau Na+. Ksp Ca
3(PO4) yang sangat kecil menyebabkan
pemisahan kalsium fosfat dari pengotornya mudah dilakukan. Hasil pengukuran pH (triplo) setelah penambahan 500 ml air, diaduk selama 5 menit dan dibiarkan selama 5 menit adalah sebagai berikut :
Tabel 5.4. Hasil pengukuran pH setelah pencucian. Pencucian ke- pH 1 12 12 12 2 11 10-11 11 3 10 10 10 4 9 9 9 5 8-9 8-9 8-9
37 Setelah pencucian ke 7 dihasilkan kemurnian kalisum fosfat yang meningkat lebih dari 1,4 kali dibandingkan sebelumnya. Kemurnian kalsium fosfat hasil proses pemisahan dengan pengotornya mencapai 95,7%. Hasil analisisnya terlihat pada tabel 5.5.
Tabel 5.5. Hasil analisis kalsium fosfat setelah pemurnian
Contoh Ca, % PO4, % 1 37,5 56,5 2 36,4 58,8 3 39,7 58,3 Rata-rata 37,9 57,9
Berat pengotor yang hilang dengan proses ini sebesar 23,3% seperti yang ditunjukkan oleh hasil penimbangan berat contoh yang dilakukan (Tabel 5.6.). Sebagian besar pengotor ini diperkirakan mengandung senyawa silikat dari kalsium. Pada penelitian ini tidak dilakukan kajian lebih dalam terhadap pengotor ini.
Tabel 5.6. Berat kalsium fosfat hasil pemurnian.
6 8 8 8 7 7 7 7 Contoh kalsium fosfat Berat sebelum pemurnian, g Berat setelah pemurnian, g 1 7 5,1742 2 7 5,6836 3 7 5,2496 Rata-rata 7 5,3691
38 5.1.3. Variasi Penambahan Asam Fosfat
Pupuk TSP dibuat dengan mereaksikan asam fosfat dengan kalsium fosfat hasil pemurnian. Reaksi yang terjadi adalah:
Ca3(PO4)2 + 2 H3PO4 3 Ca(H2PO4)2 + 2 CaSO4
Variasi penambahan 0,65, 0,74 dan 0,75 ml asam fosfat 85% terhadap 1,5 g contoh kalsium fosfat hasil pengolahan limbah ekstraksi LTJ dilakukan dan menghasilkan kadar P2O5 sebagai berikut:
Tabel 5.7. Hasil analisis P2O5 produk TSP
Volume H3PO4, ml P2O5, %
0,65 49,5
0,74 52,8
0,75 63,5
Kadar P2O5 pada penambahan 0,65 ml asam fosfat 85% telah memenuhi spesifikasi
pupuk TSP sesuai SNI 02-0086-2005 tentang pupuk tripel super fosfat (TSP). Beberapa persyaratan dalam SNI tersebut telah dipenuhi (Tabel 5.8.).
Tabel 5.8. Kualitas TSP
Parameter Satuan SNI
02-0086-2005
TSP hasil percobaan Fosfor sebagai P2O5
• Total
• Larut dalam asam sitrat 2% % % Min. 45 Min. 40 49,5 44,5
39
Gambar 5.6. TSP hasil percobaan.
Hasil pengujian Laboratorium Pusat Teknologi Bahan Galian Nuklir BATAN menunjukkan bahwa contoh produk TSP yang dihasilkan masih mengandung unsur radioaktif uranium (U) dan thorium (Th) berturut-turut adalah 316,6875 dan 31,0625 ppm.
5.2.
Karakterisasi dan Identifikasi LTJ dalam Abu BatubaraMineral LTJ dalam abu batubara yang utama adalah Monazit ((Ce,La,Y,Th)PO3) dalam
fasa an-organik. Pada abu dasar, kristal monasit terperangkap dalam fasa gelas (Ekkmann, 2012). Karakterisasi untuk identifikasi LTJ dalam abu batubara dilakukan terhadap contoh abu batubara yang diambil dari 3 (tiga) lokasi, yaitu; PLTU Ombilin, PLTU Cirebon Elektrik Power, dan PLTU Suralaya. Contoh abu batubara tersebut kemudian dianalisis menggunakan XRF dan ICP untuk mengetahui komposisi semua unsur yang terkandung dalam contoh tersebut.
PLTU Ombilin
Hasil analisis XRF terhadap abu batubara (abu terbang dan abu dasar) PLTU Ombilin dapat dilihat pada Tabel 5.9.
40
komponen Satuan Abu terbang Abu dasar
SiO2 % 52,06 37,90 Al2O3 % 31,10 18,62 Fe2O3 % 4,26 5,02 MnO % 0,015 0,024 MgO % 0,75 0,64 CaO % 1,43 3,63 Na2O % 0,15 0,17 K2O % 4,21 2,38 TiO2 % 0,60 0,40 P2O5 % 0,092 0,078 SO3 % 0,37 1,15 BaO % 0,023 0,037 Cr2O3 % 0017 0,020 CuO % 0,011 0,007 NiO % 0,006 0,005 Rb2O % 0,017 0,009 SrO % 0,010 0,010 PbO % 0,004 0,001 Y2O3 % 0,009 0,006 ZnO % 0,019 0,070 ZrO2 % 0,023 0,019 LOI % 4,85 29,82
Tabel 5.9. menunjukkan bahwa komponen yang dominan (berurutan dari besar ke kecil) dengan kadar >1% dalam abu terbang dan abu dasar adalah SiO2, Al2O3,
Fe2O3, K2O dan CaO. Unsur runutan (kadar <1%) yang bernilai ekonomi tinggi pada
contoh abu batubara ombilin ini adalah; Cr, Cu, Ni, Rb, Sr, Pb, Y, Zn dan Zr. Pada analisis dengan XRF ini unsur-unsur LTJ belum terlihat kecuali yttrium (Y). Menurut Smith, dkk., 2000 menyatakan bahwa kadar LTJ dalam abu batubara memang sangat kecil <100 ppm, sehingga untuk lebih mempertajam analisis LTJ dalam abu batubara perlu dilakukan analisis menggunakan ICP karena limit deteksinya mencapai ppb. Hasil analisis ICP contoh abu batubara PLTU Ombilin dapat dilihat pada Tabel 5.10.
Tabel 5.10. Hasil Analisis ICP contoh abu batubara PLTU Ombilin
Unsur Satuan Abu terbang Abu dasar
41
Yttrium (Y) ppm 40 10
Lantanum (La) ppm 28 10
Neodinium (Nd) ppm 28 12
Samarium (Sm) ppm 2 0
Hasil analisis ICP pada Tabel 5.10 menunjukkan bahwa unsur LTJ yang dominan adalah serium, yttrium dan lantanum. Sehingga dapat dikatakan bahwa mineral LTJ dalam abu batubara PLTU Ombilin merupakan monasit (Ce, La, Y, Th) posfat. Kadar LTJ untuk abu terbang lebih tinggi dibandingkan dengan kadar LTJ dalam abu dasar. PLTU Suralaya
Hasil analisis XRF terhadap abu batubara PLTU Suralaya dapat dilihat pada Tabel 5.11.
Tabel. 5.11. Hasil Analisis XRF contoh abu batubara PLTU Suralaya
komponen Satuan Abu terbang Abu dasar
SiO2 % 51,52 58,28 Al2O3 % 21,41 15,46 Fe2O3 % 11,17 11,28 MnO % 0,09 0,099 MgO % 3,12 3,12 CaO % 7,08 7,04 Na2O % 1,48 1,66 K2O % 1,92 1,38 TiO2 % 0,89 0,52 P2O5 % 0,26 0,17 SO3 % 0,63 0,17 BaO % 0,11 0,039 Cr2O3 % 0,03 0,04 CuO % 0,007 0,005 NiO % 0,017 0,011 Rb2O % 0,009 0,005 SrO % 0,16 0,15 PbO % tt tt Y2O3 % 0,008 0,005 ZnO % 0,016 0,008
42
ZrO2 % 0,046 0,033
Br % tt 0,002
Ga2O3 % tt 0,002
Tabel 5.9. menunjukkan bahwa komponen yang dominan (berurutan dari besar ke kecil) dengan kadar >1% dalam abu terbang dan abu dasar adalah SiO2, Al2O3,
Fe2O3, CaO dan MgO. Berbeda dengan PLTU Ombilin, kadar silika dan besi di abu
dasar lebih tinggi dibandingkan dengan kadar silika pada abu terbang. Unsur runutan (kadar <1%) yang bernilai ekonomi tinggi pada contoh abu batubara ombilin ini adalah; Cr, Cu, Ni, Rb, Sr, Pb, Y, Zn dan Zr. Pada analisis dengan XRF ini unsur-unsur LTJ belum terlihat kecuali yttrium (Y). Menurut Smith, dkk., 2000 menyatakan bahwa kadar LTJ dalam abu batubara memang sangat kecil <100 ppm, sehingga untuk lebih mempertajam analisis LTJ dalam abu batubara perlu dilakukan analisis menggunakan ICP karena limit deteksinya mencapai ppb. Hasil analisis ICP contoh abu batubara PLTU Suralaya dapat dilihat pada Tabel 5.10.
Tabel 5.12. Hasil Analisis ICP contoh abu batubara PLTU Suralaya
Unsur Satuan Abu terbang Abu dasar
Yttrium (Y) ppm 80 50
Serium (Ce) ppm 52 37
Lantanum (La) ppm 18 12
Neodinium (Nd) ppm 20 13
Samarium (Sm) ppm 0 0
Hasil analisis ICP pada Tabel 5.10 menunjukkan bahwa unsur LTJ yang dominan adalah serium, yttrium dan lantanum. Sehingga dapat dikatakan bahwa mineral LTJ dalam abu batubara PLTU Suralaya mirip karakteristiknya dengan PLTU Ombilin yaitu merupakan monasit (Ce, La, Y, Th) posfat. Kadar LTJ untuk abu terbang lebih tinggi dibandingkan dengan kadar LTJ dalam bottom ash.
43 Hasil analisis XRF terhadap abu batubara PLTU Cirebon Electric Power (CEP) dapat dilihat pada Tabel 5.13.
Tabel. 5.13. Hasil Analisis XRF contoh abu batubara PLTU CEP
komponen Satuan Abu terbang Abu dasar
SiO2 % 45,90 52,38 Al2O3 % 18,71 13,38 Fe2O3 % 14,09 15,34 MnO % 0,12 0,12 MgO % 4,43 4,80 CaO % 12,61 11,60 Na2O % 0,37 0,18 K2O % 2,16 1,12 TiO2 % 0,70 0,55 P2O5 % 0,22 0,17 SO3 % 0,45 0,18 BaO % 0,084 0,065 Cr2O3 % 0,017 0,033 CuO % 0,008 0,005 Ga2O3 0,002 tt NiO % 0,014 0,010 Rb2O % 0,007 0,003 SrO % 0,033 0,028 PbO % 0,003 0,001 Y2O3 % 0,005 0,005 ZnO % 0,029 0,014 ZrO2 % 0,024 0,025
Tabel 5.13. menunjukkan bahwa komponen yang dominan (berurutan dari besar ke kecil) dengan kadar >1% dalam abu terbang dan abu dasar adalah SiO2, Al2O3,
Fe2O3, CaO dan MgO. Hampir sama dengan karakteristik abu batubara PLTU
Suralaya dan Ombilin, kadar silika dan besi pada abu dasar lebih tinggi dibandingkan pada abu terbang. Unsur runutan (kadar <1%) yang bernilai ekonomi tinggi pada contoh abu batubara ombilin ini adalah; Cr, Cu, Ni, Rb, Sr, Pb, Y, Zn dan Zr. Sama seperti PLTU Ombilin dan PLTU Suralaya, pada analisis dengan XRF ini unsur-unsur LTJ belum terlihat kecuali yttrium (Y), sehingga perlu dilakukan analisis
44 menggunakan ICP karena limit deteksinya mencapai ppb. Hasil analisis ICP contoh abu batubara PLTU CEP dapat dilihat pada Tabel 5.14.
Tabel 5.14. Hasil Analisis ICP contoh abu batubara PLTU CEP
Unsur Satuan Fly ash Bottom ash
Yttrium (Y) ppm 50 50
Serium (Ce) ppm 49 39
Lantanum (La) ppm 16 12
Neodinium (Nd) ppm 17 14
Samarium (Sm) ppm 1 0
Hasil analisis ICP pada Tabel 5.14 menunjukkan bahwa unsur LTJ yang dominan adalah serium, yttrium dan lantanum. Sehingga dapat dikatakan bahwa mineral LTJ dalam abu batubara PLTU CEP mirip karakteristiknya dengan PLTU Ombilin dan Suralaya yaitu merupakan monasit (Ce, La, Y, Th) posfat. Kadar LTJ untuk abu terbang lebih tinggi dibandingkan dengan kadar LTJ dalam bottom ash.
Dari ketiga sampel yang telah diambil dengan lokasi yang berbeda-beda untuk diidentifikasi karakteristik komposisi kimianya terutama kandungan LTJ-nya dapat disimpulkan bahwa, ketiga sampel tersebut memiliki karakteristik yang hampir sama dengan unsur yang dominan adalah SiO2, Al2O3, Fe2O3, CaO dan MgO. Kadar silika
dan besi dari ketiga sampel tersebut lebih tinggi kadarnya pada abu dasar dibandingkan dengan di abu terbang. Sedangkan untuk identifikasi LTJ pada ketiga sampel tersebut menunjukkan bahwa LTJ pada abu batubara memiliki karakteristik mineral monasit dimana unsur-unsur LTJ yang dominan adalah LTJ dengan berat atom ringan (LTJ-ringan) yaitu; serium, lantanum, yttrium. Dari ketiga sampel tersebut kadar LTJ yang terbesar terdapat pada sampel abu terbang dari PLTU Ombilin. Perbedaan karakteristik komposisi kimia antara abu terbang dan abu dasar sangat berbeda. Hal ini disebabkan abu terbang dan abu dasar sangat berbeda secara fisik, mineralogi, dan kimia. Abu terbang merupakan abu batubara paling halus dan terbentuk dari bahan mineral batubara yang terdiri dari bahan-bahan
45 yang tidak terbakar ditambah sejumlah kecil sisa karbon dari pembakaran yang tidak sempurna. Abu dasar merupakan fraksi kasar, butiran, hasil samping tidak terbakar yang dikumpulkan dari bagian bawah tungku (furnace) tempat pembakaran batubara dari generator uap, pembangkit listrik, atau keduanya.
Ekstraksi LTJ dari abu batubara dilakukan dengan menggunakan asam nitrat pada suhu 90o
5.3.
Ekstraksi Gadolinium Oksida dari MonasitC selama kurang lebih satu jam. Selanjutnya larutan kaya hasil pelindian diekstraksi pelarut menggunakan tributil fosfat (TBP) dengan pelarut kerosene (Paten US, 2013). Penelitian tersebut dilakukan terhadap abu batubara di Amerika Serikat. Kadar LTJ dalam abu batubara tersebut adalah >500 ppm. Kadar LTJ dalam abu batubara yang layak untuk diolah adalah >500 ppm (Joshi, et al, 2013). Sesuai hasil karakterisasi LTJ dalam abu batubara yang sudah dilakukan dalam penelitian ini, menunjukkan bahwa kadar LTJ dalam abu batubara dari ketiga sampel <100 ppm, sehingga tidak layak untuk diekstraksi LTJ-nya. Namun, apabila abu batubara tersebut dilakukan pengolahan terlebih dahulu, yaitu dengan mengekstrak senyawa yang dominan yaitu silika >50% dan dipisahkan dari abu batubara, maka kadar LTJ dalam abu batubara akan meningkat sehingga kemungkinan akan layak untuk diekstrak.
Sampel monasit yang digunakan berasal dari PT. MPS (Mutiara Prima Sejahtera). Karakterisasi monasit menggunakan XRF dapat dilihat pada Tabel 5.15. Monasit yang telah berukuran lolos 325 mesh dilakukan proses destruksi basa menggunakan larutan 70% natrium oksida (NaOH) didalam autoclave pada suhu 150 oC. Diagram
46 Gambar 5.7. Diagram alir proses destruksi monasit dengan basa
LTJ-hidroksida yang dihasilkan kemudian dikalsinasi pada suhu 900 oC selama 3 jam
untuk mennghasilkan LTJ-oksida. Tujuan kalsinasi ini selain untuk menghilangkan kadar air juga menghilangkan pengotor-pengotor yang terdapat dalam sampel. Karakterisasi LTJ-oksida yang dihasilkan dari percobaan dilakukan dengan XRF yang dapat dilihat pada Tabel 5.16.
Oksida (%) Jumlah Oksida (%) Jumlah
Al2O3 0,6 Al2O3 0,215 Fe2O3 0,451 Fe2O3 0,0218 SnO2 0,331 MnO 0,0512 CaO 0,168 CaO 0,0684 P2O5 23,12 K2O 0,0291 SO3 0,014 SO3 0,086 LOI 0,52 LOI 2 PbO 0,0307 PbO 0,0157
47 Tabel 5.15. Hasil Analisis Monasit Tabel 5.16. Hasil Analisis LTJ-oksida
Berdasarkan Tabel 5.15 dan 5.16 menunjukkan terjadi peningkatan pada hasil LTJ-oksida terhadap LTJ-LTJ-oksida pada mineral monasit, yaitu dari 64,5 menjadi 96,1348%. Kemurnian LTJ dalam monasit sebesar 46,80% sedangkan kemurnian LTJ dari hasil destruksi dan pengendapan sebesar 96,18%. Semakin meningkatnya kadar dan kemurnian LTJ setelah proses destruksi dan kalsinasi menunjukkan bahwa LTJ telah terpisah dari pengotor, walaupun tidak semua pengotor dapat dihilangkan, namun kadarnya hanya kecil <3%.
Setelah mendapatkan LTJ-oksida, selanjutnya dilakukan pemisahan LTJ kedalam kelompok berat, sedang, dan ringan melalui pengendapan selektif untuk mengendapkan Gd-oksida. Proses pengendapan untuk pemisahan LTJ-berat, sedang dan ringan dilakukan dengan pengendapan selektif berdasarkan pH. Nilai pH untuk proses pemisahan unsur-unsur tersebut dapat dilihat pada Tabel 5.17.
Cl 0,0107 Cl 0,193
Total
non-LTJ oksida 25,25 Total non-LTJ oksida 2,68
Gd2O3 1,27 Gd2O3 1,24 Y2O3 1,36 Y2O3 0,932 Nd2O3 11,88 Nd2O3 14,96 U3O8 0,157 Tb4O7 0,0518 La2O3 12,93 La2O3 21,07 Dy2O3 0,395 Dy2O3 0,179 Eu2O3 0,09 Eu2O3 0,098 Sm2O3 1,79 Sm2O3 1,46 Pr6O11 2,96 Pr6O11 3,93 ThO2 6,63 MoO3 0,566 CeO2 31,74 CeO2 52,78 Total
48 Tabel 5.17. Nilai pH untuk Pengendapan LTJ-berat, sedang dan ringan (Soe, et
al., 2008)
LTJ-Berat LTJ-Sedang LTJ-Ringan
Unsur pH Unsur pH Unsur pH
Dysprosium 0 – 6,9 Samarium 6,8 – 7,08 Lantanum 7,31 – 8,23
Yttrium Europium Praseodimium
Lutetium gadolinium neodimium
Ytterbium terbium
Thulium Erbium Holmium
Proses pengendapan selain dapat digunakan untuk peningkatan kadar unsur juga dapat untuk pemisahan unsur dengan unsur yang lain. Pengendapan dilakukan menggunakan amonium hidroksida pada pH 6,30 – 6,82 untuk LTJ-berat. Selanjutnya dilakukan penyaringan dan diperoleh endapan LTJ-LTJ-berat. Hasil analisis oksida LTJ-berat menggunakan XRF dapat dilihat pada Tabel 5.18.
Tabel 5.18. Hasil Analisis oksida LTJ-Berat
Oksida Jumlah (%) Gd2O3 1,27 Y2O3 0,985 Nd2O3 15,8 Tb4O7 0,0472 La2O3 16,53 Dy2O3 0,16 Er2O3 0,0287 Sm2O3 1,55 Pr6O11 4,22 CeO2 56,6 LTJ-berat 1,221 LTJ-sedang 2,87 LTJ-ringan 93,15
49 Pada pengendapan LTJ-berat ini, hampir semua LTJ-berat dapat terendapkan. Namun, LTJ-sedang dan ringan juga ikut terendapkan pada pH 6,3 – 6,8 ini. Bahkan, untuk serium oksida hampir terendapkan pada pH tersebut. Selanjutnya dilakukan proses pengendapan LTJ-sedang pada pH 6,82 – 7,08. Hasil analisis LTJ-sedang dapat dilihat pada Tabel 5.19.
Tabel 5.19. Hasil Analisis oksida LTJ-Sedang
Unsur Jumlah (%) Eu 1,27 Gd 0,985 La 15,8 Nd 0,0472 Sm 16,53 Tb 0,16 Y 0,0287 LTJ-berat 0,0287 LTJ-sedang 18,945 LTJ-ringan 15,84
Pada proses pengendapan LTJ-sedang terjadi peningkatan jumlah dibandingkan LTJ-sedang pada LTJ-oksida dari 2,468 % menjadi 18,945. LTJ-berat yang ikut mengendap pada proses ini hanya sekitar 0,03%. Sedangkan LTJ-ringan sekitar 15,8% yang didominasi oleh unsur lantanum. Selanjutnya dilakukan proses pengendapan terakhir dilakukan untuk LTJ-ringan. Hasil analisis LTJ-ringan dapat dilihat pada Tabel 5.20.
50 Tabel 5.20. Hasil Analisis oksida LTJ-Ringan
Oksida Jumlah (%) Y2O3 0,0323 Nd2O3 5,99 Tb4O7 0,068 La2O3 69,14 Sm2O3 0,223 Pr6O11 1,77 CeO2 9,71 LTJ-berat 0,0323 LTJ-sedang 0,223 LTJ-ringan 76,9
Dilihat hasil analisis pada LTJ-ringan, terlihat bahwa unsur lantanum mengalami kenaikan yang cukup signifikan yaitu dari yang semula 21,07% menjadi 69,14%. LTJ-berat dan sedang hanya sedikit yang ikut mengendap pada proses pengendapan LTJ-ringan ini.
Berdasarkan data analisis diatas, terlihat bahwa LTJ-sedang ikut mengendap bersama dengan LTJ-berat maupun ringan. Hal tersebut mungkin disebabkan karena terjadinya tumpang tindih pH pengendapan antara LTJ berat dan sedang sehingga sulit dapat memisahkan keduanya dengan metode pengendapan. Unsur cerium yang merupakan unsur LTJ yang dominan dan merupakan LTJ-ringan lebih banyak mengendap bersama LTJ-berat pada pH 0 – 6,9. Sehingga untuk mengoptimalkan metode pengendapan ini, dapat dilakukan dengan mengendapkan unsur cerium terlebih dahulu, baru dilanjutkan dengan pengendapan LTJ-berat. Unsur cerium memiliki karakteristik yang agak berbeda dengan lantanida lain, dimana unsur cerium stabil dan akan mengendap pada kondisi Ce4+. Sehingga diperlukan oksidator untuk mengubah Ce3+ menjadi Ce4+.
51 Dari hasil percobaan dapat diketahui bahwa kemurnian LTJ-berat sebesar 96,62%, LTJ-sedang 93,08% dan LTJ-ringan 86,95%.
Setelah memperoleh LTJ-berat, -sedang dan ringan, proses selanjutnya ada;ah enkstraksi pelarut LTJ-sedang untuk memisahkan Gd-oksida. Ligan yang digunakan dalam ekstraksi pelarut adalah DBDTP (DiButil Ditiopospat). Ligan DBDTP tersebut diperoleh dengan mensintesis sendiri dengan bahan utama P2S5.
Untuk mendapatkan ligan DBDTP, P2S5 direaksikan dengan n-butanol hingga pH
netral atau sedikit basa. Produk yang dihasilkan selain DBDTP adalah berupa gas H2S dengan bau yang menyengat. Reaksi yang terjadi pada proses ini adalah:
P2S5 + 2 C4H8OH → 2 [(C4H9O)2-P-S2] + H2S
Ligan DBDTP dengan pelarut metanol akan menghasilkan kompleks Gd-DBDTP pada pH yang asam. Rendemen terbaik yang dihasilkan pada proses ini adalah 45%, pada suhu 80o
Gambar 5.8. Proses percobaan pembuatan Ligan DBDTP C, waktu pendiaman satu (1) hari.
5.4.
Reduksi LTJ-Oksida menjadi LogamReduksi LTJ-oksida menjadi logam untuk kegiatan tahun 2014 difokuskan pada reduksi Ytrrium oksida dan neodinium oksida menjadi logam Y dan Nd.