BAB 1 PENDAHULUAN
1.1 Latar Belakang
Pola kehidupan masyarakat dunia saat ini cenderung kembali ke alam termasuk di bidang obat-obatan. Orang kini cenderung beralih ke tumbuhan obat karena tumbuhan obat memiliki beberapa kelebihan yaitu tidak ada efek samping bila digunakan secara benar, efektif untuk penyakit yang sulit disembuhkan dengan obat kimia, harga murah, dan penggunaannya tidak memerlukan bantuan tenaga medis (Karyasari, 2002).
Letak geografis, suhu, iklim dan kesuburan tanah suatu wilayah sangat menentukan kandungan senyawa kimia dalam suatu tanaman. Pada tanaman yang sama jenisnya, kandungan senyawa kimianya berbeda antara satu daerah dengan daerah lainnya.Beberapa jenis tanaman yang digunakan oleh masyarakat sebagai obat-obatan tradisional diantaranya kunyit, temulawak, jahe daun - daunan dan sebagainya. Selain itu, masyarakat menggunakan tumbuhan obat seringkali tidak mengetahui kandungan kimia dari tumbuhan tersebut, sehingga dalam menentukan jumlah dosis pemakaiannya masyarakat hanya mengandalkan pada pengalaman dan perkiraan semata (Rohyani, 2015).
Menurut Harborne, (1987) tanaman dapat dimanfaatkan sebagai obat tradisional apabila tanaman tersebut mengandung senyawa kimia yang mempunyai aktifitas biologis (zat bioaktif). Metabolit sekunder meliputi alkaloid, flavonoid, terpenoid, tanin, steroid dan saponin. Kandungan senyawa metabolit sekunder dalam suatu tanaman dapat diketahui dengan suatu metode pendekatan yang dapat memberikan informasi adanya senyawa metabolit sekunder. Salah satu metode yang dapat digunakan adalah skrinning fitokimia. Oleh karena itu, pada praktikum ini akan dilakukan uji fitokimia terhadap tanaman yaitu daun rambusa, sebagai langkah awal untuk mengetahui kandungan senyawa aktif yang terdapat dalam tanaman lokal yang dapat berperan aktif dalam penyembuhan penyakit.
Apa saja kandungan metabolit sekunder (Alkaloid, flavonoid, steroid, terpenoid, tanin dan saponin) pada tanaman rambusa ?
1.3 Tujuan Praktikum
Mengetahui kandungan metabolit sekunder (Alkaloid, flavonoid, steroid, terpenoid, tanin dan saponin) pada tanaman rambusa.
1.4 Manfaat Pratikum
Penelitian ini diharapkan dapat memberi informasi mengenai ekstrak
Passiflora foetidayang mengandung beberapa senyawa metabolit sekunder, yang
berguna sebagai obat-obatan. Dengan adanya penelitian ini, diharapkan dapat menambah data pemanfaatan tanaman obat yang secara empiris maupun ilmiah sebagai wujud pelestarian tanaman obat yang bersumber dari lingkungan masyarakat.
BAB II
TINJAUAN PUSTAKA
2.1 Kajian Umum Tumbuhan
Passiflora foetidajuga dikenal dengan berbagai nama daerah seperti
ceplukan blungsun (Jawa) permot, rajutan, kaceprek atau ki leuleu’eur (Sunda),
Passiflora foetida atau yang sering dikenal dengan rambusa adalah sejenis buah markisah yang mungil . Passiflora foetida diduga berasal dari berbagai daerah di Amerika yang kini sudah menyebar ke seluruh daerah tropis di dunia termasuk Asia Tenggara dan Hawai. Passiflora foetida umumnya tumbuh sebagai tumbuhan herba liar di berbagai tempat yang tidak terawat, baik itu di daerah hutan, pesisir pantai, sawah, ladang atau tanah -tanah terbuka tak terawat yang mendapatkan penyinaran matahari penuh, namun tumbuhan ini juga suka hidup pada tanah yang lembab. Passiflora foetida merupakan tumbuhan liar yang dapat dimakan karena buah yang masak rasanya manis dan beraroma harum, namun perlu diwaspadai karena buah yang masih muda beracun.
Salah satu jenis tumbuhan yang memiliki senyawa antioksidan yaitu rambusa (Passiflora foetida) yang memiliki peran penting dalam pengobatan berbagai kategori penyakit pada manusia (Yuldasheva et all., 2004).
Berikut klasifikasi tumbuhan rambusa berdasarkan sistem klasifikasi menurut Cronquist (1991) dan ATG II (2009).
perlekatan dasar tangkai sari. Bunganya memiliki daun pelindung (brachtea) yang dapat menghasilakan enzim pencernaan yang bersifat lengket dan dapat menjebak serangga.
Buahnya berupa buah buni berbentuk bulat agak memanjang berukuran sebesar kelereng (diameter ± 2-3 cm), terbungkus oleh kelopak buah yang berbentuk seperti jarum yang bercabang-cabang. Daging pembungkus biji berwarna putih, bagian inilah yang dapat dimakan karena rasanya manis dan aromanya harum. Bijinya berwarna hitam berbentuk pipih tepinya bergerigi dengan ukuran panjang ±5 mm dan lebar ±2mm. Dalam 1 buah ini berisi biji sebanyak ± 20-30 biji (Amela dan Hoc, 1998).
2.2 Kandungan Kimia Tumbuhan
Dornelas dan Vieira, 1994 mengemukakan bahwa terdapat beberapa kandungan senyawa aktif pada Passiflora foetida diantaranya linamarine, harmaline, flavonoid C-glikosida, apigenin dan luteolin.
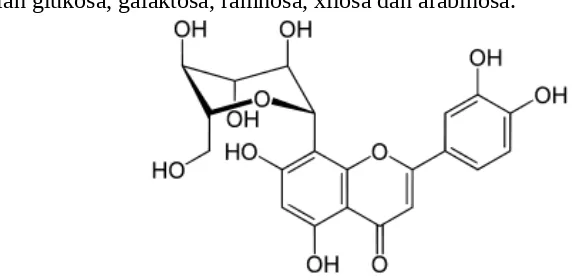
a. Flavonoid C-glikosida
Flavonoid C – glikosida merupakan flavonoid dengan struktur yang khas, dimana ikatan gula dengan aglikonnya adalah ikatan karbon-karbon (C-C), yang umum dijumpai adalah flavon-C-glikosida. Jenis gula yang terikat antara lain adalah glukosa, galaktosa, ramnosa, xilosa dan arabinosa.
Gambar 2. Struktur Flavanoid C-Glikosida
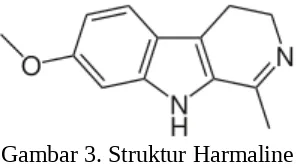
b. Harmaline
Gambar 3. Struktur Harmaline c. Linamarin
Linamarin adalah suatu senyawa yang ketika dikonsumsi lalu terurai di dalam tubuh akan diubah menjadi hidrogen sianida. Linamarin termasuk golongan glikosida sianogenik. Linamarin terdapat pada semua bagian tanaman, terutama terakumulasi pada akar dan daun. Linamarin sebagian besar terdapat dalam tanaman Linum usitatissinum (linseed), Phaseolus lunatus (Java bean), Trifolium repens (White clover), Lotus spp. (lotus), Dimorphotheca spp. (cape marigolds)
dan Manihot spp. (ubi kayu). Nama linamarin diberikan karena serupa dengan yang diketemukan dalam tanaman rami (Linum spp.). Bila senyawa ini dihidrolisa oleh asam atau enzim maka akan menghasilkan aceton + glukosa + asam sianida. Linamarin larut dalam air dan hanya dapat hancur oleh panas di atas suhu 1500 C (Nambisan B, 1999).
Gambar 4. Struktur Linamarin
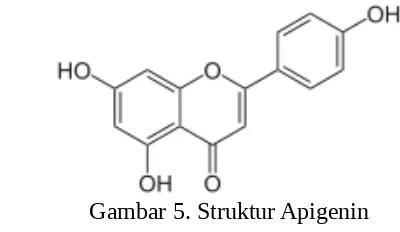
d. Apigenin
Apigenin merupakan senyawa flavonoid yang termasuk ke dalam golongan flavon. Secara kimia apigenin didefinisikan sebagai senyawa 4 5,7- ,׳
merupakan senyawa yang dapat digunakan sebagai obat penyakit hati serta sebagai antispamodik.
Gambar 5. Struktur Apigenin e. Luteolin
3, 4, 5,7-tetrahydroxyflavone atau luteolin-7-o-glukosida, adalah flavonoid umum yang ada pada banyak jenis tanaman termasuk buah-buahan, sayuran, dan tumbuhan obat. Manfaat luteolin dari flavonoid dikenal karena banyak manfaat kesehatannya, seperti antioksidan dan zat antimikroba, terutama bubuk luteolin. Tanaman yang kaya luteolin telah digunakan dalam pengobatan tradisional Tiongkok untuk mengobati berbagai penyakit seperti hipertensi, gangguan inflamasi, dan kanker.
Memiliki banyak efek biologis seperti anti radang, anti alergi dan antikanker, fungsi luteolin baik sebagai antioksidan atau pro-oksidan secara biokimia. Mekanisme aksi luteolin dapat dikaitkan secara fungsional satu sama lain. Misalnya, aktivitas anti-inflamasi mungkin terkait dengan properti antikanker. Sifat antikanker Luteolin dikaitkan dengan induksi apoptosis, dan penghambatan proliferasi sel, metastasis dan angiogenesis.
Gambar 6. Struktur Luteolin
2.3 Manfaat Tumbuhan
Menurut Asir et all (2014) tanaman rambusa/Passiflora foetida memiliki beberapa manfaat dalam bidang kesehatan diantaranya :
Khasiat rambusa yang pertama yaitu mencegah penyakit anemia. Buah ini mengandung cukup banyak zat besi yang mampu menjadi sumber penambah sel darah merah dalam tubuh.
b. Antimutagen dan antitumor
Total senyawa fenol dalam daun Passiflora foetida juga memiliki berbagai fungsi untuk menjaga kesehatan manusia, yaitu dapat bertindak sebagai antimutagen dan antitumor.
c. Vitamin C dan kalsium
Vitamin C dan kalsiummerupakan dua hal penting bagi gigi serta gusi, dua gizi tersebut ada dalam buah rambusa. Khasiat rambusa untuk gigi yaitu membantu menguatkan gigi, sedangkan untuk gusi yaitu mencegah berbagai macam infeksi mulut yang bisa menempel pada gusi.
d. Anti oksidan
Kegiatan antioksidan melalui pengikatan radikal bebas dari ekstrak daun
Passiflora foetida juga sangat tinggi sehingga konsumsi Passiflora foetida akan mengurangi jumlah pembentukan radikal bebas dan mampu memberi perlindungan terhadap spesies oksigen reaktif serta mampu menurunkan peroksidasi lipid akibat radikal bebas dalam tubuh.
2.4 Metode Fitokimia secara Umum 2.4.1 Uji Flavanoid
a. Metode Shinoda
Pada uji flavonoid dilakukan uji shinoda test (beberapa potong pita magnesium ditambah HCl pekat). Apabila esktrak yang diperoleh ditambah dengan shinoda test berwarna orange, merah atau biru maka sampel mengandung senyawa flavonoid (Markham, K.R, 1988).
Test NaOH di lakukan dengan cara sampel dalam alkohol ditambah dengan 2 - 4 NaOH 10%, apabila memberikan warna kuning maka reaksi positif, sesuai dengan yang telah dilakukan (Setiawan, 2008)
c. Metode Uji Timbal Asetat (Pb-Asetat)
Uji Timbal Asetat: Sampel (100 mg) dilarutkan dalam 10 mL pelarut. Sampel disaring, filtrat (2 mL) dimasukkan kedalam tabung reaksi, ditambahkan 1 mL Pb asetat 10% dan dikocok. Apabila terjadi perubahan warna menjadi coklat kekuningan berarti positif mengandung flavonoid (Tiwari et all, 2011).
d. Metode Bate Smith-Metchalf
Sebanyak 3 mL sampel diuapkan, dicuci dengan heksana sampai jernih. Residu dilarutkan dalam 20 ml etanol kemudian disaring. Filtrat ditambahkan 0,5 ml HCl pekat kemudian dipanaskan pada penangas air, jika terjadi perubahan warna merah tua sampai ungu menunjukkan hasil yang positif (Achmad, 1986)
e. Metode Wilstater
Filtrat ditambahkan 0,5 mL HCl dan logam Mg kemudian diamati perubahan warna yang terjadi. Warna merah menunjukkan adanya senyawa Flavon, warna merah tua diberikan oleh flavonol atau flavonon, warna hijau sampai biru diberikan oleh aglikon atau glikosida (Achmad, 1986).
f. Uji Golongan Polifenol
Isolat ditambahkan larutan FeCl3 10% dalam akuades. Reaksi positif jika memberikan warna hijau, merah, ungu, biru, atau hitam yang kuat (Harborne, 1987).
2.4.2 Alkaloid a. Metode Mayer
Ambil 3ml filtrat dari setiap sampel lalu dituangkan ke dalam tabung reaksi dan tambahkan beberapa tetes reagen Mayer. Adanya endapan putih menandakan positif alkaloid (Evan, 1997).
b. Metode Frohde
Filtrat ditambahkan pereaksi Frohde (Pereaksi Frohdemengandung larutan 1% NH4 molibdat dalam H2SO4 pekat) menghasilkan warna kuning kehijauan (Robbers, 1996)
Tuangkan3 ml filtrat ke dalam tabung reaksi dan ditambahkan beberapa tetes pereaksi Wagner dan Lugol, hasilnya diamati. Bagian kedua dari setiap filtrat dipindahkan ke corong pemisah dan dibuat basa dengan ammonia encer. Larutan basa masing-masing kemudian diekstraksi dengan volume kloroform yang sama. Kemudian lapisan kloroform yang lebih rendah dipisahkan dari lapisan amonia yang mengandung air. Lapisan berair dari masing-masing sampel diolah dengan pereaksi Mayer , Wagner dan Lugol. Lalu amati hasilnya. (Akpagu Francis C, 2015)
d. Metode Picric Acid
1gr asam picric diambil dalam 100 ml air, lalu tambahkan kedalam ekstrak tanaman dengan jumlah yang sesuai. Warna krem menunjukkanadanaya alkaloid (Evan, 1997).
e. Metode Dragendroff
Ekstrak kasar ditambahkan 0,5 mLHCl2%, selanjutnya larutan dimasukkan dalam tabung reaksi lalu ditambahkan 2 – 3 tetes reagen Dragendorff, jika terbentuk endapan jingga menandakan adanya alkaloid (Siti Khairul Bariyyah, 2013).
f. Uji Dragendorff-Meyer
Larutan uji hasil ekstraksi di tambahkan 2 tetes pereaksi Dragendorff yang merupakancampuran Bi(NO3)2.5H2O dalam HNO3 dan larutan KI). Terbentuknya endapan jingga sampai merah coklat menunjukkan positif alkaloid (Robinson, T, 1995)
g. Metode Bauchardat
Pereaksi bauchardat mengandung kalium iodida dan iood. Sampel ditambah pereaksi Bauchardat menghasilkan endapan coklat merah lalu ditambah alkohol endapannya larut (Robbers, 1996)
2.4.3 Tanin
a. Metode FeCl3
Filtrate ditambahkan larutan FeCl3 0,5 M shingga larutan menjadi biru kehitaman kemudian ditambahkan larutan H2SO4 pekat, terbentuk endapan coklat (Sudarmadji, S, 1989).
b. Metode Gelatin
c. Metode Goldbeater’s Skin
Sepotong kecil Goldbeater’s Skin direndam dalam 2% HCl. Kemudian dibilas dengan aquades. Selanjutnya masukkan dalam larutan uji selama 5 menit. Lalu bilas kembali dengan aquades, setelah itu letakkan dalam FeSO4. Adanya noda coklat atau kehitaman pada Goldbeater’s Skin menujukkan adanya tanin dalam zat uji (Edward, 1961)
d. Metode Chanwitheesuk
Sebanyak 0,5 g sampel kering diekstraksi dengan 10 mL dietil eter selama 20 jam, kemudian disaring dan residu yang diperoleh dididihkan dengan 100 ml akuades selama 2 jam,kemudian didinginkan dan disaring. Ekstrak yang diperoleh ditambahkan dengan akuades hingga volume ekstrak 100 ml. Sebanyak 0,1 ml ekstrak ditambahkan dengan 0,1 ml reagen Folin Calteu dan divortex, ditambahkan dengan 2 mL Na2CO3 dan divortex lagi (Chanwitheesuk, 2004).
e. Metode Julkunen-Titto
Sebanyak 0,1 mL larutan ekstrak 200 mg/L dimasukkan ke dalam tabung reaksi dan dibungkus dengan aluminium foil, kemudian ditambahkan 3 ml larutan vanilin 4% (b/v) dalam MeOH dan divortex. Selanjutnya ditambahkan 1,5 ml HCl pekat dan divortex lagi. Absorbansi dibaca pada λ 500 nm setelah campuran diinkubasi selama 20 menit pada suhu kamar. Kandungan tanin terkondensasi dinyatakan dalam mg katekin/kg ekstrak. (Suryanto dan Wehantouw, 2009)
f. Metode Uji Phenazone
Phenazon atau dengan nama IUPAC 1,5-dimethyl-2-phenyl-1,2-dihydro-3H -pyrazol-3-one, telah digunakan secara meluas untuk identifikasi tanin. Berikut prosedur pengujiannya; sejumlah 0.5 gram Sodium Asam Fosfat Anhidrat (HNa2O4P) ditambahkan ke dalam 5 mL ekstrak aqueous dari simplisia yang diuji. Panaskan campuran, lalu disaring. Kedalam filtrat yang didapatkan ditambahkan 2% larutan phenazone. Akan terbentuk endapan bulkis yang kadang berwarna, mengidentifikasikan zat uji mengandung tanin.(Biren at all, 2012)
2.4.4 Uji Saponin a. Metode Forth
b. Metode de Silva dan G.R. Roberts
Sampel diekstraksi dengan IPA 50% pada temperatur 60-70oC selama 16-18 jam. Rafinat diekstraksi dengan 150 mL IPA selama 2 jam. Ekstrak dievaporasi dan diatur pH nya 4,5 dengan penambahan HCl, diekstraksi kembali dengan pelarut butanol. Ekstrak dievaporasi hingga diperoleh padatan saponin (De Silva, 2004).
c. Metode L. Heng
Sampel diblender dengan dry ice dengan rasio 1:1 (b/b). Tepung didefatisasi menggunakan heksana, direfluks selama 6 jam dan dikeringanginkan. 1 g defatted
pea flour diekstraksi dengan 100 mL etanol 70% selama 1 jam pada 25oC dalam
incubator shaker. Ekstrak disaring dan dievaporasi vakum pada 27oC, ditambah
aquadest (1:3 v/v) dan disentrifugasi. Supernatan dilewatkan pada kolom Sep-Pak C18 dan dicuci dengan 15 ml air, dielusi dengan 10 ml metanol p.a dan dikeringanginkan. Saponin yang didapat dilarutkan dalam 1 mL etanol 50% (v/v) dan disentrifugasi (Li Heng, 2005).
d. Metode Simes (Uji Busa)
Simplisia sebanyak 0,5 gram dimasukkan ke dalam tabung reaksi yang telah berisikan aquades 10 ml, dikocok dan ditambahkan satu tetes larutan asam klorida 2 N. Tabungreaksi tersebut didiamkan dan diperhatikan ada atau tidak adanya busa stabil. Sampel mengandung saponin jika terbentuk busa (Suharto et all,
2012).
2.4.5 Terpenoid
a. Metode Salkowsky
5 ml ektrak dicampur dalam 2 ml kloroform dan ditambahkan beberpa tetes H2SO4 dengan hati – hati untuk membentuk lapisan. Warna coklat kemerahan atau coklat kehijauan yang terbentuk menunjukkan hasil positif untuk kehadiran terpenoid (Mir at all, 2016)
b. Metode Liebermann Burchard
Sebanyak 2 mL sampel (±0,05% b/v) ditambah dengan pereaksi Liberman-Burchard 1 mL. Adanya senyawa terpenoid ditujukan dengan terbentuknya warna biru tua atau hijau kehitaman (Harbone, 1998).
a. Metode Salkowsky
15 mg sampel dari masing-masing ekstrak dilarutkan dalam 2 ml kloroform dan 3 ml asam sulfat pekat. Kemudian akan terbentuk dua lapisan, dimana lapisan warna merah atau orange menunjukkan adanya senyawa steroid (Egwaikhide dan Gimba, 2007).
b. Metode Liebermann-Burchard
2ml anhidrida asetat ditambahkan kedalam 0,5 ml ekstrak etanol dengan penambahan masing-masing 2 ml H2S04. Warnanya berubah dari ungu menjadi biru atau hijau yang menunjukkan adanya steroid (Mir at all, 2016).
BAB III
METODE PERCOBAAN
3.1 Alat
lumpang dan alu, rak tabung reaksi, neraca analitik, penjepit tabung reaksi, spatula, gelas ukur 50 ml, penangas air, kompor listrik, pipet tetes.
3.2 Bahan
Bahan yang digunakan pada praktikum ini yaitu sampel daun rambusa, EtOH 96%, CHCl3, H2SO4 pekat, pereaksi Dragendroff, aquades, NaOH 10%, FeCl3, HCl dan kertas saring.
3.3 Tempat Dan Waktu
Praktikum ini dilaksanakan pada hari kamis 19 Oktober 2017, pukul 11.00-13.00 di Laboratorium Bahan Alam Fakultas Sains, Universitas Cokroaminoto Palopo.
3.4 Prosedur 3.4.1 Uji Flavanoid
Filtrat daun rambusa dipipet sebanyak 5 ml kemudian dimasukkan kedalam tabung reaksi. Setelah itu ditambahkan NaOH 10% sebanyak 5 tetes lalu kocok sampai homogen , selanjutnya amati perubahan warna yang terjadi. Munculnya warna kuning menunjukan adanya flavonoid (Lelaprakash, dkk, 2011)
3.4.2 Uji Alkaloid
Filtrat yang dipipet sebanyak 5 ml kedalam tabung reaksi dan ditambahkan 5 tetes pereaksi Dragendroff. Amati perubahan warna apabila berwarna merah bata maka positif mengandung senyawa alkaloid (Murtadlo, dkk, 2013).
3.4.3 Uji Tanin
Ambil 5 ml filtratdaun rambusa lalu pindahkan kedalam tabung reaksi, kemudian panaskan selama 5 menit lalu ditambahkan beberapa tetes FeCl3. Amati perubahan warna yang terjadi. Adanya tanin ditandai dengan perubahan warna menjadi hijau kebiruan (Ergina, et all, 2014)
3.4.4 Uji Saponin
3.4.5 Terpenoid
Sampel daun rambusa segar dicuci, lalu ditumbuk hingga halus selanjutnya rendam 100 gr sampel bubuk kedalam 200 ml EtOH lalu diamkan selama 15 menit, setelah itu saring larutan sampel sehingga diperoleh residu dan maserat. Selanjutnya pindahkan 1 ml ekstrak kedalam tabung reaksi lalu tambahkan 2ml CHCl3, kemudian tambahkan 2-3 tetes H2SO4 dengan hati – hati. Adanya warna coklat kemerahan atau coklat kehijauan menunjukkan adanya terpenoid (Usha Veerachari1and A. K. Bopaiah, 2011)
3.4.6 Steroid
Ambil 5 ml filtratdaun rambusa lalu pindahkan kedalam tabung reaksi, tambahkan 3 tetes H2SO4pekat untuk uji steroid. Amati perubahan warna yang terjadi, apabila berwarna merah atau orange menandakan adanya steroid (Egwaikhide and Gimba, 2007).
BAB IV
HASIL DAN PEMBAHASAN
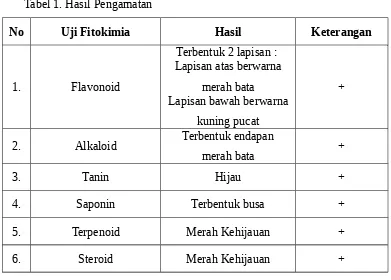
Hasil pengamatan dapat dilihat pada tabel 1.
(-) : Tidak mengandung senyawa (+) : Mengandung senyawa 4.3 Pembahasan
4.3.1 Flavonoid
Flavonoid adalah kelompok senyawa fenol terbesar yang ditemukan di alam terutama pada jaringan tumbuhan tinggi. Senyawa ini merupakan produk metabolik sekunder yang terjadi dari sel dan terakumulasi dari tubuh tumbuhan sebagai zat racun (Robinson, 1991).
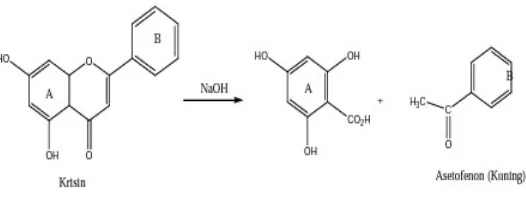
Pada praktikum ini identifikasi senyawa flavonoid pada daun rambusa dilakukan dengan cara mengambil filtrat daun rambusa lalu dipipet sebanyak 5 ml kemudian dimasukkan kedalam tabung reaksi. Setelah itu ditambahkan NaOH 10% sebanyak 5 tetes lalu kocok sampai homogen, selanjutnya amati perubahan warna yang terjadi jika berwarna kuning menandakan (+) mengandung flavonoid. Pada praktikum ini diperoleh hasil bahwa daun rambusa mengandung flavonoid (+) yang ditandai dengan terjadinya perubahan warna, dimana pada lapisan atas terbentuk warna merah bata sementara lapisan bawah berwarna kuning pucat. Hal ini terjadi karena flavonoid termasuk dari senyawa fenol. Bila fenol direaksikan dengan basa akan terbentuk warna yang disebabkan terjadinya sistem konjugasi dari gugus aromatik (Markham, 1988).
Gambar 7. Reaksi Senyawa Flavonoid dengan Pereaksi NaOH 4.3.2 Alkaloid
Alkaloid merupakan suatubasa organik yang mengandung unsur nitrogen (N) pada umumnya berasal dari tanaman, yang mempunyai efek fisiologis kuat terhadap manusia. Kegunaan senyawa alkaloid dalam bidang farmakologi adalah untuk memacu sistem syaraf, menaikkan tekanan darah, dan melawan infeksi mikrobial (Pasaribu, 2009).
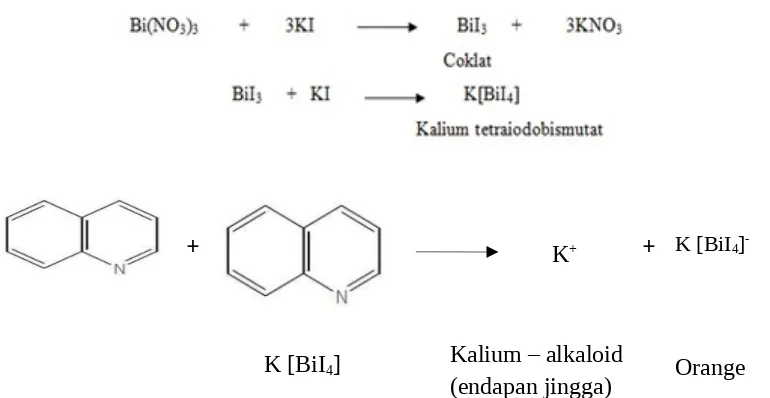
Alkaloid dapat dideteksi dengan beberapa pereaksi pengendap. Pereaksi Mayer mengandung kalium iodida dan merkuri klorida, dengan pereaksi ini alkaloid akan memberikan endapan berwarna putih. Pereaksi Dragendorff mengandung bismuth nitrat dan merkuri klorida dalam asam nitrat berair. Senyawa positif mengandung alkaloid jika setelah penyemprotan dengan pereaksi Dragendorff membentuk warna jingga (Sastrohamidjojo, 1996).
Pada praktikum ini identifikasi senyawa alkaloid dilakukan dengan cara filtrat dipipet sebanyak 5 ml lalu dimasukkan kedalam tabung reaksi dan ditambahkan 5 tetes pereaksi Dragendroff. Amati perubahan warna apabila berwarna merah bata maka positif mengandung senyawa alkaloid (Murtadlo, dkk. 2013).
Identifikasi alkaloid pada daun rambusa menunjukkan adanya senyawa alkaloid yang ditandai dengan munculnya endapan merah bata. Hal ini sesuai dengan penelitian dari Marliana, dkk (2005) yang menyatakan bahwa adanya alkaloid ditandai dengan terbentuknya endapan putih dengan pereaksi Mayer dan endapan merah dengan pereaksi Dragendorff. Pereaksi Dragendorff dapat mengendapkan alkaloid karena dalam senyawa alkaloid terdapat gugus nitrogen yang memiliki satu pasang elektron bebas menyebabkan senyawa alkaloid bersifat nukleofilik (basa).
Gambar 8. Reaksi Senyawa Alkaloid dengan Pereaksi Dragendroff 4.3.3 Tanin
Tanin merupakan senyawa polifonel yang banyak terkandung dalam berbagai jenis tanaman. Untuk melakukan identifikasi tanin dalam suatu simplisia dapat dilakukan dengan berbagai metoda identifikasi. Proses identifikasi ini bertujuan untuk mengetahui benar atau tidaknya suatu simplisia mengandung tanin. Selain itu karena tanin sangat beraneka ragam jenisnya, maka dengan proses identifikasi ini kita juga dapat meprediksi jenis tanin apakah yang dikandung dalam simplisia yang diuji (Biren Shah dan Avinash Seth, 2012).
Tanin terdapat luas dalam tumbuhan berpembuluh, dalam angiospermae terdapat khusus dalam jaringan kayu. Menurut batasannya, tanin dapat bereaksi dengan protein membentuk kepolimer mantap yang tidak larut dalam air. Secara kimia terdapat dua jenis utama tanin yang tersebar tidak merata dalam dunia tumbuhan. Tanin terkondensasi hampir terdapat di dalam paku – pakuan dan gimnospermae, serta tersebar luas dalam angiospermae, terutama pada jenis tumbuhan berkayu. Sebaliknya tanin yang terhidrolisis penyebarannya terbatas pada tumbuhan berkeping dua (Harbrone, J.B, 1987)
Pada praktikum ini identifikasi senyawa tanin dilakukan dengan cara mengambil 5 ml filtrat daun rambusa lalu pindahkan kedalam tabung reaksi, kemudian panaskan selama 5 menit lalu ditambahkan beberapa tetes FeCl3. Amati
+
K [BiI4]
+ K [BiI4] -K+
Kalium – alkaloid
perubahan warna yang terjadi. Adanya tanin ditandai dengan perubahan warna menjadi hijau kebiruan.
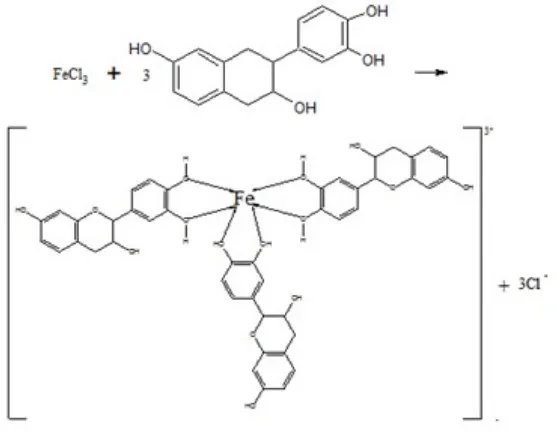
Uji fitokimia dengan menggunakan FeCl3 digunakan untuk menentukan apakah sampel mengandung gugus fenol. Adanya gugus fenol ditunjukkan dengan warna hijau kehitaman atau biru tua setelah ditambahkan dengan FeCl3, sehingga apabila uji fitokimia dengan FeCl3 memberikan hasil positif dimungkinkan dalam sampel terdapat senyawa fenol dan dimungkinkan salah satunya adalah tanin karena tanin merupakan senyawa polifenol. Hal ini diperkuat oleh (Harborne, 1987) cara klasik untuk mendeteksi senyawa fenol sederhana yaitu menambahkan ekstrak dengan larutan FeCl3 1 % dalam air, yang menimbulkan warna hijau, merah, ungu, biru atau hitam yang kuat. Terbentuknya warna hijau kehitaman atau biru tinta pada ekstrak setelah ditambahkan dengan FeCl3 karena tanin akan membentuk senyawa kompleks dengan ion Fe3+, seperti yang terlihat pada gambar 9.
Gambar 9. Reaksi antara Tanin dan FeCl3
atas mengikat tiga tanin yang memiliki 2 atom donor yaitu atom O pada posisi 4’ dan 5’ dihidroksi, sehingga ada enam pasangan elektron bebas yang bisa dikoordinasikan ke atom pusat. Atom O pada posisi 4’ dan 5’ dihidroksi memiliki energi paling rendah dalam pembentukan senyawa kompleks, sehingga memungkinkan menjadi sebuah ligan (Sa’adah, 2010).
4.3.4 Saponin
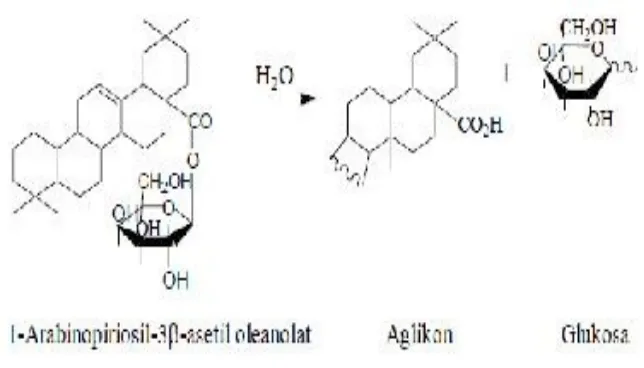
Saponin adalah glikosida triterpen dan sterol. Saponin merupakan senyawa aktif permukaan dan bersifat seperti sabun, serta dapat dideteksi berdasarkan kemampuannya membentuk busa yang stabil dalam air dan menghomolisis sel darah merah (Harborne,1984). Dari segi pemanfaatan, saponin sangat ekonomis sebagai bahan baku pembuatan hormon steroid, tetapi saponin kadang-kadang dapat menyebabkan keracunan pada ternak (Robinson, 1991).
Pada praktikum ini identifikasi senyawa saponin dilakukan dengan cara mengambil ambil 5 ml filtrat daun rambusa lalu pindahkan kedalam tabung reaksi, selanjutnya tambahkan 10 ml air panas lalu dinginkan. Kemudian dikocok kuat sampai terbentuk busa padat dan ditambahkan 3 tetes HCl 2 N, jika busa masih tetap stabil maka positif mengandung saponin.
Penambahan air panas hal ini dilakukan agar kandungan saponin tidak berkurang bila suhu menurun. Filtrat yang dihasilkan kemudian dikocok secara hingga terbentuk busa. Hal ini disebabkan saponin merupakan senyawa yang bersifat seperti sabun, dimana memiliki gugus hidrofil dan hidrofob yang dapat bertindak sebagai permukaan aktif dalam pembentukan busa (Fessenden, 1999)
Uji positif untuk saponin adalah dengan terbentuknya busa yang stabil. Saponin dapat larut dalam air karena adanya gugus hidrofil (OH) yang dapat membentuk ikatan hidrogen dengan molekul air. Penambahan HCl dilakukan untuk menguji kestabilan busa. Penambahan HCl dilakukan dalam jumlah yang sedikit karena apabila ditambahkan dalam jumlah yang banyak dapat menurunkan permukaan aktif sabun.
terhidrolisis menjadi glukosa dan senyawa lainnya dengan reaksi seperti pada gambar 10.
.
Gambar 10. Reaksi Hidrolisis Saponin dalam Air
4.3.5 Terpenoid
Terpenoid adalah suatu senyawa alam yang terbentuk dengan proses biosintesis, terdistribusi luas dalam dunia tumbuhan dan hewan. Terpenoid ditemui tidak saja pada tumbuhan tingkat tinggi, namun juga pada terumbu karang dan mikroba. Struktur terpenoid dibangun oleh molekul isoprena, kerangka terpenoid terbentuk dari dua atau lebih banyak satuan unit isoprena. Terpenoid terdiri atas beberapa macam senyawa, mulai dari komponen minyak atsiri, yaitu monoterpen dan seskuiterpen yang mudah menguap, diterpen yang lebih sukar menguap, sampai ke senyawa yang tidak menguap, triterpenoid dan sterol serta pigmen karotenoid. Masing-masing golongan terpenoid itu penting, baik pada pertumbuhan dan metabolisme maupun pada ekologi tumbuhan (Harbone, 1996).
Pada praktikum ini identifikasi senyawa terpenoid dilakukan dengan metode Salkowsky yaitu mengambil 5 ml ekstrak lalu dipindahkan kedalam tabung reaksi lalu ditambahkan 2ml CHCl3, kemudian ditambahkan 2-3 tetes H2SO4 dengan hati – hati. Adanya warna coklat kemerahan atau coklat kehijauan menunjukkan adanya terpenoid.
kehijaun. Perubahan warna terjadi setelah larutan dsimpan beberapa hari, hal itu disebabkan karena proses identifikasi senyawa metabolit sekunder dipengaruhi oleh waktu reaksi, suhu, zat pereaksi dan konsentrasi.
Selain dengan metode Salkowsky identifikasi senyawa terpenoid juga dapat dilakukan dengan metode Liebermann Burcharad. Prinsip reaksi dalam mekanisme reaksi uji terpenoid dapat dilihat pada gambar 11 dimana terjadi proses kondensasi atau pelepasan H2O dan penggabungan karbokation. Reaksi ini diawali dengan proses asetilasi gugus hidroksil menggunakan asam asetat anhidrida. Gugus asetil yang meupakan gugus pergi yang baik akan lepas sehingga terbentuk ikatan rangkap. Selanjutnya terjadi pelepasan gugus hidrogen beserta elektronnya, mengakibatkan ikatan rangkap berpindah. Senyawa ini mengalami resonansi yang bertindak sebagai elektrofil atau karbokation. Serangan karbokation menyebabkan adisi elektrofilik, diikuti dengan pelepasan hidrogen. Kemudian gugus hidrogen beserta elektronnya dilepas akibatnya senyawa mengalami perpanjangan konjugasi yang memperlihatkan munculnya cincin coklat (Siadi, 2012)
Gambar 11. Reaksi Terpenoid dengan Pereaksi Liebermann-Burchard
Steroid memilki kerangka dasar terbentuk dari sistem cincin siklopentana prehidrofenantrena. Steroid merupakan golongan senyawa metabolik sekunder yang banyak dimanfaatkan sebagai obat. Hormon steroid pada umumnya diperoleh dari senyawa-senyawa steroid alam terutama dalam tumbuhan (Djamal, 1988).
Pada praktikum ini identifikasi senyawa untuk uji steroid dilakukan dengan metode Salkowsky dengan cara mengambil 5 ml ekstrak lalu dipindahkan kedalam tabung reaksi, tambahkan 3 tetes H2SO4 pekat. Amati perubahan warna yang terjadi, apabila berwarna merah atau orange menandakan adanya steroid.
Filtrat daun rambusa mengandung steroid yang ditandai dengan terjadinya perubahan warna menjadi merah kehijauan. Uji positif adanya steroid apabila terjadi perubahan warna menjadi merah atau orange, hal ini berdasarkan reaksi Salkowsky yang menyatakan bila suatu steroid direaksikan dengan setetes asam sulfat pekat akan menghasilkan warna merah bata (Robinson, 1995).
Menurut Fessenden (1999) uji Steroid dapat juga dilakukan dengan metode Liebermann-Burchard dengan cara menyaring larutan yang telah dimaserasi tujuan untuk memisahkan residu daun rambusa dari filtrat. Filtrat yang diperoleh kemudian diuapkan. Penguapan berfungsi untuk menghilangkan pelarut eter yang tersisa pada filtrat. Residu yang diperoleh dari penguapan kemudian ditambah dengan asam asetat anhidrat dimana asam asetat anhidrat akan bereaksi dengan steroid melalui reaksi asetilasi menghasilkan kompleks asetil steroid. Reaksi yang terjadi dapat dilihat pada gambar 12.
Gugus steroid OH + O
asetil steroid. Uji positif terhadap steroid dengan metode Liebermann-Burchard adalah jika terbentuk larutan berwarna biru.
BAB V
KESIMPULAN DAN SARAN 5.1 Kesimpulan
Berdasarkan tujuan praktikum dapat disimpulkan bahwa ekstrak daun rambusa positif mengandung flavonoid, alkaloid, tanin, saponin, terpenoid dan steroid.
Sebaiknya praktikan harus lebih teliti dalam mengamati perubahan warna yang terjadi pada masing-masing pengujian karena ada banyak faktor yang mempengaruhi hasil identifikasi.
DAFTAR PUSTAKA
Achmad, S.A. 1986. Kimia Organik Bahan Alam. Jakarta: Karnunika
Asir, P. Joseph, S.Hemmalakshmi, S.Priyanga, and K.Devaki. 2014. In Vitro Free Radical Scavenging Activity And Secondary Metabolites In Passiflora Foetida L.Vol.6. No. 2. (Hal. 641)
Biren Shah dan Avinash Seth. 2012. Textbook of Pharmacognosy and
C. Akpagu Francis, et all. 2016.Estimation of alkaloid, saponin and flavonoidcontent in various extracts of Crocus sativa Vol.4. No. 5 (Hal. 491-497)
Chanwitheesuk, A.; Teerawutgulrag A.; Rakariyatham N. 2004. Screening of Antioxidant Activity and Antioxidant Compounds of Some Edible Plants of
Thailand. Food Chemistry.(Hal.92:491-497)
De Silva, U.L.L and G.R Roberts. 1972. Products From the seeds-Extractionand Properties of Saponin. Vol.4. No.3 (Hal. 91-94)
Dornelas MC and MLC.Vieira.1994. Tissue culture studies on species of Passiflora. Plant Cell Tissue and Organ Culture, (Hal. 36:211-217)
Edward P. Claus. 1961. PHARMACOHNOSY, Fourth Edition. Lea & Febiger : Philadelphia. (Hal. 324-330)
Egwaikhide PA, Gimba CE.2007. Analysis of the Phytochemical Content and Anti-microbical Activity of Plectranthus Glandulosis Whole Plant. Vol.2. No.4 (Hal.135-138)
Fessenden, R. J., Fessenden, J. S..1999. Kimia Organik, Jilid 1, Edisi ketiga.
Erlangga : Jakarta
Harborne, A. 1998. Phytochemical methods a guide to modern techniques of plant analysis: Springer Science & Business Media.
Harborne, J.B. 1987. Metode Fitokimia : Penuntun cara modern menganalisis
tumbuhan. Penerbit ITB : Bandung. (Hal: 245-248)
Lelaprakash,G., et all. 2011. In Vitro Antimicrobial activity Of Momordica
Charantia Leaves. Pharmacophore. Vol.1. No. 4. (Hal.242-252)
L. Heng. 2005. Flavour Aspects Of Pea and its Protein Preparation in Relation to
Novel Protein Foods. Wageningen University : Netherland
Karyasari.2002. Materi Pelatihan Profesional Tanaman Obat. Kelas Profesional.
Penyakit dan Pengobatannya. Karyasari: Bogor
Markham, K.R. 1988. Cara Mengidentifikasi Flavonoid.Kosasih Padmawinata.
Mir, M Amine, et all.2016. Estimation of alkaloid, saponin and flavonoid,content in various extracts of Crocus sativa. Vol.4 No.5 (Hal.171-174)
Nambisan B. 1999. Cassava Latex and Source as Linamarase for
Determination of Linamarin. Journal of Agricultural and Food Chemistry
(Hal. 372-373)
Rice-Evans CA, Miller NJ, Paganga G. 1997. Antioxidant properties of phenolic
Robbers, James E, et all. 1996.Pharmacognosy and pharmacobiotechnology.
Williams & Wilkins : United States of America.
Robinson, T. 1995. Kandungan Organik Tumbuhan Tinggi. ITB : Bandung
Sa’adah, L. (2010). Isolasi dan identifikasi senyawa tanin dari daun belimbing
wuluh (Averrhoa bilimbi l.). Universitas Islam Negeri (UIN) Maulana Malik
Ibrahim : Malang.
Siti Khairul Bariyyah, A. et all.2013. Identifikasi Senyawa Metabolit Sekunder
serta Uji Aktivitas Ekstrak Daun Jambu Batu sebagai Antibakteri. Vol. 2 No.
3. (Hal. 150 -204).
Siadi. K. 2012. Ekstrak Bungkil Biji Jarak Pagar (Jatropa curcas) Sebagai Biopestisida Yang Efektif Dengan Penambahan Larutan
NaCl. JurnalMipa 35(2). (Hal.77-83)
Sudarmadji, S. 1989.Analisa Bahan Makanan dan Pertanian . Liberti: Yogyakarta
Suharto, M. A. P., Edy, H. J., Dumanauw, J. M. 2012. Isolasi dan identifikasi senyawa saponin dari ekstrak methanol batang pisang ambon (Musa paradisiaca var. sapientum L.).Vol.1. No.2 (Hal. 86-92)
Suryanto, E, Wehantouw F. 2009. Aktivitas Penangkap Radikal Bebas dari
danSemimikro. PT. Kalman Media Pustaka : Jakarta
Rohyani, I.S., Aryanti, E., Suripto. 2015. Kandungan Fitokimia Beberapa Jenis Tumbuhan Lokal yang sering dimanfaatkan sebagai Bahan Baku Obat di
Pulau Lombok. Vol.1. No.2 (Hal. 388-391)
Tiwari, Prashant., et all. 2011. Phytochemical Screening and Extraction : A
Review. International Pharmaceutica Scienca. Vol. 1. No. 1(Hal. 98-106)
LAMPIRAN
2. Alkaloid
3. Tanin
29 Adanya warna kuning menandakan
+ mengandung flavonoid.
- 5 ml filtrat daun rambusa dipindahkan kedalam tabung reaksi
- Ditambahkan 5 tetes NaOH 10%
- Kocok sampai homogen
Filtrat daun rambusa
Adanya warna merah bata menandakan + mengandung alkaloid.
- 5 ml filtrat daun rambusa
dipindahkan kedalam tabung reaksi
- Ditambahkan 5 tetes
Filtrat daun rambusa
- 5 ml filtrat daun rambusa dipindahkan kedalam tabung reaksi
4. Saponin
5. Terpenoid
30 Adanya tanin ditandai dengan
perubahan warna menjadi hijau kebiruan.
Filtrat daun rambusa
Jika busa masih tetap ada maka positif mengandung saponin.
- Ditambahkan 10 ml air panas lalu dinginkan
- Dikocok kuat sampai terbentuk busa padat
- Ditambahkan 3 tetes HCl 2 N
Filtrat daun rambusa
- 5 ml filtrat daun rambusa dipindahkan kedalam tabung reaksi.
6. Steroid
Lampiran 2. Dokumentasi Kegiatan
Gambar 1. Maserasi sampel Gambar 2. Sampel disaring - 5 ml
filtratdaunrambusadip indahkankedalamtabu ngreaksi
- Ditambahkan 2-3 tetes Adanya warna coklat kemerahan
atau coklat kehijauan menunjukkan + mengandung terpenoid.
Filtrat daun rambusa
Ganbar 3. Ekstrak dipindahkan kedalam Gambar 4. 5 ml ekstrak daun
tabung reaksi sebanyak 5 ml rambusa