LAPORAN PRAKTIKUM KIMIA DASAR
ANALISIS KUANTITATIF DAN PENGUKURAN
Nama : Denaya Candra Safira
NRP : 143020117
Kelompok : E
Meja : 4 (Empat)
Asisten : M. Fitrian Wiriyanata
LABORATORIUM KIMIA DASAR JURUSAN TEKNOLOGI PANGAN
FAKULTAS TEKNIK UNIVERSITAS PASUNDAN
ANALISIS KUANTITATIF DAN PENGUKURAN
Denaya Candra Safira 143020117
Asisten : M. Fitriyan Wiriyanata
Tujuan Percobaan
Tujuan percobaan analisis kuantitatif dan pengukuran pH adalah untuk mengukur pH larutan, membuat dan mebakukan larutan, menentukan konsentrasi dan dapat memilih indikator yang tepat pada larutan untuk titrasi sesuai pH indikator dari larutan tersebut.
Prinsip Percobaan
Prinsip percobaan analisis kuantitatif dan pengukuran pH yaitu berdasarkan metode Asidimetri dan Alkalimetri, dimana pereaksi standar bereaksi dengan larutan yang di uji dengan dibantu oleh indikator sebagai petunjuk TAT (Titik Akhir Titrasi) sehingga bereaksi secara kuantitatif. Berdasarkan teori Arrhenius (1884), bahwa apabila suatu elektron melarut, sebagian dari elektrolit ini terurai menjadi partikel positif dan partikel negatif yang disebut ion.
Metode Percobaan
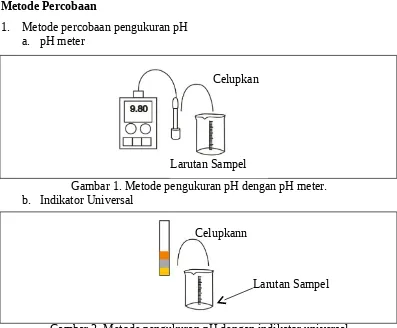
1. Metode percobaan pengukuran pH a. pH meter
Gambar 1. Metode pengukuran pH dengan pH meter. b. Indikator Universal
Gambar 2. Metode pengukuran pH dengan indikator universal Celupkan
Larutan Sampel
Celupkann
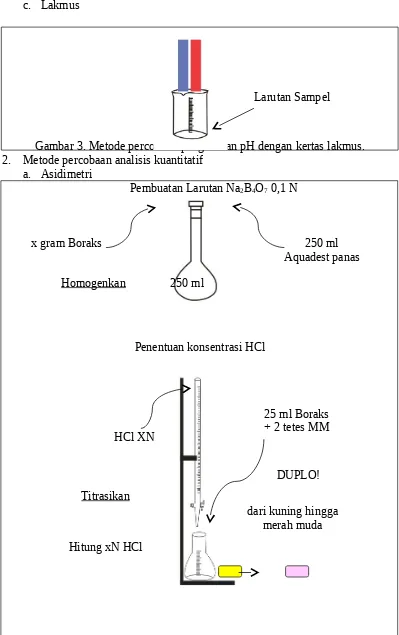
c. Lakmus
Gambar 3. Metode percobaan pengukuran pH dengan kertas lakmus. 2. Metode percobaan analisis kuantitatif
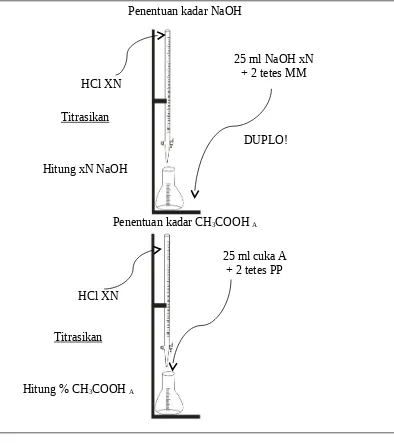
a. Asidimetri
Larutan Sampel
Homogenkan x gram Boraks
Pembuatan Larutan Na2B4O7 0,1 N
250 ml Aquadest panas
250 ml
Penentuan konsentrasi HCl
25 ml Boraks + 2 tetes MM HCl XN
DUPLO! Titrasikan
Hitung xN HCl
Gambar 5. Metode percobaan analisis kuantitatif Asidimetri
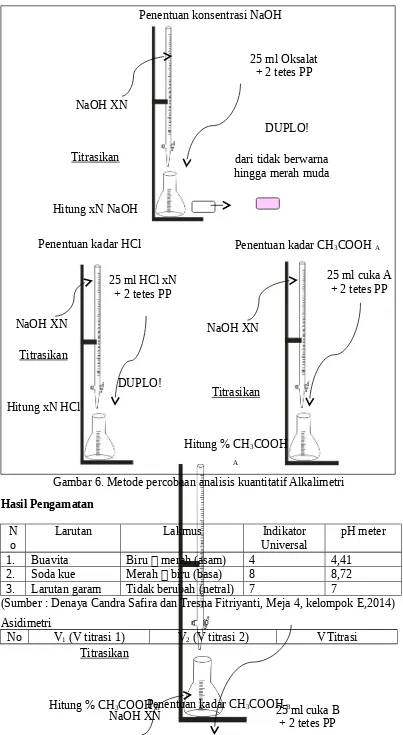
b. Alkalimetri
Penentuan kadar NaOH
DUPLO! 25 ml NaOH xN
+ 2 tetes MM HCl XN
Titrasikan
Hitung xN NaOH
Penentuan kadar CH3COOH A
25 ml cuka A + 2 tetes PP
HCl XN
Titrasikan
Hitung % CH3COOH A
Pembuatan Larutan H2C2O4 0,1 N
x gram Oksalat 250 ml
aquadest Homogenkan
Gambar 6. Metode percobaan analisis kuantitatif Alkalimetri
Hasil Pengamatan N
o Larutan Lakmus UniversalIndikator pH meter
1. Buavita Biru merah (asam) 4 4,41
2. Soda kue Merah biru (basa) 8 8,72
3. Larutan garam Tidak berubah (netral) 7 7
(Sumber : Denaya Candra Safira dan Tresna Fitriyanti, Meja 4, kelompok E,2014) Asidimetri NaOH XNPenentuan kadar CH3COOH B
Titrasikan
.
1. 20 ml 19 ml 19,5 ml
2. 17,5 ml 35 ml 26,25 ml
3. - - 8,5 ml
(Sumber : Riska dan Gumilang, Meja 1, Kelompok E, 2014)
Na2B4O7.10H2O 0,1 N 500ml
V1 (V titrasi 1) V2 (V titrasi 2) V Titrasi
1. 26,4 ml 26,2 ml 26,3 ml
2. 36,8 ml 36,5 ml 36,65 ml
3. - - 10,5 ml
H2C2O4. 2H2O 0,1 N 500ml larutan baku sekunder untuk menentukan konsentrasi dari NaOH yaitu 0,1344 N. Sedangkan pada metode Alkalimetri digunakan Oksalat sebagai larutan baku primer, dan NaOH sebahai larutan baku sekunder untuk menentukan konsentrasi dari HCl yaitu 0,1393 N. Dari hasil pengamatan juga didapatkan persen cuka A adalah 0,27% dan cuka B adalah 0,24%. Sedangkan hasil persen cuka A yang tepat adalah 0,12 %. Faktor kesalahan yang mungkin dapat terjadi dalam percobaan, sehingga membuat hasil pengamatan tidak sesuai dengan teori adalah : 1. Pembacaan skala pada buret
Membaca skala pada buret harus sangat teliti, kesalahan yang sering terjadi adalah membaca skala yang tidak sejajar dengan mata, sehingga skala yang dibaca tidak tepat.
2. Kesalahan penentuan titik akhir titrasi
tidak sampai berubah menjadi pekat, menandakan kedua senyawa tersebut telah habis bereaksi, maka penentuan TAT (Titik Akhir Titrasi) harus tepat agar volume yang didapat akurat. Warna yang berubah menjadi pekat menandakan TET (Titik Ekivalen Titrasi) sudah terlewat cukup jauh.
3. Kebocoran buret
Buret dalam keadaan bocor sebaiknya tidak digunakan untuk menghindari kesalahan dalam percobaan titrasi. Titrasi diperlakukan dengan perlahan sampai mendapat perubahan yang tepat, erlenmeyer harus digoyang secara konstan begitupun tetesan larutan baku harus konstan atau stabil. Sehingga hasil titrasi didapatkan secara maksimal.
Titrasi Asidimetri dan Alkalimetri adalah metode titrasi yang menggunakan asam dan basa sebagai larutan baku dan larutan yang akan di uji konsentrasinya. Asidimetri adalah metode titrasi yang menggunakan larutan asam sebagai larutan standar untuk menentukan konsentrasi dari larutan basa. Sedangkan Alkalimetri adalah metode titrasi yang menggunakan larutan basa sebagai larutan sandar untuk menentukan konsentrasi larutan asam. (Risma Ayu, 2014)
TAT (Titik Akhir Titrasi) adalah suatu titik dalam titrasi dimana ditandai dengan perubahan warna, sehingga titrasi harus dihentikan, hal tersebut menandakan kedua senyawa yang direaksikan telah habis bereaksi. TET (Titik Ekivalen Titrasi) adalah suatu keadaan dimana jumlah asam dan basa dalam titrasi adalah sama. Perbedaannya adalah pada keadaan TET tidak dapat diamati karena tidak ada peerubahan warna, sedangkan pada keadaan TAT dapat diamati karena warna dari larutan berubah. (Kompasiana, 2012)
Fenolftalein adalah salah satu indikator asam – basa sintetik yang memiliki rentang pH antara 8,00 – 10,0. Pada larutan asam dan netral, fenolftalein tidak berwarna. Sedangkan bila dimasukkan ke dalam larutan basa, warnanya akan berubah menjadi merah. Larutan metil jingga dan metil merah dapat membedakan antara larutan asam dengan larutan netral. Larutan asam yang ditetesi metil merah dan jingga akan tetap berwarna merah, sedangkan larutan netral berwarna kuning. Akan tetapi, metil jingga dan metil merah juga akan menyebabkan larutan basa berwarna kuning, Berarti, untuk mengetahui apakah suatu larutan bersifat basa atau netral kita tidak dapat menggunakan metil jingga. Bromtimol biru di dalam larutan asam akan berwarna kuning, dalam larutan basa akan berwarna biru, dan di dalam larutan netral akan berwarna biru kekuningan. Sebagai aturan umum, indikator yang digunakan harus mengalami perubahan warna sekitar pH titik ekuivalensi. Titrasi lebih mudah diamati apabila adanya perubahan warna dari tidak berwarna menjadi berwarna dibandingkan dari berwarna menjadi tidak berwarna, oleh karena itu indikator tidak bisa dipertukarkan penggunaannya karena membuat identifikasi menjadi lebih sulit. (Novi Irayanti, 2013)
dan kestabilannya didalam proses penimbangan, pelarutan dan penyimpanan. Syarat-syarat larutan baku primer adalah :
- Mempunyai kemurnian yang tinggi - Rumus molekulnya pasti
- Tidak mengalami perubahan selama penimbangan
- Berat ekivalen yang tinggi (Agar kesalahan penimbangan dapat diabaikan)
- Larutan stabil didalam penyimpanan Syarat-syarat larutan baku sekunder adalah :
- Derajat kemurnian lebih rendah daripada larutan baku primer - Berat ekivalennya tinggi
- Larutan relatif stabil didalam penyimpanan (Kumpulan Artikel Kimia, 2012) Aplikasi dalam bidang pangan analisis kuantitatif adalah untuk menentukan persen boraks yang terkandung dalam baso atau alam bahan pangan lainnya yang digunakan dalam kehidupan sehari-hari. Menentukan persen cuka yang digunakan untuk kebutuhan rumah tangga, membuat garam dapur NaCl dari pencampuran antara NaOH dan HCl.
Berdasarkan hasil perngamatan dapat disimpulkan bahwa larutan A (Buavita) termasuk kedalam larutan asam karena memiliki pH ±4,41, sedangkan larutan B (soda kue) termasuk larutan basa karena memiliki pH ±8,72, dan larutan C (larutan garam) termasuk kedalam larutan netral karena memiliki pH netral yaitu 7. Faktor kesalahan yang dapat terjadi dalam percobaan ini adalah :
1. Kebersihan alat
Alat yang digunakan harus bersih, tidak merupakan alat yang bekas digunakan dalam percobaan lain, tujuannya untuk menghindari kontaminasi atau bercampurnya larutan sampel yang akan diuji, sehingga hasil pengukuran pH tidak sesuai.
2. Alat ukur
Kebersihan alat ukur, pH meter tidak dibilas dengan bersih, seharusnya elektroda dibilas dengan air agar tidak meninggalkan sisa pengamatan sebelumnya. Selain itu juga pH meter yang dalam kondisi tidak baik atau rusak akan menyebabkan ketidak akuratan pengukuran.
pH larutan sampel hasil pengamatan tidak berebeda jauh dengan literatur yaitu memiliki pH sebagai berikut.
No .
Larutan pH meter Literatur
1. Buavita 4,41 3,78-4,55
2. Soda kue 8,72 9
3. Larutan garam 7 7
(sciencebuddies)
teliti. Kelebihan dari pH meter adalah dapat mengukur pH secara teliti, kekurangannya adalah harga yang tidak murah. (Noveriyanti Uswatun, 2013)
Deionized water dapat dimanfaatkan sebagai larutan elektrolit untuk mengisi tabung elektroliser. Larutan ini akan dicampur sodium bikarbonat
(KOH). Volume deionized water yang digunakan tergantung pada volume tabung yang digunakan. Air mineral juga dapat digunakan sebagai pengganti air ini, namun hal ini akan membuat risiko rusaknya elektroda semakin tinggi. Hal ini disebabkan kandungan logam dan mineral dalam air mineral masih cukup tinggi. Deionized water juga digunakan untuk membilas berbagai peralatan untuk analisislaboratorium. Larutan penyangga atau larutan dapar, atau buffer adalah larutan yang digunakan untuk mempertahankan nilai pH tertentu agar tidak banyak berubah selama reaksi kimia berlangsung. Sifat yang khas dari larutan penyangga ini adalah pH-nya hanya berubah sedikit dengan pemberian sedikit asam kuat atau basa kuat. (wikipedia, 2014)
Aplikasi pengukuran pH dalam bidang pangan adalah untuk mengukur pH dari yogurt, nata de coco, dan membuat soda kue.
Kesimpulan
Pada titrasi Alkalimetri menggunakan H2C2O4 (Oksalat) sebagai larutan baku primer untuk standarisasi NaOH sebagai larutan baku sekunder. Sedangkan pada titrasi Asidimetri menggunakan Na2B4O7 (Boraks) sebagai larutan baku primer untuk standarisasi HCl sebagai larutan baku sekunder. Konsentrasi HCl digunakan dalam titrasi Alkalimetri adalah 0,1393 N, sedangkan NaOH yang digunakan dalam titrasi Asidimetri memiliki konsentrasi 0,1344 N.
pH dari larutan Buavita adalah 4,41, masih dalam rentang pH pada literatur, sehingga larutan Buavita termasuk kedalam larutan asam. pH dari larutan soda kue adalah 8,72 sedangkan pada literatur soda kue memiliki pH 9 mendekati hasil pengukuran dan larutan soda kue dapat digolongkan sebagai larutan basa, sedangkan larutan garam diukur memiliki pH 7 sesuai dengan literatur sehingga dapat digolongkan sebagai larutan netral.
DAFTAR PUSTAKA Anonim. 2014. Larutan Penyangga. Tersedia dalam :
http://id.wikipedia.org/wiki/Larutan_penyangga Diakses : 21 November 2014.
Anonim. 2014. Air Suling. Tersedia dalam :
http://id.wikipedia.org/wiki/Air_suling. Diakses : 21 November 2014 Anonim. 2012. Larutan Baku Primer dan Sekunder. Tersedia dalam :
http://teknikkimiakita.blogspot.com/2012/03/larutan-baku-primer-dan-sekunder.html. Diakses : 22 November 2014.
Brady, J.E. 1999. Kimia Universitas Asas dan Struktur. Binarupa Aksara : Jakarta. Iriyanti, Novi. 2013. Indikator Asam Basa. Tersedia dalam :