LAPORAN V
KELARUTAN DAN KOEFISIEN AKTIVITAS ELEKTROLIT KUAT
I. TUJUAN
1. Mengukur kelarutan barium iodat dalam larutan KCl dengan berbagai kekuatan
ion
2. Menghitung kelarutan barium iodat pada I = 0 dengan jalan ekstrapolasi
3. Menghitung koefisien aktivitas rata-rata barium iodat pada berbagai nilai I dan
menguji penggunaan hukum Debye-Huckle
II. DASAR TEORI
Hukum Debye-Huckel dapat diterapkan jika konsentrasi larutan elektrolit yang
sedikit larut diukur dengan tepat walaupun konsentrasinya rendah (Sutrisno,1999).
Selain itu kelarutannya dalam air harus berada dalam batas kisaran hukum
Debye-Huckel, yaitu kelarutan ion<0,01 M untuk elektrolit 1-1 (uni-univalen).
Aktivitas atau koefisien aktivitas suatu individu ion secara percobaan tidak
dapat ditentukan, karena itu di definisikan aktivitas rata-rata a±, dan koefisien
aktivitas rata –rata y ± yang untuk elektrolit 1-2 (uni-bivalen) didefinisikan sebagai berikut :
a± = (a+ a-2)1/3………....(1) γ ± = (γ + γ -2)1/3……..………...(2) c± = (c+ c-2)1/3.………(3)
Bila nilai konsentrasi (c) dinyatakan dalam mol/liter, maka berdasarkan definisi
diatas di peroleh:
a± = γ ±.c± = Ka1/3 = konstan………..……….(4)
Dalam hal ini, a adalah hasil kali aktivitas kelarutan yang dapat di turunkan sebagai
berikut:
Ba(IO3)2
↔
Ba2+ + 2IO3-2
3 2
.
IO
Ba
a
a
Ka
………..………..(5)
Misalnya dalam larutan terdapat elektrolit lain yang tidak mengandung ion senama
dengan Ba(IO3)2 (misal KCl) dan anggap kelarutan Ba(IO3)2 dalam air adalah s mol/liter, maka c+ (konsentrasi ion Ba2+ dalam larutan) = s mol/liter dan c-
c± = 1,59 s………..(6) Dengan menggabungkan persamaan (5) dengan persamaan (2) diperoleh
s γ ± = (Ka1/3/1,5) = konstanta = so………...(7)
Dalam hal ini so adalah kelarutan teoritis bila y± mendekati 1 satu (=1) yaitu
pada keadaan dimana kekuatan ion sama dengan nol (I=0). Karena y± selalu
menurun dengan meningkatnya kekuatan ion, maka baik kelarutan dan hasil kali
kelarutan, Ksp (dinyatakan dalam konsentrasi, bukan dalam aktivitas) dari elektrolit
yang sedikit larut akan meningkat dengan adanya penambahan elektrolit lain yang
tidak mengandung ion senama. Jika nilai so dapat ditentukan dengan jalan
ekstrapolasi ke kekuatan ion sama dengan nol, maka y± pada berbagai konsentrasi akan dapat dihitung (γ± = so/s).
Pada larutan elektrolit, s bergantung pada kekuatan ion yang didefinisikan
sebagai:
2
2
/
1
i i
Z
c
I
………(8)
Keterangan:
ci = konsentrasi ion ke-i dalam mol/liter zi = muatan ion ke-i
Kekuatan ion (I) harus dihitung berdasarkan semua ion yang berada di dalam
larutan. Nilai I terendah yang dapat digunakan untuk mengukur kelarutan dibatasi
oleh kelarutan elektrolit dalam air. Ekstrapolasi ke kekuatan ion sama dengan nol,
dilakukan berdasarkan teori Debye-Huckle untuk elektrolit kuat (Karyadi,1990).
Teori Debye-Huckle menyatakan bahwa untuk larutan dengan kekuatan ion
yang rendah (I<0,01) untuk eletrolit univalen (1-1), koefisien aktivitas rata-rata
suatu elektrolit yang berdisosiasi menjadi ion bermuatan Z+ dan Z- dapat dihitung
dengan menggunakan persamaan:
Log γ ± = -A|Z+.Z-|
I
)………(9)A = tetapan dan untuk larutan dengan pelarut air pada suhu 25°C nilainya adalah
0,509. Gabungan persamaan (6) dan (8) untuk Ba(IO3)3 diperoleh:
Log s = log so + 2A
I
………..(10)Jadi, pada kekuatan ion yang rendah kurva log s sebagai fungsi
I
akan berupaIII. ALAT & BAHAN A. Alat :
1. Labu erlenmeyer 250 mL 8 buah
2. Buret 1 buah
3. Labu takar 250 mL 1 buah
4. Labu takar 100 mL 1 buah
5. Pipet 25 mL 1 buah
6. Pipet 10 mL 1 buah
B. Bahan :
1. KCl 0,1 M
2. Ba(IO3)2 (dibuat dengan mencampurkan NaIO3 dan BaCl2) 3. Na2S2O3 0,01 M
4. HCl 1 M
5. KI 0,5 g/L
6. Kanji
V. HASIL & PEMBAHASAN
1 0.3533784 0.5944564 0.2482238 -0.6051566
2 0.1590116 0.3987626 0.3926989 -0.4059403
3 0.0560577 0.2367651 0.5740810 -0.2410268
4 0.0258898 0.1609032 0.6858049 -0.1637994
5 0.0123819 0.1112739 0.7704122 -0.1132769
6 0.0048409 0.0695766 0.8495149 -0.0708290
7 - - - -
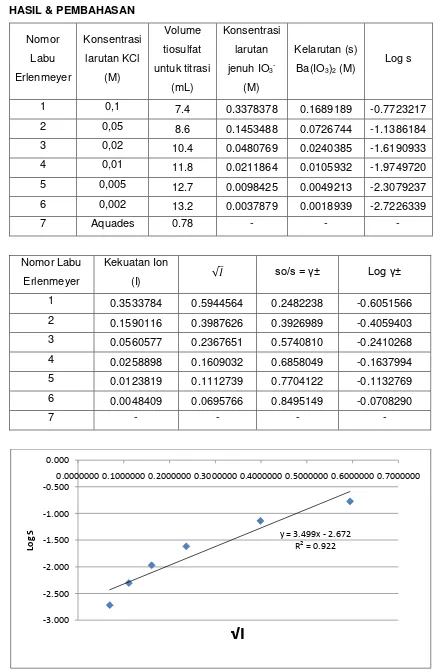
Gambar 1. Grafik antara log s terhadap
y = 3.499x - 2.672
0.0000000 0.1000000 0.2000000 0.3000000 0.4000000 0.5000000 0.6000000 0.7000000
Lo
g
S
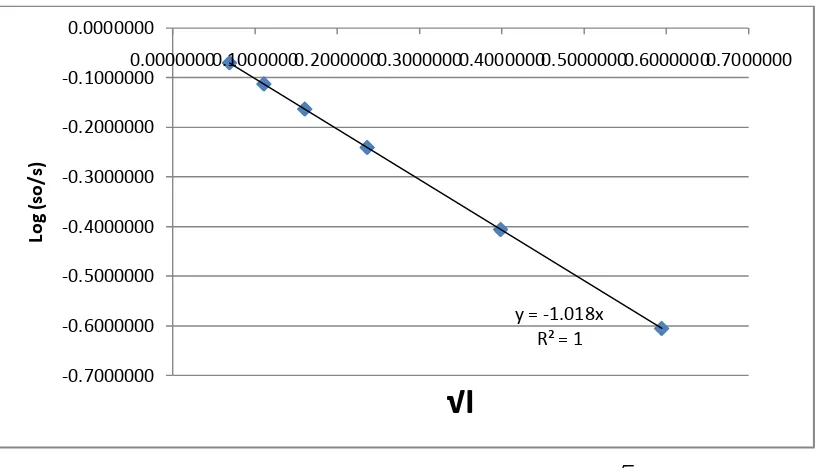
Gambar 2. Grafik antara log (so/s) terhadap
Kelarutan yang diukur pada praktikum ini adalah kelarutan dari Barium Iodat
dalam larutan KCl dengan berbagai variasi konsentrasi. Adanya variasi konsentrasi
larutan KCl ini kemudian mengakibatkan kekuatan ion dalam campuran juga ikut
berubah sehingga menjadi tidak sama antara campuran yang satu dengan yang
lain (dalam erlenmayer no 1-7).
Untuk mencapai tujuan dari praktikum ini, yakni mengukur kelarutan barium
iodat dalam larutan KCl dengan berbagai kekuatan ion ; menghitung kelarutan
barium iodat pada I = 0 dengan jalan ekstrapolasi ; menghitung koefisien aktivitas
rata-rata barium iodat pada berbagai nilai I dan menguji penggunaan hukum
Debye-Huckle, data awal yang digunakan adalah data volume tiosulfat yang
digunakan untuk titrasi. Berdasarkan data volume tiosulfat ini, selanjutnya dapat
ditentukan konsentrasi dari ion IO3- , kelarutan dari barium iodat, logaritma dari
kelarutan (log s), kurva log s, intensitas rata-rata,koefisien aktivitas rata-rata dan
log dari koefisien aktivitas rata-rata.
Adapun reaksi yang terjadi pada saat titrasi yakni :
IO3
Dalam teori Debye-Huckle dinyatakan bahwa logaritma koefisien ionik
rata-rata adalah fungsi linear dari akar pangkat dua kekuatan ionik dan slopenya
bernilai negatif. Selain itu, disebutkan pula bahwa koefisien aktivitas ionik hanya
bergantung pada muatan ion dan konsentrasinya. Kelarutan berbanding lurus
dengan kekuatan ion. Jadi, semakin besar kekuatan ion, maka semakin besar pula
kelarutannya dan sebaliknya semakin kecil ekuatan ion, maka semakin kecil pula
kelarutannya. Pada gambar 1 dan 2 digambarkan hubungan antara koefisisen
aktivitas ionik dengan konsentrasi, dimana koefisien aktivitas ionik rata-rata naik
dengan turunnya konsentrasi. Dengan jalan ekstrapolasi (x = 0) diperoleh log s =
-2,672 dan kelarutan (s) = 2,128.10-3.
VI. KESIMPULAN & SARAN A. Kesimpulan
1. Kelarutan barium iodat semakin menurun dalam larutan KCl yang
konsentrasinya semakin rendah dengan kekuatan ion yang semakin besar
2. Kelarutan barium iodat pada I = 0 dengan ekstrapolasi adalah 2.128.10-3 M 3. Koefisien aktivitas rata-rata barium iodat (γ ±) pada berbagai nilai I dapat
dilihat pada tabel lampiran
4. Koefisien aktivitas ionik rata-rata semakin meningkat dengan turunnya
konsentrasi
B. Saran
1. Praktikan hendaknya bermat dan teliti dalam melakukan praktikum
sehingga data pengamatan yang didapat tepat
2. Praktikan harus benar-benar menguasai materi sebelum meleksanakan
praktikum
VII. DAFTAR PUSTAKA
Karyadi.1990.Kimia Fisika II.Jakarta : Bumi Pustaka.
Sutrisno.1999.Kimia Fisika untuk Mahasiswa.Malang : Universitas Brawijaya. Tim Dosen Kimia Fisika.2010. Petunjuk Praktikum Kimia Fisik.Semarang : Jurusan
Kimia FMIPA UNNES.
Semarang, 19 November 2012
Mengetahui,
Dosen Pengampu Praktikan
Ir. Sri Wahyuni, M.Si Ana Yustika
JAWABAN PERTANYAAN 1. T = 25°C
Konstanta dielektrik = 78,5
e = 1,6. 10-19
NA = 6,02.10-23 mol k = 1,381.10-23 J/mol
A = ...?
H2O H+ + OH-
I = ½ (10-7 + 10-7) = 10-7
ln γ ± =
2 / 1
2 / 3
2 1 3
100
1
π
2
N
AKT
Z
Z
e
=
= 9,5387.10-56
2. I= ½ [ c+ ] [ c- ]2
0.01 = ½ c2 0.02 = c2
C = 0.141
c± = ( c+c-2)1/3
= ( 0.141x0.1412)1/3 = 0.141
Log γ ±= -A|Z+.Z-|
I
)= -0.509| +1.-2|0.011/2)
= -0.1018 γ ± = 0.791
LAMPIRAN
Suhu larutan dalam erlenmeyer = 26 oC
Standarisasi tiosulfat = 5 ml larutan KIO3 (0,0769 gram dalam 100 ml)
Memerlukan 2 ml tiosulfat untuk netralisasi.
Nomor Labu
Erlenmeyer
Kekuatan Ion
(I) so/s = γ± Log γ±
1 0.3533784 0.5944564 0.2482238 -0.6051566
2 0.1590116 0.3987626 0.3926989 -0.4059403
3 0.0560577 0.2367651 0.5740810 -0.2410268
4 0.0258898 0.1609032 0.6858049 -0.1637994
5 0.0123819 0.1112739 0.7704122 -0.1132769
6 0.0048409 0.0695766 0.8495149 -0.0708290
7 - - - -
Erlenmeyer 1
1. Konsentrasi larutan jenuh IO3
-V lar dlm Erleneyer = V1 = 25 mL
2. Kelarutan Ba(IO3)2
Ba(IO3)2 Ba2+ + 2 IO3 s s 2s
[ IO3- ] = 0.3378 M = 2s
s = 0.3378/2 = 0.1689 M
Jadi, Kelarutan Ba(IO3)2 = s = 0.1689 M
3. Log s
Log s = Log 0.1689 = -0.7723
4. Kekuatan ion (I)
KCl K+ + Cl- Ba(IO3)2 Ba2+ + 2 IO3- I = ½ {[K+] + [Cl-] + [IO3-] + [Ba2+]}
= ½ ( 0.1 + 0.1 + 0.3378 + 0.1689 )
= 0.3534
5. I1/2 = 0.35341/2 = 0.5944
6. log so = log s - |2A-
I
|= -0.7723 – ( 2 x 0.509 x 0.5944) = - 1.3774
so = antilog -1
= 0.0419
7. so/s = y± = 0.0419 /0.1689
= 0.2482
8. log y± = log 0.2482 = - 0.6052
Erlenmeyer 2
1.Konsentrasi larutan jenuh IO3
-V lar dlm Erleneyer = V1 = 25 mL [ KCl ] = M1 = 0.05 M
V tiosulfat = V2 = 8.6 mL V1.M1 = V2.M2
25 mL x 0.05 M = 8.6 mL x M2 M2 = 0.1454 M
Jadi, konsentrasi larutan jenuh IO3- = 0.1454 M 2. Kelarutan Ba(IO3)2
Ba(IO3)2 Ba2+ + 2 IO3 s s 2s
s = 0.1454/2 = 0.0727 M
Jadi, Kelarutan Ba(IO3)2 = s = 0.0727 M
3. Log s
Log s = Log 0.0727 = -1.1386
4. Kekuatan ion (I)
KCl K+ + Cl- Ba(IO3)2 Ba2+ + 2 IO3- I = ½ {[K+] + [Cl-] + [IO3-] + [Ba2+]}
= ½ ( 0.05 + 0.05 + 0.1454+ 0.0727 )
= 0.1590
5. I1/2 = 0.15901/2 = 0.3988
6. log so = log s - |2A-
I
|= - 1.1386 – ( 2 x 0.509 x 0.3988) = -1.5446
so = antilog -1.5446
= 0.0285
7. so/s = y± = 0.0285 / 0.0727
= 0.3927
8. log y± = log 0.3927 = - 0.4059
Erlenmeyer 3
1.Konsentrasi larutan jenuh IO3
-V lar dlm Erleneyer = V1 = 25 mL [ KCl ] = M1 = 0.02 M
V tiosulfat = V2 = 10.4 ml V1.M1 = V2.M2
25 ml x 0.02 M = 10.4 ml x M2 M2 = 0.0481 M
Jadi, konsentrasi larutan jenuh IO3- = 0.0481 M 2. Kelarutan Ba(IO3)2
Ba(IO3)2 Ba2+ + 2 IO3 s s 2s
[ IO3- ] = 0.0481 M = 2s
s = 0.0481/2 = 0.0240 M
Jadi, Kelarutan Ba(IO3)2 = s = 0.0240 M 3. Log s
4. Kekuatan ion (I)
KCl K+ + Cl- Ba(IO3)2 Ba2+ + 2 IO3- I = ½ {[K+] + [Cl-] + [IO3-] +[Ba2+]}
= ½ ( 0.02 + 0.02 + 0.0481 + 0.0240 )
= 0.0561
5. I1/2 = 0.05611/2 = 0.2368
6. log so = log s - |2A-
I
|= - 1.6191 – ( 2 x 0.509 x 0,2368) = - 1.8601
so = antilog -1.8601
= 0.0138
7. so/s = y± = 0.0138/ 0.0240
= 0.5741
8. log y± = log 0.5741 = - 0.2410
Erlenmeyer 4
1. Konsentrasi larutan jenuh IO3
-V lar dlm Erleneyer = V1 = 25 mL
[ KCl ] = M1 = 0.01 M V tiosulfat = V2 = 11.8 mL
V1.M1 = V2.M2 25 mL x 0.01 M = 10.3 mL x M2
M2 = 0.0212 M
Jadi, konsentrasi larutan jenuh IO3- = 0.0212 M 2. Kelarutan Ba(IO3)2
Ba(IO3)2 Ba2+ + 2 IO3 s s 2s
[ IO3- ] = 0.0212 M = 2s
s = 0.0212/2 = 0.0106 M
Jadi, Kelarutan Ba(IO3)2 = s = 0.0106 M 3. Log s
Log s = Log 0.0106 = -1.9750
4. Kekuatan ion (I)
= ½ ( 0.01 + 0.01 + 0.0212 + 0.0106 )
= 0.0259
5. I1/2 = 0.02591/2 = 0.1609
6. log so = log s - |2A-
I
|= - 1.9750 – ( 2 x 0.509 x 0,1609) = - 2.1388
so = antilog - 2.1388
= 0.0073
7. so/s = y± =0.0073 / 0.0106
= 0.6858
8. log y± = log 0.6858 = - 0.1638
Erlenmeyer 5
1. Konsentrasi larutan jenuh IO3
-V lar dlm Erleneyer = V1 = 25 mL
[ KCl ] = M1 = 0.005 M V tiosulfat = V2 = 12.7 mL
V1.M1 = V2.M2 25 mL x 0.005 M = 12.7 mL x M2
M2 = 0.0098 M
Jadi, konsentrasi larutan jenuh IO3- = 0.0098 M
2. Kelarutan Ba(IO3)2
Ba(IO3)2 Ba2+ + 2 IO3 s s 2s
[ IO3- ] = 0.0098 M = 2s
s = 0.0098/2 = 0.0049 M
Jadi, Kelarutan Ba(IO3)2 = s = 0.0049 M 3. Log s
Log s = Log 0.0049 = - 2.3079
4. Kekuatan ion (I)
KCl K+ + Cl- Ba(IO3)2 Ba2+ + 2 IO3- I = ½ {[K+] + [Cl-] + [IO3-] + [Ba2+]}
= ½ ( 0.005 + 0.005 + 0.0098 + 0.0049 )
= 0.0124
6. log so = log s - |2A-
I
|= - 2.3079 – ( 2 x 0,509 x 0.1113) = - 2.4212
so = antilog – 2.4212 = 0.0038
7. so/s = y± =0.0038 /0.0049
= 0.7704
8. log y± = log 0.7704 = - 0.1133
Erlenmeyer 6
1. Konsentrasi larutan jenuh IO3
-V lar dlm Erleneyer = V1 = 25 mL [ KCl ] = M1 = 0.002 M
V tiosulfat = V2 = 13.2 mL V1.M1 = V2.M2
25 mL x 0.002 M = 13.2 mL x M2 M2 = 0.0038 M
Jadi, konsentrasi larutan jenuh IO3- = 0.0038 M 2. Kelarutan Ba(IO3)2
Ba(IO3)2 Ba2+ + 2 IO3 s s 2s
[ IO3- ] = 0.0038 M = 2s
s = 0.0038/2 = 0.0019 M
Jadi, Kelarutan Ba(IO3)2 = s = 0.0019 M
3. Log s
Log s = Log 0.0019 = - 2.7226
4. Kekuatan ion (I)
KCl K+ + Cl- Ba(IO3)2 Ba2+ + 2 IO3- I = ½ {[K+] + [Cl-] + [IO3-] + [Ba2+]}
= ½ ( 0.002 + 0.002 + 0.0038 + 0.0019 )
= 0.0048
5. I1/2 = 0.00481/2 = 0.0696
6. log so = log s - |2A-
I
|so = antilog – 2.7935 = 0.0016
7. so/s = y± = 0.0016 / 0.0019
= 0.8495
8. log y± = log 0.8495 = - 0.0708
Erlenmeyer 7
Air
Standarisasi Na.tiosulfat
5 ml larutan KIO3 ( 0.0700 gram dalam 100 mL ) M = gr.1000/(Mr.V)
= 0.0700x1000/ (214x100)
= 0.00327 mol/L
Titrasi dengan Na.tiosulfat
V1 = V KIO3 = 5mL
M1 = M KIO3 = 0.00327 mol/L
V2 = V Na.tiosulfat = 0.78 mL ( dari titrasi ) M1 x V1 = M2 x V2
0.00327 M x 5 ml = M2 x 0.78 mL