Logam berat merupakan jenis logam yang seringkali menimbulkan masalah lingkungan perairan. Hal ini dikarenakan karakter dari logam berat yang dapat bersifat racun bagi lingkungan dan manusia. Adanya logam berat di perairan, berbahaya baik secara langsung terhadap kehidupan organisme, maupun efeknya secara tidak langsung. Logam berat yang banyak berperan sebagai polutan adalah timbal, krom, merkuri, uranium, selenium, seng, arsen, kadmium, emas, perak, tembaga dan nikel. Logam berat yang beracun ini biasanya berasal dari sisa hasil pertambangan, pemurnian bijih logam, industri peralatan elektrik, cat, baterai, pestisida, dan sebagainya.
Tembaga merupakan logam penting yang sering digunakan sebagai bahan baku dalam perindustrian. Pengolahan tembaga sering menghasilkan sisa-sisa produksi sebagai limbah yang menimbulkan efek terhadap lingkungan. Efek yang ditimbulkan oleh logam beracun seperti tembaga telah dikenal secara luas. Sebagai contoh adalah kerusakan pada ginjal dan organ-organ dalam yang lain sehingga berbagai cara dilakukan untuk memisahkan tembaga dari konstituen yang diinginkan (Sonowale, Ghalgasi and Argekar,2002). Apabila konsentrasi tembaga sangat tinggi di perairan dapat menyebabkan pencemaran air laut. Kepekatan tembaga yang tinggi dan terakumulasi dalam ikan dan organisme lain dapat mengakibatkan kerusakan insang, hati, ginjal, dan sistem saraf (www.wikipedia.org). Kadmium(II) merupakan salah satu logam berat yang masuk kategori bersifat toksik tinggi (Munaf, 1994). Kadmium dan garamnya bersifat toksik bagi organisme (terakumulasi pada hati dan ginjal), karena ion divalennya mampu berikatan dengan residu sulfihidril (-SH) pada enzim (Lagowski, 1997). Timbal merupakan logam beracun yang dapat membahayakan kesehatan manusia. Timbal dan garamnya dapat menyebabkan kerusakan pada hati, otak, peredaran darah, dan sistem saraf (www.wikipedia.org). Kromium merupakan elemen berbahaya di permukaan bumi dan dijumpai dalam kondisi oksida antara Cr(II) sampai Cr(IV), tetapi hanya kromium bervalensi tiga dan enam memiliki kesamaan sifat biologinya. Kromium bervalensi tiga umumnya merupakan bentuk yang umum dijumpai di alam dan memiliki sifat racun yang lebih rendah dibanding dengan valensi enam. Pada bahan makanan dan tumbuhan mobilitas kromium relatif rendah (Suhendrayatna, 1999).
Beberapa cara telah dilakukan untuk mengolah limbah logam berat tersebut sebelum dibuang ke perairan bebas. Cara yang biasa dipakai atau dikembangkan dengan tujuan untuk memisahkan ion-ion logam berat yang bersifat toksik dari lingkungan ialah ekstraksi pelarut, pengendapan, dan adsorpsi (Hiratani, dkk, 1994). Pemisahan ion logam pada umumnya dilakukan dengan metode pembentukan kompleks seperti ekstraksi pelarut, adsorpsi ion logam dengan resin, serta dengan electroplating (Umi, 2002). Prosedur yang biasa digunakan untuk mengambil ion logam dari larutan seperti pengendapan kimia, pertukaran ion, osmosis terbalik, ekstraksi pelarut (Ramachandra dan Kanamadi, 2003). Metode konvensional yang sering digunakan untuk mengambil logam berat
dari limbah industri di perairan termasuk pengendapan kimia dengan sulfide atau hidroksida, oksidasi atau reduksi kimia, pertukaran ion, perlakuan elektrokimia, evaporative recovery, dan adsorpsi (Al-Qodah, 2006).
Metode ekstraksi kurang efisien karena menggunakan pelarut yang sangat banyak sehingga sangat mahal untuk diaplikasikan dalam skala industri (Chen, dkk, 1995). Elektrodialisis merupakan metode pemisahan logam berat menggunakan membran semi permeable selektif ion, kekurangannya yaitu apabila terdapat endapan logam terhidroksida maka akan menyumbat membran. Kelemahan dari metode pengendapan kimia adalah endapan yang dihasilkan mengandung komponen yang beracun (Ramachandra dan Kanamadi, 2003). Metode pertukaran ion tengah dikembangkan dan akan dipelajari sebagai metode pengambilan logam dengan menggunakan bahan penukar ion.
Suatu senyawa dapat dimanfaatkan sebagai penukar ion bila mempunyai gugus aktif seperti –OH, -COOH, -SO3H sebagai pusat pertukaran. Penukar ion dengan gugus terionisasi kuat seperti -SO3H, R3NH disebut sebagai penukar kuat, sedangkan gugus ion yang terionisasi secara parsial seperti -OH, -COOH, dan – NH2 dikenal sebagai penukar lemah. Adanya pusat aktif pada penukar ion menyebabkan terjadinya pertukaran ion terhadap pusat aktif dengan ion-ion logam. Ion-ion logam akan masuk ke dalam penukar ion dan menggantikan kedudukan pusat aktif penukar ion tersebut.
Eugenol mempunyai struktur yang mirip dengan stirena yang banyak digunakan sebagai bahan dasar resin. Eugenol mempunyai gugus hidroksi (-OH), gugus metoksi (-OCH3), dan gugus propenil (-CH2-CH=CH2). Polimer dari eugenol dapat dimanfaatkan sebagai penukar kation, karena mempunyai banyak gugus hidroksi (-OH) sebagai pusat pertukaran. Melihat dari struktur eugenol, maka selain dapat dikopolimerisasi secara kationik (Odian, 1991), juga dapat disambungsilangkan dengan DVB secara ionik. Untuk meningkatkan efisiensi pertukaran dilakukan sambungsilang dengan DVB untuk membentuk struktur mirip dengan jaring, sehingga ion-ion logam selain tertukar dengan H+ pada gugus hidroksi, ion-ion logam yang mempunyai ukuran sesuai dengan ukuran jaring yang terbentuk akan terjebak dalam jaring. Peningkatan efektivitas penukar ion dapat dilakukan dengan impregnasi ionofor tertentu. Penukar ion yang terimpregnasi menjadi lebih efektif dalam mengikat ion logam karena ionofor dapat membentuk ikatan terhadap logam.
Pertukaran ion dengan metode batch untuk ion logam dapat digunakan ligan terimpregnasi yaitu memasukkan suatu ionofor tertentu ke dalam penukar ion untuk meningkatkan selektivitas penukar ion. Mustikarini (2007) telah mensintesis suatu ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena (CTA) melalui reaksi diazotasi. Ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena mempunyai dua atom O pada gugus hidroksi dan dua atom N yang mana kedua atom tersebut mempunyai sifat sangat elektronegatif sehingga dapat menarik kation dengan elektron bebasnya. Ionofor tersebut dimpregnasikan ke dalam kopoli (Eugenol-DVB) menjadi suatu penukar ion kopoli (Eugenol-(Eugenol-DVB) yang diimpregnasi dengan ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena. Dari hasil karakterisasi terlihat bahwa kopoli (Eugenol-DVB) yang diimpregnasi dengan ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena memiliki gugus fungsi yang terdapat pada kopoli
kopoli(Eugenol-DVB) dan berikatan dengan keempat elektron bebas pada atom O dan N. Selain itu kation yang mempunyai jari-jari atom mendekati ukuran pori akan terjebak dalam pori yang dibentuk oleh kompleks antara kopoli(eEugenol-DVB) dengan ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena.
Pada penelitian ini akan dilakukan penelitian efektivitas dan selektivitas kopoli (Eugenol-DVB) yang diimpregnasikan dengan ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena sebagai penukar ion terhadap ion-ion logam Cu, Cd, Cr, dan Pb secara batch dengan variasi kondisi pH dan waktu kontak. Selain itu akan diteliti pula untuk penukar ion ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena
dan dengan kopoli (Eugenol-DVB). B. Perumusan Masalah
1. Identifikasi Masalah
Pada pertukaran ion terdapat beberapa metode yang dapat digunakan, diantaranya metode batch dan metode continu. Metode batch lebih sering digunakan dalam penelitian karena lebih mudah dan dapat dilakukan secara sederhana.
Faktor-faktor yang mempengaruhi proses pertukaran ion terhadap pusat aktif penukar ion dengan ion logam secara batch antara lain : pH larutan logam, waktu kontak, konsentrasi awal larutan, dan temperatur.
Analisis logam dalam suatu sampel dapat ditentukan dengan banyak cara. Metode yang sering digunakan antara lain dengan spektrofometri serapan atom, fotometri nyala, dan kolorimetri
2, Batasan Masalah
Berdasarkan identifikasi masalah tersebut diatas, maka pada penelitian ini diberikan batasan masalah sebagai berikut :
a. Metode pertukaran ion yang digunakan adalah metode batch.
b. Variabel yang diteliti adalah pH pada range pH 1, 2, 3, 4, 5, 6, 7, dan waktu kontak sebesar 0, 5, 10, 15, 20, 25, dan 30 menit, dengan konsentrasi awal larutan sebesar 50 ppm dan pada temperatur kamar
c. Analisis logam ditentukan dengan Spektrofotometri Serapan Atom. 3. Rumusan Masalah
Berdasarkan batasan masalah tersebut di atas, maka pada penelitian ini diberikan rumusan masalah sebagai berikut :
a. Bagaimana pengaruh pH dan waktu kontak terhadap pertukaran ion tersebut ? b. Apakah kopoli (Eugenol-DVB) yang diimpregnasi dengan ionofor
5’-kloro-2,4,2’-trihidroksiazobenzena merupakan penukar ion yang selektif?
c. Apakah kopoli (Eugenol-DVB) yang diimpregnasi dengan ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena merupakan penukar ion yang paling efektif bila dibandingkan dengan penukar ion ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena, dan dengan penukar ion kopoli (Eugenol-DVB)?
C. Tujuan Penelitian Tujuan penelitian ini adalah :
1. Mengetahui pengaruh pH dan waktu kontak terhadap pertukaran ion tersebut. 2. Mengetahui tingkat selektivitas kopoli(Eugenol-DVB) yang diimpregnasi
dengan ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena.
3. Mengetahui tingkat efektivitas dari kopoli (Eugenol-DVB) yang diimpregnasi dengan ionofor 2,4,2’-trihidroksiazobenzena, ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena, dan kopoli (Eugenol-DVB).
D. Manfaat Penelitian Manfaat yang diperoleh dari penelitian ini adalah :
1. Manfaat secara teoritis, diharapkan dapat menambah khasanah ilmu pengetahuan secara umum dan ilmu kimia polimer secara khusus, serta dapat dijadikan referensi bagi penelitian selanjutnya.
2. Secara praktis adalah dapat memperluas pemanfaatan eugenol yang merupakan komponen utama minyak daun cengkeh dan meningkatkan nilai ekonomisnya.
BAB II
LANDASAN TEORI A. Tinjauan Pustaka B. Kerangka Pemikiran
Eugenol mempunyai gugus hidroksi (-OH), gugus metoksi (-OCH3), dan gugus propenil (-CH2-CH=CH2). Polimer dari eugenol dapat dimanfaatkan sebagai penukar kation, karena mempunyai gugus hidroksi (-OH) sebagai pusat pertukaran.
Monomer eugenol disambungsilangkan dengan DVB melalui reaksi kopolimerisasi kationik dengan katalis BF3(OC2H5)2 membentuk kopoli(eugenol-DVB) dengan struktur mirip jaring sehingga ion-ion logam selain tertukar dengan H+, juga terjebak dalam jaring tersebut. Kopolimerisasi dengan DVB bertujuan untuk meningkatkan efektivitas penukar ion yaitu kemampuan penukar ion dalam berikatan dan menjebak ion.
Untuk memperoleh penukar ion yang akan berikatan atau menjebak ion tertentu, maka kopoli (eugenol-DVB) diimpregnasi dengan ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena membentuk penukar ion kopoli (eugenol-DVB) yang terimpregnasi ionofor. Ionofor merupakan reseptor untuk membentuk kompleks lipofilik dengan spesies bermuatan dan mempunyai kemampuan menangkap ion-ion. Ionofor ini dapat membedakan ion-ion berdasarkan ukuran dan sifat selektivitasnya.
Pertukaran ion secara batch dipengaruh oleh kondisi optimum pertukaran. Kondisi optimum tersebut diantaranya pH larutan logam dan waktu kontak. Pada pH rendah, H+ akan terprotonasi sehingga terjadi persaingan antara proton dengan ion logam. Sedangkan pada pH tinggi, ion logam akan terhidroksida dan akan
C. Hipotesis
1. Keasamaan (ph) optimum berada pada pH larutan Cu netral dan waktu kontak optimum relatif cepat.
2. Kopoli (Eugenol-DVB) yang diimpregnasi dengan ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena merupakan penukar ion yang selektif terhadap logam Cu(II).
3. Kopoli(Eugenol-DVB) yang diimpregnasi dengan ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena merupakan penukar ion yang lebih efektif terhadap logam Cu(II) dibandingkan penukar ion ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena ataupun penukar ion kopoli(Eugenol-DVB).
BAB III
METODOLOGI PENELITIAN 1. Penentuan pH Optimum
Distirer selama 15 menit, kemudian disaring 25 mL larutan logam Cu2+ 50 ppm
dengan variasi pH 1, 2, 3, 4, 5, 6 dan 7
Erlenmeyer kopoli(eugenol-DVB) yang diimpregnasi dengan ionofor 5’-kloro-2,4,2’-Trihidroksiazobenzena
Kurva pH vs % ion logam tertukar Analisis SSA
Konsentrasi ion logam Cu2+ Filtrat
2. Penentuan Waktu Kontak Optimum
n
Distirer dengan variasi waktu kontak
0, 10, 15, 20, 25 dan 30 menit, kemudian disaring
25 mL larutan logam Cu2+ 50 ppm dengan pH yang telah dioptimasi
Erlemeyer
Penukar ion kopoli(eugenol-DVB) yang diimpregnasi dengan ionofor
5’-kloro-2,4,2’-trihidroksiazobenzena
Kurva waktu kontak vs persen (%) ion logam
Analisis SSA
Konsentrasi ion logam Cu2+
Filtrat
3. Penentuan Efektivitas Penukar Ion dalam Logam Tunggal
Distirer dengan waktu kontak optimum kemudian disaring
Langkah yang sama dilakukan untuk penukar ion Kopoli(Eugenol-DVB) dan penukar ion ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena.
25 mL larutan logam tunggal Cu2+/Cd2+/Cr3+/Pb2+ 50 ppmdengan pH 7
dioptimasi
Erlenmeyer
Penukar ion kopoli(eugenol-DVB) yang diimpregnasi dengan ionofor
5’-kloro-2,4,2’-trihidroksiazobenzena
% E masing-masing logam Analisis SSA
Konsentrasi ion logam Cu2+/ Cd2+/ Cr3+/ Pb2+
Filtrat
4. Penentuan Selektivitas Penukar Ion dalam Logam Bersaingan
Distirer dengan waktu kontak optimum kemudian disaring
Langkah yang sama dilakukan untuk penukar ion Kopoli(Eugenol-DVB) dan penukar ion ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena.
25 mL larutan logam bersaing 50 ppm dengan pH yang telah dioptimasi
Erlenmeyer
Penukar ion kopoli(eugenol-DVB) yang diimpregnasi dengan ionofor
5’-kloro-2,4,2’-trihidroksiazobenzena
% E masing-masing ion logam Analisis SSA
Konsentrasi ion logam Cu2+, Cd2+, Cr3+ dan Pb2+
Filtrat
E. Teknik Analisa Data
Kandungan logam di filtrat dianalisis dengan instrumen SAA, sehingga akan diperoleh harga absorbansi dan konsentrasi dari tiap-tiap sampel di filtrat (logam yang tidak tertukar).
pH optimum dan waktu kontak optimum adalah pH dan waktu saat konsentrasi Cu yang tidak terukar sedikit atau Cu banyak yang tertukar. pH dan waktu kontak optimum ditentukan dari harga % tertukar logam Cu(II) dalam penukar ion .
Efektivitas dan selektivitas kopoli(Eugenol-DVB) yang terimpregnasi dengan ionofor 5'-kloro-2,4,2'-trihidroksiazobenzena terhadap logam Cu(II) dan logam lainnya pada logam bersaing ditentukan berdasarkan harga % tertukar dan koefisien selektivitasnya.
F. Teknik Penafsiran dan Penyimpulan Hasil
pH dan waktu kontak dikatakan optimum atau efektif bila persen (%) tertukar dalam penukar ion sangat tinggi.
Efektifitas dikatan baik apabila jumlah persen (%) logam Cu (II) yang tertukar dalam penukar ion besar.
Selektivitas kopoli(Eugenol-DVB) yang terimpregnasi dengan ionofor 5'-kloro-2,4,2'-trihidroksiazobenzena dikatakan baik apabila harga selektivitas logam Cu(II) terhadap logam lain besar.
BAB IV
HASIL DAN PEMBAHASAN
A. Penentuan pH Optimum Logam Cu (II)
pH optimum dalam penelitian ini adalah suatu kondisi asam atau basa suatu larutan yang dinyatakan dalam pH agar logam dapat tertukar secara optimum dalam penukar ion kopoli(Eugenol-DVB) yang terimpregnasi dengan ionofor 5'-kloro-2,4,2'-trihidroksiazobenzena. Pada penelitian ini penentuan pH optimum logam dilakukan pada variasi pH 1, 2, 3, 4, 5, 6, 7 karena pada pH diatas 7, larutan logam Cu (II) telah mengalami pengendapan. Data pengamatan absorbansi dan konsentrasi Cu(II) pada setiap variasi pH, konsentrasi larutan logam Cu(II) 50 ppm, berat penukar kation kopoli(Eugenol-DVB) yang terimpregnasi dengan ionofor 5'-kloro-2,4,2'-trihidroksiazobenzena 0,1 gram disajikan pada Tabel lampiran 1. Data konsentrasi logam Cu(II) yang tidak tertukar dan tertukar disajikan pada Tabel 1.
Tabel 1. Data Konsentrasi Logam Cu(II) Tidak Tertukar, dan Tertukar Terhadap variasi pH dengan Waktu Kontak Selama 15 Menit.
pH Kons. Awal (ppm) Kons. Tak Tertukar (ppm) Kons. Tertukar (ppm) 1 42,54 ± 0,14 07,08 ± 0,92 2 41,52 ± 0,10 08,10 ± 0,96 3 36,70 ± 0,34 12,92 ± 0,72 4 36,40 ± 2,15 13,22 ± 1,09 5 33,26 ± 1,03 16,36 ± 0,03 6 32,22 ± 0,22 17,40 ± 0,84 7 49,62 ± 1,06 25,25 ± 0,06 24,37 ± 1,00 Dari data konsentrasi Cu(II) pada Tabel 1 tersebut selanjutnya dapat ditentukan persen (%) tertukar logam Cu(II). Persen (%) tertukar dapat dihitung dengan membagi konsentrasi Cu(II) tertukar dengan konsentrasi Cu(II) sebelum tertukar (Awal). Contoh perhitungan persen (%) tertukar Cu(II) pada Lampiran 2, Data persen (%) tertukar logam Cu disajikan pada Tabel 2.
Tabel 2. Data persen (%) Tertukar Logam Cu(II) 50 ppm dalam penukar kation* terhadap variasi pH dengan Waktu Kontak selama 15 menit.
pH Tertukar Ion Logam (%)
1 14,27 2 16,32 3 26,04 4 26,64 5 32,97 6 35,07 7 49,11
* kopoli(Eugenol-DVB) yang terimpregnasi dengan ionofor 5'-kloro-2,4,2'-trihidroksiazobenzena
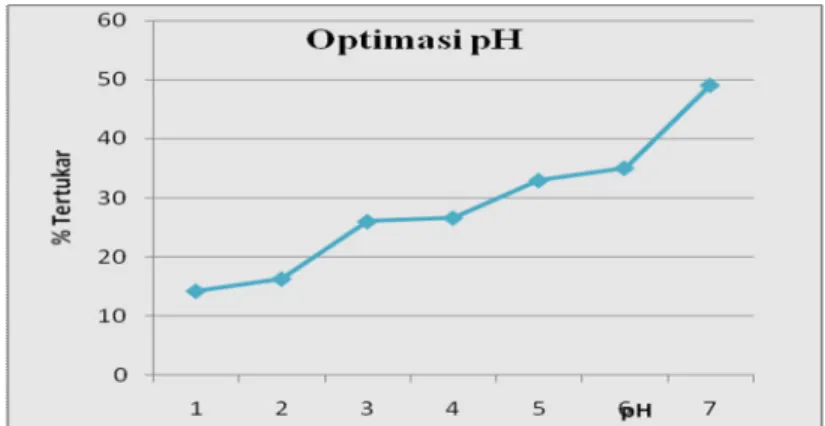
Dari data pada Tabel 2 dapat dibuat kurva hubungan antara persen (%) tertukar terhadap pH. Kurva hubungan antara persen (%) tertukar Cu terhadap pH disajikan pada Gambar 7.
Gambar 7. Kurva Hubungan Antara Persen (%) Tertukar Cu(II) terhadap pH. Kopoli(Eugenol-DVB) yang terimpregnasi dengan ionofor 5'-kloro-2,4,2'-trihidroksiazobenzena dibuat dari impregnasi Kopoli(eugenol-DVB) yang mempunyai gugus –OH sebagai pusat pertukaran dan ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena yang mempunyai dua atom O pada gugus hidroksi dan dua atom N yang mana kedua atom tersebut mempunyai sifat sangat elektronegatif sehingga dapat menarik kation dengan elektron bebasnya. Oleh karena itu, Kopoli(Eugenol-DVB) yang terimpregnasi dengan ionofor 5'-kloro-2,4,2'-trihidroksiazobenzena merupakan suatu penukar kation yang memiliki gugus aktif –OH, dimana atom O yang sangat elektronegatif mudah menarik elektron H sehingga H lepas sebagai H+(proton). Apabila larutan yang mengandung logam ditambahkan ke dalam suatu penukar kation maka akan terjadi pertukaran antara ion logam dengan proton yang terikat pada gugus aktif penukar kation tersebut, yang disebut pertukaran kation. Pertukaran kation dipengaruhi oleh pH larutan, waktu kontak, konsentrasi awal larutan, dan temperatur. pH larutan akan menunjukkan banyaknya proton maupun hidroksida yang berada pada larutan. Konsentrasi proton dan hidroksida ini akan mempengaruhi kemampuan Cu(II) untuk bertukar.
Dari data Tabel 2 dan Gambar 10 terlihat bahwa semakin tinggi pH diikuti dengan peningkatan jumlah logam yang tertukar. Konsentrasi Cu(II) yang tertukar pada pH 1 sebesar 07,08 ppm dengan persen tertukar 14,27 %. Hal ini disebabkan pada pH yang rendah atau pada pH yang lebih asam konsentrasi proton dalam larutan tinggi sehingga proton dan ion logam dalam larutan yang sama-sama bermuatan positif dan berfungsi sebgai asam lewis akan berkompetisi untuk bertukar dengan proton dalam penukar kation yang berfungsi sebagai basa lewis. Karena asam lewis dari proton lebih besar dibandingkan dengan kation logam Cu(II) maka proton akan lebih dominan bereaksi sehingga terjadi protonisasi. Penukar kation yang terprotonisasi tidak dapat bereaksi secara efektif dengan kation karena kemampuannya sebagai penukar kation berkurang sehingga menyebabkan kation logam yang tertukar sedikit. Pada pH 2, konsentrasi Cu(II) tertukar naik menjadi 08,10 ppm (16,32%) dan pada pH 3 juga terdapat peningkatan menjadi 12,92 ppm (26,04 %). Pada pH 4 konsentrasi Cu(II) masih meningkat meski tidak begitu besar menjadi 13,32 ppm (26,64%). Pada pH 5 konsentrasi Cu(II) tertukar sebesar 16,36 ppm (32,97%) dan pH 6 menjadi 17,40 ppm (36,07 %). Dan saat pH 7 konsentrasi Cu(II) menjadi 24,37 ppm dengan
persen(%) tertukar sebesar 49,11 %. Hal ini disebabkan semakin besar pH maka konsentrasi proton semakin berkurang sehingga kompetisi proton dan kation logam semakin kecil dan kation logam bisa tertukar secara efektif dengan proton pada penukar kation. Penurunan konsentrasi proton dalam larutan diikuti dengan kenaikan konsentrasi hidroksida seiring bertambahnya pH. Hidroksida merupakan basa lewis yang akan berkompetisi dengan penukar kation yang sama-sama basa lewis untuk berreaksi dengan kation logam. Semakin besar pH, kation logam lebih cenderung bereaksi dengan hidroksida membentuk endapan hidroksida yang lebih stabil sehingga konsentrasi awal ion logam yang akan tertukar dengan penukar kation menjadi berkurang yang menyebabkan kemampuan pertukaran ionnya berkurang. Pada penelitian ini, pada pH di atas 7 ternyata logam sudah membentuk endapan sehingga penelitian hanya sampai pH 7. Oleh karena itu, berdasarkan data dan Gambar terlihat bahwa pada pH 7 pertukaran kationnya mencapai nilai terbesar dibanding pada pH lain maka dapat disimpulkan bahwa pH efektif logam Cu(II) dalam pertukaran ion ini pada pH 7 sehingga untuk penelitian selanjutnya pH yang digunakan adalah larutan logam pada pH 7.
B. Penentuan Waktu Kontak Optimum Logam Cu(II)
Waktu kontak pada penelitian ini adalah lamanya kontak kation logam pada gugus aktif penukar kation. Pada penelitian ini waktu kontak logam Cu(II) dilakukan dengan variasi waktu 5, 10, 15, 20, 25, 30 menit. Data pengamatan absorbansi dan konsentrasi Cu(II) pada setiap variasi waktu kontak dengan pH larutan logam 7, konsentrasi larutan logam Cu(II) 50 ppm, berat penukar kation kopoli(Eugenol-DVB) yang terimpregnasi dengan ionofor 5'-kloro-2,4,2'-trihidroksiazobenzena 0,1 gram disajikan pada Tabel lampiran 2. Data konsentrasi logam Cu(II) dengan variasi waktu kontak disajikan pada Tabel 3. Tabel 3. Data Konsentrasi Logam Cu(II) terhadap waktu kontak dengan pH
larutan logam 7.
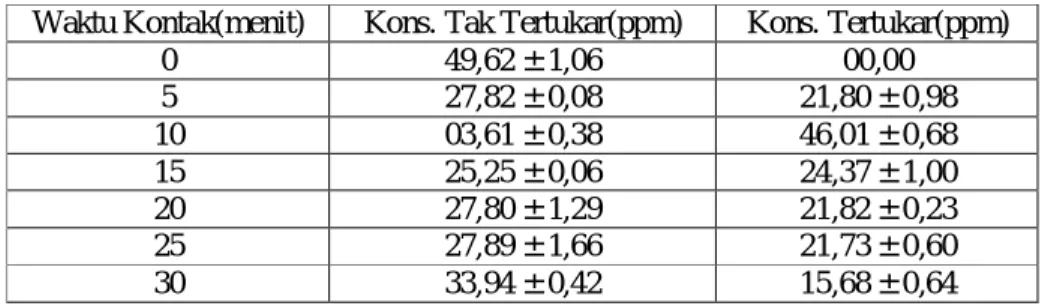
Waktu Kontak(menit) Kons. Tak Tertukar(ppm) Kons. Tertukar(ppm)
0 49,62 ± 1,06 00,00 5 27,82 ± 0,08 21,80 ± 0,98 10 03,61 ± 0,38 46,01 ± 0,68 15 25,25 ± 0,06 24,37 ± 1,00 20 27,80 ± 1,29 21,82 ± 0,23 25 27,89 ± 1,66 21,73 ± 0,60 30 33,94 ± 0,42 15,68 ± 0,64
Dari data konsentrasi Cu(II) pada Tabel 3 tersebut selanjutnya dapat ditentukan persen (%) tertukar logam Cu(II). Persen (%) tertukar dapat dihitung dengan membagi konsentrasi Cu(II) tertukar dengan konsentrasi Cu(II) sebelum tertukar (Awal). Contoh perhitungan persen (%) tertukar Cu(II) pada Lampiran 2, Data persen (%) tertukar logam Cu disajikan pada Tabel 4.
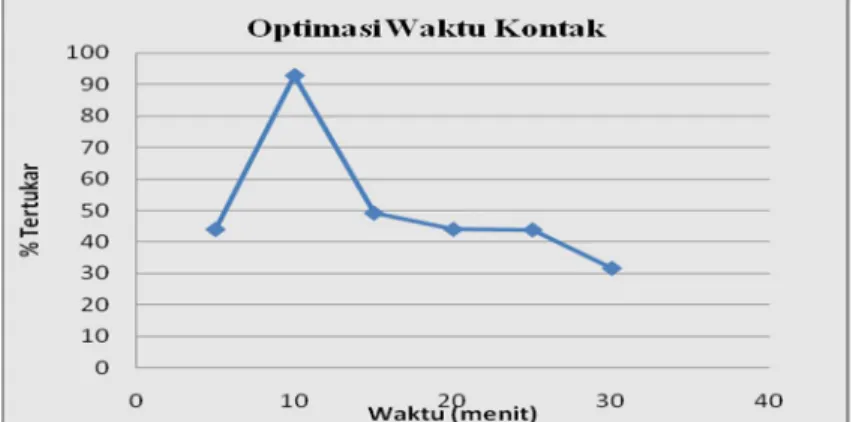
Waktu Kontak (menit) Tertukar Ion Logam (%) 5 43,93 10 92,72 15 49,11 20 43,97 25 43,79 30 31,60
Dari data pada Tabel 4 dapat dibuat kurva hubungan antara persen (%) tertukar terhadap waktu kontak. Kurva hubungan antara waktu kontak dengan persen (%) tertukarnya logam Cu (II) disajikan dalam Gambar 8.
Gambar 8. Kurva hubungan Persen (%) Tertukar Ion Cu2+ dengan waktu kontak. Tabel dan Gambar di atas menunjukkan bahwa pada saat waktu kontak 5 menit persen tertukar logam mencapai 43,93% dan saat waktu kontak diperpanjang yaitu 10 menit terjadi peningkatan yang tajam hingga mencapai 92,72%. Kenaikkan yang tajam ini dapat disebabkan atom O yang elektronegatif mudah melepaskan proton dan cepat menangkap kation logam untuk menggantikan kedudukan proton yang lepas. Selain itu, penukar ion memiliki struktur pori pada permukaannya dan struktur tersebut dengan mudah akan melepaskan dan menangkap kation. Akan tetapi semakin lama waktu kontaknya terjadi penurunan persen tertukar secara kontinu. Saat waktu kontak 15 menit persen tertukarnya menjadi 49,11%, saat waktu kontak 20 menit menurun menjadi 43,97%. meskipun tidak terlalu menurun tajam tetapi pada saat waktu kontak 25 menit menjadi 43,79% dan pada waktu kontak 30 menit hanya mencapai 31,60%.
Penurunan jumlah persen yang tertukar tersebut dapat dikarenakan pada saat larutan logam dimasukkan dalam penukar kation maka logam akan bertukar dengan proton dari penukar kation sehingga semakin banyak jumlah kation logam dalam penukar kation maka proton yang terlepas akan masuk dalam larutan. Hal ini menyebabkan konsentrasi proton akan semakin bertambah atau semakin asam sehingga menyebabkan terjadinya protonisasi. Kemungkinan lain terjadinya penurunan dapat dikarenakan Cu yang terikat secara fisis sifatnya kurang kuat
sehingga dengan bertambahnya waktu dan pengadukan maka Cu yang terjebak dalam pori penukar ion akan terlepas kembali. Selain itu, kemungkinan karena ikatan yang terbentuk antara kation logam dengan gugus aktif penukar ion kurang stabil sehingga semakin lama waktu dan pengadukan membuat ikatan itu terlepas.
Berdasarkan data dan Gambar yang diperoleh maka dapat disimpulkan bahwa pada saat waktu kontak 10 menit terjadi petukaran sebesar 92,72% sehingga waktu kontak optimum adalah waktu kontak selama 10 menit. Untuk itu, pada penelitian selanjutnya dilakukan pada pH larutan logam 7 dan waktu kontak 10 menit.
C. Penentuan Efektivitas Kopoli(Eugenol-DVB) yang terimpregnasi dengan 5’-kloro-2,4,2’-trihidroksibenzena Pada Logam Tunggal.
Efektivitas suatu penukar ion dapat ditentukan dengan melihat jumlah persen (%) tertukar suatu logam terhadap penukar ion tertentu. Pada penelitian ini untuk mengetahui efektifitas pertukaran ion logam Cu2+ terhadap penukar ion maka akan dibandingkan jumlah persen(%) tertukar ion logam Cu2+ pada penukar ion kopoli(Eugenol-DVB) yang terimpregnasi dengan ionofor 5'-kloro-2,4,2'-trihidroksiazobenzena, pada penukar ion kopoli(Eugenol-DVB), dan pada penukar ion ionofor 5'-kloro-2,4,2'-trihidroksiazobenzena. Efektivitas suatu penukar ion dipengaruhi oleh jenis logam dan struktur penukar ion itu sendiri.
Data pengamatan absorbansi dan konsentrasi ion-ion logam tunggal pada pH larutan logam 7, berat masing-masing penukar ion 0,1 gram disajikan pada Tabel Lampiran 3. Persen (%) tertukar dapat dihitung dengan membagi konsentrasi ion logam yang tertukar dengan konsentrasi ion logam sebelum tertukar. Contoh perhitungan % tertukar disajikan pada lampiran 2.Data persen (%) tertukar ion-ion logam pada masing-masing penukar ion dapat ditunjukkan pada Tabel 5.
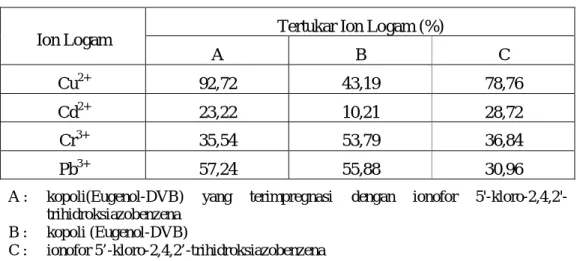
Tabel 5. Data Persen (%) Tertukar Ion-ion Logam Tunggal dalam Penukar Ion dengan pH Larutan 7 dan Waktu Kontak 10 menit.
Tertukar Ion Logam (%) Ion Logam A B C Cu2+ 92,72 43,19 78,76 Cd2+ 23,22 10,21 28,72 Cr3+ 35,54 53,79 36,84 Pb3+ 57,24 55,88 30,96
A : kopoli(Eugenol-DVB) yang terimpregnasi dengan ionofor 5'-kloro-2,4,2'-trihidroksiazobenzena
B : kopoli (Eugenol-DVB)
C : ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena
Dari data persen (%) tertukar ion logam dalam masing-masing penukar ion selanjutnya dapat dibuat kurva hubungan antara persen (%) tertukar
masing-Gambar 9. Kurva Persen (%) tertukar Ion-Ion Logam Tunggal pada Penukar Ion. Ketiga penukar ion yang dipakai memiliki gugus aktif hidroksi (-OH) yang bersifat proton terionisasi, yang akan melepaskan proton dan mengikat kation logam menurut mekanisme asam-basa Lewis. Apabila ion logam dianggap sebagai asam lewis dan gugus aktif pada penukar ion sebagai basa lewis maka teori HSAB (Hard and Soft Acid Base) menurut Pearson dapat diterapkan (Huheey, J.E., and Keither, R.L., 1993). Secara teoritis, karena gugs aktif –OH bersifat hard base sehingga lebih cenderung berikatan kuat dengan hard acid, kemudian dengan borderline acid dan terakhir dengan soft acid. Urutan yang mungkin berdasarkan HSAB adalah Cr3+>Cu2+=Pb2+>Cd2+. Pertukaran ion juga dipengaruhi oleh jenis logam dan struktur penukar ion. Selain itu, dapat dipengaruhi oleh besarnya afinitas yang berkaitan dengan valensi ion, jari-jari ion, dan berat atom. Bila berdasarkan berat atom atau massa atom relatif maka semakin besar massa atom menyebabkan jumlah mol dalam larutan semakin sedikit sehingga pertukarannya lebih kecil. Urutan berdasarkan massa atom relatifnya maka pertukaran yang terjadi Cr3+>Cu2+> Cd2+>Pb2+ Bila didasarkan dengan jari-jari bila semakin besar jari-jari ioniknya maka semakin besar ukuran kation dengan urutan jari-jari ioniknya Pb2+>Cd2+>Cu2+>Cr3+. Namun karena pertukaran ion juga dipengaruhi oleh jenis logam dan struktur penukar ion yang memiliki selektivitas dan efektivitas yang berbeda-beda maka terkadang terjadi ketidaksesuaian hasil dengan teori.
Tabel 5 menunjukkan jumlah ion-ion logam yang tertukar pada ionofor dengan waktu kontak selama 10 menit. Berdasarkan data tersebut, jumlah ion Cu yang tertukar mencapai 78,76%. Hal ini menunjukkan bahwa ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena mampu secara efektif menangkap ion Cu2+. Ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena memiliki atom donor O dan N yang sangat elektronegatif sehingga disebut basa kuat (mempunyai donor atom). Ion logam Cu2+ bersifat borderline acid sehingga mampu membentuk kompleks dengan ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena. Ion logam Cr3+ bersifat hard acid sehingga mampu membentuk ikatan kompleks dengan ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena persen tertukar Cr3+ hanya 36,84%. Meskipun Pb2+
sama-sama bersifat boderline acid seperti Cu2+, hasil yang didapatkan hanya sebesar 30,96%. Hal ini dapat dipengaruhi ion logam Pb2+ berukuran lebih besar sehingga mempengaruhi tingkat selektivitas dari ionofor itu sendiri. Ion logam Cd2+ merupakan soft acid sehingga ikatan kompleks dengan ionofor yang bersifat hard acid kurang stabil sehingga ion yang tertukar sedikit sebesar 28,72%.
Data pertukaran ion logam terhadap kopoli (Eugenol-DVB) di atas menunjukkan bahwa Cu2+ tertukar sebanyak 43,19%, Cr3+ tertukar sebesar 53,79%, Pb2+ mengalami pertukaran terbanyak sebesar 55,88%, dan Cd2+ tertukar sebesar 10,21%. Meskipun antara Cu2+ dengan Pb2+ sama-sama bersifat boderline acid. Namun perbedaan pertukaran dapat disebabkan oleh perbedaan ukuran atau jari-jari ion logam. Pb2+ memiliki ukuran dan jari-jari ionik lebih besar dibandingkan dengan Cu2+ sehingga karena ukuran tersebut Pb2+ mampu terjebak secara efektif ke dalam jaring-jaring penukar ion dibandingkan Cu2+. Sedangkan Cr3+ yang bersifat hard acid dapat berinteraksi lebih stabil dengan gugus aktif yang bersifat hard base dibandingkan dengan Cu2+. Untuk ion logam Cd2+ tertukar sedikit karena ion logam tersebut menrupakan soft acid sehingga interaksi dengan gugus aktif kurang stabil.
Data pertukaran ion Kopoli(Eugenol-DVB) yang terimpregnasi ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena di atas menunjukkan bahwa pertukaran Cu2+ mencapai 92,72% sehingga kopoli(Eugenol-DVB) yang terimpregnasi ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena penukar ion yang efektif dalam mengikat kation logam Cu2+. Meskipun bersifat boderline acid tetapi karena berada pada kondisi optimum Cu2+ sehingga mempengaruhi tingkat pertukaran. Ion logam Pb mampu bertukar sebesar 57,24%, kemungkinan karena sifatnya yang sama-sama boderline acid seperti Cu2+ maka hasil yang didapatkan cukup besar. Sedangkan Cr3+ meskipun bersifat hard acid yang mampu berinteraksi kuat dengan gugus aktif OH tetapi kemungkinan karena jari-jari ioniknya yang kecil sehingga pertukarannya sebesar 35,54%. Sedangkan Cd2+ mengalami pertukaran paling sedikit hanya sebesar 23,22%. Hal ini disebabkan interaksi antara Cd2+ yang bersifat soft acid dengan penukar ion sangat lemah sehingga penukar ion kurang mudah menarik ion logam Cd2+.
Efektivitas penukar ion terhadap logam Cu2+ dikatakan tinggi bila jumlah(%) tertukar ion logam Cu2+ dalam penukar ion besar. Dari data di atas, ion logam Cu2+ yang tertukar dalam penukar ion ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena sebesar 78,67%, dalam penukar ion kopoli (Eugenol-DVB) sebesar 43,19%, dan dalam penukar ion kopoli(Eugenol-DVB) yang terimpregnasi ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena mencapai 92,72%. Oleh karena itu, penukar ion kopoli(Eugenol-DVB) yang terimpregnasi ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena dapat dikatakan sebagai penukar ion yang paling efektif terhadap ion logam Cu2+. Urutan efektivitas penukar ion dapat ditulis sebagai berikut : penukar ion kopoli (Eugenol-DVB) yang terimpregnasi ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena > ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena > kopoli (Eugenol-DVB).
Selektivitas suatu penukar ion dapat ditentukan dengan membandingkan kemampuan penukar ion tersebut dalam menukar proton dengan kation lain yang berbeda. Pertukaran logam bersaing dilakukan dengan memasukan larutan yang berisi campuran 25 ml (50 ppm Cu2+ + 50 ppm Cd2+ + 50 ppm Cr3+ + 50 ppm Pb2+) dalam pH 7, dengan berat penukar ion yang digunakan seberat 0,1 gram. Ion-ion logam tersebut akan berkompetisi dengan ion Logam Cu2+ dalam pertukaran ion dengan penukar ion.
Data pengamatan absorbansi dan konsentrasi berbagai ion logam pada pertukaran logam bersaing dengan pH larutan 7 dan waktu kontak selama 10 menit disajikan pada Tabel Lampiran 4, Data persen (%) tertukar ion-ion logam pada masing-masing penukar ion disajikan pada Tabel 6,
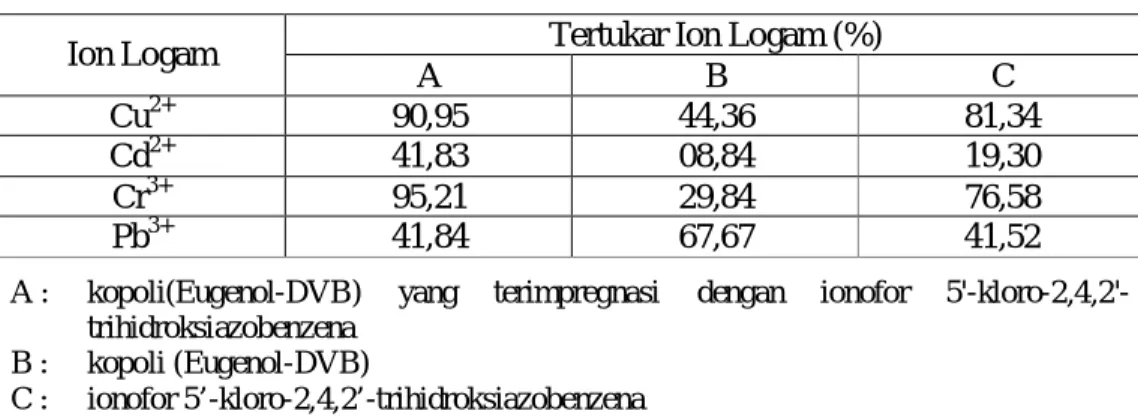
Tabel 6. Data Persen (%) Tertukar Ion-ion Logam pada Pertukaran Logam Bersaingan dengan pH larutan 7 dan Waktu Kontak selama 10 menit.
Tertukar Ion Logam (%) Ion Logam A B C Cu2+ 90,95 44,36 81,34 Cd2+ 41,83 08,84 19,30 Cr3+ 95,21 29,84 76,58 Pb3+ 41,84 67,67 41,52
A : kopoli(Eugenol-DVB) yang terimpregnasi dengan ionofor 5'-kloro-2,4,2'-trihidroksiazobenzena
B : kopoli (Eugenol-DVB)
C : ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena
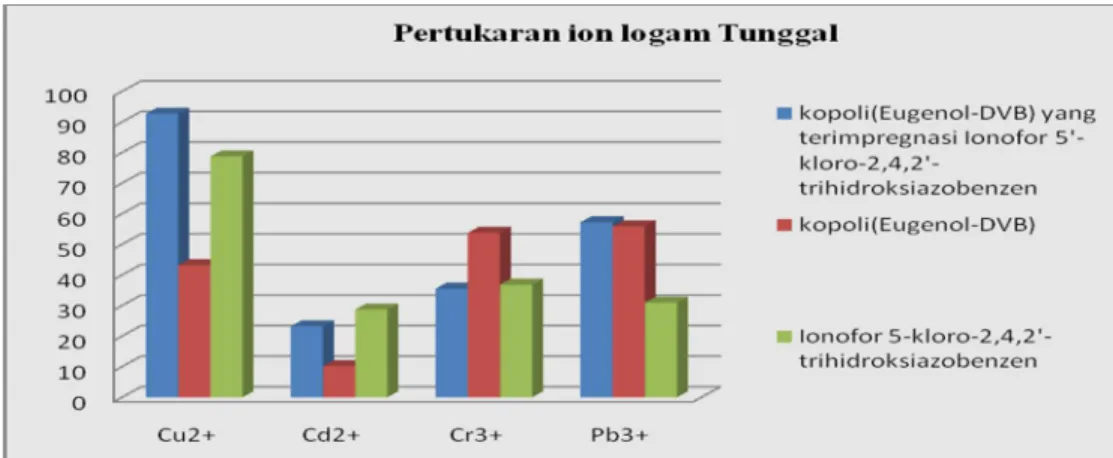
Dari data persen (%) tertukar ion-ion logam dalam Tabel 6 tersebut akan dibuat kurva hubungan antara persen (%) tertukar dengan jenis logam pada masing-masing penukar ion. Kurva persen (%) tertukar ion-ion logam pada pertukaran logam bersaingan disajikan pada Gambar 13.
Gambar 13. Kurva Persen (%) Tertukar Ion-ion Logam pada Pertukaran Logam Bersaingan.
Berdasarkan pada data di atas, untuk ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena terlihat bahwa persen (%) Cu2+ mengalami kenaikan dibandingkan pada transpor tunggalnya menjadi sebesar 81,34 %. Ion logam Cr3+ mengalami kenaikan menjadi 76,58% bila dibandingkan pertukaran tunggalnya dan Pb2+ menjadi 41,52 %. Sebaliknya, ion logam Cd 2+ mengalami penurunan menjadi 19,30 %. Hal ini disebabkan terjadi kompetisi antara ion-ion logam tersebut dalam larutan untuk menggantikan kedudukan proton dan juga terjebak pada pori. Cu2+ memiliki persen tertukar yang paling besar sehingga dapat dikatakan bahwaionofor 5’-kloro-2,4,2’-trihidroksiazobenzen merupakan penukar ion yang efektif terhadapa logam Cu. Sedangkan Cr3+ mengalami kenaikan karena Cr3+ bersifat hard acid sehingga interaksi dengan gugus aktif pada ionofor 5’-kloro-2,4,2’-trihidroksiazobenzen lebih kuat bila dibandingkan dengan ion logam lainnya sehingga Cr3+ mampu berkompetisi secara kuat dengan ion-ion logam tersebut dibandingkan dengan Pb2+ (boderline acid) dan Cd2+(soft acid).
Pada kopoli (Eugenol-DVB), ion logam Cu2+ mengalami kenaikan persen (%) tertukar menjadi 44,36 bila dibandingkan pada logam tunggalnya. Begitu juga dengan Pb2+ yang naik menjadi 67,67%. sebaliknya persen(%) tertukar ion logam Cr3+ menurun menjadi 29,84%, dan Cd2+ menjadi 08, 84%. Hal ini dikarenakan pertukaran tidak hanya terhadap gugus aktifnya yang bersifat hard base tetapi terjadi penjebakan pada jaring-jaring kopoli sehingga ion logam yang memiliki jari-jari atom mendekati ukuran jaring akan terjebak ke dalamnya. Kemungkinan ion logam Pb2+ yang ukuran jari-jari logamnya lebih besar mendekati ukuran jaring-jaring tersebut sehingga banyak yang terjebak dan mengakibatkan banyak yang terikat pada penukar ion. Sedangkan ion logam Cu2+ ukuran jari-jari ioniknya lebih kecil sehingga tidak terlalu banyak yang terjebak. Meskipun Cd2+ memiliki jari-jari ionik lebih besar dari Cu2+, tetapi karena bersifat soft acid sehingga interaksi dengan gugus aktif sangat lemah. Sedangkan Cr3+ yang memiliki sifat hard acid, tetapi ukuran jari-jari ioniknya sangat kecil sehingga kurang dapat terjebak dalam pori/jaring-jaring penukar ion.
Pada kopoli(Eugenol-DVB) yang terimpregnasi ionofor 5-kloro-2,4,2’-trihidroksiazobenzena, penurunan persen (%) tertukar terjadi pada ion logam Cu2+ menjadi 90,95% dan ion logam Pb2+ menjadi 41,84%, sedangkan kenaikan terjadi pada ion logam Cr3+ menjadi 95,21% dan ion logam Cd2+ menjadi 41,84% bila dibandingkan dengan pertukaran logam tunggalnya. Hal ini dapat disebabkan campuran multikomponen sehingga terjadi kompetisi antar ion-ion logam untuk tertukar dengan proton pada gugus aktif penukar ion ataupun terjebak dalam pori-pori penukar ion. Ion logam Cr3+ bersifat hard acid sehingga dapat berinteraksi secara stabil dengan gugus aktif yang bersifat hard base dan membuat kestabilan kompleks yang terbentuk lebih kuat sehingga pertukaran ionnya menjadi lebih besar dibanding ion-ion logam lainnya. Ion Cu2+ dan Pb2+ sama-sama bersifat boderline acid, tetapi karena penelitian dilakukan pada keadaan optimum Cu sehingga persen tertukar Cu2+ lebih besar bila dibandingkan dengan Pb2+. Sedangkan Cd2+ yang bersifat soft acid membuat interaksi dengan resin kurang stabil sehingga persen (%) tertukarnya lebih kecil bila dibandingkan dengan ion-ion logam lainnya.
tersebut semakin mudah dipisahkan dan menunjukkan bahwa penukar ion yang dipakai memiliki selektivitas yang baik. Data kecepatan tertukar ion-ion logam pada pertukaran logam bersaingan disajikan pada Tabel 9. Sedangkan contoh perhitungan kecepatan tertukar disajikan dalam Lampiran 3.
Tabel 9. Data Kecepatan Tertukar Ion-ion Logam Pada Pertukaran Logam Bersaingan.
Kecepatan Tertukar (mol/jam) Ion Logam A B C Cu2+ 1,067 10-4 5,203 10-5 9,540 10-5 Cd2+ 2,609 10-5 5,511 10-6 1,204 10-5 Cr3+ 1,393 10-4 4,36710-5 1,121 10-4 Pb3+ 1,514 10-5 2,449 10-5 1,502 10-5
A : kopoli(Eugenol-DVB) yang terimpregnasi dengan ionofor 5'-kloro-2,4,2'-trihidroksiazobenzena
B : kopoli (Eugenol-DVB)
C : ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena
Dari data kecepatan tertukar pada Tabel 9 maka dapat ditentukan harga selektivitas (α) penukar ion terhadap logam Cu2+ pada pertukaran logam bersaingan. Nilai selektivitas masing-masing penukar ion terhadap ion logam Cu2+ disajikan pada Tabel 8. Sedangkan contoh perhitungan nilai selektivitas disajikan pada lampiran 3.
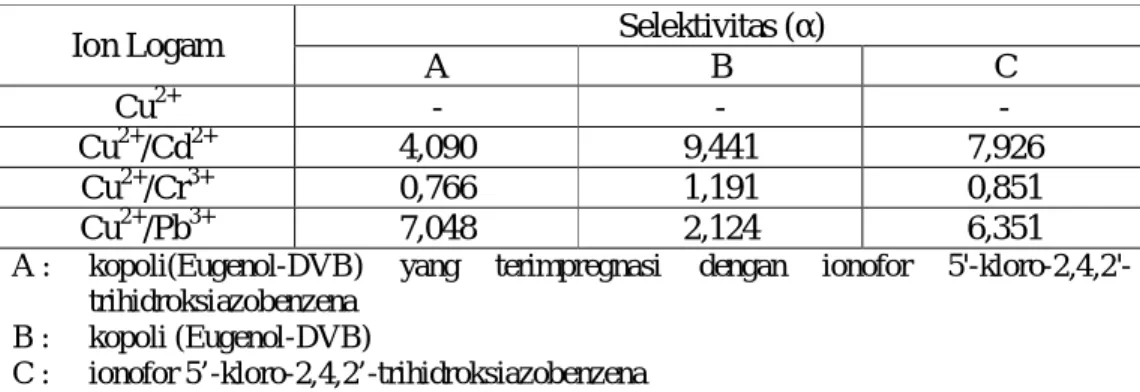
Tabel 8. Selektivitas Masing-masing Penukar Ion Terhadap Ion Logam Cu2+ dengan Ion Cd2+, Cr3+, dan Pb2+ dalam Pertukaran Logam Bersaingan.
Selektivitas (α) Ion Logam A B C Cu2+ - - -Cu2+/Cd2+ 4,090 9,441 7,926 Cu2+/Cr3+ 0,766 1,191 0,851 Cu2+/Pb3+ 7,048 2,124 6,351
A : kopoli(Eugenol-DVB) yang terimpregnasi dengan ionofor 5'-kloro-2,4,2'-trihidroksiazobenzena
B : kopoli (Eugenol-DVB)
C : ionofor 5’-kloro-2,4,2’-trihidroksiazobenzena
Data di atas menunjukkan bahwa selektivitas rata-rata Cu2+ terhadap Cr3+ di ketiga penukar ion lebih kecil dibandingkan selektifitas Cu dengan logam lainnya. Hal ini menunjukkan bahwa Cr3+ merupakan logam yang kurang mudah dipisahkan terhadap logam Cu2+. Hal ini dimungkinkan karena ukurannya yang kecil mengingat jari-jari ionik logam ini yang terkecil diantara ketiga logam lainnya ataupun karena sifatnya yang hard base sehingga berikatan kuat dengan gugus aktif. Hal lain dapat disebabkan karena massa relatifnya yang tidak terlalu
besar dan diikuti dengan konsentrasi dalam penukar ion yang besar sehingga jumlah mol yang terbentuk menjadi lebih besar sehingga kecepatannya tinggi dan mempengaruhi selektivitas terhadap Cu. Logam Cd meskipun massa atom relatifnya kecil tetapi konsentrasi di dalam penukar ion juga kecil sehingga jumlah mol juga kecil dan kurang mempengaruhi selektivitas Cu. Logam Pb meskipun banyak yang tertukar tetapi karena massa atomnya sangat besar sehingga mol yang terbentuk dalam penukar ion juga kecil.
Berdasarkan harga selektivitas di atas terlihat bahwa ketiga penukar ion tersebut memiliki koefisien selektivitas yang relatif kecil sehingga belum bisa disimpulkan bahwa penukar ion tersebut merupakan penukar ion yang selektif.
BAB V
KESIMPULAN DAN SARAN A. Kesimpulan
1. Hasil penelitian menunjukkan bahwa pH efektif dan waktu kontak optimum pada pertukaran ion logam Cu2+ dengan kopoli (Eugenol-DVB) yang terimpregnasi dengan ionofor 5-kloro-2,4,2'-trihidroksiazobenzena dengan konsentrasi ion logam Cu2+ 50 ppm, berat penukar ion 0,1 gram adalah pH 7 dan 10 menit.
2. Penukar ion kopoli (Eugenol-DVB) yang terimpregnasi dengan ionofor 5-kloro-2,4,2'-trihidroksiazobenzena, kopoli (Eugenol-DVB), maupun ionofor 5-kloro-2,4,2'-trihidroksiazobenzena ternyata merupakan penukar ion yang kurang selektif karena harga selektivitasnya relatif kecil pada pertukaran logam bersaing. Harga selektivitas ketiga penukar ion di atas dalam pertukaran logam bersaing dapat ditulis berturut-turut sebagai berikut Cu2+/Cd2+ adalah 4,090; 9,441; dan 7,926, Cu2+/Cr3+ adalah 0,766; 1,191; dan 0,851, Cu2+/Pb2+ adalah 7,048; 2,124; dan 6,351,
3. Efektivitas ketiga penukar ion yang digunakan relatif berbeda-beda terhadap ion logam Cu2+. Pada pertukaran ion logam tunggal, urutan efektifititas penukar ion terhadap logam Cu2+ adalah sebagai berikut : penukar ion kopoli (Eugenol-DVB) yang terimpregnasi dengan ionofor trihidroksiazobenzena sebesar 92,72% > penukar ion ionofor 5-kloro-2,4,2'-trihidroksiazobenzena sebesar 78,76% > penukar ion kopoli (Eugenol-DVB) sebesar 43, 19%.
B. Saran
1. Mengkaji lebih lanjut mekanisme pertukaran ion logam dengan kopoli (Eugenol-DVB) yang terimpregnasi dengan ionofor 5-kloro-2,4,2'-trihidroksiazobenzena.
2. Mengkaji lebih lanjut struktur yang akan terbentuk dari pertukaran ion tersebut.
DAFTAR PUSTAKA
Andrea E.H, and Pinnel, R.P, . 1989. Sulfonation of Polystirene, Vol. 66, No. 07, July, 613-619.
Braithwhaite, A., and Smith, F.J., 1999. Chromatographic Methods. Kluwer Academic Publishers. Netherland.
Bernasconi, dkk. 1995. Teknologi Kimia Bagian 2. PT Pradnya Paramita. Jakarta. Chen, et al. 1995. Selective Preconcentration and Separation of a Trace Amount
of Copper(II) with Poly[N-(8-hydroxy-5-quinolymethyl)-4-aminomethylstyrene] (PQAS) Resin. Analytical Science. Vol II.
Darmono, 1995, Logam-logam dalam Sistem Makhluk Hidup, UI press, Jakarta. Handayani,D.S dan Kusumaningsih, T. 2003. Sintesis Kopoli(Eugenol Sulfonat) -
DVB sebagai Resin Penukar Kation yang Efektif. Laporan Kegiatan. FMIPA Universitas Sebelas Maret : Surakarta.
Handayani, D.S. dan Martini, T., 2004, Sintesis Turunan Asam Poli(Eugenil Oksikarboksilat) dan Aplikasinya untuk Pengembangan Metode Recovery Logam dengan Transport Membran Cair, Laporan Hibah Pekerti Angkatan-II, F MIPA Universitas Sebelas Maret, Surakarta. Hendayana, S., 1993, Kimia Analitik Instrumen, IKIP Semarang Press, Semarang,
231-238,
Howard, P. H. and Meyland, W. M. 1997, Physical Properties of Organic Chemical. Lewis Publisher, Boca Raton : New York.
Huheey, J.E., and Keither, R.L., 1993, Inorganic Chemistry, Fourth Edition, Hamper Collins College Publisher, New York
Irving S.N., and Lewis, J.R., 1987, Hawley’s Condensed Chemical Dictionary, 11th Edition, Van Nostra Reinhold, New York
Kirk-Othmer, 1995, Encyclopedia of Chemical Technology. Fourth Edition. Vol. 7, John Willey and Sons; New York.
Khopkar, S.M., 1990, Konsep Dasar Kimia Analitik, UI Press, Jakarta. Terjemahan : Basic Concepts of Analytical Chemistry, S.M. Khopkar, 1985, Wiley Eastern Limited, New York.
Lagowski, J.J., 1997, Macmillan Encyclopedia of Chemistry, Simon and Schuster Macmillan, USA.
Lee, J. D. 1991, Concise Inorganic Chemistry. Fourth Edition. John Willey and Sons; New York.
Liptrot. 1974. Modern Inorganic Chemistry. London : The English Language Book Society and Mills and Boon Limited.
Morgan, D.L., Mahler,J.F., Wilson,R.E., Moorman,M.P., Herman C.P., Jr.,f and O'Connor,R.W. 1997. Toxicity of Divinylbenzene-55 for B6C3F1 Mice in a Two-Week Inhalation Study. Fundamental and Applied Toxicology 39, 89 – 100 Article No. FA972362.
Munaf. 1994. Potensi Limbah Udang Sebagai Penyerap Logam Berat (Timbal, Kadmium, dan Tembaga) di Perairan.
Mustikarini, S., 2007, Sintesis Ionofor 5’-kloro-2,4,2’-Trihidroksiazobenzena dan Studi Impregnasi Resin Kopoli(eugenol-DVB) Dengan Ionofor, Skripsi, F MIPA Universitas Sebelas Maret, Surakarta.
New Jersey Department of Health and Senior Services. 2001, Divinyl Benzene. CAS Number: 1321-74-0, New Jersey.
http://www.state.nj.us/health/eoh/odisweb/
Odian,G. 1991, Principles of polymerization. John Wiley & Sons Inc. : USA Palar, H. 1994, Pencemaran dan Toksikologi Logam Berat. Rineka Cipta.
Pecsok, R.L., Shields, L.D., Cairns, T. And Ian, G.M., 1968, Modern Methods of Chemical Analysis, Second Edition, John Wiley and Sons, New York. Russel. 1981. General Chemistry International Student Edition, McGraw Hill,
New York.
Sastrohamidjojo, H . 1981, Study of some Indonesian Essential Oils. Desertasi . FMIPA Universitas Gajah Mada : Yogyakarta.
Setiono L., dan Pudjaatmakan, H. 1990. Buku Teks Analisis Anorganik Kualitatif Makro dan Semimakro. Jilid 2. PT Kalman Media Pustaka. Jakarta. Terjemahan : Text Book of Macro and Semimacro Qualitative Inorganic Analysis. Vogel. 1979. Longman Group Limited. London
Shugar, G. and Balinger, J.T., 1996, Chemical Technicians Ready Reference Handbook, Fourth Edition, McGraw Hill, New York.
Siswanta, D., 1993, Design and Synthesis of Highly Selective Ammonium Ionophores for Ion-Selective Electrode, Thesis, Keio University, Yokohama.
Skoog, D.A. and West, D.M., 1982, Fundamentals of Analytical Chemistry, Fourth Edition, CBS College Publishing, New York.
Sonowale, S.B. Ghalgasi, Y.V., and Argekar, A.P., 2001. Extraction of Lead(II) and Copper (II) from Salicylate Media by Tributhylphosphine Oxide. Analytical Science, No. 17, 285-289.
Suhendrayatna, 1999, “Bioremoval Logam Berat Dengan Menggunakan Mikroorganisme; Suatu Kajian Kepustakaan”, ISTECS-Chapter Japan. Umi, H.T. 2002. Sintesis Asam Poly(Eugenil-Oksiasetat) dan Studi Selektivitas
Cu(II) dalam Transport Membran Cair Kloroform. Tesis. Pendidikan Sains Ilmu Kimia, Pasca Sarjana. Universitas Gajah Mada : Yogyakarta. The Dow Chemical Company. 1995, DVB-Divinyl Benzene – Product Properties. Van der Maarel, J.R.C. 1996, Structure and Change Distribution in Poly(Styrene-Sulfonat) Ion Exchange Resins. American chemical Society, Vol 29, No 06, 2039-2045,
http://www.wikipedia.org/ diakses tanggal 14 Agustus 2007 http:/www.chemicalland21,com diakses tanggal 2 Januari 2007 www.cadmium.org diakses tanggal 2 Januari 2007