TINJAUAN PUSTAKA Botani Tumbuhan Gaharu
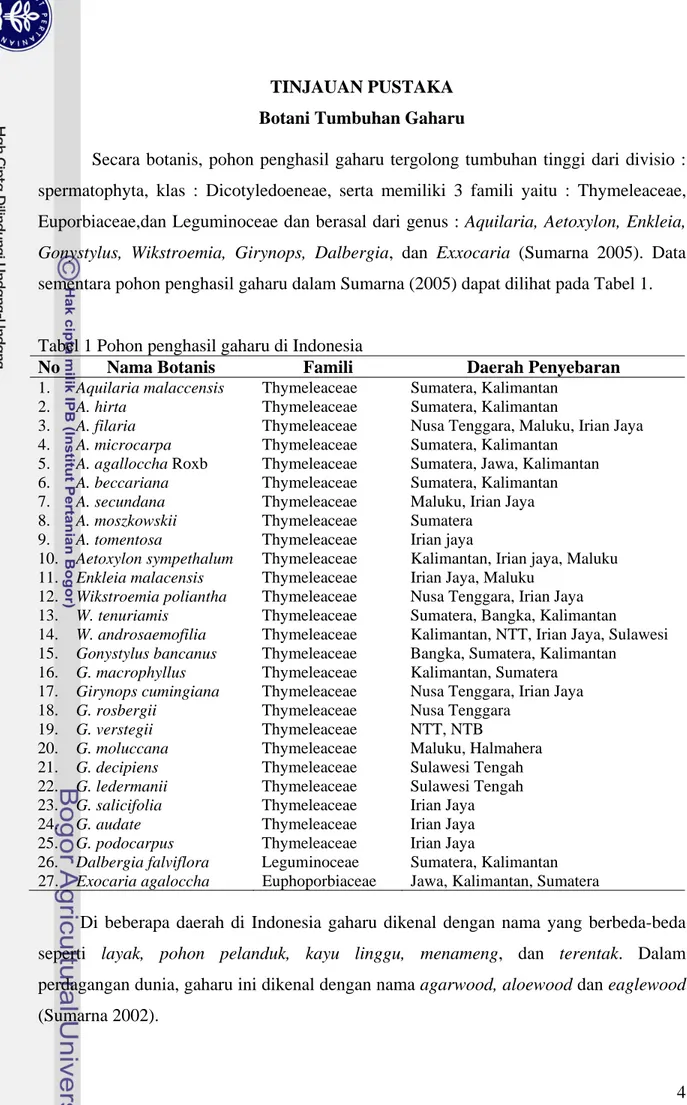
Secara botanis, pohon penghasil gaharu tergolong tumbuhan tinggi dari divisio : spermatophyta, klas : Dicotyledoeneae, serta memiliki 3 famili yaitu : Thymeleaceae, Euporbiaceae,dan Leguminoceae dan berasal dari genus : Aquilaria, Aetoxylon, Enkleia, Gonystylus, Wikstroemia, Girynops, Dalbergia, dan Exxocaria (Sumarna 2005). Data sementara pohon penghasil gaharu dalam Sumarna (2005) dapat dilihat pada Tabel 1.
Tabel 1 Pohon penghasil gaharu di Indonesia
No Nama Botanis Famili Daerah Penyebaran
1. Aquilaria malaccensis Thymeleaceae Sumatera, Kalimantan 2. A. hirta Thymeleaceae Sumatera, Kalimantan 3. A. filaria Thymeleaceae Nusa Tenggara, Maluku, Irian Jaya 4. A. microcarpa Thymeleaceae Sumatera, Kalimantan 5. A. agalloccha Roxb Thymeleaceae Sumatera, Jawa, Kalimantan 6. A. beccariana Thymeleaceae Sumatera, Kalimantan 7. A. secundana Thymeleaceae Maluku, Irian Jaya
8. A. moszkowskii Thymeleaceae Sumatera 9. A. tomentosa Thymeleaceae Irian jaya
10. Aetoxylon sympethalum Thymeleaceae Kalimantan, Irian jaya, Maluku
11. Enkleia malacensis Thymeleaceae Irian Jaya, Maluku
12. Wikstroemia poliantha Thymeleaceae Nusa Tenggara, Irian Jaya
13. W. tenuriamis Thymeleaceae Sumatera, Bangka, Kalimantan
14. W. androsaemofilia Thymeleaceae Kalimantan, NTT, Irian Jaya, Sulawesi
15. Gonystylus bancanus Thymeleaceae Bangka, Sumatera, Kalimantan
16. G. macrophyllus Thymeleaceae Kalimantan, Sumatera
17. Girynops cumingiana Thymeleaceae Nusa Tenggara, Irian Jaya
18. G. rosbergii Thymeleaceae Nusa Tenggara
19. G. verstegii Thymeleaceae NTT, NTB
20. G. moluccana Thymeleaceae Maluku, Halmahera
21. G. decipiens Thymeleaceae Sulawesi Tengah
22. G. ledermanii Thymeleaceae Sulawesi Tengah
23. G. salicifolia Thymeleaceae Irian Jaya
24. G. audate Thymeleaceae Irian Jaya
25. G. podocarpus Thymeleaceae Irian Jaya
26. Dalbergia falviflora Leguminoceae Sumatera, Kalimantan
27. Exocaria agaloccha Euphoporbiaceae Jawa, Kalimantan, Sumatera
Di beberapa daerah di Indonesia gaharu dikenal dengan nama yang berbeda-beda seperti layak, pohon pelanduk, kayu linggu, menameng, dan terentak. Dalam perdagangan dunia, gaharu ini dikenal dengan nama agarwood, aloewood dan eaglewood (Sumarna 2002).
Karakteristik Morfologis Gyrinops verstegii
Bentuk batang Gyrinops verstegii adalah silindris, tidak berbanir, dan tekstur kulit bagian luar agak kasar serta tidak bergetah. Warna kulit batang adalah coklat keputih-putihan dan bagian dalam batang berwarna putih. Menurut Moega et al. (2001), tinggi pohon Gyrinops verstegii dapat mencapai 25 m, dengan diameter 40 cm. Daun elips memanjang, urat daun lateral sejajar, berukuran 10- 20 cm, lebar 2 – 3 cm, dan berwarna hijau licin. Pembungaan terminal mendukung 6-8 bunga. Bunga berupa tabung berukuran 3,5 mm, warna putih kehijauan, benangsari berjumlah 5. Buah bulat telur berukuran 1 cm. Morfologi dan warna daun Gyrinops verstegii dapat dilihat pada Gambar 1.
Gambar 1 Bentuk bunga dan buah Gyrinops verstegii.
Keragaman Genetik Tanaman Hutan
Jenis-jenis pohon memperlihatkan keragaman dalam sifat-sifatnya. Dalam suatu jenis pohon dapat dijumpai beberapa keragaman yaitu keragaman geografis (antar provenansi), keragaman lokal (antar tempat tumbuh, antar tapak), keragaman antar pohon dan keragaman di dalam pohon. Ada dua sebab utama yang menimbulkan keragaman, yaitu perbedaan lingkungan dan perbedaan struktur genetik. Keragaman yang disebabkan oleh perbedaan keadaan tempat tumbuh, sifat-sifat tanah, dan jarak tanam adalah keragaman yang disebabkan lingkungan (environmental variation). Ada pula keragaman yang tidak dapat diterangkan dengan perbedaan tempat tumbuh, misalnya perbedaan bentuk batang, tebal cabang, dan berat jenis kayu dari pohon-pohon dalam suatu tegakan.
Dalam hal ini keragaman banyak dipengaruhi oleh perbedaan genetik yang diturunkan dari tetua kepada keturunannya, dan disebut keragaman genetik (genetic variation) (Soerianegara dan Djamhuri 1979).
Keragaman genetik dari suatu keturunan merupakan hasil dari perkembangbiakan secara seksual. Perkembangbiakan secara seksual terjadi dengan adanya sel reproduktif (gamet) jantan dan betina yang bersatu melalui proses perkawinan, sel reproduktif yang bersatu mengalami proses meiosis dimana terjadi proses reduksi jumlah kromosom dari diploid (2n) dalam sel tetua menjadi haploid (n) dalam gamet mengikuti hukum segregasi secara bebas (Hukum Mendel I). Selanjutnya pada saat perkawinan terjadi rekombinasi gamet secara acak menurut Hukum Mendel II. Selain itu pada saat meiosis, kromosom homolog juga akan mengalami pindah silang dan kadang-kadang terjadi perubahan susunan genetik karena mutasi yang akan menambah keragaman dari keturunan (Crowder 1986).
Seiring dengan perkembangan bioteknologi molekuler, penemuan metode-metode penanda genetik telah mempercepat pendugaan keragaman genetik tanaman. Penanda genetik molekuler dapat menilai keragaman genetik tanpa dipengaruhi lingkungan bahkan umur tanaman. Penanda molekuler yang telah digunakan dalam penelitian keragaman suatu populasi tanaman hutan adalah isoenzim, restriction fragment length polymorphism (RFLP), simple sequence repeat (SSR), amplified fragment lenght polymorphism (AFLP), dan random amplified polymorphic DNA (RAPD) dengan berbagai kelebihan dan kekurangannya (Tabel 2).
Tabel 2 Penanda Molekuler yang telah digunakan pada tanaman kehutanan
Nama Penanda Metode Keunggulan Kelemahan
Kodominan
Isoenzim Elektroforesis gel, Murah,mudah digunakan Memerlukan jaringan pewarnaan histokimia sistim enzim yang terdo- segar dan tertentu enzim dan protein selular kumentasi baik dapat (misal; tunas dan menghasilkan pengukuran kecambahan) frekwensi alel yang tegas
PCR-RLFP Lokus organel atau inti Membutuhkan sampel DNA Pengembangan primer (Restriction fragment spesifik diamplikasi dalam jumlah kecil. Primer mahal dan sulit
length polymorphism) menggunakan primer pcr universal untuk lokus spe- gen multilokus atau
yang dirancang khusus sifik telah tersedia banyak pseudogen kemungki- produk dipotong dengan nan diperbanyak dalam enzim restriksi dan divi- genom inti, memung-
Nama Penanda Metode Keunggulan Kelemahan
sualisasi langsung dengan kinkan kesalahan iden- elektroforesis gel. titas dan frekwensi alel
SSR (Simple sequence Primer PCR untuk me- Alel lokus tunggal yang Lokasi bermikrosatelit
repeats) ngamplifikasi motif- tegas dapat dinilai berbeda antar taxa,
motif berulang yang sehingga diperlukan hipervariabel dalam pengembangan yang genom inti atau organel mahal dan sulit untuk setiap jenis baru. Dominan
RAPD (Random Primer sequen pendek Analisis secara acak Lokasi genomik tidak
Amplified Polymorphic digunakan untuk dapat diketahui tanpa
DNA) mengamplifikasi lokus persilangan yang acak pada seluruh dikontrol genom dengan PCR
AFLP (Amplified DNA genomik total lebih reproduksibel Lebih mahal dibanding Fragment lenght dipotong dengan 2 dibanding RAPD RAPD label radioaktif Polymorphism) enzim restriksi dengan skoring otomatis tersedia mungkin diperlukan Selektif dengan meng-
Gunakan primer
RAPD (Random Amplified Polymorphic DNA)
Pertama kali teknik RAPD dilakukan oleh Williams et al. (1990) diacu dalam Septimayani (2002), berhasil mengamplifikasi DNA yang bersifat polimorfik dengan menggunakan primer acak serta bantuan enzim Taq DNA polymerase. RAPD banyak digunakan karena mempunyai beberapa keuntungan. Selanjutnya Williams et al. (1990) mengungkapkan bahwa metode RAPD lebih sederhana, cepat, DNA yang diperlukan sedikit, tidak perlu terlalu murni, dan tidak menggunakan satu primer.
Disamping kelebihan tersebut teknik ini juga memiliki kelemahan yakni dapat memberikan hasil yang berbeda-beda apabila diulang, sehingga dianggap kurang handal (reliable), khususnya bagi keperluan diagnostik yang disebabkan oleh rendahnya akurasi pengulangan hasil amplifikasi. Selain itu Ellsworth et al. (1993) mengungkapkan bahwa RAPD sensitif terhadap perubahan kecil dalam reaksi yang dapat menggangu kemampuan reproduksi pola-pola pita, karena perbedaan eksperimen, alat PCR dan laboratorium.
Secara umum analisis RAPD terdiri dari empat tahap, yaitu (1) tahap ekstraksi DNA, (2) tahap pengujian kualitas dan kuantitas ekstraksi DNA, (3) tahap amplifikasi
DNA (RAPD), dan (4) tahap pengujian kualitas dan kuantitas hasil amplifikasi. Menurut Sambrook (1989), daun yang masih muda dengan berat 0,2 - 0,3 g cukup untuk menghasilkan DNA yang sesuai dengan kebutuhan selama analisis, sementara itu menurut Karsinah (1999) dari jaringan tanaman dewasa dan daun kering masih bisa didapatkan ekstrak DNAnya. Menurut Kimball (1992), sel berkembang dengan cara menggandakan diri dan memperbesar volume sel. Oleh karena itu, semakin muda suatu jaringan daun akan memberikan peluang yang lebih besar dalam menghasilkan DNA dalam jumlah yang lebih besar daripada daun yang sudah lebih tua umurnya.
Ekstraksi DNA pada prinsipnya adalah suatu proses pengisolasian DNA dengan cara fisik (penggerusan) dibantu oleh senyawa-senyawa kimia dengan metode tertentu sehingga didapat DNA yang terpisah dari kontaminan. Keberhasilan pengekstrakan DNA dapat diketahui dengan pengujian kuantitas dan kualitas DNA. Uji kuantitas dan kualitas DNA dilakukan dengan proses elektroforesis dengan menggunakan gel agarose. Untuk melihat DNA hasil ekstraksi digunakan alat UV transilluminator.
Proses amplifikasi DNA dengan metode (RAPD), pada intinya adalah proses perbanyakan DNA secara enzimatis. Pada tahap ini terdapat tiga proses, yaitu (1) proses denaturasi DNA pada suhu 950 C, (2) proses penempelan DNA (annealing) dan (3) proses ekstensi.
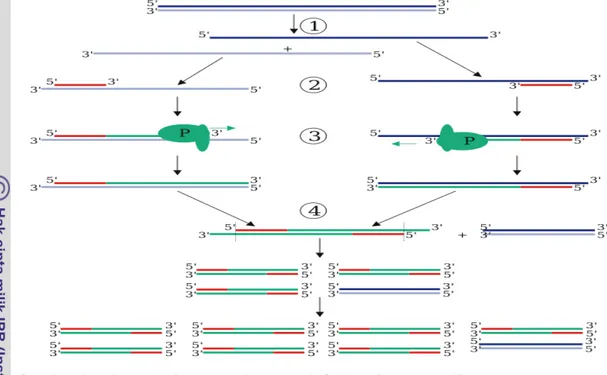
DNA adalah materi genetik yang terdiri atas dua utas ganda yang berpilin (Watson et al. 1987). Menurut Jusuf (1991), pada suhu tinggi pita ganda tersebut berpisah menjadi dua utas tunggal. Apabila pita ganda DNA telah terpisah, maka pada tahap kedua terjadi penempelan primer pada kedua ujung DNA sebagai titik awal pembacaan dan perbanyakan basa-basa DNA. Selanjutnya dilakukan proses pemanjangan dan pembentukan utas DNA yang baru (ekstensi).
Enzim Taq polimerase digunakan dengan teknik hot-start. Hal ini untuk mencegah terjadinya penempelan primer pada temperatur rendah. Penempelan primer yang terjadi pada temperatur rendah akan menghasilkan hasil amplifikasi dengan spesifisitas rendah. Spesifisitas yang rendah juga akan menurunkan sensitifitas karena adanya kompetisi antara produk spesifik dan non-spesifik. Jika konsentrasi primer terlalu tinggi dapat mengakibatkan mis-priming yang mengakibatkan meningkatnya jumlah
produk non spesifik. Jika konsentrasi primer terlalu rendah, hasil dari produk PCR akan rendah (Abdullah dan Retnoningrum 2003).
Tahap terakhir dari RAPD adalah elektroforesis hasil amplifikasi. Pada tahap ini terjadi pemisahan pita-pita DNA berdasarkan perbedaan berat molekulnya. Pita DNA yang mempunyai berat molekul lebih ringan akan berjalan lebih cepat. Keragaman antar populasi dapat dilihat dengan melihat perbedaan pola pita (polymorfisme) DNA antar populasi.
Teknik ini dapat tercipta dengan adanya penemuan Taq polymerase tersebut. DNA polymerase berasal dari bakteri Thermus aquaticus yang ditemukan di daerah yang panas pada musim panas. DNA polymerase ini stabil pada suhu yang tinggi dalam proses amplifikasi, yaitu terjadi pada saat tahap denaturasi. Metode PCR ini memiliki tingkat kesensitifan yang tinggi dalam mengamplifikasi DNA walaupun dalam ukuran yang kecil.
Peran enzim ini bisa optimal apabila suhu sistem tepat dan primer telah bekerja dalam permulaan pembacaan. Kecocokan primer dengan sekuens yang akan diamplifikasi merupakan hal yang penting, dimana primer diharapkan bersifat komplementer dengan sekuens DNA target yang akan diamplifikasi.
Primer biasanya terdiri dari 10-20 nukleotida dan dirancang berdasarkan daerah konservatif dalam genom tersebut. Makin panjang primer, makin harus spesifik daerah yang diamplifikasi. Jika suatu kelompok organisme memang berkerabat dekat, maka primer dapat digunakan untuk mengamplifikasi daerah tertentu yang sama dalam genom kelompok tersebut (Suryanto & Dwi 2003). Primer ini berperan sebagai opposite strand ketika double helix DNA terpisah pada tahap denaturation. Primer menempel pada tahap annealing dan selanjutnya mengkopi DNA sehingga tercipta kembali dua utas DNA, dan teramplifikasi selama 35 siklus. Tahapan-tahapan PCR dapat dilihat pada Gambar. 2.
Gambar 2 Tahapan-tahapan pada proses PCR (Polymerase Chain Reaction).
Mikrosatelit
Mikrosatelit merupakan rangkaian pola nukleotida antara dua sampai enam pasang basa yang berulang secara berurutan. Mikrosatelit biasa digunakan sebagai penanda genetik untuk menguji kemurnian galur, studi filogenetik, lokus pengendali sifat kuantitatif dan forensik. Mikrosatelit diamplifikasi menggunakan teknik PCR dengan beberapa pasang mikrosatelit. Hasil PCR dideteksi menggunakan teknik elektroforesis gel poliakrilamida (PAGE) yang dilanjutkan dengan pewarnaan perak.
Mikrosatelit mempunyai karakteristik sebagai berikut : tingkat polimorfisme yang tinggi, kodominan dan diwariskan mengikuti hukum Mendel (Weising et al. 2005). Bila satu primer yang spesifik telah didesain, lokus SSR dapat diamplifikasi dari sedikit sample DNA dengan PCR (Ujino et al. 1998 dalam Zulfahmi 2007). Mikrosatelit telah diaplikasikan untuk : 1. Identifikasi forensik, 2. Diagnosis dan identifikasi penyakit, 3. studi populasi genetik untuk mengamati variasi dan membuat kesimpulan tentang struktur populasi, hanyutan genetik dan efek leher botol (bottleneckseffect) 4. Konservasi biologi, untuk mengamati perubahan dalam populasi, pengaruh fragmentasi dan interaksi populasi yang berbeda serta untuk identifikasi populasi yang baru terbentuk.
Ada beberapa permasalahan dalam penggunaan penanda mikrosatelit. Permasalahan ini dapat dikelompokkan ke dalam problem teknis praktis dan problem data. Problem praktik meliputi : 1. Pemilihan primer untuk mikrostelit, banyak jenis primer yang telah didesain untuk analisi mikrosatelit pada tanaman. Primer-primer itu perlu diskrining dan dioptimasi sebelum diaplikasikan pada jenis tanaman tertentu, karena setiap tanaman mempunyai karakteristik spesifik yang berbeda satu sama lain. 2. slippage selama proses amplifikasi, termopolimerase dapat slip sehingga meghasilkan produk yang berbeda dalam ukurannya. 3. ukuran produk amplifikasi berbeda dari ukuran produk sebenarnya. Ketidakakuratan dalam identifikasi alel mungkin juga disebabkan oleh Taq polimerase yang menambah nukleotida adenosin sampai ujung 3’ produk amplifikasi.
Homoplasi adalah salah satu problem data. Homoplasi didefinisikan ketika dua alel dalam keadaan sama, tetapi tidak sama secara keturunan. Homoplasi mungkin menyebabkan problem dalam analisis studi genetika populasi, dimana dapat mempengaruhi pengukuran keragaman genetika, aliran gen, jarak genetika, ukuran neighbourhood, metode penetapan dan analisis filogenetika (Estoup et al. 2002)