BAB I PENDAHULUAN
A. Latar Belakang
Tahun 2012-2014 di poliklinik THT-KL RSUD Dr. Moewardi Surakarta, tercatat ada sekitar 298 kasus karsinoma nasofaring (KNF). Jumlah ini meningkat dibanding tahun 2007-2009 yang hanya berjumlah 143 pasien, dan hampir 95% dari jumlah tersebut merupakan KNF tipe undifferentiated (Sari, 2010).
Akibat sering ditemukan genotype maupun serotype virus Epstein Barr (EBV) pada KNF, maka sejak tahun 1966 EBV dianggap sebagai satu-satunya virus yang berhubungan dengan KNF. Namun dalam perkembangannya, sejumlah penelitian melaporkan penemuan adanya genome virus human papilloma (HPV) pada KNF, baik dengan EBV maupun tanpa EBV. Fenomena ini memunculkan dugaan koinfeksi pada KNF (Shi, 2016).
Walaupun mekanisme infeksi virus itu sendiri masih diperdebatkan, namun temuan dua atau lebih jenis virus yang berbeda/koinfeksi pada pasien KNF semakin sering dilaporkan. Hingga saat ini diperkirakan 38% virus DNA menjadi penyebab kasus kanker pada manusia termasuk KNF, dan hampir 85% dari jumlah tersebut terjadi di negara berkembang (Shi, 2016).
pada besarnya peranan LMP 1 pada perkembangan KNF, baik sejak terjadinya transformasi pada sel epitel nasofaring maupun kompleknya proses pada sel B. Di dalam sel B, sejumlah penelitian menunjukkan keberadaan LMP 1 mampu menghambat proses apoptosis dengan cara menginduksi beberapa jalur sinyal seluler, di antaranya NF, Bcl 2, Bax maupun MAPK (Shao, 2004).
Early 6 (E 6) termasuk onkoprotein pada HPV. HPV telah lama diketahui sebagai penyebab tumor pada mukosa maupun pada kutaneus. Selain mampu menyebabkan tumor ganas pada mukosa cervix uteri, HPV juga diketahui mampu menimbulkan keganasan di bagian kepala dan leher seperti orofaring, hipofaring, laring, sinonasal serta nasofaring. Di RSUD Dr. Moewardi Surakarta sendiri, didapatkan hampir sekitar 73% pasien karsinoma sel skuamosa rongga mulut merupakan HPV positif. Hal ini berdasarkan penelitian yang dilakukan di bagian bedah gigi dan mulut RSUD Dr. Moewardi tahun 2010 (Prayitno, 2010; Rubab, 2013).
menemukan adanya overekspresi p 53 pada sejumlah kasus KNF, khususnya pada pasien KNF dengan LMP 1 positif, walaupun beberapa penelitian lain menunjukkan hasil yang berbeda (Shao, 2004).
Berdasarkan uraian di atas, maka peneliti ingin melakukan penelitian untuk mengetahui bagaimanakah hubungan antara latent membrane proteins 1 (LMP 1) EBV dan early 6 (E 6) HPV terhadap ekspresi p 53, khususnya pada pasien KNF tipe undifferentiated di lingkungan RSUD Dr. Moewardi Surakarta.
B. Rumusan Masalah
“Apakah terdapat hubungan antara latent membrane proteins 1 dan early 6 terhadap p 53 pada karsinoma nasofaring”.
C. Tujuan Penelitian 1. Tujuan Umum
Untuk mengetahui hubungan latent membrane proteins 1 dan early 6 terhadap p 53 pada karsinoma nasofaring.
2. Tujuan Khusus
a. Mengetahui bagaimanakah ekspresi p 53 pada penderita KNF undifferentiated di RSUD Dr. Moewardi Surakarta.
c. Mengetahui hubungan early 6 (E 6) HPV terhadap ekspresi p 53 pada penderita KNF undifferentiated di RSUD Dr. Moewardi Surakarta.
D. Manfaat Penelitian
E. Orisinalitas Penelitian Tabel 1.1 Orisinalitas Penelitian
No Peneliti Judul Variabel Kesimpulan
BAB II
TINJAUAN PUSTAKA
A. Karsinoma Nasofaring
1. Definisi Karsinoma Nasofaring
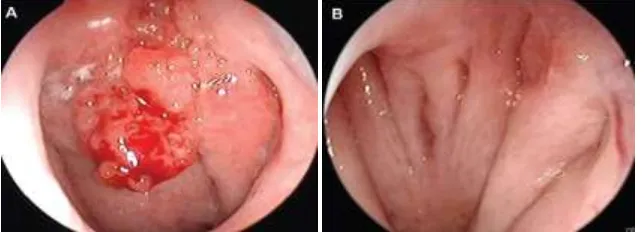
Karsinoma nasofaring atau KNF, merupakan tumor ganas yang berasal dari epitel mukosa skuamosa dinding lateral nasofaring, umumnya muncul di sekitar tuba eustachius (fossa rossenmuler) (Perez, 2014).
Gambar 2.1 A. Karsinoma Nasofaring Exophytic (Kiri); B Karsinoma Nasofaring Nonexophytic/Karsinoma Nasofaring Submucosal (Kanan) (Loh, 2011)
2. Anatomi Nasofaring
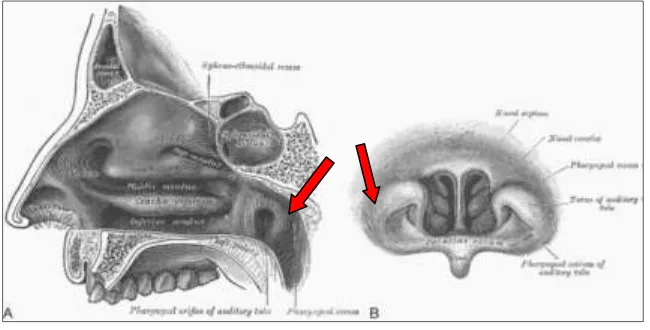
Nasofaring (rinofaring/epifaring) merupakan ruangan kecil berbentuk tubular terletak di belakang koana. Pada dinding lateral nasofaring, terdapat ostium tuba eustachius. Pada bagian superoposterior ostium tuba eustachius,
terdapat tonjolan tulang rawan yang disebut torus tubarius. Pada bagian belakang torus tubarius terdapat lekukan kecil yang disebut fossa rosenmuller/resessus
faringealis (Li, 2014).
Fasia faringobasilaris melekat pada jaringan ikat fibrokartilagenus,
dasar tengkorak, di antaranya foramen laserum, foramen spinosum serta foramen ovale. Foramen lacerum terletak sekitar 2 cm diatas fossa rosenmuller, sehingga
perluasan KNF ke superior dapat menimbulkan gejala kranialis (Drake, 2014).
Gambar 2.2 Bangunan Fossa Rossenmuller (tanda panah), A. Tampak Potongan Sagital, dan B Tampak Posterior (Amene, 2013) Nasofaring diperdarahi oleh cabang-cabang a.karotis eksterna (a.faringeal asenden dan desenden) dan cabang dari a.sfenopalatina. Sedangkan aliran darah
balik vena nasofaring, akan melalui pembuluh darah balik faring yang berada pada dinding muskuler menuju pleksus pterigoid dan v.jugularis interna (Drake, 2014).
Nasofaring dipersarafi oleh n.glosofaringeus serta cabang cabang n.maksilaris yang berasal dari n.trigeminus (Drake, 2014; Li, 2014; Anita, 2015).
spinal. Kumpulan kelenjar getah bening ini termasuk dalam rangkaian lymfonodul
servikalis profunda latero superior yang berada di leher atas bagian lateral, di
bawah muskulus sternokleidomastoideus pada ujung proc.mastoidea. Aliran getah bening ini juga akan menuju rangkaian lymfonodul servikalis profunda latero inferior, yang terletak di leher lateral bagian bawah (supraklavikula). Kompleknya
saluran getah bening pada nasofaring ini, memiliki resiko pada cepatnya metastase KNF, baik pada metatase lokoregional maupun metastase jauh (Drake, 2014).
3. Epidemiologi Karsinoma Nasofaring
Angka kejadian KNF bervariasi di setiap negara. Insiden KNF di negara barat tergolong jarang, yaitu kurang dari 1/100.000 penduduk/tahun (Shi, 2016).
Gambar 2.3 Distribusi KNF di Asia (Mahdavifar, 2016).
Cina, dilaporkan memiliki angka kejadian KNF paling sering, sekitar 18%-25% bila dibandingkan tumor ganas di bagian tubuh lainnya (Li, 2014).
Insiden KNF di Hongkong, dilaporkan 20/100.000 penduduk/tahun, sedangkan di Taiwan, Singapura dan Malaysia, angka kejadian KNF juga dilaporkan tergolong tinggi, sekitar 18,1/100.000 penduduk/tahun (Kumar, 2015). Di Indonesia, kejadian KNF belum dapat dipastikan secara tepat, mengingat masih minimnya fasilitas kesehatan di daerah-daerah, serta akibat dari sistem pencatatan yang belum terintegrasi seluruhnya. Namun berdasarkan data di rumah sakit pendidikan, memperkirakan angka kejadian KNF di Indonesia sekitar 6,2/100.000 jumlah penduduk, atau sekitar 12,000 kasus baru/tahun (Adham, 2012; Anita, 2015).
4. Histologi Mukosa Nasofaring
Mukosa nasofaring dilapisi oleh epitel silindris berlapis bersilia (pseudostratified ciliated columnar epithelium) dan ke arah orofaring berubah
menjadi epitel gepeng berlapis (stratified squamous epithelium). Permukaan mukosa tampak invaginasi serta membentuk kripta yang berbatasan dengan stroma. Lapisan stroma banyak mengandung jaringan limfoid, sehingga sering terlibat pada reaksi folikel limfoid. Pada kripta epitelium, sering terjadi infiltrasi sel limfoid, yang dapat membentuk sel epitel reticulated pattern (Kumar, 2015).
Fossa rosenmuller sebagai lokasi epitel peralihan (transisional epithelium),
5. Etiologi Karsinoma Nasofaring
Penyebab pasti KNF hingga saat ini masih menjadi perdebatan di kalangan peneliti. Sejumlah penelitian bahkan menyebutkan bahwa penyebab KNF merupakan multifaktor. Namun sejumlah ahli yang lain menyebutkan bahwa, KNF berhubungan erat dengan EBV, sehingga sebagian ahli beranggapan bahwa EBV merupakan etiologi utama KNF. Namun dengan terdeteksinya HPV pada jaringan KNF dalam beberapa dekade terakhir, semakin menambah komplek etiologi KNF (Perez, 2014; Kumar, 2015).
Selain itu, bahan karsinogenik pada makanan, lingkungan (enviromental carcinogen) serta adanya kerentanan genetik (genetic susceptibility) diduga juga
memiliki peranan penting pada munculnya KNF (Adham, 2012; Perez, 2014).
6. Gejala dan Tanda Karsinoma Nasofaring
Wei dan Sham, membagi keluhan KNF menjadi 4 kelompok, yaitu : 1. Keluhan telinga (tinitus, telinga terasa penuh dan hearing loss), 2. Keluhan hidung (epistaksis, nasal obstruction dan discharge), 3. Keluhan leher (neck masses), dan 4. Keluhan kepala (nyeri kepala, diplopia, ptosis, nyeri wajah serta numbness) (Tabuchi, 2011).
Neck masses atau pembesaran kelenjar getah bening (KGB) leher, terjadi
peneliti bahkan menyebutkan, hampir sebagian besar penderita KNF datang dengan keluhan utama benjolan di leher atau neck masses (Anita, 2015).
Gambar 2.4 Sublevel Lymph Nodes (Robins et al, 2002).
American Head and Neck Society (AHNS), American Academy of Otolaryngology-Head and Neck Surgery (AAO-HNS) dan American Joint Comission on Cancer (AJCC) membagi 6 sublevel lymph nodes leher menjadi : IA (submental), IB (Submandibula), IIA dan IIB (Upper jugular), III (middle jugular), IV (lower jugular), VA dan VB (posterior triangle group) dan VI
(anterior compartement group) (Robins et al, 2002; Balm, 2010).
7. Diagnosis Karsinoma Nasofaring
tanda adanya lesi pada nasofaring, muara tuba eustachius atau nasal cavity (Adham, 2014).
Pada pemeriksaan fisik, KNF stadium dini dapat ditandai oleh membran tympani intak dengan gambaran retraksi. Sedangkan pada stadium lanjut, dapat
ditandai dengan pembesaran KGB leher, diplopia dan nyeri kepala (Deng, 2014). Diagnosis pasti KNF, didasarkan pada pemeriksaan histologi dengan ditemukannya sel ganas pada jaringan nasofaring. Sedangkan pemeriksaan penunjang seperti CT scan nasofaring, rontgen thorak serta USG abdomen, perlu dilakukan untuk kepentingan staging KNF (Li, 2014; Gurning, 2015).
8. Klasifikasi Histologi Karsinoma Nasofaring
Histologi KNF pertama kali dijelaskan oleh Michaux tahun 1845, saat itu lebih dikenal dengan “the skull base cancer”. Namun pada tahun 1911, Trotter
memperkenalkan istilah “endotelioma”, berdasarkan pada banyaknya gambaran
endotel pada pemeriksaan histopatologi dalam penelitiannya (Wei, 2011).
Tahun 1921 Reverchon dkk memperkenalkan istilah “lymphoepithelioma carcinoma”, karena dalam penelitiannya menemukan banyak gambaran limfoid dan epitel pada jaringan KNF. Namun pada tahun 1927 Quick dan Culter memperkenalkan istilah “transtitional cell carcinoma”, atau juga dikenal dengan istilah “ringert’s tumor” (Wei, 2011).
Tahun 1929 Ewing membagi KNF menjadi 5 tipe, yaitu : squamous cell carcinoma, transtitional cell carcinoma, lymphoepithelial carcinoma, malignant
menggolongkan KNF kedalam kelompok epidermoid carcinoma. Pada tahun 1961, Bloom dkk juga memperkenalkan istilah embryonal carcinoma (Li, 2014)
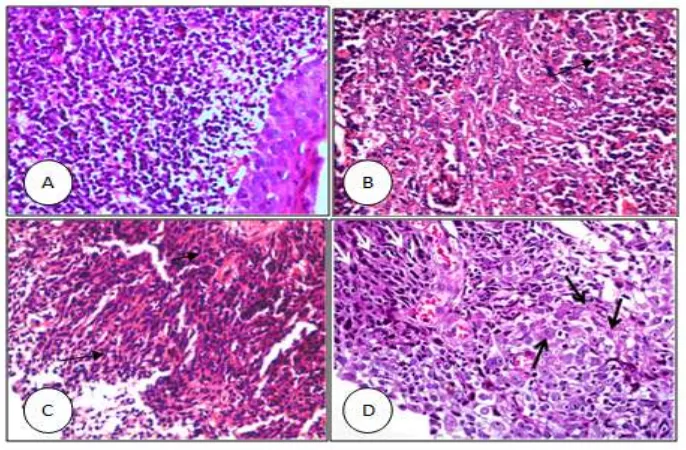
Gambar 2.5 A. Mukosa Normal Nasofaring; B. KNF Undifferentiated; C. KNF Non Keratinizing, Dan D. KNF Keratinizing (Sudiono, 2013). Yeh dkk, pada tahun 1967, dalam acara simposium Union for International Cancer Control (UICC), membagi histologi KNF menjadi epidermoid carcinoma,
clear cell carcinoma, spindle cell carcinoma, transtitional cell carcinoma,
lymphoepithelial carcinoma, pleomorphic carcinoma dan mixed cell carcinoma (Wei, 2011).
carcinoma), tipe 2 (nonkeratinizing carcinoma) serta tipe 3 (undifferentiated
carcinoma) (Wei, 2011).
Namun pada tahun 1982, dalam acara seminar KNF Western Pacific Region di Guangzhou yang diadakan oleh WHO, dilakukan revisi terhadap klasifikasi KNF hasil simposium I tersebut, yaitu dengan menggabungkan tipe 2 dan tipe 3 menjadi 1, sehingga yang tersisa hanya tipe 1 (squamous cell carcinoma) dan tipe 3 (undifferentiated cel carcinoma). Namun demikan, revisi klasifikasi tersebut membuat banyak ahli onkologi Cina yang tidak setuju dengan perubahan ini. Perubahan ini dianggap terlalu sederhana, bahkan dianggap kurang mampu mewakili gambaran histopatologi KNF yang dinilai sangat bervariasi (Wei, 2011). Simposium internasional KNF ke II tahun 1991, diselenggarakan oleh WHO. Pada simposium ke II ini, dibuat klasifikasi histopatologi KNF baru, dimana terdiri atas keratinizing squamous cell carcinoma dan nonkeratinizing cell carcinoma. Tipe keratinizing squamous cell carcinoma terdiri atas well-moderate
differentiated dan poorly differentiated, dan nonkeratinizing cell carcinoma terbagi atas differentiated dan undifferentiated (Li, 2014).
Simposium internasional KNF ke III tahun 2003, diselenggarakan oleh WHO. Pada simposium ke III ini, disepakati hanya menambahkan tipe basaloid terhadap klasifikasi pada KNF sebelumnya (simposium KNF ke II), sehingga menjadi : 1. Keratinizing squamous cell carcinoma, 2. Nonkeratinizing cell carcinoma dan 3. Basaloid squamous cell carcinoma (Wei, 2011).
keratinisasi) serta adanya gambaran sel stratifikasi. Selain itu juga dapat dijumpai adanya jembatan antar sel (intercellular bridges). Hampir sebanyak 25% tipe keratinizing squamous cell carcinoma terdapat di Amerika, dan hanya sekitar
1-2% berada di wilayah endemik KNF (Li, 2014).
Tipe nonkeratinizing cell carcinoma, ditandai dengan gambaran sel sekuensi maturasi tanpa adanya pembentukan keratin. Sel tumor tersusun teratur/berjajar berbentuk pleksiform yang tampak jernih/terang akibat adanya glikogen dalam sitoplasma, tampak berdifferensiasi serta tidak dijumpai adanya musin (Li, 2014).
Tipe karsinoma tidak berdiferensiasi (undiffererntiated), sel tumor berbentuk synctitial, gambaran patologi sel yang sangat heterogen sehingga batas antar sel sulit dibedakan. Tumor didominasi bentuk spindel yang memiliki nukleolus hiperkromatin. Tipe undiffererntiated cell carcinoma, hampir sekitar 95% terdapat pada wilayah endemik KNF (Wei, 2011; Sudiono, 2013; Li, 2014).
9. Sistem Staging dan Stadium Karsinoma Nasofaring
Hingga saat ini, sistem staging KNF masih merujuk pada sistem TNM (T : Tumor, N : Nodul dan M : Metastase). Menurut American Joint Committee on Cancer (AJCC) edisi 7, sistem TNM KNF terdiri atas : (Liang et al, 2016).
T : Tumor primer (ukuran)
Tx Tumor primer tidak dapat dinilai T0 Tidak ada tumor primer
Tis Tumor (karsinoma) in situ T1
Tumor terbatas di nasofaring/meluas ke orofaring/rongga hidung;tanpa perluasan ke parafaring
T2 Tumor meluas ke parafaring
T4
Tumor menginvasi intrakranial, fossa temporalis, orbita, ruang masticator, hipofaring dan/ menginvasi saraf kranialis (cranial nerves)
N : Nodul/kelenjar getah bening (KGB) regional (ukuran KGB) Nx KGB regional tidak dapat dinilai
N0 Tidak ada metastasis/penjalaran ke KGB regional
N1 Metastase unilateral KGB regional berukuran < 6 cm, dan/KGB retrofaring, dan/KGB di atas fossa supraklavikula .
N2 Metastase bilateral KGB regional berukuran < 6 cm, dan/KGB retrofaring, dan/KGB di atas fossa supraklavikula
N3 Metastase KGB regional unilateral/bilateral berukuran > 6 cm, dan/di atas fossa supraklavikula
N3a : Metastase KGB > 6 cm
N3b : Metastase ke dalam fossa supraklavikula M : Metastase jauh
Mx Metastase jauh tidak dapat dinilai M0 Tidak terdapat metastase jauh M1 Terdapat metastase jauh
Setiap diagnosis KNF perlu ditentukan stadium/derajatnya. Selain untuk keperluan edukasi, evaluasi serta menentukan prognosis, hal ini juga diperlukan untuk menentukan metode terapi yang akan digunakan. Secara sederhana stadium KNF dibagi menjadi stadium dini dan stadium lanjut, namun berdasarkan uraian sistem staging TNM AJCC 7 tahun 2010, maka stadium KNF, terdiri dari :
T2a,T2b N2 M0
T3 N2 M0
Stadium IVA T4 N0,N1,N2 M0
Stadium IVB Semua T N3 M0
Stadium IVC Semua T Semua N M1
(Liang et al, 2016).
10. Terapi dan Respon Terapi Karsinoma Nasofaring
KNF memiliki sifat radiosensitif, sehingga radioterapi/penyinaran menjadi modalitas utama untuk penatalaksanaan KNF. Selain radioterapi, kemoterapi juga dilaporkan dapat meningkatkan keberhasilan pengobatan, baik pada KNF stadium lanjut maupun KNF rekuren, walaupun beberapa penelitian melaporkan hasil yang kurang memuaskan. Kemoterapi merupakan obat yang dapat menghambat pertumbuhan kanker atau bahkan membunuh sel kanker. Penggunaan kombinasi obat kanker dianggap dapat lebih menurunkan potensi sitotoksik, mengatasi resisten terhadap salah satu obat antikanker, serta dapat mengurangi dosis obat sitostatika yang digunakan sehingga diharapkan akan dapat menurunkan efek samping kemoterapi (Liang et al, 2016).
Beberapa sitostatika yang mendapat rekomendasi dari FDA sebagai terapi keganasan di bagian kepala dan leher antara lain : cisplatin, carboplatin, methotrexate, 5-fluorouracil, bleomycin, hydroxyurea, doxorubicin,
cyclophosphamide, doxetaxel, mitomycin-C, vincristine serta paclitaxel (Li, 2014).
(kemoterapi dilakukan bersama dengan radioterapi), serta adjuvan (kemoterapi sesudah radioterapi) (Liang et al, 2016).
Sedangkan berdasarkan terhadap respon terapi yang telah diberikan (sesuai dengan offset publications no.48 tahun 1979), WHO membedakan menjadi 4 golongan, yaitu 1. Complete Respon/CR; 2. Partial Respon/PR; 3. Stable disease/SD, serta 4. Progressive disease/PD (Widiastuti, 2011; Li, 2014)
11. Prognosa Karsinoma Nasofaring
Five years survival rate untuk T1 sekitar 50%, dan untuk T4 sekitar 10 hingga 20%. Pasien KNF tanpa pembesaran kelenjar getah bening, dilaporkan mempunyai survival rate sekitar 50% hingga 75%. Sedangkan pasien KNF dengan pembesaran kelenjar getah bening unilateral/bilateral diperkirakan memiliki angka survival rate 20% sampai 40% (Widiastuti, 2011; Balm, 2010).
Sedangkan berdasarkan stadium penyakit, five survival rate pada stadium I sekitar 79,9%, stadium II sekitar 56,0%, stadium III sekitar 38,4% dan stadium IV sekitar 16,4%. Selain itu, sejumlah peneliti juga menyebutkan bahwa hampir sekitar 40% kasus KNF dilaporkan dapat menjadi rekurens pada tumor primer, dan hampir sekitar 60% kasus KNF dapat terjadi metastase (Widiastuti, 2011).
B. Karsinogenesis
Karsinogenesis berasal dari kata karsinogenik dan genesis. Karsinogenik dibedakan menjadi 2 faktor, yaitu faktor exogenous dan faktor endogenous. Faktor exogenous terdiri atas, makanan yang diawetkan, gaya hidup, radiasi, senyawa
kimia, bakteri, virus, parasit, konsumsi alkohol serta rokok. Sedangkan faktor endogenous terdiri atas genetik, hormonal, gangguan sistem imun, inflamasi serta
ulseratif kronik (Tanaka, 2013).
Gambar 2.6 Proses Inisiasi, Promosi Dan Progresi (Tanaka, 2013). Onkogen merupakan gen yang memiliki sifat neoplasma. Onkogen terjadi bila ada transformasi/mutasi dari proto onkogen. Proto onkogen dalam kondisi normal diperlukan untuk pertumbuhan sel. Namun jika terjadi kerusakan pada mekanisme seleksi terhadap sel normal, maka akan terjadi transformasi proto onkogen menjadi onkogen (Tanaka, 2013).
tumor supresor gen (TSG) terganggu fungsinya, akibat adanya mutasi/ada bagian yang hilang (deletion), maka sel yang telah mengalami perubahan urutan DNA (memiliki sifat onkogen), akan dapat terus berkembang. Akumulasi dalam kurun waktu yang lama inilah yang diduga berpotensi menjadi kanker (Kartawiguna, 2001).
Karsinogenesis terdiri dari proses multi-stage yang melibatkan 3 langkah, yaitu : inisiasi, promosi dan progresi. Sedangkan karakteristik kanker pada
manusia, terdiri atas “5M”, yaitu multifactorial etiology, multistep, multiyear, multigenetic alterations dan multipath disease (Kartawiguna, 2001; Tanaka, 2013)
Tahap inisiasi diakibatkan oleh karsinogen nukleofilik maupun karsinogen elektrofilik reaktif. Karsinogen ini akan dapat menjadi genotoksik maupun epigenetik. Pada tahap akhir inisiasi, belum terlihat perubahan histologi sehingga jaringan masih tampak normal. Namun demikian, tampak terjadi peningkatan sel yang mengalami nekrosis maupun prolliferasi (Kartawiguna, 2001).
Tahap promosi merupakan proses yang dapat menyebabkan sel yang telah terinisiasi mampu berkembang menjadi sel pre neoplasma. Paparan faktor promotor antara lain alkohol, lemak, obat immunosupresif, defisiensi vitamin maupun sakarin. Paparan pada tahap promosi, akan terjadi dalam waktu yang lama (Kartawiguna, 2001).
sel. Pada fase akhir tahap progresi ini, telah terjadi gambaran histologi dan klinis yang menunjukkan adanya keganasan (Kartawiguna, 2001).
C. Peran Virus Epstein Barr Pada Karsinoma Nasofaring 1. Virus Epstein Barr (EBV)
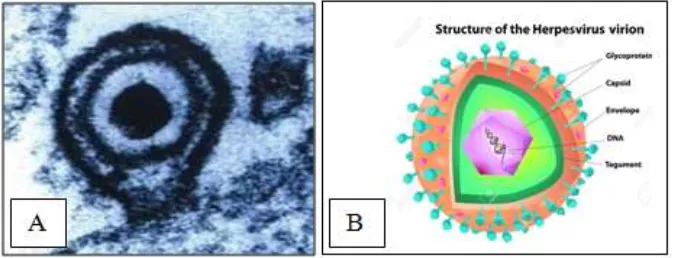
Sir Michael Anthony Epstein dan Achong Yvonne Barr, merupakan orang yang pertama kali menemukan EBV, pada pemeriksaan specimen lymphoblast menggunakan mikroskop elektron, terhadap pasien limfoma burkitt (Tsao, 2015).
Gambar 2.7 A. Gambaran Virus Epstein Barr Dengan Mikroskop Elektron; B. Struktur Virus Epstein Barr (Young dan Rickinson, 2017). EBV merupakan virus DNA, terdiri atas protein pembungkus dengan inti berbentuk toroid, sebuah nukleokapsid dengan 162 kapsomer, sebuah protein tegumentum serta sebuah selubung luar yang dilengkapi dengan tonjolan
glikoprotein 350/320 (gp 350/320). Genome EBV berbentuk linear, panjang 172 kilo base pairs (kbp), serta memiliki 84 open reading frames (ORFs). Virus ini termasuk dalam human herpes virus 4 (HHV4), family herpesviridae, sub family gammaherpesvirus dan genus lymphocrypthovirus (Wang et al, 2017)
Agency for Research on Cancer (IARC), menyebut EBV sebagai golongan I
penyebab KNF (Geng, 2015).
Gambar 2.8 Genom Virus Epstein Barr Laten (Wang et al, 2017)
Walaupun tersebar di alam, namun hingga kini hanya manusia yang diketahui sebagai natural host bagi EBV. Berdasarkan distribusi geografi dan perbedaan urutan kode nuclear antigen nya, EBV dapat dibedakan menjadi 2 tipe, yaitu EBV 1 dan EBV 2, atau dikenal juga sebagai tipe A dan tipe B. EBV tipe 1, hampir merata terdapat di benua Eropa, Amerika dan sebagian Asia. EBV tipe 2 diketahui lebih sering dijumpai di wilayah Equator Africa, New Guinea dan Alaska. EBV tipe 1 diketahui memiliki kemampuan immortalizes dan transforming pada sel B lebih unggul dibanding EBV tipe 2 (Tsao, 2015).
Pada infeksi fase laten (infeksi pada sel B), EBV mengekspresikan 6 nuclear proteins (EBNA 1, EBNA 2, EBNA 3A, EBNA 3B, EBNA 3C dan
EBNA LP), 3 integral membrane proteins (LMP 1, LMP 2A dan LMP 2B) dan 2 small nuclear RNAs (EBER 1 dan EBER 2) (Laeeq, 2014; Li, 2014; Tsao, 2015).
Infeksi laten sendiri dibedakan menjadi 4, yaitu : a. Laten 0, dimana tidak mengekspresikan protein virus, namun hanya mengambarkan transkrip EBV-enconded RNAs (EBERs); b, Laten 1, secara konsisten gen virus yang di ekspresikan EBNA 1, EBER 1 dan BART yang merupakan karakteristik limfoma
yang merupakan karakteristik KNF; serta d. Laten 3, merupakan proliferasi EBV pada sel limfosit B, yang ditandai dengan EBNA 1, EBNA 2, EBNA 3A, EBNA 3B, EBNA 3C, LMP 1, LMP 2A dan LMP 2B (Bentz, 2011; Wang, 2016).
Gambar 2.9 Infeksi Laten Virus Epstein Barr (Lorenzetti, 2014)
Penularan EBV dapat melalui cairan tubuh yang mengandung EBV, baik secara langsung (kontak oral) atau secara tidak langsung (melalui saliva yang tertinggal pada peralatan makan, peralatan mandi dll). Kebiasaan makan menggunakan chopstick diduga berkaitan dengan tingginya infeksi EBV di Cina. Namun di Jepang, dengan tradisi makan yang sama dan memiliki angka infeksi EBV yang tinggi, tetapi memiliki angka kejadian KNF rendah (Adham, 2012).
2. Virus Epstein Barr dan Karsinoma Nasofaring
Tingginya titer Ig A antibodi anti EBV VCA (viral capsid antigen) pada pasien KNF WHO tipe 2 dan WHO tipe 3 yang sering dilaporkan, merupakan bukti keberadaan EBV pada KNF. Sedangkan adanya gen EBV atau gen produk infeksi EBV pada mayoritas (65%-80%) penderita KNF seperti EBV nuclear antigen 1 (EBNA 1), latent membrane protein 1 (LMP 1), latent membrane proteins 2A (LMP 2A), latent membrane proteins 2B (LMP 2B) dan EBV enconded small RNAs (EBER), membuktikan besarnya peran EBV pada KNF
(Temple et al, 2014; Li, 2016; Wang et al, 2017).
3. Infeksi Virus Epstein Barr Pada Nasofaring
Lokasi yang dicurigai sebagai tempat masuknya EBV pada manusia di antaranya mukosa orofaring, mukosa nasofaring dan mukosa tonsil. Orofaring selain menjadi tempat infeksi primer, juga diduga menjadi tempat replikasi virus. Dugaan ini berkaitan dengan fungsi oral cavity sebagai tempat masuknya makanan dan minuman. Oleh karena itu, makanan dan minuman yang terkontaminasi EBV dapat menjadi media untuk masuknya EBV ke dalam tubuh manusia (Li, 2016).
Mukosa nasofaring terdiri atas kelenjar salivari, yang meliputi kelenjar mucous maupun serous. Pada daerah ini juga terdapat zona transisional antara
pseudostratified ciliated columnar epithelium cells dengan stratified squamous
epithelium cells. Pada zona transisional tersebut ditandai dengan sel epitel yang
perkembangan di usia 10 tahun pertama kehidupan, sehingga zona transisional ini diperkirakan menjadi lokasi masuknya virus hanya pada masa awal kehidupan. Keadaan ini pulalah yang diyakini menjadi penyebab terjadinya infeksi laten pada lapisan basal epitel selama periode masa perkembangan (Poh, 2016).
Tonsil dianggap sebagai target primer proses infeksi EBV, hal ini didasarkan pada dekatnya letak antara tonsil dengan sistem limfoid. Di dalam tonsil ini pula diduga menjadi tempat terinfeksinya sel naive B. Selain itu, walaupun masih menjadi perdebatan, namun reseptor CD 21 yang terdapat sel B (yang dapat berikatan dengan EBV), hanya diekspresikan pada epitel tonsil, bukan pada uvula, soft palate, tongue maupun pada buccal mucosa epithelial cells (Temple et al, 2014).
Setelah EBV masuk dan menetap pada sel epitel tonsil, virus selanjutnya juga akan mampu menginfeksi sel limfosit B yang bersirkulasi. Masuknya EBV ke dalam limfosit B dimungkinkan akibat adanya ikatan selektif cluster of differentiation/CD 21 (terdapat pada permukaan limfosit B) dengan glikoprotein
/gp 350/250 (terdapat pada membran EBV). Pada limfosit B inilah selanjutnya akan mulai dibentuk genotip EBV yang bersifat persistence, serta akan berhubungan erat dengan immortalization dan transformation (Poh, 2016).
D. Peran Virus Human Papilloma Pada Karsinoma Nasofaring 1. Virus Human Papilloma (HPV)
Visualized HPV pertama kali pada pertengahan tahun 1900. Pada tahun
uteri cancer. HPV merupakan virus DNA, ordo papillomavirales, family
papillomaviridae, serta spesies human papillomavirus (Laeeq, 2014).
Gambar 2.10 Virus Human Papilloma
HPV terdiri atas 3 genome utama, yaitu early (E), late (L) serta long control region (LCR). Gen early (E) terdiri atas 2 early regulatory proteins (E 1 dan E 2),
serta 3 oncoprotein (E 5, E 6 dan E 7). Gen late terdiri atas 2 late protein (L 1 dan L 2) dan long control region (LCR)/ upstream regulatory region (URR) hanya terdiri atas sebuah gen regulator (Laeeq, 2014).
Gen early (E) berfungsi pada tahap awal infeksi, selain akan mengkode protein regulator untuk transkripsi, replikasi dan transformasi, gen early (E) juga akan melakukan kontrol terhadap siklus sel untuk kelangsungan hidup virus. Gen late (L) berfungsi pada tahap akhir infeksi dengan mengkode protein kapsid hingga pada pembentukan kapsid dan partikel virus secara lengkap. Sedangkan LCR selain juga diperlukan untuk replikasi dan ekspresi gen virus, juga akan berperan terjadinya proses infeksi laten maupun kronik (Wulandari, 2011).
Genome DNA HPV berbentuk sirkuler untai ganda, berdiameter sekitar
mampu bertahan hidup selama 20 hari di luar sel serta di tempat terbuka (Laeeq, 2014; Lucs et al, 2015).
Gambar 2.11 Genom Virus Human Papiloma (Wulandari, 2011).
Saat ini diperkirakan lebih 200 tipe HPV telah teridentifikasi, dan sekitar 40 spesies diketahui dapat menginfeksi epitel mukosa pada manusia. Sesuai sifat neoplastiknya, HPV dibagi menjadi 2 kelompok, yaitu virus human papilloma high risk (HPV HR) dan virus human papilloma low risk (HPV LR) (Choi, 2016).
Beberapa tipe virus human papilloma high risk (HPV HR) yang sering ditemukan, antara lain tipe 16, 18, 31, 33, 35, 39, 45, 51 dan 68, dan diduga berhubungan dengan cervic uteri cancer dan keganasan didaerah kepala leher. Sedangkan virus human papilloma low risk (HPV LR) yang sering ditemukan adalah tipe 6, 11, 40, 42, 43, 44 dan 81, serta merupakan penyebab tumor jinak pada mukosa seperti condyloma acuminata, vagina, vulva, anus, serta warts/kutil pada kutaneus (Walline et al, 2013).
2. Human Papilloma Virus dan Karsinoma Nasofaring
Walaupun sejumlah peneliti menyebutkan bahwa HPV dapat menyebabkan KNF, namun proses infeksi HPV hingga menjadi KNF, sampai saat ini masih menjadi perdebatan di kalangan klinisi (Robinson et al, 2013; Asante et al, 2017).
Tingginya resiko di daerah oral cavity terinfeksi HPV, serta tingginya kemampuan HPV HR menyebabkan infeksi kronik pada lapisan mukosa/kutaneus (bagian tubuh yang aktif mengalami differensiasi), merupakan pemikiran awal yang mencoba menjelaskan bagaimana hubungan HPV terhadap KNF (Kumar et al, 2015).
Selain itu, Singh et al juga menjelaskan bahwa, HPV dapat menimbulkan KNF diduga akibat adanya perluasan sekunder HPV yang terdapat di orofaring ke nasofaring. Oleh sebab itu sejumlah ahli berpendapat bahwa, jika terdeteksi HPV sebagai metastatic squamous cell carcinomas di kelenjar limfanodi leher, maka sebaiknya perlu dipertimbangkan penelusuran tumor primer di orofaring, hipofaring maupun nasofaring (Asante et al, 2017).
Temuan HPV pada KNF, dilaporkan antara 9% hingga 51% kasus pada KNF. Menggunakan metode in situ hybridization (ISH) atau polymerase chain reaction (PCR), tipe HPV HR yang sering ditemukan pada KNF adalah tipe 16
dan 18. Sedangkan genome HPV yang sering dilaporkan oleh sejumlah penelitian pada KNF adalah early 6 (E 6), early 7 (E 7) dan late (L) (Atighechi et al, 2014)
dan tipe 3 populasi campuran caucasians dan Asian, mendapatkan 19% (5) merupakan HPV HR positif. Penelitian terbaru yang dipublikasikan oleh Maxwell et al, melaporkan banyak menemukan HPV HR positif pada pasien KNF WHO
tipe 2 dan tipe 3 dalam populasi caucasian (Lo, 2010; Atighechi et al, 2014)
3. Infeksi Human Papilloma Virus Pada Nasofaring
Dekatnya jarak antara orofaring dan nasofaring, banyaknya kemiripan morfologi dan fungsi mukosa orofaring dan nasofaring, serta adanya jaringan lymfoid reticular crypt epitelia yang menghubungkan orofaring dan nasofaring
(secara khusus berfungsi sebagai transepithelial antigen processing), memunculkan banyak spekulasi di kalangan peneliti maupun klinisi untuk menjelaskan hubungan antara HPV dengan KNF (Atighechi et al, 2014).
Pada manusia dengan sistem imun yang kompeten, akan mampu mengeliminasi HPV yang masuk kedalam tubuh. Namun tidak semua HPV akan tereliminasi, di mana ada beberapa virus yang masih tersisa akan mengalami fase laten, dan akan ada sepanjang hidup host (Wulandari, 2014).
Melalui luka, abrasi maupun kripte, HPV akan masuk dan menginfeksi bagian basal sel epitel, di mana pada lapisan basal tersebut merupakan daerah paling aktif melakukan pembelahan (proliferasi). Pada lapisan basal ini pulalah diduga akan terjadi replikasi genom HPV, baik melalui proses replikasi DNA sel host maupun proses replikasi yang diperankan oleh early 1 (E 1) dan early 2 (E 2)
Lapisan sel basal yang telah terinfeksi HPV, pada tahap awal akan mengalami proses transkripsi, replikasi serta transformasi gen virus. Selain itu, E 6 yang juga diproduksi oleh HPV, terdiri atas E 3 ubiquitin ligase, E 6 associated protein (E6AP) dan ubiquitinates p 53 tumor supresor protein yang diketahui
memiliki kemampuan gangguan pada p 53 (Walline et al, 2013; Laeeq, 2014).
Gambar 2.12 Siklus Hidup HPV HR (Tomaic, 2016).
Terganggunya p 53, akan menyebabkan pada gagalnya proses DNA repair. Kegagalan terhadap proses DNA repair inilah yang dapat mengakibatkan terbentuknya DNA mutan. Selain akan mampu mengakibatkan kegagalan DNA repair, gangguan pada p 53 juga mampu menyebabkan kegagalan proses
apoptosis (Walline et al, 2013; Laeeq, 2014).
E. Latent Membrane Proteins 1 (LMP 1)
Latent membrane protein 1 (LMP 1), merupakan sebuah integral komplek membran protein yang terdapat pada infeksi laten 2 EBV (Tsao, 2015).
Gambar 2.13 Peran LMP 1 Pada Keganasan (Tsao, 2015)
Komponen terminus N dan C yang dimilikinya, selain diduga akan mampu berinteraksi terhadap protein pada sel host, juga diyakini memiliki peran besar terhadap proses immortalization EBV pada sel B. Selain itu, melalui proses yang komplek, LMP 1 juga diyakini akan dapat melindungi sel B dan sel epitelial dari proses apoptosis. Akibat besarnya pengaruh LMP 1 pada KNF inilah, sehingga sejumlah klinisi maupun peneliti menyebutkan bahwa LMP 1 merupakan onkoprotein utama pada EBV. Selain itu, level ekspresi LMP 1 juga dapat digunakan untuk menentukan prognosis pada penderita KNF (Shao, 2004).
domain, yaitu C-terminal activating regions 1 (CTAR 1), C-terminal activating regions 2 (CTAR 2) dan C-terminal activating regions 3 (CTAR 3) (Gurning,
2015)
Melalui proses yang komplek, CTAR 1, CTAR 2 dan CTAR 3 yang merupakan bagian dari LMP 1, akan mampu mengaktifkan sejumlah jalur sinyal seluler setelah berikatan dengan tumor necrosis factor receptor (TNFR). CTAR 1 yang berikatan dengan TNF receptor associated factors (TRAF) 1, 2, 3 dan 5, secara noncanonical dapat mengaktifkan jalur sinyal nuclear factor (NF), mitogen activated protein kinase (MAPK) dan signal tranducer activator of
transcription-3 (STAT 3). Sedangkan CTAR 2 yang berikatan dengan TNF
receptor interacting proteins (TRIP) dan TNF receptor associated death domains
(TRADD), secara canonical selain akan mengaktifkan nuclear factor (NF), juga akan mengaktifkan phosphatidylinositol 3 kinase (PI3K) (Shao, 2004).
Nuclear factor- (NF-) dalam keadaan normal memiliki peran penting
mengatur pertumbuhan sel (cell growth) dan modulasi inflamasi (modulation of inflamation). Namun pada proses karsinogensis, aktivasi NF- selain akan
meningkatkan pertumbuhan sel, juga akan dapat mengaktifkan proses inflamasi secara berlebihan. Selain itu, pada KNF aktivasi NF- diduga juga akan menimbulkan banyak sekali kekacauan atau munculnya jalur sinyal seluler yang saling bertentangan, seperti Bcl 2, cyclooxygenase 2 (Cox 2) serta vascular endothelial growth factor (VEGF) (Chou, 2008).
B cell CLL/lymphoma 2 atau Bcl 2, merupakan protein yang diyakini
Bcl 2 dan produknya telah diidentifikasi sebagai regulator utama dalam proses apoptosis dalam banyak sel. Walaupun masih menjadi perdebatan, namun sebagian ahli membagi protein ini menjadi 2 kelompok, yaitu proapoptosis (Bax, Bak, serta Bcl-X5), dan antiapoptosis (Bcl 2 dan Bcl-XL). Sesuai dengan konsep ini, maka ekspresi yang berlebihan dari Bcl 2 akan meningkatkan daya tahan hidup sel yang mengarah pada antiapoptosis. Sebaliknya, ekspresi yang meningkat terhadap Bax/Bak, akan mengarah pada proses proapoptosis. Selain itu, sejumlah penelitian saat ini banyak yang menemukan bahwa Bcl 2 bersama dengan p 53, akan membentuk p 53 wild type akan bersinergi meningkatkan pertumbuhan sel tumor (Chou, 2008; Kresno, 2011).
Phosphatidylinositol 3 kinase (PI3K) merupakan jalur specific phospholipids yang akan mampu mengaktifkan beragam proses seluler termasuk
di antaranya proses pertumbuhan, motility, adhesion serta kelangsungan hidup sel. Oleh karena itu, peningkatan aktivitas PI3K juga diduga diyakini akan sangat berperan penting pada perkembangan KNF (Chou, 2008).
Mitogen activated proteins kinase (MAPK) yang terdapat pada nukleus, akan berikatan dengan DNA, merupakan gen yang mengatur phosphorylating transcription factor. MAP K pada KNF akan menghmbat c Jun N terminal kinase
sel normal. Namun pada sel tumor, aktivitas JNK akan ditekan sehingga kemudian menjadi efek antiapoptosis pada sel (Chou, 2008).
Signal transducer and activator of transcriptions 3 (STAT 3) termasuk bagian STAT family dari faktor transkripsi sitoplasmik yang mengaktifkan beberapa sitokin dan reseptor faktor pertumbuhan. Aktivasi persisten sinyal jalur JAK 2-STAT 3, banyak dilaporkan memegang peranan pada sejumlah tumor pada manusia, termasuk KNF. Pada KNF, sinyal STAT 3 juga dilaporkan memegang peranan penting pada proses proliferasi sel, metastasis, angiogenesis dan host immune evasion. Selain itu, walaupun masih menjadi perdebatan, namun sejumlah
ahli meyakini bahwa STAT 3 juga memiliki peran sebagai antiapoptosis (Pan, 2013)
Survivin merupakan salah satu sinyal seluler yang secara langsung dapat diaktifkan melalui LMP 1, walaupun hingga kini mekanisme pasti sinyal seluler yang berhubungan dengan survivin ini masih diperdebatkan. Survivin merupakan inhibitor penting untuk apoptosis, namun selain itu, survivin juga diyakini memiliki peran pada proliferasi sel. Pada KNF, survivin intranuclear diduga akan mampu berikatan dengan cyclin dependent kinase 4 (CDK 4) yang akan memiliki peran sebagai inhibitory protein p 21 dan p 16. Keadaan ini akan memungkinkan CDK 4 melakukan transkripsi inisiasi protein pada fase S, sehingga diduga dapat terjadi transisi serta proliferasi sel tumor (Chou, 2008; Shao, 2004; Bentz, 2011).
diantaranya akibat banyaknya variasi ekspresi LMP 1 yang dilaporkan dari hasil biopsi KNF pada sejumlah penelitian (Ai, 2012)
Beberapa penelitian melaporkan ekspresi LMP 1 berkisar hingga 60%-90% pada sejumlah penderita KNF, sedangkan beberapa penelitian yang lain melaporkan ekspresi LMP 1 positif hanya sekitar 20%-40% pada KNF. Namun, walaupun ekspresi LMP 1 ini diduga akan sangat bergantung pada tehnik pemeriksaan yang digunakan, namun secara umum konsensus ekspresi LMP 1 pada KNF hanya sekitar 20%-50% (Chou, 2008; Ai, 2012; Robinson dkk, 2013)
F. Early 6 (E 6)
Proses keganasan yang melibatkan HPV akan sangat tergantung pada genom early 6 (E 6), walaupun secara umum keberadaan E 6 ini tidak dapat dipisahkan dari early 7 (E 7) (Yim, 2005)
Onkoprotein HPV HR (E 6 dan E 7) yang diekspresikan pada sel epitel yang telah terinfeksi HPV, selain akan terlibat pada peningkatan proses proliferasi, diduga juga akan terlibat pada proses differensiasi abnormal pada sel epitel tersebut. Pada keadaan ini diperkirakan telah terjadi induksi proses lesi displasia kronis, yang pada akhirnya akan mampu menyebabkan tumbuh dan berkembangnya sel yang telah terinfeksi HPV, dengan sifat yang berbeda dengan sel asalnya, dan selanjutnya akan dapat tumbuh menjadi tumor ganas (Kresno, 2011; Laeeq, 2014)
Early 6 atau E 6 merupakan protein yang terdiri dari 158 amino acid
diperkirakan akan mampu mempromosikan sel untuk melakukan proses proliferasi sel dengan stimulasi degradasi tumor supresor protein p 53 (Yim, 2005).
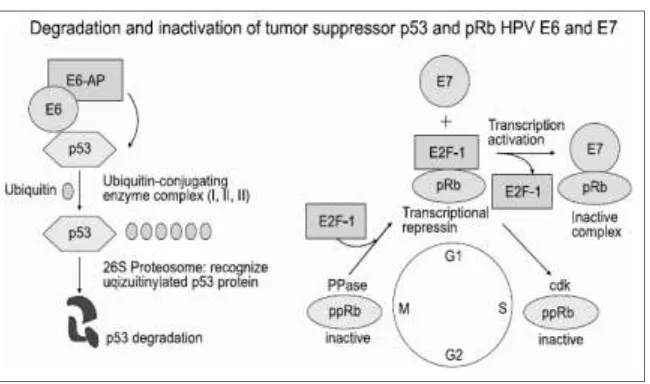
Gambar 2.14 Degradasi Dan Inaktivasi Tumor Supresor Gen P 53 dan Rb Pada Infeksi HPV E 6 dan E 7 (Yim, 2005)
E 6 merupakan suatu protein komplek yang dibentuk oleh 3 komponen, yaitu E 3 ubiquitin ligase, E 6 associated protein (E6AP) dan ubiquitinates p 53 tumor supresor protein. Ke tiga protein komplek E 6 HPV inilah yang diduga
akan mampu mengaktivasi ubiquitinasi. Keberadaan ubiquitination ini diduga memiliki kemampuan untuk menyebabkan terjadinya degradation pada p 53. P 53 yang telah mengalami degradasi ini akan menghasilkan deregulation siklus sel, baik pada fase G1/S maupun pada fase G2/M. Namun demikian, sebagian peneliti berpendapat, bahwa hanya E 6 associated protein (E6AP) sajalah yang memiliki kemampuan ubiquitination. Oleh karena itu, sejumlah peneliti ada yang menyebutkan bahwa target E 6 associated protein (E6AP) adalah p 53 (Ai, 2012)
tumor supresor gen (TSG) yang memiliki peran penting dalam mengatur pertumbuhan sel. Gen retinoblastoma yang pada awalnya diketahui sebagai kanker retinoblastoma herediter pada mata, namun dalam perkembangannya mutasi gen retinoblastoma juga akan dapat dijumpai pada hampir seluruh jenis kanker pada manusia (Kresno, 2011)
Gambar 2.15 Siklus Sel (Tanaka, 2013)
retinoblastoma yang akan berdampak terhadap kontrol pertumbuhan (Kresno, 2011; Walline et al, 2013)
G. Protein 53 (P 53)
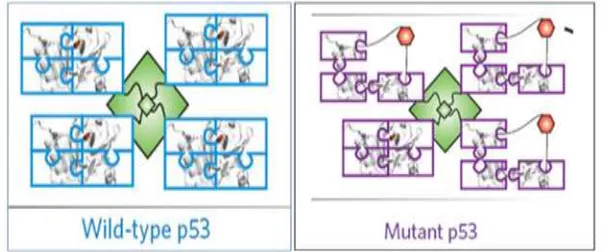
P 53 atau juga dikenal sebagai TP 53, merupakan salah satu gen supresor tumor yang sangat berperan penting pada regulasi siklus sel. Sedemikian pentingnya menjaga stabilitas sel dan menghambat terjadinya mutasi gen, serta mencegah munculnya keganasan, sehingga p 53 juga dikenal sebagai “the guardian of the genome”. Sedangkan nama p 53 itu sendiri, diambil berdasarkan pada berat molekul protein penyusunnya, yaitu 53 kilodalton (Kumar et al, 2015)
Dahulu diduga bahwa p 53 merupakan suatu onkogen, hal ini didasarkan pada banyaknya penelitian yang menemukan jumlah p 53 secara berlebihan pada sel yang mengalami transformasi. Selain itu, sejumlah penelitian juga banyak yang menemukan keberadaan p 53 mampu mempertahankan kehidupan sel dalam kultur untuk terus hidup (imortal). Akan tetapi belakangan baru diketahui bahwa p 53 yang dijumpai pada sel tersebut, merupakan p 53 yang telah mengalami transformasi atau disebut juga dengan p 53 bentuk mutan (Tiwari, 2012)
perbaikan pada DNA yang rusak tersebut tidak memungkinkan terjadi, maka p 53 akan mengarahkan sel dengan DNA yang rusak tersebut pada proses apoptosis (Tiwari, 2012)
P 53 yang di kode oleh sebuah phosphoprotein ini, memiliki bentuk tetramer, sehingga akan terdapat 4 copy molekul identik yang dirakit untuk
membentuk molekul p 53 aktif. Namun konstruksi tetramer pada p 53 ini memiliki beberapa konseksuensi, di antaranya jika terdapat defek pada salah satu molekul p 53 nya (misalnya akibat substitusi asam amino atau defek struktural), maka keadaan ini akan menurunkan fungsi p 53 itu sendiri (Kouvidou, 1995)
Selain itu, bila hanya satu sel saja yang mempunyai p 53 dengan 1 alel normal, sedangkan alel lainnya mengalami defek, maka sebagian besar fungsi p 53 tersebut akan mengalami gangguan. Oleh karena itu, p 53 tersebut hanya akan berfungsi baik jika ke 4 sub unit molekul penyusunnya dalam keadaan normal. Keadaan ini berbeda dengan tumor supresor gen lain yang biasanya akan berada dalam bentuk molekul tunggal bebas, sehingga akan memiliki bentuk yang lebih stabil (Kouvidou, 1995; Tiwari, 2012; Walline et al, 2013)
P 53 sebagai supresor tumor, akan menginduksi berhentinya siklus sel sebagai respon terhadap kerusakan DNA. Umumnya, rendahnya level ekspresi p 53 akan memungkinkan terbentuknya tumor. Pada sebagian besar tumor kepala leher, level ekspresi p 53 yang rendah diakibatkan oleh adanya mutasi p 53 (Chou, 2008)
Gambar 2.16 P 53 Wild Type Dan P 53 Mutan
Namun demikian, gambaran p 53 pada KNF tidak mengikuti pola klasik ini. Pada KNF sering dilaporkan memiliki level ekspresi p 53 yang tinggi, serta memiliki korelasi terhadap tinginya level LMP 1. Pada KNF, p 53 mutasi dilaporkan relatif jarang terjadi, sebagian peneliti bahkan melaporkan ekspresi p 53 wild type. P 53 wild type akan gagal menginduksi apoptosis, hal ini dapat disebabkan oleh 2 mekanisme, yaitu hilangnya p 14 dan kelebihan N p 63. Pada keadaan normal, p 14 akan menjaga stabilitas p 53 dengan menghambat proteolysis. Pada KNF, level p 14 yang rendah dapat diakibatkan adanya promosi
hypermethylation, sehingga akan sangat memungkinkan terjadinya p 53 degradasi
(Chou, 2008; Tsao, 2015).
63, yang diketahui tidak memiliki domain transactivation N terminal yang diperlukan untuk mengaktivasi apoptosis. Isoform N p 63 tetap berikatan dengan urutan-urutan DNA p 63 normal (dan p 53), sehingga p 63 normal atau p 53 tetap akan saling mengikat. Namun demikian, ikatan ini tetap gagal untuk memicu apoptosis, akibat hilangnya domain transactivation N terminal tersebut (Chou, 2008).
Keterangan kerangka teori :
EBV dapat menginfeksi manusia melalui mukosa orofaring/nasofaring dan tonsil. Glikoprotein 350/320 (gp 350/320) yang terdapat pada permukaan EBV, akan berikatan dengan CD 21 pada permukaan limfosit B. Infeksi EBV pada limfosit B ini akan menyebabkan terjadinya infeksi EBV tipe laten. LMP 1 yang terbentuk pada infeksi tipe laten fase 2, terdiri dari beberapa C terminus activating region (CTAR 1 dan CTAR 2). CTAR 1 yang berikatan dengan TRAF, mengaktifkan beberapa sinyal seluler, seperti NF, MAPK inhibitor, STAT 3. Sedangkan CTAR 2 yang berikatan dengan TRIP maupun TRADD selain mampu mengaktifkan NF, juga akan mengaktifkan PI3K. Akibat teraktivasinya NF ini, maka akan menimbulkan gangguan pada beberapa sinyal proliferasi, seperti Bcl 2, cyclooxygenase 2 (Cox 2) dll. Keadaan ini juga akan menyebabkan tidak terjadinya proses apoptosis, akibat gangguan pada p 53. MAP inhibitor juga akan menghambat JNK yang akan menimbulkan gangguan pada p 53. Sedangkan PI3K secara langsung akan memacu pertumbuhan sel tumor. Sedangkan survivin melalui ikatan pada CDK 4 akan berefek sebagai anti apoptosis.
HPV dapat masuk menginfeksi manusia melalui laserasi, abrasi maupun kripte. E 6 yang merupakan bagian onkoprotein pada HPV, terdiri dari beberapa protein yang akan menyebabkan terjadinya ubiquitinition. Ubiquitinition akan menyebabkan munculnya gangguan pada p 53.
H. Kerangka Konsep
Keterangan Kerangka Konsep :
EBV maupun HPV akan menginfeksi mukosa nasofaring/orofaring/tonsil. Melalui proses yang berbeda EBV akan menyebabkan munculnya LMP 1 sedangkan HPV akan menyebabkan munculnya E 6. Baik LMP 1 maupun E 6 akan menyebabkan terjadinya gangguan pada p 53. Gangguan pada p 53 akan menyebabkan kerusakan yang terjadi pada inti sel akan dapat terus berkembang, dan sangat memungkinkan terjadinya keganasan, termasuk diantaranya KNF.
I. Hipotesa
Hipotesa penelitian ini adalah :
a. Terdapat peningkatkan ekspresi p 53 pada penderita KNF undifferentiated di RSUD Dr. Moewardi Surakarta.
b. Terdapat hubungan latent membrane proteins 1 (LMP 1) EBV terhadap ekspresi p 53 pada penderita KNF undifferentiated di RSUD Dr. Moewardi Surakarta.
c. Terdapat hubungan early 6 (E 6) HPV terhadap ekspresi p 53 pada penderita KNF undifferentiated di RSUD Dr. Moewardi Surakarta.
BAB III
METODE PENELITIAN
A. Jenis Penelitian
Jenis penelitian ini merupakan observasional analitik, dengan desain penelitian cross-sectional. Variabel bebas (independent variable) dan variabel tergantung (dependent variable) pada penelitian ini akan dilakukan pengukuran pada saat yang bersamaan, yaitu LMP 1, E 6 dan P 53.
B. Tempat dan Waktu 1. Tempat
a. Poliklinik THT-KL RSUD Dr. Moewardi Surakarta Sub Onkologi b. Laboratorium Patologi Anatomi FK UNS/RSUD Dr. Moewardi
Surakarta untuk pembuatan sediaan blok parafin sampel jaringan. c. Laboratorium Patologi Anatomi FK UGM/RSUP Dr. Sardjito
Yogyakarta untuk pemeriksaan PCR dan pembacaannya. 2. Waktu
Penelitian dilaksanakan sejak bulan Juli s/d Agustus 2017
C. Populasi
1. Definisi Populasi
KNF tipe undifferentiated yang berobat ke poliklinik THT-KL RSUD Dr. Moewardi Surakarta, dengan memenuhi kriteria sebagai berikut, yaitu : Kriteria inklusi :
1. Biopsi jaringan masa nasofaring yang pertama kali dilakukan, dimana secara histopatologi menunjukkan gambaran KNF tipe undifferentiated.
Kriteria eksklusi :
1. Jaringan KNF tipe undifferentiated biopsi evaluasi (yang telah menjalani kemoradioterapi)
2. Besar Sampel
Besar sampel dihitung dengan rumus rancangan sampel cross sectional. Besar sampel yang dihitung berdasarkan uji hipotesa dengan koefisien korelasi (r), menggunakan rumus sebagai berikut (Dahlan S, 2010) :
n = 20,11 + 3, sehingga menjadi = 23,11
Keterangan :
Zβ : Dengan β = 0,20 sehingga Zß = 0,842
Zα : 1,64
ln : Logistik natural
Sampel yang diperlukan sebanyak 23,11, dibulatkan menjadi 23. Perkiraan adanya kerusakan sampel 15%. Maka dibutuhkan sampel 23 + 3,45 = 26,45, dan dibulatkan menjadi 30, sehingga diperlukan sebanyak 30 sampel.
2. Cara Pengambilan Sampel
Pengambilan sampel dilakukan dengan teknik consecutive sampling, menggunakan sampel hasil biopsi pasien KNF undifferentiated yang terdapat pada laboratorium patologi anatomi RSUD Dr. Moewardi Surakarta sejak bulan Juli s/d Agustus 2017
D. Variabel Penelitian
Variabel penelitian terdiri atas :
1. Variabel bebas (independent variable) :
Latent membrane proteins 1 (LMP 1) EBV dan early 6 (E 6) HPV
2. Variabel tergantung (dependent variable) : Ekspresi p 53 pada KNF undifferentiated.
E. Definisi Operasional
1. Latent membrane proteins 1 (LMP 1) EBV
sebagai onkogenik utama pada EBV. Sejumlah penelitian melaporkan terdeteksinya LMP 1 pada KNF sangat bervariasi, namun demikian secara umum konsensus LMP 1 pada KNF hanya sekitar 20%-50% kasus KNF. Walaupun sejumlah ahli menyebutkan bahwa deteksi LMP 1 ini akan sangat tergantung dengan metode pemeriksaan LMP 1 yang akan digunakan (Perez, 2014).
Alat ukur : Polimerase Chain Reaction (PCR) Cara ukur : PCR konvensional
Skala ukur : Nominal Hasil ukur : Positif/Negatif 2. Early 6 (E 6) HPV
Definisi : Early 6 atau E 6 merupakan onkoprotein komplek yang terdapat pada HPV dan memiliki fragmen genom sepanjang 340 bp. E 3 ubiquitin ligase, E 6 associated protein (E6AP), serta ubiquitinates p 53
tumor supresor protein yang terdapat pada E 6, akan dapat membentuk
ubiquitination. Ubiquitination ini diyakini mampu mengakibatkan
terjadinya degradasi pada p 53. Sejumlah penelitian pada KNF melaporkan E 6 dapat terdeteksi hingga 80% pada kasus KNF (Laeeq, 2014).
Alat ukur : Polimerase Chain Reaction (PCR) Cara ukur : PCR konvensional
3. Protein 53 (P 53)
Definisi : Protein 53 atau p 53, merupakan protein yang mempunyai fragmen genom berukuran 216 bp serta memiliki struktur kimia tetramer. Setiap molekul p 53, sangat identik dan berperan penting dalam siklus sel sebagai tumor supresor gen. Gen p 53 pada manusia terletak pada lengan pendek kromosom 17, dan terbentang sepanjang 16 hingga 20 kb DNA, terdiri atas 11 ekson dan hampir dapat diekspresikan pada semua jaringan tubuh. Pada keadaan normal, molekul p 53 akan mampu menghentikan siklus sel pada fase G1/S, repair DNA serta menginduksi proses apoptosis. Pada KNF, selalu terjadi kecenderungan peningkatan ekspresi p 53, walaupun dengan tingkat ekspresi yang bervariasi (Yenita, 2012). Alat ukur : Polimerase Chain Reaction (PCR)
Cara ukur : PCR Real Time Skala ukur : Numerik
Hasil ukur : Angka (milivolt)
F. Pelaksanaan Penelitian 1. Persiapan
a. Mencari dan mengumpulkan bahan kepustakaan.
b. Menghubungi bagian terkait serta mendiskusikan rencana penelitian. 2. Persiapan penelitian
3. Prosedur pemeriksaan polimerase chain reaction (PCR)
Setelah diperoleh blok parafin jaringan KNF undifferentiated, selanjutnya dilakukan pembuatan ekstraksi LMP 1 EBV (DNA), E 6 HPV (DNA) maupun p 53 (RNA) dengan cara memasukkan blok parafin kedalam tabung eppendroff yang berisi larutan 300 μℓ buffer lisis (0,01 M tris HCl, 0,1 M tris NaCl, 0,001 M EDTA, 1% SDS dan 200 ug Proteinase K). Setelah jaringan terlepas dari kaca objek, masing-masing
jaringan tersebut dipisahkan dan selanjutnya diinkubasi selama 3 jam pada suhu 65ºc, DNA selanjutnya di ekstraksi dengan metode fenol-kholoform-amonium oksalat-etanol absolut dingin.
a. Pemeriksaan PCR konvensional LMP 1 EBV (kualitatif)
1. Pada genom DNA 0,25 ug, ditambahkan campuran PCR (12,5 pmol primer 1 dab 2; 200 uM masing dNTP, 1 μℓ Taq DNA polimerase (promega); 10x buffer PCR; 10 μM Tris HCl dan 50
μMKCl.
2. Primer yang digunakan adalah = 5’ -GGC-TGG-TGT-CAC-CTG-TGT-TA-3’; (20mer) = 5’ -CCT-TAG-GAG-GAA-CAA-GTC-CC-3’ (20mer).
elektrophoresis pada agarose 2%, dengan pengecatan ethidium
bromide dibawah sinar U.V (Geneall Exgene Protocols).
b. Pemeriksaan PCR konvensional E 6 HPV (kualitatif)
1. Pada genom DNA 0,25 ug ditambahkan 24 μℓ campuran PCR, meliputi 12,5 pmol primer Gp5 dan Gp6; 250 μM masing-masing dNTP; 10 mM tris HCl; 1,5 mM MgC12; 1 unit Taq DNA polimerase (Promega).
2. Primer E 6 HPV = 5’-GCA-AGO-AAC-AGT-TAC-TGC-GA-3’ (20mer). 5’-CCT-TAG-GAG-GAA-CAA-GTC-CC-3’(20mer). 3. Prosedur PCR 94oc-4 menit, 94oc-1 menit, 55oc-1 menit, 72oc-1
menit, sebanyak 95 siklus, selanjutnya akan menghasilkan fragmen sepanjang 340 bp untuk E 6 HPV. Hasil PCR akan diperoleh dengan melakukan analisa menggunakan metode elektrophoresis pada agarose 2%, dengan pengecatan ethidium
bromide di bawah sinar U.V (Geneall Exgene Protocols)
c. Pemeriksaan PCR Real Time p 53 (kuantitatif)
1. Larutkan hingga homogen 100 mg jaringan dengan 1 ml RiboEx. 2. Primer RNA p 53 : 5’-ATG-GAG-GAG-CCG-CAG-TCA-GAT
(21mer) dan 3’ GCA-GCG-CCT-CAC-AAC-CTC-CGT-C
(22mer).
dengan kecepatan 12.000 rpm selama 10 menit pada suhu 4oc. Setelah selesai pindahkan hasil sentrifus ke dalam fresh tube. 4. Tambahkan 0,2 ml chloroform per 1 ml RiboEx, kocok selama 15
menit, simpan selama 2 menit di suhu ruang. Larutan selanjutnya di sentrifus dengan kecepatan 12.000 rpm selama 15 menit pada suhu 4oc. Setelah selesai pindahkan ke dalam fresh tube.
5. Tambahkan larutan buffer RB1 pada sampel dan campur dengan cara membolak balik tabung fresh tube.
6. Pindahkan sebanyak 700 ul dari sampel diatas kedalam tabung mini spin colomn yang berjumlah 30 buah. Selanjutnya lakukan sentrifus dengan kecepatan 10.000 rpm selama 30 menit.
7. Tambahkan 500 ml buffer SW 1 kedalam setiap tabung mini spin colomn. Selanjutnya lakukan sentrifus dengan 10.000 rpm selama
30 menit pada suhu ruang.
8. Tambahkan 500 ml buffer RNW 1 pada setiap masing tabung mini spin colomn. Selanjutnya lakukan sentrifus dengan kecepatan 10.000 rpm selama 30 menit pada suhu ruang.
9. Lanjutkan dengan melakukan sentrifus dengan 10.000 rpm selama 1 menit pada suhu ruang, selanjutnya pindahkan sampel hasil sentrifus ke dalam mini spin colomn yang baru.
11. Lanjutkan dengan pembacaan pada masing-masing tabung mini spin column. Pembacaan dilakukan dengan menggunakan mesin
PCR RT untuk mengetahui ekpresi p 53 yang terdapat pada setiap masing-masing tabung mini spin column. Gambaran ekspresi p 53 akan tampak pada LCD layar monitor dalam bentuk gelombang (Geneall Exgene Protocols).
G. Analisa Data
Analisa data menggunakan metode deskriptif, metode statistik parametrik regresi linier sederhana dan metode statistik parametrik regresi linier multivariat.
H. Etika Penelitian
I. Alur Penelitian
Keterangan :
: Variabel bebas
: Variabel terikat
: Variabel yang tidak diteliti
Kriteria Inklusi Kriteria Ekslusi
Pemeriksaan PCR Kualitatif (Konvensional)
Jaringan KNF Undifferentiated
Analisis Data Blok Parafin
Pemeriksaan PCR Kualitatif (Konvensional) Pemeriksaan PCR
Kuantitatif (Real Time)
Laten Membran Protein 1 (LMP 1)
EBV
Early 6 (E 6) HPV
BAB IV
HASIL PENELITIAN
Selain dilakukan pemeriksaan PCR konvensional (kualitatif) untuk latent membrane proteins 1 (LMP 1) EBV dan early 6 (E 6) HPV, serta PCR Real Time
(kuantitatif) yang digunakan untuk mengetahui ekspresi p 53, juga dikumpulkan beberapa data tambahan untuk memberikan gambaran karakteristik terhadap subyek pada penelitian.
A. Karakteristik Subyek Penelitian
Secara umum, gambaran karakteristik usia pasien yang menjadi sampel dalam penelitian ini, dapat diketahui dari tabel yang terdapat dalam tabel 4.1.
Tabel 4.1 Karakteristik Usia
Variabel Frekuensi %
Usia
< 40 tahun 2 6.7
40-50 tahun 12 40.0
51-60 tahun 8 26.7
> 60 tahun 8 26.7
Pada tabel tersebut dapat diketahui bahwa, usia terbanyak penderita KNF undifferentiated yang menjadi objek dalam penelitian ini adalah berusia 40-50
terlihat pada tabel 4.2. Jenis kelamin laki-laki berjumlah 21 orang (70%), sedangkan jenis kelamin perempuan berjumlah 9 orang (30%).
Tabel 4.2 Karakteristik Jenis Kelamin
Variabel Frekuensi %
Jenis Kelamin
Perempuan 9 30.0
Laki-laki 21 70.0
Sedangkan berdasarkan AJCC, sampel yang menjadi objek pada penelitian ini, seluruhnya merupakan pasien KNF undifferentiated stadium lanjut (III atau IV). Pada tabel 4.3 dapat diketahui secara rinci.
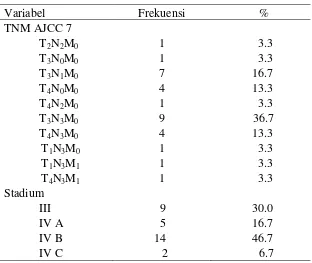
Tabel 4.3 Karakteristik TNM AJCC 7 dan Stadium KNF
Variabel Frekuensi %
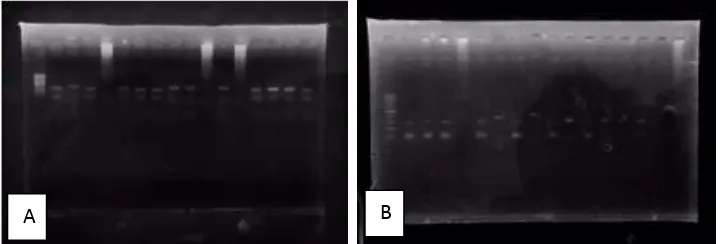
EBV negatif. Pada tabel 4.4 terlihat bahwa LMP 1 EBV positif berjumlah sebanyak 16 sampel, sedangkan LMP 1 EBV negatif berjumlah sebanyak 14 sampel. Hal ini juga sama dengan hasil pemeriksaan PCR untuk HPV, dimana E 6 HPV positif lebih banyak dibandingkan dengan E 6 HPV negatif.
Gambar 4.1 A. Hasil Pemeriksaan PCR Konvensional LMP 1 EBV; B. Hasil Pemeriksaan PCR Konvensional E 6 HPV
Pada tabel 4.4 terlihat bahwa E 6 HPV positif berjumlah sebanyak 18 sampel, sedangkan E 6 HPV negatif berjumlah sebanyak 12 sampel.
Tabel 4.4 Hasil Pemeriksaan LMP 1 EBV dan E 6 HPV
Variabel Frekuensi %
LMP1
Negatif 14 46.7
Positif 16 53.3
E 6
Negatif 12 60.0
Positif 18 40.0
C. Hasil Pemeriksaan Ekspresi P 53
Berdasarkan dari hasil pemeriksaan polimerase chain reaction real time (PCR RT), hasil ekspresi p 53 pada penelitian ini dapat dilihat pada tabel 4.2.
Nilai ekspresi p 53 pada penelitian ini, diperoleh berdasarkan hasil pemeriksaan PCR RT dan perhitungan rumus 2 (-CT). Rumus 2 (-CT) merupakan
nilai perhitungan selisih antara ekspresi p 53 sampel jaringan KNF dengan ekspresi p 53 pada jaringan normal. Nilai ekspresi p 53 pada jaringan normal ( CT) adalah 2,4, yang diperoleh dari pemeriksaan pada mukosa nasofaring orang sehat.
Gambar 4.2 Pemeriksaan PCR RT Ekspresi P 53
Berdasarkan hasil pemeriksaan dan perhitungan tersebut (tabel 4.5), maka didapatkan nilai rata-rata ekspresi p 53 dari seluruh sampel pasien KNF undifferentiated dalam penelitian ini sebesar 11,09 dengan standar deviasi 10,18.
Oleh karena itu dapat disebutkan bahwa, ekspresi p 53 dari 30 sampel yang digunakan dalam penelitian ini terjadi peningkatan sebesar 11,09.
Tabel 4.5 Hasil Pemeriksaan Ekspresi P 53
Variabel Frekuensi Mean + SD
Ekspresi P 53 30 11.09 + 10.18
D. Hubungan Antara LMP 1 EBV Terhadap Ekspresi P 53
Secara umum, hubungan antara LMP 1 EBV terhadap ekspresi p 53, dapat terlihat pada tabel 4.6.
KNF dengan LMP 1 EBV positif memiliki ekspresi p 53 rata-rata sebesar 15,27 dengan SD 11,98.
Tabel 4.6 Hubungan LMP 1 EBV Terhadap Ekspresi P 53
LMP 1 P 53 P
Mean Std. Deviation
Negatif 6.32 4.44 0,070
Positif 15.27 11.98
Total 11.09 10.19
Uji Mann Whitney (Data tidak berdistribusi normal)
Berdasarkan perhitungan diatas, maka dapat disebutkan bahwa ada kecenderungan pasien dengan LMP 1 EBV positif memiliki ekspresi p 53 yang lebih tinggi dibandingkan pasien LMP 1 EBV negatif. Sedangkan berdasarkan hasil uji statistik menggunakan mann whitney didapatkan nilai p = 0,070, hal ini berarti bahwa terdapat pengaruh yang signifikan antara LMP 1 EBV terhadap ekspresi p 53.
Gambar 4.3. Deskripsi Hubungan Antara LMP 1 Terhadap Ekspresi P53
E. Hubungan Antara E 6 HPV Terhadap Ekspresi P 53
dengan E 6 HPV positif memiliki ekspresi p 53 rata-rata sebesar 12,46 dan SD sebesar 10,30.
Tabel 4.7 Hubungan E 6 HPV Terhadap Ekspresi P 53
E6 P53 P
Mean Std. Deviation
Negatif 9.03 10.10 0,127
Positif 12.46 10.30
Total 11.09 10.19
Uji Mann Whitney (Data tidak berdistribusi normal)
Berdasarkan perhitungan diatas, maka dapat disebutkan bahwa terdapat kecenderungan pasien dengan E 6 HPV positif memiliki ekspresi p 53 yang lebih tinggi dibandingkan dengan E 6 HPV positif. Namun pada hasil uji statistik mann whitney didapatkan nilai p = 0,127, hal ini berarti bahwa tidak terdapat pengaruh
yang signifikan antara E 6 HPV terhadap ekspresi P53.
Gambar 4.4 Deskripsi Hubungan Antara E 6 Terhadap Ekspresi P 53
F. Hubungan Antara Usia Terhadap Ekspresi P 53
sebesar 13.81 dengan SD 9.52, dan pasien dengan usia > 60 tahun memiliki ekspresi p 53 rata-rata sebesar 15.36 dengan SD sebesar 11,62.
Tabel 4.8 Hubungan Antara Usia Terhadap Ekspresi P 53
Usia P53 P
Mean Std. Deviation
< 40 tahun 6.25 5.10 0,125 40-50 tahun 7.24 9.40
51-60 tahun 13.81 9.52 > 60 tahun 15.36 11.62
Total 11.09 10.19
Uji Kruskal Wallis (Data tidak berdistribusi normal)
Berdasarkan uraian diatas, maka dapat disebutkan bahwa terdapat kecenderungan semakin meningkatnya jumlah usia, maka akan semakin memiliki ekspresi p 53 yang tinggi. Namun demikian, berdasarkan hasil uji statistik Kruskal Wallis, didapatkan nilai p = 0,125 yang berarti bahwa tidak terdapat pengaruh
yang signifikan antara usia terhadap ekspresi p 53.
Gambar 4.5 Deskripsi Hubungan Antara Usia Terhadap Ekspresi P 53
G. Hubungan Antara Jenis Kelamin Terhadap Ekspresi P 53
Sedangkan pasien dengan jenis kelamin laki-laki memiliki ekspresi p 53 rata-rata sebesar 10,26 dengan SD sebesar 9.89.
Tabel 4.9 Hubungan Antara Jenis Kelamin Terhadap Ekspresi P 53
Jenis Kelamin P53 P
Mean Std. Deviation
Perempuan 12.96 11.23 0,651
Laki-laki 10.29 9.89
Total 11.09 10.19
Uji Mann Whitney (Data tidak berdistribusi normal)
Berdasarkan uraian diatas, maka terdapat kecenderungan bahwa pasien dengan jenis kelamin perempuan cederung memiliki ekspresi p 53 yang lebih tinggi dibandingkan dengan laki-laki. Namun bila berdasarkan pada hasil uji statistik mann whitney, didapatkan bahwa nilai p = 0,651. Hal ini dapat berarti bahwa tidak terdapat pengaruh yang signifikan antara jenis kelamin terhadap ekspresi p 53.
Gambar 4.6 Deskripsi Hubungan Jenis Kelamin Terhadap Ekspresi P 53
H. Hubungan Antara Stadium KNF Terhadap Ekspresi P 53
sebesar 8,95 dengan SD sebesar 12,12. Pasien KNF tipe undifferentiated stadium IV B memiliki ekspresi p 53 rata-rata sebesar 13,29 dengan SD sebesar 11,75. Sedangkan pasien KNF tipe undifferentiated dengan stadium IV C akan memiliki ekspresi p 53 rata-rata sebesar 13.53 dengan SD 1,98.
Tabel 4.10 Hubungan Antara Stadium KNF Terhadap Ekspresi P 53
Stadium P53 P
Uji Kruskal Wallis (Data tidak berdistribusi normal)
Berdasarkan uraian diatas, maka terdapat kecenderungan bahwa semakin tinggi tingkat stadium KNF, maka akan memiliki kecenderungan semakin meningkat ekspresi p 53. Namun demikian, berdasarkan hasil uji statistik Kruskal Wallis didapatkan nilai p = 0,375. Hal ini dapat berarti bahwa tidak terdapat
pengaruh yang signifikan antara tingkat stadium terhadap ekspresi p 53.
I. Hubungan LMP 1 EBV dan E 6 HPV Terhadap Ekspresi P 53
Regresi linier sederhana dengan prediktor dummy digunakan untuk mengidentifikasi hubungan antara LMP 1 EBV dan E 6 HPV terhadap ekspresi p 53 pada penderita KNF undifferentiated.