i SKRIPSI
PENGARUH Co(II) PADA ANALISIS
BESI(III) DENGAN PENGOMPLEKS
1,10-FENANTROLIN PADA pH 3,5 SECARA
SPEKTROFOTOMETRI UV-VIS
Novianti Tri Kusuma Wardani NRP. 1412 100 076
Dosen Pembimbing
Drs. R. Djarot Sugiarso K.S, M.S Suprapto, M.Si., Ph.D.
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT TEKNOLOGI SEPULUH NOPEMBER SURABAYA
i SKRIPSI
PENGARUH Co(II) PADA ANALISIS
BESI(III) DENGAN PENGOMPLEKS
1,10-FENANTROLIN PADA pH 3,5 SECARA
SPEKTROFOTOMETRI UV-VIS
Novianti Tri Kusuma Wardani NRP. 1412 100 076
Dosen Pembimbing
Drs. R. Djarot Sugiarso K.S, M.S Suprapto, M.Si., Ph.D.
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT TEKNOLOGI SEPULUH NOPEMBER SURABAYA
ii SCRIPT
EFFECT OF Co(II) ON ANALYSIS
IRON(III) WITH 1,10-PHENANTROLIN
COMPLEX AT pH 3,5 BY
SPECTROPHOTOMETRY UV-VIS
Novianti Tri Kusuma Wardani NRP. 1412 100 076
Supervisor
Drs. R. Djarot Sugiarso K.S, M.S Suprapto, M.Si., Ph.D.
CHEMISTRY DEPARTMENT
FACULTY OF MATHEMATICS AND NATURAL SCIENCES
SEPULUH NOPEMBER INSTITUTE OF TECHNOLOGY SURABAYA
iii
PENGARUH Co(II) PADA ANALISIS BESI(III) DENGAN PENGOMPLEKS 1,10-FENANTROLIN PADA pH 3,5 SECARA SPEKTROFOTOMETRI
UV-VIS
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Sains
pada
Program Studi S-1 Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Teknologi Sepuluh Nopember
Surabaya
Oleh:
NOVIANTI TRI KUSUMA WARDANI NRP. 1412 100 076
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT TEKNOLOGI SEPULUH NOPEMBER SURABAYA
v
PENGARUH Co(II) PADA ANALISIS BESI(III) DENGAN PENGOMPLEKS 1,10-FENANTROLIN PADA pH 3,5 SECARA SPEKTROFOTOMETRI
UV-VIS
Nama : Novianti Tri Kusuma Wardani
NRP : 1412100076
Jurusan : Kimia FMIPA-ITS
Dosen Pembimbing I : Drs. R. Djarot Sugiarso K.S, M.S Dosen Pembimbing II : Suprapto, M.Si., Ph.D.
ABSTRAK
Penelitian mengenai pengaruh Co(II) pada analisis besi(III) dengan pengompleks 1,10-fenantrolin pada pH 3,5 telah dilakukan secara spektrofotometri UV-Vis. Kompleks Fe(III)-Fenantrolin memiliki panjang gelombang maksimum 363 nm. Koefisien korelasi (r) yang diperoleh pada kurva kalibrasi adalah 0,997. Hasil analisis menunjukkan bahwa ion Co(II) mulai mengganggu kompleks Fe(III)-Fenantrolin pada konsentrasi 0,4 ppm dengan nilai persen (%) recovery sebesar 72,05%, nilai standar deviasi relatif (RSD) sebesar 16,36 ppt, dan nilai koefisien variasi (CV) sebesar 1,6%.
vi
SPECTROPHOTOMETRY UV-VIS
Name : Novianti Tri Kusuma Wardani
NRP : 1412100076
Department : Chemistry – ITS
Supervisor I : Drs. R. Djarot Sugiarso K.S, M.S Supervisor II : Suprapto, M.Si., Ph.D.
ABSTRACT
Research on the effect of Co (II) on analysis iron (III) with 1,10-fenantrolin complex at pH 3.5 has been carried out by UV-Vis spectrophotometry. Complex Fe (III) -Fenantrolin has maximum wavelength at 363 nm. The correlation coefficient (r) obtained in the calibration curve was 0.997. The analysis showed that the ion Co (II) complexes begin to interfere Fe(III)-Fenantrolin at a concentration 0,4 ppm with a value percent (%) recovery as 72,05%, the relative standard deviation (RSD) as 16.36 ppt, and the coefficient of variation (CV) as 1,6%.
vii
KATA PENGANTAR
Segala puji bagi Allah SWT yang telah melimpahkan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan tugas akhir ini yang berjudul “PENGARUH Co(II) PADA ANALISIS BESI(III) DENGAN PENGOMPLEKS 1,10-FENANTROLIN PADA pH 3,5 SECARA SPEKTROFOTOMETRI UV-VIS” dapat diselesaikan dengan baik. Tulisan ini terwujud berkat bimbingan, bantuan dan dukungan dari berbagai pihak. Oleh karena itu, penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Drs. R. Djarot Sugiarso K.S, M.S, selaku Dosen Pembimbing I dan Dosen Pembimbing II Suprapto, M.Si., Ph.D yang telah memberikan bimbingan serta pengarahan dalam proses penulisan naskah.
2. Dr. rer. nat. Fredy Kurniawan, M.Si, selaku Kepala Laboratorium Instrumen dan Sains Analitik sekaligus sebagai dosen wali atas semua pengarahannya.
3. Prof.Dr. Didik Prasetyoko, S.Si., M.Sc., selaku Ketua Jurusan Kimia ITS yang telah membantu secara administrasi.
4. Keluarga tercinta yang selalu memberi dukungan dan doa. 5. Icha dan Sugi yang setia menyemangati dan memberikan
motivasi.
6. Teman-teman SPECTRA, dan warga laboratorium Instrumen dan Sains analitik yang telah memberikan motivasi.
Jika terdapat kesalahan dalam penulisan naskah ini, penulis menerima kritik dan saran yang membangun untuk meningkatkan kualitas dan perbaikan lebih lanjut.
Surabaya, 31 Januari 2017 Penulis
viii
LEMBAR PENGESAHAN ... iv
ABSTRAK ... v
ABSTRACT ... vi
KATA PENGANTAR ... vii
DAFTAR ISI ... viii
DAFTAR GAMBAR ... xi
DAFTAR TABEL ... xii
DAFTAR LAMPIRAN ... xiii
BAB I ... 1 PENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Permasalahan ... 4 1.3 Batasan Masalah ... 4 1.4 Tujuan Penelitian ... 4 1.5 Manfaat Penelitian ... 4 BAB II ... 5 TINJAUAN PUSTAKA ... 5 2.1. Besi ... 5 2.2. Senyawa Kompleks ... 7 2.3. Senyawa 1,10-Fenantrolin ... 8
2.4. Kompleks Besi(III) Fenantrolin ... 8
2.5. Ion Pengganggu ... 10
2.6. Kobalt(II) ... 10
ix
2.8. Validasi Metode Analisis ... 13
2.8.1. Presisi ... 14
2.8.2. Akurasi ... 15
2.8.3. Regresi Kurva Kalibrasi ... 16
BAB III ... 17
METODOLOGI PENELITIAN ... 17
3.1. Alat dan Bahan ... 17
3.1.1. Alat ... 17
3.1.2. Bahan ... 17
3.2. Prosedur Kerja ... 17
3.2.1. Pembuatan Larutan Standar Fe3+ 100 ppm... 17
3.2.2. Pembuatan Larutan Co2+ 100 ppm ... 17
3.2.3. Pembuatan Larutan Buffer Asetat pH 3,5 ... 18
3.2.4. Pembuatan Larutan 1,10-Fenantrolin 1000 ppm ... 18
3.2.5. Pembuatan Larutan Blanko ... 18
3.2.6. Penentuan Panjang Gelombang Maksimum Kompleks Fe(III)-Fenantrolin ... 18
3.2.7.Penentuan Panjang Gelombang Maksimum ... 19
Co(II)-Fenantrolin ... 19
3.2.8. Pembuatan Kurva Kalibrasi ... 19
3.2.9. Pengaruh Ion Co2+ pada Analisa Fe3+ pada pH 3,5 ... 20
BAB IV ... 21
HASIL DAN PEMBAHASAN ... 21
4.1 Penentuan Panjang Gelombang Maksimum Kompleks Fe(III)-Fenantrolin ... 21
x
4.3 Pembuatan Kurva Kalibrasi ... 26
4.4 Pengaruh Ion Co2+ pada Analisa Fe3+ pada pH 3,5 ... 28
BAB V ... 35
KESIMPULAN ... 35
5.1. Kesimpulan ... 35
DAFTAR PUSTAKA ... 37
xi
DAFTAR GAMBAR
Gambar 2.1 Struktur 1,10-fenantrolin ... 8 Gambar 2.2 Struktur Oktahedral Fe(III) fenantrolin ... 9 Gambar 2.3 Komponen Spektrofotometer UV-Vis ... 12 Gambar 4. 1 Panjang Gelombang Maksimum (λmaks)
Fe(III)-Fenantrolin pada rentang 329 – 400 nm dengan interval 1 nm ... 22 Gambar 4. 2 Panjang Gelombang Maksimum (λmaks)
Co(II)-Fenantrolin pada rentang 329 – 400 nm dengan interval 1 nm ... 25 Gambar 4. 3 Struktur Segiempat Planar Co(II)-Fenantrolin ... 26 Gambar 4. 4 Kurva Kalibrasi Kompleks Fe(III)-Fenantrolin ... 27 Gambar 4. 5 Titik Potong antara Fe(III)-Fenantrolin dengan
Co(II)-Fenantrolin ... 29 Gambar 4. 6 Pengaruh Ion Co2+ terhadap Absorbansi
Fe(III)-Fenantrolin... 33 Gambar 4. 7 Pengaruh Ion Co2+ terhadap Prosentase Recovery
xii
Tabel 2.1 Sifat Fisik Besi ... 6 Tabel 2.2 Sifat Kimia Besi ... 6 Tabel 2.3 Sifat Lain-lain Besi ... 7 Tabel 4. 1 Data Absorbansi Pada Kompleks Fe(III)-Fenantrolin
Setelah Penambahan Ion
Co2+...31 Tabel 4. 2 Data Perhitungan Konsentrasi Fe(III) Terukur, % recovery, Standar Deviasi Relatif (RSD) dan Koefisien Variasi (CV) ... ...31
xiii
DAFTAR LAMPIRAN LAMPIRAN A
SKEMA KERJA ... 41
A.1 Pembuatan Larutan Standar Fe3+ 100 ppm ... 41
A.2 Pembuatan Larutan Co2+ 100 ppm ... 41
A.3 Pembuatan Larutan Buffer Asetat pH 3,5 ... 42
A.4 Pembuatan Larutan 1,10-Fenantrolin 1000 ppm ... 42
A.5 Pembuatan Larutan Blanko ... 43
A.6 Penentuan Panjang Gelombang Maksimum Kompleks Besi(III)-Fenantrolin ... 44
A.7 Penentuan Panjang Gelombang Maksimum Kobalt(II)-Fenantrolin ... 45
A.8 Pembuatan Kurva Kalibrasi ... 46
A.9 Pengaruh Ion Co2+ pada Analisa Fe3+ pada pH 3,5 ... 47
LAMPIRAN B PERHITUNGAN PEMBUATAN LARUTAN ... 49
B.1 Pembuatan Larutan Standar Fe3+ 100 ppm ... 49
B.2 Pembuatan Larutan Co2+ 100 ppm ... 49
B.3 Pembuatan Larutan Buffer Asetat pH 3,5 ... 50
B.4 Pembuatan Larutan 1,10-Fenantrolin 1000 ppm ... 52
LAMPIRAN C DATA HASIL PENELITIAN ... 53
C.1 Data Absorbansi Penentuan Panjang Gelombang Maksimum Kompleks Fe(III)-Fenantrolin ... 53
C.2 Data Absorbansi Penentuan Panjang Gelombang Maksimum Co(II)-Fenantrolin ... 55
xiv LAMPIRAN D
PERHITUNGAN DATA STATISTIKA ... 61 D.1 Perhitungan Persamaan Regresi Linier Kurva Kalibrasi .. 61 D.2 Perhitungan Koefisien Korelasi Kurva Kalibrasi ... 63 D.3 Perhitungan Konsentrasi dan Persen Recovery ... 64 D.4 Perhitungan Standar Deviasi (S), Standar Deviasi
xv
Karya ini aku persembahkan untuk Ibu, Bapak, dan semua keluarga tercinta Serta sahabat dalam suka maupun duka Icha, Kak Mimi, Fitrie, Debo, Lala, Wikke, Dika, Erni, dan Tetha
1 BAB I PENDAHULUAN 1.1 Latar Belakang
Penentuan besi sangat penting dilakukan untuk mengurangi pencemaran dilingkungan dan baik dalam proses industri. Dalam proses industri, senyawa kimia yang merupakan komoditas skala industri mempunyai rumus kimia yaitu besi(III) klorida (FeCl3). Senyawa ini umum digunakan dalam pengolahan limbah, produksi air minum maupun sebagai katalis. Salah satu contohnya adalah industri besi baja, logam besi(III) sebagai fotokatalis, dan lain sebagainya (Brezova dan Hoffman, 1995).
Metode analisis yang tepat diperlukan untuk menjamin mutu data yang diperoleh. Kadar besi dapat dianalisis dengan menggunakan metode gravimetri, volumetri, spektrofotometri serapan atom (AAS) dan spektrofotometri sinar tampak (UV-Vis). Macam-macam metode analisis masing-masing memiliki kelebihan dan kekurangan. Pada metode gravimetri kelebihannya yaitu pengotor dalam sampel dapat diketahui, mudah dilakukan, hasil analisisnya spesifik dan akurat, presisi dan sensitif, sedangkan kelemahan metode ini adalah membutuhkan waktu yang cukup lama. Pada metode volumetri kelebihannya yaitu mudah dilakukan dan larutan standar primer mudah didapat, sedangkan kelemahan metode ini adalah keakuratan hasil titrasi amat bergantung pada keakuratan penentuan konsentrasi larutan standar. Kemudian pada metode spektrofotometri serapan atom (AAS), kelebihannya yaitu kepekaan lebih tinggi, sistemnya relatif mudah dan dapat memilih temperatur yang dikehendaki, sedangkan kelemahan metode ini adalah hanya dapat digunakan untuk larutan dengan konsentrasi rendah, memerlukan jumlah larutan yang relatif besar (10-15 mL) dan efisiensi nebulizer untuk membentuk aerosol rendah. Dan
pada metode spektrofotometri sinar tampak (UV-Vis), kelebihannya yaitu panjang gelombang dari sinar putih dapat lebih terseleksi, caranya sederhana dan dapat menganalisa larutan dengan konsentrasi yang sangat kecil, sedangkan kelemahan metode ini adalah absorbsi dipengaruhi oleh pH larutan, suhu dan adanya zat pengganggu dan kebersihan dari kuvet, hanya dapat dipakai pada daerah ultra violet yang panjang gelombang > 185 nm, pemakaian hanya pada gugus fungsional yang mengandung elektron valensi dengan energi eksitasi rendah dan sinar yang dipakai harus monokromatis. Penentuan kadar besi secara spektrofotometri UV-Vis telah banyak dilakukan karena prosesnya cepat, mudah dan murah. Besi(II) atau besi(III) yang akan dianalisis terlebih dahulu dikomplekskan dengan pengompleks besi yang membentuk suatu warna spesifik (Vogel, 1985). Senyawa yang biasa digunakan untuk pengompleks besi yaitu 1,10-fenantrolin, batofenantrolin, ferrozine, formaldoxime, dan lain sebagainya. Senyawa pengompleks besi yang sering digunakan adalah 1,10-fenantrolin karena dapat membentuk kompleks yang stabil (Underwood, 1993).
Penelitian sebelumnya, dilakukan analisa besi dengan menggunakan pengompleks 1,10-fenantrolin. Besi dalam senyawa memiliki bilangan oksidasi +2 dan +3. Besi yang umum digunakan adalah besi dengan bilangan oksidasi +2. Secara umum, Fe2+ diperoleh dari Fe3+ yang direduksi oleh natrium thiosulfat (Na2S2O3) pada penelitian yang berjudul “Studi Gangguan Nikel pada Analisa Besi dengan Pengompleks 1,10-Fenantrolin pada pH 4,5 secara Spektrofotometri UV-Vis” (Wulandari, 2009). Hasil menunjukkan bahwa ion Ni(II) mulai mengganggu analisa besi pada konsentrasi 0,08 ppm dengan persen recovery sebesar 82,93%. Selanjutnya, penelitian dilakukan oleh Aditya Pramanasyah A (2009) yang berjudul “Studi Gangguan Co pada Analisa Besi dengan Pengompleks 1,10-Fenantrolin pada pH 4,5 secara Spektrofotometri UV-Vis”
3 menunjukkan bahwa ion Co2+ mulai mengganggu dalam analisis kompleks Fe(II)-Fenantrolin pada konsentrasi 0,2 ppm dengan nilai %recovery sebesar 94,11%. Kemudian, Sofia (2014) melakukan penelitian yang berjudul “Analisis Gangguan Kalsium pada Besi dengan kondisi pH 4,5 menggunakan Pengompleks 1,10-Fenantrolin dengan Spektrofotometer UV-Vis” menunjukkan bahwa ion Ca(II) mengganggu dengan cara menurunkan nilai absorbansi besi sehingga diperoleh persen recovery sebesar 94,70%, RSD sebesar 2,15 ppt dan CV sebesar 0,215%.
Penelitian dengan menggunakan Fe2+ telah banyak digunakan maka dilakukan penelitian lain dengan menggunakan Fe3+ sehingga tidak diperlukan proses reduksi. Penelitian diawali oleh Ricma Dewi (2014) dalam judul “Penentuan Kondisi Optimum pada Pembentukan Kompleks Fe(III) Fenantrolin dengan Spektrofotometri UV-Vis”, diperoleh hasil bahwa Fe(III) Fenantrolin memiliki panjang gelombang maksimum 360 nm dengan pH optimum 3,5 dan stabil dalam waktu 20 menit. Penelitian selanjutnya berjudul “Studi Gangguan Cu2+
pada Analisa Besi(III) dengan Pengompleks 1,10-Fenantrolin pada pH 3,5 secara Spektrofotometri UV-Vis” yang dilakukan oleh Steven Wang (2015), menunjukkan bahwa ion Cu(II) mulai mengganggu besi(III) pada konsentrasi 0,3 ppm dengan nilai recovery sebesar 64,42%, menurunkan nilai presisi yang ditandai dengan nilai RSD sebesar 203,4 ppt dan nilai CV sebesar 20,34%.
Berdasarkan penelitian sebelumnya mengenai studi gangguan Co(II) pada analisa besi(II) dengan pengompleks 1,10-fenantrolin pada pH 4,5 secara spektrofotometri UV-Vis, maka dalam penelitian ini akan dilakukan analisa pengaruh Co(II) pada analisis besi(III) dengan pengompleks 1,10-fenantrolin pada pH 3,5 secara spektrofotometri UV-Vis untuk mengetahui pengaruh penambahan ion Co2+ pada kompleks besi(III)-fenantrolin.
1.2 Permasalahan
Permasalahan dalam penelitian ini adalah bagaimana pengaruh Co(II) pada analisis besi(III) dengan pengompleks 1,10-fenantrolin pada pH 3,5 secara spektrofotometri UV-Vis. 1.3 Batasan Masalah
Batasan masalah dalam penelitian ini adalah penelitian dilakukan menggunakan larutan standar Fe3+ konsentrasi 5 ppm, larutan Co2+ konsentrasi 0,0 – 0,6 ppm, dan penentuan panjang gelombang maksimum pada rentang 329 – 400 nm.
1.4 Tujuan Penelitian
Tujuan dalam penelitian ini adalah untuk mengetahui pengaruh Co(II) pada analisis besi(III) dengan pengompleks 1,10-fenantrolin pada pH 3,5 secara spektrofotometri UV-Vis. 1.5 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat menjadi salah satu solusi untuk menganalisis kandungan logam besi dengan adanya ion Co2+ secara spektrofotometri UV-Vis pada limbah cair proses pengolahan dalam industri pembuatan baja.
5 BAB II
TINJAUAN PUSTAKA 2.1. Besi
Besi merupakan salah satu unsur logam transisi golongan VIII B yang mudah ditempa, mudah dibentuk, berwarna putih perak, dan mudah dimagnetisasi pada suhu normal. Logam besi ini mempunyai massa atom 55,847 sma, nomor atom 26, jari-jari atom 1,26 Å, titik lebur 1808° K, titik didih 3023° K, dan dalam senyawa mempunyai bilangan oksidasi +2 dan +3. Logam besi terdapat dalam tiga bentuk, yaitu α-iron (alfa-iron), γ-iron (gama-iron), dan δ-iron (delta-iron). Perbedaan dari tiap bentuk besi tersebut adalah dari susunan atom-atom pada sisi kristalnya. Secara kimia besi merupakan logam yang cukup efektif, hal ini karena besi dapat bersenyawa dengan unsur lain, seperti unsur-unsur halogen (fluorin, klorin, bromin, iodin, dan astatin), belerang, fosfor, karbon, oksigen dan silikon (Sunardi, 2006).
Keberadaan besi pada kerak bumi menempati posisi keempat terbesar dan merupakan logam yang terpenting dalam industri, salah satunya sering dipadukan dengan baja. Di alam, besi terdapat dalam bentuk senyawa-senyawa antara lain sebagai hematit (Fe2O3), magnetik (Fe3O4), pirit (FeS2), dierit (FeCO3), ferri klorida (FeCl3) dan lainnya. Senyawa besi pada umumnya bersifat sukar larut dan cukup banyak terdapat didalam tanah, namun senyawa dierit (FeCO3) memiliki sifat mudah larut dalam air (Sunardi, 2006).
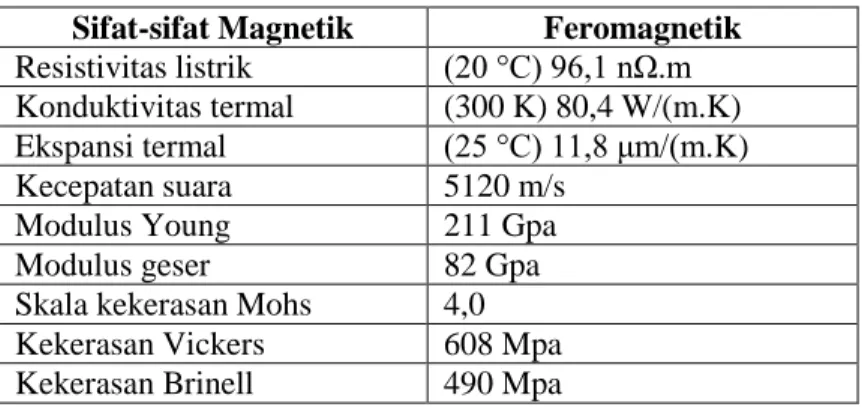
Secara garis besar, besi mempunyai dua sifat yaitu sifat fisika dan sifat kimia, dapat dilihat pada Tabel 2.1 dan 2.2:
Tabel 2.1 Sifat Fisik Besi Ciri – ciri Fisik
Bau Tidak Berbau
Kepadatan 7,86 (Air = 1)
Massa jenis (sekitar suhu kamar) 7,86 g/cm3 Massa jenis cair pada titik lebur 6,98 g/cm3
Titik lebur 1811° K (1538 °C,
2800 °F)
Titik didih 3134° K (2861 °C,
5182 °F)
Kalor peleburan 3134° K
Kalor penguapan 340 kJ/mol
Kapasitas kalor (25 °C) 25,10 J/
(mol.K)
(Sunardi, 2006) Tabel 2.2 Sifat Kimia Besi
Keterangan Umum Unsur
Nama, Lambang, Nomor atom Besi, Fe, 26
Deret kimia Logam transisi
Golongan, Periode, Blok 8, 4, d
Penampilan Metalik mengkilap
keabu-abuan
Massa atom 55,845 g/mol
Konfigurasi electron [18Ar] 3d6 4s2 Jumlah elektron tiap kulit 2, 8, 14, 2
(Sunardi, 2006) Sifat-sifat besi diantaranya adalah
1. Mempunyai daya hantar listrik dan panas yang baik, karena memiliki ikatan ganda dan ikatan kovalen logam.
2.
Besi murni cukup reaktif. Dalam udara lembab cepat teroksidasi membentuk besi(III) oksida hidrat.7
Selain sifat-sifat diatas besi juga memiliki sifat lainnya yang ditunjukkan pada Tabel 2.3:
Tabel 2.3 Sifat Lain-lain Besi
Sifat-sifat Magnetik Feromagnetik Resistivitas listrik (20 °C) 96,1 nΩ.m Konduktivitas termal (300 K) 80,4 W/(m.K) Ekspansi termal (25 °C) 11,8 μm/(m.K)
Kecepatan suara 5120 m/s
Modulus Young 211 Gpa
Modulus geser 82 Gpa
Skala kekerasan Mohs 4,0 Kekerasan Vickers 608 Mpa Kekerasan Brinell 490 Mpa
(Sunardi, 2006) 2.2. Senyawa Kompleks
Senyawa kompleks merupakan senyawa yang tersusun dari suatu ion pusat berupa ion logam dengan satu atau lebih ligan yang menyumbangkan pasangan elektron bebasnya kepada ion pusat. Donasi pasangan elektron ligan kepada ion pusat menghasilkan ikatan kovalen koordinasi sehingga senyawa kompleks juga disebut senyawa koordinasi (Cotton dan Wilkinson, 1984). Jadi semua senyawa kompleks atau senyawa koordinasi adalah senyawa yang terjadi karena adanya ikatan kovalen koordinasi antara logam transisi dengan satu atau lebih ligan (Sukardjo, 1989). Senyawa kompleks sangat berhubungan dengan asam dan basa lewis dimana asam lewis adalah senyawa yang dapat bertindak sebagai penerima pasangan bebas sedangkan basa lewis adalah senyawa yang bertindak sebagai penyumbang pasangan elektron (Shriver. D. F, 1990). Senyawa kompleks
dapat diuraikan menjadi ion kompleks, dimana ion kompleks merupakan ion yang bermuatan positif atau negatif yang terdiri dari sebuah atom pusat dan ligan. Ion pusat memiliki berbagai bilangan oksidasi mulai dari nol maupun positif. Sedangkan ligan dapat bermuatan netral maupun negatif (Prakash, 2001).
2.3. Senyawa 1,10-Fenantrolin
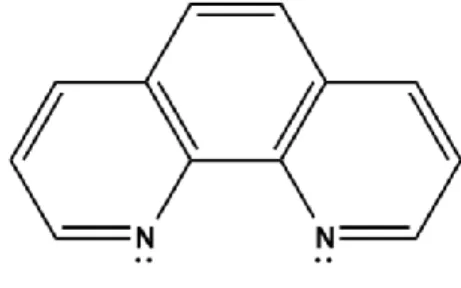
Senyawa 1,10-fenantrolin (phen) sering dijumpai dalam bentuk monohidratnya, dengan rumus molekul C12H8N2.H2O. Phen merupakan bubuk kristal berwarna putih, mempunyai titik leleh antara 98° C - 100° C, berat molekul 198,23 g/mol. Phen dapat membentuk molekul anhidratnya pada suhu 117° C. Phen larut dalam air, benzena, alkohol, aseton, kloroform (Ueno, 1992). Phen merupakan ligan chelat karena dapat membentuk kompleks dengan struktur lingkar (Considine and Considine, 1994). Struktur senyawa 1,10-fenantrolin dapat dilihat pada Gambar 2.1.
Gambar 2.1 Struktur 1,10-fenantrolin 2.4. Kompleks Besi(III) Fenantrolin
Kompleks besi(III) dari senyawa organik 1,10-fenantrolin disebut dengan indikator ferrin. Indikator ferrin dapat dibuat dengan mencampurkan FeCl3.6H2O dan 1,10-fenantrolin dalam kuantitas yang ekivalen. Kompleks besi(III) fenantrolin merupakan kompleks yang tidak stabil karena
9 disebabkan adanya orbital-d pada besi yang tidak memiliki pasangan elektron.
Konfigurasi Elektron dan hibridisasi pada logam besi: 26Fe = [18Ar] 4s2 3d6 __ __ __ 3d 4s 4p 26Fe3+ = [18Ar] 4s0 3d5 __ __ __ __ 3d 4s 4p Fe (III) fenantrolin 3d 4s 4p
Hibridisasi dari senyawa kompleks Fe(III) fenantrolin adalah d2sp3 yang memberikan bentuk geometri oktahedral. Bentuk oktahedral dari Fe(III) fenantrolin digambarkan sebagai berikut (Liu, 1996).
2.5. Ion Pengganggu
Ion pengganggu adalah ion yang menyebabkan kesalahan. Adanya ion pengganggu sangat mempengaruhi analisis kuantitatif. Toleransi ion pengganggu adalah konsentrasi ion asing yang menyebabkan kesalahan lebih kecil dari ±3,0% dalam penentuan analisis (Amin and Gouda, 2008). Ion pengganggu pada penelitian sengaja ditambahkan pada suatu larutan kompleks untuk mengetahui seberapa besar konsentrasi ion tersebut dapat mengganggu analisis. Penelitian sebelumnya dipilih ion pengganggu Zn(II) (Ria, 2015), Cu(II) (Wang, 2015), Ni(II) (Setiawan, 2015), dan Co(II) yang dilakukan oleh Aditya Pramanasyah A (2009) pada analisa besi(II) hasilnya menunjukkan bahwa ion Co(II) mempengaruhi analisa besi pada konsentrasi tertentu. Sedangkan pada analisa besi(III) belum diteliti untuk ion Co(II).
2.6. Kobalt(II)
Kobalt (Co) merupakan logam berat yang bersifat esensial dan memiliki warna sedikit berkilauan, metalik, keabu-abuan. Kobalt tersedia didalam banyak bentuk seperti pada kertas perak, potongan, bubuk, tangkai, dan kawat. Unsur ini juga merupakan suatu unsur dengan sifat rapuh agak keras dan mempunyai sifat magnetis yang cukup kuat. Kobalt terdapat di alam melalui sumber alam dan aktivitas manusia. Kobalt secara alami terdapat di bebatuan, tanah, air tanaman dan hewan. Sumber alami kobalt di lingkungan adalah tanah, debu, air laut, lava gunung berapi, dan kebakaran hutan. Kobalt juga bisa berasal dari limbah yang berasal dari pembakaran minyak, pembakaran batu bara, sisa pembakaran kendaraan bermotor, pesawat, serta limbah dari industri logam keras (Considene, 1984).
Kobalt mempunyai titik leleh 1490°C, titik didih 3900°C, kerapatan 8,92 g/cm2. Kobalt lebih keras dari pada Fe
11 dan Ni, sukar ditempa tetapi karena mengandung karbon menambah kemudahan ditempa dan diulur. Kobalt berada dalam dua bentuk allotropi, bentuk heksagonal terbuka adalah stabil dibawah 417°C dan bentuk kubus pusat muka yang stabil dari 417°C sampai titik lebur. Kobalt terletak pada golongan VIII-B periode ke-4, dalam sistem periodik unsur dan merupakan unsur transisi yang segolongan dengan Fe dan Ni mempunyai konfigurasi elektron (Ar) 4s2 3d8, nomor atom 27, nomor massa 50,43, potensial ionisasi pertama 7,86 eV dan kedua 17,05 eV dan elektronegatifitasnya 2,6.
Logam ini mudah melarut dalam asam-asam mineral encer :
Co(s) + 2H+(aq) → Co2+(aq) + H2(g) (2.1) Pelarutan dalam asam nitrat disertai dengan pembentukan nitrogen oksida :
3Co(s) + 2HNO3(aq) + 6H+(aq) → 3Co2+(aq) + 2NO(g) + 4H2O(l) (2.2) Dalam larutan air, kobalt secara normal terdapat sebagai ion kobalt(II), Co2+; kadang-kadang, khususnya dalam kompleks-kompleks, dijumpai ion kobalt(III), Co3+. Kedua ion ini masing-masing diturunkan dari oksida CoO dan Co2O3. Oksida kobalt(II) – kobalt(III), Co3O4, juga diketahui. Dalam larutan air dari senyawa-senyawa kobalt(II), terdapat ion Co2+ yang merah. Senyawa-senyawa kobalt(II) yang tak-berhidrat atau tak berdisosiasi, berwarna biru. Jika disosiasi dari senyawa-senyawa kobalt ditekan, warna larutan berangsur-angsur berubah menjadi biru. Ion kobalt(III), Co3+, tidak stabil, tetapi kompleks-kompleksnya stabil, baik dalam larutan maupun dalam bentuk kering. Kompleks-kompleks kobalt(II) dapat dioksidasikan dengan mudah menjadi kompleks-kompleks kobalt(III) (Vogel, 1990).
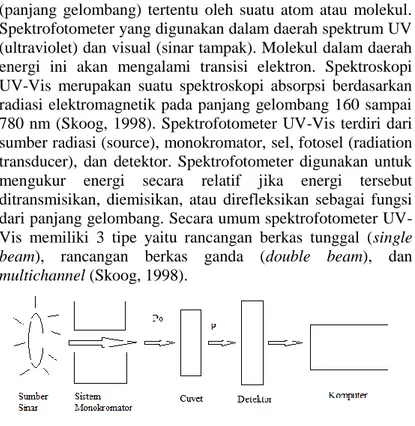
2.7. Spektrofotometer UV-Vis
Spektrofotometer adalah sebuah instrumen yang mengukur absorbsi atau penyerapan cahaya dengan energi
(panjang gelombang) tertentu oleh suatu atom atau molekul. Spektrofotometer yang digunakan dalam daerah spektrum UV (ultraviolet) dan visual (sinar tampak). Molekul dalam daerah energi ini akan mengalami transisi elektron. Spektroskopi UV-Vis merupakan suatu spektroskopi absorpsi berdasarkan radiasi elektromagnetik pada panjang gelombang 160 sampai 780 nm (Skoog, 1998). Spektrofotometer UV-Vis terdiri dari sumber radiasi (source), monokromator, sel, fotosel (radiation transducer), dan detektor. Spektrofotometer digunakan untuk mengukur energi secara relatif jika energi tersebut ditransmisikan, diemisikan, atau direfleksikan sebagai fungsi dari panjang gelombang. Secara umum spektrofotometer UV-Vis memiliki 3 tipe yaitu rancangan berkas tunggal (single beam), rancangan berkas ganda (double beam), dan multichannel (Skoog, 1998).
Gambar 2.3 Komponen Spektrofotometer UV-Vis Cara kerja spektrofotometer secara singkat adalah sinar radiasi keluar dari sumber sinar dan menuju monokromator, selanjutnya dari monokromator tersebut sinar diteruskan menuju sampel dimana sebagian sinar akan diabsorb. Sinar yang melewati sampel tersebut akan ditangkap oleh detektor dan diproses untuk mendapatkan nilai absorbansi dari sampel.
Nilai absorbansi dari larutan sampel yang diukur Spektrofotometer UV-Vis digunakan untuk mengukur intensitas sinar yang dilalui menuju sampel (I) dan
13 membandingkannya dengan intensitas sinar sebelum dilewatkan ke sampel tersebut (I0). Rasio I/I0 disebut transmitan (T), sedangkan absorban diperoleh dari transmitan tersebut dengan rumus A= -log T sesuai dengan hukum dasarnya yaitu hukum Lambert Beer. Hukum Lambert-Beer ini juga memiliki kelemahan, yaitu kenaikan konsentrasi menjadi 2x dan 3x konsentrasi tidak mengubah nilai serapan menjadi 2x atau 3x serapan mula-mula. Ketidaklinieran hubungan antara serapan dengan konsentrasi tersebut dinamakan penyimpangan dari hukum Lambert-Beer (Harvey, 2000).
Hukum Lambert-Beer dinyatakan dalam rumus sebagai berikut:
A = ɛ.b.c (2.3) A = a.b.c (2.4) Keterangan: A = absorbansi
ɛ = absorptivitas (konsentrasi larutan molar) a = absorptivitas (konsentrasi larutan ppm) b = lintasan sumber sinar pada sampel c = konsentrasi
(Underwood, 1993) 2.8. Validasi Metode Analisis
Validasi metode analisis merupakan suatu proses penilaian terhadap parameter analitik tertentu berdasarkan percobaan laboratorium untuk membuktikan bahwa parameter tersebut memenuhi syarat untuk tujuan penggunaannya. Validasi metode analisis ini bertujuan untuk mendapatkan suatu hasil analisis yang absah atau valid, dapat dipercaya dan dapat dipertanggungjawabkan secara ilmiah dan hasil analisis ini dapat menunjukkan kesesuaian dengan tujuan pengujian (Harmita, 2004). Beberapa parameter analisis yang harus dipertimbangkan dalam validasi metode analisis diuraikan dan didefinisikan sebagaimana cara penentuannya.
2.8.1. Presisi
Presisi adalah keterdekatan hasil dari pengulangan analisis atau pengukuran. Presisi metode analisis ini dinyatakan sebagai simpangan baku relatif (SBR) atau koefisien variasi (KV). Adapun ukuran presisi metode analisis ini adalah mengetahui kesalahan karena sistem, tidak tergantung pada penyiapan sampel (Repeatabilitas Sistem) dan ukuran dari variabilitas intrinsik termasuk kesalahan karena penyiapan sampel (Repeatabilitas Metode) (Ibrahim, 2007).
Presisi metode dinyatakan dengan tiga jenis penetapan yaitu repeatabilitas (keterulangan), presisi antara dan reproduksibilitas.
1. Repeatabilitas (keterulangan) merupakan kemampuan metode untuk memberikan hasil analisis yang sama untuk beberapa sampel yang kadarnya sama.
2. Presisi (Ruggedness) antara adalah pengukuran kinerja metode dimana sampel-sampel diuji dan dibandingkan menggunakan tenaga analis berbeda, peralatan berbeda atau hari berbeda (interday presicion). Presisi antara ini tidak perlu dilakukan jika kajian reproduksibilitas telah dilakukan.
3. Reproduksibilitas (ketertiruan) merupakan presisi yang terakhir dan tuntas. Diuji dengan cara menyiapkan sampel yang homogen dan stabil, lalu diuji oleh beberapa laboratorium (studi kolaboratif). Hal ini akan memperlihatkan adanya galat acak yang disebabkan oleh sampel dan laboratorium, serta adanya galat sistemik yang belum tuntas dikoreksi.
Penentuan presisi atau keseksamaan validasi metode analisis ini ditentukan dengan nilai simpangan baku relatif (SBR) atau
Relatif Standard Deviation (RSD) dan Koefisien Variasi (SD)
yang dapat dihitung dengan persamaan: RSD =
15
CV =
̅ (2.6) dengan SD adalah simpangan baku (Sandar Deviasi) yang dirumuskan dengan persamaan:
SD = √∑ ̅
(2.7) Keterangan: xi = pengukuran tunggal
̅ = rata-rata dari jumlah data terhadap n pengukuran
n = jumlah pengukuran
(Ibrahim, 2007) Suatu metode analitik dapat dikatakan memiliki presisi yang baik jika RSD < 20 ppt dan CV < 2% (Miller dan Miller, 1991).
2.8.2. Akurasi
Akurasi adalah tingkat kedekatan hasil pengujian dengan nilai yang sebenarnya atau nilai yang dinyatakan benar (Ibrahim, 2007). Akurasi ini ditentukan dengan empat cara sebagai persen perolehan kembali (% recovery).
1. Analisis kadar analit dengan metode yang divalidasi terhadap sampel yang telah diketahui kadarnya.
2. Analisis kadar analit yang ditambahkan kedalam matriks sampel yang dianalisis (spiked method). Yang dapat dinyatakan dalam persamaan:
% Recovery =
100% (2.8) Dengan Ch adalah kadar analit yang dihitung dari metode yang divalidasi, Cb adalah kadar tanpa analit (blangko), dan Cs adalah kadar analit teoritis.
3. Jika matriks dan eksipien tidak tersedia, maka akurasi dinyatakan dengan persen perolehan kembali kadar analit yang ditambahkan pada produk jadi yang sudah mengandung analit (standar addition method).
4. Membandingkan hasil analisis analit dengan metode yang divalidasi terhadap hasil dengan metode baku (cara grafik).
Akurasi dapat dinyatakan juga dengan Absolut Error (AE) atau Relative Error (RE), sebagai berikut:
AE = (2.9) RE = (2.10) Dengan adalah harga atau kadar rata-rata yang didapat dan
adalah harga atau kadar sebenarnya (Underwood, 1993). 2.8.3. Regresi Kurva Kalibrasi
Tata cara pada umumnya adalah analis mengambil sederetan standar yang diketahui kadar analitnya lalu diukur dalam alat analisa dibawah kondisi yang sama dengan yang selanjutnya dipakai untuk sampel. Setelah kurva kalibrasi ditetapkan, kadar analat dalam cuplikan dapat diperoleh dengan interpolasi. Untuk menaksir seberapa baik kumpulan titik percobaan itu sesuai dengan garis lurus, dihitung koefisien korelasi (r). Nilai r dinyatakan dengan:
r = ∑ ̅ ̅
√ ∑ ̅ ∑ ̅ (2.11) Dari persamaan diatas dapat ditunjukkan bahwa r dapat mempunyai nilai dalam rentang -1 r 1. Nilai r = -1 menggambarkan korelasi negatif sempurna, yaitu semua titik percobaan terletak pada garis lurus yang negatif lerengnya. Demikian pula jika r = 1 menggambarkan korelasi positif sempurna. Semua titik berat tepat terletak pada garis lurus yang positif lerengnya. Jika tidak ada korelasi antara x dan y, maka nilai r sama dengan nol. Dalam analisis, kurva kalibrasi dengan nilai r yang lebih besar dari 0,90 dianggap layak dan nilai r yang lebih kecil dari 0,90 dinyatakan tidak layak (Miller, 1991).
17 BAB III
METODOLOGI PENELITIAN 3.1. Alat dan Bahan
3.1.1. Alat
Peralatan yang digunakan dalam penelitian ini adalah kaca arloji, gelas beaker 50 mL, propipet, pipet ukur, pipet tetes, labu ukur 10 mL, labu ukur 50 mL, labu ukur 100 mL, spatula, hot plate, termometer, neraca analitik, pH meter digital, serta alat instrumentasi yang digunakan adalah spektrofotometer UV-Vis Genesys 10S.
3.1.2. Bahan
Bahan yang digunakan dalam penelitian ini adalah Besi(III)Klorida Heksahidrat (FeCl3.6H2O), Kobalt(II)Klorida Heksahidrat (CoCl2.6H2O), 1,10-fenantrolin (C12H8N2), Asam Asetat (CH3COOH), Natrium Asetat (CH3COONa), aseton (C3H6O), dan aqua DM (H2O). Semua bahan menggunakan sumber sigma aldriq.
3.2. Prosedur Kerja
3.2.1. Pembuatan Larutan Standar Fe3+ 100 ppm
Larutan standar Fe3+ 100 ppm dibuat dengan cara melarutkan FeCl3.6H2O sebanyak 0,0484 gram dengan aqua DM sedikit dalam gelas beaker. Setelah larut, larutan dimasukkan ke dalam labu ukur 100 mL dan ditambahkan aqua DM hingga tanda batas.
3.2.2. Pembuatan Larutan Co2+ 100 ppm
Larutan Co2+ 100 ppm dibuat dengan cara melarutkan CoCl2.6H2O sebanyak 0,0881 gram dengan aqua DM sedikit dalam gelas beaker. Kemudian, larutan dimasukkan ke dalam
labu ukur 100 mL dan ditambahkan aqua DM hingga tanda batas.
3.2.3. Pembuatan Larutan Buffer Asetat pH 3,5
Larutan buffer asetat pH 3,5 dibuat dengan cara melarutkan 0,3962 gram CH3COONa dengan aqua DM dalam gelas beaker dan ditambahkan 5 mL CH3COOH (Ka = 1,75 x 10-5). Selanjutnya larutan yang telah dibuat dimasukkan ke dalam labu ukur 50 mL, kemudian larutan ditambahkan aqua DM hingga tanda batas dan diukur pH-nya.
3.2.4. Pembuatan Larutan 1,10-Fenantrolin 1000 ppm Larutan 1,10-fenantrolin 1000 ppm dibuat dengan cara melarutkan 0,1000 gram 1,10-fenantrolin dengan aqua DM dalam gelas beaker. Lalu larutan dipanaskan dan diaduk menggunakan pengaduk besi pada suhu 60 °C hingga larut. Kemudian, larutan yang telah dibuat dimasukkan ke dalam labu ukur 100 mL dan ditambahkan aqua DM hingga tanda batas.
3.2.5. Pembuatan Larutan Blanko
Larutan blanko dibuat dengan cara mencampurkan larutan 1,10-fenantrolin 1000 ppm sebanyak 1,5 mL; larutan buffer asetat pH 3,5 sebanyak 1,5 mL; dan aseton sebanyak 5 mL ke dalam labu ukur 10 mL. Larutan tersebut kemudian ditambahkan aqua DM hingga tanda batas.
3.2.6. Penentuan Panjang Gelombang Maksimum Kompleks Fe(III)-Fenantrolin
Larutan standar Fe3+ 100 ppm dimasukkan kedalam labu ukur 10 mL sebanyak 0,5 mL, ditambahkan larutan 1,10-fenantrolin 1000 ppm sebanyak 1,5 mL, ditambahkan larutan buffer asetat pH 3,5 sebanyak 1,5 mL. Larutan yang dihasilkan ditambahkan 5 mL aseton dan ditambahkan aqua DM hingga tanda batas. Selanjutnya larutan campuran
19 dikocok dan didiamkan selama 5 menit. Kemudian larutan diukur absorbansinya pada panjang gelombang 329 nm – 400 nm menggunakan spektrofotometer UV-Vis dengan pengulangan sebanyak 3 kali atau triplo. Setelah itu, dibuat kurva antara absorbansi dan panjang gelombang. Dari kurva tersebut dapat diketahui panjang gelombang maksimum kompleks Besi(III)-fenantrolin.
3.2.7. Penentuan Panjang Gelombang Maksimum Co(II)-Fenantrolin
Larutan Co2+ 100 ppm dimasukkan kedalam labu ukur 10 mL sebanyak 0,5 mL, ditambahkan larutan 1,10-fenantrolin 1000 ppm sebanyak 1,5 mL, ditambahkan larutan buffer asetat pH 3,5 sebanyak 1,5 mL. Larutan ditambahkan 5 mL aseton dan ditambahkan aqua DM hingga tanda batas. Selanjutnya larutan campuran dikocok dan didiamkan selama 5 menit. Kemudian larutan diukur absorbansinya pada panjang gelombang 329 nm – 400 nm menggunakan spektrofotometer UV-Vis dengan pengulangan sebanyak 3 kali atau triplo. Setelah itu, kurva dibuat antara absorbansi dan panjang gelombang. Dari kurva tersebut dapat diketahui panjang gelombang maksimum kobalt(II)-fenantrolin.
3.2.8. Pembuatan Kurva Kalibrasi
Larutan standar Fe3+ 100 ppm dimasukkan ke dalam labu ukur 10 mL sebanyak 0,1 mL. Larutan ditambahkan ke dalam labu ukur sebanyak 1,5 mL larutan 1,10-fenantrolin 1000 ppm, ditambahkan sebanyak 1,5 mL larutan buffer asetat pH 3,5, ditambahkan sebanyak 5 mL aseton, dan aqua DM hingga tanda batas. Kemudian campuran tersebut dikocok dan didiamkan selama 5 menit, selanjutnya larutan diukur absorbansinya pada panjang gelombang maksimum yang telah diperoleh. Tiap prosedur diulangi sebanyak 3 kali dan data absorbansi yang diperoleh dibuat kurva kalibrasi antara absorbansi sebagai y dengan konsentrasi sebagai x. Prosedur
diatas dilakukan kembali untuk konsentrasi larutan standar Fe3+ sebanyak 0,2 mL; 0,3 mL; 0,4 mL; 0,5 mL; 0,6 mL; 0,7 mL; dan 0,8 mL.
3.2.9. Pengaruh Ion Co2+ pada Analisa Fe3+ pada pH 3,5 Larutan standar Fe3+ 100 ppm dimasukkan kedalam labu ukur 10 mL sebanyak 0,5 mL, ditambahkan larutan Co2+ sebanyak 0,00 mL; larutan 1,10-fenantrolin 1000 ppm sebanyak 1,5 mL; larutan buffer asetat pH 3,5 sebanyak 1,5 mL; aseton sebanyak 5 mL; dan aqua DM hingga tanda batas. Setelah itu, campuran tersebut dikocok dan didiamkan selama 5 menit. Kemudian larutan diukur absorbansinya pada panjang gelombang maksimum yang telah diperoleh. Prosedur diulangi sebanyak 3 kali dan data absorbansi yang diperoleh dibuat kurva kalibrasi antara absorbansi sebagai y dengan konsentrasi sebagai x. Prosedur diatas dilakukan kembali untuk larutan Co2+ sebanyak 0,01 mL; 0,02 mL; 0,03 mL; 0,04 mL; 0,05 mL; dan 0,06 mL.
21 BAB IV
HASIL DAN PEMBAHASAN
4.1 Penentuan Panjang Gelombang Maksimum Kompleks Fe(III)-Fenantrolin
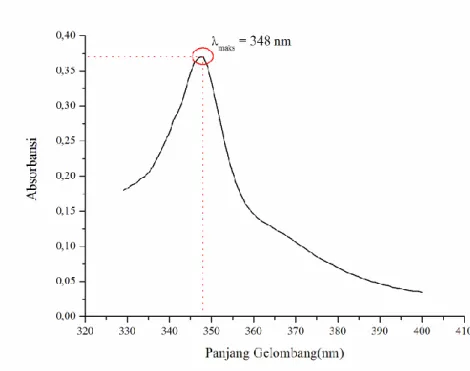
Penelitian ini diawali dengan penentuan panjang gelombang maksimum (λmaks) kompleks Fe(III)-Fenantrolin yang menggunakan instrumen spektrofotometri UV-Vis. Pengukuran dilakukan pada rentang panjang gelombang 329 - 400 nm yang dilakukan sebanyak tiga kali. Rentang panjang gelombang tersebut dipilih karena sehubungan dengan daerah ultraviolet(UV) yang memiliki rentang panjang gelombang 200 – 380 nm dan daerah sinar tampak (Visible) yang memiliki rentang panjang gelombang 380 – 780 nm, dan kompleks Fe(III)-Fenantrolin terbentuk dengan warna larutan bening sedikit kekuningan (hampir tidak berwarna). Oleh sebab itu, pada rentang panjang gelombang 329 – 400 nm terdapat panjang gelombang maksimum dari kompleks Fe(III)-Fenantrolin yang terbentuk secara sempurna dan stabil didaerah UV (Ricma, 2014).
Pengukuran dilakukan dengan menambahkan larutan standar Fe(III) konsentrasi 5 ppm dengan larutan pengompleks 1,10-fenantrolin, digunakan larutan standar Fe(III) konsentrasi 5 ppm karena pada konsentrasi 5 ppm terdapat didalam rentang konsentrasi pada pembuatan kurva kalibrasi dan larutan pengompleks 1,10-fenantrolin sebagai ligan untuk membentuk kompleks. Kemudian, larutan campuran ditambahkan larutan buffer asetat pH 3,5 karena pada penelitian sebelumnya merupakan pH optimum untuk pembentukan kompleks Fe(III)-Fenantrolin (Ricma, 2014). Setelah itu, ditambahkan aseton yang berfungsi untuk menambah kelarutan dan yang terakhir ditambahkan aqua DM hingga tanda batas. Larutan campuran dikocok dan didiamkan selama 5 menit agar pembentukan kompleks
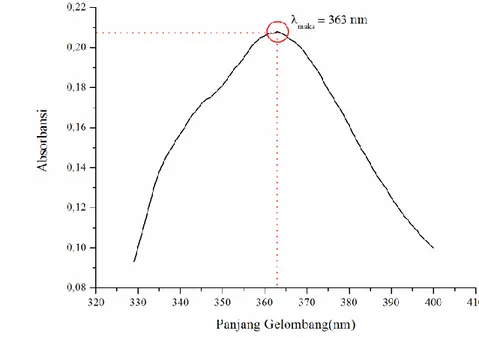
Fe(III)-Fenantrolin terbentuk sempurna dan stabil. Setelah terbentuk kompleks Fe(III)-Fenantrolin, dilakukan analisis menggunakan spektrofotometer UV-Vis pada panjang gelombang 329 – 400 nm dengan interval 1 nm. Pengukuran ini dilakukan pengulangan sebanyak tiga kali atau triplo supaya hasil data yang diperoleh lebih akurat dan presisi. Panjang gelombang maksimum (λmaks) ditunjukkan dengan nilai absorbansi tertinggi yang ditandai dengan adanya puncak tertinggi pada data kurva setelah pengukuran dilakukan seperti pada Gambar 4.1 dibawah ini:
Gambar 4. 1 Panjang Gelombang Maksimum (λmaks) Fe(III)-Fenantrolin pada rentang 329 – 400 nm dengan interval 1 nm
23 Berdasarkan Gambar 4.1 hasil pengukuran panjang gelombang maksimum (λmaks) kompleks Fe(III)-Fenantrolin menggunakan spektrofotometer UV-Vis pada rentang 329 – 400 nm dengan interval 1 nm diperoleh nilai absorbansi tertinggi sebesar 0,209 pada panjang gelombang (λmaks) 363 nm (Lampiran C.1). Pada penelitian Ria Fina 2015, mengatakan bahwa panjang gelombang 363 nm merupakan panjang gelombang maksimum (λmaks) kompleks Fe(III)-Fenantrolin yang terbentuk secara sempurna dan stabil. Oleh sebab itu, panjang gelombang maksimum (λmaks) sebesar 363 nm akan digunakan dalam analisis lebih lanjut sebagai dasar pengukuran nilai absorbansi maksimum pada tahap selanjutnya.
Reaksi yang terjadi antara besi(III) dengan pengompleks 1,10-fenantrolin sebagai berikut:
Fe3+(aq) + 3C12H8N2(aq) → [Fe(C12H8N2)3]3+(aq) (4.1) Konfigurasi elektron dan hibridisasi pada logam besi sebagai berikut: 26Fe = [18Ar] 4s2 3d6 26Fe3+ = [18Ar] 4s0 3d5 Fe (III) fenantrolin Keterangan :
: Pasangan elektron dari logam Fe3+ : Pasangan elektron dari 1,10-Fenantrolin
Hibridisasi dari senyawa kompleks Fe(III)-Fenantrolin adalah d2sp3, karena 1,10-fenantrolin merupakan ligan kuat yang dapat mendesak posisi elektron Fe3+, sehingga di orbital d
masih tersisa 2 orbital kosong. Orbital kosong tersebut yang akan diisi oleh ligan 1,10-fenantrolin dan membentuk kompleks Fe(III)-Fenantrolin yang memiliki sifat paramagnetik. Geometri senyawa kompleks Fe(III)-Fenantrolin berbentuk oktahedral seperti pada gambar yang tertera dalam tinjauan pustaka (Liu, 1996).
4.2 Penentuan Panjang Gelombang Maksimum Co(II)-Fenantrolin
Penentuan panjang gelombang maksimum (λmaks) Co(II)-Fenantrolin dilakukan dengan menggunakan instrumen spektrofotometri UV-Vis. Pengukuran dilakukan pada rentang panjang gelombang 329 - 400 nm yang dilakukan sebanyak tiga kali. Rentang panjang gelombang tersebut dipilih karena pengukuran panjang gelombang maksimum (λmaks) kompleks Fe(III)-Fenantrolin dilakukan pada panjang gelombang yang sama. Pengukuran dilakukan dengan menambahkan larutan Co(II) konsentrasi 5 ppm dengan larutan pengompleks 1,10-fenantrolin, larutan buffer asetat pH 3,5, aseton dan terakhir ditambahkan aqua DM hingga tanda batas. Setelah itu campuran larutan dikocok dan didiamkan selama 5 menit. Kemudian dilakukan analisis menggunakan spektrofotometer UV-Vis pada panjang gelombang 329 – 400 nm dengan interval 1 nm. Pengukuran ini dilakukan pengulangan sebanyak tiga kali atau triplo, data yang diperoleh ditunjukkan pada Gambar 4.2
Grafik pada Gambar 4.2 menunjukkan bahwa hasil pengukuran panjang gelombang maksimum (λmaks) Co(II)-Fenantrolin menggunakan spektrofotometer UV-Vis pada rentang 329 – 400 nm dengan interval 1 nm diperoleh nilai absorbansi tertinggi sebesar 0,370 pada panjang gelombang (λ) 348 nm (Lampiran C.2). Pengukuran ini dilakukan untuk mengetahui pengaruh ion Co2+ pada bagian tahap selanjutnya.
25
Gambar 4. 2 Panjang Gelombang Maksimum (λmaks) Co(II)-Fenantrolin pada rentang 329 – 400 nm dengan interval 1 nm Reaksi yang terjadi antara kobalt(II) dengan pengompleks 1,10-fenantrolin sebagai berikut:
Co2+(aq) + 2C12H8N2(aq) → [Co(C12H8N2)2]2+(aq) (4.2) Sehingga, konfigurasi elektron dan hibridisasi pada logam kobalt sebagai berikut:
27Co = [18Ar] 4s2 3d7
27Co2+ = [18Ar] 4s0 3d7
Co (II) fenantrolin
Keterangan :
: Pasangan elektron dari logam Co2+ : Pasangan elektron dari 1,10-Fenantrolin
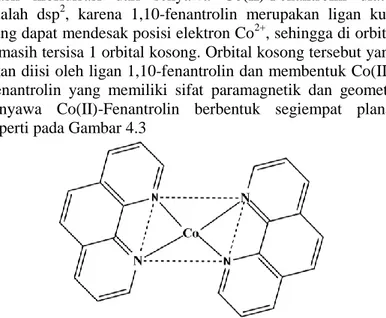
Hasil hibridisasi dari senyawa Co(II)-Fenantrolin diatas adalah dsp2, karena 1,10-fenantrolin merupakan ligan kuat yang dapat mendesak posisi elektron Co2+, sehingga di orbital d masih tersisa 1 orbital kosong. Orbital kosong tersebut yang akan diisi oleh ligan 1,10-fenantrolin dan membentuk Co(II)-Fenantrolin yang memiliki sifat paramagnetik dan geometri senyawa Co(II)-Fenantrolin berbentuk segiempat planar seperti pada Gambar 4.3
Gambar 4. 3 Struktur Segiempat Planar Co(II)-Fenantrolin 4.3 Pembuatan Kurva Kalibrasi
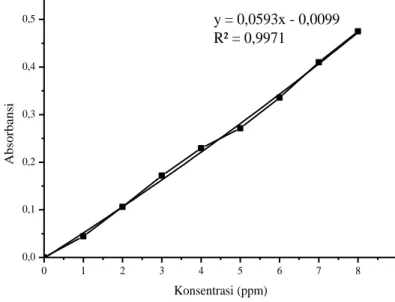
Kurva kalibrasi merupakan garis yang diperoleh dari gabungan beberapa titik yang menyatakan hubungan antara absorbansi terhadap konsentrasi setelah dianalisis regresi linear. Kurva kalibrasi yang baik yaitu kurva kalibrasi yang nilai linearitasnya mendekati 1 (Ricma, 2014). Kurva kalibrasi harus dibuat dalam rentang konsentrasi sampel. Konsentrasi yang digunakan untuk membuat kurva kalibrasi adalah 1, 2, 3,
27 4, 5, 6, 7, dan 8 ppm. Pembuatan kurva kalibrasi dilakukan dengan mengukur absorbansi larutan Fe(III)-Fenantrolin pada variasi konsentrasi yang sudah disediakan setelah ditambahkan larutan pengompleks 1,10-fenantrolin, larutan buffer asetat pH optimum yaitu pH 3,5, aseton dan terakhir ditambahkan aqua DM hingga tanda batas. Setelah itu campuran larutan tersebut dikocok dan didiamkan selama 5 menit. Kemudian dilakukan analisis menggunakan spektrofotometer UV-Vis pada panjang gelombang 363 nm. Dari data absorbansi yang diperoleh, kemudian dibuat kurva seperti pada Gambar 4.4 berikut:
Gambar 4. 4 Kurva Kalibrasi Kompleks Fe(III)-Fenantrolin Kurva kalibrasi yang dihasilkan pada Gambar 4.4 memiliki persamaan garis y = 0,0593x – 0,0099, sehingga nilai R2 sebesar 0,9971 dan koefisien korelasi yang didapat
0 1 2 3 4 5 6 7 8 9 0,0 0,1 0,2 0,3 0,4 0,5 A b so rb a n si Konsentrasi (ppm) y = 0,0593x - 0,0099 R² = 0,9971
dari perhitungan sebesar 0,997. Koefisien korelasi atau uji kelinearan yang menyatakan ukuran kesempurnaan hubungan antara konsentrasi dan absorbansi ditentukan untuk mengetahui keabsahan kurva kalibrasi yang didapat. Koefisien korelasi(r) dikatakan sempurna jika nilai mendekati +1, apabila r bernilai 0 maka tidak ada korelasi antara konsentrasi dan absorbansi. Koefisien korelasi yang bernilai +1 menunjukkan korelasi dengan kemiringan(slope) positif, sedangkan yang bernilai -1 menunjukkan korelasi dengan kemiringan(slope) negatif (Eckschlager, 1972). Pada Gambar 4.4 menyatakan bahwa nilai R memiliki kemiringan(slope) positif dan hubungan antara konsentrasi dan absorbansi searah karena mendekati +1. Pada Lampiran C.3 dan D.2 dapat dilihat data dan perhitungan untuk pembuatan kurva kalibrasi. 4.4 Pengaruh Ion Co2+ pada Analisa Fe3+ pada pH 3,5
Pada analisis secara kuantitatif, adanya ion pengganggu dalam analisis sangat mempengaruhi hasil analisis yang didapatkan. Ion pengganggu yang dimaksud adalah ion asing yang sengaja ditambahkan pada larutan kompleks, untuk mengetahui seberapa besar konsentrasi ion asing tersebut mulai mengganggu terhadap kompleks. Toleransi ion pengganggu didefinisikan sebagai konsentrasi ion asing yang menyebabkan kesalahan lebih dari 3% dalam penentuan analisis. Akibat adanya kehadiran logam asing lain yang membentuk kompleks maka akan mengakibatkan gangguan dalam analisis kompleks pada konsentrasi tertentu, sehingga kompleks yang diharapkan tidak didapatkan hasil yang maksimal (Setiawan, 2015). Analisa besi secara spektrofotometri UV-Vis dapat diganggu oleh beberapa ion lain, karena dapat terjadi perubahan kompleks dengan 1,10-fenantrolin terutama untuk logam-logam divalent.
Pada penelitian ini akan digunakan ion Co2+ sebagai ion pengganggu dalam analisis kompleks Fe(III)-Fenantrolin. Penggunaan ion Co2+ sebagai ion pengganggu, karena kobalt
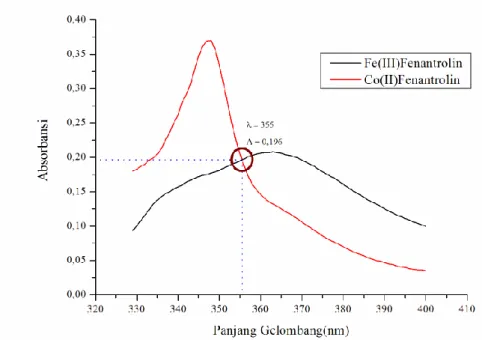
29 termasuk dalam golongan logam transisi dan dalam bentuk ionnya memiliki orbital kosong pada orbital d. Pada tahap sebelumnya, dilakukan pengujian panjang gelombang maksimum kompleks Fe(III)-Fenantrolin dan Co(II)-Fenantrolin untuk mengetahui pengaruh ion Co(II) pada pembentukan kompleks Fe(III)-Fenantrolin apabila kurva panjang gelombang maksimum digabungkan. Berikut gabungan kurva panjang gelombang maksimum kompleks Fe(III)-Fenantrolin dengan Co(II)-Fenantrolin ditunjukkan pada Gambar 4.5
Gambar 4. 5 Titik Potong antara Fe(III)-Fenantrolin dengan Co(II)-Fenantrolin
Berdasarkan Gambar 4.5 bahwa terdapat titik potong pada panjang gelombang maksimum kompleks Fe(III)-Fenantrolin dengan Co(II)-Fe(III)-Fenantrolin yaitu pada panjang gelombang λ = 355 nm dengan absorbansi 0,196, sehingga ion Co(II) dikatakan dapat mengganggu pembentukan kompleks Fe(III)-Fenantrolin. Pada penelitian Anwar 2009, mengatakan bahwa Ion Co(II) dapat dikatakan mengganggu apabila ada perpotongan antara panjang gelombang kompleks Fe(III)-Fenantrolin dengan Co(II)-Fe(III)-Fenantrolin. Ion Co(II) dianggap mengganggu, karena akan berkompetisi dengan ion besi untuk membentuk kompleks dengan 1,10-fenantrolin. Kompetisi yang terjadi antara Co(II) dengan Fe(II) pada pembentukan kompleks dengan 1,10-fenantrolin dapat mempengaruhi nilai absorbansi. Jika kompetisi ini menyebabkan penurunan intensitas warna ataupun meningkatkan intensitas warna, maka akan sangat berpengaruh sekali terhadap pembentukan kompleks Fe(II)-Fenantrolin, bahkan hal ini dapat mencegah terjadinya pembentukan kompleks tersebut secara sempurna.
Pengujian dilakukan dengan cara menambahkan larutan standar Fe(III) konsentrasi 5 ppm dengan variasi larutan Co(II) yang digunakan sebagai ion pengganggu, yakni pada konsentrasi 0,0-0,6 ppm. Kemudian ditambahkan larutan pengompleks 1,10- fenantrolin, larutan buffer asetat pH 3,5, aseton dan terakhir ditambahkan aqua DM hingga tanda batas. Campuran larutan tersebut dikocok dan didiamkan selama 5 menit, setelah itu dilakukan analisis menggunakan spektrofotometer UV-Vis pada panjang gelombang 363 nm. Berikut data absorbansi yang diperoleh yang akan dibuat kurva absorbansi terhadap konsentrasi Co2+ yang ditambahkan, kemudian dapat diketahui %recovery Fe3+ dengan menghitung ppm Fe3+ yang telah ditambahkan dengan ion Co2+ dan dari data perhitungan tersebut akan dibuat kurva %recovery Fe3+ terhadap konsentrasi Co2+ yang ditambahkan.
31 Tabel 4. 1 Data Absorbansi Pada Kompleks
Fe(III)-Fenantrolin Setelah Penambahan Ion Co2+ Konsentrasi Ion Co2+ (ppm) Absorbansi Arata-rata A1 A2 A3 0,0 0,278 0,266 0,270 0,271 0,1 0,275 0,276 0,274 0,275 0,2 0,243 0,257 0,244 0,248 0,3 0,239 0,214 0,207 0,220 0,4 0,194 0,199 0,200 0,198 0,5 0,175 0,173 0,177 0,175 0,6 0,164 0,162 0,160 0,162
Tabel 4. 2 Data Perhitungan Konsentrasi Fe(III) Terukur, % recovery, Standar Deviasi Relatif (RSD) dan Koefisien Variasi (CV) Konsentrasi Ion Co2+ (ppm) Konsentrasi Fe(III) terukur (ppm) % Recovery RSD (ppt) CV (%) 0,0 4,40 88,00 % 22,58 2,3 0,1 4,47 101,59 % 3,64 0,4 0,2 4,01 91,14 % 31,49 3,1 0,3 3,54 80,45 % 76,45 7,6 0,4 3,17 72,05 % 16,36 1,6 0,5 2,78 63,18 % 11,43 1,1 0,6 2,56 58,18 % 12,35 1,2
Berdasarkan pada Tabel 4.1 dapat diketahui besar konsentrasi Fe(III) yang terukur dalam analisis pengaruh ion Co(II) dalam kompleks Fe(III)-Fenantrolin dengan menggunakan persamaan garis yang diperoleh dari pembuatan kurva kalibrasi sebelumnya. Pada Tabel 4.2 menunjukkan
bahwa pada konsentrasi tertentu Co2+ yang ditambahkan akan didapatkan nilai RSD dan nilai CV yang cukup besar. Nilai RSD dan CV dapat dikatakan memiliki kecermatan (presisi) yang baik apabila RSD kurang dari 20 ppt dan CV kurang dari 2% (Riyanto, 2014). Pada penambahan ion Co2+ konsentrasi 0,1 ppm, 0,4 ppm, 0,5 ppm, 0,6 ppm dengan nilai RSD yang berturut-turut 3,64 ppt, 16,36 ppt, 11,43 ppt, 12,35 ppt dan nilai CV 0,4%; 1,6%; 1,1%; 1,2% menunjukkan kecermatan (presisi) yang baik karena nilai RSD < 20 ppt dan CV < 2%. Sedangkan, penambahan ion Co2+ pada konsentrasi 0,0 ppm, 0,2 ppm, 0,3 ppm dengan nilai RSD yang berturut-turut 22,58 ppt, 31,49 ppt, 76,45 ppt dan nilai CV 2,3%; 3,1%; 7,6% menunjukkan kecermatan (presisi) yang tidak baik karena nilai RSD > 20 ppt dan CV > 2%. Pada lampiran C.4, D.3 dan D.4 dapat dilihat data perhitungan untuk %recovery, nilai RSD dan nilai CV. Kurva data absorbansi setelah ditambahkan ion Co2+ dan kurva %recovery kompleks Fe(III)-Fenantrolin setelah ditambahkan ion Co2+ dapat dilihat pada Gambar 4.6 dan 4.7
Pada Gambar 4.6 menunjukkan bahwa semakin besar konsentrasi Co2+ yang ditambahkan maka nilai absorbansi yang dihasilkan akan semakin kecil. Uji ini dilakukan untuk mengetahui seberapa besar pengaruh penambahan konsentrasi Co2+ pada kompleks Fe(III)-Fenantrolin. Berdasarkan Gambar 4.7 pada konsentrasi 0,4 ppm Co2+, prosentase recovery Fe3+ mencapai 72,05% atau dibawah 80% untuk standar batuan dan bahan anorganik, sedangkan batas nilai %recovery yang diijinkan pada sample batuan dan bahan anorganik sebesar 80% - 120%. Pada konsentrasi 0,0 ppm sampai 0,3 ppm diijinkan karena masih dalam rentang 80% - 120%, sehingga dikatakan ion Co2+ belum mulai mengganggu analisis kompleks Fe(III)-Fenantrolin. Sedangkan pada konsentrasi 0,4 ppm hingga 0,6 ppm %recovery tidak masuk kedalam rentang yang diijinkan. Adanya perpotongan pada kurva gabungan antara panjang gelombang kompleks
Fe(III)-33 Fenantrolin dengan Co(II)-Fenantrolin pada λ tertentu dan data %recovery, maka dapat disimpulkan bahwa ion Co2+ mulai mengganggu dalam analisis kompleks Fe(III)-Fenantrolin pada konsentrasi ion Co2+ 0,4 ppm, karena %recovery yang didapat kurang dari rentang batas yang diijinkan untuk sample batuan dan bahan anorganik yaitu 80% - 120%. Hal ini dapat terjadi karena adanya persaingan antara Co(II) dengan Fe(III) yang dapat menyebabkan penurunan intensitas warna ataupun meningkatkan intensitas warna, sehingga dapat mencegah terjadinya pembentukan kompleks tersebut secara sempurna. Pada penelitian Anwar 2009, ion Co2+ mulai mengganggu dalam analisis kompleks Fe(II)-Fenantrolin pada konsentrasi ion Co2+ 0,2 ppm dengan nilai %recovery sebesar 94,11%. Rentang batas yang diijinkan untuk jenis sample Fe(II)-Fenantrolin yaitu 95% - 120%.
Gambar 4. 6 Pengaruh Ion Co2+ terhadap Absorbansi Fe(III)-Fenantrolin
Gambar 4. 7 Pengaruh Ion Co2+ terhadap Prosentase Recovery Fe(III)-Fenantrolin
35 BAB V KESIMPULAN 5.1. Kesimpulan
Berdasarkan penelitian yang telah dilakukan, maka dapat disimpulkan bahwa analisa Fe(III) dengan pengompleks 1,10-fenantrolin pada pH 3,5 secara spektrofotometri UV-Vis, diperoleh panjang gelombang maksimum (λmaks) kompleks Fe(III)-Fenantrolin sebesar 363 nm. Penambahan ion Co(II) mempengaruhi pembentukan kompleks Fe(III)-Fenantrolin karena dapat mengakibatkan nilai absorbansi menjadi menurun atau tidak stabil. Ion Co(II) mulai mengganggu dalam analisis kompleks Fe(III)-Fenantrolin pada konsentrasi ion Co(II) 0,4 ppm, dengan diperoleh nilai %recovery sebesar 72,05% (kurang dari 80%), nilai standar deviasi relatif (RSD) sebesar 16,36 ppt, dan nilai koefisien variasi (CV) sebesar 1,6%.
37
DAFTAR PUSTAKA
Achmad, Kukuh. S. 2000. Validasi Metode Uji. Pusat Standarisasi dan Akreditasi Laboratorium BSN: Jakarta.
Amin A. S. and Gouda A. A., 2008. Utility of Solid-Phase Spectrophotometry for Determination of Dissolved Iron (II) and Iron (III) using
2,3-dichloro-6-(3-carboxy-2-hydroxy-1-naphthylazo) quinoxaline.
Talanta 76, 1241-1245.
Anwar, Aditya P. 2009. Studi Gangguan Co pada Analisa Besi dengan Pengompleks 1,10-Fenantrolin pada pH 4,5 Secara Spektrofotometri UV-Vis. Skripsi. Surabaya: Institut Teknologi Sepuluh Nopember. Atkins PW, Shriver DF, and Langford C., 1990. Inorganic
Chemistry. Oxford University Press.
Brezova, V., Blazkova, A., Borozova, E., Cappan, M. And Radin, F., 1995. The Influence of Dissolved Metal Ion on The Degradation of Phenol in Aqueous TiO2 Suspension. J. Molec Catal A., 98, 108 116. Considine, D. M., P. E and Considine, G. D., 1994. Van
Reinhold Encyclopedia of Chemistry, 4th Edition. Van Nostrand Reinhold Company, New York. Cotton dan Wilkinson. 1989. Kimia Anorganik Dasar.
UI-Press, Jakarta.
Cotton, F. A., Wilkinson. G., 1984. Kimia Anorganik Dasar, (terjemahan), Penerbit UI-Press, Jakarta.
Daintith. 1990. A Concise Dictionary of Chemistry. Market Oxford University.
Day, R. D. Jr., Underwood. 1993. Analisa Kimia Kuantitatif. Erlangga, edisi ke-4.
Dewi, Ricma. 2014. Penentuan Kondisi Optimum pada
Pembentukan Kompleks Fe(III) Fenantrolin
dengan Spektrofotometri UV-Vis. Tugas Akhir Kimia ITS. Surabaya.
Eckschlager, K., M.Sc., D.Ph. 1972. Errors, Measurement and Result in Chemical Analysis. London: Van Norstrand Reinhold Company.
Harmita. 2004. Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya, Majalah Ilmu Kefarmasian, Vol. I, No. 3, Desember 2004, 117-135.
Harvey, D. 2000. Modern Analytical Chemistry. Mc Graw-Hill, New York.
Hoffman, M.R., Martin, S.T., Choi, W. and Bahneman,
D.W., 1997.
EnvironmentalApplication of
Semiconductor Photocatalysis
. J. Chem. 1
Rev., 69-96.
Ibrahim. 2007. Penelitian dan Penilaian Pendidikan. Bandung: Sinar Baru Algensindo.
Liu C., Ye X., Zhan R. and Wu Y., 1996. Phenol Hydroxylation by Iron (II) phenanthroline: The Reaction Mechanism. Journal of Molecular Catalysis A: Chemical 112, 15-22.
39 Miller, J.C; Miller, J. N., 1991. Statistika untuk Kimia
Analitik. ITB, Bandung.
Prakash S. 2001. Antioxidant Activity. Medallion Laboratories Analytical Progress. Volume 19. Number 2. Riyanto. 2014. Validasi dan Verifikasi. Deepublish:
Yogyakarta.
Setiawan, Andika Rendi. 2015. Pengaruh Penambahan Ion
Ni2+ dalam Analisis Besi(III) dengan Pengompleks
1,10-Fenantrolin pada pH 3,5 menggunakan Spektrofotometer UV-Vis. Tugas Akhir Kimia ITS. Surabaya.
Skoog DA, Holler FJ, Niemann TA. 1998. Principle of Instrumental Analysis. Edisi ke-5. Florida: Saunders College.
Sofia, V. N. 2014. Analisis Gangguan Kalsium pada Besi
dengan Kondisi pH 4,5 menggunakan
Pengompleks 1,10-Fenantrolin dengan
Spektrofotometer UV-Vis. Tugas Akhir Kimia ITS. Surabaya.
Sukardjo. 1989. Kimia Anorganik. Rineka Cipta. Yogyakarta. Sunardi. 2006. Unsur Kimia, Yrama Widya, Jakarta.
Ueno, K., Imamura, T., Cheng, K. L., 1992. Hand Book of
Organic Analytical Reagents, 2nd edition. CRC
Press, Tokyo.
Vogel. 1985. Buku Teks Analisa Anorganik Kualitatif Makro dan Semimikro, (Terjemahan oleh Setiono L.,
Pudjaatmaka A. H), Edisi Kelima. PT. Kalman Media Pustaka, Jakarta.
Vogel. 1990. Buku Teks Analisis Anorganik Kualitatif Makro dan Semimikro. Jakarta: PT. Kalman Media Pustaka.
Wang, Steven. 2015. Studi Gangguan Cu2+ pada Analisa Besi (III) dengan Pengompleks 1,10-Fenantrolin pada pH 3,5 secara Spektrofotometri UV-Vis. Tugas Akhir Kimia ITS. Surabaya.
Widowati, W. 2008. Efek Toksik Logam. Penerbit: ANDI, Yogyakarta.
Wijaya, Ria Fina. 2015. Analisis Pengaruh Ion Zn (II) pada
Penentuan Fe3+ dengan Pengompleks
1,10-Fenantrolin pada pH Optimum Menggunakan Spektrofotometer UV-Vis. Tugas Akhir Kimia ITS. Surabaya.
Wulandari, Desi Ayu. 2009. Studi Gangguan Nikel pada
Analisa Besi dengan Pengompleks
1,10-Fenantrolin pada pH 4,5 Secara Spektrofotometri UV-Vis. Tugas Akhir Kimia ITS. Surabaya.
41 LAMPIRAN A SKEMA KERJA
A.1 Pembuatan Larutan Standar Fe3+ 100 ppm
A.2 Pembuatan Larutan Co2+ 100 ppm
Ditambahkan aqua DM hingga tanda batas Dimasukkan kedalam labu ukur 100 mL Dilarutkan dengan aqua DM
sedikit dalam gelas beaker 0,0484 gram FeCl3.6H2O
Larutan Standar Fe3+ 100 ppm
Ditambahkan aqua DM hingga tanda batas Dimasukkan kedalam labu ukur 100 mL Dilarutkan dengan aqua DM
sedikit dalam gelas beaker 0,0881 gram CoCl2.6H2O
A.3 Pembuatan Larutan Buffer Asetat pH 3,5
A.4 Pembuatan Larutan 1,10-Fenantrolin 1000 ppm Diukur pHnya
Ditambahkan aqua DM hingga tanda batas Dimasukkan kedalam labu ukur 50 mL Ditambahkan kedalam gelas beaker
Dilarutkan dengan aqua DM dalam gelas beaker 0,3962 gram CH3COONa
5 mL CH3COOH (Ka = 1,75 x 10-5)
Larutan Buffer Asetat pH 3,5
Ditambahkan aqua DM hingga tanda batas Dimasukkan kedalam labu ukur 100 mL Dipanaskan dan distirer pada suhu 60° C hingga larut
Dilarutkan dengan aqua DM sedikit dalam gelas beaker 0,1000 gram 1,10-fenantrolin
43 A.5 Pembuatan Larutan Blanko
Ditambahkan aqua DM hingga tanda batas dan dikocok
Ditambahkan kedalam labu ukur 10 mL Ditambahkan kedalam labu ukur 10 mL Dimasukkan kedalam labu ukur 10 mL 1,5 mL 1,10-fenantrolin
1,5 mL buffer asetat pH 3,5
5 mL aseton
A.6 Penentuan Panjang Gelombang Maksimum Kompleks Besi(III)-Fenantrolin
*Prosedur diulang sebanyak tiga kali atau triplo
Dibuat kurva antara absorbansi dan panjang gelombang
Diukur absorbansinya pada λ = 329 - 400 nm* Dikocok larutan campuran dan didiamkan selama 5 menit
Ditambahkan aqua DM hingga tanda batas Ditambahkan kedalam labu ukur 10 mL dengan urutan mulai dari kiri
0,5 m L st anda r Fe 3+ 1,5 m L 1,10 -fena n tr ol in 1,5 m L buff er as et at pH 3,5 5 m L aset on
45
A.7 Penentuan Panjang Gelombang Maksimum
Kobalt(II)-Fenantrolin
*Prosedur diulang sebanyak tiga kali atau triplo
Dibuat kurva antara absorbansi dan panjang gelombang
Diukur absorbansinya pada λ = 329 - 400 nm* Dikocok larutan campuran dan didiamkan selama 5 menit
Ditambahkan aqua DM hingga tanda batas Ditambahkan kedalam labu ukur 10 mL dengan urutan mulai dari kiri
0,5 m L st anda r Co 2+ 1,5 m L 1,10 -fenan tr ol in 1,5 m L buf fe r as et at pH 3,5 5 m L ase ton
A.8 Pembuatan Kurva Kalibrasi
*Prosedur diulang sebanyak tiga kali atau triplo
**Prosedur diatas dilakukan kembali untuk konsentrasi 0,2 mL; 0,3 mL; 0,4 mL; 0,5 mL; 0,6 mL; 0,7 mL; dan 0,8 mL
Dibuat kurva kalibrasi antara absorbansi sebagai y dengan konsentrasi sebagai x Diukur absorbansinya pada λ = 363 nm* Dikocok larutan campuran dan didiamkan selama 5 menit
Ditambahkan aqua DM hingga tanda batas Ditambahkan kedalam labu ukur 10 mL dengan urutan mulai dari kiri
0,1 m L** st and ar F e 3+ 1,5 m L 1,10 -fena n tr ol in 1,5 m L buf fe r as et at pH 3,5 5 m L ase ton
47 A.9 Pengaruh Ion Co2+ pada Analisa Fe3+ pada pH 3,5
*Prosedur diulang sebanyak tiga kali atau triplo
**Prosedur diatas dilakukan kembali untuk konsentrasi 0,01 mL; 0,02 mL; 0,03 mL; 0,04 mL; 0,05 mL; dan 0,06 mL
Dibuat kurva antara absorbansi sebagai y dengan konsentrasi sebagai x
Diukur absorbansinya pada λ = 363 nm* Dikocok larutan campuran dan didiamkan selama 5 menit
Ditambahkan aqua DM hingga tanda batas Ditambahkan kedalam labu ukur 10 mL dengan urutan mulai dari kiri
0,5 m L st anda r Fe 3+ 1,5 m L 1,10 -fena n tr ol in 1,5 m L bu ff er as et at pH 3,5 5 m L ase ton Diperoleh Kurva 0,00 m L** lar u tan C o 2+
49 LAMPIRAN B
PERHITUNGAN PEMBUATAN LARUTAN B.1 Pembuatan Larutan Standar Fe3+ 100 ppm
Perhitungan pembuatan larutan standar Fe3+ 100 ppm, yaitu:
100 ppm = 100 mg/L = 100 mg/1000 mL = 10 mg/100 mL
Massa FeCl3.6H2O yang dibutuhkan untuk membuat larutan standar Fe3+, yaitu:
= = = x = 48,4 mg x = 0,0484 g
Jadi, massa FeCl3.6H2O yang diperlukan adalah 0,0484 gram dalam 100 mL larutan untuk mendapatkan konsentrasi 100 ppm.
B.2 Pembuatan Larutan Co2+ 100 ppm
Perhitungan pembuatan larutan standar Co2+ 100 ppm, yaitu:
100 ppm = 100 mg/L = 100 mg/1000 mL
= 10 mg/100 mL
Massa CoCl2.6H2O yang dibutuhkan untuk membuat larutan standar ion Co2+, yaitu:
= = x = 88,12 mg x = 0,0881 g
Jadi, massa CoCl2.6H2O yang diperlukan adalah 0,0881 gram dalam 100 mL larutan untuk mendapatkan konsentrasi 100 ppm.
B.3 Pembuatan Larutan Buffer Asetat pH 3,5
Perhitungan pembuatan larutan buffer asetat pH 3,5, yaitu: CH3COOH 100% = x ρ CH3COOH = 1 x 1,049 kg/L = 1,049 kg/L = 1049 gram/L Lalu dirubah dalam bentuk molar, maka:
M.CH3COOH = = = 17,47 mol/L = 17,47 M