Oseana, Volume XXIV, Nomor 2,1999 : 27-43 ISSN 0216-1877
BUDIDAYA ROTIFERA (Brachionus plicatilis)
oleh
Sri Redjekil)
ABSTRACT
Rotifera (Brachionus plicatilis) culture .Rotifer (Brachionus plicatilis) as zoop- lankton were live on euryhaline. Its function as initial feed of marine fish and crusta-ceans. The rotifers consumed all of organic matter (omnivora) i.e. periphyton, nanno- plankton, detritus and all of organic matter. Rotifers have the highest nutrition be-cause part of its have essential fatty acids (EPA and DHA). Algae (Chlorella sp., Nannochloropsis sp., Tetraselmis sp.), protein (casein, lesitin, kuning telur, minyak ikan), gist (yeast) dan vitamin (B1, B12 dan E) were used for enrich rotifer. Size of rotifer S-type between 76-143 Um (lorica length) and 63114 Um (width lorica) and L-type between 210-350 Um (lorica length) and 170-185 Um (width lorica). The reproduction with bisexual system (parthenogenesis). Media for culture rotifer on 20- 30°C of temperature, 59 of pH, 0-50 ppt of salinity, >5 ppm of dissolved oxygen and 100-2000 lux of light intensity. Culture of rotifer use daily harvest method, water increment, conventional and controlled system.
PENDAHULUAN
Rotifer (Brachionus plicatilis)
merupakan zooplankton yang sering digunakan sebagai pakan awal larva ikan laut
(WATANABE et al. 1983), udang dan kepiting
(DANAKUSUMAH & IMANTO 1988). Rotifera pertama kali digunakan sebagai pakan
larva ikan ayu, P. altivelis (ITO 1963),
kemudian ikan fugu, Fugu rupbripes rubripes
(HIRATA 1974), udang, Penaeus monodon
(HIDAKA 1966) dan Red Seabream, Pagrus
major (FUJITA 1973), ikan Mugil cephalus (NASH et al. 1974), ikan turbot, Scophtalmus maximus (OLSEN & MINCK,1983) dan ikan
sebelah, Paralichtys olevaceus (FUKUSHO et al. 1985). Rotifer sering digunakan pada panti- panti perbenihan ikan laut karena jenis pakan tersebut memiliki keuntungan dibanding zoo- plankton lainnya. TESHIMA et al. (1980) telah mencoba serangkaian penelitian untuk menggantikan rotifer dengan pakan buatan atau plankton lainnya sebagai pakan awal larva ikan laut, tetapi peran rotifer belum dapat digantikan dengan pakan lainnya. Rotifer mempunyai keuntungan-keuntungan sebagai berikut: mudah dicerna oleh larva ikan, mempunyai ukuran yang sesuai dengan mulut larva ikan, mempunyai gerakan yang sangat lambat sehingga mudah ditangkap oleh larva,
1)
mudah dikultur secara massal, pertumbuhan dan perkembangannya sangat cepat dilihat dari siklus hidupnya, tidak menghasilkan racun atau zat lain yang dapat mem-bahayakan kehidupan larva serta memiliki nilai gizi yang paling baik untuk pertumbuhan larva.
BIOLOGI
Tehnik budidaya berdasarkan pengetahuan tentang aspek biologi dan kimia yang meliputi morfologi, reproduksi, habitat, pertumbuhan, kebiasaan dan cara makan, cara kultur dan nilai gizi serta kualitas air yang memenuhi kriteria.
1. Morfologi
Brachionus termasuk filum Rotifer, kelas Monogononta, bangsa Ploima, suku
Brachionidae, marga Brachionus, jenis
Brachionus plicatilis. Rotifer mempunyai warna putih dan berbentuk seperti piala, pada bagian korona atau mulut dilengkapi dengan bulu getar yang bergerak aktif. Diameter korona antara 60-80 mikron. Tubuh rotifer terbagi atas 3 bagian yaitu kepala, badan dan kaki atau ekor. Pemisahan bagian kepala dengan badan tidak jelas. Bagian kaki dan ekor berakhir dengan belahan yang disebut jari. Badan rotifer dilapisi kutikula yang tebal disebut "lorika". Pada bagian kepala terdapat 6 duri, sepasang ditengah sebagai duri yang panjang. Ujung depan tubuh rotifer dilengkapi dengan gelang-gelang silia yang kelihatan melingkar seperti spiral yang disebut "korona" dan berfungsi untuk memasukkan makanan kedalam mulutnya (ANONYMOUS 1985).
Panjang tubuh rotifer antara 60-273 Um dengan lebar antara 92-170 Um. Pada pemeliharaan larva, pakan yang diperlukan pertama kalinya sangat tergantung kepada ukuran jenis pakan yang sesuai dengan mulut larva. Dengan adanya perkembangan ilmu pengetahuan tentang jasad pakan maka telah
ditemukan rotifer jenis besar (tipe L) dan jenis kecil (tipe S). Beberapa hasil penelitian menyebutkan bahwa pada tahun 1989, rotifer yang ditemukan di Teluk Banten umumnya bertipe-L dengan panjang lorika antara 210-225 Um dan lebar antara 170-185 Um (DANAKUSUMAH 1989), kemudian pada tahun 1992 rotifer yang dikultur di stasiun Bojonegara umumnya bertipe-S dengan panjang lorika antara 76-143 Um dan lebar antara 63-114 Um (REDJEKI 1995 &
REDJEKI et al. 1995a dan b). Di Jepang,
ukuran panjang lorika tipe L antara 220-350 mikron sedangkan tipe S antara 100-180 mikron. Tipe S sesuai untuk pakan larva yang baru menetas dan bermulut kecil sedangkan tipe L sesuai untuk pakan larva umur 7-21 hari. Kedua rotifer tersebut mempunyai sifat-sifat (karakteristik) yang berbeda tergantung teknik kulturnya (FUKUSHO & IWAMOTO 1980,
FUKUSHO & OKAUCHI 1982, ITO et al.
1981). Beberapa faktor yang mempengaruhi ukuran rotifer antara lain jenis pakan yang diberikan, kondisi geografis, suhu dan genetik.
Secara taksonomi, rotifer tipe-L disebut
dengan Brachionus hepatotomus dan tipe-S
disebut Brachionus plicatilis rotundiformis. Rotifera tipe-L memiliki lorika memanjang dengan duri yang tumpul sedangkan tipe-S memiliki lorika bulat dengan ujung anterior berduri. Secara genetik, kedua tipe rotifer tersebut terdapat gerbedaan dimana pada roti-fer tipe L hidup lebih lama dibanding dengan rotifer tipe S (FU et al, 1991). Ditambahkan pula bahwa kedua tipe rotifer yang awalnya berasal dari berbagai lokasi telah dianalisa dengan menggunakan metoda "Isozymes" dan metoda "Cluster" dengan membedakan spine
anteriornya. Demikian pula RUMENGAN et
al. dalam MUSTAHAL (1995) menganalisa tentang perbedaan kromosome antara kedua tipe rotifer tersebut.
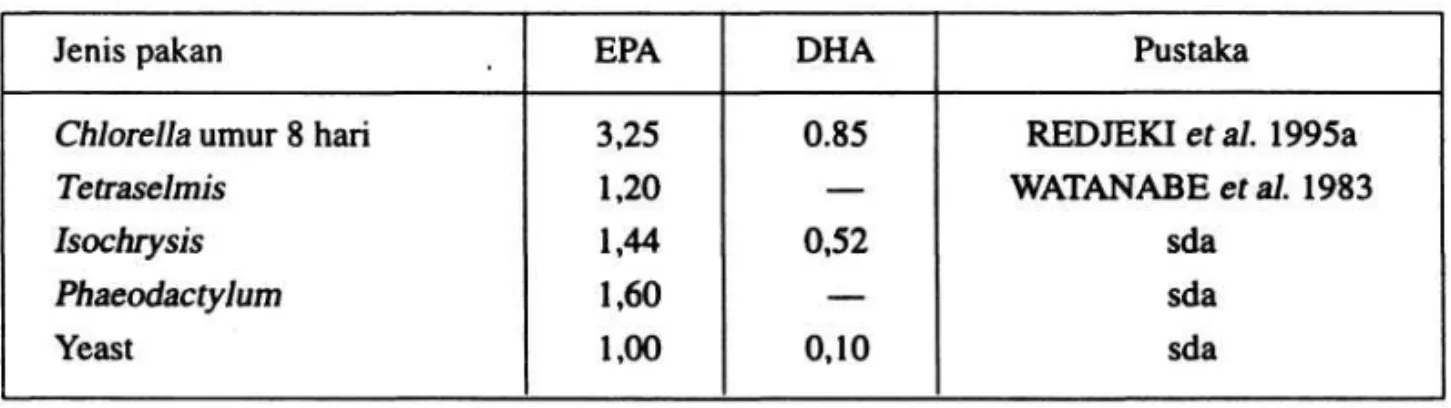
Ukuran rotifer sangat tergantung dari jenis makanan yang dimakannya, hal ini seperti yang disajikan padaTabel 1 di bawah ini.
Tabel 1. Panjang dan lebar lorika rotifer sesuai dengan jenis makanannya
2. Reproduksi
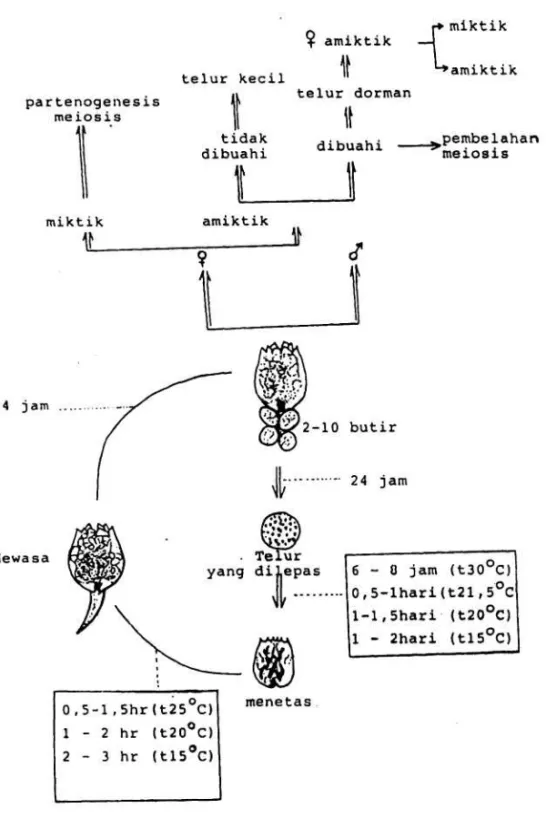
Rotifer mempunyai sistem reproduksi biseksual, kelamin yang terpisah tetapi yang betina dapat melangsungkan reproduksi secara partenogenesis. Sistem reproduksi betina disebut ovum dan jantan disebut testis. Untuk menghasilkan spermatozoa, rotifer jantan siap berkopulasi setelah satu jam telur menetas.
Lama hidup rotifer betina berkisar 12- 19 hari. Rotifera terdiri atas 2 tipe yaitu tipe amiktik dan miktik. Satu tipe betina miktik dapat menghasilkan satu tipe telur yaitu amiktik atau miktik. Betina amiktik ialah betina yang menghasilkan telur dan melakukan pembelahan meiosis. Telur amiktik bila tidak dibuahi akan menghasilkan telur yang ukurannya kecil. Apabila telur dibuahi akan menghasilkan telur yang ukurannya besar, telur tersebut disebut telur dorman dengan kulit telur yang tebal dan akan berkembang menjadi betina yang bersifat amiktik. Generasi selanjutnya dapat bersifat amiktik atau miktik. Sedangkan betina miktik ialah betina yang menghasilkan telur secara partenogenesis meiosis. Rotifer setelah 24 jam menetas, dapat menghasilkan dua atau tiga butir telur. Kecepatan penetasan telur tergantung dari suhu
media air (CHUMAIDI et al. (1992).
Waktu yang dibutuhkan rotifer untuk melepaskan telur adalah selama 24 jam (pada suhu air 15°C), 120 jam (pada suhu 20-25°C)
dan 6 jam (pada suhu air 30°C), sedangkan waktu yang dibutuhkan untuk menjadi rotifer dewasa yaitu selama 2-3 hari (pada suhu 15°C), 1-2 hari (pada suhu 20°C), 0,5-1,5 hari (pada suhu 25°C).
Pada kondisi optimum, rotifer dapat melepaskan telur setiap 4 jam dan jarak waktu ini akan semakin panjang dengan bertambahnya umur rotifer. Selama hidupnya, rotifer dapat melepaskan telur antara 10-24 butir. Waktu yang dibutuhkan untuk menetaskan telur adalah 1-2 hari (pada suhu 15°C), 1-1,5 hari (pada suhu 20°C), 0,5-1 hari (pada suhu 21,5°C) dan 6-8 jam (pada suhu 30°C). Rotifer dapat mencapai umur 3,4 - 4,5 hari pada suhu 25°C. Adapun siklus daur hidup rotifer disajikan pada Gambar 1.
3. Habitat
Rotifer dapat hidup di perairan telaga, sungai, rawa, danau dan sebagian besar terdapat di perairan air payau (MARSHALL & WILLIAM 1967, REDJEKI & MURTININGSIH 1995b) dan melimpah pada perairan yang kaya akan nannoplankton dan detritus.
4. Kebiasaan, Cara dan jumlah makan
Rotifer bersifat omnivora, jenis makanannya terdiri dari perifiton, nannoplank-ton, detritus dan semua partikel organik yang sesuai dengan lebar mulut larva. Beberapa
Gambar 1. Siklus hidup rotifera (Brachionus plicatilis)
jasad pakan yang dapat digunakan untuk
budidaya ikan laut adalah Chlorella sp.
(HIRATA & MORI dalam CHOTIYAPUTTA
& HIRAYAMA, 1978), Chlamidomonas dan
Olisthodiscus CHOTIYAPUTTA &
HIRAYAMA, 1978), Chaematococcus,
Isochrysis galbana, Monochrysis lutheri, Exuviella (ANONYMOUS 1985), marine
yeast (FURUKAWA dalam CHOTIYAPUTTA
& HIRAYAMA 1978), Tetraselmis sp.
(FUKUSHO et al. 1984) dan protozoa
(MUSTAHAL 1995). Jenis makanan tersebut dikonsumsi dengan cara filtrasi (HIRAYAMA dalam MUSTAHAL 1995). Dari jenis pakan tersebut, jenis alga hijau Chlorella sp. yang paling efisien untuk pakan rotifer dalam kultur massal.
Jumlah dan kualitas makanan rotifer sangat mempengaruhi populasi rotifer. Beberapa hasil penelitian menyebutkan bahwa kepadatan Tetraselmis dan Chlorella sebesar 5 juta sel/ml dan ragi roti sebanyak 1-2 g/berat badan/1 juta rotifer akan diperoieh rotifer sebanyak 500-700 ekor/ml selama 3 minggu dengan inokulasi awal 10 ekor/ml. Oleh sebab itu untuk mendapatkan rotifer yang lebih baik disarankan agar dalam memberikan pakan Chlorella sebaiknya dengan kepadatan 2,13- 3,5 x I juta sel/ml (RACHMASARI 1989). Pada tahun 1990-1991 saat berlangsungnya kerjasama antara Subbalitdita Bojonegara dengan JICA, budidaya jasad pakan yang meliputi Chlorella sp., Tetraseimis sp. dan rotifera memiliki kepadatan masing-masing yang berkisar antara 15-25X106 sel/ml dan 15,67-55,38x104 sel/ml (hari ke-6) dan 44,67- 1 13 ,35 ind./ml (hari ke-5) dengan total produksi bulanan masing-masing antara 736- 9050xl012 sel/ml dan 13,12-183,53xl010 sel/
ml (hari ke-6) dan 580- 6000X106 individu
rotifera (hari kc-5) (REDJEKI et al. (1991). Penelitian terhadap laju pemangsaan
harian rotifer terhadap Chlorella sp. dalam
kepadatan yang bervariasi antara 0, 5, 1, 3, 5, 8 dan 15 juta sel/ml menunjukkan bahwa laju
pemangsaan harian bertambah dengan
bertambahnya kepadatan sel Chlorella sp.
hingga ke densitas pertambahan laju pemangsaannya (YAMASAKI & HIRATA
1986, MUSTAHAL et al. 1991).
5.Nilai Gizi
Pertumbuhan dan kelangsungan hidup larva ikan laut dan udang sangat tergantung pada kualitas rotifer. Kualitas rotifer yang diberikan harus m&npunyai nutrisi yang sesuai dengan kebutuhan larva ikan. Salah satu sumber nutrisi yang tidak dapat disintesa oleh ikan itu sendiri yaitu adanya asam lemak esensial. Hal ini seperti yang diungkapkan oleh KANAZAWA (1990) bahwa kebutuhan suatu jenis ikan akan asam lemak esensial seimbang dengan asam lemak esensial yang dikandung dalam tubuhnya. Sumber asam lemak esensial yang paling penting pada ikan laut adalah eicosapentaenoat acid (20:5w3 = EPA) dan decosaheksaenoat (22:6w3 = DHA).
Rotifer yang dibudidayakan dengan pakan ragi roti saja mempunyai nilai gizi yang relatif lebih rendah bila dibandingkan dengan yang diberi pakan Chlorella sp. Hal ini telah terbukti pada beberapa hasil penelitian dalam rangka upaya peningkatan gizi pakan dengan berbagai macam emulsifier berupa kuning telur, casein, lecithin dan emulsi lemak yang berasal dari minyak ikan lemuru/sarden, minyak ikan cumi, minyak ikan cod dan
minyak jagung (REDJEKI et al. 1993). Upaya
peningkatan gizi tersebut diberi tambahan vi- tamin B-l (REDJEKI & MURTININGSIH,
1991), B-12 (YU etal 1988, UTYANI 1992)
dan vitamin E (HENDRY 1993). REDJEKI et
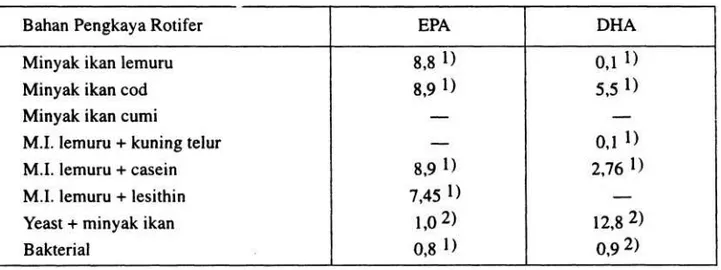
al. (1991) melaporkan pula bahwa rotifera yang akan diberikan ke larva ikan, terlebih dahulu diperkaya dengan yeast, kuning telur dan minyak ikan (scot emulsion). Beberapa bahan pengkaya yang mempunyai keunggulan dalam memenuhi kebutuhan nutrisi ikan dapat dilihat pada Tabel 2.
Tabel 2. Kandungan nutrisi pakan yang terdapat pada rotifer dan beberapa bahan pengkaya lainnya.
Sumber : 1). REDJEKI 1995b, et al. 1993 dan 1995b. 2). IMADA 1983
Peningkatan asam lemak esensial khususnya EPA dan DHA dapat ditingkatkan melalui rotifer karena dianggap sebagai pakan alami berupa sebuah kapsul yang dapat memindahkan kandungan nilai gizinya ke larva ikan. Peningkatan asam lemak esensial atau yang disebut "Enrichment", dimana pengkayaan yang dilakukan kepada rotifer dalam media tertentu selama beberapa saat. Hal ini telah dibuktikan pada beberapa jenis alga
tertentu (KITAJIMA et al. 1979) seperti
Isochrysis, Chlorella, Monochrysis
(KITAJIMA & KODA dalam KOVEN et al.
1990, KIITAJIMA et al. 1979),
Nannochloropsis sp., Tetraselmis (FUKUSHO et al. 1984). Peningkatan gizi rotifer melalui ragi roti yang diperkaya dengan asam lemak
esensial (KITAJIMA et al dalam LUBZENS
et al. 1989) demikian pula minyak ikan
(WATANABE et al. 1983), pakan buatan/pelet
(GATESCOUPE & LUQUET 1981) dan pakan buatan berupa mikrocapsul (WALFORD
& LAM dalam LUBZENS et al. 1989).
Berbagai macam alga dapat dijadikan sebagai bahan pengkaya dari hasil-hasil penelitian diperoleh alga yang paling baik
adalah Chlorella sp. yang merupakan mikro
organisme laut yang merupakan sumber produsen omega-3 HUFA. Asam lemak yang dihasilkan cukup tinggi karena mempunyai siklus rantai makanan yang pendek dan kandungan asam lemak omega-3nya cukup tinggi yaitu sebesar 20-45% dari seluruh kandungan asam lemak esensialnya. Pengkayaan rotifer dengan menggunakan alga seperti terlihat pada Tabel 3.
Pengkayaan rotifer dengan alga selama 6-24 jam dapat meningkatkan kandungan
omega-3 HUFA (KITAJIMA et al. 1979).
Ditambahkan oleh WATANABE et al (1983)
bahwa rotifer yang diberi pakan Chlorella sp. selama 12 jam dapat meningkatkan EPA sebesar 12%. Pengkayaan rotifer dengan
perbedaan umur Chlorella sp. ikut
mempengaruhi nilai gizi rotifer seperti yang dilaporkan oleh REDJEKI et al. (1995a) bahwa kandungan asam lemak esensial rotifer yang
Tabel 3.Rotifer yang diperkaya dengan berbagai macam alga
diberi Chlorella sp. dengan umur 3, 8 dan 11 hari mempunyai kandungan EPA dan DHA sebesar masing-masing 2,33 dan 0,57; 3,25 dan 0,85; 1,97 dan 0,99. Sebaliknya dengan ragi roti, rotifer yang diberi pakan ragi roti memberikan nilai gizi yang lebih rendah (EPA 1 % dan DHA 0,1 %) dibanding Chlorella sp.
(WATANABE et al. 1983).
Selain kebutuhan larva ikan laut akan asam lemak esensial yang dapat diperoleh dari minyak ikan dan alga, vitamin juga tidak kalah pentingnya untuk melengkapi kebutuhan akan asam lemak tersebut. Berbagai macam vitamin yang telah dicoba oleh beberapa pakar rotifera adalah vitamin B-12, B-l, E dan lain-lain.
Vitamin B-12 dikenal dengan berbagai bentuk yang biasa dikenal dengan 'kobalamin' atau 'sianokobalamina' yang merupakan bentuk yang paling aktif (WINAMO 1988). Dilaporkan oleh HOFFMAN (1980) bahwa vitamin B-12 merupakan salah satu faktor pertumbuhan beberapa organisme tingkat rendah, sedangkan hewan tingkat tinggi mendapatkan suplai vitamin B-12 melalui makannya seperti hati, ginjal, susu dan telur.
Ditambahkan oleh SCHUNACK et al.
(1990) menyatakan bahwa vitamin B12 mempengaruhi metabolisme asam nukleat dan protein, penting untuk pengembangan erithrosit (eritrophoresis) serta fungsi syaraf dan pertumbuhan. Selain itu vitamin B-12 juga
berperan dalam menjaga agar sel-sel tubuh dapat berfungsi.
Hasil penelitian UTYANI (1992) tentang budidaya rotifer pada berbagai salinitas dan pemberian vitamin B-12 dengan dosis berbeda. Hasil laporannya menyebutkan bahwa vitamin B-12 tidak berpengaruh terhadap umur kultur rotifer dilihat dari jumlah telur maksimum. Kebutuhan vitamin B-12 hanya dijumpai pada bakteri dan alga karena merupakan derivat dari lingkungannya (MERTZ 1987). Pemberian vitamin B-12 melebihi 0,1 mg/1 dapat menimbulkan efek letal dosis bagi rotifer. Sebaliknya dengan perlakuan salinitas, pada salinitas rendah (17 ppt) jumlah telur yang dihasilkan lebih banyak (374 ind/ml) dibanding pada salinitas tinggi (37 ppt) dengan jumlah telur 47,7 ind/ml).
Demikian halnya dengan vitamin E
(C29H50O2) yang berfungsi untuk menjaga
fungsi reproduksi agar berjalan normal disamping untuk meningkatkan pemanfaatan beberapa protein, vitamin A dan karotenoid (NICHOLAS 1976, HALVER, 1989 dan NURSANYOTO 1992). Vitamin E yang terdapat secara berlebihan dapat menyebabkan keracunan, kematian beberapa species, terhambatnya pertumbuhan, terjadi penyakit tulang dan tumbuhnya beberapa penyakit yang berhubungan dengan sistem saluran darah, sistem reproduksi dan otot (NURSANYOTO
1992). Vitamin E yang larut dalam lemak diberikan kepada rotifer dalam bentuk emulsi yang mantap.
WINARNO (1988) menyebutkan bahwa emulsi adalah suatu dispersi atau suspensi suatu cairan dalam cairan lain, yang molekul-molekul kedua campuran tersebut tidak saling berbaur tetapi saling antagonis karena mempunyai berat molekul yang sama pada kedua jenis campuran tersebut. Vitamin E biasa juga dikenal dengan "Tokoferol" yang berfungsi sebagai pendorong bekerjanya hormon-hormon sex (NURSANYOTO 1992). Ditambahkan oleh WINAMO (1988) bahwa senyawa vitamin E secara kimia ada kemiripan dengan hormon-hormon sex khususnya L- tokoferol.
HENDRY (1993) dalam penelitiannya mengenai dosis vitamin E terhadap kepadatan rotifer menyebutkan bahwa sebanyak 5 gram cairan dalam kapsul vitamin E (L-tokoferol dosis 1 Ug/ml) yang dicampur dengan 1 gram kuning telur dan 100 ml air yang dikocok selama 2-3 menit dengan pemberian cahaya pada malam hari memberikan kepadatan roti-fer sebesar 3180 ind/ml, sedangkan kultur ro-tifer tanpa cahaya memberikan kepadatan 1013,33 ind/mi. Jumlah telur yang dihasilkan pada media yang diberi cahaya sebanyak 303,5 butir/ml dan pada media tanpa cahaya sebanyak 181,97 butir/ml. Bahan-bahan pengkaya tersebut dipergunakan setelah rotifera dipanen dan diperkaya selama beberapajam, hal ini seperti yang terlihat pada Gambar 2.
6. Kualitas air
Pertumbuhan rotifer sangat dipengaruhi oleh kualitas air seperti suhu air, pH, oksigen terlarut, karbondioksida dan salinitas. Kualitas air merupakan salah satu faktor penting yang dapat menyebabkan perubahan tingkah laku organisme perairan dan dapat memperlihatkan nafsu makan berkurang atau tidak, pertumbuhan lambat atau cepat, adanya
gangguan hama dan penyakit yang akhirnya dapat mempengaruhi kelangsungan hidup ro-tifer.
a. Suhu Air
Suhu air berpengaruh terhadap fisiologi hewan dalam hal metabolisme dan kelarutan oksigen dalam air. Peningkatan suhu akan diikuti dengan meningkatnya konsumsi oksigen dan akan menurunkan daya larut oksigen dalam air. Ditambahkan oleh WATANABE (1988) bahwa suhu dapat berpengaruh terhadap pertumbuhan dan laju metabolisme. Suhu air juga mempengaruhi jumlah makanan yang dikonsumsi oleh ikan (LOVELL1977). Menurut Hukum Van't Hoff, peningkatan suhu 10°C akan meningkatkan laju reaksi biokimia 2 kali lipat. Dengan meningkatnya suhu maka konsumsi oksigen akan meningkat dan menyebabkan peningkatan konsumsi makanan yang akhirnya akan menaikkan angka pertumbuhan (FULKS & MAIN 1991), demikian pula dalam proses pemijahan dan perkembangan embrio yang normal (BENNET 1970).
Alat yang digunakan untuk memonitor pemeliharaan rotifer terhadap perubahan suhu adalah menggunakan sistem chemostat dan turbidostat dengan cara menjaga medium kultur secara kontinyu (BORASS 1983; BENNET & BORASS 1988). Pada prinsipnya ialah menjaga homeostatis dalam tangki kultur dengan memanen rotifer dan mengganti mediumnya secara otomatis (JAMES & ABU- RESEQ. 1989).
Kisaran suhu air yang baik untuk pertumbuhan rotifer adalah 20-30°C (FULKS & MAIN 1991), sedangkan pada seat reproduksi, suhu maksimum antara 30-34°C (THEILACKER & MC MASTER dalam FULKS MAIN 1991). Rotifer tipe L hidup optimal pada suhu 10-25°C dan tipe S pada suhu 25-35°C. Suhu yang lebih besar 20°C akan memperlihatkan bentuk lorika yang bundar dan duri yang tajam serta akan
memperlihatkan reproduksi yang lebih baik, sedangkan suhu dibawah 20°C akan memperlihatkan bentuk lorika yang panjang dan dun lorika yang tumpul (ITO et al. dalam FUKUSHO & OKAUCHI 1982). Suhu air pada kultur rotifera antara 3-4°C dapat menyebabkan "thermal shock" dan antara 10- 15°C dapat menyebabkan kematian (BOYD 1982). Perubahan suhu pada kultur rotifer sebesar 0,2°C permenit masih dapat ditolerir.
Pengaruh suhu sangat berperan dalam pertumbuhan rotifer, seperti dilaporkan oleh MUSTAHAL (1993) bahwa rataan laju pertumbuhan rotifer pada media suhu sebesar 15,25 dan 35°C masing-masing dari 0,25; 0,85 dan 0,95 /hari menjadi 0,35; 2,5 dan 2,67/hari. Dalam waktu 8 bulan kultur pada media terkontrol, produksi rotifer jenis S pada masing- masing suhu bertambah dari rata-rata 26, 195 dan 156 ind./ml/hari menjadi 58,182 dan 190 ind/ml/hari, dimana penggantian medium setiap 2 - 4 hari sekali. Dalam penyimpanan rotifer, suhu juga mempengaruhi kualitas
roti-fer, hal ini dilaporkan oleh LUBZENS et al.
(1990) yang berhasil menyimpan rotifer pada suhu 40°C dalam waktu lama tanpa harus mengganti medium pemelihaannya.
b. pH
pH adalah ukuran dari konsentrasi ion hidrogen dan dapat menunjukkan suasana air tersebut apakah asam atau basa. pH merupakan logaritma negatif dari aktifitas ion hidrohen dimana ion hidrogen yang diukur bukan konsentrasi ion hidrogen tetapi aktifitas ion hidrogen (BOYD 1982). Aktifitas ion adalah konsentrasi termodinamik dari ion yaitu dalam mol/1 (BOYD 1990). Di alam, pH perairan dipengaruhi oleh konsentrasi karbondioksida (CO2) dan senyawa yang bersifat asam. Fitoplankton dan tanaman air lainnya akan
mengambil CO2 dari air selama proses
fotosintesis sehingga mengakibatkan pH air
meningkat pada slang hari dan menurun pada malam hari.
p H s e c a r a t i d a k l a n g s u n g mempengaruhi pertumbuhan populasi rotifer, tergantung dari jenis makanan yang diberikan dan dapat mempengaruhi jumlah amoniak bebas (YU & HIRAYAMA 1986). Pertumbuh-an rotifer membutuhkPertumbuh-an kisarPertumbuh-an pH optimum antara 5-9 (FUKUSHO, 1989a), 7,5-8,5
(HOFF & SNELL dalam FULKS & MAIN
1991). Pada saat kepadatan rotifer maximum, nilai pH antara 6-8. Pada pH dibawah 4,5 dan diatas 9,5, rotifer tidak dapat hidup
(SCHUSTER & GROENEWEG dalam
INSAN & CHUMAIDI 1986). c. Oksigen Terlarut
Pada budidaya secara intensif, para-meter oksigen terlarut merupakan hal yang sangat penting karena dapat menghambat usaha budidaya tersebut. Konsentrasi oksigen menurun dengan meningkatnya salinitas (BOYD 1982). Ditambahkan pula bahwa kadar oksigen terlarut yang diperlukan untuk kelangsungan hidup ikan sangat bervariasi tergantung dari lamanya waktu pemaparan. Konsentrasi oksigen terlarut sebesar 0,3 ppm akan mempengaruhi ikan-ikan kecil dan dapat bertahan hidup dalam waktu singkat, antara 0,3-l ppm, ikan dapat mematikan jika dibiarkan terlalu lama. Antara 1-5 ppm ikan dapat bertahan hidup tetapi jika terlalu lama dibiarkan maka ikan tidak mau makan dan pertumbuhannya lambat. Oksigen terlarut diatas 5 ppm merupakan konsentrasi yang diinginkan untuk pertumbuhan dan kelangsungan hidup ikan. Batas konsentrasi oksigen terlarut yang dapat ditolerir oleh ikan sangat berbeda tergantung dari jenisnya. Jumlah oksigen yang dikonsumsi oleh rotifer pada suhu air 10°C adalah 7,07x10-5 ml/hari, pada suhu air 25° C 10,04x10-5 ml/hari dan pada suhu 30°C sebesar 16,48xl0~5ml/hari (FUKUSHO 1989b).
d. Salinitas
Salinitas merupakan konsentrasi semua ion-ion dalam air (BOYD, 1990). Walaupun rotifer dapat mentolerir salinitas, perubahan salinitas yang menyolok pada kultur rotifer akan menyebabkan reproduksi sexual dan akan menghasilkan telur dorman (ANONYMOUS
1985, HAGIWARA et al. 1988, FULKS and
MAIN 1991). Jika terdapat perubahan salinitas yang besar dalam waktu yang singkat maka rotifer akan stress dan aktifitas berenangnya
terhenti (LUBZENS et al., 1989, HOFF &
SNELL dalam FULKS & MAIN 1991).
Ditambahkan pula bahwa rotifer dapat mentolerir salinitas dengan kisaran 1-60 ppt, tetapi salinitas terbaik untuk pertumbuhan antara 10-20 ppt. Untuk mendapatkan kepadatan rotifer tertinggi dan induk rotifer yang membawa telur terbanyak dijumpai pada media kultur bersalinitas 10-15 ppt (REDJEKI 1995a). Hasil penelitian NAINGGOLAN (1996) pada rotifer yang diberi perlakuan salinitas sebesar 3, 6, 9, 12 dan 15 g/kg diperoleh jumlah telur masing-masing sebesar 80, 66, 64, 61, 70 butir, kepadatan populasi rotifer masing-masing sebanyak 31, 39, 42, 41, 85 ind/ml dan laju pertumbuhan rata-rata masing-masing perlakuan adalah sebesar 0,21, 0,261, 0,527, 0,4, 0,343.
e. Intensitas Cahaya
Cahaya secara tidak langsung dapat mempengaruhi fotosintesa bakteri dan mikroalga yang terdapat dalam tangki kultur dan dapat tumbuh subur serta dapat digunakan sebagai pakan rotifer (FUKUSHO 1989b). Sebagian besar jenis rotifer sangat bereaksi positif dengan cahaya dan sebagian lainnya menghindari cahaya demikian pula terhadap rotifer pelagik lebih responsif terhadap cahaya dibanding rotifer bentik (HYMAN 1951).
Menurut HOFF & SNELL dalam
FULKS & MAIN (1991), intensitas cahaya yang diperlukan untuk kultur rotifer dalam ruangan tidak melebihi 2.000-lux dan
dianjurkan menggunakan photoperiod selama 18:6 jam untuk siklus terang dan gelap per harinya.
f. Senyawa-senyawa Organik
Senyawa organik terpenting pada
budidaya adalah NH3-N (amoniak), NO2-N
(nitrit)dan N03-N (nitrat). Senyawa organik
dari unsur alami didalam air maupun yang berasal dari cemaran dan perombakan bahan- bahan pupuk, kotoran atau pakan yang diberikan dalam jumlah berlebihan. Menurut YU & HIRAYAMA(1986), kandungan senyawa N anorganik yang meningkat dalam media kultur langsung menurunkan densitas rotifer.
Amoniak merupakan produk hasil metabolisma dan pembusukan senyawa
organik oleh bakteri. Amoniak (NH3)
berbentuk ion adalah racun untuk budidaya
sedangkan NH4 tidak berbahaya kecuali bila
konsentrasinya sangat tinggi (CHOLIK 1987). Konsentrasi amoniak bebas tidak melebihi 1 mg/1 pada kultur rotifer (HOFF & SNELLL dalam FULKS & MAIN, 1991). Jumlah NH3
dapat diakibatkan oleh pH yang tinggi, suhu yang tinggi dan pada salinitas tinggi. Adanya amoniak bebas dalam kultur rotifer akan mempengaruhi peningkatan jumlah populasi rotifer pada kultur massal (YU & HIRAYAM A
1986). Kadar NH3-N 17 ppm menyebabkan
penurunan populasi sebanyak 50% dalam
waktu 24 jam sedangkan NO2-N sebesar 10,5-
20 ppm sudah bersifat toksik bagi hewan air
laut. Sedangkan kadar NO3-N sebesar 1000
ppm bersifat toksik.
Dengan makin bertambahnya umur kultur jasad pakan maka makin banyak akumulasi bahan-bahan tersebut. Akibatnya akan meracuni jasad pakan yang dikultur dan menghambat pertumbuhannya oleh karena itu suatu cara yang paling praktis adalah mengusahakan media kultur diperbaharui. dalam waktu yang tidak terlalu lama agar tidak terjadi akumulasi senyawa-senyawa beracun tersebut.
g. Logam Berat
Setiap jasad pakan hidup aktif dalam menyerap unsur hara atau logam dari media budidaya, oleh sebab itu untuk menghindari penumpukan bahan cemaran dan logam berat dalam individu jasad pakan hidup maka me-dia budidaya yang digunakan harus mengikuti baku mutu air sesuai dengan SK Menteri Kependudukan dan Lingkungan Hidup No.2/ Men.KLH/88 yaitu Hg 0,003 ppm, Pb 0,01 ppm, Cd 0,01 ppm, Zn 0,1 ppm, Cu 0,06 ppm, Ag 0,05 ppm, Se 0,005 ppm, Cr 0,01 ppm, Ar 0,01 ppm dan Ni 0,002 ppm (KLH, 1988).
BUDIDAYA
Keberhasilan suatu usaha pembenihan ikan laut sangat ditentukan oleh penyediaan jasad pakannya yaitu rotifer (B. plicatilis). Beberapa metoda yang telah banyak dilakukan di tempat-tempat pembenihan adalah metoda panen harian, penambahan air dan konvensional. Ketiga metoda tersebut akan diuraikan lebih lanjut dibawah ini.
a. Metoda Panen Harian
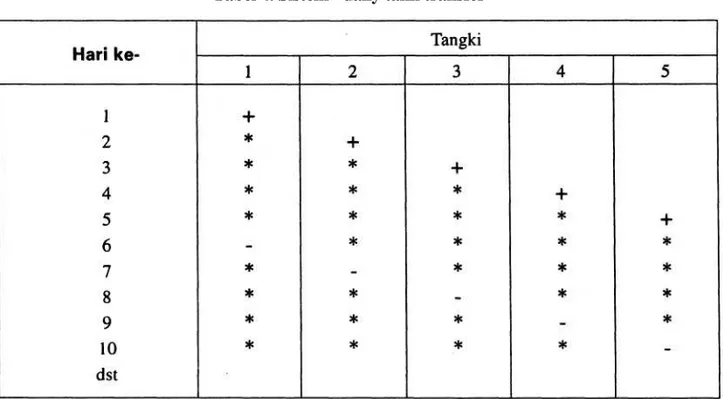
Kultur rotifer dengan sistem ini umumnya digunakan di panti pembenihan karena selain memudahkan si pengelola juga mudah dalam memonitor selama kultur. Pada sistem ini menggunakan metoda "daily tank transfer" seperti pada tabel 4 dibawah ini.
Padat penebaran awal rotifer adalah 10 ekor/ml. Awalnya rotifer diberi pakan ragi roti dengan dosis 0,3 9/1 juta rotifer/hari. Sementara itu kultur rotifer dilakukan di tempat lain. Bila kepadatan rotifer telah mencapai kurang lebih 100 ekor/ml maka 30% volume airnya dibuang dan diganti dengan air yang
berasal dari media Chlorella sp. dengan
kepadatan 20-30 juta sel/ml. Untuk selanjutnya rotifer dapat dipanen setiap hari dengan cara menyipon 30% dari volume medium dan
menyaringnya dengan plankton net ukuran 90 mikron, kemudian rotifer tersebut dikembalikan kedalam tangki budidaya. Panen harian dapat dilakukan selama 2-3 bulan. Bila air media telah kotor, maka 80% volume air harus diganti dengan cara menyipon. Setelah itu tangki budidaya diisi dengan air Chlorella sp. sampai penuh. Pencucian tangki filter harus dilakukan setiap 5-7 hari sekali.
Hasil penelitian kultur rotifer dengan sistem panen harian pada salinitas berbeda diperoleh nilai kepadatan rotifer tertinggi sebesar 162 ind/ml pada salinitas 10 ppt. Persentasi terbesar induk rotifer yang membawa telur sebesar 275% yang diperoleh pada salinitas 20 ppt. Ukuran panjang lorika rotifer antara 75-190 Um dengan lebar antara 64-150 Um (REDJEKI & ISMAIL 1995a). b. Sistem Penambahan Air
Sistem ini juga menggunakan metoda "daily tank transfer". Pada sistem ini menggunakan tangki kultur Chlorella dan ro-tifer yang terpisah. Sistem ini menggunakan 5 buah tangki. Adapun cara dengan sistem ini sebagai berikut: pada hari pertama, kultur ro-tifer pada media Chlorella dan air laut serta air tawar sebanyak 30%, hari kedua menjadi 60% dan hari ketiga 100%. Pada hari keempat dan kelima, kultur rotifer dipanen sampai menjadi 100% dan hari keenam dapat dipanen total untuk diganti seperti semula.
Hasil penelitian REDJEKI (1995a) dilaporkan bahwa kultur rotifer dengan sistem penambahan air pada salinitas berbeda diperoleh angka kepadatan tertinggi sebanyak 470 ind/ml pada salinitas 10-15 ppt. Persentasi terbesar induk rotifer yang membawa telur sebesar 128% yang diperoleh pada salinitas 10- 30 ppt. Ukuran panjang lorika rotifer antara 76-143 mikron dan lebar 63-114 mikron. Dari hasil penelitian diperoleh bahwa ukuran roti-fer tergolong kedalam tipe "S".
Tabel 4. Sistem "daily tank transfer"
Keterangan: + = inokulasi * = penambahan air
- = panen dan inokulasi baru.
c. Sistem Konvensional
Sistem ini juga menggunakan metoda "daily tank transfer" dimana menggunakan
tangki kultur Chlorella dan rotifer yang
berbeda. Kultur Chlorella sp. dilakukan pada tangki yang jauh terpisah dengan kultur rotifer. Pada sistem ini tangki rotifer diisi dengan media Chlorella. Setelah kepadatan Chlorella sp. mencapai 20-30 juta sel/ml, benih rotifer diinokulasikan dengan padat penebaran 10
ekor/ml. Setelah kepadatan Chlorella turun
antara 1-3 juta sel/ml, maka rotifer harus dipanen dengan cara menyipon dan menyaringnya dengan plankton net ukuran 90 Um. Sistem ini dapat diperoleh kepadatan rotifer sebesar 100-300 ind/ml.
DAFTAR PUSTAKA
ANONYMOUS 1985. Budidaya rotifera (Brachionus plicatilis O.F.Muller). Seri ketiga. Proyek Penelitian dan pengembangan Budidaya Laut (ATA- 192). Kerjasama antara Sub Balai Penelitian Budidaya Laut dan Japan International Cooperation Agency : 16 pp.
BENNET G.W. 1970. Management of lakes and ponds. Second edition.Published by Van Nostrand Reinhold Company. New York : 375 pp.
BENNET W.N. and M.E. BORASS 1988. Iso-lation of a fast growing strain of the rotifer Brachionus callyciflorus Pallas using turbidostaat culture. Aquaculture 73(1): 27-36.
BORASS W.E. 1983. Population dynamic of food limited rotifers in two stage
chemostat culture. Limnology,
Oceanography 28(2): 546563.
BOYD C.E., 1982. Water quality management for fish culture. Elsevier. Science publishers B.V. Amsterdam : 318 pp. BOYD C.E. 1990. Water quality in ponds for
agriculture. Birmingham Publishing Co. Birmingham, Alabama; 482 pp.
CHOLIK r. 1987. Dasar-dasar bertambak udang intensif. Direktorat Jenderal Perikanan, Jakarta.
CHOTIYAPUTTA C. dan K. HIRAYAMA 1978. Food selectivity of the rotifer, Brachionus plicatilis feeding on phy- toplankton. Japan Marine Biology 45. CHUMAIDIS. ILYAS, YUNUS, SACHLAN,
R.UTAMI, A. PRIYADI, P.T. IMANTO, S.T. HARTATI, P. BASTIAWAN, Z. JANGKARU, R. ARIFUDIN 1992. Petunjuk teknis budidaya pakan alami ikan dan udang. Pusat Penelitian dan Pengembangan Perikanan, Jakarta : 84 pp.
DANAKUSUMAH E. dan P.T. IMANTO 1987. Pakan alami dalam usaha pembenihan ikan dan udang. Sub Balai Penelitian Budidaya Pantai Bojonegara-Serang.
FUKUSHO K. and H. IWAMOTO 1980. Cyclomorphosis in size of the cultured rotifer Brachionus plicatilis. Bull. Nat. res. Inst. Aquaculture 1 : 29-37.
FUKUSHO K. dan M.OKAUCHI 1982. Strain
and size of the rotifer, Brachionus
plicatilis being cultured in South East Asian Countries. Bull. Natl. Res. Ins. Aquaculture 3: 107-109.
FUKUSHO K., M. OKAUCHI S. NURAINI A.TSUJIGADO and T. WATANABE 1984. Food value of rotifer Brachionus plicatilis culture with Tetraselmis tetrathele for larvae of Red Sea Bream (Pagrus major). Bull, of Japanese Soc. Sci.Fish. 50 (8): 1439-1444.
FUKUSHO K., M. OKAUCHI H. TANAKA P. KRAISINGDECHA S. I. WAHYU-NI, 1985. Food value of a rotifer Brachionus plicatilis culture with Tetraselmis tetrathele for larvae of a flounder Paralychthys olivaceus. Bull. Nat. res. Inst. Aquaculture 1 : 29-36. FUKUSHO K. 1989a. Biology and mass
pro-duction of the rotifer, Brachionus
plicatilis (1). Int. Jour. Aqua. Fish. Tech. 1 : 232-240.
FUKUSHO K. 1989b. Biology and mass
pro-duction of the rotifer, Brachionus
plicatilis (2). Int. Jour. Aqua. Fish. Tech. 1 : 292-299.
FULKS W. and K. L. MAIN 1991. Rotifer and microalgae culture systems. Pro-ceeding of a U.S. Asia workshop. The Oceanic Institute, Honolulu, Hawaii 364 pp.
FUJITA S. 1973. Importance of zooplankton mass culture in producing marine fish seed for fish farming. Bull. Plankton Soc. Japan 20 (1): 49-53.
GATESCOUPE F.J. and P. LUQUET 1981. Practical diet for mass culture of the Brachionus plicatilis. Application to larval rearing of sea bass Dicentrarchus labrax. Aquaculture 22 : 149-163.
HAGIWARA A., A.HINO and R. HIRANO 1988. Effects of temperature and chlo- rinity on resting egg formation in the rotifer, Brachionus plicatilis. Nippon Suisan Gakkaishi. 54 (4) : 569-575. HALVER J.E 1989. The vitamins. In fish
nu-trition. Edited by John E. Halver. Aca-demic Press, Inc. San Diego, California : 789 pp.
HENDRY 1993. Pengaruh dosis L-tokoferol yang berbeda terhadap pertumbuhan populasi Brachionus plicatilis, Jurusan Manajemen Sumberdaya Perairan, Fak. perikanan, Institut Pertanian Bogor, Bogor : 140pp .
HIRATA H. 1974. An attempt to apply on ex-perimental microcosm for mass culture of marine rotifer, Brachionus plicatilis,
Mullen Fac. Fish., Univ. Kagoshima,
Japan 22: 163-172.
HIRATA H. 1980. Culture methods of the marine rotifer Brachionus plicatilis. Min. Rev. Data file. Fish. Res 1 : 27-46. HOFFMAN. F. 1980. The nutrition of fish.
Information service of the vitamin De-partment. La Roche and Co. Ltd. Basle : 47 pp.
HYMAN L. H. 1951. The invertebrates: Acanthocephala, Ascelminthes and Entoprocta. The Pseudocoelomata bilateria. Vo. III. Me. G raw Hill Book Company. Inc. New York : 572 pp. IMADA O. 1983. Feeding and environmental
condition. In : The rotifer, Brachionus plicatilis. Biology and Mass culture, Kosheisa-Keisaku, Tokyo : 129-155. ITO T. 1963. Fundamental problems on the
rearing of ayu, Pleoglossussus altivelis. 36 th Japan. Lakes-rivers. Aquaculture. Res. Conf. Spec. Ed :1-24.
ITO S H. Sakamoto M. Hori and K. Hirayama 1981. Morphological characteristics and suitable temperature for the growth of several strains of the rotifer, Brachionus plicatilis. Bull. Fac. Fish. Nagasaki Univ. 51 (6) : 9-16.
INSAN I. dan CHUMAIDI 1986. Pengaruh umur dan kepadatan kultur Chlorella sp. terhadap perkembangan populasi Brachionus sp. Balai Penelitian Perikanan Air Tawar. Bull. Pen. Perik. Darat 5 (2) : 1-5.
JAMES CM. dan T.S. ABU REZAQ 1989. An intensive chemostat culture system for the production of rotifer for aquacul- ture. Aquaculture 81 (2) : 291-301. KANAZAWAA. 1990. Fish nutrition. Special
Seminar. Pusat Penelitian dan penyambangan Perikanan, Jakarta.
KLH 1988. Surat Keputusan Menteri Negara Kependudukan dan Lingkungan Hidup No.02/Men.KLH/1988. tanggal 19 Januari 1988.
KITAJIMA C, S. FUJITA F. OHWA. Y.YONE and T. WATANABE 1979. Improve-ment of dietary value for Red Sea Bream larval of the rotifer Brachionus plicatilis cultured with baker yeast Saccharomyces cereviceae. Bull. Japan. Soc. Sci. Fish. 45 : 469-471.
KOVEN W. M., A. TANDLER G. W. KISSIL D. SKLAN O. FRIEZLANDER and M. HARELI1990. The effect of dietary (n- 3) polyunsaturated fatty acid on growth. Survival and swim bladder develop- ment in Sparus aurata larvae, Aquacul- tore 91 : 131-134.
LOVELLR.T. 1975. Nutritional deficiencies in intensive cultured catfish in the pathology offishes. The Univ. of Wisconsin, Press. Madison : 721 - 731.
LUBZENS E.A., A. TANDER and G. MINKEFF 1989. Rotifer as food in aquaculture. National centerfor mari- culture Israel Oceanographic and imnological research, Israel. Hydrology 2(186/187) : 387-400.
LUBZENS E., G. Kolodny B. Perry N. Galai R. Sheshinski and Y. Wax 1990. Fac- tors affecting survival of rotifers, Brachionus plicatilis O.F. Mullerat 4°C. Aquaculture 91 (1): 186-203.
MARSHALL A.J. and W.D. WILLIAM 1967. Text book of zoology invertebrates. English language book Society and Mc. Millan. The Mc. Millan press Ltd, Melbourne.
MERTZ, W. 1987. Trace elements in human and animal nutrition, Vol. I. Fifth edition. Academic Press. Inc. Harcourt Brace Jovanovich, Publishers San Diego: 143-177.
MUSTAHAL Y. NISHIOKAS. YAMASAKI and H. HIRATA 1991. A trial of species improvement in culture of rotifer, Brachionus plicatilis by temperature, control and steady state of feeding. Suisan Zoshoku 39 (3) : 295-301. MUSTAHAL 1993.Metoda seleksi untuk
mempertinggi laju rotifera, Brachionus plicatilis. Jurnal Penelitian Budidaya Pantai 9(5): 49 -58.
MUSTAHAL 1995. Laju pertumbuhan dan tingkat pemangsaan protozoa, Euplotes sp. dalam medium yang berbeda hubungannya dengan penyediaan jasad pakan bagi perbenihan ikan laut. Prosiding Seminar Sehari Hasil Penelitian Sub Balai Penelitian Budidaya Pantai Bojonegara-Serang. Pros. No.01/Pros./03/95 : 140-146.
NAINGGOLAN M., 1996. Peranan salinitas (3, 6, 9, 12, 15 g/kg) terhadap produksi Brachionus plicatilis. Fakultas
Perikanan, Jurusan Budidaya Perairan Institut Pertanian Bogor : 63 pp.
NASH C, C. M. KUO and S.C. McCONNEL 1974. Operational procedure for rearing larvae of the grey mullet, Mugil cephalus. Aquaculture 3 (1) : 15-24. NICHOLAS L. 1976. Ilmu gizi dan ilmu diit di
daerah tropik. Alih bahasa: Achmad Djaeni Sediaoetama. PN. Balai Pustaka. Jakarta: 675 pp.
NURSANYOTO H. 1992. Ilmu Gizi, Zat Gizi Utama. PT. Golden Terayo Press. Jakarta: 162 pp.
OLSEN J. O. and F. MiNCY 1983. A techni- cal solution to the mass culturing of lar- val turbot. Aquaculture Eng. 2 (1) : 1-12. RACHMASARIM. 1989. Studi pertumbuhan
rotifer (Brachionus plicatilis) dengan pakan Chlorella sp. Tetraselmis dan ragi roti. Fak. Perikanan, Institut Pertanian Bogor : 72 pp.
REDJEKI S.; R. PURBA S. MURTI- NINGSIH, A. BASYARIE dan T. AHMAD 1991. Penyediaan jasad pakan untuk pemeliharaan larva kakap
putih (Lates calcarifer) dan kerapu
(Epinephelus fuscoguttatus). Bull. Pen. Perikanan, Special Edition No. 2 : 23-30. REDJEKI S., R. PURBA dan P.T. EVIANTO
1993. Pengkayaan rotifer untuk meningkatkan pertumbuhan dan kelangsungan hidup larva kakap putih Lates calcarifer. Jur. Pen. Bud. Pantai 9 (5) : 65-75.
REDJEKI S. 1995a. Kultur rotifer dengan sistem penambahan air pada salinitas berbeda. Jurnal Fisheries Garing Edisi Vol. 4 (1) Pebruari, Univ. Riau, Padang: 7-11 pp
REDJEKI S., 1995b. Peningkatan gizi rotifera melalui pengkayaan serta hubungannya dengan pertumbuhan dan kelangsungan hidup larva ikan laut dan udang karang. Kongres limu Pengetahuan Nasional (KIPNAS VI) di Serpong tanggal 1 1 - 1 5 September 1995 : 13 pp.
REDJEKI S. dan A. ISMAIL, 1995a. Kultur rotifer dengan sistem panen harian pada salinitas berbeda. Prosiding Seminar Sehari Hasil Penelitian Subalitkandita Bojonegara-Serang. Pros. No.0l/Pros./ 03/95: 171-182.
REDJEKI S., S. MURTININGSIH dan MUSTAHAL 1995a. Kandungan HUFA-omega-3 rotifer yang diberi pakan Chlorella sp. dengan umur yang berbeda. Makalah penunjang pada prosiding Seminar Kongres llmu Pengetahuan Nasional ke VI tanggal 24-27 Agustus di Serpong, Tangerang. REDJEKI S., R. PURBA, S.MURTININGSIH
dan P.T. IMANTO 1995b. Peningkatan nutrisi jasad pakan untuk meningkatkan pertumbuhan dan kelangsungan hidup larva kakap putih (Lates calcarifer). Pros. Kongres Biologi National XIV di Depok tanggal 24-27 Juli 1995 : 17 pp. SCHUNAK. W., K. MAYER and M. HAAKE
1990. Senyawa obat. Buku pelajaran kimia farmasi, Edisi II. Gajahmada Univ. Press. Yogya : 606-611.
TESHIMA S., A. KANAZAWA and M. SAKAMOTO 1980. Attempt to culture the rotifer with micro encapsulated
diets. Nippon Suisan Gakkaishi 44
(12) : 1351-1355.
UTYANI 1992. Pengaruh pemberian vitamin B12 pada berbagai dosis terhadap populasi rotifer (Brachionus plicatilis) yang diberi pakan Chlorella sp. pada salinitas 17 dan 37 . Jurusan Budidaya Perairan, Fak. Perikanan, IPB, Bogor. WATANABE T., C. KITAJIMA and S.
FUJITA1983. Nutritional value of live organism used in Japan for mass propagation of fishes review. Aquacul- ture 34 : 115-143.
WATANABE T., 1988. Fish nutrition and mariculture. JICA textbook. The general aquaculture course. Kanagawa International Fisheries Training Centre. JICA : 233 pp.
WINARNO F.G. 1988. Kimia pangan dan gizi. Gramedia, Jakarta.
YAMASAKI S. and H. HIRATA 1986. Food consumption rates of two types of rotifer, Brachionuspikatilis. Aquacul- ture 34 : 137-140.
YU J.P. and K. HIRAYAMA 1986. The effect of un-ionized ammonia on the population
growth of the rotifer, Brachionus
pticatilis in mass culture. Bull. Japan, Soc. Sci. Fish 52 (9) : 1509-1513. YU J.P., A. HINO, R. HIRANO and K.
HIRAYAMA 1988. Vitamin B 1 2 producing bacteria as a nutritive complement for a culture of rotifer, Brachionus plicatilis. Nippon Suisan Gakkaishi, Tokyo, 54 (11) : 1873-1880.