Produksi Masal Inokulum Azotobacter, Azospirillum dan Bakteri
Pelarut Fosfat dengan Menggunakan Media Alternatif
RICHARD GUNAWAN A14062223
PROGRAM STUDI MANAJEMEN SUMBERDAYA LAHAN DEPARTEMEN ILMU TANAH DAN SUMBERDAYA LAHAN
FAKULTAS PERTANIAN INSTITUT PERTANIAN BOGOR
RINGKASAN
RICHARD GUNAWAN. Produksi Masal Inokulum Azotobacter, Azospirillum dan Bakteri Pelarut Fosfat dengan Menggunakan Media Alternatif. Dibimbing oleh ISWANDI ANAS dan FAHRIZAL HAZRA.
Azospirillum, Azotobacter dan bakteri pelarut fosfat adalah jenis mikroba yang paling umum digunakan dalam pupuk hayati. Untuk mendapatkan inokulan pupuk hayati yang baik, tingginya jumlah sel inokulan, bahan pembawa yang baik serta metode sterilisasi merupakan faktor paling penting dalam menentukan kualitas pupuk hayati.
Terkait jumlah sel inokulan dalam bahan pembawa, media tumbuh yang digunakan untuk menumbuhkan sel-sel mikroba memainkan peran yang sangat penting. Untuk produksi massa sel mikroba, media harus mampu mendukung pertumbuhan mikroba yang cepat dengan jumlah sel yang tinggi dengan harga yang murah. Penelitian ini bertujuan untuk mencari media tumbuh mikroba yang mampu mendukung pertumbuhan mikroba yang cepat dengan jumlah sel yang tinggi, media mudah didapatkan dan harganya murah.
Penelitian dilakukan di Laboratorium Bioteknologi Tanah, dan Kimia dan Kesuburan Tanah Laboratorium, Departemen Ilmu Tanah dan Sumberdaya Lahan, Fakultas Pertanian, Institut Pertanian Bogor.
Hasil penelitian menunjukkan bahwa media IPB RI-1 dapat menghasilkan 1010 cfu/ml Azotobacter, 108 cfu/ml Azospirillum dan 109 cfu/ml Bakteri Pelarut Fosfat. Media Nutrient Broth hanya mampu menghasilkan jumlah mikrob sebanyak 108 cfu/ml media. Ini berarti bahwa media IPB RI-1 mampu meningkatkan populasi Azotobacter 100 kali lipat dan Bakteri Pelarut Fosfat meningkat 10 kali lipat dari populasi mereka di dalam media Nutrient Broth. Media IPB RI-2 mampu meningkatkan populasi Azotobacter 10 kali lipat dibandingkan dengan media Nutrient Broth. Biaya bahan media IPB RI-1 dan IPB RI-2 sangat murah dibandingkan dengan biaya bahan media Nutrient Broth. Biaya bahan media IPB RI-1 hanya 3% ( Rp. 945) dan IPB RI-2 sekitar 2 % (Rp. 690) dari biaya media Nutrient Broth ( Rp.27.752).
Kata Kunci : Media alternatif, Nutrient Broth, Azotobacter, Azospirillum, Bakteri Pelarut Fosfat
SUMMARY
RICHARD GUNAWAN. Mass Production of Innoculant Azotobacter, Azospirillum and Phospate Solubilizing Bacteria Using Alternative Media. Supervised by ISWANDI ANAS and FAHRIZAL HAZRA.
Azotobacter, Azospirillum and phosphate solubilizing bacteria are the most commonest microbial inoculant used in preparation of biofertilizer. To have good biofertilizers inoculant, the high number of inoculant cells, and good carriers as well as the method of carriers sterilization are among the most important factors determined the quality of biofertilizer.
Related to the number of inoculant cells in carriers, the growing medium used to cultivate the microbial cells plays very important role. For mass production of microbial cells of inoculant, the medium should be able to support fast growth with high number of microbial cells of inoculant but the price of medium should be reasonably cheap. This study aimed to find cheap growing medium that can support high number of microbial inoculant cells and the components of the medium should be easy to obtain and the price is cheap.
The study was conducted at the Laboratory of Soil Biotechnology, and the Laboratory of Soil Chemistry and Soil Fertility, the Department of Soil Science and Land Resources, Faculty of Agriculture, Bogor Agricultural University (IPB). The results showed that the media IPB RI-1 was able to support the growth of 1010 cfu / ml Azotobacter, 108 cfu / ml Azospirillum and 109 cfu / ml Phospate Solubilizing Bacterium. The Nutrient Broth media was only able to produce microbial cells much as 108 cfu / ml media. This means that the media IPB RI-1 increased 100-fold population of Azotobacter compared to the growth of this bacterium in Nutrient Broth and Phospate Solubilizing Bacteria increased 10-fold of their population in Nutrient Broth medium. The costs of the IPB RI-1 and IPB RI-2 were much cheaper compared to the cost of Nutrient Broth media. The cost of media IPB RI-1 only 3% (Rp 945) and IPB RI-2 about 2% (Rp 690) of the cost of media Nutrient Broth (Rp 27.752).
Keywords : Alternative media, Nutrient Broth, Azotobacter, Azospirillum, Phospate Solubilizing Bacteria
Produksi Masal Inokulum Azotobacter, Azospirillum dan Bakteri
Pelarut Fosfat dengan Menggunakan Media Alternatif
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar SARJANA PERTANIAN
pada Fakultas Pertanian, Institut Pertanian Bogor
RICHARD GUNAWAN A14062223
PROGRAM STUDI MANAJEMEN SUMBERDAYA LAHAN DEPARTEMEN ILMU TANAH DAN SUMBERDAYA LAHAN
FAKULTAS PERTANIAN INSTITUT PERTANIAN BOGOR
Judul Penelitian : Produksi Masal Inokulum Azotobacter, Azospirillum dan Bakteri Pelarut Fosfat dengan Menggunakan Media Alternatif
Nama : Richard Gunawan
NRP : A14062223
Menyetujui,
Pembimbing I Pembimbing II
Prof. Dr. Ir. Iswandi Anas, M.Sc Ir. Fahrizal Hazra, M.Sc NIP.19500509 197703 1 001 NIP.19631120.198903 1 002
Mengetahui,
Ketua Departemen Ilmu Tanah dan Sumberdaya Lahan
Dr. Ir. Syaiful Anwar, M.Sc NIP: 19621113 198703 1 003 Tanggal Lulus :
RIWAYAT HIDUP
Penulis dilahirkan di Medan pada tanggal 14 Februari 1988 dari pasangan drs. Haider Purba dan Healthy Sitorus. Penulis merupakan anak kedua dari tiga bersaudara.
Penulis memulai studinya di Taman Kanak-Kanak (TK) Mardi Yuana 2 Bogor tahun 1992 dan kemudian melanjutkan ke Sekolah Dasar (SD) Mardi Yuana 2 Bogor dan lulus pada tahun 2000. Setelah itu penulis melanjutkan studi ke Sekolah Menengah Pertama (SMP) Mardi Yuana 2 Bogor, dan lulus pada tahun 2003. Selanjutnya, penulis melanjutkan studi ke Sekolah Menengah Atas Negeri (SMAN) 3, Bogor dan lulus pada tahun 2006. Pada tahun yang sama dengan kelulusan SMA, penulis diterima di Institut Pertanian Bogor (IPB) melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB). Setelah menjalankan Tingkat Persiapan Bersama (TPB) pada tahun pertama di IPB, penulis diterima di Program Mayor Manajemen Sumberdaya Lahan, Departemen Ilmu Tanah dan Sumberdaya Lahan, Fakultas Pertanian.
Selama menjalankan studi di Institut Pertanian Bogor, penulis pernah tergabung dalam kepanitiaan Soilidarity 2008 sebagai wakil ketua, kepanitiaan Seminar dan Loka Karya Nasional 2008 : Strategi Penanganan Krisis Sumberdaya Lahan untuk Mendukung Kedaulatan Pangan dan Energi pada Divisi Publikasi dan Dokumentasi, kepanitiaan Seminar Nasional HMIT : Soil and Mining 2008 pada Divisi Acara dan kepanitiaan Seminar Nasional HMIT : Soil and Palm Oil 2009 pada Divisi Publikasi dan Dokumentasi. Selama itu penulis juga pernah tergabung dalam Himpunan Mahasiswa Ilmu Tanah sebagai Ketua Divisi Hubungan Masyarakat dan Media Informasi pada tahun tahun 2008-2009.
KATA PENGANTAR
Puji syukur atas kehadirat Tuhan Yang Maha Esa yang telah memberikan nikmat serta anugrah-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi ini dengan baik.
Skripsi yang berjudul Produksi Masal Inokulum Azotobacter, Azospirillum dan Bakteri Pelarut Fosfat dengan Menggunakan Media Alternatif ini merupakan hasil penelitian sebagai salah satu syarat kelulusan menjadi Sarjana Pertanian di Departemen Ilmu Tanah dan Sumberdaya Lahan, Fakultas Pertanian, Institut Pertanian Bogor.
Penulis menyadari bahwa tanpa dukungan, bantuan serta doa dari berbagai pihak maka penyelesaian tugas akhir ini tidak akan berjalan dengan baik. Untuk itu penulis menghaturkan ucapan terima kasih kepada :
1. Prof. Dr. Ir. Iswandi Anas, M.Sc selaku dosen pembimbing I yang telah memberikan waktu, arahan, dukungan sekaligus penyandang dana sehingga penulisan skripsi ini terselesaikan dengan sangat baik
2. Ir. Fahrizal Hazra, M.Sc selaku dosen pembimbing II yang telah memberikan waktu dan arahan serta bantuan selama penyusunan skripsi 3. Dr. Rahayu Widyastuti, M.Sc selaku dosen penguji yang telah
memberikan saran untuk perbaikan skripsi ini.
4. Bapak Udin dari Pabrik Gula Subang yang telah memberikan izin dalam pengambilan sampel molases untuk bahan penelitian
5. Haider Purba dan Healthy Sitorus selaku orangtua saya yang tak henti-hentinya memberikan kasih sayang dan dukungan kepada saya serta kepada adik dan kakak saya, Irene Margaretha dan Corry Riama
6. Rekan-rekan angkatan 43 khususnya Natasha, Enjelia, Sindy dan Yuli. 7. Rekan-rekan S2 khususnya kepada Bapak Togi, Bapak Mukhlis, Ibu Arum
dan Ibu Mila yang telah banyak mambantu penulis dalam menyelesaikan penulisan skripsi ini.
8. Segenap staf Laboratorium Bioteknologi Tanah, Tata Usaha dan Perpustakaan Departemen Ilmu Tanah dan Sumberdaya Lahan
9. Pihak-pihak lain yang tidak dapat disebutkan satu per satu yang telah membantu dalam penelitian serta penulisan skripsi ini
Penulis menyadari bahwa masih terdapat kekurangan dalam penulisan skripsi ini. Namun, Penulis berharap semoga skripsi ini bermanfaat bagi yang membacanya.
Bogor, Oktober 2011
DAFTAR
ISI
I. PENDAHULUAN ... 5
1.1 Latar Belakang ... 5
1.2 Tujuan Penelitian ... 5
1.3 Hipotesis Penelitian ... 5
II. TINJAUAN PUSTAKA ... 6
2.1 Pupuk hayati ... 6
2.1.1 Bakteri ... 6
2.1.2 Azotobacter ... 7
2.1.3 Azospirillum ... 8
2.1.4 Bakteri Pelarut Fosfat... 9
2.2 Media Alternatif...11 2.2.1 Dedak Padi ... 10 2.2.2 Gula Merah ... 11 2.2.3 Monosodium Glutamat ... 12 2.2.4 Terasi ... 13 2.2.5 Molases...14
III. METODOLOGI PENELITIAN ... 16
3.1. Tempat dan Waktu Penelitian ... 16
3.2. Bahan dan Alat ... 16
3.3 Pelaksanaan Penelitian ... 18
3.3.1 Persiapan Bahan-Bahan ... 18
3.3.2 Pembiakan Inokulan dalam Media ... 18
3.3.3 Penghitungan Populasi Mikroba dengan Metode Cawan Agar (Plate Counting) dan Metode MPN (Most Probable Number) ... 20
IV. HASIL DAN PEMBAHASAN ... 21
4.1 Media IPB RI-1………. ... 21
4.2 Media IPB RI-2……… ... 22
4.3 Media Nutrient Broth……… ... 24
4.4 Perbandingan Populasi Azotobacter,Azospirillum dan Bakteri Pelarut Fosfat pada Media IPB RI-1, Media IPB RI-2 dan Media Nutrient Broth……...…….25
4.4.1 Azotobacter………. 25
4.4.3 Bakteri Pelarut Fosfat……… .. 27
4.5 Kajian sifat kimia .. ………28
4.5.1 Nilai pH……… 28
4.5.2 Nilai EC (Electrycal Conductivity)……….. 29
4.5.3 Nilai Eh (Potensial Reduksi)……… 30
4.6 Harga Bahan Media………. .. 31
4.6.1 Biaya Bahan Media IPB RI-1, IPB RI-2, dan Nutrient Broth……….. 31
V. Kesimpulan dan Saran……….. 34
5.1. Kesimpulan………. .... 34
5.2 Saran……… .... 34
DAFTAR TABEL
Nomor Halaman
Teks
1. Komposisi Dedak Menurut Persyaratan Mutu………...11
2. Nutrisi Gula Merah per 100 gram Porsi Makanan………..……….……..12
3. Kandungan Nutrisi dalam 100 gram Terasi Udang …...…...14
4. Komposisi Kimia Molases ………....……15
5. Komposisi Bahan untuk Membuat 5 liter Media IPB RI-1… ……..……16
6. Komposisi Bahan untuk Membuat 5 liter Media IPB RI-2...17
7. Komposisi Bahan untuk Membuat 500 ml media Nutrient Broth……...17
8. Kandungan N, P dan K pada Media IPB RI-1, IPB RI-2 dan Nutrient Broth...17
9. Media, Mikroba dan Perlakuan Aerasi pada Media ……….19
10.Nilai pH pada Media IPB RI-1, IPB RI-2 dan Nutrient Broth ...29
11.Nilai EC pada Media IPB RI-1, IPB RI-2 dan Nutrient Broth ...30
12.Nilai Eh pada Media IPB RI-1, IPB RI-2 dan Nutrient Broth...31
13.Biaya BahanUntuk membuat 1 liter Media IPB RI-1………...…32
14.Biaya Bahan Untuk membuat 1 liter Media IPB RI-2…………...32
15.Biaya Bahan Untuk membuat 1 liter Media Nutrient Broth...…33
Lampiran 1. Viabilitas Mikroba Inokulan pada Media IPB RI 1, IPB RI 2 dan Nutrient Broth Selama Masa Penyimpanan 15 Hari……….40
2. Komposisi Media Nitrogen Free Media...…………...………..40
3. Komposisi Media Pikovskaya ………...………...……..41
4. Komposisi Media Nitrogen Free Bromtymol Blue ……..……...…41
DAFTAR GAMBAR
Nomor Halaman
Teks
1. Pertumbuhan Populasi Azotobacter, Azospirillum dan Bakteri Pelarut
Fosfat pada Media IPB RI-1………...…………21 2. Pertumbuhan Populasi Azotobacter, Azospirillum dan Bakteri Pelarut
Fosfat pada Media IPB RI-2………...………22 3. Pertumbuhan Populasi Azotobacter, Azospirillum dan Bakteri Pelarut
Fosfat pada Media Nutrient Broth…...………...24
4. Pertumbuhan Populasi Azotobacter pada Media IPB RI-1, Media IPB
RI-2 dan media Nutrient Broth………....……….25
5. Pertumbuhan Populasi Azospirillum pada Media IPB RI-1, Media IPB
RI-2 dan media Nutrient Broth………...……….……..26
6. Pertumbuhan Populasi Bakteri Pelarut Fosfat pada Media IPB RI-1, Media IPB RI-2 dan media Nutrient Broth………...27
Lampiran
1. Media IPB RI-1 dan IPB RI-2 yang Tidak Diberikan aerasi………...…..42 2. Media IPB RI-1 dan IPB RI-2 yang Diberikan Aerasi………..42 3. Media IPB RI-1 dan IPB RI-2 Sebelum dan Sesudah Sterilisasi……... 42
I. PENDAHULUAN
1.1. Latar Belakang
Pupuk hayati secara umum adalah substansi yang mengandung mikroba hidup, yang ketika diaplikasikan pada benih, permukaan tanah atau tanaman dapat memacu pertumbuhan tanaman (Vessey, 2003). Pupuk hayati dapat digunakan sebagai agen biokontrol yang tidak berbahaya bagi proses ekologi dan lingkungan. Banyak mikroba yang bisa dimanfaatkan, antara lain: Azospirillum., Azotobacter
untuk menambat N2 dari udara tanpa harus bersimbiosis dengan tanaman. Beberapa isolat dari kedua spesies ini juga mampu meningkatkan kelarutan P sukar larut. Berdasarkan penelitian Hidayati (2009), aplikasi pupuk hayati yang mengandung mikoriza dan bakteri penambat N, bakteri pelarut P dan bakteri pelarut K terbukti telah meningkatkan pertumbuhan jagung.
Ada berbagai cara dalam memproduksi inokulum bakteri, namun cara yang paling umum dipakai adalah dengan menggunakan media YEM untuk
Rhizobium dan media Nutrient Broth untuk mikroba lainnya. Penggunaan media Nutrient Broth sangat efektif dalam menumbuhkan berbagai mikroba. Namun Nutrient Broth sangat mahal (Rp. 3.400.000,- /kg) dan media ini sulit diperoleh
oleh kalangan petani Indonesia. Oleh karena itu, dibutuhkan suatu media alternatif yang dapat menumbuhkan mikroba dengan baik, murah, mudah diperoleh dan dibuat dengan menggunakan bahan-bahan yang tersedia di sekitar petani.
1.2. Tujuan Penelitian
Penelitian ini bertujuan untuk mencari media tumbuh mikroba yang mampu mendukung pertumbuhan mikroba yang cepat dengan jumlah sel yang tinggi, media mudah didapatkan dan harganya murah.
1.3. Hipotesis Penelitian
Media alternatif yang dapat menyokong pertumbuhan mikroba yang lebih baik, lebih murah dan lebih mudah didapat dibandingkan dengan Nutrient Broth.
II. TINJAUAN PUSTAKA
2.1. Pupuk hayati
Biofertilizer yang umum digunakan adalah inokulum Rhizobium, Azotobacter, Pseudomonas, Bacillus, Trichoderma, dan VA Mychoriza.
Pemanfaatan biofertilizer yang dikombinasikan dengan pupuk organik dan anorganik memberikan prospek cukup baik untuk memperbaiki dan meningkatkan produktifitas tanah ( Prihatini et al., 1996).
Pengertian pupuk hayati secara umum adalah substansi yang mengandung mikroba hidup, yang ketika diaplikasikan pada benih, permukaan tanah atau tanaman dapat memacu pertumbuhan tanaman (Vessey, 2003). Pupuk hayati dapat digunakan sebagai agen biokontrol yang tidak berbahaya bagi proses ekologi dan lingkungan. Banyak mikroba yang bisa dimanfaatkan, antara lain: Azospirillum
spp., Azotobacter spp. untuk menambat N2 dari udara tanpa harus bersimbiosis dengan tanaman. Beberapa isolat dari kedua spesies ini juga mampu meningkatkan kelarutan P sukar larut. Aeromonas spp. dan Aspergillus spp.
adalah contoh untuk mikroba pelarut P yang sangat efektif dalam melepaskan ikatan P yang sukar larut. Selain itu, mikroba ini bisa memperbaiki agregasi dan aerasi tanah (Khudori, 2006). Pupuk hayati mengandung sumber hara seperti N, P, K dan hara lainnya. Mikroba yang ditambahkan ke dalam pupuk hayati selain mampu meningkatkan ketersediaan hara, juga mampu meningkatkan efisiensi pengambilan hara (uptake) oleh tanaman sehingga efisiensi pemupukan
meningkat. Hasil pengujian pada tanaman pangan (padi, jagung, dan kentang) menunjukkan bahwa dengan aplikasi pupuk hayati, dapat menurunkan dosis pupuk kimia hingga 50% (Goenadi et al., 1995). Beberapa isolat bakteri pemacu
pertumbuhan dari kelompok Bacilus sp., Pseudomonas sp., Azospirillum sp. juga
telah terbukti dapat memacu pertumbuhan dan pruduksi padi dan jagung di rumah kaca dan di lapang (Hamim et al., 2008).
2.1.1. Bakteri
Bakteri merupakan mikroba prokariotik (tidak memiliki membran inti) dan mempunyai dinding sel yang terdiri atas peptidoglikan. Bakteri berkembang biak
dengan membelah diri (pembelahan biner). Ukuran bakteri berkisar 1-2 mikrometer dengan diameter 0,5-1 mikrometer. Bakteri tanah menempati pori mikro (>10 mikrometer). Hal ini disebabkan kelembaban pada pori mikro lebih terjaga dan memberikan kondisi optimal bagi pertumbuhan bakteri. Selain itu, pada pori mikro bakteri akan lebih terlindung dari serangan protozoa (Killham, 1995).
Setiap gram tanah subur mengandung 1 miliar bakteri sehingga pada 15 cm lapisan tanah bagian atas (top soil) mengandung kurang lebih 1 ton bakteri per hektar (Adams and Early, 2004). Bakteri dapat dikelompokkan berdasarkan bentuknya, yaitu : batang (bacilli); di mana bentuk ini dominan jumlahnya, kokus
(cocci), dan spiral (spirillum). Bentuk spiral tidak umum terdapat dalam tanah.
Bakteri yang umum dijumpai pada tanah antara lain dari genus Pseudomonas, Arthrobacter, dan Bacillus (Killham, 1995). Faktor lingkungan yang
mempengaruhi keanekaragaman bakteri dalam tanah antara lain : kelembaban tanah, aerasi, suhu, bahan organik, derajat kemasaman (pH), dan suplai hara. Sebagian bakteri dapat hidup pada kondisi ekstrim dengan membentuk endispora (Alexander, 1977).
Pertumbuhan bakteri tanah membawa keuntungan ke arah perbaikan struktur tanah yang lebih mantap dan gembur. Partikel-partikel tanah akan bergabung satu sama lain dengan bahan perekat berupa kompleks gula yang dihasilkan oleh bakteri sehingga terbentuk saluran-saluran halus yang mempermudah pergerakan udara dalam tanah. Keadaan ini akan meningkatkan daya pegang air oleh tanah sehingga air yang tersedia bagi tanaman meningkat. Selain itu unsur hara yang semula berada dalam bentuk tidak larut akan berubah menjadi bentuk yang terlarut sehingga lebih mudah diambil tanaman (Sarief, 1985).
2.1.2. Azotobacter
Azotobacter adalah bakteri penambat nitrogen yang hidup bebas sehingga
tidak membentuk hubungan simbiotik dengan tanaman. Azotobacter mempunyai
laju respirasi yang paling tinggi, anggota genus ini bersifat mesofilik, artinya tumbuh pada suhu sekitar 30o C. Kerapatan bakteri ini di dalam tanah berkisar 103
sampai 106 sel per gram tanah. Selain kemampuan menambat nitrogen,
Azotobacter juga mampu menghasilkan metabolit lain yang bermanfaat bagi
tanaman seperti auxin, thiamine, riboflavin, pyridoxine, cyanocobalamine, asam
nikotinat, asam pantothenat, asam indol asetat, gibberelin, dan senyawa pengatur tumbuh lainnya yang bermanfaat bagi pertumbuhan tanaman. Azotobacter
merupakan bakteri penambat nitrogen yang hidup bebas, sangat sensitif pada pH rendah dan reaksi tanah merupakan faktor pembatas bagi perkembangan dan penyebarannya (Lasrin, 1997).
Beberapa spesies Azotobacter yang dikenal sebagai A. chroococcum,
terutama dijumpai pada tanah-tanah yang netral atau bersifat basa ; A.gilis,
merupakan spesies akuatik; A.vinelandii dan A. beijerinckii asal mulanya
dipisahkan dari tanah-tanah di Amerika Utara; A.insignis, dipisahkan dari
sampel-sampel air di Indonesia; A. macrocytogenes diisolasi dari tanah-tanah Denmark;
dan A. paspali dari rizosfer tumbuhan Paspalu spp. yang asal mulanya dipisahkan
dari tanah-tanah Brazil. A. paspali diestimasi mampu menyumbang nitrogen, dari
hasil penambatan nitrogen atmosfer sebanyak 15-93 kg N/ha/tahun pada akar
Paspalum notatum (Yuwono, 2006).
2.1.3. Azospirillum
Azospirillum adalah bakteri gram negatif yang mengandung butir-butir
poli-ߚ-hydroxy butyrate. Pada media semi padat yang mengandung malat, terbentuk pelikel yang berwarna putih, padat dan berombak. Sel-sel berbentuk setengah spiral dan bergerak secara berputar. Suhu optimum bagi pertumbuhan
Azospirillum berkisar antara 32o-36o C, sedangkan pH optimum bagi pertumbuhan Azospirillum berkisar antara 6,8-7,9 (Day and Dubereiner, 1976). Tanah yang
mengandung pH dibawah 5,7 umumnya tidak mengandung Azospirillum. Bakteri
ini banyak terdapat di daerah perakaran padi, jagung, gandum, sorgum serta gulma yang berasosiasi dengan padi serta tumbuhan dikotil dan monokotil lainnya. Mikroba ini bersifat sangat aerobik dengan adanya amonia di dalam media dan tidak mampu menambat nitrogen dalam keadaan anaerob total.
Azospirillum sp. dapat melarutkan fosfat dengan cara mereduksi pH media dan
Azospirillum dapat mengkhelat ion Fe3+ dengan mensintesis siderofor jenis spirilobaktin (Bachhwat and Ghosh, 1989). Azospirillum juga memiliki
kemampuan yang sangat baik dalam mengkolonisasi akar sehingga menjadikannya lebih kompetitif di rizosfer. Jumlah sel Azospirillum yang banyak
di rizosfer maupun pada permukaan organ tumbuhan lainnya menyebabkan populasi bakteri fitapatogen menurun karena tidak dapat berkompetisi dengan
Azospirillum dalam memperoleh subtrak (Bahsan and Bashan, 2002).
Beberapa peneliti telah mengemukakan manfaat penggunaan Azospirillum
pada tanaman. Okon dan Kalpunik (1986) melaporkan bahwa inokulasi
Azospirillum pada tanaman sorgum dapat meningkatkan hasil sebesar 15-20%.
Azospirillum mampu meningkatkan hasil panen pada tanaman pada berbagai jenis
tanah maupun wilayah iklim berbeda. Perkecambahan biji kedelai Tanggamus yang diinokulasikan dengan isolat Azospirillum menyebabkan peningkatkan
panjang batang dan peningkatan jumlah akar lateral (Astuti, 2007). Azospirillum
diestimasi mampu menghemat penggunaan pupuk nitrogen ekuivalen dengan 20-40 kg/ha pada pertanaman serealia (Yuwono, 2006).
2.1.4. Bakteri Pelarut Fosfat
Bakteri pelarut fosfat berpotensi meningkatkan ketersediaan fosfat terlarut bagi tanaman, terutama pada tanah yang mengalami defisiensi fosfat. Bakteri
pelarut fosfat yang sering dgunakan dalam pupuk hayati antara lain:
Pseudomonas, Bacillus, Rhizobium dan Bradyrhizobium.
Ilmer dan Schinner (1995) menyatakan bahwa mekanisme pelarutan fosfat berhubungan dengan kemampuan bakteri dalam menghasilkan asam organik seperti asam asetat, oksalat, suksinat, sitrat dan ketoglutarat.
Pelarutan P oleh perakaran tanaman dan mikroba tergantung pada pH tanah. Sebagian dari bakteri genus Pseudomonas dan Bacillus dan sebagian dari
fungi genus Penicillum dan Aspergillus memiliki kemampuan untuk melarutkan P
tidak larut dalam tanah menjadi larut dengan mengeluarkan asam-asam organik (Rao, 1982) seperti : asam sitrat, glutamate, suksinat, laktat, asam formiat, asetat, propionate, glikolat, okasalat, malat, fumarat,tartrat, dan α–ketobutirat, yang mampu menghelat kation-kation logam Al3+, Fe3+, Ca2+, Mg2+ (Alexander, 1978;
Rao, 1982). Asam-asam organik tersebut bersifat non folatil sehingga kation yang dihelat menjadi bentuk stabil (Rao, 1982) dan ion H2PO4- menjadi bebas dari ikatannya dan tersedia bagi tanaman untuk diserap.
Bakteri pelarut fosfat banyak terdapat di rizosfer tanaman, ini membuat rizosfer manjadi tempat paling aktif dalam pelarutan fosfat (Kundu et al., 2002).
Peranan mikroba dalam transformasi fosfor antara lain : (1) Melarutkan komponen fosfor anorganik, (2) Mengubah komponen fosfor organik menjadi ortofosfat (mineralisasi), (3) Mengubah bentuk fosfor anorganik menjadi protoplasma sel dan, (4) Membantu proses oksidasi dan reduksi dari komponen fosfor anorganik (Alexander, 1977). Fungi pelarut fosfat dari genus Aspergillus
mampu melarutkan fosfat dari Ca3(PO4) sebesar 18% sedangkan Penicillum mampu melarutkan fosfat dari sumber yang sama sebesar 26-40% (Rao, 1982).
2.2. Media Alternatif
Media alternatif adalah media yang digunakan untuk menumbuhkan mikroba dengan menggunakan bahan-bahan yang murah dan mudah didapat seperti dedak padi, gula merah, monosodium glutamate, terasi dan molases.
2.2.1. Dedak Padi
Dedak padi merupakan hasil samping penggilingan padi yang berasal dari lapisan luar beras pecah kulit dalam proses penyosohan beras. Proses pengolahan gabah menjadi beras akan menghasilkan dedak padi kira-kira sebanyak 10% pecahan-pecahan beras atau menir sebanyak 17%, tepung beras 3%, sekam 20% dan berasnya sendiri 50%. Persentase tersebut sangat bervariasi tergantung pada varietas dan umur padi, derajat penggilingan serta penyosohannya (Grist, 1972).
Dedak merupakan limbah dalam proses pengolahan gabah menjadi beras yang mengandung “bagian luar” beras yang tidak terbawa, tetapi tercampur pula dengan bagian penutup beras itu. Hal inilah yang mempengaruhi tinggi atau rendahnya kandungan serat kasar dedak (Rasyaf, 1990).
Hartadi et al. (1990) menyatakan bahwa dedak dengan kandungan serat
kasar 6-12 % memiliki kandungan lemak 14,1%, protein kasar 13,8%, sedangkan menurut National Research Council (1994) dedak padi mengandung energi
metabolis sebesar 2100 kkal/kg, protein kasar 12,9%, lemak 13%, serat kasar 11,4%, Ca 0,07%, P tersedia 0,21%, serta Mg 0,22%. Dedak padi sangat kaya dengan minyak dan tinggi serat kasarnya. Serat kasar adalah karbohidrat yang tidak larut setelah dimasak berturut-turut dalam larutan H2SO4 1,25% mendidih selama 30 menit dan dalam larutan NaOH 1,25% mendidih selama 30 menit. Serat kasar diduga kaya akan lignin dan selulosa sehingga sulit dicerna (hewan) (Amrullah, 2002). Komposisi dedak menurut persyaratan mutu dapat dilihat pada Tabel 1.
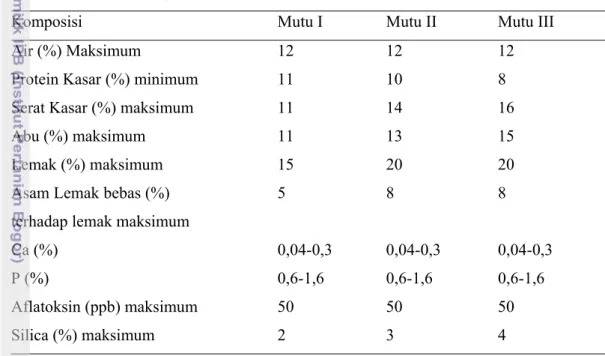
Tabel 1. Komposisi Dedak Menurut Persyaratan Mutu (DSN, 2001)
Komposisi Mutu I Mutu II Mutu III
Air (%) Maksimum 12 12 12
Protein Kasar (%) minimum 11 10 8
Serat Kasar (%) maksimum 11 14 16
Abu (%) maksimum 11 13 15
Lemak (%) maksimum 15 20 20
Asam Lemak bebas (%) terhadap lemak maksimum
5 8 8 Ca (%) 0,04-0,3 0,04-0,3 0,04-0,3 P (%) 0,6-1,6 0,6-1,6 0,6-1,6 Aflatoksin (ppb) maksimum 50 50 50 Silica (%) maksimum 2 3 4 2.2.2. Gula Merah
Gula merah atau gula Jawa biasanya diasosiasikan dengan segala jenis gula yang dibuat dari nira, yaitu cairan yang dikeluarkan dari bunga pohon dari keluarga palma, seperti kelapa, aren, dan siwalan. Bunga (mayang) yang belum mekar diikat kuat (kadang-kadang dipres dengan dua batang kayu) pada bagian pangkalnya sehingga proses pemekaran bunga menjadi terhambat. Sari makanan yang seharusnya dipakai untuk pemekaran bunga menumpuk menjadi cairan gula. Mayang membengkak setelah proses pembengkakan berhenti, batang mayang diiris-iris untuk mengeluarkan cairan gula secara bertahap. Cairan biasanya ditampung dengan timba yang terbuat dari daun pohon palma tersebut. Cairan
dipanaskan dengan api sampai kental. Setelah benar-benar kental, cairan dituangkan ke dalam bentuk setengah mangkok atau setengah elip yang terbuat dari daun palma Bentuk demikian ini dihasilkan dari cetakan yang digunakan berupa setengah tempurung kelapa, adapula yang menggunakan cetakan bambu, sehingga bentuknya bulat silindris. Kandungan nutrisi gula merah dalam 100 gram porsi makanan dapat dilihat pada Tabel 2.
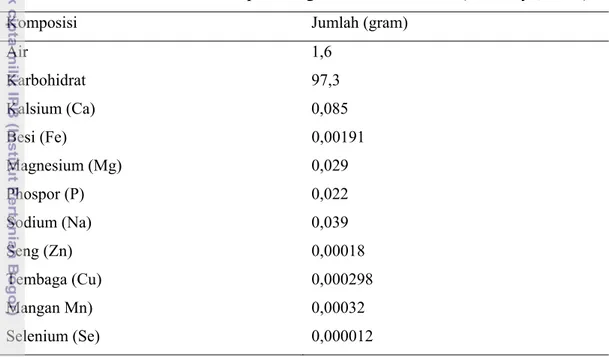
Tabel 2. Nutrisi Gula Merah per 100 gram Porsi Makanan (Asiamaya, 2010)
Komposisi Jumlah (gram)
Air 1,6 Karbohidrat 97,3 Kalsium (Ca) 0,085 Besi (Fe) 0,00191 Magnesium (Mg) 0,029 Phospor (P) 0,022 Sodium (Na) 0,039 Seng (Zn) 0,00018 Tembaga (Cu) 0,000298 Mangan Mn) 0,00032 Selenium (Se) 0,000012 2.2.3. Monosodium Glutamat
Monosodium Glutamate (MSG) adalah zat penambah rasa pada makanan
yang dibuat dari hasil fermentasi zat tepung dan tetes dari gula beet atau gula tebu. Dan natrium (sodium) dari asam glutamat (salah satu asam amino non-esensial penyusun protein). MSG terdiri dari 78% glutamat, 12% natrium dan 10% air. MSG dijual sebagai kristal halus berwarna putih, dan penampakannya mirip gula pasir atau garam dapur. Glutamat adalah salah satu dari 20 asam amino penyusun protein. Sebagai asam amino, glutamat termasuk dalam kelompok non esensial, yang artinya tubuh mampu memproduksi sendiri. Glutamat ada di setiap makhluk hidup baik dalam bentuk terikat maupun bebas. Glutamat sebagai asam amino non-essensial ditemukan pada tahun 1866 oleh seorang ilmuwan Jerman bernama Prof. Ritthausen yang berhasil mengisolasinya dari gluten (protein gandum).
Glutamat yang masih terikat dengan asam amino lain sebagai protein tidak memiliki rasa. Hanya jika glutamat yang dalam bentuk bebas memiliki rasa
Umami (gurih). Dengan demikian, semakin tinggi kandungan glutamate bebas
dalam suatu makanan, semakin kuat rasa umaminya.
Kadar glutamat dalam makanan bervariasi tergantung dari macam makanan, kondisi makanan (mentah atau matang) dan proses pengolahannya Tomat mentah yang berwarna hijau hanya mengandung 20 mg/100 g glutamat bebas dan setelah matang meningkat drastis menjadi 246 mg/100 g. Sementara air susu sapi yang hanya mengandung 1 mg/100 g glutamat bebas, setelah melalui proses enzimatik, fermentasi dan disimpan selama dua tahun meningkat kandungan glutamat bebasnya menjadi 1680 mg/100 g sebagai keju Parmegiana Regiano.
2.2.4. Terasi
Terasi merupakan produk awetan ikan-ikan kecil arau rebon yang telah diolah melalui proses pemeraman atau fermentasi, penggilingan atau penumbukan, dan penjemuran yang berlangsung kurang lebih 20 hari. Ke dalam produk terasi tersebut, ditambahkan garam yang berfungsi sebagai pengawet.
Ada beberapa jenis terasi. Bila dilihat dari bahan dasar yang digunakan, terdapat tiga macam terasi. Ada terasi udang, ikan, dan terasi campuran antara ikan dan udang. Kualitas terasi bisa dilihat dari tekstur dan warnanya. Terasi yang bermutu baik, teksturnya tidak terlalu keras, juga tidak terlalu lembek. Terasi yang berwarna merah sebaiknya dihindari karena warna merah itu berasal dari bahan pewarna rhodamin B yang biasa digunakan untuk tekstil. Kandungan nutrisi pada terasi dapat dilihat pada Tabel 3.
Tabel 3. Kandungan Nutrisi dalam 100 gram Terasi Udang
Komposisi Jumlah (gram)
Protein 30 Lemak 3,5 Karbohidrat 3,5 Mineral 23 Kalsium 100 Fosfor 250 Besi 0,0031 Air 40
sumber : Daftar Analisis Bahan Makanan Fak. Kedokteran UI ; Jakarta, 1992
2.2.5. Molases
Molasses merupakan cairan kental, rasanya agak pahit dan berwarna gelap, hasil produk samping dari pabrik gula. Menurut Paturau (1982), molases adalah keluaran terakhir yang diperoleh dari pembuaran gula tebu setelah melalui kristalisasi berulang dan merupakan sisa sirup tang tidak dapat mengkristal lagi dengan perlakuan sederhana. Menurut Baikow (1982), molases merupakan sisa sirup yang terbuang dari maskuit dan tidak dapat dikristalisasi lagi dalam pembuatan gula.
Menurut Paturau (1982), berdasarkan jumlah tebu yang digiling, jumlah molases yang dihasilkan bervariasi antara 2,2% – 3,7%, dengan rata-rata 2,7%. Molases sebagai hasil samping pabrik gula mempunyai kandungan gula sekitar 40% - 45% sangat dimungkinkan untuk diolah menjadi gula kembali, mengingat harga molases yang relatif lebih murah daripada harga gula kristal. Molases dapat digunakan secara langsung atau dapat dijadikan bahan baku pembuatan produk-produk yang bernilai ekonomis, misanlya untuk kecap, pupuk, pakan ternak, ataupun untuk industri fermentasi.
Menurut Kirk dan Othmer (1963), molases dari gula tebu mempunyai nilai pH 5,5 – 6,5. Sifat yang masam dan pH yang rendah pada molases disebabkan oleh kandungan asam alifatik pada proses klarifikasi.
Kandungan gula dalam molases sangat bervariasi karena dipengaruhi oleh berbagai faktor, antara lain varietas tebu, tanah, iklim, periode penanaman, cara
pengolahan tebu di perusahaan (Paturau,1982). Kandungan gula dalam molases juga dipengaruhi oleh efisiensi operasi pabrik gula, sistem pemanasan dan tipe serta kapasitas kristalizer (Baikow, 1982). Paturau (1982) menyatakan bahwa molases terdiri dari berbagai komposisi kimia. Komposisi kimia molases dapat dilihat pada Tabel 4.
Tabel 4. Komposisi Kimia Molases (Paturau, 1982)
Komposisi Kisaran (%) Rata-Rata (%)
Air 17-25 20 Sukrosa 30-40 35 Glukosa 4-9 7 Fruktosa 5-12 9 Gula pereduksi 1-5 3 Karbohidrat lain 2-5 4 Abu 7-15 12 Komponen nitrogen 2-6 4,5
Asam bukan nitrogen 2-6 5
III. METODOLOGI PENELITIAN
3.1. Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Bioteknologi Tanah, serta Laboratorium Kimia dan Kesuburan Tanah, Departemen Ilmu Tanah dan Sumberdaya Lahan, Fakultas Pertanian IPB. Penelitian dimulai sejak Juni hingga Desember 2010.
3.2. Bahan dan Alat
Bahan yang digunakan untuk membuat media IPB RI-1 adalah: pupuk Urea, Pupuk SP-36, limbah ikan teri, terasi, dedak, MSG, gula merah dan air mineral serta inokulan mikroba (Azotobacter, Azospirillum dan Bakteri Pelarut
Fosfat). Jumlah inokulan yang digunakan sebanyak 2% dari volume media. Inokulan mikroba adalah koleksi Prof. Dr. Iswandi Anas, Kepala Laboratorium Bioteknologi Tanah, Fakultas Pertanian Institut Pertanian Bogor. Komposisi bahan media IPB RI-1 disajikan pada Tabel 5.
Tabel 5. Komposisi Bahan untuk Membuat 5 liter Media IPB RI-1
Komposisi Jumlah (gram)
Pupuk Urea 50 Pupuk SP-36 25 Limbah ikan teri 50
Terasi 12,5 Dedak 50 MSG 5 Gula merah 50
Air mineral 5 liter
Bahan yang digunakan membuat media IPB RI-2 antara lain : molases, air mineral dan inokulan mikroba (Azotobacter, Azospirillum dan Bakteri Pelarut
Fosfat) sebanyak 2% dari volume media yang dibuat. Komposisi bahan media IPB RI-2 disajikan pada Tabel 6.
Tabel 6. Komposisi Bahan untuk Membuat 5 liter Media IPB RI-2
Komposisi Jumlah Molases (5%) 250 ml
Air mineral 5 liter
Sebagai pembanding digunakan media Nutrient Broth produksi
Difco™. Bahan yang digunakan membuat media Nutrient Broth antara lain Nutrient Broth dan air mineral. Komposisi bahan media Nutrient Broth disajikan
pada Tabel 7.
Tabel 7. Komposisi Bahan untuk Membuat 500 ml Media Nutrient Broth Komposisi Jumlah Difco™ Nutrient Broth 4 gram
Air mineral 500 ml
Selain itu digunakan pula media agar antara lain : Nitrogen Free Media
untuk Azotobacter, Nitrogen Free Bromthymol Blue untuk Azospirillum dan
Pikovskayauntuk Bakteri Pelarut Fosfat.
Hasil analisis unsur hara pada media IPB RI-1, media IPB RI-2 dan media
Nutrient Broth dapat dilihat pada Tabel 8.
Tabel 8. Kandungan N, P dan K pada Media IPB RI-1, IPB RI-2 dan Nutrient Broth
Media N P K
%
Media IPB RI-1 0,13 0,07 0,02 Media IPB RI-2 0,05 0,02 0,13
3.3. Pelaksanaan Penelitian
Metode penelitian meliputi persiapan bahan-bahan, pembiakan inokulan dalam media serta penghitungan sel mikroba dengan Metode Cawan Agar (Plate Counting) dan Metode MPN (Most Probable Number).
3.3.1. Persiapan bahan-bahan
Azotobacter, Azospirillum dan Bakteri Pelarut Fosfat yang diinokulasikan
ke dalam media alternatif, dibiakkan dengan menggunakan shaker selama 4 hari dengan menggunakan media Nutrient Broth.
Pada media IPB RI-1, semua bahan-bahan dihaluskan lalu dicampur dalam satu wadah, lalu disaring dan kemudian disterilisasi dengan menggunakan autoklaf pada suhu 121o C selama 15 menit. Hal yang sama dilakukan pada media IPB RI-2. Untuk media Nutrient Broth, digunakan Nutrient Broth produksi
Difco™ yang dilarutkan dengan 500 ml air mineral, lalu disterilisasi dengan menggunakan autoklafpada suhu 121o C selama 15 menit.
3.3.2. Pembiakan Inokulan dalam Media
Inokulan Azotobacter, Azospirillum dan Bakteri Pelarut Fosfat
diinokulasikan ke dalam 12 galon air mineral. Wadah ini terdiri dari 6 galon yang masing-masing berisi 5 liter media IPB RI-1, dan 6 galon yang masing-masing berisi 5 liter media IPB RI-2. Hal yang hampir sama dilakukan pada media
Nutrient Broth yakni dengan menginokulasikan Azotobacter, Azospirillum dan
Bakteri Pelarut Fosfat ke dalam 6 erlenmeyer yang masing-masing berisi 500 ml media Nutrient Broth. Setelah itu tiap media diberikan perlakuan yakni dengan
diberikan aerasi dan tidak diberikan aerasi. Jumlah semua biakan yang dibuat adalah 18 biakan, disajikan pada Tabel 9.
Tabel 9. Media, Mikroba dan Perlakuan Aerasi pada Media
No. Kode /Nama Media Nama Bakteri Aerasi 1 IPB RI-1 Azotobacter Ya
2 IPB RI-1 Azotobacter tanpa
3 IPB RI-1 Azospirillum Ya
4 IPB RI-1 Azospirillum tanpa
5 IPB RI-1 Bakteri Pelarut Fosfat Ya 6 IPB RI-1 Bakteri Pelarut Fosfat tanpa 7 IPB RI-2 Azotobacter Ya
8 IPB RI-2 Azotobacter tanpa
9 IPB RI-2 Azospirillum Ya
10 IPB RI-2 Azospirillum tanpa
11 IPB RI-2 Bakteri Pelarut Fosfat Ya 12 IPB RI-2 Bakteri Pelarut Fosfat tanpa
13 Nutrient Broth Azotobacter Ya
14 Nutrient Broth Azotobacter tanpa
15 Nutrient Broth Azospirillum Ya
16 Nutrient Broth Azospirillum tanpa
17 Nutrient Broth Bakteri Pelarut Fosfat Ya
18 Nutrient Broth Bakteri Pelarut Fosfat tanpa
Azotobacter, Azospirillum dan Bakteri Pelarut Fosfat ditumbuhkan pada
media IPB RI-1, IPB RI-2 dan Nutrient Broth dalam wadah air mineral yang
telah dimodifikasi. Wadah air mineral dijadikan sebagai fermentor dan untuk perlakuan pemberian aerasi, udara yang steril dialirkan dengan menggunakan pompa akuarium dengan laju alir 1-2 liter/menit. Aerasi berfungsi sebagai penyuplai oksigen untuk sel mikroba. Laju oksigen yang disuplai ke dalam media dijaga stabil. Fluktuasi laju alir oksigen dapat mengganggu metabolisme sel karena oksigen terlarut tidak stabil. Selain aerasi, galon modifikasi juga dilengkapi dengan batu aerasi dan filter udara steril. Batu aerasi berfungsi sebagai pemecah gelembung-gelembung udara agar gelembung udara yang terbentuk berukuran kecil sehingga laju difusi oksigen ke dalam larutan lebih cepat dan meningkatkan kadar oksigen terlarutnya sedangkan filter udara steril berfungsi sebagai penyaring udara dari luar yang masuk ke dalam galon yang berisi media sehingga terhindar dari kontaminan mikroba lain.
3.3.3. Penghitungan Populasi Mikroba dengan Metode Cawan Agar (Plate Counting) dan Metode MPN (Most Probable Number)
Pengambilan sampel kultur inokulan dilakukan pada hari ke-0, 5, 10 dan 15. Sebanyak 10 ml kultur diambil dari media IPB RI-1, media IPB RI-2 dan media Nutrient Broth, lalu dibuat 10 ml ke dalam 90 ml larutan fisiologi untuk
membuat pengenceran 10-1 dan serial pengenceran diteruskan hingga 10-8. Sebanyak 1 ml larutan dari masing-masing seri pengenceran dipindahkan ke cawan petri yang kemudian dituang ke media yang sudah disiapkan sesuai dengan mikroba yang dihitung populasinya yaitu media NFM (Nitrogen Free Media)
untuk Azotobacter dan media Pikovskaya untuk Bakteri Pelarut Fosfat. Koloni
bakteri yang tumbuh diamati dan dihitung populasinya dengan menggunakan metode cawan agar (Plate Counting). Sedangkan untuk Azospirillum
menggunakan media NFB (Nitrogen Free Bromthymol Blue). Koloni bakteri
yang tumbuh diamati dan dihitung populasinya dengan menggunakan metode
Most Probable Number. Seluruh prosedur kerja dilakukan di dalam laminar air flow secara aseptik untuk menghindari terjadinya kontaminasi.
IV. HASIL DAN PEMBAHASAN
4.1. Media IPB RI-1
Pada media IPB RI-1 dilakukan penghitungan populasi Azotobacter, Azospirillum dan Bakteri Pelarut Fosfat (BPF). Pertumbuhan populasi mikroba
pada media IPB RI-1 disajikan pada Gambar 1.
Gambar 1. Pertumbuhan Populasi Azotobacter,Azospirillum dan Bakteri
Pelarut Fosfat pada Media IPB RI-1
Populasi Azotobacter tertinggi terjadi pada hari ke-10 pada media yang
diberikan aerasi. Sedangkan untuk Azospirillum dan Bakteri Pelarut Fosfat
populasi tertinggi terjadi pada hari ke-5. Dari berbagai mikroba yang diisolasi pada media IPB RI-1 dapat terlihat bahwa populasi Azotobacter adalah yang
tertinggi diantara mikroba yang lain, hal ini dikarenakan Azotobacter merupakan
bakteri non simbiotik yang bersifat aerobik. Azotobacter mampu menambat
nitrogen dalam jumlah yang cukup tinggi, bervariasi ± 2-15 mg nitrogen/gram sumber karbon yang digunakan (Rao, 1982).
Ketersediaan unsur hara merupakan salah satu faktor penting untuk pertumbuhan mikroba. Unsur hara yang cukup akan diikuti dengan pertumbuhan mikroba yang baik. Ketersediaan unsur hara yang kurang akan menjadi penghambat pertumbuhan sel mikroba.
0 1 2 3 4 5 6 7 8 9 10 0 5 10 15 Populasi ‐ Lo g [x] (Cfu/ml) Waktu (hari)
Azotobacter dengan aerasi
tambahan
Azotobacter tanpa aerasi
tambahan
Azospirillum dengan aerasi
tambahan
Azospirillum tanpa aerasi
tambahan
BPF dengan aerasi
tambahan
Unsur hara yang terpenting untuk mikroba adalah karbon dan nitrogen. Hampir 50% berat kering sel terdiri atas karbon, oleh karena itu karbon merupakan makronutrien yang paling utama dibutuhkan. Prokariot autotrof menggunakan CO2 sebagai satu-satunya sumber karbon, sedangkan yang bersifat heterotrof menggunakan molekul organik sebagai sumber karbon untuk pertumbuhan (Madigan et al., 2000) .
Nitrogen memainkan peran penting dalam metabolisme seluler khususnya dalam pembelahan sel, sehingga apabila kandungan nitrogennya semakin sedikit maka kemampuan bakteri untuk membelah menjadi semakin lambat. Akibatnya pertumbuhan bakteri pun menjadi rendah.
Bakteri dapat mengasimilasi senyawa nitrogen organik maupun anorganik untuk pertumbuhannya. Senyawa nitrogen dalam bentuk tersebut akan direduksi atau dikatabolisasi oleh bakteri menjadi ammonia (White, 1995).
4.2. Media IPB RI-2
Pada media IPB RI-2 dilakukan penghitungan populasi Azotobacter, Azospirillum dan Bakteri Pelarut Fosfat (BPF). Pertumbuhan populasi mikroba
dalam media IPB RI-2 disajikan pada Gambar 2.
Gambar 2. Pertumbuhan Populasi Azotobacter,Azospirillum dan Bakteri
Pelarut Fosfat pada Media IPB RI-2 0 1 2 3 4 5 6 7 8 9 10 0 5 10 15 Populasi ‐ Lo g [x] (Cfu/ml) Waktu (hari)
Azotobacter dengan aerasi
tambahan
Azotobacter tanpa aerasi
tambahan
Azospirillum dengan aerasi
tambahan
Azospirillum tanpa aerasi
tambahan
BPF dengan aerasi
tambahan
Pola pertumbuhan populasi Azotobacter pada media IPB RI-2 hampir
sama dengan pola pertumbuhan populasi Azotobacter pada media IPB RI-1.
Hanya saja pada media IPB RI-2, populasi Azotobacter pada media yang tidak
diberikan aerasi mengalami penurunan pada hari ke-10, sedangkan pada media IPB RI-1, populasi Azotobacter masih stasioner.
Populasi Bakteri Pelarut Fosfat mengalami peningkatan dari hari ke-0 hingga hari ke-5 selanjutnya dari hari ke-5 hingga hari ke-15 Bakteri Pelarut Fosfat mengalami fase stasioner, di mana tidak terjadi peningkatan atau penurunan pada populasi mikroba. Fase stasioner merupakan fase dimana sel-sel mulai tidak tumbuh lagi. Hal ini disebabkan oleh menyusutnya nutrien dalam media, keterbatasan oksigen dan akumulasi produk metabolisme yang toksik bagi organisme. Akumulasi produk toksik ini seringkali menjadi masalah dalam fermentasi sel karena sebagian besar nutrisi tidak diubah menjadi bahan bahan sel tetapi disekresikan sebagai produk buangan (White, 1995). Laju pertumbuhan bakteri pada fase ini melambat atau terhenti sedangkan jumlah mikroba yang hidup konstan.
Populasi Azospirillum mengalami peningkatan dari hari ke-0 hingga hari
ke-5, selanjutnya pada hari ke-10 populasinya menurun, baik pada media yang tidak diberikan aerasi maupun yang diberikan aerasi. Lalu pada hari ke-15 populasi Azospirillum pada media yang tidak diberikan aerasi stasioner sedangkan
pada media yang diberikan aerasi mengalami penurunan.
Setiap mikroba memerlukan sumber karbon bagi pertumbuhannya dengan cara mengubah karbon tersebut menjadi material sel melalui proses asimilasi. Bakteri heterotrof menggunakan senyawa organik sebagai sumber karbonnya (Lim, 1998). Sumber karbon yang dapat digunakan oleh bakteri ini diantaranya terdapat pada molases. Molases mengandung kadar gula sekitar 45-58% yang tersusun dari sukrosa, glukosa, fruktosa dan komponen lainnya sehingga masih dapat digunakan sebagai sumber karbon yang baik bagi pertumbuhan bakteri (Novita, 2001).
Kemampuan mikroba untuk memperoleh energi pada kondisi heterotrof bergantung pada kemampuan metabolismenya untuk mengoksidasi senyawa karbon (bahan organik) sebagai sumber energi utama. Senyawa karbon dalam
metabolismenya berperan penting untuk menghasilkan energi melalui oksidasi senyawa tersebut dan menyediakan unsur C untuk pembentukan material sel (Prescott et al., 2000).
Bakteri memerlukan kalsium terutama dalam bentuk ion Ca2+ sebagai kofaktor enzim tertentu dan fosfor terutama dalam bentuk fosfat yang diperlukan oleh bakteri sebagai komponen struktur sel dan simpanan energi. (Volk and Wheeler, 1984).
Asam amino merupakan salah satu faktor penting bagi pertumbuhan bakteri. Asam amino ini disintesis oleh bakteri atau disediakan sebagai nutrisi eksogenus. Kebutuhan asam amino dapat disediakan sebagai asam amino bebas yang dapat didegrasi oleh bakteri protease sebelum atau setelah masuk ke dalam sel. Di dalam sel, asam amino pertama kali diaminasi untuk menghasilkan asam organik yang masuk ke dalam siklus Tricarboxylic. Amonia yang dihasilkan dari
diaminasi akan bertindak sebagai sumber nitrogen untuk biosintesis (Lim, 1998).
4.3. Media Nutrient Broth
Pada media Nutrient Broth penghitungan populasi Azotobacter, Azospirillum dan Bakteri Pelarut Fosfat (BPF). Pertumbuhan mikroba pada media Nutrient Broth disajikan pada Gambar 3.
Gambar 3. Pertumbuhan Populasi Azotobacter,Azospirillum dan Bakteri
Pelarut Fosfat pada Media Nutrient Broth
0 1 2 3 4 5 6 7 8 9 10 0 5 10 15 Populasi ‐ Lo g [x] (Cfu/ml) Waktu (hari) Azotobacter dengan aerasi tambahan
Azotobacter tanpa aerasi
tambahan
Azospirillum dengan
aerasi tambahan
Azospirillum tanpa aerasi
tambahan
BPF dengan aerasi
tambahan BPF tanpa aerasi
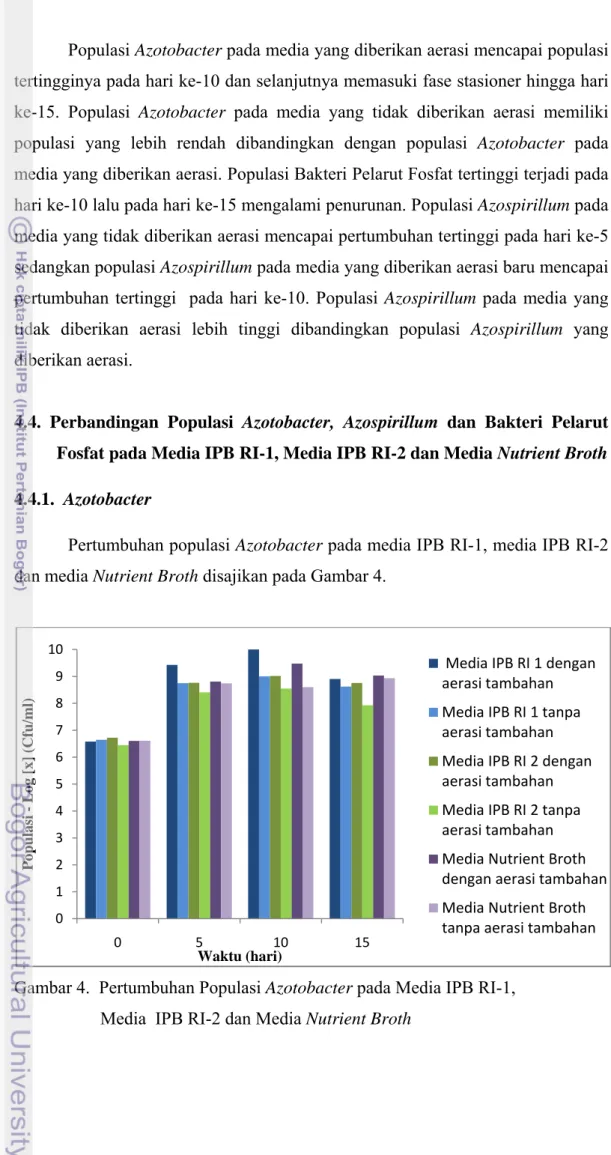
Populasi Azotobacter pada media yang diberikan aerasi mencapai populasi
tertingginya pada hari ke-10 dan selanjutnya memasuki fase stasioner hingga hari ke-15. Populasi Azotobacter pada media yang tidak diberikan aerasi memiliki
populasi yang lebih rendah dibandingkan dengan populasi Azotobacter pada
media yang diberikan aerasi. Populasi Bakteri Pelarut Fosfat tertinggi terjadi pada hari ke-10 lalu pada hari ke-15 mengalami penurunan. Populasi Azospirillum pada
media yang tidak diberikan aerasi mencapai pertumbuhan tertinggi pada hari ke-5 sedangkan populasi Azospirillum pada media yang diberikan aerasi baru mencapai
pertumbuhan tertinggi pada hari ke-10. Populasi Azospirillum pada media yang
tidak diberikan aerasi lebih tinggi dibandingkan populasi Azospirillum yang
diberikan aerasi.
4.4. Perbandingan Populasi Azotobacter, Azospirillum dan Bakteri Pelarut Fosfat pada Media IPB RI-1, Media IPB RI-2 dan Media Nutrient Broth
4.4.1. Azotobacter
Pertumbuhan populasi Azotobacter pada media IPB RI-1, media IPB RI-2
dan media Nutrient Broth disajikan pada Gambar 4.
Gambar 4. Pertumbuhan Populasi Azotobacter pada Media IPB RI-1,
Media IPB RI-2 dan Media Nutrient Broth
0 1 2 3 4 5 6 7 8 9 10 0 5 10 15 Populasi -L og [x] (Cfu/ml) Waktu (hari)
Media IPB RI 1 dengan
aerasi tambahan
Media IPB RI 1 tanpa
aerasi tambahan
Media IPB RI 2 dengan
aerasi tambahan
Media IPB RI 2 tanpa
aerasi tambahan
Media Nutrient Broth
dengan aerasi tambahan
Media Nutrient Broth
Populasi Azotobacter pada media IPB RI-1 yang diberikan aerasi
menunjukkan populasi yang lebih tinggi dibandingkan dengan media lain dan terendah terdapat pada media IPB RI-2 tanpa aerasi. Perubahan populasi
Azotobacter dari hari ke-0 hingga hari ke-15 menunjukkan bahwa terdapat
banyak faktor yang menyebabkan terjadinya dinamika perbedaan populasi pada tiap media. Faktor-faktor tersebut antara lain: kandungan nutrisi pada media, pemberian aerasi, pH, ketersediaan oksigen dan suhu. Faktor-faktor ini mempengaruhi populasi mikroba dalam media.
Populasi Azotobacter mencapai titik tertinggi pertumbuhannya pada hari
ke-10 pada media IPB RI-1, media IPB RI-2 yang diberikan aerasi dan media
Nutrient Broth yang diberikan aerasi, hal ini menunjukkan semua faktor tumbuh
yang diperlukan oleh Azotobacter dalam keadaan tersedia pada media tersebut.
Selanjutnya pada hari ke-15, populasi Azotobacter menurun, hal ini diakibatkan
karena kandungan nutrien dalam media yang sudah mulai berkurang.
4.4.2. Azospirillum
Pertumbuhan populasi Azospirillum pada media IPB RI-1, media IPB
RI-2 dan media Nutrient Broth disajikan pada Gambar 5.
Gambar 5. Pertumbuhan Populasi Azospirillum pada Media IPB RI-1,
Media IPB RI-2 dan Media Nutrient Broth
0 1 2 3 4 5 6 7 8 9 10 0 5 10 15 Populasi ‐ Log [x] (Cfu/ml) Waktu (hari)
Media IPB RI 1 dengan
aerasi tambahan
Media IPB RI 1 tanpa
aerasi tambahan
Media IPB RI 2 dengan
aerasi tambahan
Media IPB RI 2 tanpa
aerasi tambahan
Media Nutrient Broth
dengan aerasi tambahan
Media Nutrient Broth
Pada media IPB RI-1, IPB RI-2 dan media Nutrient Broth yang tidak
diberikan aerasi Azospirillum mencapai titik pertumbuhan tertingginya pada hari
ke-5. Sedangkan media Nutrient Broth yang diberikan aerasi mencapai populasi
tertingginya pada hari ke-10. Selanjutnya pada hari ke-15, populasi Azospirillum
pada ketiga media mengalami penurunan.
Azospirillum hidup pada lingkungan dengan pH 6.8-7.9 (Alexander, 1977). Azospirillum termasuk dalam ke dalam grup bakteri Gram negatif,
aerobik/mikroaerofilik, motil (Holt et al.,1994). Bakteri mikroaerofilik adalah
bakteri yang tumbuh bila ada oksigen bebas dalam jumlah sedikit. Oleh karena itu, seperti terlihat pada Gambar 5, populasi Azospirillum pada media IPB RI-1,
IPB RI-2 dan Nutrient Broth yang tidak diberi aerasi lebih tinggi dibandingkan
dengan media yang diberikan aerasi. 4.4.3. Bakteri Pelarut Fosfat
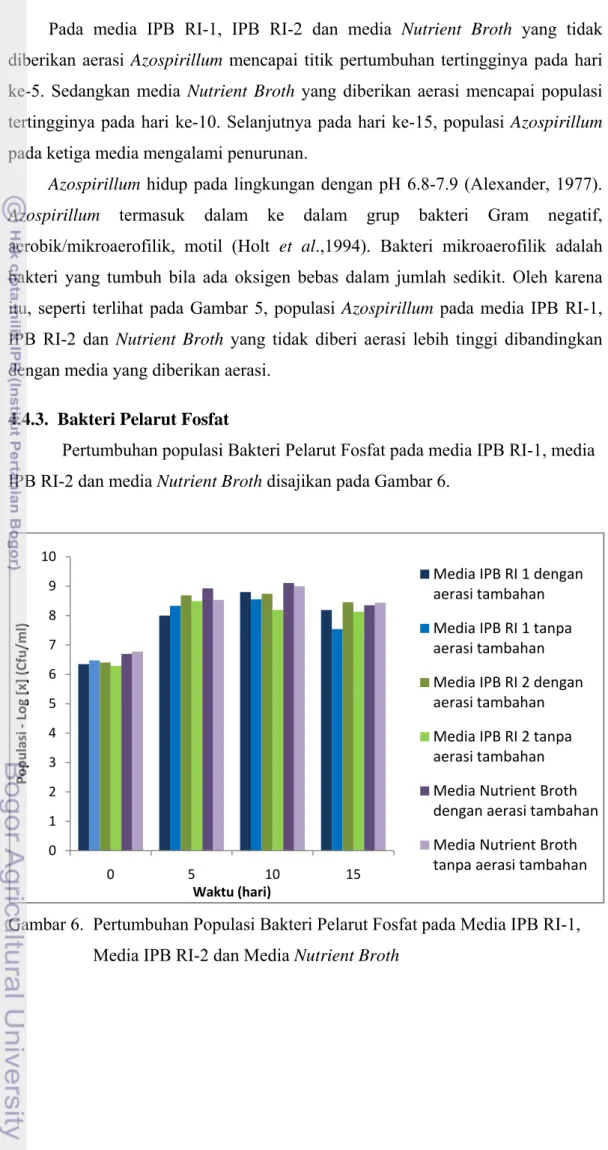
Pertumbuhan populasi Bakteri Pelarut Fosfat pada media IPB RI-1, media IPB RI-2 dan media Nutrient Broth disajikan pada Gambar 6.
Gambar 6. Pertumbuhan Populasi Bakteri Pelarut Fosfat pada Media IPB RI-1, Media IPB RI-2 dan Media Nutrient Broth
0 1 2 3 4 5 6 7 8 9 10 0 5 10 15 Populasi ‐ Log [x] (Cfu/ml) Waktu (hari)
Media IPB RI 1 dengan
aerasi tambahan
Media IPB RI 1 tanpa
aerasi tambahan
Media IPB RI 2 dengan
aerasi tambahan
Media IPB RI 2 tanpa
aerasi tambahan
Media Nutrient Broth
dengan aerasi tambahan
Media Nutrient Broth
Pada hari ke-0 hingga hari ke-5 populasi Bakteri Pelarut Fosfat mengalami peningkatan. Pada selang masa tersebut populasi Bakteri Pelarut Fosfat berada pada fase eksponensial. Pada fase tersebut ditandai dengan periode pembelahan yang cepat. Populasi Bakteri Pelarut Fosfat pada media IPB RI-1, media IPB RI-2 dan media Nutrient Broth memiliki pola yang sama hingga hari
ke-5, namun pada hari ke-10, populasi Bakteri Pelarut Fosfat pada media Nutrient Broth meningkat melebihi populasi dari media IPB RI-1 dan media IPB RI-2.
Pada hari ke-15 populasi Bakteri Pelarut Fosfat pada ketiga media berada pada jumlah yang sama, kecuali media IPB RI-1 yang tidak diberikan aerasi, populasi Bakteri Pelarut Fosfat lebih rendah dibandingkan dengan media yang lain.
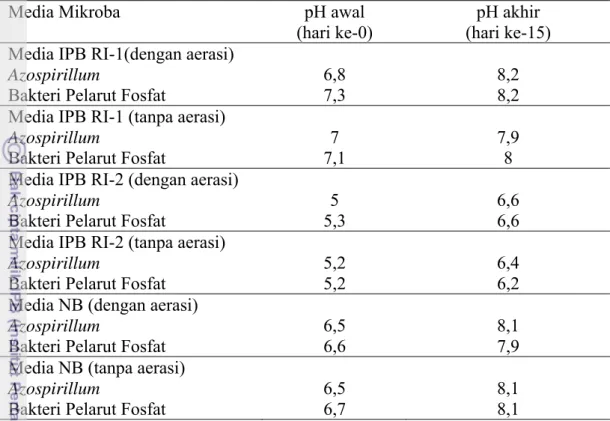
4.5. Kajian Sifat Kimia 4.5.1. Nilai pH
pH merupakan derajat kemasaman yang menunjukkan terdapat lebih banyak ion H+ atau OH- dalam suatu larutan (Tan, 1982). Mikroba dapat tumbuh baik pada daerah pH tertentu, misalnya untuk bakteri pada pH 6,5 – 7,5; khamir pada pH 4,0 – 4,5 sedangkan jamur dan aktinomisetes pada daerah pH yang luas. Setiap mikroba mempunyai pH minimum, optimum dan maksimum untuk pertumbuhanya. Beberapa spesies dapat tumbuh dalam keaadaan sangat masam atau sangat alkalin, bila bakteri di kuitivasi di dalam suatu media yang mula-mula disesuaikan pH-nya misal 7 maka mungkin pH ini akan berubah sebagai akibat adanya senyawa-senyawa asam atau basa yang dihasilkan selama pertumbuhannya. Perbandingan nilai pH pada media IPB RI-1, media IPB RI-2 dan media Nutrient Broth (NB)dapat dilihat pada Tabel 10.
Tabel 10. Nilai pH pada Media IPB RI-1, IPB RI-2 dan Nutrient Broth
Media Mikroba pH awal (hari ke-0)
pH akhir (hari ke-15) Media IPB RI-1(dengan aerasi)
Azospirillum 6,8 8,2
Bakteri Pelarut Fosfat 7,3 8,2 Media IPB RI-1 (tanpa aerasi)
Azospirillum 7 7,9
Bakteri Pelarut Fosfat 7,1 8 Media IPB RI-2 (dengan aerasi)
Azospirillum 5 6,6
Bakteri Pelarut Fosfat 5,3 6,6 Media IPB RI-2 (tanpa aerasi)
Azospirillum 5,2 6,4
Bakteri Pelarut Fosfat 5,2 6,2 Media NB (dengan aerasi)
Azospirillum 6,5 8,1
Bakteri Pelarut Fosfat 6,6 7,9 Media NB (tanpa aerasi)
Azospirillum 6,5 8,1
Bakteri Pelarut Fosfat 6,7 8,1
Perubahan pH menunjukkan aktivitas mikroba yang terdapat pada media. Pada awal pengukuran, pH media IPB RI-1 dan media Nutrient Broth berada pada
kondisi netral (pH 6,5-7), sedangkan pH media IPB RI-2 lebih masam. Setelah hari ke 15,pH pada media semakin basa. Hal ini disebabkan oksigen sebagai akseptor elektron terkuat mengoksidasi bahan organik menjadi CO2. Mikroba aerob menggunakan oksigen dalam proses respirasi dan akan menghasilkan CO2. CO2 yang terbebaskan bereaksi dengan air membentuk H2CO3 dan karena bersifat asam lemah maka anionnya (HCO3-) akan cenderung membentuk garam tak larut dengan Fe3+ dan H+. Unsur-unsur yang dapat menjadi sumber kemasaman dapat menurun dan pH akan meningkat.
4.5.2. Nilai EC (Electrycal Conductivity)
EC menunjukkan kadar garam serta memberikan indikasi mengenai hara yang terkandung dalam larutan dinyatakan dalam µS/cm. Nilai EC pada media IPB RI-1, IPB RI-2 dan Nutrient Broth (NB) dapat dilihat pada Tabel 11.
Tabel 11. Nilai EC pada Media IPB RI-1, IPB RI-2 dan Nutrient Broth
Media Mikroba hari ke-0 EC awal (µS/cm)
EC akhir hari ke-15
(µS/cm) Media IPB RI-1(dengan aerasi)
Azospirillum 3,49 2,63
Bakteri Pelarut Fosfat 3,72 2,83 Media IPB RI-1 (tanpa aerasi)
Azospirillum 5,34 6,12
Bakteri Pelarut Fosfat 3,39 5,75 Media IPB RI-2 (dengan aerasi)
Azospirillum 1138 1321
Bakteri Pelarut Fosfat 1110 1371 Media IPB RI-2 (tanpa aerasi)
Azospirillum 1060 1294
Bakteri Pelarut Fosfat 1094 1331 Media NB (dengan aerasi)
Azospirillum 309 1035
Bakteri Pelarut Fosfat 340 477 Media NB (tanpa aerasi)
Azospirillum 449 570
Bakteri pelarut Fosfat 500 758
Perubahan nilai EC dalam larutan hara berbanding lurus dengan banyaknya unsur hara yang terkandung dalam larutan hara. Semakin banyak unsur hara yang terkandung dalam larutan maka semakin tinggi nilai EC. Hal ini mengindikasikan kemampuan larutan untuk menghantarkan ion listrik ke akar tanaman semakin tinggi. Media IPB RI-2 mempunyai nilai EC paling tinggi, ini menunjukkan bahwa dalam media IPB RI-2 terkandung banyak ion-ion. Akan tetapi Chalcedaas (1998) menambahkan bahwa konduktivitas mengukur jumlah total partikel bermuatan listrik dalam larutan, tetapi tidak membedakan antara satu ion dengan ion lain sehingga konduktivitas tidak dapat mendeteksi keseimbangan hara dalam suatu larutan.
4.5.3. Nilai Eh (Potensial Reduksi)
Nilai Eh menunjukkan keadaan oksidatif dan redukstif dari suatu larutan. Nilai Eh yang positif menunjukkan kondisi oksidatif, sebaliknya nilai Eh negatif
menunjukkan kondisi reduktif (Ponnamperuma, 1976). Nilai Eh pada media IPB RI-1, media IPB RI-2 dan media Nutrient Broth (NB) dapat dilihat pada Tabel 12.
Tabel 12. Nilai Eh pada Media IPB RI-1, IPB RI-2 dan Nutrient Broth
Media Mikroba Eh awal hari ke-0 (mV) Eh akhir hari ke-15 (mV)
Media IPB RI-1(dengan aerasi)
Azospirillum -93,2 -114,1
Bakteri Pelarut Fosfat -91 -114,8 Media IPB RI-1 (tanpa aerasi)
Azospirillum -76 -74
Bakteri Pelarut Fosfat -54,9 -99,5 Media IPB RI-2 (dengan aerasi)
Azospirillum 10,2 -102,4
Bakteri Pelarut Fosfat 29,7 -112 Media IPB RI-2 (tanpa aerasi)
Azospirillum -105 -160,1
Bakteri Pelarut Fosfat -100,5 -162,2 Media NB (dengan aerasi)
Azospirillum 144 -107,3
Bakteri Pelarut Fosfat 152,3 -101,2 Media NB (tanpa aerasi)
Azospirillum 165 -102,2
Bakteri pelarut Fosfat 145,8 -102,5
Kondisi media mikroba bersifat lebih reduktif karena mikroba didalamnya melepaskan elektron secara simultan melalui proses respirasi. Pada tabel dapat dilihat bahwa semakin lama waktu inkubasi maka nilai Eh semakin reduktif. Kecepatan penurunan nilai Eh masing-masing media berbeda-beda. Nilai Eh ini berpengaruh terhadap kehidupan mikroba, kondisi reduktif menggambarkan aktivitas bakteri rendah akibat oksigen yang berkurang. Hal ini dapat mengakibatkan bakteri yang ada tidak bisa berkerja dengan optimal dalam mendekomposisi bahan-bahan organik.
4.6. Harga Bahan Media
4.6.1. Biaya Bahan Media IPB RI-1, IPB RI-2, dan Nutrient Broth
Pada penelitian ini dilakukan penghitungan biaya bahan media untuk melihat biaya yang diperlukan dalam membuat masing-masing media. Biaya
bahan-bahan yang dibutuhkan untuk membuat 1 liter media IPB RI-1 adalah Rp. 945 (Tabel 13). Bahan-bahan yang digunakan pada media IPB RI-1 dibeli dari pasar Bogor dan bahan-bahan seperti kepala ikan teri dan gula merah didapatkan dengan harga murah karena bahan-bahan tersebut adalah barang-barang yang sudah lama di pasar dan tidak ada yang membeli lagi.
Tabel 13. Biaya Bahan untuk Membuat 1 liter Media IPB RI-1
Bahan Jumlah Harga (kg) Biaya yang digunakan Pupuk Urea 10 gram Rp. 1.300 Rp. 13
Pupuk SP-36 5 gram Rp. 10.100 Rp. 50 Terasi 2,5 gram Rp. 100.000 Rp. 250 MSG 1 gram Rp. 30.000 Rp. 30 Kepala ikan teri 10 gram Rp. 1.000 Rp. 10 Air mineral 1 Liter Rp. 10.500/19 L. Rp. 552 Dedak padi 10 gram Rp. 1.000 Rp. 10 Gula merah 10 gram Rp. 3.000 Rp. 30 Total biaya bahan untuk 1 liter media IPB RI-1 Rp. 945
Biaya bahan-bahan yang dibutuhkan untuk membuat 1 liter media IPB RI-2 adalah Rp. 690 (Tabel 14). Bahan molases yang digunakan pada penelitian ini berasal dari Pabrik Gula Subang yang berada di Kecamatan Purwodadi, Kabupaten Subang.
Tabel 14. Biaya Bahan untuk Membuat 1 liter Media IPB RI-2
Bahan Jumlah Harga Biaya yang digunakan Air mineral 1 Liter Rp. 10.500/19 L. Rp. 552 Molases (5%) 50 ml Rp. 2.750/ L Rp. 138 Total biaya bahan untuk 1 liter media IPB RI-2 Rp. 690
Biaya bahan-bahan yang dibutuhkan untuk membuat 1 liter media Nutrient Broth adalah Rp. 27.752 (Tabel 15). Nutrient Broth yang dipakai pada penelitian
Tabel 15. Biaya Bahan untuk Membuat 1 liter Media Nutrient Broth.
Bahan Jumlah Harga Biaya yang digunakan Air mineral 1 Liter Rp. 10.500/19 L. Rp. 552
Nutrient Broth 8 gram Rp. 3.400.000/ kg Rp.27.200 Total biaya bahan untuk 1 liter media Nutrient Broth Rp. 27. 752
Biaya bahan yang diperlukan untuk membuat media Nutrient Broth sangat
mahal jika dibandingkan dengan total biaya bahan untuk membuat media IPB RI-1 maupun media IPB RI-2.
V. KESIMPULAN DAN SARAN
5.1. Kesimpulan
Media IPB RI-1 menghasilkan 1010 cfu/ml Azotobacter, 109 cfu/ml
Bakteri Pelarut Fosfat dan 108 cfu/ml Azospirillum. Media Nutrient Broth hanya
mampu menghasilkan populasi mikroba sebanyak 108 cfu/ml media. Media IPB RI-1 mampu menghasilkan populasi Azotobacter 100 kali lipat dan Bakteri
Pelarut Fosfat meningkat 10 kali lipat dari populasi mereka di dalam media
Nutrient Broth
Media IPB RI-2 menghasilkan 109 cfu/ml Azotobacter, 108 cfu/ml Azospirillum dan 108 cfu/ml Bakteri Pelarut Fosfat. Media IPB RI-2 mampu
menghasilkan sel Azotobacter 10 kali lipat dibandingkan dengan media Nutrient Broth.
Biaya bahan untuk membuat media IPB RI-1 dan IPB RI-2 sangat murah dibandingkan dengan biaya bahan untuk membuat media Nutrient Broth. Total
biaya bahan media IPB RI-1 hanya 3% (Rp 945) dan IPB RI-2 hanya 2% (Rp 690) dari total biaya bahan media Nutrient Broth (Rp 27.752).
5.2. Saran
Pada studi awal ini telah diperoleh waktu fermentasi 15 hari untuk pertumbuhan optimum mikroba pada media alternatif yang diuji, sehingga disarankan suatu penelitian lanjut untuk menguji media alternatif tersebut dengan waktu lebih dari 15 hari fermentasi dan diharapkan dapat melakukan uji efektifitas melalui tanaman.
DAFTAR PUSTAKA
Adams, C. R. and M. P. Early. 2004. Principles of Horticulture. Elsevier. Boston.
Alexander, M. 1977. Introduction to Soil Microbiology. John Willey and Sons.
New York.
___________ . 1978. Introduction to Soil Microbiology. 2nd ed. Willey Eastern
Private limited. New Delhi.
Amrullah, K. I. 2002. Nutrisi Ayam Broiler. Lembaga Satu Gunung Budi. Bogor.
Asiamaya. 2010.http://www.asiamaya.com/nutrients/gulajawa.htm [3 Mei 2011].
Astuti, A. 2007. Isolasi dan Karakterisasi Azospirillum sp. Indigenus Penghasil Asam Indol asetat Asal Tanah Rizosfer. Skripsi. Departemen Biologi,
Fakultas Matematika dan Ilmu Pengetahuan Alam. Institut Pertanian Bogor. Bogor.
Bachhwat, A. K. and S. Ghosh. 1989. Temperature inhibition of siderophore production in Azospirillum brasilense. J Bacteriol 171 :4092-4094.
Bahsan, Y. and L. E. Bashan. 2002. Protection of tomato seedlings against infection by Pseudomonas syringe pv. Tomato by using plant
growth-promoting bacterium Azospirillum brailense. Appl Environ Microbiol 6:
2637-2643.
Baikow, V. E. 1982. Manufacture and Refining of Sugar Cane. Elsevier Scientific
Publishing Company. Amsterdam.
Chalcedaas, P. N. M. 1998. Conductivity of nutrient simplyfied. Practical hydroponic and greenhouse. International Trade Directory 1998-1999. P
122-124
Day, J. M. and J. Dobereiner. 1976. Physiological aspects of N2 fixation by Azospirillum from Digitania roots. Soil Biol Biochem. 8: 45-50.
[DSN] Dewan Standarisasi Nasional. 2001. Dedak Padi/ Bahan Baku Pakan. Goenadi, D. H., R. Saraswati, R. R. Nganro, A. S. Adinigsih. 1995. Mikroba
pelarut hara dan pemantap agregat dari beberapa tanah tropika basa.
Menara Perkebunan 62 : 60-66.
Hamim, N., R. Mubarik, I. Hanarida, N. Sumarni. 2008. Pengaruh pupuk hayati terhadap pola serapan hara, ketahanan penyakit, produksi dan kualitas hasil beberapa komoditas tanaman pangan dan sayuran unggulan KKP3T. Institut Pertanian Bogor. Bogor.
Hartadi, H. S., Reksohadiprodjo dan A. D. Tillman. 1990. Tabel Komposisi Pakan untuk Indonesia. Gadjah Mada University Press. Yogyakarta.
Hidayati, N. 2009. Efektivitas Pupuk Hayati pada Berbagai Lama Simpan Terhadap Pertumbuhan Tanaman Padi (Oryza sativa) dan Jagung
(Zea mays) [skripsi]. Fakultas Matematika dan Ilmu Pengetahuan Alam.
Institut Pertanian Bogor
Holt, J. G., N. R. Krieg, P. H. A. Sneath, J.T. Staley, S.T. Williams. 1994.
Bergey’s Manual of determinative Bacteriology. Lippincott Williams &
Wilkins. Phalidelpia.
Illmer, P. and F. Schinner. 1995. Solubilization of inorganic calcium phosphates solubilization mechanism. Soil Biol Biochem 27: 257-263.
Imas, T., R. S. Hadioetomo, A. W. Gunawan, Y. Setiadi. 1989. Mikrobaiologi Tanah II. Departemen Pendidikan Dan Kebudayaan Direktorat Jenderal
Pendidikan Tinggi Pusat Antar Universitas Bioktenologi Institut Pertanian Bogor. Bogor.
Khudori. 2006. Teknologi Pemupukan Hayati. Republika. Jakarta.
Killham, K . 1995. Soil Ecology . Cambridge University Press. Cambridge.
Kirk, R. E. and D. F. Othmer. 1963. Kirk-Othmer encyclopedia of Chemical Technology. 2nd Edition. John Wilet and sons Inc. New York.
Kundu, B. S., R. Gera, N. Sharma, A. Bhatia, R. Sharma. 2002. Host specifity of phospate solubilizing bacteria. Ind J. Microbiol 42:19-21.
Lasrin, H. 1997. Ketahanan Hidup Azotobacter Penambat Nitrogen pada Berbagai
Bahan Pembawa serta Pengaruhnya terhadap Pertumbuhan Tanaman jagung (Zea mays). Skripsi. Jurusan Tanah, Fakultas Pertanian. IPB.
Bogor.
Lim, D. 1998. Microbiology. 2nd Edition. McGraw-Hill Companies.
Columbus.
Madigan, M. T., J. M. Martinko, J. Parker. 2000. Biology of Microorganism . 9th
Edition. Prentice Hall. New Jersey.
Novita, E. 2001. Optimasi proses koagulasi flokulasi pada limbah cair yang mengandung melanoidin. J. Ilmu Dasar 2(1):61-67.
Okon, Y, S. L. Albercth, R. H. Burris. 1977. Methods for growing Spirillum lipoferum for counting it in pure cultures and association with plants. Appl Environ Microbiol 33(1):85-88.
Okon, Y and Y. Kalpunik. 1986. Development and function of Azospirillum
-inoculated roots. Plant and soil 90:3-16.
Paturau, J. M. 1982. By-Products of The Cane Sugar Industry. Elsevier Scientific
Publishing Company. Amsterdam.
Ponamperuma, F. N., 1976. Physicochemical Properties of Submerged Soils in Relation to Fertility. In The Fertility of Paddy Soils and Fertilizer Applications for Rice. Food and Fertilizer Technology Center. Taipei.
Prescott, L. M., J. P. Harley, D. A. Klein. 2000. Microbiology. 5th Edition.
McGraw-Hill Companies. Columbus.
Prihatini, T., A. Kentjasari, Subowo. 1996. Pemanfaatan biofertilizers untuk peningkatan produktivitas lahan pertanian. Jurnal Penelitian dan Pengembangan Pertanian XV (1):22-26
Rasyaf, M. 1990. Bahan Makanan Unggas. Kanisius. Yogyakarta.
Rao, N. S. 1982. Biofertilizers in Agriculture. Oxford & IBH Publishing Co.
Oxford. New Delhi.
Ritz, K., M. McHugh and J. Harris. 2003. Biological Diversity and function in soils : contemporary perspective and implication in rtelation the formulation of effective indicator. OECD Expert meeting on Soil Erosion
and Soil Biodiversity Indicator. Rome.
Rodriguez, H., T. Gonzales, I. Goire, Y. Bashan. 2004. Gluconic acid production and phosphate solubilization by the plant growth-promoting bacterium
Azospirillum spp. Naturwissenschaften 91:552-555.
Sarief, E. S. 1985. Kesuburan dan Pemupukan Tanah Pertanian. Pustaka Buana.
Bandung
Vessey, J. K. 2003. Plant growth promoting rhizobacteria as biofertilizer. Plant Soil 255: 571-586.
Volk, WA, M. F. Wheeler. 1984. Basic Microbiology. 5th Edition. Harper & Row
Publisher Inc. New York.
White, D. 1995. The Phisiology and Biochemistry of Procaryotes. Oxford
Yuwono, T. 2006. Bioteknologi Pertanian. Gajah Mada University Press.