BAB 3
METODE PENELITIAN
3.1. Waktu dan Tempat
Penelitian dilaksanakan mulai dari bulan April sampai dengan November 2016 di Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan. Analisis residu karbofuran secara kuantitatif dilakukan di Balai Besar Proteksi dan Perbenihan Tanaman Perkebunan (BBPPTP), Medan dan Pengamatan mikroskopis menggunakan SEM dilakukan di Pusat Penelitian Biologi, Bagian Zoologi, Lembaga Penelitian Indonesia, Cibinong, Jawa Barat.
3.2. Alat dan Bahan
Alat yang digunakan pada penelitian ini antara lain spektrofotometer, Hight
Performance Liquid Chromatographi (HPLC), vortex, sentrifuge, inkubator, pipet
volume, cawan petri, erlenmeyer, gelas ukur, beaker glass, jarum ose bengkok, pipet mikro dan tip, magnetic stirrer, magnetic bar, laminar airflow, ion coater,
vacum drier, orbital shaker, ultrasonic cleaner dan Scanning Electron
Microscope (SEM).
Bahan yang digunakan pada penelitian ini antara lain pestisida berbahan aktif karbofuran dengan merek dagang Gemafur© 3GR, Nutrient Agar (NA),
Plate Count Agar (PCA), akuades, Phospat Buffered Saline (PBS), N-heksan,
alkohol (50%, 70%, 85%, 95%, absolut), tert butanol, desinfektan, larutan tri-sodium sitrat, larutan polyurethane A dan B, caccodylate buffer, Glutaraldehyde
2,5%, tannic acid 2%, OsO4
Media yang digunakan pada penilitan ini adalah Nutrient Agar (NA),
Nutrient Broth (NB), Plate Count Agar (PCA) dan Busnel Hass Broth (BHB).
Bakteri yang digunakan merupakan bakteri koleksi Laboratorium Mikrobiologi FMIPA USU dengan spesies Pseudomonas aeruginosa dan Pseudonomonas
aeruginosa Strain M111.
3.3. Prosedur Penelitian
3.3.1. Persiapan Kultur Bakteri dan Pemeriksaan Kemurnian Kultur
Kedua bakteri diremajakan pada media NA selama 1 x 24 jam. Pemeriksaan kemurnian kultur dilakukan untuk memastikan kemurnian kultur yang didapatkan melalui pemeriksaan morfologi secara mikroskopis dengan metode pewarnaangram (Fardiaz, 1992) dan uji biokimia (Hadioetomo, 1990).Selanjutnya isolat ditumbuhkan kembali pada media NB sebagai kultur antara dalam pemanenan sel, inkubasi dilakukan dengan menggunakan
orbitalshaker pada suhu ambient dengan kecepatan 120 rpm selama 2 x24 jam
(Lampiran 1).
3.3.2.Pembuatan Suspensi Sel Bakteri
Isolat yang ditumbuhkan pada media NB (Nutrient Broth) sebagai kultur
antara diendapkan dengan menggunakan centrifuge dengan kecepatan 6000xg selama 20 menit pada 4oC. Akan terbentuk dua fase yaitu fase cair/ supernatan (bagian atas) dan fase padat/ pelet (bagian bawah). Pelet bakteri dihomogenkan pada PBS pH 7 kemudian diendapkan dengan cara yang sama. Perlakuan ini
diulangi sebanyak dua kali untuk membersihkan sel bakteri dari sisa media. Bagian pelet diambil kembali dan kemudian dicampur dengan PBS hingga homogen. Suspensi diatur kekeruhannya dengan nilai absorbansi 1 pada panjang gelombang 600 nm (109 CFU/ ml).
3.3.3.Imobilisasi Bakteri
a. Imobilisasi dengan Mengunakan Polyurethane foam (PUF)
sebanyak 100 ml ke dalam erlenmeyer yang berisi PUF secara aseptis, kemudian
dihomogenkan pada orbital shaker selama 6 jam (Quek et al., 2005) dimodifikasi. b. Imobilisasi dengan Menggunakan Alginat
Sebanyak 50 ml suspensi bakteri yang sama kemudian dicampurkan dengan 50 ml alginat dengan konsentrasi 3% (b/v). Selanjutnya campuran tersebut diteteskan pada CaCl2 0,1 Menggunakan syringe sambil dilakukan pengadukan
dengan kecepatan putaran 50-100 rpm menggunakan magnetic stirrer. Pengerasan gel dilakukan selama satu jam (Li et al. 2009). Gel yang terbentuk dipindahkan dalam larutan NaCl fisiologis (0,85%) untuk mendapatkan struktur gel yang kompak. Kapsul yang terbentuk selanjutnya dimasukkan ke air destilasi steril dan diputar secara perlahan selama satu jam untuk menghilangkan residu CaCl2
(Lampiran 1).
3.3.4. Efektifitas Imobilisasi
Keberhasilan dari proses imobilisasi dapat dihitung dengan cara membandingkan jumlah bakteri sebelum dan sesudah imobilisasi, dengan persamaan sebagai berikut:
����������������������= �������� ������� ������ ℎ�����������
�������� ������� ������� ����������� � 100%
3.3.5. Uji Viabilitas Bakteri Setelah Imobilisasi dan Pengaplikasian pada Media Uji
Uji viabilitas dilakukan dengan metode Triana et al. (2006) yang telah dimodifikasi, segera setelah proses enkapsulasi selesai dan diinkubasi selama 20 hari pada suhu 37o
Penghitungan jumlah bakteri segera dilakukan setelah enkapsulasi. Jumlah populasi bakteri yang terdapat pada polyurethane foam (PUF) dan kapsul alginat dihitung selama 15 hari masa inkunasi dengan interval 5 hari. Penghitungan jumlah bakteri dilakukan dengan cara memisahkan bakteri dari bahan penyalut. Kapsul alginat diguncang dalam larutan tri-sodiun sitrat hingga larut sempurna, sedangkan bakteri pada polyurethane foam dimasukkan dalam larutan NaCl
C kondisi kering dan amobil. Viabilitas sel terenkapsulasi dihitung dengan menggunakan metode Total Plate Count menggunakan media
Plate Count Agar (PCA) dengan membuat pengenceran berseri.
Efektifitas Imobilisasi = Populasi bakteri setelah imobilisasi
0,85% dan diguncang dengan vortex. Ketahanan bakteri terimobilisasi didapat
dengan membandingkan populasi bakteri sebelum diaplikasikan, dengan seusdah diaplikasikan selama 15 hari masa inkubasi pada suhu ambien.
Ketahanan (%) = �������� ������� ���� �������� ���� ����� �
�������� ����������� �������� ������� �������������
× 100%
3.3.6. Uji Aktifitas Biosurfaktan
Skrining aktivitas biosurfaktan dilakukan dengan metode Drop Collapsing
Test (Jain et al., 1991) yang dimodifikasi, yaitu metode yang digunakan untuk
menentukan penurunan tegangan permukaan cairan. Isolat bakteri ditumbuhkan
pada media BHB yang ditambahkan 2% dekstrosa sebagai sumber karbon. Sebanyak 2 ml inokulum cair isolat bakteri (λ600 = 1 Abs setara 109 CFU/ml) diinokulasikan kedalam 100 ml media BHB yang mengandung 2% dekstros secara aseptis. Media diinkubasi pada waterbath shaker dengan kecepatan 150 rpm pada suhu ruang selama 15 hari. Setelah 15 hari masa inkubasi, masing-masing media biakan disaring dan diambil filtratnya. Sebanyak 4 ml filtrat media dimasukkan ke dalam tabung reaksi, ditambah 4 ml N-heksan dan 2 ml akuades. Lalu campuran larutan tersebut dihomogenkan dengan vorteks selama 10 detik dan didiamkan selama 1menit. Emulsi yang terbentuk diukur ketebalannya dengan menggunakan gelas ukur. Persentase Indeks Emulsifikasi (IE) dihitung dari
masing-masing isolat dengan cara membandingkannya antara volume emulsi dibagi dengan totalvolume filtrat lalu dikali 100% (Hamzah et al., 2013).
IE (%) = ������ ������ ���� ���������
����� ������ ������� (10 ��)
× 100%
(Hamzah et al., 2013)
3.3.7. Uji Kemampuan Bakteri Terimobilisasi Dalam Mendegradasi Pestisida Secara In-vitro
Pengujian kemampuan bakteri yang telah diimobilisasi dalam mendegradasi pestisida dilakukan dengan memberikan bakteri imobil pada media cair Busnel Hass Broth dengan 4% (b/v) pestisida berbahan aktif karbofuran.
Populasi bakteri pada penyalut pada waktu t
Populasi bakteri pada penyalut sebelum diaplikasikan x 100%
Volume emulsi yang terbentuk
Bakteri yang telah diimobilisasi dengan menggunakan polyurethane foam maupun
alginat dimasukkan masing-masing 0,2 gram dan 2 gram dalam 98 ml media uji kemudian dinkubasi pada suhu ruang selama 30 hari menggunakan orbital shaker pada suhu ruang (28oC) dengan kecepatan 100 rpm. Sebagai kontrol, dilakukan pengujian degradasi pestisida menggunakan bakteri sel bebas dengan memberikan 2 ml suspensi bakteri (λ600 = 1Abs setara 109 CFU/ml) pada 98 ml media uji. Dilakukan perhitungan jumlah sel dananalisis dengan HPLC untuk mengetahui
residu pestisida pada media uji setiap 10 hari masa inkubasi selama 30 hari Teraakun et al. (2004) dimodifikasi. (Lampiran 1).
3.3.8. Pengamatan Distribusi dan Penempelan Bakteri Pada Bahan Penyalut Prosedur pengamatan mikroskopis menggunakan SEM merujuk pada Scneider (2014) yang telah dimodifikasi. Sampel berupa kapsul alginat dan
polyurethane foam dibersihkan dengan cara merendam sampel dalam larutan
caccodylate buffer kurang lebih 2 jam. Kemudian diagitasi dalam ultrasonic
cleaner selama 5 menit. Sampel kemudian diprefiksasi dengan merendam dalam larutan glutaraldehyde 2,5% selama 2 hari. Selanjutnya sampel difiksasi dalam tannic acid 2% selama 6 jam. Setalah itu cuci dengan caccodylate buffer selama 5 menit sebanyak 4 kali ulangan. Proses berikutnya dalah dehidrasi dengan perendaman pada alkohol 50% selama 5 menit 4 kali pengulangan, 70% selama 20 menit, 80% selama 20 menit, alkohol 95% selama 20 menit dan terakhir pada alkohol absolut selama 10 menit hingga 2 kali ulangan. Setelah proses dehidrasi selesai sampel dikeringkan dengan merendam dalam tert butanol selama 10 menit sebanyak 2 kali pengulangan. Sampel dibekukan dalam freezer sampai beku. Selanjutnya divakum dalam vacum drier hingga mengering. Setelah kering sampel direkatkan pada permukaan tembaga untuk di-coating emas menggunakan E IS-2 Ion Coater. Sampel diamati dengan Mikroskop Elektron Jeol JSM-5310LV
Scanning Microscope di Laboratorium Zoologi, Pusat Penelitian Biologi,
BAB 4
HASIL DAN PEMBAHASAN
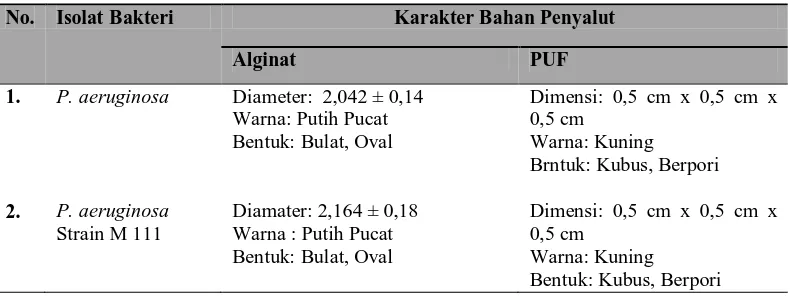
4.1. Imobilisasi Bakteri Menggunakan Alginat dan Polyurethane Foam (PUF) Imobilisasi dilakukan dengan metode ekstruksi menggunakan syringe 23G x 1¼ menghasilkan kapsul alginat dengan diameter 2,042 ± 0,14 untuk Pseudomonas
aeruginosa dan 2,164 ± 0,18 untuk Pseudomonas aeruginosa Strain M111, warna
kapsul putih pucat dan bentuk bulat hingga oval untuk masing-masing kapsul dari kedua isolat (Tabel 1). Perbedaan bentuk dan diamater dari kapsul alginat hasil imobilisasi dipengaruhi oleh beberapa faktor, diantaranya konsentrasi dari alginat, konsentrasi dari suspensi awal yang digunakan dan jarak antara jarum suntik dengan larutan CaCl2
Hal tersebut sesuai dengan yang disampaikan oleh Cheetham et al. (1979) jbahwa karakteristik fisik dari alginat bergantung pada beberapa faktor. Diantaranya adalah konsentrasi alginat dan suspensi awal sel bakteri. Konsentrasi alginat dapat mempengaruhi karakter, seperti kekuatan mekanik, retensi sel, porositas, diameter kapsul, dan kompresibilitas. Selain itu, Sandoval (2010), Smidsrod dan Braek (1996) dan Castilla et al. (2010) juga menyatakan bahwa ukuran dan bentuk dari kapsul alginat bergantung pada konsentrasi Na-alginat, viskositas, diameter jarum suntuk yang digunakan dan jarak antara jarum suntik dengan larutan CaCl
.
2
Table 1. Karakteristik morfologi kapsul alginat dan Polyurethana Foam (PUF) pada saat proses ekstruksi dilakukan.
No. Isolat Bakteri Karakter Bahan Penyalut
Alginat PUF
Diamater: 2,164 ± 0,18 Warna : Putih Pucat Bentuk: Bulat, Oval
Dimensi: 0,5 cm x 0,5 cm x 0,5 cm
Warna: Kuning Bentuk: Kubus, Berpori
ukuran dan morfologi yang cenderung sama. Pada pengamatan permukaan PUF
dengan magnifikasi sebesar 10 X terlihat adanya pori-pori yang sangat banyak dan saling terhubung dengan bagian dalam dari PUF itu sendiri. PUF merupakan salah satu golongan plastik yang membentuk struktur seperti busa sehingga memiliki banyak pori (Gambar 4).
Gambar 4. Mikrograf bahan penyalut menggunakan mikroskop stereo pencahayaan atas. a) Kapsul alginat untuk isolat Pseudomonas
aeruginosa, b) Kapsul alginat untuk isolat Pseudomonas aeruginosa Strain M 111, c) Polyurethane Foam untuk isolat Pseudomonas aeruginosa dan d) Polyurethane Foam untuk isolat Pseudomonas aeruginosa Strain M 111
Hasil pengamatan mikrokopis menggunakan Scanning Electron
Microscope (SEM) permukaan dalam dan luar dari kapsul alginat dan PUF
(Gambar 5). Permukaan dari kapsul alginat dengan magnifikasi 7500 X terlihat alginat terlihat kasar dan bergelombang (Gambar 5a dan 5e). Struktur berbentuk tonjolan yang tidak teratur yang disebut protrusion (pr) ditemukan pada bagian permukaan dan tersebar di beberapa bagian kapsul alginat. Struktur tersebut dikenali sebagai koloni bakteri yang membentuk struktur biofilm. Penampakan
a
b
2 mm 2 mm
c
1 cmd
a
po
Gambar 5. Mikrograf SEM pada tampak permukaan dan bagian dalam bahan penyalut. a) permukaan luar kapsul alginat bakteri P. aeruginosa (pr = protrusion), b) permukaan dalam kapsul alginat bateri P.
aeruginosa (ba = bakteri), c) permukaan luar PUF bakteri P.aeruginosa, permukaan dalam PUF P. aeruginosa (ba = bakteri),
d) permukaan luar kapsul alginat bakteri P. aeruginosa Strain M111 (pr = protrusion), e) permukaan dalam kapsul alginat bateri bakteri
P. aeruginosa Strain M111 (ba = bakteri), g) permukaan luar PUF
protrusion pada permukaan alginat juga diperlihatkan oleh penelitian yang
dilakukan oleh Rosa et al. (1988), struktur seperti pada Gambar 5a dan 5e dinamakan dengan protrusion yang merupakan kumpulan dari sel bakteri yang melekatkan diri satu sama lain pada permukaan kapsul dengan membentuk struktur biofilm.
Bakteri yang terimobilisasi di bagian permukaan luar cenderung lebih sulit untuk bertahan dibandingkan dengan yang berada di bagian dalam kapsul, sehingga bakteri membentuk biofilm agar dapat memaksimalkan kondisi lingkungan agar mendukung pertumbuhan dari bakteri tersebut. Bagian dalam dari kapsul alginat (Gambar 5b dan 5f) memperlihatkan bahwa bakteri dibalut oleh alginat. Sel-sel bakteri tersebar secara merata pada bagian dalam kapsul alginat tersebut. Kapsul alginat mampu memberikan porositas yang tinggi sehingga komunikasi dan aliran nutrisi antara sel bakteri terjalin dengan baik. Riley et al. (1999) menyatakan bahwa kemampuan difusi dari nutrien dan gas, ditentukan oleh area pori pada bahan penyalut, berperan penting pada viabilitas dari bakteri yang terimobilisasi pada bahan penyalut.
Untuk bagian permukaan dari PUF (Gambar 5c dan 5g) terbilang sangat halus dan rata. Terlihat bahwa bakteri P. aeruginosa mampu melekatkan diri pada permukaan PUF, dikarenakan bakteri membentuk struktur biofilm. Struktur
biofilm dapat terlihat menyatukan satu sel bakteri dengan bakteri lainnya, dan
koloni bakteri dengan substrat perlekatannya. Dunne et al. 2001 menyatakan bahwa bakteri Pseudomonas aeruginosa mampu menghasilkan eksopolisakarida bagian dari EPS. Dalam beberapa kasus, bakteri mampu menghasilkan EPS yang
digunakan untuk menangkap nutrisi. Chen dan Stewart, (2002) menyimpulkan bahwa EPS bertanggung jawab pada interaksi adhesi dan kohesi sehingga memiliki peran penting dalam menjaga integritas struktural dari biofilm P.
aeruginosa sehingga dapat melekat dengan baik di permukaan PUF.
merupakan komponen dari Extracelular Polymeric Substance (EPS). Bakteri P.
aeruginosa mampu menghasilkan EPS dan membentuk biofilm sedangkan bakteri
P. aeruginosa Strain M111 cenderung tidak menghasilkan struktur biofilm.
Menurut Wei and Luyan (2013), bakteri Pseudomonas memiliki pili tipe IV yang mampu membantu pergerakan bakteri tersebut dan kemampuannya dalam melekatkan diri pada satu substrat.
Jumlah bakteri yang berada pada bagian dalam mengindikasikan bahwa suspensi yang digunakan pada proses imobilisasi mampu masuk hingga ke bagian dalam PUF, karena PUF memiliki pori-pori yang sangat banyak mulai dari bagian permukaan hingga bagian dalam. Jumlah bakteri yang berada di permukaan dari PUF lebih banyak dibandingkan pada bagian dalam dikarenakan proses imobilisasi yang kurang maksimal.
Bakteri P. aeruginosa memiliki kemampuan berikatan pada suatu permukaan dengan menghasilkan eksopolisakarida (Drenkard, 2003; Dunne, 2001). Wei danLuyan (2013) menyatakan bahwa P. aeruginosa membentuk biofilm sebagai substansi pelindung pertumbuhan yang memungkinkan mikroorganisme untuk bertahan hidup di lingkungan yang dapat merusak dan mencegah pembenihan sel untuk memasuki relung baru di bawah kondisi yang diinginkan. Biofilm dapat terbentuk pada berbagai permukaan dan yang lazim berada di alam.
Penelitian yang dilakukan oleh Yamaguchi et al. (1999) menunjukkan bahwa tingginya jumlah bakteri F92 imobil ditentukan oleh hidrofobisitas permukaan PUF atau jumlah akumulasi dari sel yang dialirkan. Hal tersebut telah
menyiratkan bahwa adanya hubungan langsung antara hidropobisitas permukaan sel dan adesi inisial yang bersifat irreversible pada permukaan bahan penyalut, berpengaruh pada efektifitas dari imobilisasi menggunakan PUF (Obuekwe & Al-Muttawa, 2001).
ekstraseluler pada suatu bakteri dapat diinduksi oleh perletakan ke permukaan
PUF (Vandevivere & Kirchman, 1993).
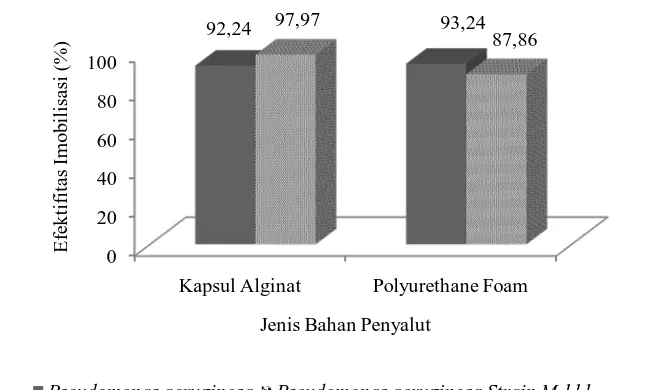
Kemampuan alginat dalam memerangkap sel bakteri lebih baik dibandingkan dengan PUF, hal ini dibuktikan oleh data (Gambar 6) yang memperlihatkan efektifitas imobilisasi lebih tinggi ditunjukkan oleh kapsul alginat dengan rata-rata efektifitas sebesar 95,105%, dimana bakteri P. aeruginosa sebesar 92,24% dan P. aeruginosa Strain M111 97,97. Berbeda dengan PUFdengan rata-rata lebih rendah yaitu 90,55%. Untuk bakteri P. aeruginosa lebih efektif diimobilisasi dengan menggunakan PUF (93,24%) dibandingkan pada kapsul alginat (92,24%).
Keberhasilan proses imobilisasi dapat dipengaruhi oleh beberapa hal, pada kapsul alginat dapat terjadi pembilasan (wash out) sel bakteri pada saat proses ekstruksi dilakukan sehingga jumlah bakteri yang berhasil terimobilisasi lebih sedikit dibandingkan dengan jumlah bakteri sebelum dilakukannya imobilisasi. Begitu pula dengan polyurethane foam (PUF), pada PUF kesempatan sel bakteri mengalami pembilasan (wash out) lebih besar dikarenakan teknik imobilisasi ini mengandalkan kemampuan sel bakteri untuk melekat pada permukaan PUF dan masuk melalui pori-pori yang ada.
Konsentrasi alginat 3% merupakan konsentrasi yang tepat untuk digunakan dalam proses imobilisasi. Rosa et al. (1988) menyatakan bahwa Gambar 6. Efektifitas imobilisasi bakteri menggunakan bahan penyalut alginat
dan polyurethane foam
konsentrasi alginat sebesar 3% tidak mengakibatkan terjadinya kebocoran sel,
menyediakan porositas tinggi dan pengikatan sel yang besar.
4.2. Viabilitas Bakteri Terimobilisasi
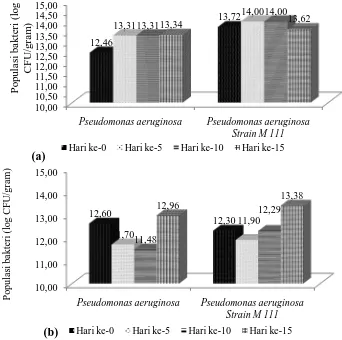
Viabilitas bakteri terimobilisasi pada kapsul alginat cenderung stabil, sedangkan bakteri yang diimobilisasi pada PUF menunjukkan data viabilitas yang fluktuatif selama masa inkubasi (Gambar 6). Kedua bakteri yang diimobilisasi pada PUF menunjukkan data yang hampir sama yaitu jumlah bakteri cenderung mengalami penurunan pada hari ke-5 hingga hari ke-10 dan kemudian kenaikan jumlah populasi pada hari ke-15. Dapat dikatakan bahwa kedua bakteri pada PUF melakukan penyesuaian terlebih dahulu, dikarenakan bakteri harus mampu melekatkan diri dengan baik pada permukaan PUF.
(a)
(b)
Gambar 7. Viabilitas bakteri terimobilisasi pada (a) kapsul alginat dan (b)
Polyurethane Foam (PUF)
Pseudomonas aeruginosa Pseudomonas aeruginosa
Strain M 111
Hari ke-0 Hari ke-5 Hari ke-10 Hari ke-15 10,00
Pseudomonas aeruginosa Pseudomonas aeruginosa
Strain M 111
Proses pembentukan biofil termasuk dalam penyesuain diri P. aeruginosa
untuk menempel pada PUF. Sesuai dengan hasil pengamatan mikroskopis dengan menggunakan SEM (Gambar 5d) memperlihatkan bahwa bakteri melekatkan diri pada permukaan PUF dengan membentuk satu lapisan (monolayer) yang dikenal juga sebagai biofilm untuk membantu bakteri melekatkan diri dan juga memperoleh nutrisi dari lingkungan sekitarnya, sedangkan bakteri P. aeruginosa Strain M111 tidak membentuk struktur biofilm.
Pada penelitian yang dilakukan oleh Quek et al. (2005) menyatakan bahwa bakteri yang diimobilisasi pada PUF akan menghasilkan satu lapisan yang sering disebut sebagai eksopolisakarida, yang bertanggung jawab untuk membentuk
monolayer dimana pembentukan tersebut dipicu oleh interaksi antara bakteri
dengan permukaan PUF (Vandevivere & Kirchman, 1993). Mekanisme pembentukan EPS berbeda pada beberapa bakteri dan membutuhkan waktu dalam proses pembentukannya (Diaz et al. 2002).
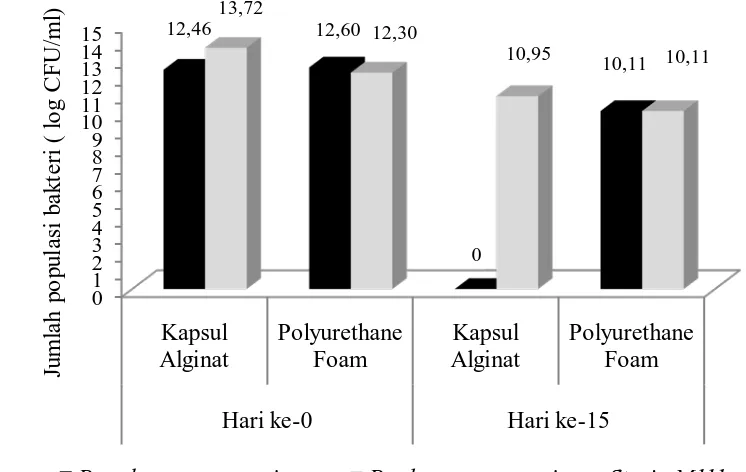
Pengukuran viabilitas bakteri terimobilisasi alginat dan PUF ketika diaplikasikan ke media uji menunjukkan bahwa viabilitas bakteri yang diimobilisasi menggunakan PUF lebih baik dibandingkan dengan alginat. Pada bakteri Pseudomonas aeruginosa dimobilisasi menggunakan kapsul alginat yang diaplikasikan pada media uji memperlihatkan bahwa pada hari ke-15 kapsul
alginat telah hancur dan menyatu dengan media uji, sehingga bakteri dapat dikatakan telah release 100%. Bakteri P. aeruginosa Strain M111 terimobilisasi kapsul alginat memperlihatkan data yang baik dimana kapsul alginat masih utuh dan kompak dengan jumlah bakteri yang bertahan sebesar 80% (Gambar 8). Dapat
dikatakan bahwa bakteri yang diimobilisasi menggunakan PUF akan lebih baik digunakan untuk pengaplikasian. Hal ini karenakan PUF mampu bertahan dalam kondisi lingkungan yang bervariasi, sedangkan kapsul alginat cenderung mengalami peluruhan.
oleh Chen danLin (2007) mendapat hasil bahwa kapsul alginat hancur seluruhnya
pada waktu 115 jam setelah aplikasi dilakukan, namun kapsul alginat-silika mampu bertahan 80% setelah diaplikasikan selama 170 jam. Beberapa penelitian mengasumsikan bahwa ikatan kovalen mampu terbentuk antara polimer
polyurethane dan permukaan sel selama proses imobilisasi (Fusee et al. 1981).
Hasil dari pengamatan mikroskop elektron pada Escherichia coli yang diimobilisasi pada polyurethane menyatakan bahwa sel telah merekat pada struktur kompak dari bahan penyalut (Klein &Kluge, 1981). Hasil dari penelitian O’Reilly dan Crawford (1989) mengindikasikan bahwa transfer oksigen pada
polyurethane terjadi dengan sangat baik. Polyurethane juga diketahui sebagai
matriks yang efektif dalam pendegradasian PCP oleh Flavobacterium. Proses dapat dilakukan berulang-ulang (continious-reuseable). Keuntungan imobilisasi menggunakan PUF mampu mempertahankan aktifitas pendegradasian PCP hingga 150 hari.
Kapsul alginat cenderung sensitif terhadap agen pengkelat, kondisi lingkungan yang ekstrem seperti pH, namun untuk suhu tidak terlalu berpengaruh. Faktor yang paling penting dari sifat fisik alginat adalah kemampuan
Gambar 8. Viabilitas bakteri terimobilisasi pada (a) kapsul alginat dan (b)
Polyurethane Foam (PUF) pada media uji BHB + 4% pestisida
berbahan aktif karbofuran selama 15 hari masa inkubasi
0
dalam mengikat kation, yang merupakan dasar untuk pembentukan gel.
Pembentukan gel tidak bergantung kepada suhu (Smidsrød, 1973). Pengikatan kalsium oleh agen pengkelat seperti beberapa kation dapat terjadi sebagai akibat dari struktur G-blok, yang disebut sebagai model '' egg-box '' (Grant et al. 1973). Ba2+ dapat mengganti beberapa ion kalsium, juga berkontribusi terhadap peningkatan stabilitas mekanik dan pembentukan pada alginat. Alginat juga membentuk kompleks yang kuat dengan polikation (Thu et al. 1996). Kompleks ini tidak dapat larut dengan kalsium pengkelat, dan dengan demikian dapat digunakan baik untuk menstabilkan gel dan untuk mengurangi porositas gel. Secara umum, pori-pori dari gel alginat terbilang besar, protein besar (Mw > 3 x 105 Da) akan berdifusi keluar dari manik-manik alginat tergantung pada ukuran molekul (Tanaka et al. 1984).
4.3. Aktifitas Biosurfaktan
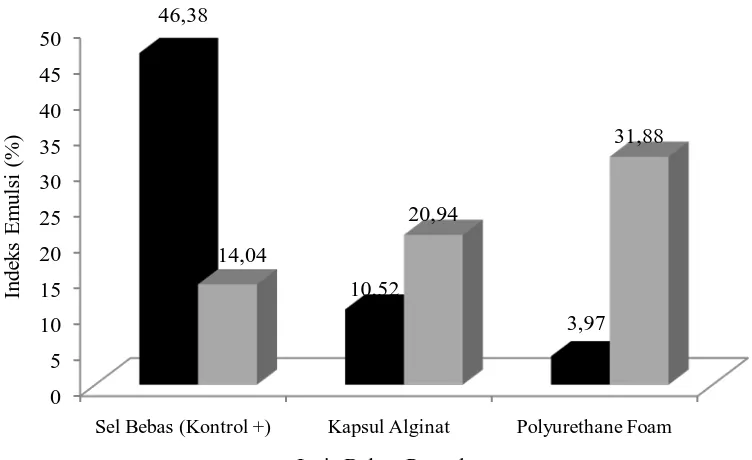
Aktifitas biosurfaktan yang ditunjukkan oleh nilai indeks emulsi antara sel bebas bakteri, bakteri yang diimobiliasi dengan alginat dan PUF memiliki perbedaan. Bakteri P. aeruginosa memiliki indeks lebih tinggi pada perlakukan dengan sel bebas, sedangkan P.aeruginosa strain M 111 memiliki indeks lebih tinggi pada perlakuan PUF. Perbedaan jenis bakteri mempengaruhi aktifitas dari biosurfaktan. Jenis bahan penyalut juga memberikan pengaruh yang berbeda pada jenis bakteri yang berbeda untuk aktifitas biosurfaktan yang dimilikinya.
Diketahui bahwa pada bakteri P. aeruginosa menghasilkan Indeks Emulsi (IE) lebih tinggi pada perlakuan sel bebas 46,38%, sedangkan pada bakteri P.
aeruginosa Strain M111 lebih tinggi pada PUF sebesar 31,88 %. IE terendah dari
bakteri P. aeruginosa yang diimobilisasi dengan PUF sebesar 3,97 %, sedangkan bakteri P. aeruginosa Strain M111 sebesar 14,04 % pada perlakuan sel bebas.
Data selengkapnya dapat dilihat pada Gambar 9.
yang dihasilkan berbeda kuantitasnya bila ditumbuhkan pada sumber nutrisi yang
berbeda (Duvnjak et al. 1983; Abouseoud et al. 2008; Jeong et al. 2004; Heyd et
al. 2011). Menurut Duvnjak et al. (1983) biosurfaktan yang dihasilkan
masing-masing mikroba berbeda bergantung pada jenis mikroba dan nutrien yang dikonsumsinya. Demikian pula untuk jenis mikroba yang sama, jumlah surfaktan yang dihasilkan berbeda berdasarkan nutrien yang dikonsumsinya.
Onwosi danOdibo (2012) melakukan penelitian mengenai produksi biosurfaktan dalam beberapa jenis sumber karbon seperti D-mannito, sukorsa, xylosa, sorbitol, raffinosa, laktosa, mannosa, maltosa, dulcita, glukosa, groundnut oil, gliserol, parafin, diesel, kerosin dan minyak kelapa, mendapatkan hasil bahwa biosurfaktan dihasilkan dalam konsentrasi tertinggi pada substrat sukrosa.
Abouseoud et al. (2008), menggunakan minyak zaitun sebagai sumber nutrisi bagi bakteri untuk menghasilkan biosurfaktan. Jeong et al. (2004)
Pseudomonas aeruginosa BYK-2diimobilisasi dengan bahan penyalut PVA dan
dioptimalkan untuk produksi berkelanjutan rhamnolipid. Heyd et al. (2011)
menggunakan Pseudomonas aeruginosa DSM 2874 terimobilisasi kapsul alginat magnetik dengan gliserol sebagai sumber karbon.
Gambar 9. Aktifitas biosurfaktan selama 15 hari masa inkubasi
0
Sel Bebas (Kontrol +) Kapsul Alginat Polyurethane Foam
46,38
4.4. Pertumbuhan Bakteri Pada Media Uji BHB + 4% Pestisida Berbahan Aktif Karbofuran
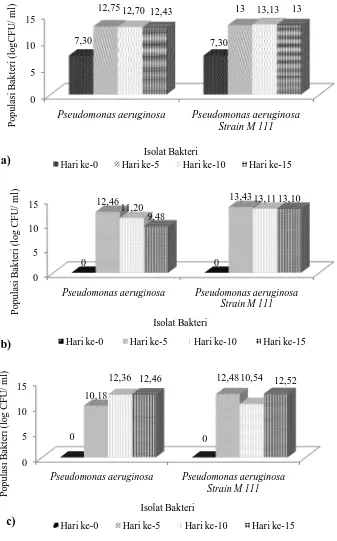
Profil pertumbuhan bakteri pada perlakuan dengan menggunakan sel bebas bakteri (kontrol +) memperlihatkan bahwa selama masa inkubasi terjadi peningkatan jumlah bakteri dengan pesat pada hari ke-5 dan cenderung menurun namun tidak meningkat dengan pesat mulai hari ke-10 hingga 15. Bila dibandingkan dengan data degradasi karbofuran yang tersaji pada Gambar 13 dapat dikatakan bahwa pertumbuhan bakteri berbanding lurus dengan konsentrasi karbofuran. Pada hari ke-5 hingga hari ke-15 terjadi penurunan konsentrasi dari karbofuran (Gambar 10).
Bakteri ditumbuhkan pada media yang hanya menye diakan karbofuran sebagai sumber nutrisinya, sehingga dapat dikatakan pada hari ke-5 hingga 10 jumlah bakteri menurun dikarenakan konsentrasi dari karbofuran juga menurun. Namun penuruna tidak terlalu signifikan, masing berkisar pada 1012 CFU/ml
untuk P. aeruginosa dan 1013
Pada perlakuan menggunakan bakteri yang terimobilisasi dengan kapsul alginat (Gambar 10b) menunjukkan data yang hampir sama, hanya saja terjadi penurunan yang cukup pesat untuk bakteri P. aeruginosa dimulai dari hari ke-5 hingga hari ke-15 masa inkubasi. Hal ini sejalan dengan data degradasi (Gambar 11) yang menunjukkan bahwa konsentrasi karbofuran sudah tidak terdeteksi pada hari ke-5, sehingga sumber nutrisi juga semakin terbatas.
CFU/ml untuk P. aeruginosa Strain M 111. Hal ini dikarenakan karbofuran tidak terdegradasi sempurna melainkan terbentuk metabolit lain yang masih dapat digunakan oleh bakteri sebagai sumber nutrisi bagi pertumbuhannya.
0 5 10 15
Pseudomonas aeruginosa Pseudomonas aeruginosa
Strain M 111
Hari ke-0 Hari ke-5 Hari ke-10 Hari ke-15 b)
0 5 10 15
Pseudomonas aeruginosa Pseudomonas aeruginosa
Strain M 111
7,30 7,30
12,7512,70 12,43 13 13,13 13
P
Hari ke-0 Hari ke-5 Hari ke-10 Hari ke-15 a)
0 5 10 15
Pseudomonas aeruginosa Pseudomonas aeruginosa
Strain M 111
Hari ke-0 Hari ke-5 Hari ke-10 Hari ke-15 c)
Gambar 10. Profil pertumbuhan bakteri Pseudomonas aeruginosa dan
Pseudomonas aeruginosa Strain M111 a) Sel bebas bakteri
4.5. Potensi Bakteri Dalam Mendegradasi Pestisida Berbahan Aktif Karbofuran
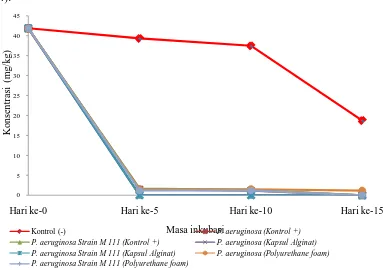
Residu karbofuran yang diamati dari perlakuan bakteri terimabilisasi dan sel bebas selama 15 hari masa inkubasi memperlihatkan bahwa, sel bebas
Pseudomonas aeruginosamemiliki kemampuan yang baik dalam mendegradasi
karbofuran (konsentrasi awal 41,86 mg/kg) dimana keberadaan carbofuran sudah tidak terdeteksi pada hari ke-15 masa inkubasi. P. aeruginosa yang diimobilisasi menggunakan alginat memperlihatkan data yang paling baik, dimana pada hari ke-5 masa inkubasi konsentrasi karbofuran sudah tidak terdeteksi. P. aeruginosa yang diimobilisasi menggunakan PUF menunjukkan data yang kurang baik, dimana hingga hari ke-15 masa inkubasi konsentrasi karbofuran terdeksi sebesar 1,17 mg/kg (kemampuan degradasi 97,60%) (Gambar 11, Lampiran 10: Halaman 54).
Bakteri Pseudomonas aeruginosa Strain M 111 memperlihatkan kemampuan yang lebih cepat dalam mendegradasi karbofuran. Konsentrasi karbofuran pada hari ke-15 sudah tidak terdeteksi dengan perlakuan menggunakan sel bebas dan imobilisasi pada PUF, sedangkan imobilisasi menggunakan kalpsul alginat pada hari ke-5 konsentrasi dari karbofuran sudah tidak terdekteksi.
Gambar 11. Residu karbofuran selama 15 hari masa inkubasi 0
Hari ke-0 Hari ke-5 Hari ke-10 Hari ke-15
K
Kemampuan kedua isolat bakteri dalam mendegradasi karbofuran tersebut
dipengaruhi oleh beberapa faktor seperti kemampuan bakteri dalam menghasilkan biosurfaktan dan enzim yang mampu mendegradasi karbofuran. Pada hasil uji aktifitas biosurfaktan didapatkan bahwa P. aeruginosa mampu menghasilkan indeks emulsi yang lebih tinggi dibandingkan dengan P. aeruginosa Strain M 111, mengindikasikan kemampuan yang baik dari biosurfaktan untuk membantu proses degradasi oleh enzim yang dihasilkan oleh bakteri.
Bakteri P. aeruginosa diketahui mampu menghasilkan biosurfaktan dari golongan glikolipid yaitu rhamnolipid. Rhamnolipid yang dihasilkan mampu membantu mempercepat proses biodegradasi senyawa-senyawa hidrokarbon yang sulit larut dalam air. Salah satunya adalah pestisida. Pestisida yang terkandung dalam media uji mampu didegradasi dengan bantuan biosurfaktan yang dihasilkam oleh bakteri. Penelitian yang dilakukan oleh Onwosi dan Odibo (2012) dan Zhang, Mulligan (2005), dan Miller (1994) membuktikan bahwa bakteri dari genus Pseudomonas mampu menghasilkan biosurfaktan dari golongan glikolipid yaitu rhamnolipid. Bakteri yang dapat menghasilkan rhamnolipid pada umumnya mampu mendegradasi senyawa-senyawa hidrokarbon, mengikat logam berat dari tanah dan dekontaminasi minyak dari tanah.
Ada dua mekanisme yang dilakukan oleh biosurfaktan dalam proses biodegradasi pestisida, yaitu dengan cara membentuk emulsi sehingga bakteri akan lebih mudah mensekresi enzim untuk proses biodegradasi, kemudian yang kedua dengan cara mengubah polaritas dari membran sel bakteri sehingga mampu
melekatkan pestisida ke membran sel yang kemudian akan menginduksi sekresi enzim dari bakteri.
Karbofuran akan masuk ke bagian dalam micelle, kemudian enzim akan melekat
ke permukaan micelle agar terjadi biodegradasi.Beberapa penelitian mengenai bakteri Pseudomonas pendegradasi pestisida berbahan aktif karbofuran telah dilakukan. Diantaranya adalah Venkateswarlu et al. (1977), bakteri pesudomonas mampu mendegradasi karbofuran dengan konsentrasi 16 ppm selama 40 hari dimana bakteri tersebut terbukti memanfaatkan karbofuran sebagai sumber karbon dan nitrogen untuk metabolisme. Pada penelitian Rajagopal et al. (1984) menunjukkan bahwa selama 30 hari bakteri mampu mendegradasi 70% dari konsentrasi awal 10 ppm pada kondisi yang sama. Beberapa penelitian menyatakan bahwa bakteri yang menghidrolisa karbofuran, mampu mendegradasi sempurna struktur cincin aromatis.
Pada bakteri yang diimobilisasi dengan alginat memperlihatkan kemampuan bakteri dalam menghasilkan biosurfaktan dan mendegradasi karbofuran paling baik dibandingkan dengan perlakuan lainnya. Hal ini dapat terjadi dikarenakan kapsul alginat memiliki kemampuan mengimobilisasi sel dalam jumlah yang besar, porositas dan kemampuan difusi yang baik sehingga komunikasi antara satu sel bakteri dengan bakteri baik, menciptakan jumlah yang cukup untuk mencapai quorum dan menghasilkan biosurfaktan maupun enzim yang digunakan untuk memperoleh sumber nutrisi bagi pertumbuhan dan metabolisme sel bakteri. Menurut Wei dan Luyan (2013), apabila P. aeruginosa telah mencapai jumlah yang sesuai (quorum) maka sel bakteri tersebut mampu menghasilkan metabolit berupa enzim, biosurfaktan dan resistensi antibiotik.
Ada dua jalur pendegradasian karbofuran pada rantai N-metil karbamatnya
mendegradasi karbofuran, tetapi tidak mendegradasi cincin arimatik (Trabue et al.
2001).
Selain Pseudomonas ada beberapa bakteri yang telah diteliti kemampuannya dalam mendegradasi karbofuran, dimana mekanisme dalam biodegradasi tersebut hampir sama dengan yang dimiliki oleh Pseudomonas. Feng
et al. (1997) melaporkan bahwa starin CF06 dari genus Sphinomonas mampu
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari penelitian ini didapatkan kesimpulan sebagai berikut:
a. Kapusl alginat memiliki efektifitas imobilisasi lebih tinggi dibandingka n
dengan Polyurethane Foam.
b. Bakteri Pseudomonas aeruginosa dan Pseudomonas aeruginosa Straint M111
yang diimobilisasi memiliki kemampuan degradasi pestisida yang lebih baik dibandingkan sel bebas.
c. Bahan penyalut yang lebih baik digunakan untuk menjaga viabilitas bakteri
pada proses pengujian degradasi karbofuran adalah Polyurethane Foam (PUF). Bakteri yang diimobilisasi dengan PUF mampu bertahan selama 15 hari inkubasi, sedangkan kapsul alginat cenderung lebih cepat mengalami peleburan.
d. Bahan penyalut yang lebih baik digunakan untuk mendegradasi karbofuran adalah alginat dimana selama 5 hari masa inkubasi karbofuran telah terdegrdasi seluruhnya., sedangkan bakteri pada PUF mampu mendegradasi sempurna selama 15 hari masa inkubasi.
5.2. Saran