TAHAP-TAHAP PEKERJAAN
ANALISIS KIMIA
.
• Langkah langkah pokok metoda ilmiah • Menetapkan masalah
• Melakukan kajian teoritik dan menarik hipotesa
• Melakukan eksperimen atau observasi • Mengolah data hasil observasi
• Menarik kesimpulan
• Masalah merupakan problema spesifik yang dicari jawabannya.
• Sumber masalah dalam kimia analisis adalah sampel atau cuplikan.
• Kajian teoritik sebelum melakukan analisis diperlukan untuk memberikan landasan berfikir yang benar.
• Melalui kajian teoritik dibuat hipotesis.
• Observasi merupakan inti dari kimia analisis untuk mengungkap kebenaran ilmiah.
• Hasil observasi adalah data
• Berdasarkan pengolahan data ditarik kesimpulan. Kesimpulan merupakan jawaban ilmiah atas masalah.
Uraian Materi :
1. Tahapan untuk Analisis Kuantitatif
2. Kesalahan dalam Analisis Kimia
TAHAP-TAHAP PEKERJAAN ANALISIS
KIMIA
1. Tahapan untuk Analisis Kuantitatif
• Sampling
• Preparasi Sampel • Pengukuran
• Perhitungan dan Interpretasi data
. .
A. SAMPLING
Adalah suatu prosespengambilan cuplikan/zat yan akan diteliti.
Cuplikan yang dianalisis harus bersifat
representatif, yakni dapat mewakili
keseluruhan materi yang akan dianalisis.
Teknik Sampling
• Obyek analisis tidak mungkin secarakeseluruhan dianalisis di laboratorium.
• Dari obyek analisis diambil sejumlah tertentu yang representatif untuk dikumpulkan
menjadi sampel lapangan.
• Teknik sampling adalah cara pengambilan sampel, contoh atau cuplikan dari bahan ruah/lapangan yang menjadi obyek analisis
• Pengambilan sampel lapangan
• Pengurangan jumlah dan ukuran sampel lapangan menjadi sampel laboratorium
• Pengurangan sampel laboratorium menjadi sampel analitik
• Penyimpanan sampel analitik
SAMPLING
Syarat: Cuplikan harus representatif
Contoh: Sampel induk
Sampel primer
A
B
C
1 4 3 2 2 + 3 1 + 4 d c b a a b c d Sampel bulkSampel sub bulk
Contoh sampling :
1. Untuk menganalisis kandungan logam berat dalam air sungai yang mengalir, pengambilan cuplikan dilakukan di beberapa titik pada setiap jarak 100 meter. Selain itu kedalaman, jarak dari pinggir, dan lingkungan sekitar sungai harus diperhatikan.
2. Jika berbentuk padatan, cuplikan harus dihomogenkan dengan cara digerus atau digiling, kemudian diayak menggunakan ayakan dengan mesh (ukuran) tertentu. Untuk memperkecil jumlah, cuplikan dikumpulkan dalam bentuk kerucut, lalu diratakan dan dibagi empat bagian. Dua bagian yang berseberangan akan digunakan sebagai cuplikan.
B. PREPARASI SAMPEL PADAT
1. Cara basah
• Pelarutan langsung dengan air (zat padat dilarutkan
dalam air larutan )
• Pelarutan dengan asam, seperti HNO3, H2SO4, HCl, HClO4, atau campurannya.
• Destruksi dengan air raja HNO3 p : HCl p = 1 : 3.
Terdapat 2 cara, yaitu: 1. Cara basah
2. Cara kering
Diabukan dalam furnace pada suhu tertentu. Jika
diperlukan + “ashing aid”. Abu dilarutkan dalam asam, kemudian diencerkan secara kuantitatif.
Menghilangkan Adanya Interferensi
Contoh 1
:
Al 3+ maupun ion Fe3+ sama-sama membentuk kompleks berwarna
merah dengan aluminon, sedangkan Fe2+ tidak.
Apa yang harus dilakukan jika suatu sampel hanya akan diukur konsentrasi Al3+nya ???
Contoh 2
:
Ion Mg2+ dan Fe3+ dapat mengendap dengan oksalat (pada proses
gravimetri). Pada pH 6,5 ion besi dapat mengendap sebagai hidroksidanya, sedangkan ion magnesium tidak.
Apa yang harus dilakukan jika suatu sampel hanya akan diukur konsentrasi Mg2+???
C. PENGUKURAN
.
Metode Pengukuran untuk analisis kuantitatif Contoh:
• Metode Konvensional : Volumetri dan Gravimetri • Metode fisiko-kimia modern : - Elektrokimia
• D. perhitungan dan interpretasi Data Data hasil pengukuran diolah
sedemikian rupa, ditafsirkan dengan cara-cara analitik, dan dinyatakan
sedemikian, sehingga dapat dipahami artinya.
Tafsiran dari data yang diperoleh tidak selalu mudah dan sederhana, karena pada setiap pekerjaan analisis selalu terjadi kesalahan-kesalahan
Perhitungan Statistik untuk membantu dalam pengambilan
kesimpulan/Keputusan
2. KESALAHAN DALAM ANALISIS KIMIA
Kesalahan tak tentu/ Indeterminat Error Sumber penyebab Kesalahan tak dapat
ditentukan secara pasti. Contoh:
- Kebisingan & penyimpangan dalam rangkaian elektronika
- Getaran dalam suatu gedung
Kesalahan tertentu/ Determinant Error/ Kesalahan sistematik
- Kesalahan Metode/ Cara Analisis : Umumnya bersumber dari adanya zat lain yang
mempengaruhi hasil pengukuran. Hasil
pengukuran bisa menjadi lebih besar atau lebih kecil dari yang seharusnya
- Kesalahan Operasional: Umumnya terjadi karena keterbatasan kemampuan
analis/operator
- Kesalahan Instrumental: Ketidakmampuan alat ukur untuk bekerja sesuai standar yang
Perumusan Kesalahan Relatif
Biasanya dinyatakan dengan:
Hasil sebenarnya – Hasil pengamatan
% Kesalahan = x 100% Hasil sebenarnya
STATISTIKA SEDERHANA UNTUK ANALISIS KIMIA
1. Mean (harga rata-rata, x ), merupakan ukuran kecenderungan sentral.
x1 + x2 + x3 + ... + xn
X =
n
2. Simpangan baku (S), merupakan ukuran variabilitas hasil analisis
( x – x )2 S = n – 1 JK S = n - 1
3. Relative Standard Deviation (R.S.D) s R.S.D = x 4. Coefficient of Variation (C.V.) s x 100 C.V. = x Contoh :
Analisis terhadap bijih besi menghasilkan ukuran persen massa besi: 7,08 ; 7,21 ; 7,12 ; 7,09 ; 7,16 ; 7,14 ; 7,07 ; 7,14 ; 7,18 ; 7,11.
Hitung rata-rata, Simpangan baku, dan koefisien variasi!
Jawab :
5. Batas Kepercayaan, merupakan daerah di sekitar harga yang sesungguhnya
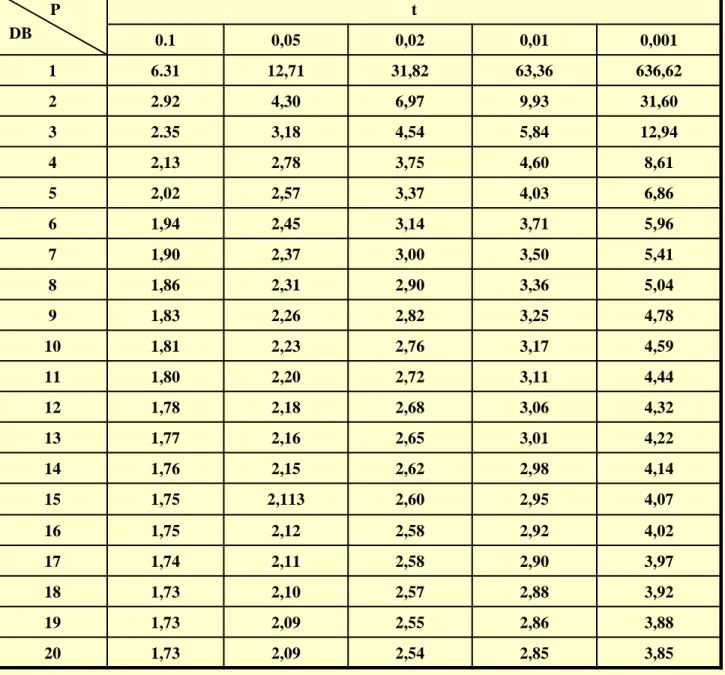
Nilai t diperoleh dari Tabel t pada derajat kebebasan (D.B.) = n - 1
Contoh:
Hasil analisis massa nikel (mg) yang terkandung dalam 1 g suatu bahan galian adalah : 5,0 ; 5,3 ; 5,7 ; 4,8 ; 5,2
Hitung batas kepercayaan pada tingkat kepercayaan 95% Jawab:
x = 5,2 ; s = 0,3 ; sx = 0,134
Maka = 5,20 + 0,37. Jadi 95% dipercaya bahwa massa nikel berada pada range : 4,83 – 5,57. x x x t S S S n S x t n
Tabel untuk t
dengan tingkat kepercayaan 90% - 99% P DB t 0.1 0,05 0,02 0,01 0,001 1 6.31 12,71 31,82 63,36 636,62 2 2.92 4,30 6,97 9,93 31,60 3 2.35 3,18 4,54 5,84 12,94 4 2,13 2,78 3,75 4,60 8,61 5 2,02 2,57 3,37 4,03 6,86 6 1,94 2,45 3,14 3,71 5,96 7 1,90 2,37 3,00 3,50 5,41 8 1,86 2,31 2,90 3,36 5,04 9 1,83 2,26 2,82 3,25 4,78 10 1,81 2,23 2,76 3,17 4,59 11 1,80 2,20 2,72 3,11 4,44 12 1,78 2,18 2,68 3,06 4,32 13 1,77 2,16 2,65 3,01 4,22 14 1,76 2,15 2,62 2,98 4,14 15 1,75 2,113 2,60 2,95 4,07 16 1,75 2,12 2,58 2,92 4,02 17 1,74 2,11 2,58 2,90 3,97 18 1,73 2,10 2,57 2,88 3,92 19 1,73 2,09 2,55 2,86 3,88 20 1,73 2,09 2,54 2,85 3,85
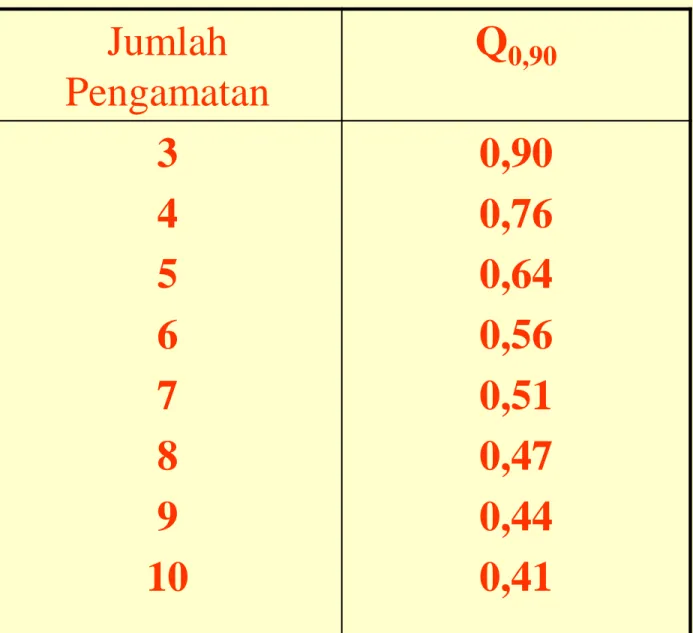
6. Ukuran Penolakan data Hasil Pengamatan (Uji Q)
Digunakan untuk menguji adanya data yang meragukan/
mencurigakan, apakah data tersebut perlu dibuang atau tidak.
xc = data yang mencurigakan
Q = Xc - Xd xd = data terdekat
Xb - Xk xb = data terbesar
xk = data terkecil
Apabila Q hitung > Qtabel , artinya data yang mencurigakan berada di luar
range, sehingga harus dibuang.
Tabel Nilai Kuesien Penolakan, Q Jumlah Pengamatan Q0,90 3 4 5 6 7 8 9 10 0,90 0,76 0,64 0,56 0,51 0,47 0,44 0,41
.
• Contoh• Hasil penentuan kadmium dalam sampel debu adalah ;
• 4,3 ;4,1 ; 4,0 dan 3,2 mikrogram/gram. • A pakah data 3,2 dibuang
Contoh Uji Q :
Dari hasil analisis diperoleh normalitas suatu larutan:
0,1014;0,1012;0,1016;0,1019. Data yang dicurigai :
0,1019.
Tentukan apakah data terakhir perlu dibuang atau tidak!
0,1019 0,1016
0, 43 0,1019 0,1012
Q
Dari tabel, harga Q untuk n=4 adalah 0,76
Karena Qhitung(0,43)<Qtabel(0,76), maka data tersebut tidak perlu dibuang.
7. Membandingkan dua set data a. Uji F
Untuk menguji presisi dari dua metode yang dibandingkan, apakah berbeda atau tidak
Jika Fhitung < Ftabel , berarti dapat diperbandingkan
b.Uji t
Untuk menguji rata-rata dari dua metode yang dibandingkan, apakah berbeda atau tidak
x1 - x2 (n1-1)s12 + (n
2-1)s22
t = sp =
sp 1/n1 + 1/n2 n1 + n2 – 2
Jika thitung > ttabel , berarti berbeda secara signifikan
Ket : SI2 = Nilai Varians Terbesar
SII2= Nilai Varians terkecil
2 2 ( ) ( ) I II S terbesar F S terkecil
Nilai angka banding variansi F
DB1= der. bebas variansi terbesar ; DB2= der. bebas variansi terkecil P=0,05
DB1 DB2 1 2 3 4 5 6 7 8 9 10 1 161,4 199,7 215,6 224,6 230,2 234,0 236,8 238,9 240,5 241,9 2 18,51 19,0 19,16 19.25 19,50 19,33 19,35 19,37 19,38 19,40 3 10,13 9,55 9,28 9,12 9,01 8,94 8,89 8,85 8,81 8,79 4 7,71 6,94 6,59 6,39 6,26 6,16 6,09 6,04 6,00 5,96 5 6.61 5,79 5,41 5,19 5,05 4,95 4,88 4,82 4,77 4,74 6 5,99 5,14 4,76 4,53 4,29 4,28 4,21 4,15 4,10 4,06 7 5,59 4,74 4,35 4,12 3,97 3,87 3,79 3,73 3,68 3,64 8 5,32 4,46 4,07 3,84 3,69 3,58 3,50 3,44 3,39 3,35 9 5,12 4,26 3,86 3,63 3,48 3,37 3,29 3,23 3,18 3,14 10 4,96 4,10 3,71 3,48 3,33 3,22 3,14 3,07 3,02 2,98 11 4,84 3,98 3,59 3,36 3,20 3,09 3,01 2,95 2,90 2,85 12 4,75 3,89 3,49 3,26 3,11 3,00 2,91 2,85 2,80 2,75 13 4,67 3,81 3,41 3,18 3,03 2,92 2,83 2,77 2,71 2,67 14 4,60 3,74 3,34 3,11 2,96 2,85 2,76 2,70 2,65 2,60 15 4,54 3,68 3,29 3,06 2,90 2,79 2,71 2,64 2,51 2,54 16 4,49 3,63 3,24 3,01 2,85 2,74 2,66 2,59 2,54 2,49 17 4,45 3,59 3,20 2,96 2,81 2,70 2,61 2,55 2,49 2,45 18 4,41 3,55 3,16 2,93 2,77 2,66 2,58 2,51 2,56 2,41 19 4,38 3,52 3,13 2,90 2,74 2,63 2,54 2,48 2,42 2,38 20 4,35 3,49 3,10 2,87 2,71 2,60 2,51 2,45 2,39 2,35
Nilai angka banding variansi F
DB1= derajat bebas variansi terbesar ; DB2= derajat bebas variansi terkecil P=0,01 DB1 DB2 1 2 3 4 5 6 7 8 9 10 1 4052 5000 5403 5625 5764 5859 5928 5982 6022 6056 2 98,50 99,00 99,17 99,25 99,30 99,33 99,36 99,37 99,39 99,40 3 34,12 30,82 29,46 28,71 28,24 27,91 27,67 27,49 27,35 27,23 4 21,20 18,00 16,69 15,98 15,52 15,21 14,98 14,80 14,66 14,55 5 16,26 13,27 12,06 11,39 10,97 10,46 10,46 10,29 10,16 10,05 6 13,75 10,92 9,78 9,15 8,75 8,47 8,26 8,10 7,98 7,87 7 12,25 9,55 8,45 7,85 7,46 7,19 6,99 6,84 6,72 6,62 8 11,26 8,65 7,59 7,01 6,63 6,37 6,18 6,03 5,91 5,81 9 10,56 8,02 6,99 6,42 6,06 5,80 5,61 5,47 5,35 5,26 10 10,04 7,56 6,55 5,99 4,64 5,39 5,20 5,06 4,94 4,85 11 9,65 7,21 6,22 5,67 5,32 5,07 4,89 4,74 4,63 4,54 12 9,33 6,93 5,95 5,41 5,06 4,82 4,64 4,50 4,39 4,30 13 9,07 6,70 5,74 5,21 4,86 4,62 4,44 4,30 4,19 4,10 14 8,86 6,51 5,56 5,04 4,69 4,46 4,28 4,14 4,03 3,94 15 8,68 6,36 5,42 4,89 4,56 4,32 4,14 4,00 3,89 3,80 16 8,53 6,23 5,29 4,77 4,44 4,20 4,03 3,89 3,78 3,69 17 8,40 6,11 5,18 4,67 4,34 4,10 3,93 3,79 3,68 3,59 18 8,29 6,01 5,09 4,58 4,25 4,01 3,84 3,71 3,60 3,51 19 8,18 5,93 5,01 4,50 4,17 3,94 3,77 3,63 3,52 3,43 20 8,10 5,85 4,94 4,43 4,10 3,87 3,70 3,56 3,46 3,37
Contoh :
Hasil pengukuran dua metode adalah sbb:
Bandingkan presisi dan rata-rata kedua metode!
Metode baru (1) Metode Standar (2)
Rata-rata 7,85% 8,03% Simpangan baku 0,130% 0,095% Jumlah sampel 5 6 Jawab: 0,132 F = = 1,87 0,0952 (5-1) x 0,0169 + (6-1) x 0,0090 7,85 – 8,03 Sp = = 0,112 ; t = = 2,66 9 0,112 1/5+1/6
Harga F tabel pada p = 5% untuk derajat kebebasan 4 dan 5 adalah 5,19. Jadi Fhitung< Ftabel, artinya Kedua harga presisi dapat diperbandingkan.
Harga t berdasarkan tabel pada derajat kebebasan 9 dan tingkat
kepercayaan 95% adalah 2,26. Jadi t hitung > t tabel , artinya kedua rata-rata berbeda secara signifikan.
8. Presisi (kecermatan)
Kemiripan ukuran dalam satu set data, ditunjukkan dengan harga simpang baku
9. Akurasi (ketepatan)
Ukuran kedekatan nilai hasil percobaan (xi) atau rata-rata ( x ) ke nilai yang sebenarnya ( )
Kesalahan absolut = xi - atau x
-Kesalahan absolut Kesalahan Relatif =
Ketepatan dan Kecermatan
Ketepatan: besar atau kecilnya penyimpangan yang
diberikan oleh hasil pengukuran dibandingkan dengan nilai sebenarnya.
Kecermatan: menyangkut keberulangan hasil pengukuran yang dapat pula dinyatakan oleh besar kecilnya
simpangan baku. .
Contoh:
Hitung kesalahan absolut, persen kesalahan dan kesalahan ‘parts per
thousand” untuk rata-rata dari data set berikut:
Xi (mg) = 8,33 ; 8,29 ; 8,28 ; 8,34 ; 8,36 = 8,27 mg Jawab : X = 8,32 mg Kesalahan absolut = 8,32 – 8,27 = 0,05 mg kesalahan absolut 0,05 % kesalahan = x 100 = x 100 = 0,6 8,27 0,05 Kesalahan ppt = x 1000 = 6 8,27
x x xx x xx xx x X X X X X X X X X X A B C D Keterangan:
A : Presisi baik, akurasi baik
B : Presisi baik, akurasi tidak baik
C : Presisi tidak baik, akurasi baik (rata-rata) D : Presisi tidak baik, akurasi tidak baik
1. Normalitas suatu larutan ditentukan
dengan empat kali titrasi. Hasilnya adalah 0,2041 ; 0,2039 ; 0,2049 dan 0,2043.
Hitunglah harga rata-rata, standar deviasi dan koefisien variasinya.
2. Seorang ahli Kimia menetapkan persentase besi dalam suatu bijih. Hasil yang diperoleh adalah sbb :
ẋ = 15,30s = 0,10 n = 4
3. Tetapkan batas ketangguhan 95% dan
99% untuk dari data berikut :
x = 38,3 ; Sx = 2,9 ; n = 10
4. Analisis A melaporkan persentase besi dalam suatu sample sbb :
16,65 ; 16,70 ; 16,68 ; 16,60 ; dan 16,63 Hitunglah : nilai rata-rata, standar deviasi dan koefisien variasi.
Apabila nilai persentase besi tersebut
adalah 16,55%, Hitunglah kesalahan mutlak dan kesalahan relatif .
6. Mahasiswa M,N,O,P melaporkan hasil analisanya seperti gambar di bawah ini
• 7. seorang teknisi memperoleh hasil untuk konsentrasi (mg/dL) kolesterol dalam darah sebagai berikut :
• 240 ; 265 ; 230 ; 238 ;244
a. adakah sesuatu hasil yang dapat ditolak oleh uji Q.
b. Berapa nilai yang harus dilaporkan sebagai konsentrasi.