KAJIAN PEMBERIAN SINBIOTIK DENGAN FREKUENSI
BERBEDA UNTUK PENCEGAHAN KO-INFEKSI
INFECTIOUS MYONECROSIS VIRUS DAN VIBRIO HARVEYI
PADA UDANG VANAME (LITOPENAEUS VANNAMEI)
ADNI OKTAVIANA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Kajian Pemberian Sinbiotik dengan Frekuensi Berbeda Untuk Pencegahan Ko-Infeksi Infectious Myonecrosis Virus dan Vibrio harveyi pada Udang Vaname (Litopenaeus vannamei) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2014
Adni Oktaviana NRP C151110061
* Pelimpahan hak cipta atas karya tulis dari penelitian kerja sama dengan pihak luar IPB harus didasarkan pada perjanjian kerja sama yang terkait
RINGKASAN
ADNI OKTAVIANA. Kajian pemberian sinbiotik dengan frekuensi berbeda untuk pencegahan ko-infeksi Infectious Myonecrosis Virus dan Vibrio harveyi pada udang vaname Litopenaeus vannamei. Dibimbing oleh WIDANARNI dan MUNTI YUHANA.
Salah satu kendala budidaya udang secara intensif adalah serangan penyakit. Serangan penyakit yang sering menyerang adalah penyakit bakterial, viral dan infeksi bersama bakteri dan virus (ko-infeksi). Ko-infeksi dapat mempercepat dan meningkatkan mortalitas. Aplikasi sinbiotik dapat menjadi salah satu alternatif yang dapat digunakan untuk menekan serangan penyakit, karena mampu meningkatkan respon imun dan resistensi udang terhadap serangan penyakit. Penelitian ini bertujuan untuk mengkaji pemberian sinbiotik dengan frekuensi berbeda untuk pencegahan ko-infeksi IMNV dan V. harveyi. Frekuensi yang digunakan yaitu pemberian sinbiotik setiap hari, tiga hari sekali dan tujuh hari sekali. Sinbiotik yang digunakan pada penelitian ini adalah gabungan dari probiotik SKT-b dan prebiotik oligosakarida yang diekstraksi dari tepung ubi jalar varietas sukuh (Ipomoea batatas L). Penelitian ini terdiri dari beberapa tahap yaitu persiapan prebiotik (pembuatan tepung ubi jalar, ekstraksi oligosakarida dengan etanol 70%, penghitungan total padatan terlarut serta analisa kandungan oligosakarida dengan HPLC), persiapan probiotik, persiapan stok virus IMNV dan persiapan V. harveyi, pengujian sinbiotik 1 dosis (1% probiotik dengan 2% prebiotik) secara in vivo selama 30 hari dan uji tantang. Pengujian performa pertumbuhan pada akhir perlakuan sinbiotik dilakukan dengan mengukur laju pertumbuhan harian dan rasio konversi pakan. Jumlah bakteri pada usus udang meliputi total bakteri, jumlah bakteri Vibrio dan total bakteri SKT-bR dihitung pada akhir perlakuan sinbiotik. Pengukuran respon imun dilakukan sebelum dan setelah uji tantang meliputi pengukuran total hemosit, diferensial hemosit (total sel hialin dan sel granular), aktivitas phenoloxidase serta aktivitas respiratory burst. Pengujian resistensi udang terhadap ko-infeksi dilakukan dengan penyuntikan IMNV dan V. harveyi dengan mengamati sintasan yang dilakukan selama tujuh hari. Konfirmasi udang yang terinfeksi untuk memastikan virus dan bakteri yang menginfeksi, dilakukan dengan uji PCR (IMNV) dan metode gores kuadran pada media TCBS-Rif (V. harveyi).
Hasil ekstrak oligosakarida dengan TPT 5% yang digunakan pada penelitian ini mengandung inulin sebesar 1,115%; FOS sebesar 1,015% serta GOS sebesar 1,488%. Pemberian pakan dengan penambahan sinbiotik selama 30 hari telah meningkatkan jumlah bakteri dalam usus udang (total bakteri, total bakteri Vibrio dan total bakteri SKT-bR) yang dapat menyebabkan peningkatan kinerja pertumbuhan (LPH dan FCR) serta resistensi udang terhadap ko-infeksi IMNV dan V. harveyi. Perlakuan sinbiotik yang diberikan dapat meningkatkan nilai THC dan aktivitas PO secara signifikan dibandingkan dengan kedua kontrol (sebelum uji tantang). Secara umum, perlakuan sinbiotik setiap hari menunjukan respon yang lebih baik terhadap peningkatan resistensi terhadap ko-infeksi IMNV dan V. harveyi serta performa pertumbuhan udang vaname. Pemberian pakan dengan penambahan sinbiotik setiap hari memberikan hasil terbaik pada performa pertumbuhan dengan LPH sebesar 8,12±0,12%/hr dan FCR sebesar 1,11±0,08,
serta respon imun terutama pada parameter jumlah hemosit (THC) sebesar 6,40x106±0,85 sel/ml dan aktivitas phenoloxidase (PO) sebesar 1,07±0,15. Selain itu, penambahan sinbiotik setiap hari juga menghasilkan resistensi terbaik terhadap ko-infeksi IMNV dan V. harveyi, dengan nilai sintasan sebesar 93,33±5,77% dibandingkan kontrol positif sebesar 46,67±11,57%.
SUMMARY
ADNI OKTAVIANA. The frequency effect of synbiotic supplementation diet to control the co-infection disease of Infectious Myonecrosis Virus and Vibrio harveyi. Supervised by WIDANARNI and MUNTI YUHANA.
One of the obstacles in intensive shrimp culture is the high frequency of disease. The diseases that most often attack are bacterial, viral and infection by bacterial and viral at the same time (co-infection). Co-infection disease can accelerate and increase mortality. One of the alternative to prevent the diseases is synbiotics, because synbiotics could increase the shrimp immune response and resistance to diseases. This study aimed to evaluated the frequency effect of synbiotic supplementation diet to control the co-infection disease of IMNV and V. harveyi. The frequencies applied in this study were daily, once in three days and once a week supplementation. The synbiotics used in this study is the combination between the probiotics SKT-b and prebiotic is the derivate of oligosaccharide from sweet potato starch (Ipomoea batatas L). Several stages of this study consisted of prebiotic preparation (making the sweet potato starch, oligosaccharide extraction with ethanol 70%, the determination of total dissolved solid and oligosaccharide test with HPLC), probiotic preparation, IMNV stock preparation and V. harveyi preparation, 1 dosage synbiotics (1% probiotic with 2 % prebiotic) in vivo test during 30 days and challenged test. The growth performance were the daily growth rate and feed conversion ratio. The number of bacteria in shrimp intestine observed at the end of synbiotics treatment consisted of the total viable bacterial count, presumptive vibrio counts and the presumptive SKT-bR counts. Immune responses observed before and after challenge test were total hemocyte count, the numbers of hemocytes (hyaline cells and granular cells), phenoloxidase activity and respiratory burst activity. Shrimp resistance observed was the shrimp survival against co-infection by IMNV and V. harveyi for seven days. PCR test using Nugen IMNV diagnostic kits for IMNV confirmation and streak plate method on TCBS containing rif media for V. harveyi confirmation.
The result of oligosaccharide extraction with 5% TPT used in this study consist of 1,115% inulin; 1,015% FOS and 1,488% GOS. Supplementation of synbiotics diet during 30 days were increase the number of bacteria in shrimp intestine and improve growth performance (LPH and FCR) and shrimp resistance against co-infestion IMNV and V. harveyi. Synbiotics treatment significantly increase THC value and PO activity than controls (before challenge test). Generally, daily supplementation of synbiotics showed better resistance against co-infection IMNV and V. harveyi and better growth performance than control. Daily supplementation of synbiotics given the best result in LPH was 8,12±0,12% and FCR was 1,11±0,08. Total hemocyte count value was 6,40x106±0,85 cell/ml and phenoloxidase was 1,07±0,15. Moreover, daily supplementation of synbiotics given the best shrimp resistance against co-infection by IMNV and V. harveyi with the survival value was 93,33±5,77% compared with positive control was 46,67±11,57%.
Keywords : Co-infection, IMNV, Litopenaeus vannamei, Synbiotic, Vibrio harveyi
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam bentuk apa pun tanpa izin IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
KAJIAN PEMBERIAN SINBIOTIK DENGAN FREKUENSI
BERBEDA UNTUK PENCEGAHAN KO-INFEKSI
INFECTIOUS MYONECROSIS VIRUS DAN VIBRIO HARVEYI
PADA UDANG VANAME (LITOPENAEUS VANNAMEI)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Kajian Pemberian Sinbiotik dengan Frekuensi Berbeda untuk Pencegahan Ko-infeksi Infectious Myonecrosis Virus dan Vibrio harveyi pada Udang Vaname (Litopenaeus vannamei)
Nama : Adni Oktaviana NIM : C151110061
Disetujui oleh Komisi Pembimbing
Dr Ir Widanarni, MSi Ketua
Dr Munti Yuhana, SPi MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah yang berjudul “Kajian Pemberian Sinbiotik dengan Frekuensi Berbeda untuk Pencegahan Ko-infeksi Infectious Myonecrosis Virus dan Vibrio harveyi pada Udang Vaname (Litopenaeus vannamei)” berhasil diselesaikan. Penelitian ini dilakukan dari bulan April sampai Agustus 2013 bertempat di Laboratorium Kesehatan Ikan Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor dan Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Widanarni, MSi dan Ibu Dr Munti Yuhana, SPi, MSi selaku pembimbing yang telah banyak memberi saran. Dr Dinamella Wahjuningrum, SSi, MSi selaku penguji atas bimbingan dan saran yang diberikan. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya. Penulis sampaikan pula terima kasih dan penghargaan kepada teknisi laboratorium, teman-teman mahasiswa Program Studi Ilmu Akuakultur IPB khususnya angkatan 2011, serta semua pihak yang telah membantu secara langsung maupun tidak langsung.
Akhir kata, penulis berharap semoga karya ilmiah ini dapat bermanfaat. Penulis menyadari hasil penelitian dalam karya ilmiah ini bukanlah sebuah kebenaran mutlak karena sangat mungkin berubah seiring berkembangnya ilmu pengetahuan.
Bogor, Februari 2014
DAFTAR ISI
DAFTAR TABEL iv DAFTAR GAMBAR iv DAFTAR LAMPIRAN vi 1 PENDAHULUAN 1 Latar Belakang 1 Tujuan Penelitian 2 Manfaat Penelitian 2 Hipotesis 2 2 TINJAUAN PUSTAKA 2 Sinbiotik 2Infectious Myonecrosis Virus (IMNV) 4
Vibrio harveyi 5
Ko-infeksi 6
Sistem Imun pada Udang 6
3 METODE PENELITIAN 8
Persiapan Prebiotik 8
Analisis Kandungan Oligosakarida 9
Persiapan Probiotik 9
Persiapan Stok Virus IMNV 10
Persiapan Vibrio harveyi 10
Pengujian Sinbiotik secara In Vivo 10
Uji Tantang 11
Penghitungan Populasi Bakteri di Usus 12
Parameter Pertumbuhan 12
Parameter Respon Imun 13
Sintasan 14
Pengujian Udang Terinfeksi IMNV dan V. harveyi 14
Analisis Data 15
4 HASIL DAN PEMBAHASAN 15
Oligosakarida Ubi Jalar Varietas Sukuh 15 Penghitungan Populasi Bakteri di Usus Udang 16
Kinerja Pertumbuhan 17
Respon Imun 19
Sintasan 23
SIMPULAN DAN SARAN 26 Simpulan 26 Saran 26 DAFTAR PUSTAKA 26 LAMPIRAN 31 RIWAYAT HIDUP 47
DAFTAR TABEL
1 Jenis dan Konsentrasi Gula Tepung Ubi Jalar Varietas Sukuh yang Diidentifikasi dengan HPLC (High Performance Liquid
Chromatograph) 4
2 Perlakuan Pemberian Sinbiotik dengan Frekuensi Berbeda dan Uji
Tantang dengan Ko-infeksi IMNV dan V. harveyi 11 3 Hasil Analisis Oligosakarida Ubi Jalar Varietas Sukuh dengan
HPLC 15
4 Jumlah Bakteri di Usus Udang Uji (L. vannamei) 16
DAFTAR GAMBAR
1 IMNV. Virion IMNV (a); Subadult Udang Vaname yang Terinfeksi IMNV (b); dan Organ Limfoid yang Terinfeksi IMNV
(d) (Poulos et al. 2006) 5
2 Klasifikasi Hemosit: Hialin (a); Semi Granular (b); dan Granular
(c) (Martines 2007) 7
3 Mekanisme Pertahanan Tubuh Nonspesifik pada Krustasea (Smith
et al. 2003) 7
4 Tahapan Pembuatan Ubi Jalar 8
5 Laju pertumbuhan harian udang selama 30 hari pemberian sinbiotik. Data (mean±SE) dengan huruf berbeda menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3:
pemberian sinbiotik tujuh hari sekali 17 6 Rasio konversi pakan (FCR) selama 30 hari pemberian sinbiotik.
Data (mean±SE) dengan huruf berbeda menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3: pemberian sinbiotik
tujuh hari sekali 18
7 Hemosit total (THC) udang (L. vannamei) sebelum uji tantang (akhir perlakuan sinbiotik) dan setelah uji tantang. Data (mean±SE) dengan huruf berbeda pada pola yang sama menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari
8 Sel hialin total udang (L. vannamei) sebelum uji tantang (akhir perlakuan sinbiotik) dan setelah uji tantang. Data (mean±SE) dengan huruf berbeda pada pola yang sama menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3: pemberian sinbiotik
tujuh hari sekali 20
9 Sel granular total udang (L. vannamei) sebelum uji tantang (akhir perlakuan sinbiotik) dan setelah uji tantang. Data (mean±SE) dengan huruf berbeda pada pola yang sama menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3: pemberian sinbiotik
tujuh hari sekali 21
10 Aktivitas phenoloxidase (PO) udang (L. vannamei) sebelum uji tantang (akhir perlakuan sinbiotik) dan setelah uji tantang. Data (mean±SE) dengan huruf berbeda pada pola yang sama menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari
sekali; P3: pemberian sinbiotik tujuh hari sekali 22 11 Aktivitas respiratory burst (RB) udang (L. vannamei) sebelum uji
tantang (akhir perlakuan sinbiotik) dan setelah uji tantang. Data (mean±SE) dengan huruf berbeda pada pola yang sama menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari
sekali; P3: pemberian sinbiotik tujuh hari sekali 23 12 Sintasan udang (L. vannamei) sebelum uji tantang (akhir
perlakuan sinbiotik) dan setelah uji tantang. Data (mean±SE) dengan huruf berbeda pada pola yang sama menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3: pemberian sinbiotik
tujuh hari sekali 24
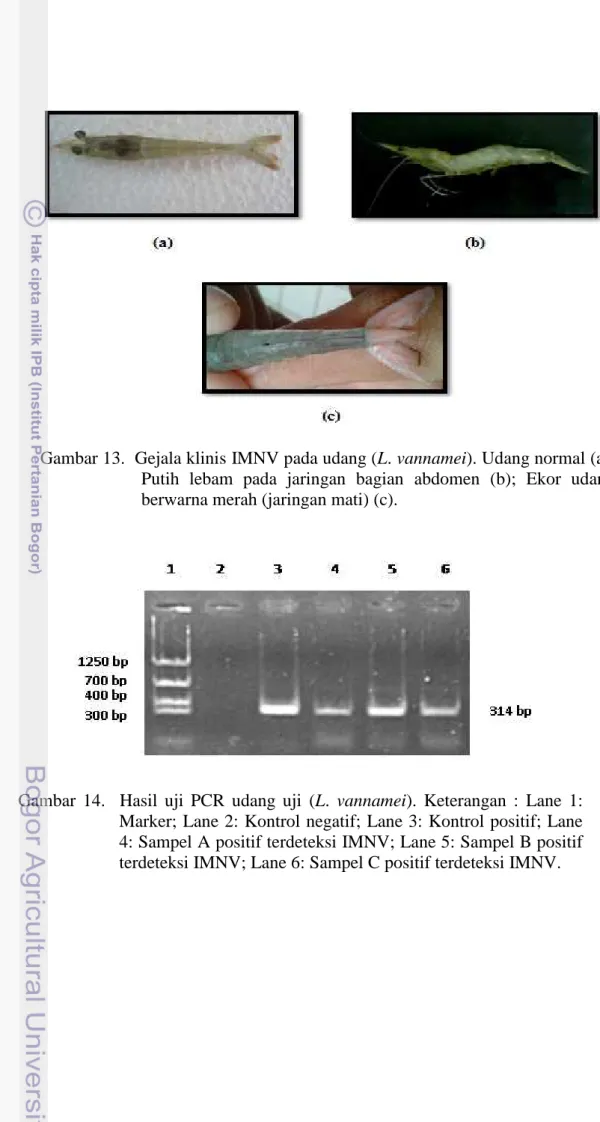
13 Gejala klinis IMNV pada udang (L. vannamei). Udang normal (a); Putih lebam pada jaringan bagian abdomen (b); Ekor udang
berwarna merah (jaringan mati) (c) 25 14 Hasil uji PCR udang uji (L. vannamei). Keterangan : Lane 1:
Marker; Lane 2: Kontrol negatif; Lane 3: Kontrol positif; Lane 4: Sampel A positif terdeteksi IMNV; Lane 5: Sampel B positif
DAFTAR LAMPIRAN
1 Pembuatan Media Bakteri 31
2 Udang Terinfeksi IMNV yang Digunakan untuk Stok Virus 31
3 Metode Total Plate Count 32
4 Metode Gores Kuadran 32
5 Hasil Uji Statistik dengan SPSS terhadap Rasio Konversi Pakan
(FCR) Udang Uji 33
6 Hasil Uji Statistik dengan SPSS terhadap Laju Pertumbuhan
Harian Udang Uji 34
7 Hasil Uji Statistik dengan SPSS terhadap Sintasan Udang Uji
Setelah Uji Tantang 35
8 Hasil Uji Statistik dengan SPSS terhadap Total Hemosit Udang
Uji Sebelum Uji Tantang 36
9 Hasil Uji Statistik dengan SPSS terhadap Sel Hialin Udang Uji
Sebelum Uji Tantang 37
10 Hasil Uji Statistik dengan SPSS terhadap Sel Granular Udang Uji
Sebelum Uji Tantang 38
11 Hasil Uji Statistik dengan SPSS terhadap Aktivitas Phenoloxidase
Udang Uji Sebelum Uji Tantang 39 12 Hasil Uji Statistik dengan SPSS terhadap Aktivitas Respiratory
Burst Udang Uji Sebelum Uji Tantang 40
13 Hasil Uji Statistik dengan SPSS terhadap Total Hemosit Udang
Uji Setelah Uji Tantang 41
14 Hasil Uji Statistik dengan SPSS terhadap Sel Hialin Udang Uji
Setelah Uji Tantang 42
15 Hasil Uji Statistik dengan SPSS terhadap Sel Granular Udang Uji
Setelah Uji Tantang 43
16 Hasil Uji Statistik dengan SPSS terhadap Aktivitas Phenoloxidase
Udang Uji Setelah Uji Tantang 44 17 Hasil Uji Statistik dengan SPSS terhadap Aktivitas Respiratory
1
1.
PENDAHULUAN
Latar Belakang
Serangan penyakit merupakan salah satu masalah serius dalam budidaya udang secara intensif (Chang et al. 2012). Penyakit yang sering menyerang budidaya udang intensif adalah penyakit bakterial, viral dan infeksi bersama bakteri dan virus (ko-infeksi) (Teixeira-Lopes 2011). Menurut Poulos et al. (2006), salah satu penyakit viral yang mematikan dan menjadi masalah utama pada budidaya udang vaname adalah IMNV (Infectious Myonecrosis Virus). Penyakit ini menyebar ke Indonesia pada tahun 2006 (Senapin 2007) dan dapat menyebabkan kematian massal pada udang hingga 70% (Hasan 2011). Selain infeksi oleh virus, di alam juga sering ditemukan infeksi oleh bakteri dan Vibrio sp ditemukan paling sering sebagai penyebab infeksi sekunder pada udang (Liu dan Chen 2004). Phuoc et al. (2009), melaporkan infeksi antara Vibrio spp dengan White Spot Syndrome Virus (WSSV). Selanjutnya, Teixeira-Lopes (2011), melaporkan udang vaname dapat terinfeksi oleh dua jenis virus berbeda yaitu Infectious Hypodermal and Hematopoietic Virus (IHHNV) dan IMNV secara alami.
Infeksi dari beberapa patogen secara bersamaan (ko-infeksi) dapat mempercepat awal mortalitas dan meningkatkan mortalitas (Hasan 2011). Oleh karena itu, perlu adanya cara untuk mencegah serangan penyakit ko-infeksi ini. Dalam beberapa tahun terakhir, antibiotik digunakan untuk mengendalikan penyakit dalam industri budidaya udang, namun antibiotik dapat menyebabkan patogen resisten antibiotik, kerusakan lingkungan dan masalah keamanan pangan (Chang et al. 2012; Ai et al. 2011). Menurut Zhang et al. (2012), perlu dicari alternatif untuk meningkatkan kekebalan tubuh dan mencegah wabah penyakit pada hewan akuatik. Hasil penelitian Li et al. (2009), menunjukkan sinbiotik dapat menjadi salah satu alternatif yang dapat digunakan untuk menekan serangan penyakit, karena sinbiotik terbukti mampu meningkatkan respon imun dan resistensi udang terhadap serangan WSSV. Sinbiotik merupakan kombinasi seimbang dari probiotik dan prebiotik dalam mendukung kelangsungan hidup dan pertumbuhan bakteri yang menguntungkan dalam saluran pencernaan makhluk hidup (Schrenzenmeir dan Vrese 2001).
Probiotik merupakan mikroba tambahan yang memberikan pengaruh menguntungkan bagi kesehatan inang (Nayak 2010). Sedangkan, prebiotik adalah bahan pangan yang tidak dapat dicerna oleh inang tetapi memberikan efek menguntungkan bagi inang dengan cara merangsang pertumbuhan mikroflora normal di dalam saluran pencernaan inang (Schrenzenmeir dan Vrese 2001). Beberapa penelitian menunjukkan keuntungan dari penggunaan probiotik (Panigrahi et al. 2005; Watson et al. 2008; dan Nayak 2010) dan prebiotik secara terpisah (Delgado et al. 2011; Hoseinifar et al. 2013). Namun, menurut Merrifield et al. (2010), aplikasi sinbiotik lebih baik daripada aplikasi probiotik dan prebiotik secara terpisah.
Penelitian ini mengkaji pemberian sinbiotik yang menggabungkan probiotik SKT-b dan prebiotik oligosakarida hasil ekstraksi dari ubi jalar varietas sukuh, dengan menggunakan beberapa frekuensi pemberian sinbiotik berbeda pada pakan
2
udang vaname. Frekuensi pemberian sinbiotik merupakan salah satu faktor penting yang dapat mempengaruhi pembentukan, kestabilan dan induksi respon imun pada inang (Nayak 2010). Oleh karena itu, penelitian mengenai frekuensi pemberian sinbiotik yang optimal untuk pencegahan ko-infeksi IMNV dan V. harveyi pada udang vaname penting dilakukan. Selain itu, frekuensi pemberian sinbiotik yang tepat akan berpengaruh terhadap efisiensi produksi mengingat aplikasi sinbiotik akan membutuhkan biaya tambahan.
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengkaji pemberian sinbiotik dengan frekuensi berbeda untuk pencegahan ko-infeksi IMNV dan V. harveyi pada udang vaname.
Manfaat Penelitian
Manfaat dari penelitian ini adalah untuk memberikan informasi tentang pemberian sinbiotik dengan frekuensi yang tepat untuk menekan munculnya serangan penyakit Infectious Myonecrosis (IMN) dan vibriosis (V. harveyi) pada budidaya udang vaname.
Hipotesis
Hipotesis penelitian ini adalah pemberian sinbiotik dosis 1 (1% probiotik + 2% prebiotik) dengan frekuensi tertentu dapat berpengaruh dalam pencegahan ko-infeksi IMNV dan V. harveyi pada udang vaname.
2.
TINJAUAN PUSTAKA
Sinbiotik
Probiotik adalah mikroba tambahan yang memberikan pengaruh menguntungkan bagi inang melalui peningkatan nilai nutrisi dan memperbaiki respon inang terhadap penyakit (Verschuere et al. 2000). Konsep awal aktivitas probiotik yaitu mendukung aktif saluran pencernaan dan memberikan sifat antagonisme terhadap patogen, membantu sistem kekebalan tubuh, memberikan manfaat gizi, dan membantu sebagai penghalang mukosa usus (Chiu et al. 2010; Merrifield et al. 2010; Nayak 2010).
Menurut Verschuere et al. (2000), bakteri probiotik memiliki beberapa mekanisme kerja, yaitu memproduksi senyawa inhibitor, kompetisi terhadap senyawa kimia atau sumber energi (nutrisi), kompetisi terhadap tempat pelekatan,
3
meningkatkan respon imun, perbaikan kualitas air dan interaksi dengan fitoplankton.
Bakteri probiotik yang telah banyak dilaporkan efektif dalam penghambatan patogen dan meningkatkan pertumbuhan dan sintasan pada budidaya udang meliputi Lactobacillus sp, Bacillus sp, ragi dan beberapa bakteri Gram negatif (Kongnum dan Hongpattarakere 2012). Bakteri probiotik yang digunakan pada penelitian ini adalah bakteri Vibrio SKT-b. SKT-b merupakan bakteri dari genus Vibrio, membentuk koloni berwarna kuning pada media TCBS dan menyebar pada media SWC-agar, memproduksi protease dan amilase, namun tidak memproduksi khitinase. Probiotik ini dapat memanfaatkan glukosa dan sukrosa, tetapi tidak dapat memanfaatkan laktosa. Hasil karakteristik fisiologi dan biokimia serta analisis sekuen sebagian gen 16S-rRNA menunjukkan bahwa isolat probiotik SKT-b ini termasuk spesies Vibrio alginolyticus dengan indeks kemiripan 88% (Widanarni et al. 2003). SKT-b telah teruji kemampuannya dalam menghambat pertumbuhan bakteri V. harveyi dan meningkatkan kelangsungan hidup larva udang windu pada berbagai stadia (Widanarni et al. 2010).
Probiotik sering didefinisikan sebagai aplikasi mikroorganisme atau komponen dari mikroorganisme yang bermanfaat untuk kesehatan inangnya (Cerezuela et al. 2011). Namun, probiotik memiliki beberapa kelemahan yaitu kemampuan bertahan, kolonisasi dan kompetisi untuk mendapatkan nutrisi dengan bakteri lain yang terdapat dalam satu lingkungan ekosistem. Bakteri probiotik juga dipengaruhi oleh kondisi lingkungan, jika terjadi perubahan lingkungan yang ekstrim maka bakteri dalam saluran pencernaan akan mengalami wash out (Lisal 2005). Penambahan prebiotik dapat mengatasi kelemahan probiotik.
Prebiotik didefinisikan sebagai bahan makanan yang tidak dapat dicerna yang menguntungkan dan mempengaruhi inang, secara selektif merangsang pertumbuhan dan/atau aktivitas spesifik bakteri yang dapat meningkatkan kesehatan inang (Cerezuela et al. 2011). Prebiotik merupakan komponen bahan pangan yang tidak dapat dicerna oleh inang, memiliki pengaruh menguntungkan terhadap inang dan berhubungan dengan mendukung keberadaan mikrobiota (FAO 2007).
FAO (2007), menyatakan bahwa komponen yang dapat diklaim sebagai prebiotik harus terlebih dahulu dikarakterisasi meliputi sumber asalnya, kemurnian, komposisi dan struktur kimia, konsentrasi dan jumlah yang dibawa ke inang. Manfaat minimum prebiotik adalah mempengaruhi fisiologi dan mendukung keberadaan mikrobiota pada bagian tertentu terutama saluran pencernaan. Kualifikasi prebiotik adalah bahwa prebiotik tidak hanya untuk meningkatkan bifidobakteria saja namun juga ditunjukkan dengan pengaruh meningkatkan kesehatan fisiologi inangnya (Watson et al. 2008). Prebiotik yang digunakan pada penelitian ini adalah oligosakarida yang diekstrak dari tepung ubi jalar.
Oligosakarida merupakan gula dengan tiga hingga 20 unit sakarida. Oligosakarida merupakan rantai pendek polisakarida. Karakteristik senyawa oligosakarida adalah terdiri dari susunan monosakarida antara lain glukosa, galaktosa, xylosa dan fruktosa; memiliki ikatan glikosidik; dan memiliki berat molekul yang rendah dibawah polisakarida. Oligosakarida tidak dapat dihidrolisis dan diserap oleh usus halus (Marlis 2008).
4
Ubi jalar mengandung karbohidrat yang tinggi dan protein serta lemak yang rendah. Rendemen ubi jalar varietas sukuh adalah 29,71 % dan kadar air tepung adalah 4,98 %. Gula yang terdapat pada ubi ini adalah rafinosa, maltosa, sukrosa dan maltotriosa (Tabel 1). Konsentrasi gula ubi jalar yang dikukus meningkat dibandingkan dengan ubi jalar mentah (Marlis 2008).
Tabel 1. Jenis dan konsentrasi gula tepung ubi jalar varietas sukuh yang diidentifikasi dengan HPLC (High Performance Liquid Chromatograph).
Jenis gula Konsentrasi gula tepung ubi jalat (% berat kering) Segar Panggang Kukus Sangrai Drum dried Fruktosa 0,33 0,29 0,19 0,32 0,43 Glukosa 0,23 0,24 0,28 0,21 0,26 Sukrosa 2,06 1,33 1,60 2,52 2,84 Maltosa 0,26 2,04 3,52 0,29 0,71 Total gula sederhana (A) 2,88 3,90 5,59 3,34 4,24 Maltotriosa 0,11 0,03 0,14 Tidak terdetektsi 0,04 Rafinosa 0,03 0,10 0,20 0,01 0,19 Total oligosakarida (B) 0,14 0,13 0,34 0,01 0,23 Total A+B 2,92 4,03 5,93 3,35 4,47 Sumber: Marlis 2008
Sinbiotik merupakan aplikasi gabungan dari probiotik dan prebiotik yang memberikan keunggulan kompetitif bagi probiotik terhadap sumber energi fermentasi yang tinggi dibandingkan dengan kompetisi populasi endogenous, sehingga secara efektif dapat meningkatkan kelangsungan hidup dan pelekatan (implantasi) dari suplemen makanan mikroba hidup dalam saluran pencernaan dari inang(Daniels et al. 2010; Ai et al. 2011; Cerezuela et al. 2011; Delgado et al. 2011). Li et al. (2009), melaporkan bahwa aplikasi sinbiotik dari prebiotik isomaltooligosakarida dan probiotik Bacillus OJ pada udang telah terbukti secara signifikan meningkatkan kelangsungan hidup udang yang diuji tantang dengan WSSV, mendukung keberadaan mikrobiota gastro-intestinal dan merangsang respon imun.
Infectious Myonecrosis Virus (IMNV)
Penyakit Infectious Myonecrosis (IMN) akibat infeksi IMNV ini pertama kali ditemukan pada budidaya udang vaname di Timur Laut Brazil. IMNV secara signifikan menyebabkan penyakit dan kematian pada juvenil dan subadult di tambak pembesaran udang vaname (Lightner 2012). Walaupun IMNV tampak menyebar terbatas pada daerah Timur Laut Brazil, penyakit ini telah menyebar ke Asia Tenggara dan dilaporkan terjadi di Indonesia pada tahun 2006 (Senapin et al. 2007).
5
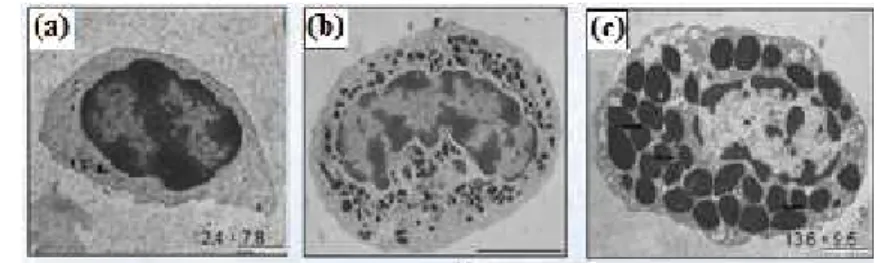
Partikel virus IMNV berbentuk icosahedral dengan diameter 40 nm (Gambar 1). Genom IMNV terdiri dari dsRNA tunggal dengan molekul berukuran 7560 bp. Sekuen genom virus menunjukkan dua non-overlaping open reading frames (ORFs). ORF I mengkode pengikatan protein RNA dan sebuah capsid protein. Daerah pengkodean pengikatan protein RNA terletak pada setengah pertama ORF I dan membentuk sebuah motif pengikatan dsRNA. Setengah kedua ORF I mengkode sebuah RNA-dependen dari RNA polimerase (RdRp) (Lightner 2012). Berdasarkan pada karakteristik ini, IMNV paling mirip dengan famili Totiviridae (Poulos et al. 2006).
Organ target penyakit IMNV adalah otot dan organ limfoid (Gambar 1). Jaringan yang terinfeksi yaitu otot skeletal (abdomen), ekor, hemosit, parenchymal cells, organ limfoid, dan sedikit menyerang otot kardiak. IMNV merupakan tipe virus sistemik dan tidak bereplikasi pada jaringan enteric seperti hepatopankreas, saluran usus dan caeca. Tanda udang yang terinfeksi oleh IMNV dapat dilihat dari gejala klinis yang ditimbulkan yaitu otot udang yang transparan, volume hepatopankreas berkurang, ekor kehilangan warna dan transparan, nekrosis dibagian abdomen dan chepalothorax, bintik putih pada otot, dan nekrosis pada kipas ekor (Teixeira-Lopes 2011).
Vibrio harveyi
V. harveyi bersifat patogen oportunistik, yaitu organisme yang dalam keadaan normal ada di lingkungan pemeliharaan dan bersifat saprofitik serta menjadi patogen jika kondisi lingkungan dan inang memburuk. V. harveyi tergolong dalam divisi Bacteria, Klas Shyzomycetes, Ordo Eubacteria, Famili Vibrionaceae dan genus Vibrio. Bakteri ini termasuk Gram negatif, bersel tunggal, berbentuk batang pendek yang bengkok (koma) atau lurus, bersifat motil, ukuran sel 1-4 mikron, berpendar dan mempunyai flagel disalah satu kutubnya (Garrity et al. 2004).
Bakteri V. harveyi merupakan patogen yang menyebabkan penyakit vibriosis. Penyakit vibriosis pada budidaya udang terjadi pada stadia larva sampai dewasa. Udang yang terinfeksi pada kondisi gelap tampak berpendar, sedangkan udang yang dipelihara di tambak akan terlihat bercahaya jika permukaan tambak
Gambar 1. IMNV. Virion IMNV (a); subadult udang vaname terinfeksi IMNV (b); dan organ limfoid yang terinfeksi IMNV (c) (Poulos et al. 2006).
6
tertiup angin. Tanda-tanda udang yang terinfeksi V. harveyi gerakan lemah dan menyentak-nyentak, jaringan mengalami nekrosis, pertumbuhan lambat, metamorfosis lambat, udang menyala dalam gelap, otot dan dagingnya berwarna gelap, dan usus kosong (Cano-Gomez et al. 2009).
Ko-Infeksi
Ko-infeksi disebabkan oleh dua atau lebih patogen yang menyerang pada saat bersamaan. Beberapa penelitian telah melaporkan adanya ko-infeksi. Ko-infeksi oleh bakteri-bakteri telah dilaporkan oleh Phuoc et al. (2009), dimana udang windu yang diuji tantang oleh V. parahaemolyticus dan V. harveyi yang diisolasi dari udang sakit dapat menyebabkan sindrom merah pada udang windu. Ko-infeksi oleh beberapa virus juga dilaporkan telah menyerang budidaya udang vaname di Brazil, dimana udang tersebut terinfeksi oleh IMNV dan WSSV (Feijo et al. 2013).
Ko-infeksi oleh IHHNV dan WSSV pada budidaya udang vaname telah dilaporkan oleh Teixeira-Lopes (2011). Flegel et al. (2004), dengan menggunakan histopatologi dan PCR menemukan infeksi oleh dua, tiga sampai empat infeksi virus bersamaan yaitu virus HPV, WSSV, IHHNV dan MBV pada tambak udang komersial di Thailand. Selvin dan Lipton (2003), menemukan kehadiran V. alginolyticus yang mematikan pada tambak udang yang terinfeksi WSSV. Walaupun tidak semua sampel terinfeksi kedua jenis patogen tersebut. Namun, hal ini membuktikan bahwa udang yang melemah karena terinfeksi WSSV akan mudah mengalami infeksi sekunder oleh Vibrio.
Sistem Imun pada Udang
Sistem imun pada udang kurang berkembang dibandingkan dengan vertebrata lain. Udang maupun krustasea tidak memiliki sistem imun spesifik atau adaptif dan hanya memiliki sistem imun non-spesifik atau bawaan (innate). Sel efektor dari sistem kekebalan tubuh pada krustasea adalah sel-sel darah atau hemosit sementara hepatopankreas bertanggung jawab untuk biosintesis beberapa faktor humoral (Rowley dan Pope 2012).
Sistem pertahanan tubuh utama tersebut terdiri dari dua bagian yaitu sistem pertahanan tubuh selular dan sistem pertahanan humoral. Sistem pertahanan selular berupa aktivitas sel-sel hemosit meliputi fagositosis, nodulasi dan enkapsulasi. Sistem pertahanan humoral mencakup protein antikoagulan, enzim phenoloksidase (PO), peptida antimikrobial, lektin, aglutinin dan lain sebagainya. Kedua sistem pertahanan ini bekerja sama memberikan perlindungan tubuh terhadap infeksi organisme patogen dari lingkungan (Sahoo et al. 2007). PO terdapat dalam hemolim sebagai inaktif pro-enzim yang disebut prophenoloxidase (proPO). proPO adalah non-self recognition sistem yang terdapat pada arthropoda dan invertebrata lain. Transformasi proPO menjadi PO melibatkan beberapa reaksi yang dikenal sebagai proPO activating system. proPO dan PO dilibatkan dalam enkapsulasi, melanisasi dan berfungsi sebagai sistem non self recognition (Liu dan Chen 2004).
7
Hemosit memainkan peranan penting dalam sistem imun tubuh krustasea. Johansson et al. (2000), mengklasifikasikan hemosit berdasarkan ada tidaknya butiran pada sitoplasma (Gambar 2). Pada udang, seperti krustasea lainnya, terdapat tiga jenis utama hemosit, yaitu sel hialin, sel semi-granular dan sel granular (Pyng Yeh et al. 2009).
Hialin merupakan sel dengan perbandingan inti lebih tinggi dari sitoplasma dan memiliki sedikit granul submikron. Semi granular merupakan sel dengan perbandingan inti lebih rendah dari sitoplasma dan memiliki granul sub mikron dan mikron serta adanya granul refractile. Semi granular memperlihatkan kapasitas mengenali dan merespons partikel unsur atau molekul asing atau dikenal sebagai sel aktif dalam enkapsulasi. Granular merupakan sel dengan perbandingan inti lebih rendah dari sitoplasma berisi butiran halus dan bertanggung jawab mengaktifkan system prophenoloksidase (sistem proPO). Sel semi granular dan granular melakukan fungsi sistem proPO sedangkan sel hialin melakukan fagositosis dalam imunitas krustasea (Johansson et al. 2000). Mekanisme pertahanan tubuh nonspesifik pada krustasea dapat dilihat pada Gambar 3.
Gambar 2. Klasifikasi hemosit: hialin (a); semi granular (b); dan granular (c) (Martines 2007).
Gambar 3. Mekanisme pertahanan tubuh nonspesifik pada krustasea (Smith et al. 2003).
8
Parameter kekebalan tubuh udang terhadap virus masih kurang diperhatikan. Pyng Yeh (2009), memeriksa parameter kekebalan tubuh udang yang terinfeksi virus antara lain total hemosit count (THC), diferensial hemosit, aktivitas PO, respiratory burst, dan superoksida dismutase (SOD), serta ekspresi gen kekebalan terkait, termasuk proPO, lipopolisakarida (LPS) dan β-1,3-glukan protein-binding (LGBP), dan peroxinectin (PE) untuk memahami respon imun udang putih di bawah pengaruh infeksi virus.
3.
METODE PENELITIAN
Persiapan Prebiotik
Persiapan prebiotik dimulai dengan tahap pembuatan tepung ubi jalar. Prosedur pembuatan prebiotik yaitu ubi jalar dibersihkan dan dikupas, kemudian diiris dengan menggunakan pisau dengan ketebalan ±1 mm. Selanjutnya irisan ubi jalar dikeringkan dalam oven pengering pada suhu 55oC selama 5 jam hingga irisan ubi dapat dipatahkan dengan tangan. Irisan ubi jalar kemudian digiling dengan willey mill dan diayak dengan ukuran 60 mesh (250 µm) (Marlis 2008). Tahapan dalam pembuatan ubi jalar dapat dilihat pada Gambar 5.
Gambar 4. Tahapan pembuatan ubi jalar
Persiapan ubi jalar varietas sukuh
Pengupasan
Pengirisan
Pengeringan pada suhu 55oC
Penggilingan dengan willey mill
Pengayakan 60 mesh
9
Tahapan selanjutnya adalah ekstraksi oligosakarida/prebiotik dengan etanol. Prosedur kerja yang dilakukan adalah sebagai berikut: sebanyak 10 gram tepung ubi jalar disuspensikan ke dalam 100 ml etanol 70% dan diaduk selama 15 jam menggunakan magnetic stirer pada suhu ruang. Setelah itu dilakukan penyaringan menggunakan kertas saring dan residu dicuci dengan etanol 70%. Filtrat yang diperoleh dipekatkan menggunakan evaporator vakum pada suhu 40oC. Hasil pemekatan disentrifus pada 2000 rpm selama 10 menit untuk mengendapkan kotoran dan padatan sehingga ekstrak mudah disterilisasi dengan membran steril 0,2 µm (Muchtadi 1989).
Hasil ekstraksi oligosakarida tersebut dilakukan penghitungan total padatan terlarut (Apriyantono 1989). Prosedur penghitungan total padatan terlarut adalah sebagai berikut: cawan porselen dikeringkan selama dua jam dalam oven bersuhu 100oC, kemudian didinginkan dalam desikator hingga diperoleh berat tetap. Cawan tersebut kemudian ditimbang (a gram). Sebanyak 1 ml ekstrak kasar oligosakarida ditempatkan ke dalam cawan porselen tersebut dan ditimbang berat larutan ekstrak kasar oligosakarida (b gram). Cawan yang telah berisi ekstrak kasar oligosakarida kemudian ditempatkan dalam oven selama sehari semalam. Setelah kering, cawan berisi sampel ekstrak kasar oligosakarida didinginkan dalam desikator selama 10 menit atau hingga berat cawan stabil. Berat cawan yang berisi ekstrak kering kemudian diukur (c gram). Total padatan terlarut dihitung dari hasil perbandingan berat ekstrak setelah dikeringkan dengan berat ekstrak sebelum dikeringkan dan dikalikan 100%.
TPT = − x 100%
Analisis Kandungan Oligosakarida
Hasil ekstraksi ubi jalar varietas sukuh dengan TPT sebesar 5% (Marlis 2008), diukur kandungan fruktooligosakarida (FOS), galaktooligosakarida (GOS) dan inulinnya dengan menggunakan HPLC (High Performance Liquid Chromatograph). Kolom yang digunakan untuk pengukuran FOS dan GOS adalah carbohydrate column (4,6 mm x 250 mm), ukuran partikel 4 µm dengan refraktif indeks detector dan flow rate (laju alir) 2,0 ml/menit. Fase gerak yang digunakan adalah asetonitril dan air dengan perbandingan asetonitril: aquabidest (80:20). Volume sampel yang diinjeksikan 20 µl dengan temperatur kolom 40oC. Sedangkan kolom yang digunakan untuk pengukuran inulin adalah Aminex Ion Exclusion HPX-87H (300 x 7,8 mm). Fase gerak yang digunakan adalah aquabidest (100%) dengan flow rate (laju alir) 0,3 ml/menit dengan refraktif indeks detector. Volume sampel yang diinjeksikan 20 µl dengan temperatur kolom 80oC dan temperatur detektor 40oC.
10
Persiapan Probiotik
Bakteri probiotik yang digunakan adalah Vibrio alginolitycus SKT-b yang telah diberi penanda resisten antibiotik rifampicin (Widanarni et al. 2003) sebagai penanda molekuler untuk membedakan bakteri yang diinokulasikan dengan bakteri yang telah ada pada media pemeliharaan serta tubuh udang. Isolat SKT-b resisten rifampicin (SKT-bR) tersebut kemudian dikultur ulang dan dimurnikan lalu dilakukan re-karakterisasi dan total plate count (TPC). Sebelum digunakan isolat SKT-bR dikultur dalam 25 ml media SWC (Sea Water Complete) cair (Lampiran 1) selama 18 jam dalam water shaker pada suhu 29oC.
Persiapan Stok Virus IMNV
Jenis virus yang digunakan pada penelitian ini adalah IMNV yang diperoleh dari udang vaname yang telah terinfeksi virus IMNV yang berasal dari Balai Pengembangan Budidaya Air Payau (BPBAP) Situbondo dan telah dikonfirmasi dengan PCR positif IMNV dengan ciri-ciri gejala klinis ekor udang berwarna merah muda (Lampiran 2). Udang tersebut lalu dibersihkan dan diambil bagian dagingnya. Kemudian daging udang dicacah hingga halus lalu ditambahkan larutan PBS dengan perbandingan 1:10 (w/v) kemudian dihomogenkan. Setelah itu disentrifuse dengan kecepatan 6500 rpm pada suhu 4oC selama 20 menit. Selanjutnya supernatan disaring dengan filter mess size 0,45 µm. Ekstrak virus hasil filtrasi kemudian disimpan pada freezer suhu -70oC (Rodriguez et al. 2007).
Persiapan Vibrio harveyi
Jenis bakteri yang digunakan adalah Vibrio harveyi MR 5339 yang telah diberi penanda resisten terhadap antibiotik rifampicin sebagai penanda molekuler untuk membedakan bakteri yang diinokulasikan dengan bakteri yang telah ada pada media pemeliharaan serta tubuh udang. Isolat V. harveyi didapat dari koleksi Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Institut Pertanian Bogor. Isolat bakteri tersebut dikultur ulang dan dimurnikan kemudian dilakukan re-karakterisasi dan total plate count (TPC). Isolat V. harveyi yang digunakan dikultur dalam 25 ml media SWC cair selama 18 jam dalam water shaker pada suhu 29oC.
Pengujian Sinbiotik secara In Vivo
Persiapan Hewan Uji dan Media Pemeliharaan
Hewan uji yang digunakan pada penelitian ini adalah benih udang vaname Specific Pathogen Free (SPF) terhadap Infectious Myonecrosis Virus (IMNV), White Spot Syndorme Virus (WSSV), Taura Syndrome Virus (TSV) dan Infectious Hypodermal and Hematopoietic Necrosis Virus (IHHNV), stadia postlarva (PL) 15, yang berasal dari hatchery komersil di Carita, Banten. Sebelum digunakan
11
benur dipelihara terlebih dahulu selama 14 hari hingga ukuran rata-rata 0,3±0,03 g. Wadah yang digunakan berupa akuarium sebanyak 15 buah yang telah didesinfeksi dengan menggunakan klorin sebanyak 30 ppm kemudian setelah 24 jam diberikan Na-thiosulfat sebanyak 15 ppm dan diaerasi. Akuarium yang digunakan berukuran 60x30x40cm3 dengan volume air 30 liter dan kepadatan udang 15 ekor/akuarium. Kualitas air dalam akuarium selama perlakuan dipertahankan stabil dengan penyiponan dan pergantian air setiap hari sebanyak 10%. Kualitas air selama penelitian adalah temperatur 28-29oC, salinitas 29-32 ppt, oksigen terlarut 4,5-6,5 mg/l; pH 7,4-7,5; dan ammonia-nitrogen 0,005-0,016 mg/l.
Persiapan Pakan Uji
Pakan yang digunakan pada penelitian ini berupa pelet komersil dengan kandungan protein sebesar 40%. Pakan uji dibuat dengan menambahkan sinbiotik pada pakan udang dengan mencampurkan sinbiotik 1 dosis (1% probiotik + 2% prebiotik) dan putih telur sebanyak 2% sebagai bahan perekat, pakan kontrol ditambahkan dengan 2% putih telur tanpa penambahan sinbiotik (Nurhayati et al. 2014).
Aplikasi Sinbiotik pada Udang Vaname
Aplikasi sinbiotik melalui pakan dilakukan selama 30 hari menggunakan rancangan acak lengkap (RAL) yang terdiri dari lima perlakuan dengan tiga ulangan (Tabel 2). Udang diberi pakan sebanyak 4 kali dalam sehari (pukul 08.00, 12.00, 16.00 dan 20.00 WIB) dengan feeding rate sebesar 10-12% berat biomassa. Tabel 2. Perlakuan pemberian sinbiotik dengan frekuensi berbeda dan uji tantang
dengan ko-infeksi IMNV dan V. harveyi
Perlakuan Keterangan
Kontrol - Pemberian pakan tanpa sinbiotik dan tanpa ko-infeksi oleh IMNV dan V. harveyi
Kontrol + Pemberian pakan tanpa sinbiotik dengan ko-infeksi IMNV dan V. harveyi
P1 Pemberian pakan dengan sinbiotik setiap hari serta ko-infeksi IMNV dan V. harveyi
P2 Pemberian pakan dengan sinbiotik tiga hari sekali serta ko-infeksi IMNV dan V. harveyi
P3 Pemberian pakan dengan sinbiotik tujuh hari sekali serta ko-infeksi IMNV dan V. harveyi
Uji Tantang
Uji tantang dilakukan pada akhir perlakuan sinbiotik, dimaksudkan untuk menguji kinerja sinbiotik terhadap resistensi udang vaname yang diinfeksi oleh IMNV dan V. harveyi. Pengamatan uji tantang dilakukan selama tujuh hari setelah infeksi IMNV.
Udang yang telah diberi pakan perlakuan selama 30 hari dipuasakan selama satu hari kemudian diinfeksi dengan IMNV dan tiga hari kemudian dengan
12
V. harveyi (kecuali kontrol negatif). Infeksi dilakukan dengan cara injeksi secara intramuskular pada bagian punggung antara segmen kedua dan ketiga sebanyak masing-masing 100 µl (Selvin dan Lipton 2003). Sebelum digunakan ekstraksi IMNV dicampur dengan PBS sebanyak 1:1. Kepadatan bakteri V. harveyi yang digunakan adalah 103CFU/ml (LD50).
Penghitungan Populasi Bakteri di Usus
Penghitungan jumlah bakteri di usus dilakukan pada akhir perlakuan sinbiotik (hari ke-30). Penghitungan jumlah bakteri dalam usus udang terdiri dari total viable bacterial count (TBC), total presumptive vibrio count (TVC) dan total SKT-bR count. Usus diambil sebanyak 0,1 g yang dikumpulkan dari 3-5 ekor udang kemudian dihomogenkan dalam larutan phosphat buffer saline (PBS) sebanyak 0,9 ml. Penghitungan bakteri menggunakan metode hitung cawan sebar, dengan menggunakan media SWC (Sea Water Complete) agar untuk perhitungan TBC, media spesifik TCBS (Thiosulfate Citrate Bilesalt Sucrose) agar untuk perhitungan TVC dan media spesifik TCBS-rif agar (50 µg/ml) untuk perhitungan SKT-bR.
Parameter Pertumbuhan
Laju Pertumbuhan Harian
Laju pertumbuhan harian (LPH) diukur pada akhir perlakuan sinbiotik selama 30 hari. Menurut Huissman (1987), laju pertumbuhan harian dapat dihitung dengan menggunakan rumus berikut:
α = − 1 x 100% Keterangan:
α = Laju pertumbuhan harian (%)
Wt = Bobot rata-rata udang pada akhir penelitian (gram)
Wo = Bobot rata-rata udang pada awal penelitian (gram) t = Periode pemeliharaan
Rasio Konversi Pakan
Rasio konversi pakan (FCR) diukur pada akhir perlakuan sinbiotik selama 30 hari. Menurut Zonneveld et al. (1991), rasio konversi pakan selama penelitian dapat dihitung dengan menggunakan rumus sebagai berikut:
FCR =
( + )− Keterangan:
FCR = Rasio konversi pakan F = Jumlah pakan (gram)
13
Bm = Biomassa udang yang mati (gram)
Bo = Biomassa udang pada awal penelitian (gram)
Parameter Respon Imun
Hemosit Total
Hemosit total diukur pada akhir perlakuan sinbiotik (sebelum uji tantang) dan setelah uji tantang. Hemosit total diamati dengan langkah-langkah berikut hemolim udang diambil sebanyak 0,1 ml dari pangkal kaki renang pertama dengan menggunakan jarum suntik yang sudah berisi 0,3 ml antikoagulan Na-sitrat 3,8%, Campuran yang diperoleh kemudian dihomogenkan dan diteteskan ke haemositometer setelah tetesan pertama dibuang, selanjutnya jumlah sel per ml diamati di bawah mikroskop dengan pembesaran 400 kali (Sang et al. 2009). Hemosit total dihitung dengan menggunakan rumus:
THC = rata-rata jumlah sel terhitung x 1 x FP
Keterangan: FP = faktor pengencer Diferensial Hemosit
Diferensial hemosit diukur pada akhir perlakuan sinbiotik (sebelum uji tantang) dan setelah uji tantang. Hemolim udang yang telah diambil diteteskan pada gelas objek dan dibuat preparat ulas, kemudian dikering udarakan lalu difiksasi dengan metanol 100% selama 5 menit. Setelah itu dikering udarakan kembali lalu diwarnai dengan larutan Giemsa 10% selama 10 menit (Sang et al. 2009). Preparat diamati dengan menggunakan mikroskop dan dibedakan jumlah sel hialin dan granular. Persentase hemosit dihitung dengan menggunakan rumus:
Jenis sel hemosit (%) = ℎ ℎ
ℎ x 100% Aktivitas Phenoloxidase
Aktivitas phenoloxidase dilakukan pada akhir perlakuan sinbiotik (sebelum uji tantang) dan setelah uji tantang. Aktivitas phenoloxidase diukur dengan menggunakan spektrofotometrik dengan mencatat perubahan bentuk dopachrome yang diproduksi dari L-dihidroxyphenylalanine (L-DOPA). Hemolim yang telah diencerkan disentrifus 700 rpm pada suhu 4oC selama 20 menit. Larutan supernatan yang dihasilkan dibuang dan pellet dicuci, kemudian dilarutkan kembali dengan cacodylatecitrate buffer (0,01M sodium cacodylate; 0,45 M sodium chloride; 0,01 M trisodium citrate; pada pH 7,0) lalu disentrifus kembali. Pellet yang telah dilarutkan dengan 200 ml cacodylate buffer dan 100 ml aliquot kemudian diinkubasi dengan 50 ml trypsin (T-0303, Sigma, 1 mg/ml) yang berfungsi sebagai pengaktif selama 10 menit pada suhu 25-26oC; kemudian ditambahkan 50 ml L-DOPA, yang dilanjutkan dengan 800 ml cacodylate buffer selama 5 menit. Kemudian optical density diatur pada 490 nm. Larutan kontrol
14
yang terdiri dari 100 µl larutan sel, 50 µl cacodylate buffer (untuk mengganti trypsin), dan 50 µl L-DOPA, digunakan untuk kontrol aktivitas phenoloxidase semua larutan yang diuji. Optical density aktivitas phenoloxidase udang yang diuji diekpresikan oleh bentuk dopachrome 100 µl hemolim (Hsieh et al. 2008). Aktivitas Respiratory Burst
Pengukuran aktivitas respiratory burst dilakukan pada akhir perlakuan sinbiotik (sebelum uji tantang) dan setelah uji tantang. Aktivitas respiratory burst hemosit dihitung dengan menggunakan reduksi Nitroblue Tetrazolium (NBT) menjadi formazan dalam kadar negatif superoxide (Cheng et al. 2004). Sebanyak 100 µl hemolim yang telah diberikan antikoagulan dimasukan kedalam tube, kemudian diinkubasi selama 30 menit pada suhu ruang. Tube kemudian disentrifuge 3000 rpm selama 20 menit. Plasma dibuang dan 100 µ l zymosan (0,3% dalam modifikasi larutan Hank’s Balanced Salt lengkap 10 mM calcium chloride; 3 mM magnesium chloride dan 5 mM magnesium sulfate) ditambahkan dan dibiarkan bereaksi selama 2 jam pada suhu ruang. Setelah itu, disentrifus 3000 rpm selama 10 menit dan supernatan dibuang, lalu hemosit dicuci dua kali dengan menggunakan 100 µl methanol 70% lalu dikering udarakan. Pellet yang terbentuk dilarutkan kedalam 120 µl, 2 M KOH dan 140 µl dimethyl sulfoxide (DMSO). Optical density diatur pada 630 nm menggunakan microplate reader. Respiratory burst diekspresikan sebagai NBT-reduction dalam 10 µl hemolim.
Sintasan
Sintasan udang vaname diamati pada akhir perlakuan sinbiotik selama 30 hari (sebelum uji tantang) dan setelah uji tantang, dengan menggunakan rumus (Soleimani et al. 2012) sebagai berikut:
Survival = x 100% Keterangan:
Nf = Jumlah udang pada akhir penelitian (ekor) No = Jumlah udang pada awal penelitian (ekor)
Pengujian Udang Terinfeksi IMNV dan V. harveyi
Pengujian udang terinfeksi IMNV dan V. harveyi dilakukan pada akhir uji tantang. Hal ini dilakukan untuk membuktikan virus dan bakteri yang menginfeksi. Uji PCR dilakukan pada akhir uji tantang untuk membuktikan bahwa udang terinfeksi oleh IMNV pada Laboratorium Uji Loka Pemeriksaan Penyakit Ikan dan Lingkungan (LP2IL), Serang menggunakan Nugen diagnostic kits. Udang yang digunakan untuk uji PCR adalah udang yang menunjukkan gejala klinis terinfeksi IMNV. Gejala klinis yang diamati antara lain adanya warna putih lebam di dalam jaringan pada segmen abdomen ke arah ekor hingga warna merah muda pada ekor. Pembuktian bakteri dilakukan dengan metode gores kuadran pada media TCBS-Rif (50 µg/ml). Hepatopankreas udang yang terinfeksi diambil kemudian dilakukan metode gores kuadran.
15
Analisis Data
Data performa pertumbuhan (laju pertumbuhan spesifik harian dan rasio konversi pakan) dan respon imun (hemosit total, diferensial hemosit, aktivitas phenoloxidase dan aktivitas respiratory burst) dan sintasan yang diperoleh diuji secara statistik (α=0,05) dengan menggunakan software statistik SPSS 16 dan apabila berbeda nyata dilanjutkan dengan uji beda nyata Duncan. Data kandungan oligosakarida dan populasi bakteri di usus diuji secara deskriptif.
4.
HASIL DAN PEMBAHASAN
Oligosakarida Ubi Jalar Varietas Sukuh
Hasil uji kandungan oligosakarida tepung kukus ubi jalar varietas sukuh dengan HPLC menunjukkan bahwa ubi jalar varietas sukuh mengandung FOS, GOS dan inulin (Tabel 3). Ubi jalar diketahui mengandung oligosakarida yang tidak dapat dicerna (Non Digestible Oligosaccharides) yang dapat berfungsi sebagai prebiotik (Marlis 2008).
Tabel 3. Hasil analisis oligosakarida ubi jalar varietas sukuh dengan HPLC
No. Parameter Unit Hasil
1. FOS g/100 g 1.015
2. GOS g/100 g 1.488
3. Inulin g/100 g 1.115
FOS, GOS dan inulin merupakan prebiotik yang biasa digunakan pada akuakultur. FOS dapat difermentasikan oleh bakteri tertentu yang dapat menghasilkan enzim pemecah FOS seperti lactobacillus dan bifidobacter (Delgado et al. 2011). Pakan yang ditambah dengan FOS dapat mendukung pertumbuhan dan kelangsungan hidup bakteri dalam saluran GI inang. Selanjutnya penambahan FOS dan inulin dalam pakan telah menunjukkan peningkatan pertumbuhan dan/atau kelangsungan hidup hewan air.
GOS adalah prebiotik yang dihasilkan melalui konversi enzimatik terutama galaktosa, laktosa dan molekul glukosa. Penambahan 2% GOS dalam pakan meningkatkan performa pertumbuhan secara signifikan (Hoseinifar et al. 2013). Beberapa penelitian telah melaporkan kinerja pertumbuhan yang membaik dari spesies ikan yang diberi prebiotik (Merrifield et al. 2010; Ringo et al. 2010; Soleimani et al. 2012). Namun, Grisdale-Helland et al. (2008), melaporkan bahwa penambahan 1% GOS dalam pakan tidak mempengaruhi performa pertumbuhan dari Atlantic salmon (S. salar) dan Hybrid striped bass (M. chrysops x M. saxatilis). Perbedaan hasil tersebut dapat disebabkan oleh perbedaan cara pemberian, dosis pemberian, jenis prebiotik dan morfologi usus serta beberapa parameter penting lainya seperti spesies ikan dan waktu pemberian prebiotik serta tahap perkembangan ikan yang digunakan dalam penelitian (Hoseinifar et al. 2013).
16
Inulin adalah oligosakarida yang biasa digunakan sebagai prebiotik pada manusia atau pakan hewan. Inulin memiliki banyak manfaat dalam akuakultur diantaranya dapat menstimulasi mikroba baik dalam usus, menekan patogen dan meningkatkan sistem imun, walaupun dalam dosis tinggi mungkin berdampak negatif pada morfologi usus (Ringo et al. 2010).
Penghitungan Populasi Bakteri di Usus Udang
Jumlah bakteri total (TBC), bakteri Vibrio total (TVC) dan bakteri probiotik SKT-bR total di usus udang setelah pemberian pakan perlakuan selama 30 hari disajikan pada Tabel 4.
Tabel 4. Penghitungan populasi bakteri di usus udang (L. vannamei) Perlakuan Bakteri Total
(CFU/g)
Bakteri Vibrio Total (CFU/g) Bakteri Probiotik SKT-bRTotal (CFU/g) Kontrol (-) 6,00 x 105 2,00 x 103 -Kontrol (+) 5,00 x 105 3,00 x 103 -P1 2,21 x 107 2,31 x 105 1,83 x 104 P2 1,34 x 107 1,73 x 105 1,23 x 102 P3 3,22 x 106 1,03 x 104 9,51 x 101 Keterangan: P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari
sekali; P3: pemberian sinbiotik tujuh hari sekali.
Pemberian sinbiotik selama 30 hari meningkatkan jumlah bakteri di dalam usus udang. Peningkatan jumlah bakteri tidak hanya terjadi pada jumlah bakteri total pada usus udang namun juga jumlah bakteri Vibrio dan probiotik SKT-bR. Hal ini ditunjukkan oleh jumlah bakteri pada perlakuan sinbiotik lebih tinggi dibandingkan dengan kontrol.
Menurut Ai et al. (2011), bakteri pada saluran pencernaan mengambil bagian dalam dekomposisi nutrisi, memberikan makroorganisme dengan bahan aktif secara fisiologis seperti enzim, asam amino dan vitamin, dengan demikian memfasilitasi pemanfaatan pakan dan pencernaan. Pemberian sinbiotik meningkatkan fungsi dan jumlah dari bakteri menguntungkan dalam usus (Delgado et al. 2011). Menurut Daniels et al. (2010) pemberian MOS pada lobster menyebabkan bakteri pada gastrointestinal lebih stabil dibandingkan dengan perlakuan yang tidak diberikan MOS. Pemberian probiotik secara live-sprayed dan freeze-dried pada ikan meningkatkan bakteri asam laktat total pada usus ikan (Panigrahi et al. 2005). Li et al. (2009), melaporkan bahwa peningkatan dosis pemberian probiotik Bacillus dan isomaltooligosakarida (IMO) pada udang vaname menurunkan jumlah bakteri Vibrio pada usus udang, namun hal ini meningkatkan imunomudulatory udang tersebut. Aplikasi sinbiotik dapat memaksimalkan pakan yang tertelan diubah lebih efektif menjadi protein struktural yang kemudian dapat meningkatkan pertumbuhan (Cerezuela et al. 2011).
Aplikasi sinbiotik tidak hanya dapat meningkatkan pertumbuhan namun dapat juga meningkatkan respon imun inang. Bakteri usus dapat mendukung
17
perubahan parameter imun nonspesifik. Mekanisme imun nonspesifik bertindak sebagai pertahanan pertama terhadap infeksi dengan menginduksi peradangan sebagai respon imun awal. Sinbiotik yang mendukung mikrobiota usus mungkin memiliki tindakan protektif pada sel-sel mukosa usus dengan merangsang kekebalan tubuh nonspesifik, tanpa memberikan pengaruh negatif pada pertumbuhan (Ai et al. 2011).
Kinerja Pertumbuhan
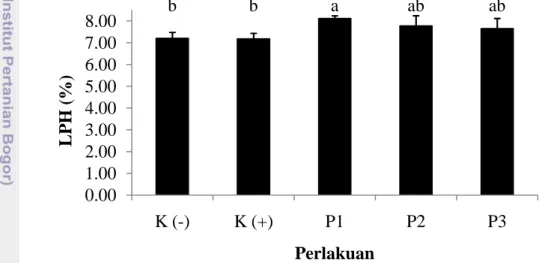
Laju pertumbuhan harian (LPH) penelitian ini berbeda secara signifikan antara perlakuan sinbiotik dengan kontrol, namun tidak berbeda nyata antar perlakuan sinbiotik. Nilai LPH yang diperoleh pada perlakuan berturut-turut yaitu P1 (8,12±0,12%), diikuti oleh P2 (7,78±0,46%); P3 (7,66±0,46%); kemudian kontrol negatif sebesar 7,21±0,26% dan kontrol positif sebesar 7,18±0,25% (Gambar 5).
Rasio konversi pakan (FCR) berbeda nyata antara perlakuan P1 dengan kedua kontrol. Nilai FCR terbaik diperoleh pada perlakuan P1 yaitu sebesar 1,11±0,08; kemudian diikuti oleh perlakuan P2 sebesar 1,22±0,17, perlakuan P3 sebesar 1,38±0,15; kemudian kontrol negatif sebesar 1,76±0,55 dan kontrol positif sebesar 1,73±0,24 (Gambar 6).
Pertumbuhan terbaik ditunjukkan oleh perlakuan P1. Hal ini menunjukkan bahwa pemberian sinbiotik berpengaruh terhadap peningkatan performa pertumbuhan udang. Lesmanawati (2013), melaporkan bahwa pemberian bakteri
Gambar 5. Laju pertumbuhan harian udang (LPH) selama 30 hari pemberian sinbiotik. Data (mean±SE) dengan huruf berbeda menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3: pemberian sinbiotik tujuh hari sekali.
b b a ab ab 0.00 1.00 2.00 3.00 4.00 5.00 6.00 7.00 8.00 K (-) K (+) P1 P2 P3 L P H (% ) Perlakuan
18
SKT-b melalui pakan pada udang vaname terbukti dapat meningkatan aktivitas enzim pencernaannya. Hal ini diperkuat oleh Wang (2007) bahwa meningkatnya pertumbuhan udang diduga disebabkan oleh meningkatkan aktivitas enzim pencernaan yang diinduksi oleh probiotik. Meningkatnya aktivitas enzim-enzim pencernaan (amilase dan protease) dapat meningkatkan efisiensi pakan sehingga dapat memperbaiki kecernaan pakan (Lesmanawati 2013).
Ai et al. (2011), melaporkan bahwa pemberian probiotik Bacillus subtilis dengan prebiotik fruktooligosakarida dapat meningkatkan laju pertumbuhan harian dan efisiensi pakan pada juvenil yellow croaker. Hal serupa juga telah dilaporkan oleh Daniels et al. (2010), pemberian Bacillus spp dan mannanoligosakarida (MOS) pada lobster (Homarus gammarus L) dapat meningkatkan performa pertumbuhan lobster. Menurut Zhang et al. (2012) pemberian MOS dapat menghasilkan struktur permukaan penyerapan mikrovili usus lebih luas dan hal ini memberikan potensi untuk meningkatkan pemanfaatan nutrisi dan kinerja pertumbuhan. Pemberian pakan sinbiotik memberikan perubahan fisiologis dan biologis dalam lingkungan gastrointestinal (GI) dan perubahan morfologi epitel GI (Daniels et al. 2010). Aplikasi sinbiotik dapat memaksimalkan pakan yang tertelan diubah lebih efektif menjadi protein struktural yang kemudian dapat meningkatkan pertumbuhan (Cerezuela et al. 2011).
Gambar 6. Rasio konversi pakan (FCR) selama 30 hari pemberian sinbiotik. Data (mean±SE) dengan huruf berbeda menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3: pemberian sinbiotik tujuh hari sekali.
a a b ab ab 0.00 0.50 1.00 1.50 2.00 2.50 K (-) K (+) P1 P2 P3 F C R Perlakuan
19
Respon Imun
Hemosit total (THC) udang sebelum uji tantang tidak berbeda nyata antara perlakuan sinbiotik, namun berbeda nyata antara perlakuan sinbiotik dengan kedua kontrol. Nilai THC pada kontrol sebesar 3,93x106±1,89 sel/ml dan 3,73x106±1,12 sel/ml, sedangkan pada perlakuan sinbiotik P1, P2, dan P3 berurut-turut sebesar 6,40x106±0,85 sel/ml; 6,80x106±0,70 sel/ml dan 6,92x106±0,84 sel/ml. Nilai THC udang setelah uji tantang berbeda signifikan antara P1 (6,45x106±1,18 sel/ml) dan kontrol positif (1,88x106±0,71 sel/ml) dan perlakuan sinbiotik lainnya yaitu P2 (1,08x106±0,22 sel/ml) dan P3 (1,13x106±0,34 sel/ml) (Gambar 7).
Pemberian sinbiotik dengan frekuensi berbeda selama 30 hari mampu meningkatkan nilai THC dibandingkan dengan kontrol. Hemosit udang memiliki kemampuan untuk berproliferasi, tingkat proliferasi tersebut dapat ditingkatkan dengan pemberian immunostimulan dan lipopolisakarida serta prebiotik (Sang et al. 2009). Hal ini menjelaskan meningkatnya jumlah THC pada udang yang diberikan sinbiotik. Hemosit memainkan peranan penting dalam sistem imun tubuh krustasea, karena hemosit dapat menghilangkan partikel asing yang masuk ke dalam tubuh (Hauton et al. 2012). Jumlah hemosit yang tinggi dalam darah udang dapat meminimalisir infeksi IMNV dan meningkatkan sintasan udang yang diinfeksi oleh IMNV (Lesmanawati 2013). THC setelah koinfeksi mengalami penurunan, penurunan jumlah hemosit merupakan efek dari berjalannya Gambar 7. Hemosit total (THC) udang (L. vannamei) sebelum uji tantang
(akhir perlakuan sinbiotik) dan setelah uji tantang. Data (mean±SE) dengan huruf berbeda pada warna yang sama menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3: pemberian sinbiotik tujuh hari sekali.
b b a a a a b a b b 0.00 1.00 2.00 3.00 4.00 5.00 6.00 7.00 8.00 K (-) K (+) P1 P2 P3 T H C ( x 10 6 m l -1 ) Perlakuan
20
mekanisme pertahanan tubuh terhadap serangan patogen (Costa et al. 2009; Smith et al. 2003).
Diferensial hemosit (DH) yang diamati adalah sel hialin dan sel granular. DH udang sebelum uji tantang tidak berbeda signifikan baik sel hialin (Gambar 8) maupun sel granular (Gambar 9). Nilai sel hialin sebelum uji tantang berturut-turut yaitu kontrol negatif (77,54% ±1,66); kontrol positif (75,14% ±7,16); P1 (69,42% ±12,63); P2 (65,91% ±6,77) dan P3 (64,73% ±16,14). Nilai sel granular sebelum uji tantang pada setiap perlakuan berturut-turut yaitu kontrol negatif (22,46% ±1,66); kontrol positif (24,86% ±7,16); P1 (30,58% ±12,63); P2 (34,08% ±6,77) dan P3 (35,26% ±16,14).
Nilai DH udang setelah uji tantang terdapat perbedaan yang signifikan antara perlakuan P1 dan P2 dengan kontrol negatif. Nilai sel hialin yang diperoleh yaitu kontrol negatif (61,48%±1,34); kontrol positif (52,31% ±6,89); P1 (42,57% ±3,01); P2 (41,99% ±9,71) dan P3 (52,21% ±4,33), sedangkan nilai sel granular yang diperoleh yaitu kontrol negatif (38,52% ±1,34); kontrol positif (47,69% ±6,89); P1 (57,43% ±3,01); P2 (58,01% ±9,71) dan P3 (47,78% ±4,33).
Hasil dari penelitian ini menunjukkan bahwa pemberian sinbiotik dengan frekuensi berbeda selama 30 hari tidak dapat meningkatkan jumlah sel hialin maupun sel granular udang. Menurut Hauton (2012), sel hialin memiliki peran dalam fagositosis sementara granular memiliki fungsi memproduksi melanin dan mengeluarkan peptide antimikroba dan terlibat dalam reaksi sitotoksik. Peningkatan sel granular terjadi setelah udang diberikan uji tantang dengan IMNV dan V. harveyi. Hal ini diduga terjadi karena adanya pengaruh dari infeksi patogen yang diberikan. Van De Braak et al. (2002), menjelaskan bahwa sel granular akan
Gambar 8. Sel hialin total udang (L. vannamei) sebelum uji tantang (akhir perlakuan sinbiotik) dan setelah uji tantang. Data (mean±SE) dengan huruf berbeda pada warna yang sama menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3: pemberian sinbiotik tujuh hari sekali.
a a a ab a a a b b ab 0.0 10.0 20.0 30.0 40.0 50.0 60.0 70.0 80.0 K (-) K (+) P1 P2 P3 S el h ial in ( x 10 6m l -1) Perlakuan
21
dilepaskan kembali ke dalam hemolim saat udang dalam kondisi stres, terluka atau terinfeksi oleh material asing.
Aktivitas phenoloxidase (PO) udang sebelum uji tantang berbeda signifikan antara P1 dan P2 dengan P3 dan kedua kontrol (Gambar 10). Nilai PO yang diperoleh pada perlakuan P1 dan P2 yaitu sebesar 1,07±0,15 dan 0,91±0,11. Setelah uji tantang PO terlihat berbeda secara signifikan antara P1 dengan kontrol positif dan P3, namun tidak menunjukkan perbedaan yang nyata dengan perlakuan P2. Nilai PO yang diperoleh pada perlakuan P1 dan P2 masing-masing sebesar 1,28±0,18 dan 0,97±0,42.
Aktivitas phenoloxidase memainkan fungsi penting dalam pertahanan kekebalan tubuh invertebrata termasuk udang, karena aktivitas phenoloxidase dapat mengaktifkan jalur sintesis melanin yang akan memproduksi sitotoksin yang dapat membunuh mikroorganisme patogen. Aktivitas phenoloxidase dan imunokompeten berkorelasi positif di berbagai invertebrata, dan organisme yang memiliki aktivitas phenoloxidase tinggi tidak rentan terhadap infeksi patogen (Zhang et al. 2012). Pada penelitian ini aktivitas phenoloxidase sebelum uji tantang tertinggi diperlihatkan oleh perlakuan P1 dan P2. Hal ini menunjukkan bahwa frekuensi pemberian sinbiotik berperan dalam proses pembentukan sistem imun pada udang sehingga dapat meningkatkan resistensi udang terhadap serangan patogen. Setelah uji tantang perlakuan P1 dan P2 juga berbeda signifikan dengan perlakuan P3. Hal ini menunjukan kestabilan respon imun pada perlakuan P1 dan P2 lebih baik dibandingkan dengan P3. Menurut Nayak (2010) perbedaan
Gambar 9. Sel granular total udang (L. vannamei) sebelum uji tantang (akhir perlakuan sinbiotik) dan setelah uji tantang. Data (mean±SE) dengan huruf berbeda pada warna yang sama menunjukkan berbeda nyata (p < 0,05) antar perlakuan. Keterangan: K(-): kontrol negatif; K(+): kontrol positif; P1: pemberian sinbiotik setiap hari; P2: pemberian sinbiotik tiga hari sekali; P3: pemberian sinbiotik tujuh hari sekali.
a a a a a b ab a a ab 0.0 10.0 20.0 30.0 40.0 50.0 60.0 K (-) K (+) P1 P2 P3 S el gr an u lar ( x 10 6m l -1) Perlakuan