SKRIPSI
PENINGKATANKANDUNGAN β-KAROTENDunaliella salinaAKIBAT PEMBERIAN INTENSITAS CAHAYA YANG BERBEDA
Oleh: NOVI SUGIATI
JOMBANG–JAWA TIMUR
FAKULTAS PERIKANAN DAN KELAUTAN UNIVERSITAS AIRLANGGA
SKRIPSI
PENINGKATAN KANDUNGAN β-KAROTENDunaliella salinaAKIBAT PEMBERIAN INTENSITAS CAHAYA YANG BERBEDA
Oleh :
NOVI SUGIATI NIM. 141111090
Telah diujikan pada Tanggal : 9 Juni 2016
KOMISI PENGUJI SKRIPSI
Ketua : Dr. Woro Hastuti Satyantini, Ir., M.Si. Anggota : Sapto Andriyono, S.Pi., M.T.
Sudarno, Ir. M.kes.
Dr. Endang Dewi Masithah, Ir., M.P. Wahju Tjahjaningsih, Ir., M.Kes.
Surabaya, 18 Agustus 2016 Fakultas Perikanan dan Kelautan
Universitas Airlangga Dekan,
RINGKASAN
NOVI SUGIATI. Peningkatan Kandungan β-Karoten Dunaliella salina Akibat Pemberian Intensitas Cahaya yang Berbeda. Dosen Pembimbing : Dr. Endang Dewi Masithah, Ir., M.P. dan Wahju Tjahjaningsih, Ir., M.Si.
Dunaliella salina merupakan alga hijau uniseluler dari kelas Chlorophyta yang dapat tumbuh pada berbagai kondisi lingkungan seperti suhu rendah, salinitas, pH, dan cahaya yang tinggi. Dunaliella salina merupakan salah satu contoh sumber alami β-karoten dan memiliki sel yang lebih besar dibandingkan dengan genus Dunaliella lain, sehingga mampu menghasilkan β-karoten lebih banyak. Dunaliella salina mampu mengakumulasi kandungan β-karoten lebih banyak saat dikultur dalam kondisi stres lingkungan seperti salinitas tinggi, nutrisi rendah dan cahaya yang tinggi. β-karoten banyak digunakan dalam industri makanan, sebagai pewarna aditif dalam budidaya perikanan dan sebagai antioksidan dalam bidang kesehatan.
Penelitian ini bertujuan untuk mengetahui peningkatan kandungan
β-karoten pada D. salina akibat intensitas cahaya yang berbeda dan untuk
mengetahui intensitas cahaya terbaik yang dapat menghasilkan kandungan
β-karoten tertinggi pada D. salina. Metode penelitian yang digunakan adalah
metode eksperimental dengan Rancangan Acak Lengkap (RAL) dan hasil penelitian dianalisis secara deskriptif.Perlakuan yang digunakan adalah intensitas cahaya yang berbeda, yaitu A (700 lux), B (2.200 lux), C (3.700 lux) dan
D (5.200 lux) dengan lima ulangan pada setiap perlakuan. Parameter utama yang
diamati adalah kandungan β-karoten D. salina. Parameter pendukung yang diamati adalah pertumbuhan kepadatan sel D. salinadan kualitas air seperti suhu, pH, dan salinitas.
SUMMARY
NOVI SUGIATI. TheIncrease β-Carotene Content on Dunaliella salina with Different Light Intensity Treatment. Academic Advisor : Dr. Endang Dewi Masithah, Ir., M.P. and Wahju Tjahjaningsih, Ir., M.Si.
Dunaliella salina has unicellular’s green alga from class of Chlorophyta’s which grow on a variety of environmental conditions such as low temperature, salinity, pH, and high light. Dunaliella salina is one of example from natural source of β-carotene and a larger cell than the other of genus Dunaliella, so it be able to produce high β-carotene. Dunaliella salina able to accumulate more β-carotene content when cultured in environmental stress conditions such as high salinity, low nutrients and high light. β-carotene many used in the food industry, as a colorant additives in aquaculture and as an antioxidant in health.
This study aim to know the increaseβ-carotene content onD. salinaeffect from aplication difference light intensities and to know the maximal light intensity to obtain the highest β-carotene content in D. salina. The research method was experimental with completely randomized design (CRD) with deskriptive analysis. The treatments used different light intensities, namely A (700 lux), B (2.200 lux), C (3.700 lux) and D (5.200 lux) with five repetitions in each treatment. The primary parameter be measured, was β-carotene content of
D. salina. Supported parameter in this research was the growth of D. salina and water quality such as temperature, pH, and salinity.
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan rahmat, karunia serta izin-Nya, sehingga penulis dapat
menyelesaikan Skripsi tentang Pengaruh Intensitas Cahaya yang Berbeda Terhadap Kandungan β-Karoten Dunaliella salina. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh Gelar Sarjana Perikanan pada Program Studi S-1 Budidaya Perairan, Fakultas Perikanan dan Kelautan Universitas Airlangga Surabaya.
Penulis menyadari bahwa Skripsi ini tidak luput dari kesalahan, sehingga penulis sangat mengharapkan kritik dan saran yang membangun agar kami dapat memperbaiki kesalahan pada karya tulis selanjutnya. Penulis berharap semoga Skripsi ini bermanfaat dan dapat memberikan informasi kepada semua pihak, khususnya bagi Mahasiswa Program Studi Budidaya Perairan, Fakultas Perikanan dan Kelautan Universitas Airlangga Surabaya guna kemajuan serta perkembangan ilmu dan teknologi dalam bidang perikanan, terutama budidaya perairan.
Surabaya, 18 Agustus 2016
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih yang tak terhingga kepada:
1. Dr. Mirni Lamid, drh., M.P., Dekan Fakultas Perikanan dan Kelautan Universitas Airlangga, Surabaya;
2. Ibu Dr. Endang Dewi Masithah, Ir., M.P. dan Ibu Wahju Tjahjaningsih, Ir., M.Si. Dosen Pembimbing yang telah memberi bimbingan, nasehat dan ilmu mulai dari penyusunan proposal hingga Skripsi ini selesai;
3. Ibu Dr. Woro Hastuti Satyantini, Ir. M.Si., Bapak Sapto Andriyono, S.Pi., M.T. dan Bapak Sudarno, Ir. M.Kes., Dosen Penguji yang memberikan evaluasi dan arahan hingga Skripsi ini selesai;
4. Bapak Agustono, Ir., M.Kes., Koordinator Skripsi, dan Staf Kemahasiswaan yang membantu dalam alur penyelesaian Skripsi;
5. Bapak Kustiawan Tri Pursetyo, S.Pi., M.Vet., Dosen Wali yang telah memberikan bimbingan dan dukungan dalam hal akademik;
6. Bapak Annur Ahadi Abdillah, S.Pi., M.Si., Dosen yang banyak membantu hingga Skripsi ini selesai;
7. Kedua orang tua Bapak Sugiyan, Ibu Warti, Randa Wipiyanto, A.Md. Pi. serta kakak-kakakku yang telah memberikan kasih sayang dan dukungan moril dalam pelaksanaan hingga Skripsi ini selesai;
8. Teman-teman kos dan teman-teman angkatan 2011 Fakultas Perikanan dan Kelautan. Terima kasih atas bantuan dan semangat dalam menyelesaikan Skripsi ini;
DAFTAR ISI
2.1.1 Klasifikasi dan Morfologi ... 5
2.1.2 Habitat... 6
2.1.3 Reproduksi Sel ………... 6
2.1.4 Pertumbuhan ………... 8
2.1.3 Faktor-faktor yang Mempengaruhi Pertumbuhan... 9
2.2 β-Karoten ... 11
2.2.1 Pengertianβ-Karoten………... 11
2.2.2 Proses Pembentukan ………... 12
3.2 Hipotesis ... 16
IV METODOLOGI ... 18
4.1 Tempat dan Waktu Penelitian ... 18
4.2 Materi Penelitian ... 18
4.2.1 Alat Penelitian ... 18
4.2.2 Bahan Penelitian ... 18
4.3 Metode Penelitian ... 19
4.3.1 Rancangan Penelitian ... 19
4.3.2 Prosedur Kerja ... ... 21
4.4 Parameter ... 26
4.4.1 Parameter Utama... 26
4.4.2 Parameter Penunjang ... 27
4.5 Analisis Data ... 27
V HASIL DAN PEMBAHASAN ... 28
5.1 Hasil ... 28
5.1.1 Kandungan β-KarotenD. salina ... 28
5.1.2 PertumbuhanD. salina... 29
5.1.3 Kualitas Air ... 31
5.2 Pembahasan ... 33
VI KESIMPULAN DAN SARAN ... 42
6.1 Kesimpulan ... 42
6.2 Saran ... 42
DAFTAR PUSTAKA ... 43
DAFTAR TABEL
Tabel Halaman
DAFTAR GAMBAR
Gambar Halaman
1. Struktur SelD. salina... 6
2. Reproduksi SelD. salinadengan Pembentukan Zigot Baru... 7
3. Pola Pertumbuhan Fitoplankton... 9
4. Strukturβ-karoten ... 12
5. Proses Pembentukan β-karoten ... 13
6. Mekanisme SelDunalielladalam Merespon Cahaya dan Nutrisi ... 14
7. Kerangka Konseptual Penelitian ... 16
8. Diagram Alir Penelitian ... 20
9. Grafik Kandungan β-karotenD. salinaselama Penelitian... 29
DAFTAR LAMPIRAN
Lampiran Halaman
1. Kandungan β-KarotenD. salina... ... 48
2. Data Pertumbuhan Kepadatan Sel D. salina... 50
3. Data Rata-rata Kualitas Air ... 52
I PENDAHULUAN
1.1 Latar Belakang
Organisme fotosintetik memiliki pigmen organik yang berperan dalam
proses fotosintesis. Klorofil, karotenoid dan fikobilin merupakan tiga kelas utama
dari pigmen yang dimiliki oleh organisme fotosintetik. Klorofil dan karotenoid
memiliki sifat lipofilik sedangkan fikobilin memiliki sifat hidrofilik (Masojideket
al., 2004). Karotenoid berasal dari kelas terpenoid, berupa rantai poliena dengan
40 karbon yang diakhiri oleh kelompok cincin siklik sehingga menunjukkan
struktur khas molekul karotenoid (Del Campo et al., 2007). Karotenoid secara
umum ditemukan pada tumbuhan, alga, bakteri fotosintetik, bakteri non
fotosintetik, jamur dan kapang (Karnjanawipagul et al., 2010). Lebih dari 400
karotenoid ditemukan di alam dan β-karoten merupakan karoten yang paling
banyak dikomersialkan (PisalandLele, 2005).
Gupta et al. (2007) mengatakan bahwa terdapat dua macam karotenoid
yang digunakan dalam budidaya perairan yaitu sintetik dan alami. Karotenoid
sintetik jika digunakan secara berlebihan dapat menyebabkan kerusakan
lingkungan. Harga karotenoid sintetik yang mahal juga menyebabkan penggunaan
dalam formula pakan ikan dibatasi. Menurut Abu-Rezq et al. (2010), harga
β-karoten sintetik yang mahal menyebabkan beralihnya penggunaan β-karoten
secara alami.
β-karoten merupakan senyawa hidrokarbon (C40H56) dengan ikatan rantai jenuh yang menghasilkan warna orange dan memiliki dua isomer yaitu trans dan
penangkal radikal bebas (Marchal et al., 2013). Menurut Jeffrey and Egeland
(2009), β-karoten secara komersial dapat disintesis dari ekstraksi sumber alami.
Dunaliella salina merupakan contoh sumber alamiβ-karoten. Menurut Pisal and
Lele (2005) β-karoten banyak digunakan sebagai anti kanker, pencegah penuaan dini dan imunomodulator. Jeffrey and Egeland (2009), menambahkan bahwa
β-karoten digunakan dalam industri makanan, sebagai pewarna aditif dalam
budidaya perikanan dan sebagai antioksidan dalam bidang kesehatan.
Menurut Pisal and Lele (2005) D. salina memiliki beberapa keuntungan
dibandingkan dengan sumber β-karoten alami lain. Keuntungan tersebut antara lain D. salina lebih mudah dibudidayakan secara kontinyu karena waktu kultur
lebih singkat dan tingkat pertumbuhan sel lebih cepat. Sel D. salina juga mudah
dibudidayakan karena lebih tahan terhadap perubahan kondisi lingkungan,
sehingga ketersediaan sumber β-karoten secara kontinyu dapat terpenuhi. Rizky
dkk. (2012) menambahkan bahwa fitoplankton kaya nutrien antara lain asam
lemak omega 3 dan 6, asam amino esensial dan karoten. Keunggulan lain dari
fitoplankton adalah tidak tergantung pada iklim dan cuaca, waktu tumbuh cepat
sehingga dapat dipanen dalam waktu yang tidak terlalu lama, dapat diproduksi
terus-menerus, tidak menyebabkan dampak buruk bagi lingkungan, serta produksi
dapat dikendalikan sesuai dengan kebutuhan.
Menurut Zainuri dkk. (2006), sebuah isolat lokal spesies alga dari Balai
Budidaya Air Payau (BBAP) Jepara yaitu D. salina, memiliki potensi sumber
kondisi lingkungan seperti suhu rendah, salinitas, pH, dan cahaya yang tinggi
(Polle and Qin, 2009). Dunaliella salina mampu mengakumulasi konsentrasi
β-karoten lebih banyak saat dikultur dalam kondisi stres lingkungan (De-Fretes et
al., 2012).
Menurut Hu (2004), intensitas cahaya akan mempengaruhi respon seluler
selD. salinayaitu klorofil dan pigmen lain akan meningkat seperti fikobiliprotein
serta β-karoten sebagai bentuk pertahanan diri. Hasil penelitian El-Baky et al.
(2007), menunjukkan bahwa saat dikultur dalam kondisi stres salinitas dan
dikombinasikan dengan tingkat nitrogen rendah D. salina mampu menghasilkan
60,4%β-karoten dari total karotenoid.
Berdasarkan hal diatas, maka dilakukan penelitian untuk mengetahui
peningkatan kandungan β-karoten akibat intensitas cahaya yang berbeda serta mengetahui intensitas cahaya yang optimal untuk pembentukan β-karoten
D. salina.
1.2 Perumusan Masalah
1. Apakah perbedaan intensitas cahaya dapat meningkatkan kandungan
β-karoten padaD. salina?
2. Berapakah intensitas cahaya terbaik untuk menghasilkan kandungan
β-karoten tertinggi padaD. salina?
1.3 Tujuan
1. Untuk mengetahui peningkatan kandungan β-karoten pada D. salina akibat
2. Untuk mengetahui intensitas cahaya terbaik yang dapat menghasilkan
kandungan β-karoten tertinggi padaD. salina.
1.4 Manfaat
1. Untuk memberikan informasi ilmiah mengenai peningkatan kandungan
β-karotenD. salinaakibat intensitas cahaya yang berbeda.
2. Untuk memberikan informasi ilmiah mengenai nilai intensitas cahaya terbaik
II TINJAUAN PUSTAKA
2.1 Dunaliella salina
2.1.1 Klasifikasi dan Morfologi
Klasifikasi D. salina menurut Shaktivel et al. (2011) adalah sebagai
berikut:
Kingdom : Plantae Phylum : Chlorophyta Class : Chlorophyceae Order : Volvocales Family : Dunaliellaceae Genus :Dunaliella
Species :Dunaliella salina
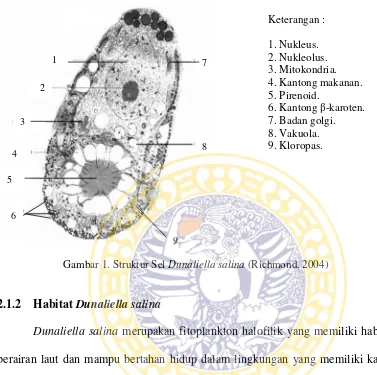
Dunaliella salina merupakan alga hijau uniseluler dari kelas Chlorophyta
(Oren, 2005). Sel D. salina memiliki panjang 5-29 µm dan lebar 4-20 µm
(Posudin et al., 2010). SelD. salina memiliki bentuk bervariasi yaitu elips, bulat
telur dan silinder tergantung kondisi lingkungan tertentu. Dunaliella salina
mempunyai dua flagela sama panjang yang terletak pada bagian anterior (Polle
and Ben-Amotz, 2009). Dunaliella salina mempunyai struktur sel yang terdiri
dari kloropas, pyrenoid, vakuola, nukleus, nukleolus dan badan golgi serta
memiliki bintik mata pada bagian anterior (Polle and Ben-Amotz, 2009).
Dunaliella salina memiliki sel yang lebih besar dibandingkan dengan genus
Dunaliella lain, sehingga mampu memproduksi β-karoten lebih banyak (Oren, 2005). Dunaliella salina bersifat halofilik, mempunyai sebuah central pyrenoid
dan memiliki kloropas berbentuk melengkung, mengandung banyak β-karoten
Borowitzka, 1989 ; Borowitzka and Siva, 2007). Gambar struktur sel D. salina
dapat dilihat pada Gambar 1.
Gambar 1. Struktur SelDunaliella salina(Richmond, 2004)
2.1.2 HabitatDunaliella salina
Dunaliella salina merupakan fitoplankton halofilik yang memiliki habitat
perairan laut dan mampu bertahan hidup dalam lingkungan yang memiliki kadar
garam tinggi (Polle and Qin, 2004). Chen (1994) menyatakan bahwa salinitas
optimal bagi pertumbuhan D. salina adalah 20-35 ppt. Juneja et al. (2013)
menyatakan bahwa D. salina dapat tumbuh pada suhu 25-40oC. Borowitzka and
Borowitzka (1989) menyatakan bahwa pertumbuhan normalD. salinaadalah pada
intensitas cahaya 1.200-2.200 lux. Menurut Boyd (2011), pH 6-9 merupakan
2.1.3 Reproduksi SelDunaliella salina
Dunaliella salina dapat bereproduksi dengan dua cara yaitu seksual dan
aseksual (Zainuri et al., 2006). Reproduksi seksual dapat terjadi sebagai respon
dari perubahan lingkungan ekstrim seperti nutrisi yang rendah melalui proses
gametogenesis dengan memproduksi isogamet yang terlihat seperti zoospora
(Polle and Qin, 2009). Reproduksi seksual D. salina terjadi dengan cara
melakukan isogami, selama pekembangan zigot akan terjadi pembelahan secara
meiosis. Zigot berwarna merah atau hijau memiliki endomembran yang halus dan
sangat tipis (Shariati and Hadi, 2011). Zigot akan membelah secara meiosis
setelah tahap istirahat dan akan membentuk lebih dari 16 sel yang dibebaskan
melalui celah pada dinding sel induk (Polle and Qin, 2009). Zigot kemudian
membelah hingga 32 sel anak haploid melalui celah pada dinding sel induk (Oren,
2005). ReproduksiD. salinasecara seksual dapat dilihat pada Gambar 2.
Gambar 2. Reproduksi SelD. salinadengan Pembentukan Zigot Baru (Oren, 2005).
Sel D. salina mengalami pembelahan sel secara longitudinal pada
reproduksi aseksual. Reproduksi aseksual terjadi hingga dua jam. Proses
memiliki pyrenoid dan sepasang flagela. Inti sel yang telah meiliki pyrenoid dan
flagela kemudian mengalami pembelahan. Sel hasil pembelahan tersebut masih
melekat pada bagian anterior dan posterior yang dihubungkan oleh membran
plasma. Membran plasma akan lepas dan kedua sel anak baru akan terpisah
menjadi dua sel anakan (PolleandQin, 2009).
2.1.4 PertumbuhanDunaliella salina
Menurut Lavens and Sorgeloos (1996), pertumbuhan fitoplankton dibagi
menjadi beberapa fase yaitu fase lag, fase eksponensial, fase berkurangnya
pertumbuhan relatif, fase stasioner, dan fase kematian.
1. FaseLag
Pertumbuhan fitoplankton pada fase ini dikaitkan dengan adaptasi
fisiologis metabolisme sel pertumbuhan fitoplankton, seperti peningkatan kadar
enzim dan metabolit yang terlibat dalam pembelahan sel dan fiksasi karbon.
2. Fase Eksponensial
Fase eksponensial ditandai dengan sel fitoplankton telah mengalami
pembelahan dan laju pertumbuhan relatif tetap. Pertumbuhan fitoplankton dapat
maksimal tergantung pada spesies alga, nutrien, intensitas cahaya, dan temperatur.
3. Fase Berkurangnya Pertumbuhan Relatif
Pertumbuhan sel mulai melambat karena faktor kimia dan fisika seperti
4. Fase Stasioner
Fase stasioner ditandai dengan kematian fitoplankton hampir sama
dengan laju pertumbuhan sehingga kepadatan fitoplankton pada fase ini relatif
konstan.
5. Fase Kematian
Fase kematian ditandai dengan kualitas air menurun dan nutrien habis
sehingga tidak mampu menyokong kehidupan fitoplankton. Kepadatan sel
menurun dengan cepat karena laju kematian fitoplankton lebih tinggi daripada laju
pertumbuhan hingga kultur berakhir.
Grafik pola pertumbuhan fitoplankton dapat dilihat pada Gambar 3.
Gambar 3. Pola Pertumbuhan Fitoplankton (LavensandSorgeloos, 1996).
2.1.5 Faktor-Faktor yang Mempengaruhi Pertumbuhan Dunaliella salina A. Suhu
Dunaliella salina dapat bertahan pada suhu rendah hingga di bawah titik
beku dan bersifat mematikan pada suhu di atas 40oC (Isnansetyo dan
Kuarniastuty, 1998). Juneja et al. (2013) menyatakan bahwa D. salina dapat
tumbuh pada suhu 25-40oC.
Keterangan: 1. Faselag
2. Fase logaritmik/eksponensial 3. Fase berkurangnya pertumbuhan
relatif
B. Cahaya
Ben-Amotz (2004) menyatakan bahwa Dunaliella memiliki respon yang
berbeda terhadap cahaya dan mengalami pertumbuhan yang lambat pada
intensitas cahaya yang terlalu tinggi. Borowitzka and Borowitzka (1989)
menyatakan bahwa pertumbuhan normal D. salina adalah pada intensitas cahaya
1.200-2.200 lux.
C. Salinitas
Dunaliella salina merupakan fitoplankton halofilik yang mampu bertahan
hidup dalam lingkungan yang memiliki kadar garam tinggi (Polle and
Ben-Amotz, 2004). Konsentrasi salinitas yang tinggi di lingkungan kultur dapat
menjadikan sel D. salina bersifat hipotonik sehingga terjadi penyusutan sel,
sedangkan pada konsentrasi salinitas yang rendah maka akan bersifat hipertonik
atau sel D. salina mengalami pengembangan (Pisal and Lele, 2004). Chen and
Durbin (1994) menyatakan bahwa salinitas optimal bagi pertumbuhan D. salina
adalah 20-35 ppt.
D. Derajat Keasaman (pH)
pH didefinisikan sebagai negatif logaritma konsentrasi ion hidrogrn dalam
air atau tingkat keasaman dan kebasaan dalam air (Edhy dkk., 2010). Menurut
Boyd (2011), pH 6-9 merupakan kisaran pH terbaik untuk pertumbuhan
fitoplankton.
E. Kebutuhan Nutrien
makro yang dibutuhkan oleh fitoplankton yaitu karbon (C), nitrogen (N), fosfor
(P), sulfur (S), kalium (K), natrium (Na), besi (Fe), magnesium (Mg), kalsium
(Ca). Unsur hara mikro yang dibutuhkan yaitu boron (B), tembaga (Cu), mangan
(Mn), zink (Zn), molibdenum (Mo), kobalt (Co), vanadium (V), selenium (Se) dan
lain-lain (Grobbelaar, 2004).
2.2 β-Karoten
2.2.1 Pengertianβ-Karoten
Karotenoid berasal dari kelas terpenoid, berupa rantai poliena dengan 40
karbon yang dibentuk dari delapan unit isoprena C5 yang menunjukkan struktur
khas molekul karotenoid (Del-Campo et al., 2007). Karotenoid dikelompokkan
menjadi dua yaitu karoten yang merupakan kelompok hidrokarbon (C40H56) dan
xantofil yang merupakan turunan karoten teroksigenasi (Gross, 1991 dalam de
Fretes et al., 2012). Lebih dari 400 karotenoid ditemukan di alam dan β-karoten
merupakan karoten yang paling banyak dikomersialkan (Pisal and Lele, 2005).
β-karoten ditemukan terakumulasi dalamoil globulepada tilakoid yang ada dalam kloroplas dan terdiri dari dua isomer yaitu all-trans dan 9-cis β-karoten (Kleinegriset al., 2010).
β-karoten memiliki rumus C40H56 dengan berat molekul 536,9 (Shariati and Hadi, 2011) memiliki ikatan rantai jenuh yang menghasilkan warna orange
dan memiliki isomer yang berbeda yaitu trans dan cis. Molekul ini berperan
secara fisiologis sebagai provitamin A dan penangkal radikal bebas (Leon et al.,
2003). Cincin β dari β-karoten dapat diubah menjadi vitamin A di dalam tubuh
molekul retinal akan direduksi menjadi retinol yang merupakan vitamin A
(Lindqvist and Andersson, 2002). β-karoten pada D. salina memiliki dua fungsi
yang berbeda. Fungsi yang pertama berperan dalam transfer energi ke klorofil
dalam proses fotosintesis dan fungsi kedua sebagai perlindungan sel terhadap
oksidasi akibat kondisi lingkungan yang ekstrim (Hejazi and Wijffel, 2003).
Gambar strukturβ-karoten dapat dilihat pada Gambar 4.
Gambar 4. Strukturβ-karoten (Haekalet al., 2013)
2.2.2 Proses Pembentukanβ-karoten
β-karoten ditemukan terakumulasi dalam oil globule pada tilakoid yang ada dalam kloroplas dan terdiri dari dua isomer yaituall-transdan9-cisβ-karoten
(Kleinegris et al., 2011). Semua organisme hidup yang mengandung senyawa
isoprenoid akan mensintesis isopentenil difosfat (IPP) dan difosfat dimethylallyl
(DMAPP) melalui jalur plastidial 2-c-metil-d-erythritol-4-fosfat (MEP). Jalur
MEP yang terjadi di plastida akan mensintesis isopentenil difosfat (IPP),
kemudian akan terjadi tiga reaksi yang dikatalisasi oleh prenyltransferase dan
mengarah pada pembentukan geranylgeranyl difosfat (GGPP) yang merupakan
Gambar 5. Proses Pembentukanβ-karoten (StangeandFlores, 2012) Biosintesis karotenoid terdiri dari kondensasi dua molekul GGPP (C20)
menjadi phytoene dengan bantuan enzim sintase phytoene (PSY). Phytoene
kemudian akan mengalami reaksi desaturasi oleh enzim phytoene desaturase
(PDS) yang mengkatalis terbentuknya 9,15,9’-tri-cis-ζ-karoten. Desaturase pertama akan menghasilkan 9,9’-di-cis- ζ-karoten dengan bantuan enzim karoten
isomerase (Z-ISO). Desaturase kedua akan menghasilkan 7,9,9’-cis-neurosporene
dan 7',9'-cis-likopen dengan bantuan enzim desaturase (ZDS). Carotene somerase
(CRTISO) akan mengkatalis terbentuknya all-trans likopen. Likopen akan
mengalami dua reaksi siklase yaitu oleh enzim β-siklase (βLCY) yang dapat
menghasilkan β-karoten dan enzim ε-siklase (εLCY) dapat menghasilkan
α-karoten (StangeandFlores, 2012).
2.3 ResponDunaliella salinaTerhadap Cahaya
Menurut Hu (2004), cahaya akan mempengaruhi respon seluler sel
serta karotenoid. Intensitas cahaya tinggi akan menyebabkan peningkatan pigmen
lain seperti zeaxanthin,β-karoten dan astaxanthin sebagai bentuk pertahanan diri.
Cahaya akan melakukan aktivasi jalur transduksi pada membran plasma
selDunaliella, sehingga akan mengubah susunan ekspresi gen dalam nukleus dan
sitoplasma. Produk dari gen ini akan dikirim ke kloroplas sehingga dapat
menyebabkan peningkatan lipid dan produksi karotenoid (Ramoset al., 2011). Sel
Dunalielladalam merespon cahaya dan nutrisi dapat dilihat pada Gambar 6.
III KONSEPTUAL PENELITIAN DAN HIPOTESIS
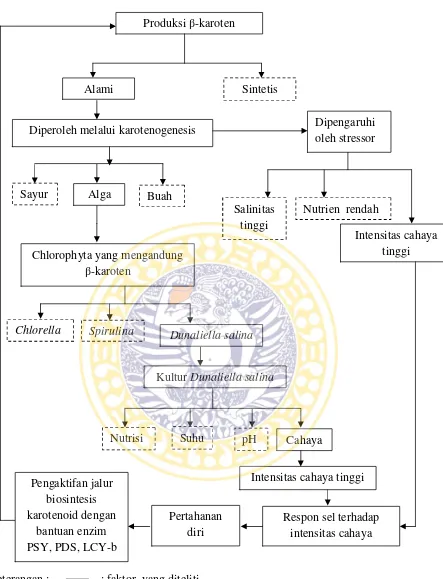
3.1 Kerangka Konseptual
Karotenoid merupakan kelompok isoprenoid dengan 40 atom karbon yang
terdiri dari karoten dan turunan oksigen yaitu xantofil. Karotenoid merupakan
pigmen sekunder dari organisme fotosintetik yang memiliki peran penting sebagai
antioksidan dan sebagai provitamin A (Leon et al., 2003). Lebih dari 400
karotenoid ditemukan di alam dan β-karoten merupakan karoten yang paling
banyak dikomersialkan (Pisal and Lele, 2005). β-karoten merupakan bagian dari karotenoid yang merupakan senyawa hidrokarbon (C40H56) dengan berat molekul
536,9 (Shariati and Hadi, 2011). Menurut Polle and Qin (2004),β-karoten dapat disintesis dari ekstraksi sumber alami. Dunaliella salina dan D. bardawil
merupakan contoh sumber alami β-karoten terbesar. β-karoten digunakan dalam
industri makanan, sebagai pewarna aditif dalam budidaya perikanan dan sebagai
antioksidan dalam bidang kesehatan.
Menurut Zainuri dkk. (2006), sebuah isolat lokal spesies alga dari Balai
Budidaya Air Payau (BBAP) Jepara yaitu D. salina, memiliki potensi sumber
karotenoid sebagai feed additive atau feed suplemen dalam budidaya ikan.
Menurut Kusumaningrum dan Zainuri (2014), β-karoten pada D. salina akan meningkat selama fase stasioner karenaβ-karoten yang dihasilkan akan digunakan
untuk bertahan hidup bagi fitoplankton ini. Dunaliella salina memiliki dua jenis
β-karoten yaitu all-trans β-karoten dan 9-cis- β-karoten. All-trans β-karoten disintesis secara bersamaan dengan pembentukan klorofil sedangkan 9- cis
kloroplas. 9-cis-β-karoten yang tersimpan dalam lapisan lipid akan digunakan
sebagai pertahanan diri ketika terjadi perubahan lingkungan terutama perubahan
salinitas dan cahaya. Menurut De-Fretes et al. (2012) Dunaliella salina mampu
mengakumulasi konsentrasi β-karoten sangat tinggi saat dikultur dalam kondisi
stres. Cahaya memegang peranan penting pada jalur biosintesis karotenoid
(Kusumaningrum dan Zainuri, 2014). Cahaya akan melakukan aktivasi jalur
transduksi pada membran plasma selD. salina, sehingga akan mengubah susunan
ekspresi gen dalam nukleus dan sitoplasma. Hasil susunan gen ini akan dikirim ke
kloroplas sehingga dapat menyebabkan peningkatan produksi karotenoid (Ramos
et al., 2011). Stres lingkungan seperti nutrisi rendah, cahaya tinggi dan salinitas
berpengaruh terhadap ekspresi enzim phytoene synthase (PSY), phytoene
desaturase (PDS) dan lycopene β-cyclase (LCY-b) yang akan meningkatkan
akumulasi β-karoten pada mikroalga ini (Ramoset al., 2009).
3.2 Hipotesis
H1 : Perbedaan intensitas cahaya dapat meningkatkan kandunganβ-karoten pada
D. salina.
IV METODOLOGI
4.1 Tempat dan Waktu
Penelitian ini dilaksanakan di Laboratorium Pendidikan Fakultas
Perikanan dan Kelautan, Universitas Airlangga, Surabaya pada bulan September
2015.
4.2 Materi Penelitian 4.2.1 Alat Penelitian
Alat-alat yang digunakan pada penelitian ini adalah tabung kaca, selang
aerator, aerator, tabung reaksi, rak tabung reaksi, gelas ukur, pipet tetes, mikro
pipet, mikroskop binokuler, haemocytometer, hand counter, spektrofotometer,
lampu flourescent 40 Watt, rak kultur, refraktometer, pH meter, lux meter,
autoclave, cover glass, kertas label, vortex, centrifuge, gunting, cuvet, plastik
gelap,sterofoam, dan alumunium foil.
4.2.2 Bahan Penelitian
Bahan-bahan yang digunakan pada penelitian ini adalah bibit D. salina
dan medium Walne yang berasal dari Balai Budidaya Air Payau (BBAP)
Situbondo, air laut, kertas perkamen (pembungkus alat saat proses autoclave),
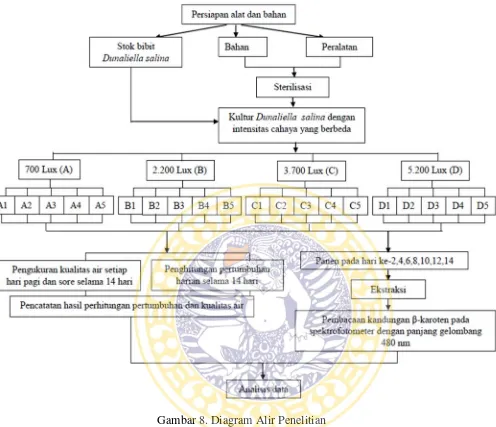
4.3 Metode Penelitian 4.3.1 Rancangan Penelitian
Metode penelitian digunakan untuk memecahkan suatu masalah yang
dapat dilakukan dengan pengumpulan data melalui pengamatan, survei, ataupun
melalui percobaan (Kusriningrum, 2012). Metode yang digunakan dalam
penelitian ini adalah metode eksperimental (true eksperimental) dengan
Rancangan Acak Lengkap (RAL). Perlakuan pada penelitian ini terdiri dari empat
perlakuan dengan lima kali ulangan sehingga terdapat 20 satuan percobaan.
Perlakuan yang diberikan pada penelitian ini adalah perbedaan intensitas
cahaya pada kultur D. salina. Intensitas cahaya yang diberikan adalah 700 lux
(A), 2.200 lux (B), 3.700 lux (C) dan 5.200 lux (D), masing-masing perlakuan
terdiri dari lima ulangan. Perbedaan perlakuan intensitas cahaya diperoleh
berdasarkan Borowitzka and Borowitzka (1989) yang menyatakan bahwa
pertumbuhan normal D. salinaadalah pada intensitas cahaya 1.200-2.200 lux.
Variabel yang digunakan dalam penelitian ini terdiri dari tiga variabel
yaitu variabel bebas, variabel terikat dan variabel kontrol. Variabel bebas pada
penelitian ini adalah perbedaan intensitas cahaya, sedangkan variabel terikat
Diagram alir penelitian dapat dilihat pada Gambar 8.
4.3.2 Prosedur Kerja
A. Persiapan dan Pengaturan Intesitas Cahaya
Medium kultur yang digunakan adalah medium Walne yang diperoleh dari
Balai Budidaya Air Payau (BBAP) Situbondo. Terdapat 20 satuan percobaan
sehingga dibutuhkan 20 tabung kaca. Ruang kultur dipersiapkan dengan
memasang rak kultur dan setiap bagian sisi ditutup dengan plastik gelap.
Perlakuan pencahayaan diperoleh dari lampu flourescent 40 Watt yang
ditempatkan pada rak kultur. Nilai intensitas cahaya pada perlakuan diperoleh dari
jarak antara lampu dengan botol media kultur. Menurut Kawaroe dkk. (2009),
pengukuran intensitas cahaya dapat dilakukan dengan menggunakan lux meter.
Pengukuran intensitas cahaya dilakukan dengan cara menghadapkan lensa sensor
lux meter pada lampu hingga jarum skala pada lux meter menunjukkan angka
yang dikehendaki.
B. Sterilisasi
Sterilisasi dilakukan untuk membunuh kontaminan yang dapat
mengganggu pertumbuhan D. salina. Sterilisasi yang dilakukan pada penelitian
ini meliputi sterilisasi peralatan, bahan dan rak kultur.
Menurut Masithah dkk. (2011), sterilisasi alat dan air laut dimaksudkan
untuk menghindari kontaminasi mikroorganisme lain. Peralatan yang akan
digunakan dicuci sampai bersih dan dibilas dengan air tawar kemudian peralatan
dikeringkan di bawah sinar matahari. Peralatan yang akan digunakan untuk kultur
Sterilisasi dengan autoclave dilakukan untuk peralatan yang terbuat dari kaca
tahan panas.
Menurut Isnansetyo dan Kurniastuty (1995), sterilisasi media dapat
menggunakan autoclave. Sterilisasi media dilakukan dengan cara memasukkan
media air laut ke dalam botol kaca kemudian ditutup menggunakan kapas yang
dilapisi kain kasa dan alumunium foil. Botol kaca yang berisi media disterilisasi
menggunakanautoclave pada suhu 121ºC selama 15 menit. Menurut Hendaryono
dan Wijayanti (1994), sterilisasi rak kultur D. salina dilakukan dengan
membersihkan ruang kultur kemudian dilakukan penyemprotan alkohol 90%
menggunakanhand-sprayer.
C. Persiapan Pupuk untuk KulturDunaliella salina
Pupuk yang digunakan sebagai media kultur skala laboratorium adalah
pupuk Walne yang diperoleh dari Balai Budidaya Air Payau (BBAP) Situbondo.
Menurut Isnansetyo dan Kurniastuty (1998), komposisi pupuk Walne adalah
Na2EDTA 45 gr, NaH2PO4.H2O 20 gr, FeCl3.6H2O 1,5 gr, H3BO333,6 gr, MnCl2
0,36 gr, NaNO3 100 gr, trace metal solution 1 ml, vitamin 1 ml dan 100 ml
akuades. Larutan pupuk disterilkan menggunakan autoclave kemudian disimpan
dalam lemari es.
D. Lingkungan dan Media KulturDunaliella salina
Menurut Masithah dkk. (2011), lingkungan kultur dapat mempengaruhi
merupakan campuran dari media air laut steril 464 ml, bibit D. Salina 35 ml
dengan kepadatan awal stok murni 719,825 x 104 sel/ml dan kepadatan yang
dikehendaki 5x105 sel/ml, pupuk Walne 0,5 ml serta vitamin B120,5 ml. Menurut
Sari dan Manan (2012), media air laut yang telah dicampur dengan pupuk Walne
dan vitamin diaerasi beberapa saat, kemudian dilakukan penebaran bibitD. salina.
Tujuan pemberian aerasi untuk melarutkan pupuk Walne dan vitamin serta untuk
meningkatkan kelarutan CO2pada media kultur.
E. Penebaran BibitDunaliella salina
Bibit D. salinayang akan digunakan untuk penelitian diperoleh dari Balai
Budidaya Air Payau (BBAP) Situbondo. Pengiriman bibit D. salina dilakukan
pada suhu rendah. Bibit D. salinadikemas dalam botol kemudian dimasukkan ke
dalam kotak sterofoam yang sudah diberi es, kemudian bibit D. salina disimpan
dalam lemari pendingin. Menurut Isnansetyo dan Kurniastuty (1998) stok murni
bibit D. salina saat disimpan pada lemari pendingin pada suhu 5-15ºC dapat
bertahan hingga satu bulan. Bibit D. salina dari stok murni dicek dan dihitung
menggunakan haemocytometer dengan bantuan mikroskop sebelum dimasukkan
ke dalam botol kultur. Menurut Sari dan Manan (2012), pengecekan dan
penghitungan bibit fitoplankton sebelum dikultur bertujuan untuk mengetahui
kepadatan awal dan adanya kontaminasi, baik dari protozoa maupun dari spesies
plankton lain. Menurut Masithah dkk. (2011), bibit D. salina dimasukkan ke
dalam botol kultur dengan kepadatan 5x105 sel/ml. Menurut Kwangdinata dkk.
(2013), jumlah bibit D. salina yang diperlukan untuk kultur dihitung
V1=
N2 x V2 N1
Keterangan :
V1 = VolumeDunaliella salinayang dibutuhkan (ml) V2 = Volume media kultur yang dikehendaki (ml)
N1 = Kepadatan bibit atau stok murniDunaliella salina(sel/ml) N2 = Kepadatan bibitDunaliella salinayang dikehendaki (sel/ml)
F. Pengukuran PertumbuhanDunaliella salina
Pengukuran pertumbuhan dilakukan dengan menghitung kepadatan sel
setiap hari sampai pemanenan. Pengambilan sampel dilakukan dengan
menggunakan pipet tetes. Kepadatan sel dihitung dengan penghitungan langsung
menggunakan haemocytometer kemudian dilakukan penghitungan sel di bawah
mikroskop cahaya binokuler dengan perbesaran 400 kali (Prieto et al., 2011).
Menurut Kwangdinata dkk. (2013), data yang diperoleh dihitung menggunakan
rumus sebagai berikut:
Kepadatan Fitoplankton (sel/ml) = x 104
Keterangan :
nA, nB, nC, nD = Jumlah sel fitoplankton pada block A, B, C, D
G. PemanenanDunaliella salina
Menurut Isnansetyo dan Kurniastuty (1995) pemanenan fitoplankton harus
dilakukan pada saat yang tepat yaitu pada puncak populasi. Pemanenan
fitoplankton dapat dilakukan secara total atau parsial tergantung dari tujuan
pertumbuhan pada setiap perlakuan dan untuk mengetahui perkembangan
pembentukan β-karotenD. salina.
Pemanenan D. salina secara parsial dilakukan dengan cara mengambil 10
ml sampel dan dimasukkan ke dalam tabung reaksi kemudian disimpan dalam
lemari pendingin (Isnansetyo dan Kurniastuty, 1995), kemudian dilakukan
ekstraksi untuk mengetahui kandungan β-karotenD. salina.
H. Ekstraksi
Menurut Pisal and Lele (2006), analisis kandungan β-karoten dapat dilakukan dengan cara mengambil 5 ml sampel hasil panen D. salina
menggunakan pipet, kemudian disentrifus dengan kecepatan 5.000 rpm selama
lima menit. Hasil sentrifus diambil bagian pelet kemudian ditambahkan dengan 5
ml akuades, kemudian disentrifus dengan kecepatan 5.000 rpm selama lima menit.
Hasil sentrifus diambil bagian pelet dan dimasukkan ke dalam tabung reaksi,
kemudian ditambahkan 5 ml metanol dan disentrifus dengan kecepatan 5.000 rpm
selama lima menit. Hasil sentrifus diambil bagian pelet dan ditambahkan 5 ml
pelarut aseton:akuades dengan perbandingan (80:20 v/v) atau 4 ml aseton dan
1 ml akuades. Hasil campuran dihomogenkan menggunakan vortex selama dua
menit dan disentrifus dengan kecepatan 5.000 rpm selama lima menit. Hasil
campuran terdiri dari dua warna cairan yaitu lapisan cairan bening dan lapisan
cairan berwarna kekuningan. Lapisan cairan bening dibuang dan lapisan cairan
berwarna kekuningan diambil untuk dibaca pada spektrofotometer dengan
I. Perhitungan Kandunganβ-karoten
Menurut Hejazi and Wijffels (2003), analisis kandungan β-karoten dapat
ditentukan dengan metode spektrofotometer. Menurut PisalandLele (2006), hasil
ekstraksi berupa lapisan cairan yang berwarna kekuningan, kemudian
dimasukkan ke dalam cuvet dan dibaca menggunakan spektrofotometer dengan
panjang gelombang 480 nm. Rumus perhitungan β-karoten menurut Hurst (2002)
adalah sebagai berikut:
Keterangan :
: koefisien absorbansiβ-karoten 2273 V : volume sampel
A : absorbansi pada panjang gelombang 480 nm
J. Pengukuran Kualitas Air
Pengukuran parameter kualitas air pada kultur D. salina dilakukan setiap
hari yaitu pada pagi dan sore hari. Parameter kualitas air yang diamati meliputi
suhu, pH dan salinitas air. Pengukuran suhu dengan termometer, pH dengan pH
meter dan salinitas dengan refraktometer.
4.4 Parameter
4.4.1 Parameter Utama
Parameter utama yang diamati dalam penelitian ini adalah jumlah
kandungan β-karoten D. salina yang dianalisa setelah dilakukan pemanenan dan ekstraksi.
4.4.2 Parameter Penunjang
Parameter penunjang penelitian ini adalah pertumbuhan harian sel
D. salinadan kualitas air yang meliputi suhu, salinitas, dan pH diukur setiap hari
selama perlakuan.
4.5 Analisa Data
Hasil perhitungan kandungan β-karoten dan pertumbuhan sel D. salina
dilakukan analisa menggunakan metode deskriptif. Menurut Nazir (2011), tujuan
dari penelitian deskriptif ini adalah untuk membuat deskripsi, gambaran atau
lukisan secara sistematis, faktual, dan akurat mengenai fakta, sifat serta hubungan
V HASIL DAN PEMBAHASAN
5.1 Hasil
5.1.1Kandungan β-KarotenDunaliella salina
Kandungan β-karoten D. salina diukur setiap dua hari sekali mulai hari
ke-2 sampai hari ke-14 untuk mengetahui perkembangan pembentukan β-karoten
D. salina. Data lengkap kandungan β-karoten D. salina disajikan dalam Lampiran 1. Data rata-rata kandungan β-karoten D. salina pada semua perlakuan
disajikan pada Tabel 1.
Tabel 1. Rata-rata Kandungan β-karotenD. salina
Hari
ke-Kandunganβ-karotenD. salina(ml/L) pada Perlakuan ± SD
A B C D
2 0,0012 ± 0,0002 0,0014 ± 0,0003 0,0032 ± 0,0010 0,0054 ± 0,0013 4 0,0024 ± 0,0010 0,0043 ± 0,0009 0,0054 ± 0,0021 0,0058 ± 0,0027 6 0,0031 ± 0,0008 0,0049 ± 0,0012 0,0059 ± 0,0015 0,0074 ± 0,0012 8 0,0035 ± 0,0015 0,0052 ± 0,0052 0,0068 ± 0,0011 0,0087± 0,0014 10 0,0052 ± 0,0011 0,0053 ± 0,0008 0,0051 ± 0,0007 0,0057 ±0,0010 12 0,0042 ± 0,0019 0,0043 ± 0,0013 0,0043 ± 0,0005 0,0054 ± 0,0008 14 0,0037 ± 0,0012 0,0039 ± 0,0021 0,0036 ± 0,0016 0,0041 ± 0,0022 Keterangan : (A) intensitas cahaya 700 lux, (B) intensitas cahaya 2.200 lux, (C)
intensitas cahaya 3.700 lux, (D) intensitas cahaya 5.200 lux
Grafik rata-rata kandungan β-karoten D. salina selama penelitian dapat
Gambar 9. Grafik Rata-rata Kandunganβ-karotenD. salinaselama Penelitian Berdasarkan Tabel 1 dan Gambar 9, menunjukkan bahwa semakin tinggi
intensitas cahaya, hasil pengukuran kandungan β-karoten juga semakin tinggi. Kandungan β-karoten tertinggi perlakuan A (intensitas cahaya 700 lux) dan B
(intensitas cahaya 2.200 lux) terjadi pada hari ke-10 yaitu 0,0052 ml/L dan
0,0053 ml/L, pada perlakuan C (intensitas cahaya 3.700 lux) dan D (intensitas
cahaya 5.200 lux) kandungan β-karoten tertinggi terjadi pada hari ke-8 yaitu
0,0068 ml/L dan 0,0087 ml/L.
5.1.2 PertumbuhanDunaliella salina
Pertumbuhan D. salina digambarkan dengan kepadatan sel yang dihitung
setiap hari selama 14 hari pemeliharaan dengan menggunakan alat
haemocytometer. Data dan grafik pertumbuhan kepadatan D. salinadapat dilihat
pada Tabel 2 dan Gambar 10.
Tabel 2. Kepadatan Rata-rata SelD. salina
Hari
ke-Kepadatan SelD. salina(104sel/ml) pada Perlakuan ± SD
A B C D
1 129,45 ± 27,23 215,45 ± 30,16 239,50 ± 46,82 348,15 ± 38,87 2 187,30 ± 51,33 377,00 ± 91,13 771,20 ± 180,19 1484,10 ± 255,20 3 421,55 ± 89,14 1136,85 ± 36,62 1370,85 ± 103,53 2299,85 ± 422,56 4 695,40 ± 199,10 1487,10 ± 189,73 1660,85 ± 62,01 2703,65 ± 140,59 5 872,00 ± 77,84 2043,00 ± 471,63 2399,05 ± 274,40 2931,55 ± 251,88 6 1056,9 ± 135,38 2587,80 ± 399,09 3111,30 ± 290,09 3548,75 ± 278,77 7 1553,75 ± 152,79 2682,10 ± 354,72 3445,20 ± 273,02 3868,15 ± 274,01 8 1702,35 ± 247,68 2960,15 ± 393,86 3752,15 ± 138,54 4391,35 ± 273,88 9 1953,70 ± 298,41 3063,35 ± 256,68 3660,00 ± 636,87 4014,35 ± 272,09 10 2216,35 ± 445,99 3129,00 ± 649,03 3239,95 ± 353,70 3979,10 ± 284,48 11 2112,35 ± 517,26 2665,15 ± 465,51 2652,30 ± 480,28 3463,65 ± 369,34 12 2190,05 ± 439,35 2556,50 ± 257,99 2559,10 ± 297,48 3393,60 ± 231,01 13 2151,55 ± 502,14 2470,55 ± 694,31 2357,35 ± 374,06 3181,15 ± 289,43 14 1891,05 ± 402,03 2053,60 ± 378,45 1978,05 ± 427,75 2686,90 ± 240,58 Keterangan: (A) intensitas cahaya 700 lux, (B) intensitas cahaya 2.200 lux, (C)
intensitas cahaya 3.700 lux, (D) intensitas cahaya 5.200 lux
Grafik pertumbuhan rata-rata kepadatanD. salina selama penelitian dapat
Berdasarkan Tabel 2 dan Gambar 10, dapat diketahui bahwa kepadatan
D. salina mengikuti pola pertumbuhan kultur fitoplankton secara umum, yaitu
fase adaptasi, eksponensial, stasioner dan kematian. Pada perlakuan A dan B
(intensitas cahaya 700 lux dan 2.200 lux), hari ke-1 sampai ke-2 merupakan fase
adaptasi, fase eksponensial terjadi pada hari ke-3 hingga ke-10, fase kematian
terjadi mulai hari ke-11 hingga akhir kultur yaitu hari ke-14. Kepadatan D. salina
pada perlakuan C dan D (intensitas cahaya 3.700 lux dan 5.200 lux), hari ke-1
hingga ke-2 merupakan fase adaptasi, fase eksponensial terjadi pada hari ke-3
hingga hari ke-8 dan mulai terjadi penurunan kepadatan (fase kematian) pada hari
ke-9 hingga akhir kultur hari ke-14.
5.1.3 Kualitas Air
Pengukuran kualitas air dilakukan setiap hari yaitu pada pagi dan sore hari.
Hasil pengukuran kualitas air selama penelitian ditunjukkan pada Lampiran 3.
Grafik rata-rata suhu air selama penelitian dapat dilihat pada Gambar 11.
Gambar 11. Grafik Rata-rata Suhu Air Selama Penelitian
Berdasarkan Gambar 11, dapat diketahui bahwa semakin tinggi intensitas
(700 lux) berkisar antara 28-30ºC, perlakuan B (2.200 lux) berkisar antara
30-31ºC, perlakuan C (3.700 lux) berkisar antara 30-32ºC, dan perlakuan D
(5.200 lux) berkisar antara 32-34ºC).
Grafik rata-rata pH air selama penelitian dapat dilihat pada Gambar 12.
Gambar 12. Grafik Rata-rata pH Air Selama Penelitian
Berdasarkan Gambar 12, dapat dilihat bahwa terjadi nilai fluktuasi pH
pada semua perlakuan. Derajat Keasaman (pH) perlakuan A (700 lux) berkisar
antara 7,6-8,4, pH perlakuan B (2.200 lux) berkisar antara 7,8-8,9, pH perlakuan
C (3.700 lux) berskisar antara 8,0-9,0 dan pH perlakuan D (5.200 lux) berkisar
antara 8,1-9,1.
Grafik rata-rata suhu air selama penelitian dapat dilihat pada Gambar 13.
Berdasarkan Gambar 13, dapat diketahui bahwa nilai rata-rata salinitas
pada semua perlakuan mengalami kenaikan dari hari pertama kultur hingga hari
terakhir kultur (hari ke-14). Salinitas awal pada semua perlakuan dibuat sama
yaitu 20 ppt, namun pada akhir kultur salinitas tiap perlakuan mengalami
kenaikan. Salinitas pada akhir kultur (hari ke-14) perlakuan A (700 lux) yaitu
23 ppt, perlakuan B (2.200 lux) yaitu 23 ppt, perlakuan C (3.700 lux) yaitu 24 ppt,
dan perlakuan D (5.200 lux) yaitu 25 ppt.
5.2 Pembahasan
Dunaliella salina merupakan mikroalga hijau yang memiliki kemampuan
untuk mengakumulasi jumlah β-karoten alami dalam jumlah yang tinggi pada kondisi stres lingkungan (El-Baky et al., 2007). Sel D. salina berwarna
kemerahan dan lebih besar dibandingkan spesies Dunaliella yang lain, sehingga
β-karoten yang dihasilkan lebih banyak (Oren, 2005).
Hasil perhitungan kandungan β-karoten D. salina pada hari ke-2 hingga
ke-14 menunjukkan bahwa kandungan β-karotenD. salinatertinggi terdapat pada perlakuan D (intensitas cahaya 5.200 lux). Hal ini diduga karena cahaya tinggi
menyebabkan enzim pada sel D. salina bekerja secara optimal untuk
pembentukan β-karoten. Steinbrenner and Linden (2001), menyatakan bahwa intensitas cahaya tinggi mampu meningkatkan enzim carotenoid hydroxylase
(CH) dan phytoene syntase (PSY) yang merupakan prekursor pembentukan
phytoene. Peningkatan enzim carotenoid hydroxylase (CH) dan phytoene sintase
komponen penyusun β-karoten, sehingga peningkatan phytoene menyebabkan sintesisβ-karoten juga meningkat.
Menurut Kusumaningrum dan Zainuri (2013), β-karoten dapat dibentuk pada awal pertumbuhan bersamaan dengan klorofil-a yang berfungsi sebagai
fotoprotektor dan pigmen aksesoris pengumpul cahaya. Fotoprotektor memiliki
fungsi mencegah kerusakan akibat fotooksidasi, dalam proses ini klorofil mudah
mengalami kerusakan karena klorofil akan membentuk triplet yang apabila
berikatan dengan oksigen akan membentuk oksigen tunggal (singlet oxygen).
Oksigen tunggal merupakan oksidan kuat yang akan mengoksidasi klorofil, asam
lemak, protein dan asam nukleat sehingga menyebabkan kematian organisme. β-karoten akan segera menetralkan oksigen tunggal melalui proses detoksifikasi
sehingga kematian sel tidak terjadi.
Pisaland Lele (2005) menyatakan bahwa kondisi lingkungan yang kurang
sesuai seperti intensitas cahaya dan salinitas yang tinggi serta nutrien rendah akan
menyebabkan kondisi fisiologis sel D. salinatidak seimbang, sehingga sintesis β-karoten meningkat sebagai bentuk pertahanan diri. Produksi β-β-karoten pada selD.
salina berfungsi sebagai penangkal radikal bebas dan racun berbahaya yang
masuk ke dalam sel. Hal ini menyebabkan D. salina lebih mampu bertahan
terhadap kondisi lingkungan ekstrim dibandingkan dengan mikroalga lain.
Semakin tinggi intensitas cahaya yang diberikan,maka kandungan β-karoten yang dihasilkan juga semakin tinggi, namun pada hari ke-10 dan ke-14 perlakuan B
cahaya 3.700 lux) (Gambar 9). Hal ini diduga karena perlakuan C (intensitas
cahaya 3.700 lux) telah mengalami fase kematian lebih awal (hari ke-9), sehingga
kandungan β-karoten yang dihasilkan lebih sedikit dibandingkan dengan perlakuan B (intensitas cahaya 2.200 lux) dan A (intensitas cahaya 700 lux) yang
mengalami fase kematian mulai hari ke-11.
Hari ke-10, ke-12 dan ke-14 nilai rata-rata kandungan β-karotenD. salina
menunjukkan hasil yang hampir sama antar perlakuan. Hal ini diduga karena pada
hari ke-10 perlakuan A (intensitas cahaya 700 lux) dan B (intensitas cahaya
2.200 lux) mengalami puncak kandungan β-karoten, sedangkan perlakuan C
(intensitas cahaya 3.700 lux) dan D (intensitas cahaya 5.200 lux) mulai
mengalami penurunan kandungan β-karoten. Nilai rata-rata kandungan β-karoten yang hampir sama pada hari ke-12 dan ke-14 diduga disebabkan oleh selD. salina
pada semua perlakuan mengalami fase kematian (Tabel 2). Hal ini menyebabkan
kandungan β-karoten yang dihasilkan juga menurun. Hal ini sesuai dengan
pendapat Kusumaningrum dan Zainuri (2013) yang menyatakan bahwa produksi
pigmen karotenoid D. salina semakin meningkat sejalan dengan semakin
bertambah usia sel dan akan terus menurun sampai menuju fase kematian sel.
Produksi β-karoten yang dihasilkan pada fase ini digunakan untuk pertahanan hidup sel saat nutrisi dalam medium mulai menipis.
Cahaya memegang peranan sangat penting dalam pembentukan β-karoten pada sel D. salina. Hu (2004) menjelaskan bahwa cahaya akan mempengaruhi
respon seluler sel D. salina yaitu peningkatan klorofil dan pigmen lain seperti
peningkatan pigmen lain seperti zeaxanthin, β-karoten dan astaxanthin sebagai bentuk pertahanan diri. Jin and Polle (2009) menjelaskan bahwa sel D. salina
akan merespon cahaya, kemudian sel akan melakukan aktivasi sinyal transduksi
dari plastid ke inti sel. Aktivasi sinyal transduksi akan menyebabkan perubahan
susunan ekspresi gen dalam nukleus dan sitoplasma. Produk dari gen ini akan
dikirim ke kloroplas, kemudian akan terjadi pembentukan β-karoten dengan bantuan enzim karotenogenesis.
StangeandFlores (2012) menjelaskan bahwa proses biosintesis karotenoid
diawali dengan dua molekul GGPP (C20) mengalami kondensasi menjadi
phytoene dengan bantuan enzim phytoene sintase (PSY). Biosintesis dilanjutkan
dengan reaksi desaturasi phytoene oleh enzim phytoene desaturase (PDS) untuk
menghasilkan trans likopen yang berwarna merah muda dan 9,15,9’-tri-cis
-ζ-karoten, reaksi ini dikatalisis oleh dua desaturase dan dua isomerase. Desaturase
pertama akan menghasilkan 9,9’-di-cis- ζ-karoten dengan bantuan enzim karoten
isomerase (Z-ISO). Desaturase kedua akan menghasilkan 7,9,9’-cis-neurosporene
dan 7',9'-cis-likopen dengan bantuan enzim desaturase (ZDS). Enzim carotene
isomerase (CRTISO) akan mengkatalis pembentukan all-trans likopen. Likopen
akan mengalami dua reaksi siklase yaitu oleh enzim β-siklase (βLCY) yang dapat
menghasilkan β-karoten dan enzim ε-siklase (εLCY) dapat menghasilkan
α-karoten.
Hasil perhitungan kepadatan selD. salinapada hari ke-1 hingga hari ke-14
secara maksimal untuk proses fotosintesis yang menghasilkan energi, kemudian
energi yang dihasilkan digunakan untuk pembelahan sel. Menurut Al-Qasmyet al.
(2012), cahaya dapat memicu produksi Adenosine triphosphate (ATP) dan
Nicotinamide adenine dinucleotide phosphate-oxidase(NADPH) yang digunakan
fitoplankton sebagai energi untuk pembelahan sel, sehingga kepadatan populasi
sel meningkat.
Cahaya tinggi dapat menyebabkan pembelahan sel terjadi secara seksual.
Zainuriet al., (2006) mengatakan bahwaD. salinadapat bereproduksi dengan dua
cara yaitu seksual dan aseksual. Menurut Polle and Qin (2009), reproduksi
seksual dapat terjadi sebagai respon dari perubahan lingkungan yang kurang
sesuai, melalui proses gametogenesis dengan memproduksi isogamet yang terlihat
seperti zoospora. Shariati and Hadi (2011) menambahkan, reproduksi seksual D.
salina terjadi dengan cara melakukan isogami, selama pekembangan zigot akan
terjadi pembelahan secara meiosis. Zigot berwarna merah atau hijau memiliki
endomembran yang halus dan sangat tipis. Menurut Polle and Qin (2009), zigot
akan membelah secara meiosis setelah tahap istirahat dan akan membentuk lebih
dari 16 sel yang dibebaskan melalui celah pada dinding sel induk. Oren (2005)
menambahkan zigot kemudian membelah hingga 32 sel anak haploid melalui
celah pada dinding sel induk.
Pertumbuhan fitoplankton dalam kultur ditandai dengan kepadatan sel
fitoplankton yang semakin bertambah. Pertumbuhan fitoplankton terdiri atas
empat fase yaitu fase adaptasi, eksponensial, stasioner dan kematian (Isnansetyo
hingga ke-2 yaitu pertumbuhan sel belum terjadi secara signifikan karena sel
D. salina masih beradaptasi dengan lingkungan. Fase eksponensial perlakuan A
dan B (intensitas cahaya 700 lux dan 2.200 lux) terjadi pada hari ke-3 sampai hari
ke-10, pada perlakuan C (intensitas cahaya 3.700 lux) dan D (intensitas cahaya
5.200 lux) terjadi pada hari ke-3 sampai hari ke-8. Menurut Agustini (2014), fase
eksponensial merupakan fase yang ditandai dengan peningkatan pertumbuhan sel
yang signifikan. Fase stasioner pada semua perlakuan tidak tampak, hal ini diduga
karena fase stasioner kurang dari 24 jam sedangkan pengamatan kepadatan sel
D. salinadilakukan setiap 24 jam sekali.
Fase kematian pada perlakuan A (intensitas cahaya 3.700 lux) dan B
(intensitas cahaya 2.200 lux) terjadi mulai hari ke-11, sedangkan pada perlakuan
C (intensitas cahaya 3.700 lux) dan D (intensitas cahaya 5.200 lux) terjadi mulai
hari ke-9. Hal ini terjadi karena pada perlakuan C (intensitas cahaya 3.700 lux)
dan D (intensitas cahaya 5.200 lux) lebih cepat mengalami pembelahan sel
sehingga jumlah sel D. salina lebih banyak. Semakin banyak jumlah sel dalam
media kultur, maka nutrien yang dibutuhkan untuk pertumbuhan juga semakin
banyak. Hal ini mengakibatkan nutrien dalam media kultur semakin berkurang,
sehingga pada perlakuan C (intensitas cahaya 3.700 lux) dan D (intensitas cahaya
5.200 lux) fase kematian lebih cepat terjadi. Lavens and Sorgeloos (1996)
menyatakan bahwa kualitas air dan nutrien dalam media yang semakin menurun
dapat menyebabkan sel fitoplankton tidak dapat berkembang sehingga terjadi
Menurut Agustini (2014), pada kultur fitoplankton skala laboratorium,
ketika nutrisi dalam media kultur berkurang dan tidak ada penambahan dari luar
maka fitoplankton akan mengalami beberapa fase. Fase awal yang terjadi adalah
fase lag (adaptasi) yaitu fitoplankton beradaptasi terhadap lingkungan, pada fase
ini belum terjadi peningkatan pertumbuhan sel secara signifikan. Fase setelah fase
lagakan terjadi fase eksponensial yang ditandai dengan peningkatan pertumbuhan
sel yang signifikan. Fase stasioner terjadi setelah fase eksponensial, yaitu akan
terjadi keseimbangan antara laju pertumbuhan dan laju kematian. Fase akhir yang
terjadi adalah fase kematian yang ditandai dengan kepadatan sel fitoplankton yang
terus berkurang. Menurut Rizky dkk. (2012), fitoplankton akan memanfaatkan
kandungan nutrien pada media kultur untuk melakukan proses pertumbuhan.
Peningkatan jumlah sel akan terhenti pada satu titik puncak kepadatan. Puncak
kepadatan sel fitoplankton membutuhkan nutrien yang lebih banyak, sedangkan
kandungan nutrien dalam media akan semakin menurun karena tidak dilakukan
penambahan nutrien. Hal ini dapat menyebabkan kematian sel fitoplankton.
Pertumbuhan D. salina yang baik dapat dipengaruhi oleh kondisi
lingkungan di dalam media kultur. Faktor lingkungan yang dapat mendukung
pertumbuhanD. salinaadalah suhu, pH dan salinitas. Hasil pengukuran suhu pada
perlakuan A (700 lux) berkisar antara 28-30ºC, perlakuan B (2.200 lux) berkisar
antara 30-31ºC, perlakuan C (3.700 lux) berkisar antara 30-32ºC, dan perlakuan D
(5.200 lux) berkisar antara 32-34ºC. Hal ini diduga karena intensitas cahaya tinggi
yang diberikan akan melepaskan energi panas yang lebih banyak, sehingga suhu
memiliki pengaruh pada pembentukan karotenoid fitoplankton. Suhu yang lebih
tinggi dapat menyebabkan fotooksidasi yaitu kerusakan klorofil, asam lemak, dan
protein akibat ikatan oksigen tunggal. Fitoplankton akan memproduksi karotenoid
untuk menetralkan oksigen tunggal sehingga fotooksidasi tidak terjadi. Kisaran
suhu selama penelitian dapat dikatakan masih dapat ditoleransi oleh D. salina,
karena fitoplankton tersebut mampu bertahan hidup pada rentang suhu hingga
40ºC. Hal ini sesuai dengan pendapat Junejaet al. (2013) yang menyatakan bahwa
D. salinadapat tumbuh pada suhu 25-40oC.
Pengukuran pH pada penelitian berkisar antara 7,6-9,1. Kisaran pH
tersebut juga diduga dapat menyebabkan stres tambahan selain perlakuan
intensitas cahaya, namun kisaran pH tersebut masih dapat ditoleransi untuk
pertumbuhan D salina. Menurut Boyd (2011), pH 6-9 merupakan kisaran pH
terbaik untuk pertumbuhan fitoplankton. Menurut Septina (2011), fitoplankton
secara umum hidup dengan baik pada pH netral (pH 7). Nilai pH lebih rendah dari
4,0 merupakan perairan asam dan dapat menyebabkan kematian organisme air,
sedangkan pH lebih dari 9,5 merupakan perairan basa dan dapat mengurangi
produktivitas fitoplankton.
Salinitas didefinisikan sebagai konsentrasi total ion-ion terlarut dalam air
dan dinyatakan dalam satuan part per thousand (ppt) (Edhy dkk., 2010). Pada
media kultur D. salina, salinitas merupakan faktor yang sangat penting untuk
mengatur keseimbangan tekanan osmotik sel D. salina dalam media kultur
fitoplankton halofilik yang memiliki habitat perairan laut dan mampu bertahan
hidup dalam lingkungan yang memiliki kadar garam tinggi. Kisaran salinitas yang
lebih tinggi dari kondisi awal kultur (salinitas 20 ppt) diduga akibat penguapan
yang terjadi karena pengaruh suhu yang tinggi, sehingga salinitas air akan
meningkat. Perubahan salinitas tersebut diduga menjadi penyebab stres sel D.
salinaselain perlakuan intensitas cahaya. Menurut Ramoset al(2011), perubahan
salinitas dapat merusak membran plasma sel D. salina sehingga memicu aktivasi
enzim protein kinase dan dapat memicu konversi zat pati menjadi gliserol di
dalam kloroplas. Perubahan salinitas yang berlangsung dalam jangka waktu lama
akan menyebabkan enzim protein kinase bekerja untuk merubah ekspresi gen
VI KESIMPULAN DAN SARAN
6.1 Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan, maka dapat ditarik
kesimpulan sebagai berikut:
1. Perbedaan intensitas cahaya dapat meningkatkan kandungan β-karoten pada
D. salina.
2. Intensitas cahaya maksimal untuk memperoleh kandungan β-karoten D.
salina tertinggi adalah pada intensitas cahaya 5.200 lux dengan kandungan
sebanyak 0,0087 ml/L.
6.2 Saran
Saran pada penelitian ini adalah perlu dilakukan penelitian mengenai
intensitas cahaya yang lebih tinggi, yang masih mampu ditolerir untuk
DAFTAR PUSTAKA
Abdillah, A. A., M. A. Alamsjah., H. Pramono., N. Sugianti and J. Hermawan. 2014. Antioxidant Production from Dunaliella salina Under Salinity Stress and Light Stress. The Proceeding of the Fourth International Fisheries Symposium. Surabaya. pp. 156-164.
Abu-Rezq, T., S. Al-Hooti, S. Jacob, M. Al-Shamali, A. Ahmed and N. Ahmed. 2010. Optimum Culture Conditions Required for the Locally Isolated
Dunaliella salina.Journal of Algal Biomass. 1(4) : 58-83.
Agustini, N. W. S. 2014. Kandungan Pigmen Astaxanthin dari Mikroalga
Botryococcus braunii pada Berbagai Penambahan Nitrogen dan Phospor. Seminar Nasional Pusat Penelitian Bioteknologi. LIPI. 11: 3-25.
Al-Qasmy, M., Member, N. R., Talebi, S., Al-Rajhi, S., and Al-Barwani, T. 2012. A Review of Effect of Light on Microalgae Growth. Proceedings of the World Congress on Engineering. London. 1 : 1-4.
Ben-Amotz, A. 2004. Industrial Production of Microalga Cell-mass and Secondary Product Major Industrial. In : A. Richmond ed. Handbook of Microalgal Culture: Biotechnology and Applied Phycology. Australia: Blackwell Science. pp. 83-84.
Borowitzka, M. A and L. J. Borowitzka. 1989. Micro-Algal Biotechnology. Cambridge University Press. Cambridge. New York. pp. 27-58.
Borowitzka, M. A and C. J. Siva. 2007. The Taxonomy of the Genus Dunaliella
(Chlorophyta, Dunaliellales) with Emphasis on the Marine and Halophilic Species. Journal Applied Phycology. 19 : 567-590.
Boyd, C. E. 2001. Water Quality Standards: pH. Global Aquaculture Alliance. USA. pp. 42-44.
De-Fretes, H., A. B. Susanto., B. Prasetyo dan L. Limantara. 2012. Karotenoid dari Mikroalga dan Makroalga: Potensi Kesehatan Aplikasi dan Bioteknologi. Jurnal Teknologi dan Industri Pangan. 23 (2) : 221-228.
Del-Campo, J. A., M. Garcia-Gonzales, and M. G. Guerrero. 2006. Outdoor Cultivation of Microalgae for Carotenoid production: Current State and Perspectives. Appl Microbiol Biotechnol. 74 : 1163-1174.
El-Baky, A. H., F. K. El Baz and G. S. El-Baroty. 2007. Production of Carotenoid from Marine Microalgae and its Evaluation as Safe Food Colorant and Lowering Cholesterol Agents. Journal Agriculture and Environment. 2 (6): 792-800.
Gupta, S. K., A. K. Jha. A.K. Pal and V. Venkateshwarlu. 2007. Use of Natural Carotenoids for Pigmentation in Fishes. Natural Product Radiance. 6 (1) : 46-49.
Grobbelaar. 2004. Alga Nutrition Mineral Nutrition. In : A. Richmond ed.
Handbook of Microalgal Culture: Biotechnology and Applied Phycology. Australia: Blackwell Science. pp. 97-105.
Haekal, F. E., M. M. Hefny and A. M., Abd El-Tawab. 2013. Electrochemical Behavior of Titanium in Saline Media Containing Alga Dunaliella salina
and Its Secretion. International Journal of Electrochemical Science. 8 : 4610-4630.
Hejazi, M. A. and R. H. Wijffels. 2003. Effect of Light Intensity on β-carotene Production and Extraction byDunaliella salina in Two-Phase Bioreactors. Biomolecular Engineering. Elsevier. 20 : 171-175.
Hendaryono, D. P. S dan Wijayani. 1994. Teknik Kultur Jaringan. Kanisius. Yogyakarta. hal. 57-58.
Hu, Q. 2004. Environmental Effects on Cell Composition. In : A. Richmond ed.
Handbook of Microalgal Culture: Biotechnology and Applied Phycology. Australia: Blackwell Science. p. 83-84.
Hurts, W. J. 2002. Method of Analysis for Functional Foods and Nutraceuticals. CRC Press. London. p. 236-246
Isnansetyo, A dan Kurniastuty. 1995. Teknik Kultur Phytoplankton dan Zooplankton. Kanisius. Yogyakarta. hal 34-85.
Jeffrey, S. W. and E. S. Egeland. 2009. Pigments of Green and Red Forms of Dunaliella and Related Chlorophytes. In : A. Ben-Amotz, ed. The Alga Dunaliella Biodiversity, Physiology, Genomics and Biotechnology. USA: Science Publisher. p. 111-113.
Juneja A., R. M. Ceballos and G. S. Murthy. 2013. Effects of Environmental Factors and Nutrient Availability on the Biochemical Composition of Algae for Biofuels Production. Journal of Energies. 6 : 4607-4638.
Karnjanawipagul, P., W. Nittayanuntawech, P. Rojsanga and L. Suntornsuk. 2010. Analysis of β-Carotene in Carrot by Spectrophotometry. Mahidol
University Journal of Pharmaceutical Sience. 37 (1-2) : 8-16.
Kawaroe, M., T. Pratono, A. Sunuddin, D. W. Sari dan D. Augustine. 2009. Laju Pertumbuhan Spesifik Chlorella dan Dunaliella sp. Berdasarkan Perbedaan Nutrien dan Fotoperiode. Jurnal Ilmu Perairan dan Perikanan Indonesia. 16 (1) : 73-77.
Kleinegris, D. M. M, M. Jannsen, W. A. Brandenburg and R. H. Wijffels. 2011. Continuous Production of Carotenoids from Dunaliella salina. Journal of Enzyme and Microbial Technology Elsevies. 48 : 253-259.
Kusriningrum. 2012. Perancangan Percobaan. Airlangga University Press. Surabaya. hal 43-69.
Kusumaningrum H. P. and M. Zainuri. 2014. Optimization and Stability of Total Pigments Production of Fusan from Protoplasma Fusion of Microalga
Dunaliella and Chlorella in vivo: Attempts on Production of Sustainable Aquaqulture Natural Food. International Journal of Marine and Aquatic Resource Conservation and Co-existence Reasearch Article. 1(1):1-5.
Kusumaningrum H. P. dan M. Zainuri. 2013. Aplikasi Pakan Alami Kaya Karotenoid untuk Post Larvae Penaeus monodon. Jurnal Ilmu Kelautan Universitas Diponegoro. 18 (3) : 143-149.
Kwangdinata, R., I. Raya dan M. Zakir. 2013. Produksi Biodiesel dari Lipid Fitoplankton Nannochloropsis sp. Melalui Metode Ultrasonik. Marina Chimica Acta. 4 (2) : 28-36.
Lavens, P and Sorgeloos, P. 1996. Manual on the Production and Use of Live Food for Aquaculture. FAO Fisheries Technical Paper. Italy. p. 14-15.
Leon, R., M. Martin, J. Vigara, C., Vilchez and J. M. Vega. 2003. Algae Mediated Photoproduction of β-Carotene in Aqueous Organic Two Phase Systems. Molecular Engineering. 20 : 177-182.
Lindqvis, L and Andersson. 2002. Biochemical Properties of Purified Recombinant Human β-carotene 15,15’ Monooxygenase. Journal of Biology Chemistry. p. 2-4.