HIDROKARBON DAN MINYAK BUMI
Standar Kompetensi : Mengkomunikasikan senyawa hidrokarbon dan kegunaannya Kompetensi Dasar : 1. Mendeskripsikan kekhasan atom karbon yang
membentuk senyawa hidrokarbon ;
2. Menggolongkan senyawa hidrokarbon dan turunannya 3. Mendeskripsikan kegunaan senyawa hidrokarbon dalam
kehidupan manusia
A. Pendahuluan
Hidrokarbon berasal dari : hidro = unsur hydrogen dan karbon = unsur karbon C.
Senyawa hidrokarbon adalah senyawa yang komponen utama penyusunnya adalah unsr C dan H. Sebagian besar senyawa hidrokarbon bersumber dari makhluk hidup. Berdasarkan sumber penyusunnya senyawa hidrokarbon dikelompokkan menjadi hidrokarbon organik dan hidrokarbon anorganik. Jumlah senyawa hidrokarbon di alam sangat banyak jumlahnya. Berdasarkan bentuk rantainya, hidrokarbon dibedakan menjadi hidrokarbon rantai lurus, rantai melingkar dan aromatik.
B. Keistimewaan Atom Karbon
Sifat-sifat khas atom karbon yang menyebabkan terbentuknya senyawa karbon, yaitu :
1. Karbon mempunyai 4 elektron valensi, bila berikatan dengan atom karbon lain kemungkinan struktur Lewisnya adalah sebagai berikut:
x x x C x x x C x x x C x x x C x x x x
2. Atom karbon mampu membentuk berikatan kovalen. Elektron valensi yang dimiliki atom C adalah 4 sehingga pencapaian oktet (kestabilan) memerlukan 4 elektron dari atom lainnya dengan membentuk 4 ikatan kovalen.
3. Atom unsur karbon relatif kecil. Atom karbon terletak pada periode 2 dalam SPU. Hal ini menunjukkan bahwa jari-jari atom karbon relatif kecil sehingga ikatan-ikatan atom karbon relatif stabil dapat membentuk ikatan rangkap dua maupun rangkap tiga.
4. Atom karbon mampu membentuk rantai karbon, yaitu ikatan antara sesama atom karbon. Atom karbon dapat membentuk senyawa rantai yang sangat panjang. Rantai karbon yang terbentuk dapat bervariasi, yaitu rantai C lurus (alifatik), rantai C bercabang dan melingkar (siklik).
Contoh : a. Rantai C lurus CH3 – CH2 – CH2 – CH2 – CH2 – CH3 b. Rantai C bercabang CH3 – CH – CH – CH2 – CH3 CH3 CH3
c. Rantai siklik
Tugas Mandiri 1
1. Sebutkan keistimewaan-keistimewaan yang dimiliki atom karbon!
Jawab : ………..………..……… ………. 2. Jelaskan mengapa atom karbon mudah berikatan dengan atom lain !
Jawab : ………..………..……… ………. 3. Jelaskan dengan gambar contoh ikatan rantai C bercabang !
Jawab : ………..………..……… ………. 4. Gambarkan contoh ikatan rantai siklik !
Jawab : ………..………..……… 5. Mengapa ukuran atom karbon relatif kecil ?
Jawab : ………..………..……… ……….
C. Atom C Primer, Sekunder, Tersier dan Kuarterner
Berdasarkan jumlah atom karbon yang terikat pada atom karbon lainnya, atom karbon dibedakan menjadi atom C primer, C sekunder, C tersier, dan C kuarterner. Untuk memahaminya perhatikan struktur karbon berikut:
Keterangan: P = primer
S = sekunder
T = tersier K = kuarterner Berdasarkan struktur karbon di atas, dapat disimpulkan:
Atom C primer yaitu atom C yang mengikat 1 atom C lain.
Atom C sekunder yaitu atom C yang mengikat 2 atom C lain.
Atom C tersier yaitu atom C yang mengikat 3 atom C lain.
Atom C kuarterner yaitu atom C yang mengikat 4 atom C lain.
Tugas Mandiri 2
1. Jelaskan apa yang dimaksud dengan :
a. Atom Cprimer : ………. b. Atom Csecunder : ………. CP – CS – CK – CK – CT – CT – CS – CP CP CP CP CP CP CP
2. Tentukan jumlah atom C primer, C sekunder, C tersier, dan C kuarterner pada senyawa karbon rumus struktur berikut : a. b. Jawab : ………..………..……… ……….
3. Jelaskan mengapa tidak ditemukan atom C yang memiliki 5 ikatan ?
Jawab : ………..………..……… ……….
D. Sifat Senyawa Karbon
Senyawa-senyawa yang mengandung unsur karbon disebut senyawa karbon. Senyawa karbon ada yang terdapat dalam makhluk hidup dan ada yang berada di alam bebas. Senyawa karbon digolongkan ke dalam senyawa karbon organik dan anorganik.
Perbedaan senyawa karbon organik dan anorganik:
No Senyawa karbon organik Senyawa karbon anorganik
1
2 3 4 5
Berasal dari makhluk hidup, dapat pula disintesis di laboratorium Ikatan kovalen
Umumnya tidak larut dalam air Reaksinya lambat
Mempunyai isomer
- Berasal dari batu-batuan
- Ikatannya ion - Larut dalam air - Reaksinya cepat
- Tidak mempunyai isomer
E. Klasifikasi Hidrokarbon
Senyawa karbon yang paling sederhana adalah hidrokarbon. Karena hanya terdiri dari dua unsur, yaitu karbon (C) dan hidrogen (H). Meskipun demikian jumlah senyawa yang dihasilkan dari kedua unsur ini sangat banyak.
Penggolongan hidrokarbon didasarkan pada dua hal, yaitu bentuk rantai karbon dan jenis ikatan.
1. Berdasarkan bentuk rantai karbon
a. Rantai karbon alifatik, yaitu rantai karbon terbuka. Rantai karbon alifatis ini bisa lurus dan bisa juga bercabang. Contoh: CH3 – CH2 – CH2 – CH2 – CH2 – CH3 C – C – C – C – C– C – C C C C C C C C C C – C – C – C – C– C – C C C C C C C C C C
b. Rantai karbon siklik, yaitu hidrokarbon dengan rantai tertutup atau melingkar. Hidrokarbon dengan rantai tertutup dibedakan atas karbosiklik dan heterosiklik.
1) Karbosiklik
Yaitu senyawa siklik yang rantai lingkarnya hanya terdiri dari atom C saja. Yang termasuk karbosiklik adalah senyawa aromatik dan alisiklik.
a) Senyawa aromatik
Yaitu senyawa karbosiklik yang terdiri atas 6 atom karbon atau lebih yang memiliki ikatan rangkap terkonjugasi.
Contoh :
b) Senyawa alisiklik
Yaitu senyawa karbosiklik yang hanya mempunyai ikatan tunggal. Contoh :
2) Heterosiklik
Yaitu senyawa karbosiklik yang di dalam rantai lingkarnya terdapat atom lain selain atom karbon dan hidrogen.
Contoh :
2. Berdasarkan jenis ikatan
a. Ikatan jenuh
Yaitu senyawa hidrokarbon yang semua ikatan karbonnya merupakan ikatan tunggal (– C – C –). Contoh : CH3 – CH2 – CH2 – CH2 – CH3 CH3 – CH2 – CH – CH2 – C – CH2 – CH2 – CH3 CH3 CH3 CH3 C – C – C – C – C H H H H H H H H H H H
b. Ikatan tak jenuh
Yaitu senyawa hidrokarbon yang mengandung ikatan rangkap 2 (–C=C–) maupun rangkap 3 (–C = C–) pada ikatan karbon-karbon.
Contoh :
CH3 – CH= CH – CH2 – CH3 CH3 – CH2 – C≡ C – CH – CH3
Tugas Mandiri 3
1. Apa yang dimaksud dengan senyawa karbon?
Jawab : ………..………..……… ………. 2. Sebutkan perbedaan antara senyawa karbon organik dan anorganik!
Jawab : ………..………..……… ………. 3. Rantai karbon siklik dibedakan menjadi dua, sebutkan dan jelaskan!
Jawab : ………..………..……… ………. 4. Jelaskan apa yang dimaksud dengan ikatan jenuh? Beri 2 (dua) contohnya!
Jawab : ………..………..……… ………. 5. Jelaskan apa yang dimaksud dengan ikatan tak jenuh? Beri 2 (dua) contohnya!
Jawab : ………..………..……… ……….
F. Alkana, Alkena, Alkuna
1. Alkana
a. Rumus Umum Alkana
Alkana merupakan senyawa hidrokarbon alifatik jenuh, yaitu hidrokarbon dengan rantai terbuka dan semua ikatannya tunggal. Rumus umum alkana adalah:
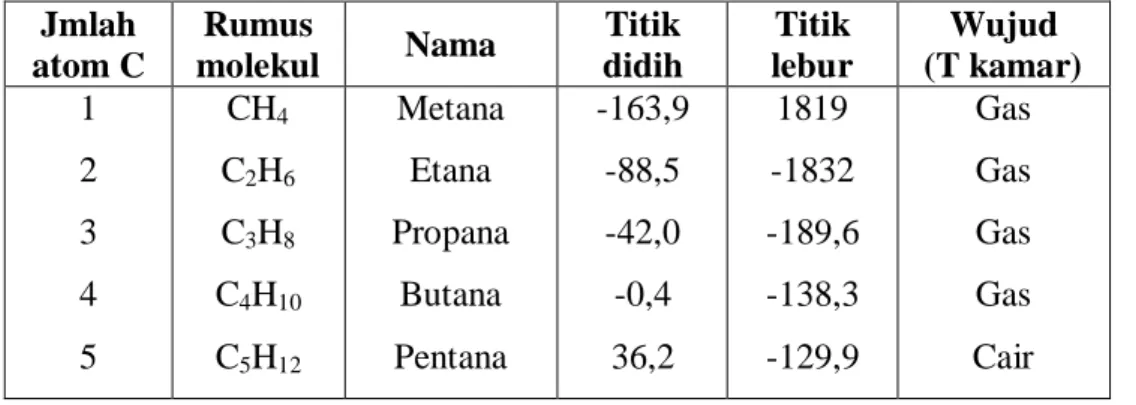
Tabel 4.1 Deret Homolog Alkana
Jmlah atom C Rumus molekul Nama Titik didih Titik lebur Wujud (T kamar) 1 2 3 4 5 CH4 C2H6 C3H8 C4H10 C5H12 Metana Etana Propana Butana Pentana -163,9 -88,5 -42,0 -0,4 36,2 1819 -1832 -189,6 -138,3 -129,9 Gas Gas Gas Gas Cair CH3
6 7 8 9 10 C6H14 C7H16 C8H18 C9H20 C10H22 Heksana Heptana Oktana Nonana Dekana 69,1 98,5 125,8 150,9 174,2 -94,9 -90,5 -56,7 -50,9 -29,6 Cair Cair Cair Cair Cair
Jika suatu atom H pada alkana berkurang maka dihasilkan suatu gugus yang disebut gugus alkil.
Rumus alkil adalah:
Nama alkil diambil dari nama alkana, yaitu akhiran ana diganti dengan il. Contoh : Alkana Alkil CH4 (metana) CH3 (metil) C2H6 (etana) C2H5 (etil) C3H8 (propana) C2H7 (propil) C5H12 (pentana) C5H11 (pentil/amil) b. Isomer Alkana
Isomer adalah senyawa yang mempunyai rumus molekul sama tetapi rumus strukturnya berbeda. Contoh :
Isomer senyawa pentana (C5H12)
1) CH3 – CH2 – CH2 – CH2 – CH3 n – pentana 2) CH3 – CH2 – CH2 – CH3 2 – metil butana
3) CH3 – C – CH3 2,2 – dimetil propana
c. Tata Nama Alkana
Tata nama alkana menurut IUPAC (International Union of Pure and Applied Chemistry) adalah sebagai berikut:
1) Senyawa-senyawa alkana diberi nama berakhiran – ana. Contoh: metana, etana, dan propana
2) Senyawa alkana yang mempunyai rantai karbon lurus namanya diberi awalan normal dan disingkat dengan n.
CH3 – CH2 – CH2 – CH2 – CH3 n – pentana
3) Senyawa alkana yang mempunyai rantai karbon bercabang terdiri dari rantai utama dan rantai cabang. Rantai utama adalah rantai hidrokarbon yang terpanjang diberi nomor secara berurutan dimulai dari ujung yang terdekat dengan cabang.
Contoh :
CnH2n + 1
CH3 CH3
4) Penulisan nama untuk senyawa alkana bercabang dimulai dengan penulisan nomor cabang diikuti tanda ( – ), lalu nama cabang berikut nama rantai utamanya.
Contoh :
Rantai induk : butana Gugus alkil (cabang) : metil Nomor cabang : 2
Namanya : 2 – metil butana
5) Bila cabangnya terdiri atas lebih dari satu gugus alkil yang sama maka cara penulisan namanya yaitu tulisan nomor-nomor cabang alkil, tiap nomor dipisahkan dengan tanda ( , ). Lalu diikuti nama alkil dengan diberi awalan Yunani sesuai jumlah gugus alkilnya (dua = di, tiga = tri, empat = tetra, dan seterusnya), kemudian nama rantai utamanya.
Rantai utama : pentana Gugus alkil : metil Nomor cabang : 2, 3
Namanya : 2, 3 – dimetil pentana
6) Bila cabangnya terdiri atas gugus alkil yang berbeda, maka penulisan nama cabang diurutkan berdasarkan abjad.
Rantai utama : heptana Gugus alkil : metil dan etil
Nama : 4 – etil – 2, 5 – dimetil heptana
d. Sifat-sifat alkana
1. Merupakan senyawa nonpolar tidak larut dalam air 2. Semakin banyak atom C semakin tinggi titik didihnya 3. Dapat mengalami reaksi oksidasi dengan oksigen
4. Dengan halogen (F2, Cl2, Br2, I2) mengalami reaksi substitusi atau penggantian dengan atom H. 5 CH3 – 4CH2 – 3CH2 – 2CH – 1CH3 CH3 rantai utama cabang 5 CH3 – 4CH2 – 3CH2 – 2CH – 1CH3 CH3 5 CH3 – 4CH2 – 3CH – 2CH – 1CH3 CH3 CH3 1 CH3 – 2CH – 3CH2 – 4CH – 5CH – 6CH2 – 7CH3 CH3 C2H5 CH3
2. Alkena
a. Rumus Umum Alkena
Alkena merupakan hidrokarbon tak jenuh yang mempunyai ikatan rangkap dua (C = C). Rumus umum alkena adalah:
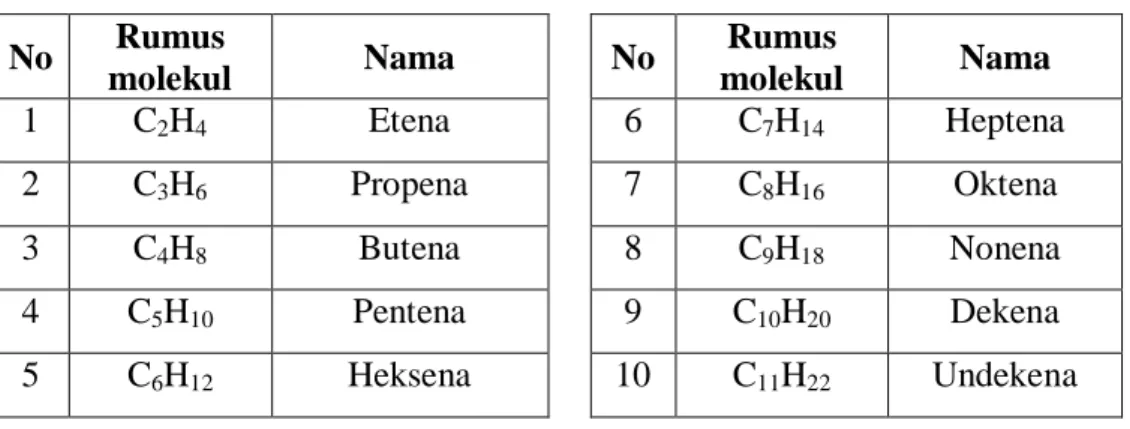
Tabel 4.2 Rumus molekul alkena dan namanya
No Rumus molekul Nama No Rumus molekul Nama 1 C2H4 Etena 6 C7H14 Heptena 2 C3H6 Propena 7 C8H16 Oktena 3 C4H8 Butena 8 C9H18 Nonena 4 C5H10 Pentena 9 C10H20 Dekena 5 C6H12 Heksena 10 C11H22 Undekena b. Isomer Alkena
Isomer yang terjadi pada alkena dapat berupa isomer rantai, isomer posisi, dan isomer cis-trans. 1) Isomer rantai
Isomer rantai pada alkena terjadi karena rantai karbon berubah misalnya dari lurus menjadi bercabang tetapi posisi ikatan rangkap tetap.
Contoh:
Rumus
molekul Rumus struktur Nama
C4H8 CH3 – CH2 – CH = CH2 CH3 – C = CH2
1 – butena
2 – metil -1- propena
2) Isomer posisi
Yaitu isomer yang terjadi karena posisi ikatan rangkap diantara atom-atom C nya dapat pindah tempat.
Contoh:
Rumus
molekul Rumus struktur Nama
C4H8 CH3 – CH2 – CH = CH2 CH3 – CH = CH – CH3
1 – butena 2 – butena
3) Isomer cis-trans
Isomer cis-trans terjadi karena adanya perbedaan kedudukan gugus-gugus yang sejenis di sekitar ikatan C = C.
Contoh:
CnH2n n = jumlah atom karbon
Rumus
molekul Rumus struktur Nama
C4H8
C = C
C = C
Cis 2 – butena
Trans 2 – butena
c. Tata Nama Alkena
1) Akhiran – ana menjadi – ena. Contoh : etena, propena, butena.
2) Letak ikatan rangkap ditunjukkan dengan nomor, ditulis sebelum nama alkena rantai utama yaitu rantai terpanjang yang mengandung ikatan rangkap. Pemberian nomor dimulai dari atom karbon yang terdekat dengan ikatan rangkap.
Contoh:
3) Alkena bercabang diberi nama dimulai dengan nomor cabang, tanda (–), nama alkil, nomor tempat ikatan rangkap, tanda (–), dan nama rantai utama.
Contoh:
2 -metil -2- pentena
d. Sifat-sifat Alkena
1. Merupakan senyawa nonpolar tidak larut dalam air 2. Semakin banyak atom C semakin tinggi titik didihnya 3. Dapat mengalami reaksi adisi (pemutusan ikatan rangkap)
4. Dapat mengalami polimerisasi, yaitu penggabungan molekul-molekul sederhana (monomer) menjadi molekul besar (polimer)
5. Pembakaran sempurna alkena menghasilkan C2O dan H2O
3. Alkuna
a. Rumus Umum Alkuna
Alkuna adalah senyawa hidrokarbon yang mempunyai sebuah ikatan rangkap tiga. Rumus umum alkuna adalah: n = jumlah atom C CH3 CH3 H H H H CH3 CH3 4 CH3 – 3CH2 – 2CH = 1CH2 1 – butena 5 CH3 – 4CH2 – 3CH = 2C – 1CH3 CH3 CnH2n-2
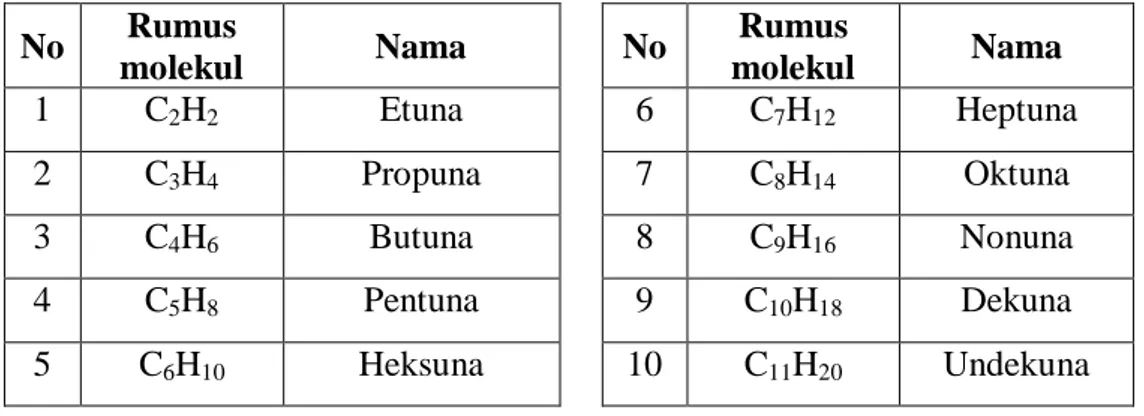
Tabel 4.3 Rumus molekul dan beberapa alkuna No Rumus molekul Nama No Rumus molekul Nama 1 C2H2 Etuna 6 C7H12 Heptuna 2 C3H4 Propuna 7 C8H14 Oktuna 3 C4H6 Butuna 8 C9H16 Nonuna 4 C5H8 Pentuna 9 C10H18 Dekuna 5 C6H10 Heksuna 10 C11H20 Undekuna b. Isomer Alkuna
Pada alkuna terjadi isomer posisi dan isomer rantai. Pada isomer rantai letak ikatan rangkap tetap. Pada isomer posisi letak ikatan rangkap berubah.
Contoh : Isomer rantai :
Rumus
molekul Rumus struktur Nama
C5H8 CH3 – CH2 – CH2 – C ≡ CH CH3 – CH – C ≡ CH 1 – pentuna 3 – metil -1- butuna Isomer posisi : Rumus
molekul Rumus struktur Nama
C4H8 CH3 – CH2 – C ≡ CH CH3 – C ≡ C – CH3
1 – butuna 2 – butuna
c. Tata Nama Alkuna
Tata nama alkuna pada umumnya sama dengan alkena, hanya akhiran -ena diganti menjadi –una. Contoh:
CH3 – CH2 – C ≡ CH 1 – butuna CH3 – C ≡ C – CH3 2 – butuna
CH3 – CH – C ≡ CH 3 – metil -1- butuna
d. Sifat-sifat Alkuna
1. Alkuna mempunyai sifat seperti alkana maupun alkena
2. Alkuna sangat sukar larut dalam air tetapi larut di dalam pelarut organik, seperti karbontetraklorida.
Tugas Mandiri 4
1. Tuliskan rumus umum dari alkana, alkena dan alkuna!
Jawab : ………..………..……… ……….
CH3
2. Kelompokkan senyawa berikut ke dalam alkana, alkena, alkuna atau alkil ! a. C12H24 e. C11H22 b. C8H18 f. C16H34 c. C22H42 d. C30H62 d. C6H13 e. C17H32 Jawab : ………..………..……… ………..………. 3. Beri nama pada rumus struktur berikut:
a. CH3 – CH2 – CH2 – CH2 – CH3 : ………
b. CH3 – CH = CH – CH3 : ………
c. CH3 – CH2 – CH2 – CH2 – C ≡ CH : ……… d. CH3 – CH – CH – CH – C = CH2 : ………
e. CH ≡ C – CH2 – CH – CH2 – CH3 : ………
4. Tuliskan rumus struktur dari senyawa berikut:
a. 2,2,3 – trimetil pentana : ………
b. 2,2,3,4 – tetrametil pentana : ………
c. 3,4 – dimetil -2- heksena : ………
d. 3,4,4 – trimetil -2- heptena : ………
e. 3 – metil -1- pentuna : ………
e. Tuliskan rumus struktur dan nama-nama isomer dari:
a. Heksana : ……… c. Butena : ………
b. Heptana : ……… d. Pentuna : ………
G. Reaksi-reaksi Hidrokarbon
1. Reaksi Adisi
Senyawa etena C2H4 dapat diubah menjadi etana dengan menambah dua atom H. Penambahan suatu gugus atom pada senyawa tak jenuh (ikatan rangkap dua atau rangkap tiga) sehingga terjadi senyawa jenuh disebut reaksi adisi.
Contoh reaksi adisi:
a. Reaksi hidrogen pada alkena atau alkuna
Adisi hidrogen pada suatu senyawa disebut hidrogenasi. Contoh: Propena propana CH3 CH3 CH3 CH3 H – C = C – C – H + H2 H – C – C – C – H H H H H H H H H H H katalis
b. Adisi halogen Contoh : H H H H H H I I I I I I H − C = C − C − H + Br2 Katalis H − C − C − C − H I I I I H Br Br H
Propena 1,2-dibromo propana
c. Adisi hidrohalogen H H H H H H I I I I I I H − C = C − C − H + HBr Katalis H − C − C − C − H I I I I H H Br H
propena 2-bromo propana
2. Reaksi Substitusi
Reaksi subtitusi biasa terjadi pada alkana. Alkana dapat bereaksi dengan Cl2 dengan bantuan sinar matahari terjadi reaksi substitusi sebagai berikut.
H H
I I
H ─ C ─ H + Cl ─ Cl
→
H ─ C ─ Cl + HClI I
H H
Pada reaksi tersebut satu atom H pada metana diganti oleh satu Cl dari Cl2. Secara umum reaksi substitusi digambarkans sebagai berikut.
H H I I H ─ C ─ A + XY
→
H ─ C ─ X + AY I I H H Contoh : H H H H I I I H ─ C ─ C ─ H + Br2→
H ─ C ─ C ─ H + HBr I I I H H H BrReaksi substitusi adalah reaksi penggantian satu atom atau gugus atom yang terikat pada atom C dalam satu molekul oleh atom atau gugus atom lain.
3. Reaksi Eliminasi
Senyawa alkana dapat dibuat dari senyawa alkana dengan reaksi eliminasi. Perhatikan beberapa reaksi eliminasi berikut.
a. Dehidrogenasi (penarikan hidrogen) Contoh :
CH2 ─ CH2
→
CH2 = CH2 + H2I I
H H
etana etena
b. Dehidrasi (penarikan air) Contoh : H2SO4 (pekat) CH2 ─ CH2 CH2 = CH2 + H2O I I H OH etanol etena c. Dehidrohalogenasi (penarikan HX) Contoh : alkohol CH2 ─ CH ─ CH3 ─ KOH CH2 = CH ─ CH3 + KBr + H2O I I H Br 2-bromopropana propena
Berdasarkan contoh di atas reaksi eliminasi adalah reaksi pengeluaran gugus atom dari dua atom C yang berdekatan pada senyawa jenuh sehingga terbentuk senyawa tak jenuh atau senyawa yang mempunyai ikatan rangkap. Secara umum reaksi eliminasi digambarkan sebagai berikut.
I I I I
─ C ─ C ─ ─ C = C ─ + PQ
I I
P Q
4. Reaksi Oksidasi/pembakaran
Reaksi oksidasi pada senyawa hidrokarbon misalnya reaksi pembakaran dengan gas oksigen di udara. Hasil reaksinya adalah gas CO2, air, dan energi.
Contoh :
a. Pembakaran alkana
CH4(g) + 2 O2(g) → CO2(g) + 2 H2(g) C3H8(g) + 5 O2(g) → 3 CO2(g) + 4 H2O(l) b. Pembakaran alkena
C2H4(g) + 3 O2(g) → 2 CO2(g) + 2 H2O(l)
Tugas Mandiri 5
1. Jelaskan apa yang dimaksud dengan :
a. Reaksi adisi : ………
b. Reaksi substitusi :
………
c. Reaksi eleminasi :
2. Dari reaksi berikut, tentukan yang mana reaksi substitusi, adisi, dan oksidasi! a. CH ≡ CH + 2 H2 → CH3 – CH3 b. CH3 − CH3 + Cl2 → CH3 – CH2 – Cl + HCl c. 2 C2H6 + 7 O2 → 4 CO2 + 6 H2O d. CH2 = CH2 + Br2→ CH2Br – CH2Br e. CH3 – CH2OH → CH2 = CH2 + H2O Jawab : ……… H. Gugus Fungsi
Gugus fungsi merupakan bagian reaktif dari senyawa karbon yang menentukan sifat-sifat senyawa karbon. Bagian inilah yang menjadi pusat terjadinya reaksi kimia. Meskipun senyawa karbon memiliki unsur dasar sama, tetapi memiliki sifat yang jauh berbeda, karena memiliki gugus fungsi berbeda. Gugus fungsi adalah atom atau kelompok atom dengan susunan tertentu yang menentukan struktur dan sifat-sifat senyawa. Gugus fungsi dapat berupa ikatan karbon rangkap 2, ikatan rangkap 3 dan/atau gugus atom.
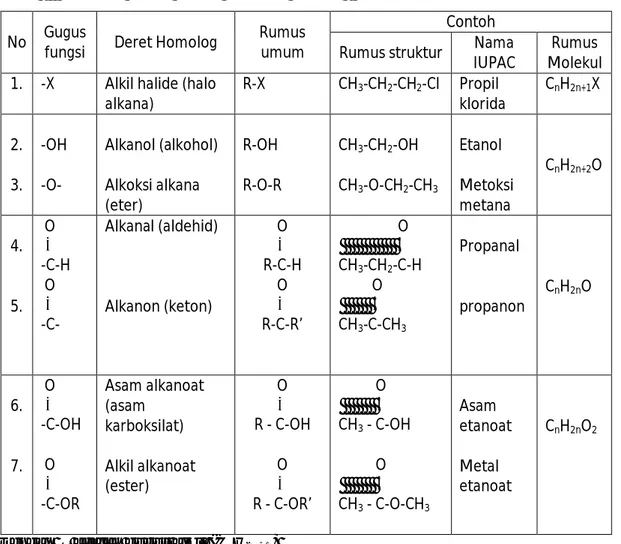
Tabel : Beberapa gugus fungsi senyawa karbon ;
No Gugus
fungsi Deret Homolog
Rumus umum
Contoh
Rumus struktur Nama
IUPAC
Rumus Molekul
1. -X Alkil halide (halo
alkana) R-X CH3-CH2-CH2-Cl Propil klorida CnH2n+1X 2. 3. -OH -O- Alkanol (alkohol) Alkoksi alkana (eter) R-OH R-O-R CH3-CH2-OH CH3-O-CH2-CH3 Etanol Metoksi metana CnH2n+2O 4. 5. O ║ -C-H O ║ -C- Alkanal (aldehid) Alkanon (keton) O ║ R-C-H O ║ R-C-R’ O ║ CH3-CH2-C-H O ║ CH3-C-CH3 Propanal propanon CnH2nO 6. 7. O ║ -C-OH O ║ -C-OR Asam alkanoat (asam karboksilat) Alkil alkanoat (ester) O ║ R - C-OH O ║ R - C-OR’ O ║ CH3 - C-OH O ║ CH3 - C-O-CH3 Asam etanoat Metal etanoat CnH2nO2
Dengan R adalah gugus alkil (CnH2n+1)
1. Haloalkana
Haloalkana adalah senyawa karbon turunan alkana yang mengikat satu atau lebih unusr halogen ; Contoh : CH3-CH3 + HCl CH3-CH2-Cl + HCl
Etana monokloro etana
Tabel : Beberapa senyawa Haloalkana dan kegunaannya :
No Rumus
Molekul Nama Senyawa Kegunaan
1 CH3Br Bromo metana Bahan pemadam kebakaran di pesawat 2 CH3Cl Kloro metana Bahan pendingin, pembuatan silicon
3 CHCl3 Kloroform Pelarut dan anastesia
4 ClBrC2H3F3 Halotan Digunakan sebagai anestesi lokal 5 C2H5Cl Kloro etana Anestesi local & pembuatan TEL 6 CHI3 Iodoform Antiseptic, pendingin lemari es, AC,
pendorong obat semprot 7 C2H3Cl Vinil klorida Monomer pembuatan PVC 8 CCl4 Tetrakloro
metana
Pemadam api
9 CFC Kloro Floro
Carbon
Disebut Freon, digunakan sebagai cairan pendingin AC/kulkas
10 DDT Dikloro divenil trikloro etana
Digunakan sebagai insektisida
2. Alkohol (Alkanol)
Alkohol berasal dari bahasa Arab kuhl atau kohol yang berarti inti tepung. Alkohol/alkanol adalah hidrokarbon yang memiliki gugus fungsi –OH dengan rumus struktur R-OH dan rumus molekul CnH2n+2O, merupakan senyawa yang banyak digunakan dalam industry.
Contoh : CH3OH = methanol CH3CH2OH = etil alkohol a. Sifat Alkohol :
1) Mempunyai TD lebih tinggi dibandingkan eter
2) Makin besar molekul relatif, kelarutan dalam air berkurang ; 3) Merupakan senywa non elektrolit ;
4) Alkohol yang memiliki Mr kecil berwujud cair, sedang yang mempunyai Mr besar berwujud padat ;
5) Ikatan antar senyawa alcohol merupakan ikatan hydrogen ;
b. Kegunaan alkohol ;
1) Bidang kesehatan, sebagai pelarut organik (misalnya etanol & butanol) ; 2) Bidang biologi, sebagai desinfektan (misalnya etanol dan methanol) ; 3) Spiritus, digunakan sebagai bahan bakar (campuran methanol & etanol) ;
4) Etanol digunakan sebagai campuran minuman beralkohol, pelarut parfum, pembuatan serat sintetis
5) Methanol merupakan bahan dasar pembuatan formalin ;
6) Glikol (etilen glikol/C2H4O2) digunakan sebagai zat anti beku pada radiator mobil ;
7) Gliserol (gliserin) digunakan untuk obat-obatan, kosmetik, pelumas, bahan dasar serat plastik dan bahan peledak.
3. Eter (Alkoksi alkana)
Eter merupakan senyawa karbon yang mempunyai gugus fungsi –O- yang terikat pada 2 gugus alkil R-O-R dengan rumus umum CnH2n+2O.
Contoh : CH3-O-CH3 = dimetil eter CH3-O-CH2-CH3 = etil metil eter a. Sifat senyawa eter
2) Memiliki titik didih dan titik leleh lebih rendah daripada alcohol ; 3) Merupakan senyawa non elektrolit ;
4) Kurang reaktif ;
5) Sukar larut dalam air dan merupakan senyawa kurang polar ;
b. Kegunaan eter (dietil eter)
1) Dalam laboratorium digunakan sebagai pelarut non polar seperti lemak dan damar ; 2) Bidang kesehatan, digunakan sebagai obat bius/anetesi (dietil eter) ;
4. Aldehida (Alkanal)
Aldehida atau alkanal merupakan senyawa karbon yang mempunyai gugus fungsi karbonil pada ujung rantai C.
a. Sifat aldehida
1) Pada suhu kamar aldehida suku rendah berwujud gas, sedang aldehida dengan suku banyak berwujud cair ;
2) Titik didih lebih rendah dari alkohol ; 3) Merupakan senyawa polar ;
4) Termasuk senywa non elektrolit b. Kegunaan aldehida
1) Formalin, digunakan untuk mengawetkan preparat anatomi dan pengawetan mayat ; 2) Bahan dasar pembuatan zat warna, dammar sintetis dan plastik thermostat ;
5. Keton/alkanon
Alkanon merupakan senywa karbon yang kedua tangannya mengikat gugus alkil (R). Dua gugus alkil yang diikat bisama sama atau tidak sama ;
a. Sifat-sifat alkanon
1) Termasuk senyawa polar yang larut dalam air ;
2) Mempunyai titik didih yang lebih tinggi disbanding eter dan alcohol ; 3) Antar senywa keton tidak terjadi ikatan hydrogen ;
4) Keton kurang reakstif disbanding aldehida ; 5) Merupakan reduktor lemah/oksidator kuat ;
b. Kegunaan alkanon
1) Aseton/propanon, digunakan sebagai pelarut senyawa organik, seperti pernis, lak, pembersih cat kayu dan cat kuku ;
2) Bahan pembuatan kloroform dan iodoform ; 3) Bahan anti ledakan pada penyimpanan asetilena ;
6. Asam karboksilat (Asam alkanoat)
Asam alkanoat mengandung gugus fungsi –CO- a. Sifat senyawa asam akrboksilat
1) Mempunyai ikatan hidrogen ssehingga mudah berikatan dengan air ; 2) Dengan bertambahnya suku, kereaktifannya berkurang ;
b. Kegunaan asam karboksilat
1) Asam asetat/asam alkanoat (asam cuka) digunakan untuk pembuatan serat sitentis, parfum, cat, obat-obatan, pewarnaan dan penyedap makanan ;
2) Asam oksalat digunakan sebagai penghilangan karat dan zat warna ;
3) Asam tartrat sebagai hasil samping fermentasi anggur, digunakan untuk pengasaman minuman, fotografi, permen, penyamakan dan pembuatan keramik ;
4) Asam metanoat (asam format) yang dihasilkan dari semut merah digunakan untuk vulkanisasi karet, kosmetik, tekstil dan desinfektan ;
5) Asam stearat, digunakan untuk pembuatan lilin ;
6) Asam karboksilat suku tinggi digunakan untuk pembuatan sabun ;
7) Asam laktat digunakan dalam industry kembang gula dan pengolahan ikan ;
7. Ester (Alkil alkanoat)
Ester/alkil alkanoat merupakan senywa karbon turunan dari asam karboksilat dimana gugus hidroksil (-OH) asam karboksilat diganti dengan gugus alkoksi (R-O-).
a. Sifat senyawa ester
1) Titik didih ester lebih rendah daripada asam karboksilat ; 2) Ester lebih mudah menguap dibandingkan asam atau alkohol ; 3) Memiliki bau yang harum dan sedikit larut dalam air ;
4) Merupakan senywa non elektrolit ;
5) Tidak memiliki ikatan hidrogen, hanya terdapat ikatan Vander Waals ; 6) Merupakan senyawa yang kurang reaktif ;
7) Senyawa ester umumnya memiliki aroma yang khas, sehingga banyak digunakan dalam industri makanan.
No Nama senyawa Aroma
1 Etil butirat Nanas
2 Etil format Rum
3 Isopentil asetat Pisang 4 n-oktil asetat Jeruk manis 5 n-propil butirat Apricot 6 Propel asetat Buah pir 7 Metal butirat apel
b. Kegunaan ester
1) Ester digunakan untuk pemberi aroma berbagai buah-buahan dan makan ; 2) Ester lemak digunakan untuk pembuatan mentega, margarine dan sabun ; 3) Ester lilin paraffin digunakan untuk lampu penerangan ;
4) Lilin wax digunakan untuk, pelindung/pemoles mobil, proses pembuatan batik dan pembuatan semir sepatu ;
Tugas Mandiri
1. Jelaskan apa yang dimaksud dengan gugus fungsi !
Jawab : ……….
2. Diantara senyawa berikut, kelompokkan berdasarkan gugus fungsinya : No Rumus Molekul No Rumus Molekul
1 C(CH3)2Br-CH3 5 CH3CH2CH(CH3)2-OH
2 CH3CH2COCH2CH3 6 CH3CH2Cl
3 Metal etanoat 7 3-pentanon
4 CH3CH2COOH 8 H-COO-CH3
Jawab : ……….
3. Jelaskan mengapa senyawa karbon memiliki sifat yang berbeda, meskipun mempunyai unsur pembentuk sama ?
Jawab : ……….
4. Sebutkan 5 contoh senyawa karboksilat yang bersumber dari alam !
Jawab : ……….
5. Sebutkan 4 (empat) sifat senyawa ester !
Jawab : ……….
6. Sebutkan 4 (empat) kegunaan senyawa alcohol !
Jawab : ……….
7. Tuliskan rumus struktur dari :
a. 2-metil-1butanol : ………..
b. 2-metil-2propanol : ………
8. Ester banyak digunakan sebagai penambah aroma (essence). Sebutkan 5 contoh makanan yang menggunakan aroma senyawa ester !
Jawab : ……….
9. Sebutkan dampak penggunaan senyawa berikut ini : a. Formalin b. DDT c. Freon d. Kloroform e. Methanol Jawab : ……….
10. Tuliskan rumus struktur senyawa ester berikut : a. Metal propanoat c. propil metanoat b. Etil etanoat d. isopropil metanoat
Jawab : ……….
I. Minyak Bumi
Minyak bumi berasal dari bahasa latin, yaitu petroleum. Petra berarti batuan dan oleum berarti minyak. Jadi, petroleum artinya minyak batuan. Petroleum terkait dengan fosil hewan dan tumbuhan yang ditemukan dalam kulit bumi sebagai gas, zat cair, dan zat padat.
Minyak bumi terbentuk akibat pelapukan sisa-sisa atau bangkai hewan dan tumbuhan renik serta lapisan-lapisan lumpur yang terkubur dalam jangka waktu jutaan tahun lamanya di dasar laut. Perubahan endapan fosil secara bertahap menjadi lapisan batuan endapan (sedimen) karena adanya tekanan dan suhu yang tinggi dari panas bumi. Endapan atau sedimen tersebut secara alami akan berubah menjadi minyak bumi dan gas alam.
1. Komposisi Minyak Bumi
Minyak bumi yang terdapat pada kulit bumi disertai dengan adanya gas alam. Komponen penyusun gas alam tersebut tergantung dari sumbernya. Gas alam merupakan campuran alkana dengan massa molekul sedang.
Sebagian komposisi minyak mentah merupakan hidrokarbon jenuh, yaitu alkana dan sikloalkana. Sebanyak 50% – 95%nya terdiri dari hidrokarbon alkana, sikloalkana, dan senyawa aromatik. Susunan hidrokarbon dalam minyak bumi berbeda-beda, tergantung dari umur dan suhu pembentukan zat tersebut.
a. Golongan alifatik
Alkana yang dimulai dari rantai pendek sampai rantai panjang dan rantai lurus maupun bercabang. Komponen yang paling banyak ditemukan adalah n-oktana atau isooktana (2,2,4-trimetil pentana).
b. Golongan alisiklik
Sikloalkana, alkana yang berupa rantai tertutup atau siklik, seperti siklopentana dan sikloheksana. Sikloalkana merupakan komponen tersebar setelah golongan alifatik.
c. Golongan aromatik
Senyawa hidrokarbon yang berbentuk siklik segienam dengan ikatan rangkap selang-seling (benzena dan turunannya).
d. Hidrokarbon tidak jenuh
Jumlahnya sangat sedikit karena mudah mengalami adisi membentuk hidrokarbon jenuh. e. Senyawa anorganik
1) Belerang = 0,01 – 0,7% terdapat sebagai R S R 2) Nitrogen = 0,01 – 0,9% terdapat sebagai pirol (C4H5N)
3) Oksigen = 0,06 – 0,4% terdapat R COOH (asam karboksilat) 4) Organologam = vanadium dan nikel (sedikit)
Gambar 4.1
Bahan bakar yang digunakan dalam kehidupan sehari-hari merupakan hasil pengolahan minyak bumi. Minyak bumi yang dihasilkan dari pengeboran tidak dapat langsung digunakan, tapi harus melalui proses distilasi bertingkat terlebih dahulu.
Pada distilasi bertingkat, pemisahan terjadi berdasarkan perbedaan titik didih berbagai hidrokarbon senyawa yang terdapat dalam minyak bumi. Perhatikan gambar diagram fraksionasi minyak bumi dengan distilasi bertingkat berikut:
Proses distilasi bertingkat merupakan cara untuk memisahkan komponen-komponen penyusun minyak bumi melalui kolom-kolom berfraksi dengan pelat-pelat dan sejumlah sungkup gelembung udara.
Hasil fraksionasi minyak bumi digunakan untuk berbagai keperluan. Hasil fraksionasi minyak bumi dan kegunaannya dapat dilihat pada tabel berikut:
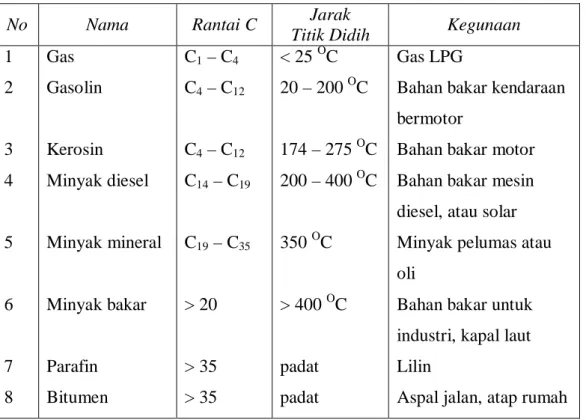
Tabel 4.4 Hasil fraksionasi minyak bumi dan kegunaannya
No Nama Rantai C Jarak
Titik Didih Kegunaan 1 2 3 4 5 6 7 8 Gas Gasolin Kerosin Minyak diesel Minyak mineral Minyak bakar Parafin Bitumen C1 – C4 C4 – C12 C4 – C12 C14 – C19 C19 – C35 > 20 > 35 > 35 < 25 OC 20 – 200 OC 174 – 275 OC 200 – 400 OC 350 OC > 400 OC padat padat Gas LPG
Bahan bakar kendaraan bermotor
Bahan bakar motor Bahan bakar mesin diesel, atau solar Minyak pelumas atau oli
Bahan bakar untuk industri, kapal laut Lilin
Aspal jalan, atap rumah
Gasolin, kerosin, atau bensin dan minyak tanah lebih banyak diperlukan daripada hidrokarbon yang rantainya lebih panjang. Untuk memenuhi kebutuhan bensin dan minyak tanah itu maka dilakukan pemecahan molekul hidrokarbon yang besar menjadi molekul kecil. Proses ini disebut cracking. Cara
melakukan cracking yaitu dengan pemanasan hidrokarbon rantai panjang pada suhu tinggi dan ditambah katalis Al2O3 atau SiO2.
3. Bensin
Bensin adalah campuran isomer-isomer heptana (C7H16) dan oktana (C8H18). Bensin dari hidrokarbon rantai lurus kurang efisien untuk menggerakkan mesin kendaraan. Kurangnya efisiensi ini ditandai dengan suara ketukan (knocking) pada mesin kendaraan. Dengan demikian, sebaiknya menggunakan bensin yang komponennya senyawa hidrokarbon bercabang. Komponen bensin yang paling banyak cabangnya adalah 2,2,4-trimetil pentana atau isooktana dengan rumus:
Bensin yang dijual di pasaran merupakan campuran isooktana dengan alkana-alkana lainnya, seperti heptana dan oktana. Persentase isooktana dalam suatu bensin disebut angka oktan (bilangan oktan). Misalnya campuran yang mengandung 20% n-heptana dan 80% isooktana, mempunyai bilangan oktan 80. Mutu atau kualitas bensin ditentukan oleh besarnya bilangan oktan.
Makin tinggi harga bilangan oktan suatu bensin, berarti bensin tersebut makin bagus atau makin efisien dalam menghasilkan energi. Bensin premium memiliki bilangan oktan antara 80 – 84 sedangkan petramax mempunyai bilangan oktan 92 – 94. Selain itu, di pasaran dikenal pula petramax plus yang memiliki bilangan oktan 98.
Bila bilangan oktan bensin rendah, pada mesin kendaraan akan timbul suara ketukan (knocking) sehingga mesin mudah panas dan rusak. Untuk meningkatkan bilangan oktan pada bensin ditambahkan TEL (Tetra Etyl Lead) dengan rumus kimia Pb(C2H5)4. TEL dikenal sebagai anti knocking. Penggunaan TEL ini ternyata menimbulkan masalah yaitu timbulnya pencemaran udara oleh partikulat Pb.
Sekarang penggunaan TEL sebagai zat aditif pada bensin tidak diperbolehkan lagi dan digantikan oleh senyawa lain yang lebih ramah lingkungan yaitu MTBE (Methyl Tertiary Buthyl Ether). Contoh bensin yang menggunakan MTBE adalah pertamax dan pertamax plus.
Berdasarkan data yang didapat dari Museum Minyak dan Gas Bumi Graha Widya Patra di TMII Jakarta, lapangan produksi minyak dan gas bumi di Indonesia berjumlah 51 tempat, antara lain di Minas (sumur Minas merupakan lapangan minyak yang terbesar di Asia Tenggara), kilang minyak Wonokromo, kilang minyak Plaju, lapangan minyak Cepu, kilang minyak sungai Gerong, lapangan minyak Tarakan, kilang minyak Pangkalan Brandan, kilang minyak Dumai, dan kilang minyak Balongan. Kilang gas terdapat di LNG Arun, LNG Badak (Bontang), LPG Mundu (Cirebon), dan LPG Rantau (Aceh).
H3C – C – CH2 – CH – CH3 CH3
Tugas Mandiri 6
1. Sebutkan komponen penyusun minyak bumi!
Jawab : ………..……… ……… 2. Sebutkan hasil penyulingan minyak bumi dan kegunaannya!
Jawab : ………..……… ……… 3. Jelaskan istilah-istilah berikut:
a. TEL : ……… c. LPG : ………
b. MTBE : ……… d. LNG : ………
4. Jelaskan apa yang dimaksud dengan bilangan oktan?
Jawab : ………..……… ……… 5. Apa fungsi dari penambahan MTBE?
Jawab : ………..……… ………