UJI ANALGETIK EKSTRAK ETANOL 70% BATANG BROTOWALI (Tinospora crispa (L.) Miers.)
PADA MENCIT PUTIH JANTAN SWISS DENGAN METODE RANGSANG KIMIA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Farmasi
Oleh:
R.R. Fransiska Dewi Kusumo Wardhani NIM: 048114090
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
ii
UJI ANALGETIK EKSTRAK ETANOL 70% BATANG BROTOWALI (Tinospora crispa (L.) Miers.)
PADA MENCIT PUTIH JANTAN SWISS DENGAN METODE RANGSANG KIMIA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Farmasi
Oleh:
R.R. Fransiska Dewi Kusumo Wardhani NIM: 048114090
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
v
HALAMAN PERSEMBAHAN
Kupersembahkan karyaku kepada...
Allah Bapa di surga , putra-Nya Yesus Kristus Juru Selamatku, dan Bunda Maria Papa dan Mama tercinta atas semua cinta dan doanya
Kakak dan seluruh keluargaku tercinta
Semua sahabat-sahabatku yang selalu setia memberikan dukungan dan doa Almamaterku tercinta
vi
PRAKATA
Puji syukur kepada Tuhan Yang Maha Esa atas berkat dan karunia-Nya
sehingga penulis dapat menyelesaikan skripsi yang berjudul: “Uji Analgetik Ekstrak
Etanol 70% Batang Brotowali (Tinospora Crispa (L.) Miers.) pada Mencit Putih
Jantan Swiss dengan Metode Rangsang Kimia”, sebagai salah satu syarat untuk
mencapai gelar Sarjana Farmasi Universitas Sanata Dharma Yogyakarta.
Dalam penelitian dan penyusunan skripsi ini penulis telah mendapat banyak
bantuan dan dukungan dari berbagai pihak sehingga skripsi ini dapat terselesaikan
dengan baik. Oleh karena itu, pada kesempatan ini penulis ingin mengucapkan terima
kasih yang sebesar-besarnya kepada :
1. Rita Suhadi , M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta dan Dosen Pembimbing Akademis.
2. Arief Rahman Hakim, M.Si., Apt., selaku Dosen Pembimbing Utama atas
bimbingan, pengarahan, dan dukungannya selama penelitian sampai penyusunan
skripsi ini.
3. Yohanes Dwiatmaka, M.Si. selaku Dosen Penguji yang telah memberikan
masukan , kritik, dan saran untuk kesempurnaan skripsi ini.
4. dr. Fenty, M.Kes., Sp.PK. selaku Dosen Penguji yang telah memberikan
masukan, kritik, dan saran untuk kesempurnaan skripsi ini.
5. Segenap dosen dan karyawan Fakultas Farmasi Universitas Sanata Dharma
vii
6. Kepala Balai Besar Penelitian dan Pengembangan Tanaman Obat dan Obat
Tradisional yang telah membantu dalam penyediaan serbuk simplisia batang
brotowali dan determinasi tumbuhan.
7. Kedua orang tuaku Agustinus Wibowo S. dan Laela Suwaela yang selalu
mendoakan dan memberi motivasi dan materi dalam mendukung penelitian ini
serta kakakku yang memberi semangat tersendiri.
8. Keluarga besarku yang selalu mendukung dan mendoakanku, terutama sepupuku
Dita dan Winda.
9. Teman-teman “seperjuangan” di Laboratorium, Meidina, Anggi, Indra dan Filisia
yang banyak membantu saat penelitian.
10.Teman-teman angkatan 2004 terutama kelompok praktikum D, Ivonne, Indah,
Suster Amandine, Ratna, Rizky, Widya, Avi, Feri DS, dan teman-teman FKK angkatan 2004, terima kasih atas kerjasamanya dan dukungannya selama ini.
11.Teman-teman kos Zusi Arib, Meli, Tuti, Mamith, Ntrie, Archy, Evi, Ma’dum,
Lina, Thea, Mukti, Ina, Kristin, Angel, Hilaria, dan Vivi, terima kasih atas canda
tawa, dukungan, dan rasa persaudaraan yang telah diberikan selama ini.
12.Sahabat-sahabatku Livia, Rani, Honey, Didit, Elly, Cindy, Vita, terima kasih atas
dukungannya yang membuat penulis tetap bersemangat.
13.Semua pihak yang tidak dapat disebutkan satu per satu yang telah membantu
viii
Penulis menyadari bahwa penulisan skripsi ini masih jauh dari sempurna
baik dalam hal isi, maupun bahasa. Oleh karena itu saran dan kritik yang
membangun sangat penulis harapkan untuk menyempurnakan skripsi ini. Akhir kata,
penulis berharap semoga skripsi ini dapat bermanfaat dan menjadi sumbangan dalam
perkembangan ilmu pengetahuan.
Yogyakarta, 31 Juli 2008
x
INTISARI
Brotowali (Tinospora crispa (L) Miers.) merupakan salah satu tanaman yang bisa digunakan sebagai obat tradisional. Brotowali sering digunakan dalam pengobatan demam, sakit perut, rematik, sakit kuning, gatal-gatal, sakit kepala, dan kencing manis. Penelitian ini bertujuan untuk menguji efek analgetik dan besarnya daya analgetik ekstrak etanol 70% batang brotowali pada mencit jantan.
Jenis penelitian ini merupakan jenis penelitian eksperimental murni dengan menggunakan rancangan acak lengkap pola satu arah. Subyek uji yang digunakan yaitu mencit putih jantan Swiss sebanyak 42 ekor, yang terbagi dalam 6 kelompok. Kelompok I sebagai kontrol negatif menggunakan natrium karboksimetilselulose 0,5%. Kelompok II sebagai kontrol positif menggunakan suspensi parasetamol dalam natrium karboksimetilselulose 0,5% dengan dosis 91 mg/kgBB. Kelompok III-VI sebagai kelompok perlakuan ekstrak etanol 70% batang brotowali dengan dosis 66; 132; 264; dan 528 mg/kgBB. Bahan uji dan kontrol diberikan secara peroral. Setelah 15 menit, rangsang asam asetat dosis 100 mg/kgBB diberikan secara intraperitoneal kemudian geliat mencit diamati dan dicatat dalam kurun waktu 5 menit selama 60 menit. Jumlah kumulatif geliat diubah ke dalam bentuk persentase penghambatan geliat. Data yang diperoleh dianalisis mengunakan uji Kolmogorov-Smirnov, One-Way ANOVA, dan dilanjutkan dengan uji LSD.
Pada penelitian ini diperoleh persentase penghambatan geliat pada parasetamol dosis 91 mg/kgBB sebesar 55,71% dan ekstrak etanol 70% batang brotowali dosis 66; 132; 264; dan 528 mg/kgBB sebesar 49,27%, 67,57%, 79,83%, dan 86,69%.
Kata kunci : analgetik, ekstrak etanol 70% batang brotowali
xi
ABSTRACT
Brotowali (Tinospora crispa (L) Miers.) is one of plants that can be used as a traditional medicine. Brotowali is often used by people as therapy for antipyretic, stomachache, rheumatic, jaundice, itc, headache and antidiabetes. The research had been done to prove the analgetic effect and analgetic potency of 70% ethanolic extract of brotowali’s stems.
The research was a pure experimental research with one way random complete design. The test subjects were 42 white male Swiss mice and separated on 6 groups. Group I as a negative control used natrium carboxymethylcellulose 0,5%. Group II as a positive control used paracetamol suspension in natrium carboxymethylcellulose 0.5% which dosage was 91 mg/kg of body weight. Groups III-VI as groups test used 70% ethanolic extract of brotowali’s stems which dosage were 66; 132; 264; and 528 mg/kg of body weight. Extract and control were given by oral injection. Fifteen minutes later, acetic acid was given in mice by intraperitoneal administration, dosage 100 mg/kg of body weight. The writhing responds are watched closely and booked every 5 minutes in 60 minutes. The accumulation numbers of the writhing responds are transferred into the form of resistance percentage of writhing protection. The data which is got from the calculation, later, is analyzed statistically by Kolmogorov-Smirnov, One Way ANOVA, and LSD Test.
By this experiments, percentage of writhing protection in paracetamol at 91 mg/kgBB were 55.71% and 70% ethanolic extract of brotowali’s stems at 66; 132; 264; and 528 mg/kg of body weight were 49.27%, 67.57%, 79.83%, and 86.69%.
xii
DAFTAR ISI
Halaman
HALAMAN JUDUL……… ii
HALAMAN PERSETUJUAN PEMBIMBING……….. iii
HALAMAN PENGESAHAN……….. iv
HALAMAN PERSEMBAHAN……….. v
PRAKATA………....……… vi
PERNYATAAN KEASLIAN………. ix
INTISARI……… x
ABSTRACT………... xi
DAFTAR ISI………. xii
DAFTAR TABEL………. xvi
DAFTAR GAMBAR……… xviii
DAFTAR LAMPIRAN…….………... xx
BAB I. PENGANTAR………. 1
A. Latar Belakang………. 1
1. Permasalahan……… 3
2. Keaslian Penelitian………... 3
3. Manfaat Penelitian………... 5
B. Tujuan Penelitian……….. 5
BAB II. PENELAAHAN PUSTAKA ... 6
A. Tumbuhan brotowali ... 6
xiii
2. Morfologi ... 6
3. Nama Daerah ... 6
4. Kandungan Kimia ... 6
5. Kegunaan... 8
B. Metode Penyarian ... 9
C. Radikal Bebas dan Antioksidan ... 10
1. Radikal Bebas ... 10
2. Antioksidan ... 11
D. Nyeri ... 12
1. Definisi Nyeri... 12
2. Jenis Nyeri... 13
3. Mekanisme Nyeri... 14
E. Analgetika ... 19
F. Parasetamol... 20
G. Metode Pengujian Efek Analgesik ... 22
H. Landasan Teori ... 26
I. Hipotesis ... 28
BAB III. METODOLOGI PENELITIAN... 29
A. Jenis Rancangan Penelitian ... 29
B. Metode Penelitian ... 29
C. Variabel dan Definisi Operasional ... 30
1. Variabel ... 30
xiv
D. Bahan Penelitian ... 31
E. Alat Atau Instrumen Penelitian ... 33
1. Alat Ekstraksi ... 33
2. Alat Uji Geliat... 33
F. Tata Cara Penelitian ... 33
1. Pembuatan Sediaan Uji ... 33
2. Uji pendahuluan ... 38
3. Uji Utama ... 42
BAB IV. HASIL DAN PEMBAHASAN ... 46
A. Pengumpulan Bahan dan Pembuatan Serbuk ... 46
B. Pembuatan Ekstrak Batang Brotowali ... 47
C. Uji Pendahuluan ... 48
1. Penetapan kriteria geliat ... 49
2. Penetapan dosis asam asetat ... 49
3. Penetapan kontrol negatif ... 51
4. Penetapan dosis parasetamol dan ekstrak batang brotowali ... 53
5. Penetapan selang waktu pemberian antara parasetamol dengan rangsang asam asetat ... 57
6. Penetapan selang waktu pemberian antara ekstrak batang brotowali dengan rangsang asam asetat ... 59
xv
BAB V. KESIMPULAN DAN SARAN ... 74
A. Kesimpulan ... 74
B. Saran ... 74
DAFTAR PUSTAKA ... 75
LAMPIRAN ... 79
xvi
DAFTAR TABEL
Halaman
Tabel I. Jumlah kumulatif geliat hewan uji pada penetapan dosis
efektif asam asetat... 50
Tabel II. Jumlah kumulatif geliat hewan uji pada penetapan kontrol
negatif ... 52
Tabel III. Jumlah kumulatif geliat dan % penghambatan geliat pada
penetapan dosis parasetamol dan ekstrak etanol 70%
batang brotowali... 54
Tabel IV. Hasil analisis LSD % penghambatan geliat pada penetapan
dosis parasetamol dan ekstrak batang brotowali... 56 Tabel V. Jumlah kumulatif geliat dan % penghambatan geliat pada
penetapan selang waktu pemberian antara parasetamol dengan
rangsang asam asetat... 58
Tabel VI. Hasil analisis uji LSD % penghambatan geliat pada penetapan
selang waktu pemberian antara parasetamol 91 mg/kgBB dengan
rangsang asam asetat... 59
Tabel VII. Jumlah kumulatif geliat dan % penghambatan geliat pada
penetapan selang waktu pemberian antara ekstrak brotowali 264
mg/kgBB dengan rangsang asam asetat... 60
Tabel VIII. Hasil analisis uji LSD % penghambatan geliat pada penetapan
xvii
asam asetat... 61
Tabel IX. Jumlah kumulatif geliat hewan uji dan % penghambatan geliat
pada kelompok perlakuan uji utama... 64
Tabel X. Hasil analisis uji LSD % penghambatan geliat pada kelompok
perlakuan... 66
Tabel XI. Persentase penghambatan geliat pada kelompok perlakuan
xviii
DAFTAR GAMBAR
Halaman
Gambar 1. Kerangka flavonoid (1a) dan sistem penomoran turunan
flavonoid (1b) ... 7
Gambar 2. Mekanisme proses nyeri ... 16
Gambar 3. Perombakan asam arakhidonat... 17
Gambar 4. Tempat berakhirnya serabut aferen pada 6 lapisan dari sumsum
tulang belakang... 18
Gambar 5. Struktur molekul parasetamol ... 21
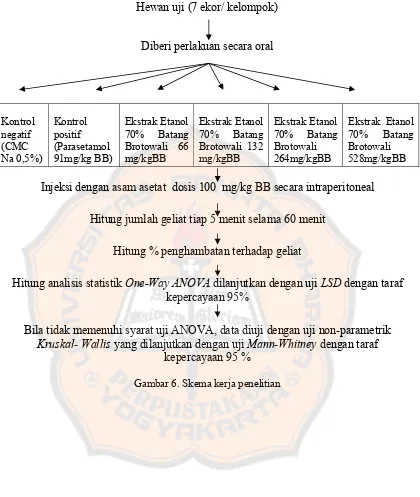
Gambar 6. Skema kerja penelitian ... 45
Gambar 7. Diagram batang rata-rata jumlah kumulatif geliat pada penetapan dosis efektif asam asetat... 50
Gambar 8. Diagram batang rata-rata jumlah kumulatif geliat pada penetapan
kontrol negatif... 52
Gambar 9. Diagram batang rata-rata jumlah kumulatif geliat (a) dan
% penghambatan geliat (b) pada penetapan dosis
parasetamol... 55
Gambar 10. Diagram batang rata-rata jumlah kumulatif geliat (a) dan
% penghambatan geliat (b) pada penetapan dosis ekstrak
etanol 70 % batang brotowali... 55
Gambar 11. Diagram batang rata-rata jumlah kumulatif geliat (a) dan
xix
antara parasetamol 91 mg/kgBB dengan rangsang asam asetat... 58
Gambar 12. Diagram batang rata-rata jumlah kumulatif geliat (a) dan % penghambatan geliat (b) pada penetapan selang waktu pemberian antara ekstrak batang brotowali dengan rangsang asam asetat... 60
Gambar 13. Diagram batang rata-rata jumlah kumulatif geliat (a) dan % penghambatan geliat (b) pada pengujian efek analgetik... 65
Gambar 14. Perbandingan rata-rata % penghambatan geliat ekstrak batang brotowali pada mencit jantan dan mencit betina... 71
Gambar 15. Rata-rata % penghambatan geliat dari infusa batang brotowali pada mencit betina (a) dan ekstrak etanol batang brotowali pada mencit jantan (b)... 72
Gambar 16. Tumbuhan brotowali ... 81
Gambar 17. Batang brotowali ... 81
Gambar 18. Serbuk batang brotowali ... 82
Gambar 19. Ekstrak etanol 70% batang brotowali, (a) ekstrak cair, (b) ekstrak kental... 82
xx
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat keterangan determinasi simplisia batang brotowali
(Tinospora crispa (L.) Miers... 78
Lampiran 2. Foto tumbuhan, batang, serbuk batang brotowali, ekstrak
etanol 70% batang brotowali dan geliat mencit... 81
Lampiran 3. Data jumlah geliat hewan uji dan hasil analisis statisitk
pada penetapan dosis efektif asam asetat... 84
Lampiran 4. Data jumlah geliat hewan uji kontrol negatif (CMC-Na) dan
hasil analsis statisitik pada penetapan kontrol negatif... 86
Lampiran 5. Data jumlah geliat hewan uji dan hasil analisis variansi satu arah pada penetapan dosis efektif parasetamol dan penetapan
dosis efektif ekstrak etanol 70% batang brotowali... 88
Lampiran 6. Data % penghambatan geliat dan hasil analisis variansi satu
arah pada penetapan dosis efektif parasetamol dan penetapan
dosis efektif ekstrak etanol 70% batang brotowali... 91
Lampiran 7. Data jumlah geliat hewan uji dan hasil analisis variansi satu
arah pada penetapan selang waktu pemberian efektif antara
parasetamol dengan asam asetat... 93
Lampiran 8. Data % penghambatan geliat dan hasil analisis variansi satu
arah pada penetapan selang waktu pemberian efektif antara
xxi
Lampiran 9. Data jumlah geliat hewan uji dan hasil analisis variansi satu
arah pada penetapan selang waktu pemberian efektif antara
ekstrak brotowali (264 mg/kgBB) dengan asam asetat... 97
Lampiran 10. Data % penghambatan geliat dan hasil analisis variansi satu
arah pada penetapan selang waktu pemberian efektif antara
ekstrak brotowali (264 mg/kgBB) dengan asam asetat... 99
Lampiran 11. Data jumlah geliat hewan uji setelah pemberian asam asetat dan
hasil analisis statistik pada semua kelompok perlakuan... 101
Lampiran 12. Data % penghambatan geliat dan hasil analisis statistik pada
semua kelompok perlakuan... 116
Lampiran 13. % Potensi relatif ekstrak terhadap parasetamol... 121 Lampiran 14. Data % penghambatan geliat dan hasil analisis statistik semua
kelompok perlakuan pada mencit jantan dan betina... 122
Lampiran 15. Data % penghambatan geliat dan hasil analisis statistik kelompok
perlakuan ekstrak etanol 70% dan infusa batang brotowali pada
dosis yang setara... 127
Lampiran 16. Cara perhitungan % penghambatan geliat terhadap kontrol
negatif dan % potensi relatif ekstrak terhadap kontrol positif.... 128
1 BAB I PENGANTAR A. Latar Belakang
Sejak zaman dahulu, berbagai macam jenis tumbuhan telah digunakan secara luas dalam metode pengobatan tradisional dan masyarakat saat ini cenderung untuk kembali memanfaatkan bahan-bahan alami dalam proses pengobatan suatu penyakit. Hal ini terjadi karena pengobatan tradisional dirasa memiliki risiko efek samping yang lebih ringan daripada pengobatan dengan bahan kimia.
Menurut Harborne (1984) flavonoid umumnya larut dalam air dan dapat diekstraksi dengan etanol 70%. Oleh karena itu pada penelitian ini akan dilihat khasiat tumbuhan brotowali sebagai analgetika jika dilarutkan dalam pelarut polar selain air, yaitu etanol 70%. Menurut Anonim (1986) etanol dipertimbangkan sebagai penyari karena sifatnya yang lebih selektif, tidak beracun, dan absorpsinya lebih baik. Kapang dan jamur akan sulit tumbuh dalam etanol 20% ke atas sehingga sediaan ekstrak etanol relatif lebih tahan lama dan banyak digunakan dalam skala industri. Bentuk sediaan ekstrak etanol juga dipilih karena jumlah zat aktif yang terlarut lebih banyak sehingga diharapkan efek farmakologis yang muncul akan lebih optimal.
1. Permasalahan
a. Apakah ekstrak etanol 70% batang brotowali memiliki efek analgetik terhadap mencit putih jantan ?
b. Seberapa besar persentase daya analgetik yang dimiliki ekstrak etanol 70%
batang brotowali pada mencit putih jantan ? 2. Keaslian Penelitian
Sepanjang penulusuran pustaka penulis di Perpustakaan Universitas Sanata Dharma dan Universitas Gadjah Mada penelitian mengenai uji analgetik ekstrak etanol 70% batang brotowali terhadap mencit jantan belum pernah dilakukan. Adapun penelitian-penelitian tentang tanaman brotowali yang pernah dilakukan adalah sebagai berikut :
1. Pengaruh Infus Batang Brotowali(Tinospora tuberculata Beumee.) terhadap Berat Badan Tikus Putih (Suhartinah,1985).
2. Efek Analgetik Infus Batang Brotowali (Tinospora crispa (L) Miers) pada Mencit Putih Jantan (Teruna, 1987 cit. Soedibyo, 1998).
3. Efek Anti Inflamasi Infus Batang Brotowali (Tinospora crispa (L) Miers) pada Tikus Putih Jantan (Rivai, 1987 cit. Soedibyo, 1998).
4. Uji Fraksi Ekstrak Batang Brotowali (Tinospora crispa (L) Miers) terhadap Beberapa Bakteri Penyebab Diare secara Invitro (Iskandar, 1990 cit. Soedibyo, 1998).
6. Uji Repelan Rebusan Batang Brotowali (Tinospora crispa (L) Miers. Ex Hook f. & Thems.) terhadap Aedes aegepty (Hayati, 1997).
7. Daya Penolak Serangga Ekstrak Batang Brotowali (Tinospora crispa (L) Miers. Ex Hook f. & Thems.) yang Diberikan secara Peroral Pada Marmut terhadap Nyamuk Aedes aegepty (Sulistyowati, 1999).
8. Efek Repelan Ekstrak Batang Brotowali Tinospora crispa (L) Miers. Ex Hook f. & Thems.) terhadap Aedes aegepty secara Topikal (Mubayinah, 1999).
9. Aktivitas Ekstrak Petroleum Eter dan Fraksi Metanol Batang Brotowali Tinospora crispa (L) Miers. Ex Hook f. & Thems.) terhadap Pertumbuhan Candida albicans In Vitro (Silawati, 2001).
10. Efek Infus Batang Brotowali Tinospora crispa (L) Miers. Ex Hook f. & Thems.)
terhadap Nyamuk Aedes aegepty serta Analisis Kualitatif Kandungan Kimianya secara KLT (Pooe, 2001).
11. Uji Sitotoksisitas Ekstrak Kloroform Batang Brotowali (Tinospora crispa (L.) Miers.) terhadap Sel Myeloma dan Profil KLT-nya (Elfrieda, 2004).
12. Uji Sitotoksisitas Ekstrak Etanolik Batang Brotowali Tinospora crispa (L) Miers.) terhadap Sel Hela serta Profil KLT-nya (Rahayu, 2004).
13. Pengaruh Pemberian Ekstrak Batang Brotowali (Tinospora crispa (L) Miers.) peroral terhadap Pertumbuhan dan Perkembangan Plasmodium bergehi pada mencit in vivo (Astuti, 2005).
15. Efek Analgetik Infusa Batang Brotowali (Tinospora crispa (L.) Miers.) pada Mencit Putih Betina (Handara, 2006).
3. Manfaat Penelitian a. Manfaat teoritis
Penelitian ini diharapkan dapat memberikan informasi yang berguna tentang penggunaan tanaman obat sebagai analgetika.
b. Manfaat praktis
Penelitian ini diharapkan dapat memberikan informasi kepada masyarakat tentang kegunaan ekstrak etanol 70% batang brotowali sebagai analgetika.
B. Tujuan Penelitian
1. Untuk mengetahui ada tidaknya efek analgetik ekstrak etanol 70% batang brotowali terhadap mencit putih jantan.
6
BAB II
PENELAAHAN PUSTAKA
A. Tumbuhan Brotowali
1. Keterangan Botani
Menurut Backer dan Bakhuizen, (1965) tumbuhan brotowali diklasifikasikan ke dalam famili: Menispermaceae; genus: Tinospora dan spesies: Tinospora crispa (L.) Miers. ex Hook. f & Thems. Tumbuhan brotowali juga mempunyai nama lain, yaitu Tinospora rumphii Boerl. dan Tinospora tuberculata (Lamk) Beaumae ex Heyne. (Anonim, 1978)
2. Morfologi
Perdu memanjat, tinggi batang sampai 2,5 cm, berkutil-kutil yang rapat, pepagannya mudah terkelupas. Daun bertangkai, panjang sampai 16 cm, bentuknya seperti jantung atau agak membundar telur tetapi berujung runcing, lebar 6 cm sampai 13 cm. Perbungaan berbentuk tandan semu dengan 1 sampai 3 bunga bersama-sama, menggantung panjang 7 cm sampai 25 cm. Bunga (jantan) bergagang pendek 3 mm sampai 4 mm, kelopak 6, hijau, panjang lebih kurang 3,5 mm, daun mahkota 3, panjang lebih kurang 8 mm (Anonim, 1978).
3. Nama Daerah
Jawa: Danawali (Sunda), antawali, daun gadel, bratawali, putrawali (Jawa). Nusatenggara: Antawali (Bali). Indonesia : Brotowali (Anonim, 1986)
4. Kandungan Kimia
palmatin, harsa dan zat pahit pikroretin, sedangkan akarnya mengandung alkaloid berberina dan kolumbina. (Anonim, 1978; Syamsuhidayat dan Hutapea, 1991; Soedibyo, 1998).
Hasil pemeriksaan kandungan senyawa kimia terhadap ekstrak etanol batang tumbuhan brotowali secara kualitatif dengan metode Kromatografi Lapis Tipis menunjukkan adanya senyawa flavonoid, alkaloid, dan terpenoid (Rahayu, 2004). Flavonoid
Flavonoid adalah senyawa fenol alam yang terdapat dalam hampir semua tumbuhan dari bangsa Algae hingga Gimnospermae. Di dalam tumbuhan, flavonoida biasanya berikatan dengan gula sebagai glikosida (Mursyidi, 1990). Flavonoid merupakan kandungan khas tumbuhan hijau dan sebenarnya terdapat pada semua bagian tumbuhan termasuk daun, akar, kayu, kulit, tepungsari, nektar, bunga, buah buni, dan biji (Markham, 1982).
Golongan flavonoid dapat digambarkan sebagai deretan senyawa C6-C3-C6
artinya, kerangka karbonnya terdiri dari dua gugus C6 ( cincin benzena tersubsitusi)
yang disambungkan oleh rantai alifatik tiga karbon.
C C C
Gambar 1 . Kerangka flavonoid (a) dan sistem penomoran turunan flavonoid (b) (Robinson, 1995)
vasoprotektif sebagai penghambat promotor tumor dan untuk proteksi pada mukosa saluran cerna atau gastrik. Efek-efek tersebut berhubungan dengan pengaruh flavonoid pada metabolisme asam arakhidonat (Evans, 2002). Flavonoid dapat bekerja sebagai inhibitor lipooksigenase. Penghambatan lipooksigenase dapat menimbulkan pengaruh lebih luas karena reaksi lipooksigenase merupakan langkah pertama pada jalur yang menuju ke hormon eikosanoid seperti prostaglandin dan tromboksan (Robinson, 1995). Flavonoid merupakan suatu kelompok antioksidan polifenol yang memiliki kemampuan sebagai scavenger superoksida, oksigen singlet, dan radikal peroksi lipid (Sitompul, 2003).
Flavonoid umumnya larut dalam air dan dapat diekstraksi dengan etanol 70%. Pada penyarian lebih lanjut digunakan petroleum eter (PE), etanol 80%, dan pelarut organik lain, flavonoid tetap berada dalam lapisan air (Harborne, 1984).
5. Kegunaan
B. Metode Penyarian
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan (Anonim,1995).
Cairan penyari yang digunakan untuk ekstraksi menurut Farmakope Indonesia adalah air, eter, atau campuran etanol dan air. Etanol digunakan sebagai penyari karena lebih selektif, kapang/kuman sulit tumbuh dalam etanol di atas 20%, tidak beracun, bersifat netral, absorpsinya baik, dapat bercampur dengan air, panas yang digunakan untuk pemekatan lebih sedikit (Anonim, 1986).
Perkolasi adalah cara penyarian yang dilakukan dengan mengalirkan melalui serbuk simplisia yang telah dibasahi. Prinsip perkolasi adalah sebagai berikut: serbuk simplisia ditempatkan dalam suatu bejana silinder yang bagian bawahnya diberi sekat berpori. Cairan penyari dialirkan dari atas ke bawah melalui serbuk tersebut, cairan penyari akan melarutkan zat aktif dari sel-sel yang dilaluinya sampai mencapai keadaan jenuh. Gerak ke bawah disebabkan oleh kekuatan gaya beratnya sendiri dan cairan di atasnya, dikurangi dengan daya kapiler yang cenderung untuk menahan (Anonim, 1986). Perkolasi merupakan ekstraksi dengan pelarut yang selalu baru sampai sempurna (exhaustive extraction), yang umumnya dilakukan pada temperatur ruangan.
yang keluar dari perkolator disebut perkolat atau sari, sedangkan sisa setelah penyarian disebut ampas atau sisa perkolasi (Anonim,1986).
Menurut Anonim (1986), cara perkolasi lebih baik daripada dengan cara maserasi karena:
1. Aliran cairan penyari menyebabkan adanya pergantian larutan yang terjadi dengan larutan yang konsentrasinya lebih rendah, sehingga meningkatkan derajat perbedaan konsentrasi.
2. Ruangan di antara butir-butir serbuk simplisia membentuk saluran tempat mengalir cairan penyari. Karena kecilnya saluran kapiler tersebut maka kecepatan pelarut cukup untuk mengurangi lapisan batas sehingga dapat meningkatkan perbedaan konsentrasi.
C. Radikal Bebas dan Antioksidan
1. Radikal Bebas
Radikal bebas adalah suatu molekul yang reaktif karena kehilangan satu atau lebih elektron yang bermuatan listrik yang seharusnya mengorbit berpasangan. Dalam tubuh, radikal bebas dapat merusak sel-sel untuk memperoleh elektron guna menstabilkan dirinya (Setiati, 2003). Radikal bebas akan merusak molekul yang elektronnya ditarik oleh radikal bebas tersebut sehingga menyebabkan kerusakan sel, gangguan fungsi sel, bahkan kematian sel. Molekul utama di dalam tubuh yang dirusak oleh radikal bebas yaitu DNA, lemak, dan protein (Setiati, 2003).
retikulum endoplasma, dan intisel. Sedangkan secara eksogen, radikal bebas berasal dari asap rokok, polutan radiasi, obat-obatan, dan pestisida (Setiati, 2003). Radikal bebas yang berlebihan akan menyebabkan kerusakan jaringan sehingga menimbulkan nyeri. Dalam proses peradangan, radikal bebas terbentuk ketika asam arakhidonat dikonversikan menjadi peroksida baik melalui jalur siklooksigenase maupun lipooksigenase. Ketika terjadi kerusakan jaringan organ, jumlah radikal bebas meningkat seiring dengan peningkatan produksi peroksida, padahal tubuh memproduksi antioksidan endogen yang terbatas contohnya yaitu superoksida dismutase (SOD), katalase, dan glutation peroksidase (GSH Px) yang bekerja menstabilkan radikal bebas. Apabila jumlah radikal bebas makin banyak, antioksidan endogen tak mampu lagi melumpuhkannya secara efektif sehingga harus ada tambahan antioksidan dari luar (eksogen) yang berasal dari bahan makanan (Sibuea, 2004).
2. Antioksidan
Antioksidan adalah suatu senyawa yang dapat menghambat atau mencegah kerusakan karena oksidasi pada suatu molekul target. Antioksidan mempunyai struktur molekul yang dapat memberikan elektronnya dengan cuma-cuma kepada radikal bebas tanpa terganggu sama sekali dan dapat memutus reaksi berantai dari radikal bebas (Setiati, 2003)
superoksid dismutase (SOD), glutation peroksidase (GPx), peroksidase/katalase, dan glutation (GSH). Antioksidan eksogen atau yang dikenal juga sebagai antioksidan sekunder karena menangkap radikal dan mencegah reaksi berantai, contohnya adalah vitamin E (tokoferol), vitamin C (askorbat), karoten, asam urat bilirubin, flavonoid, dan albumin. Selain itu terdapat juga antioksidan tersier yang memperbaiki kerusakan biomolekuler yang disebabkan oleh radikal bebas (Setiati, 2003).
Banyak antioksidan yang ditemukan di alam, seperti pada sayuran, buah segar dan pada tumbuhan obat (herbal antioksidan). Antioksidan dari tumbuhan obat seperti jamu-jamuan telah lama digunakan oleh praktisi kedokteran natural di seluruh dunia. Riset modern terhadap antioksidan herbal ini menyatakan bahwa sifat medis dari tumbuhan tersebut disebabkan oleh senyawa yang dikandungnya, terutama flavonoid (Setiati, 2003). Flavonoid merupakan scavenger superoksida, oksigen singlet dan radikal peroksi lipid. Di dalam keluarga polifenol, flavonoid ternyata mempunyai sifat antioksidan yang amat kuat yang mencapai 20 kali sifat antioksidan vitamin E (Sitompul, 2003).
D. Nyeri
1. Definisi Nyeri
potensial. Nyeri merupakan suatu fungsi biologis sebagai penanda adanya bahaya eksternal (misal: panas atau trauma fisik) dan proses patologi internal (misal: inflamasi atau penyumbatan saluran kemih oleh batu ginjal).
Keadaan psikis sangat mempengaruhi nyeri, misalnya emosi dapat menimbulkan rasa sakit (kepala) atau memperhebatnya, tetapi dapat pula menghindarkan sensasi rangsangan nyeri. Nyeri dikatakan pula sebagai suatu perasaan pribadi dimana ambang toleransi nyeri berbeda-beda bagi setiap orang. Ambang nyeri didefinisikan sebagai tingkat (level) dimana nyeri dirasakan untuk pertama kali. Jadi, intensitas rangsangan yang terendah saat seseorang merasakan nyeri. Rasa nyeri dalam kebanyakan hal hanya merupakan gejala, yang berfungsi melindungi tubuh (Tjay dan Rahardja, 2002).
2. Jenis Nyeri
Nyeri dapat dibedakan berdasarkan waktu timbulnya nyeri yaitu: nyeri akut dan nyeri kronik (Anonim, 2001). Nyeri akut dengan kecepatan penjalaran antara 6-30 meter per detik biasanya memiliki sebuah penyebab yang dapat ditegaskan dan sering kali berfungsi sebagai perlindungan yang bertindak sebagai peringatan dari ancaman luar atau kegagalan dalam tubuh. Nyeri kronik dengan kecepatan penjalaran antara 0,5-2 meter per detik sering kali tidak menandakan bahaya yang segera menimbulkan pencegahan dan pasien mungkin tidak mengartikan nyeri tersebut sebagai penyakit serius (Greene dan Harris, 2000).
nyeri dalam. Nyeri viseral muncul dari organ dalam dan berbeda bermakna dengan nyeri somatik (Anonim, 2001).
Nyeri berdasarkan intensitasnya dibedakan menjadi 4 jenis yaitu: nyeri ringan, nyeri sedang, nyeri berat, dan nyeri kanker. Nyeri ringan sampai nyeri sedang misalnya nyeri sakit kepala, gigi, otot, sendi (rematik), perut, haid, nyeri akibat benturan atau kecelakaan (trauma) efektif diobati dengan menggunakan analgetika perifer. Nyeri berat misalnya nyeri setelah pembedahan atau fraktur (patah tulang) yang lebih efektif bila diobati menggunakan analgetika narkotik atau opioid (Tjay dan Rahardja, 2002).
3. Mekanisme Nyeri
Tahap awal dari timbulnya sensasi nyeri adalah adanya rangsangan atau stimulasi pada reseptor yang dikenal dengan nosiseptor. Reseptor ini terdapat pada struktur somatik dan viseral, serta diaktivasi oleh rangsang kimia, suhu dan mekanis. Stimulasi noksius dapat memicu pelepasan mediator seperti bradikinin, K+, prostaglandin, histamin, leukotrien, serotonin, substansi P yang nantinya akan mengaktivasi nosiseptor (Baumann, 2003).
Seseorang akan merasakan nyeri secara sadar ketika proses transmisi nyeri menuju otak berjalan dengan baik. Sensasi nyeri yang dirasakan oleh tiap individu akan berbeda walaupun mendapatkan rangsangan yang sama, dan hal ini disebut dengan persepsi nyeri. Tubuh secara alamiah juga dapat menangani rangangan nosiseptif melalui tahapan modulasi. Tahapan ini melibatkan sistem opiat endogen yang terdiri dari neurotransmiter ( contoh : enkefalin, dinorfin, dan β-endorfin) dan reseptornya (antara lain mu, kappa, dan delta). Proses modulasi alami yang dilakukan tubuh menghambat proses transmisi nyeri. Sistem Saraf Pusat juga mempunyai suatu sistem menurun yang terorganisasi untuk mengontrol transmisi nyeri, neurotransmiter yang penting dalam proses ini antara lain opiat endogen, serotonin, noradrenalin, asam γ-aminobutirat (GABA) dan neurotensin (Baumann, 2003)
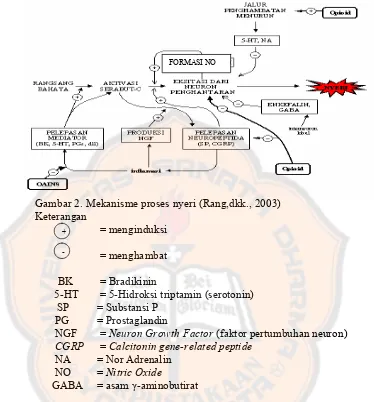
Gambar 2. Mekanisme proses nyeri (Rang,dkk., 2003) Keterangan
= menginduksi = menghambat BK = Bradikinin
5-HT = 5-Hidroksi triptamin (serotonin) SP = Substansi P
PG = Prostaglandin
NGF = Neuron Growth Factor (faktor pertumbuhan neuron) CGRP = Calcitonin gene-related peptide
NA = Nor Adrenalin NO = Nitric Oxide
GABA = asam γ-aminobutirat
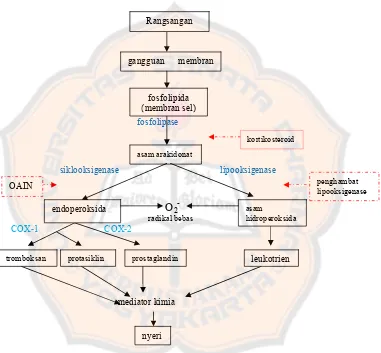
Nyeri juga bisa terjadi karena jumlah radikal bebas dalam tubuh melampaui normal. Pada dasarnya radikal bebas dalam jumlah normal tidak berbahaya karena tubuh memiliki antioksidan alamiah (glutathion-peroxydase, superoxide-dismutase, katalase) yang mampu menangkap radikal bebas tersebut. Dalam proses peradangan, radikal bebas terbentuk ketika asam arakhidonat dikonversikan menjadi peroksida baik melalui jalur siklooksigenase ataupun lipooksigenase. Ketika terjadi kerusakan sel atau organ, produksi peroksida meningkat seiring dengan peningkatan jumlah radikal bebas, padahal di dalam tubuh jumlah antioksidan alamiah terbatas, kondisi
FORMASI NO
-ini akan menimbulkan stress oksidatif dengan kemungkinan kerusakan sel atau organ. Apabila sel atau organ sudah rusak, maka mediator nyeri akan keluar dan mengaktivasi reseptor nyeri sehingga seseorang bisa merasakan nyeri (Tjay dan Rahardja,, 2002).
Gambar 3. Perombakan Asam Arakhidonat (Tjay dan Rahardja, 2002; Rang, dkk, 2003)
Keterangan: : menghambat ; : proses pembentukan
Kebanyakan reseptor pada kulit memiliki struktur khusus yang merupakan ujung saraf bebas yang sederhana di perifer. Tiga tipe serabut saraf terlibat dalam pengiriman nyeri ini ialah :
nyeri
tromboksan protasiklin prostaglandin leukotrien
a. serabut A-β : berukuran besar, bermielin, cepat menyalurkan impuls (30- 100 m/detik), memiliki ambang nyeri yang rendah dan memberi tanggapan terhadap sentuhan ringan.
b. serabut A-δ : bermielin tipis dan menyalurkan impuls dengan lebih lambat (6-30 m/detik), memberi tanggapan terhadap tekanan panas, dingin, kimia dan memberi reaksi terhadap sensasi nyeri tajam sehingga menghasilkan reflek penarikan diri atau gerakan cepat.
c. serabut C : berukuran kecil, tak bermielin, oleh karena itu menyalurkan dengan lambat (1-2,5 m/detik), memberi tanggapan terhadap segala jenis rangsang berbahaya dan menyalurkan lebih lambat nyeri tumpul (Greene dan Harris, 2000).
Menurut Greene dan Harris (2000) tiga kelompok utama reseptor kulit yang telah diidentifikasi,yaitu :
a. mekanoreseptor (yang mendeteksi sentuhan ringan). b. termoreseptor (yang mendeteksi panas).
c. nosiseptor (yang mendeteksi adanya luka dan rangsangan yang membahayakan
Gambar 4 . Tempat berakhirnya serabut aferen pada 6 lapisan dari sumsum tulang belakang (Rang dkk., 2003)
Mechanoreceptor Mechanoreceptor Nociceptor
E. Analgetika
Analgetika adalah obat atau senyawa yang bertujuan untuk mengurangi atau melenyapkan rasa nyeri tanpa menghilangkan kesadaran (Anonim,2000). Sedangkan sebuah sumber lain (Anonim, 1991) menyatakan bahwa analgetika adalah kelompok obat yang memiliki aktivitas menekan atau mengurangi rasa nyeri.
Efek analgetik dapat dicapai dengan berbagai cara, seperti menekan kepekaan reseptor terhadap rangsang nyeri mekanik, termik listrik atau kimiawi di pusat atau dengan cara menghambat pembentukan prostaglandin sebagai mediator nyeri (Anonim, 1991). Efek analgetik dari OAINS (Obat Anti Inflamasi Non Steroid) digunakan baik di perifer maupun di sentral, tetapi efek perifernya lebih banyak. Efek analgetiknya berhubungan dengan efek antiinflamasinya dan diakibatkan oleh inhibisi sintesis prostaglandin dalam jaringan yang meradang.
Menurut Ritter, Lewis, dan Mant (1999) analgetika dapat menghambat nyeri dengan bekerja di perifer atau di sentral sebagai berikut :
1. pada tempat terjadinya luka, dengan mencampuri kerja mediator kimia pada nosisepsi ( contoh penghambatan sintesis prostaglandin oleh obat AINS).
2. transmisi pada saraf perifer, menggunakan anastesi lokal.
3. transmisi pada dorsal horn dan talamus. Hal ini menjelaskan beberapa aksi opioid dan nefopam serta beberapa antidepresan yang menghambat reuptake axonal 5HT dan noradrenalin.
4. jalur pada pusat persepsi nyeri. Hal ini merupakan model kerja opioid dan kerja
Berdasarkan kerja farmakologisnya, analgetika dapat digolongkan ke dalam :
Analgetika narkotik
Analgetika narkotik, kini disebut juga opioida (= mirip opiat), adalah zat yang bekerja terhadap reseptor opiod khas di SSP, hingga persepsi nyeri dan respons emosional terhadap nyeri berubah (dikurangi). Zat-zat ini memiliki daya penghalang nyeri yang kuat sekali dengan titik-titik yang terletak di sistem saraf sentral. Mereka umumnya mengurangi kesadaran (sifat meredakan dan menidurkan) dan menimbulkan perasaan nyaman (euforia) selain itu mengakibatkan toleransi dan kebiasaan (habituasi) serta ketergantungan fisik dan psikis (ketagihan, adiksi) bila pengobatan dihentikan (Tjay, dan Rahardja, 2002).
Analgetika non narkotika
Obat ini merupakan analgetika yang paling efektif dengan efek samping paling sedikit. Parasetamol dan NSAID sering dipilih untuk mengobati nyeri akut yang ringan sampai sedang. Obat-obat ini mencegah pembentukkan prostaglandin yang muncul akibat rangsang nyeri, sehingga mengurangi jumlah impuls nyeri yang diterima oleh SSP (Baumann, 2005).
F. Parasetamol
OH
NHCOCH3
Gambar5. Struktur molekul Parasetamol (Anonim, 1995)
Parasetamol adalah metabolit aktif dari phenacetin yang bertanggung jawab akan efek analgetiknya. Obat ini berguna untuk nyeri ringan sampai sedang seperti sakit kepala, mialgia, nyeri pascapersalinan, dan keadaan lain dimana aspirin efektif sebagai analgetik (Furst dan Munster, 2001).
Mekanisme kerja parasetamol adalah menghambat enzim siklooksigenase (COX-3). Parasetamol bekerja dengan menghambat biosintesis prostaglandin terutama di hipotalamus sehingga obat ini memiliki aktivitas antiinflamasi yang relatif rendah dan lebih efektif bila digunakan sebagai analgetik-antipiretik (Rang, dkk, 2003).
G. Metode Pengujian Efek Analgetik
Pengujian analgetika dapat dilakukan secara in vivo maupun secara in vitro. Pengujian analgetika secara in vitro secara umum dikaitkan dengan ikatan senyawa dengan reseptor yang berhubungan dengan rangsang nyeri sedangkan pengujian secara in vivo berkaitan dengan kemampuan suatu senyawa dalam menurunkan reaksi hewan uji terhadap rangsang nyeri.
Metode-metode pengujian aktivitas analgetika secara in vivo dilakukan dengan menilai kemampuan zat uji untuk menekan atau menghilangkan rasa nyeri yang diinduksi pada hewan uji (mencit, tikus, marmot), yang meliputi induksi secara mekanik, termik, elektrik dan secara kimia (Anonim, 1991).
Turner (1965) membagi metode pengujian daya analgetik menjadi dua, yaitu berdasarkan jenis analgetiknya. Masing-masing metode tersebut antara lain :
1. Golongan analgetika narkotika
Analgetika narkotika adalah analgetika dengan mekanisme kerja sentral. Metode penapisan aktivitas analgetik untuk analgetika narkotika antara lain sebagai berikut:
a. Metode jepitan ekor
apabila tidak ada usaha untuk melepaskan jepitan selama 15 detik pada tiga kali pengamatan.
b. Metode rangsang panas
Hewan percobaan ditempatkan diatas lempeng panas dengan suhu 50oC sampai 55oC sebagai rangsang nyeri. Mencit yang sudah diberi senyawa uji secara subkutan atau peroral, diletakkan pada hot plate yang sudah dipersiapkan. Reaksi mencit adalah menjilat kaki depan, kaki belakang lalu meloncat. Selang waktu antara pemberian rangsang nyeri dan terjadinya respon, disebut waktu reaksi. Waktu reaksi dapat diperpanjang oleh obat-obat analgetika. Perpanjangan waktu reaksi selanjutnya dapat dijadikan sebagai ukuran dalam mengevaluasi aktivitas analgetik.
c. Metode pengukuran tekanan
d. Metode potensi petidin
Metode ini kurang baik, karena dibutuhkan hewan uji dalam jumlah besar, tetapi dapat digunakan untuk uji sedatif. Tiap kelompok tikus terdiri dari 20 ekor, setengah kelompok dibagi menjadi 3 kelompok kecil dan diberi petidin dengan dosis berturut-turut yaitu 2, 4, dan 8 mg/kg. Setengah kelompok dibagi menjadi dua kelompok yaitu kelompok petidin dan senyawa uji dengan dosis 25% dari LD50.
Persen proteksi dihitung dengan bantuan metode rangsang panas. e. Metode antagonis nalorfin
Uji analgetik dengan metode ini bertujuan untuk menunjukkan aksi obat-obat seperti morfin. Nalorfin memiliki kemampuan untuk meniadakan aksi dari morfin. Hewan uji yang biasa digunakan dalam metode ini adalah tikus, mencit, dan anjing. Hewan uji diberi obat dengan dosis toksik kemudian segera diikuti pemberian nalorfin (0,5-10,0 mg/KgBB) secara intravena. Sebuah obat yaitu piritramid dapat menyebabkan respon seperti hilangnya refleks korneal dan refleks bradipnea. Efek tersebut dapat dilawan setelah 1 menit pemberian nalorfin 1,25 mg/KgBB yang disuntikkan secara intravena. Teori menyebutkan bahwa nalorfin dapat menggantikan ikatan morfin dengan reseptornya.
f. Metode kejang oksitosin.
dietilstilbestrol secara subkutan pada paha tikus. Setelah 10 minggu hewan uji siap diuji analgetik. Senyawa yang akan diuji diberikan 15 menit secara subkutan sebelum diberi oksitosin secara intraperitoneal. Penurunan kejang dapat teramati dan ED50 dapat diperkirakan. Selain morfin senyawa analgetika yang bisa diuji dengan
metode ini adalah heroin, metadon, kodein, meperidin. g. Metode pencelupan air panas.
Sepuluh tikus disuntik intraperitoneal dengan senyawa uji, kemudian ekor tikus dicelupkan dalam air panas (suhu 58oC). respon tikus dilihat dari hentakan ekornya dari air panas.
2. Golongan analgetika nonnarkotika
Metode penapisan analgetik untuk analgetika nonnarkotika antara lain sebagai berikut :
a. Metode rangsang kimia.
Untuk uji efek analgetik jenis ini senyawa pembanding yang digunakan biasanya adalah analgetika nonnarkotika seperti asetosal, parasetamol, dan sebagainya. Perhitungan persen proteksi mengikuti persamaan sebagai berikut:
% Proteksi = 100 – [(P/K) x 100%]
Keterangan: P = jumlah geliat kumulatif mencit setelah perlakuan K = jumlah rata-rata geliat mencit kelompok kontrol negatif. b. Metode pedodolometer
Metode ini menggunakan aliran listrik untuk mengukur besarnya efek analgetik. Alas kandang tikus terbuat dari kepingan metal yang bisa mengalirkan listrik. Tikus diletakkan pada kandang tersebut kemudian dialiri listrik. Respon ditandai dengan teriakan dari tikus tersebut. Pengukuran dilakukan setiap 10 menit selama 1 jam.
c. Metode rektodolometer.
Tikus diletakkan dalam kandang yang dibuat khusus dengan alas tembaga yang dihubungkan dengan sebuah penginduksi yang berupa gulungan. Ujung lain dari gulungan tersebut kemudian dihubung dengan silinder elektroda tembaga. Sebuah voltmeter yang sensitif untuk mengubah 0,1 volt dihubungkan dengan konduktor yang berada di atas gulungan. Tegangan yang sering digunakan untuk menimbulkan teriakan mencit adalah 1 sampai 2 volt.
H. Landasan Teori
jaringan, baik aktual maupun potensial. Hampir sebagian besar penyakit memberi gejala nyeri yang dimanifestasikan dalam bentuk rasa sakit pada organ atau jaringan pada tubuh. Nyeri juga bisa terjadi apabila jumlah radikal bebas dalam tubuh melampaui normal. Pada dasarnya radikal bebas dalam jumlah normal tidak berbahaya karena tubuh memiliki antioksidan alamiah (glutathion-peroxydase, superoxide-dismutase, katalase) yang mampu menangkap radikal bebas tersebut. Dalam proses peradangan, radikal bebas terbentuk ketika asam arakhidonat dikonversikan menjadi peroksida baik melalui jalur siklooksigenase ataupun lipooksigenase (Tjay dan Rahardja, 2002).
I. Hipotesis
29 BAB III
METODELOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental murni dengan menggunakan rancangan acak lengkap pola satu arah.
B. Metode Penelitian
Metode pengujian efek analgetik yang digunakan pada penelitian ini yaitu metode rangsang kimia. Pada metode ini digunakan rangsang kimia berupa asam asetat yang diberikan secara intraperitoneal pada mencit yang sudah diberi senyawa uji secara per oral pada selang waktu tertentu. Respon nyeri pada mencit adalah geliat berupa kontraksi perut disertai tarikan kedua kaki belakang dan perut menempel pada lantai. Geliat diamati setiap 5 menit selama 1 jam. Pemberian analgetik akan mengurangi rasa nyeri sehingga jumlah geliat yang terjadi berkurang. Daya analgetik dapat dievaluasi menggunakan persen penghambatan terhadap geliat, yaitu:
% penghambatan terhadap geliat = 100 – [(P/K) x 100] Keterangan:
P = jumlah kumulatif geliat hewan uji setelah pemberian obat yang telah ditetapkan
K = jumlah rata-rata geliat hewan uji kelompok kontrol
C. Variabel dan Definisi Operasional 1. Variabel
Variabel penelitian meliputi:
a. Variabel bebas dari penelitian ini adalah kelompok perlakuan yang meliputi
kelompok kontrol negatif, kelompok kontrol positif, dan kelompok ekstrak batang brotowali dengan 4 peringkat dosis per kg berat badan mencit.
b. Variabel tergantung dari penelitian ini adalah daya analgetik. Daya analgetik adalah angka dalam persen yang menunjukkan seberapa besar suatu zat tertentu dalam menimbulkan efek analgetik sehingga mampu menghambat respon geliat.
c. Variabel pengacau terkendali :
1) Subjek uji, yaitu mencit putih jantan galur Swiss, usia 2-3 bulan, dan berat badan 20-30 gram.
2) Asal tumbuhan brotowali, yaitu berasal dari Balai Besar Penelitian dan Pengembangan Tanaman Obat dan Tanaman Tradisional Tawangmangu, Kabupaten Karanganyar, Jawa Tengah.
3) Metode ekstraksi batang brotowali, yaitu menggunakan metode perkolasi dengan penyari etanol 70%.
4) Cara pemberian zat uji, yaitu secara peroral. d. Variabel pengacau tak terkendali:
1) Keadaan patologis hewan uji adalah keadaan individu mencit.
3) Ketahanan mencit adalah kemampuan individu mencit dalam menahan rasa sakit.
4) Kemampuan absorpsi mencit adalah kemampuan absorpsi individu mencit terhadap ekstrak batang brotowali.
2. Definisi Operasional
a. Efek analgetik adalah kemampuan suatu zat untuk mengurangi atau menghilangkan rasa nyeri dengan/tanpa menghilangkan kesadaran.
b. Ekstrak batang brotowali adalah ekstrak yang diperoleh dengan menyari batang brotowali menggunakan penyari etanol 70% dengan cara perkolasi. c. Metode rangsang kimia adalah metode yang digunakan untuk mengukur
efek analgetik zat uji terhadap subyek uji dengan cara memberi rangsang nyeri dengan pemberian zat kimia tertentu.
d. Daya analgetik menunjukkan seberapa besar suatu zat tertentu dalam memberi efek analgetik, yang ditunjukkan dengan besarnya nilai persentase penghambatan terhadap respon (geliat).
e. Respon nyeri pada mencit adalah geliat berupa kontraksi perut disertai tarikan kedua kaki belakang dan perut menempel pada lantai.
D. Bahan Penelitian
2. Serbuk batang brotowali (Tinospora crispa (L) Miers.) yang telah dideterminasi dan diperoleh dari Balai Besar Penelitian dan Pengembangan Tanaman Obat dan Tanaman Tradisional Tawangmangu, Kabupaten Karanganyar, Jawa Tengah pada bulan Agustus 2007, yang kemudian diekstraksi dengan etanol 70%.
3. Bahan kimia untuk uji analgetik :
a. Parasetamol : berupa serbuk hablur berwarna putih; tidak berbau dan rasa sedikit pahit (Anonim, 1995). Parasetamol yang digunakan dalam penelitian diperoleh dari Brataco Chemika dengan kualitas farmasetis.
b. CMC Na : berupa serbuk halus atau berbentuk granul berwarna putih, bersifat higroskopis (Anonim, 1995), diperoleh dari Brataco Chemika dengan kualitas farmasetis.
c. Asam asetat glasial: berupa cairan jernih; tidak berwarna; bau khas, tajam jika diencerkan dengan air; rasa asam (Anonim, 1995), diproduksi oleh Merck dengan kualitas pro analisis dan diperoleh dari Laboratorium Kimia Organik Universitas Sanata Dharma.
d. Etanol 70% : berupa cairan jernih, mudah menguap; tidak berwarna; bau khas; rasa terbakar pada lidah, mudah terbakar (Anonim, 1995), diperoleh dari Asia Lab dengan kualitas teknis.
E. Alat atau Instrumen Penelitian 1. Alat Ekstraksi
Seperangkat alat gelas berupa beaker glass, Erlenmeyer, gelas ukur, labu ukur, cawan porselen, pipet tetes, batang pengaduk; perkolator; seperangkat alat penyaring; corong buchner dan vaccum merek Amleitung Lessen; Rotary Vaccum Evaporator merek Janke & Kunkel RV5 ST; oven merek Termaks
2. Alat Uji Geliat
Kotak kaca tempat pengamatan geliat; stopwatch; jarum yang digunakan untuk pemberian peroral, berupa jarum yang ujungnya berbentuk bulat dan berlubang di bagian tengah; spuit injeksi merek Profi yang memiliki ujung runcing dan digunakan untuk pemberian secara intraperitoneal, neraca analitik merek Mettler Toledo tipe AE 2000; neraca merek Mettler Toledo tipe PM 600.
F. Tata Cara Penelitian 1. Pembuatan Sediaan Uji
a. Pengumpulan bahan
1) Bahan uji yang digunakan yaitu serbuk batang brotowali yang telah dideterminasi dan diperoleh dari Balai Besar Penelitian dan Pengembangan Tanaman Obat dan Tanaman Tradisional Tawangmangu, Kabupaten Karanganyar, Jawa Tengah pada bulan Agustus 2007.
b. Pembuatan serbuk batang brotowali
Batang brotowali yang telah dikumpulkan kemudian dipotong-potong dengan panjang antara 3-4 cm. Batang yang telah dipotong, dipisahkan dari pengotornya kemudian dicuci dengan air mengalir dan dikeringkan di bawah sinar matahari dengan ditutupi kain hitam. Simplisia yang telah dikeringkan lalu dirajang dan diserbuk kemudian diayak dengan ayakan berukuran 60 mesh.
c. Pembuatan ekstrak batang brotowali
Sebanyak 400 gram serbuk batang brotowali dimasukkan ke dalam perkolator, kemudian direndam dengan etanol 70% sampai mencapai ketinggian 1,5 cm di atas permukaan serbuk selama 24 jam. Kran perkolator dibuka dan kecepatan aliran diatur sehingga tiap 1 menit didapat perkolat sebanyak 20 tetes. Ekstraksi dihentikan jika perkolat yang keluar berwarna bening. Perkolat yang didapatkan disaring dengan menggunakan corong buchner dan vaccum untuk menghilangkan sisa serbuk yang mungkin ikut terbawa, kemudian perkolat diuapkan di dalam oven dengan suhu 50o C sampai didapatkan ekstrak yang kental. Sebelum diuapkan, perkolat terlebih dahulu dikentalkan dengan menggunakan alat vaccum rotary evaporator. Hal ini dilakukan untuk mempercepat proses penguapan. Ekstrak pekat kemudian disimpan di dalam lemari pendingin (kulkas) dengan suhu .
d. Pembuatan larutan CMC Na 0,5 %
e. Pembuatan larutan asam asetat
Larutan asam asetat yang diujikan dalam penelitian meliputi dosis 100 mg/kg BB dan 150 mg/kgBB. Maka perhitungan kebutuhan asam asetat dengan volume pemberian 0,5ml/20 gram BB mencit adalah sebagai berikut :
1) Larutan asam asetat 100 mg/kgBB = 2,0 mg/20 gram BB =2,0 mg/0,5 ml = 4,0 mg/ml = 400 mg/100ml
= 0,4 g/100 ml = 0,4 %
Larutan asam asetat 0,4 % dibuat dengan cara mengambil asam asetat glasial pro analisis dengan berat jenis (BJ) 1050 mg/ml sebanyak 0,38 ml dengan pipet volume dan dimasukkan ke dalam labu ukur 100,0 ml dan ditambah aquadest hingga 100 ml.
2) Larutan asam asetat 150 mg/kgBB = 3,0 mg/20 gram BB =3,0 mg/0,5 ml = 6,0 mg/ml = 600 mg/100ml
= 0,6 g/100 ml = 0,6 %
f. Pembuatan suspensi parasetamol dalam CMC Na 0,5%
Suspensi parasetamol yang diujikan dalam penelitian ini meliputi dosis 65 mg/kgBB dan 91 mg/kgB, maka perhitungan konsentrasi parasetamol dengan volume pemberian 0,5 ml/20 gram BB mencit adalah sebagai berikut:
1) Suspensi parasetamol 65 mg/kgBB = 1,30 mg/20 gramBB
= 1,30 mg/0,5 ml = 2,6 mg/ml
Suspensi parasetamol 65 mg/kgBB dibuat dengan menimbang 130 mg serbuk parasetamol dan dimasukkan ke dalam labu ukur 50,0 ml dan ditambah larutan CMC-Na 0,5% hingga volumenya 50 ml.
2) Suspensi parasetamol 91 mg/kgBB = 1,82 mg/20 gramBB
= 1,82 mg/0,5 ml = 3,64 mg/ml
Suspensi parasetamol 91 mg/kgBB dibuat dengan menimbang 182 mg serbuk parasetamol dan dimasukkan ke dalam labu ukur 50,0 ml dan ditambah larutan CMC-Na 0,5% hingga volumenya 50 ml.
g. Pembuatan suspensi ekstrak batang brotowali dalam CMC Na 0,5%
1) Suspensi ekstrak batang brotowali 66 mg/kgBB = 1,32 mg/20 gramBB
= 1,32 mg/0,5 ml = 2,64 mg/ ml
Suspensi ekstrak batang brotowali 66 mg/kgBB dibuat dengan menimbang 66 mg ekstrak kental batang brotowali dan dimasukkan ke dalam labu ukur 25,0 ml dan ditambah larutan CMC-Na 0,5% hingga volumenya 25 ml.
2) Suspensi ekstrak batang brotowali 132 mg/kgBB = 2,64 mg/20 gramBB
= 2,64 mg/0,5 ml = 5,28 mg/ ml
Suspensi ekstrak batang brotowali 132 mg/kgBB dibuat dengan menimbang 132 mg ekstrak kental batang brotowali dan dimasukkan ke dalam labu ukur 25,0 ml dan ditambah larutan CMC-Na 0,5% hingga volumenya 25 ml.
3) Suspensi ekstrak batang brotowali 264 mg/kgBB = 5,28 mg/20 gramBB
= 5,28 mg/0,5 ml = 10,56 mg/ ml
4) Suspensi ekstrak etanol batang brotowali 528 mg/kgBB = 10,56 mg/20 gramBB
= 10,56 mg/0,5 ml = 21,12 mg/ ml
Suspensi ekstrak batang brotowali 528 mg/kgBB dibuat dengan menimbang 528 mg ekstrak kental batang brotowali dan dimasukkan ke dalam labu ukur 25,0 ml dan ditambah larutan CMC-Na 0,5% hingga volumenya 25 ml.
2. Uji Pendahuluan a. Seleksi hewan uji
Hewan uji yang digunakan yaitu mencit putih jantan galur Swiss, berat 20-30 gram, umur 2-3 bulan. Semua hewan uji dipelihara dengan kondisi perlakuan yang sama meliputi: pakan, minum, kandang, dan alasnya. Sebelum digunakan dalam percobaan, semua hewan uji diadaptasikan terlebih dahulu dengan kondisi yang sama. Bila akan digunakan dalam perlakuan, hewan uji dipuasakan terlebih dahulu selama ± 18-22 jam tanpa diberi makan, tetapi tetap diberi minum. Hal ini bertujuan untuk mengurangi variasi akibat adanya makanan.
b. Penetapan kriteria geliat
diberikan secara intraperitonial. Adanya jaringan yang rusak mengakibatkan timbulnya rasa sakit dan mencit memberikan respon geliat.
c. Penetapan dosis asam asetat
Penetapan dosis asam asetat menggunakan 2 peringkat dosis, yaitu 100mg/kgBB dan 150mg/kgBB. Sebanyak 6 ekor hewan uji, mencit putih jantan, galur Swiss, berat 20-30 gram, umur 2-3 bulan yang telah dipuasakan ± 18-22 jam dibagi ke dalam 2 kelompok. Masing-masing kelompok terdiri dari 3 ekor mencit diinjeksi secara intraperitonial dengan asam asetat. Setelah itu diamati geliatnya selama 60 menit dan dicatat jumlah geliat tiap 5 menit. Kelompok dosis efektif asam asetat yang dipilih adalah yang memberikan respon geliat dengan jumlah jumlah geliat yang tidak terlalu sedikit dan tidak terlalu banyak karena dapat menyulitkan pengamatan.
d. Penetapan kontrol negatif
Penetapan kontrol negatif ini bertujuan untuk mengetahui zat yang tidak memiliki efek analgetik, sehingga dapat digunakan untuk membandingkan dengan zat uji. Kontrol negatif yang digunakan yaitu CMC Na 0,5 % . Volume pemberian pada mencit sebanyak 0,5 ml dan diasumsikan berat mencit dalam penelitian ini adalah 20 gram.
kemudian dibandingkan dengan kelompok hewan uji yang hanya diberi rangsang asam asetat dosis 100 mg/kgBB secara intraperitoneal untuk melihat ada tidaknya efek analgetik pada kelompok kontrol negatif .
e. Penetapan dosis parasetamol dan dosis ekstrak batang brotowali
Dosis parasetamol yang lazim digunakan pada manusia adalah 500 mg. Diketahui faktor konversi manusia dengan berat badan 70 kg ke mencit dengan berat badan 20 gram adalah 0,0026, maka dosis parasetamol yang digunakan adalah 0,0026 x 500 mg = 1,3 mg/20 gBB atau 65 mg/kgBB. Berdasarkan penelitian yang dilakukan oleh Reo (2005), dosis parasetamol yang digunakan untuk pengujian efek analgetik adalah 91 mg/kgBB. Dosis ini diperoleh dengan mengkonversikan dosis parasetamol, yaitu 500 mg/ 50kgBB ke berat badan manusia Eropa (70kg) menjadi (70 kg/50 kg) x 500 mg = 700 mg. Dosis konversi dari manusia 70 kg ke mencit 20 gram adalah 0,0026 x 700 mg = 1,82 mg/20 gBB sehingga diperoleh dosis parasetamol 91 mg/kg BB . Jadi pada penetapan dosis parasetamol digunakan 2 peringkat dosis, yaitu 65 mg/kgBB dan 91 mg/kgBB.
dosis yang paling efektif (jumlah geliat paling sedikit) digunakan sebagai kontrol positif.
Penetapan dosis ekstrak batang brotowali didasarkan pada dosis infusa batang brotowali yang efektif memberikan efek analgetik, yaitu 2400 mg/kgBB. Dosis ekstrak batang brotowali didapatkan dengan mengkonversi dosis infus tersebut dengan angka rendemen yang didapat dari hasil ekstraksi batang brotowali. Nilai rendemen ekstrak etanol 70% batang brotowali adalah 11% yang diperoleh dari perbandingan antara ekstrak yang didapat (sebanyak 43,5 gram) dengan berat awal simplisia (sebanyak 400gram) lalu dikalikan 100 %. Perhitungan dosis ekstrak batang brotowali adalah sebagai berikut :
Dosis ekstrak = 11% x dosis infus batang brotowali Dosis ekstrak = 0,11 x 2400mg/kgBB = 264 mg/kgBB
Dalam penetapan dosis ekstrak batang brotowali digunakan 6 ekor mencit putih jantan yang dibagi dalam 2 kelompok, galur Swiss, berat 20-30 gram, umur 2-3 bulan yang telah dipuasakan ± 18-22 jam sebelumnya. Tiap- tiap kelompok diberi suspensi ekstrak batang brotowali sesuai dengan peringkat dosis masing-masing secara per oral, kemudian mencit diinjeksi dengan asam asetat 100 mg/kgBB secara intraperitonial dengan selang waktu 30 menit. Geliat mencit yang timbul diamati selama 60 menit dengan dicatat jumlah geliatnya tiap 5 menit. Kelompok dosis yang paling efektif (jumlah geliat paling sedikit) digunakan sebagai dosis ekstrak.
f. Penetapan selang waktu pemberian antara parasetamol dengan rangsang asam asetat
dipuasakan ± 18-22 jam dibagi ke dalam 3 kelompok. Tiap-tiap kelompok diberi suspensi parasetamol dosis 91 mg/kgBB secara peroral dengan selang waktu 5, 15, dan 30 menit sebelum pemberian asam asetat. Selanjutnya, mencit diinjeksi dengan asam asetat dosis 100 mg/kgBB secara intraperitonial. Geliat mencit diamati dan dicatat tiap selang waktu 5 menit selama 60 menit. Waktu yang dipilih adalah waktu yang memberikan jumlah geliat paling sedikit.
g. Penetapan selang waktu pemberian antara ekstrak batang brotowali dengan rangsang asam asetat
Rentang waktu yang diujikan adalah 5, 15, dan 30 menit. Sebanyak 9 ekor mencit putih jantan, galur Swiss, berat 20-30 gram, umur 2-3 bulan yang telah dipuasakan ± 18-22 jam dibagi ke dalam 3 kelompok. Tiap-tiap kelompok diberi ekstrak batang brotowali dosis 264 mg/kgBB secara peroral. Selanjutnya, asam asetat dosis 100 mg/kgBB diinjeksikan secara intraperitoneal dengan selang waktu 5, 15, dan 30 menit. Geliat mencit diamati dan dicatat tiap selang waktu 5 menit selama 60 menit. Waktu yang dipilih adalah waktu yang memberikan jumlah geliat paling sedikit.
3. Uji Utama
a. Perlakuan hewan uji
ekstrak batang brotowali dengan 4 peringkat dosis, yaitu 66 mg/kgBB, 132 mg/kgBB, 264 mg/kgBB, dan 528 mg/kgBB. Hewan uji diberikan senyawa uji secara per oral kemudian diinjeksi dengan asam asetat dosis 100 mg/kgBB secara intraperitonial dengan selang waktu 15 menit. Penentuan daya analgetik atau besarnya persentase penghambatan geliat dilakukan dengan pengamatan respon nyeri berupa geliat pada hewan uji akibat pemberian asam asetat tersebut. Pengamatan dilakukan tiap 5 menit selama 60 menit.
b. Analisis Hasil
Data yang diperoleh berupa jumlah kumulatif geliat kemudian digunakan untuk menghitung persentase penghambatan geliat dengan cara sebagai berikut :
% penghambatan terhadap geliat = 100 – [(P/K) ×100 Keterangan:
P = jumlah kumulatif geliat hewan uji setelah perlakuan K = jumlah rata-rata geliat hewan uji kelompok kontrol
Potensi relatif ekstrak terhadap parasetamol sebagai kontrol positif pada tiap kelompok perlakuan dihitung dengan rumus:
Potensi relatif ekstrak = % daya analgetik ekstrak x dosis parasetamol x100% terhadap parasetamol % daya analgetik parasetamol dosis ekstrak
Hewan uji (7 ekor/ kelompok)
Diberi perlakuan secara oral
Kontrol
Injeksi dengan asam asetat dosis 100 mg/kg BB secara intraperitoneal
Hitung jumlah geliat tiap 5 menit selama 60 menit
Hitung % penghambatan terhadap geliat
Hitung analisis statistik One-Way ANOVA dilanjutkan dengan uji LSD dengan taraf kepercayaan 95%
Bila tidak memenuhi syarat uji ANOVA, data diuji dengan uji non-parametrik Kruskal- Wallis yang dilanjutkan dengan uji Mann-Whitney dengan taraf
46
BAB IV
HASIL DAN PEMBAHASAN
A. Pengumpulan Bahan dan Pembuatan serbuk
Batang brotowali yang digunakan dalam penelitian ini dikumpulkan sekitar bulan Agustus 2007 oleh Balai Besar Balai Besar Penelitian dan Pengembangan Tanaman Obat dan Tanaman Tradisional di daerah Tawangmangu. Batang yang diambil adalah batang yang cukup tua dan siap panen dan berusia sekitar 11-12 bulan sehingga diharapkan kandungan zat aktif di dalam batang sudah terbentuk secara optimal.
Batang brotowali yang telah dikumpulkan kemudian dipotong-potong dengan panjang antara 3-4 cm untuk mempermudah proses selanjutnya. Batang yang telah dipotong kemudian dipisahkan dari zat pengotornya dan dicuci dengan air mengalir hingga bersih. Setelah batang brotowali dicuci bersih, dilakukan proses pengeringan untuk mendapatkan simplisia yang tidak mudah rusak sehingga lebih tahan lama. Proses pengeringan dimaksudkan untuk mengurangi kadar air dan manghentikan reaksi enzimatik sehingga dapat mencegah penurunan mutu dan kerusakan simplisia. Pengeringan dilakukan di bawah sinar matahari dengan ditutupi kain hitam untuk mencegah kerusakan zat aktif yang tidak tahan terhadap sinar matahari. Proses ini dilakukan selama kurang lebih 1 minggu sampai didapatkan tiga kali penimbangan dengan bobot konstan atau simplisia kering yang mudah dipatahkan.
memperluas permukaan kontak antara simplisia dengan penyarinya sehingga zat aktif di dalam simplisia batang brotowali lebih mudah diekstraksi.
B. Pembuatan Ekstrak Batang Brotowali
Pembuatan ekstrak batang brotowali dilakukan dengan metode perkolasi. Metode ini dipilih karena dengan metode ini senyawa akan lebih mudah terekstrak sehingga diharapkan senyawa yang terekstrak lebih banyak. Pelarut yang digunakan adalah etanol 70% yang memiliki polaritas cukup tinggi sehingga mampu menyari sebagian besar kandungan kimia dari simplisia. Sebelum dilakukan ekstraksi, batang brotowali diserbuk terlebih dahulu. Hal ini dimaksudkan untuk memperluas luas kontak antara serbuk batang brotowali dengan pelarutnya sehingga proses ekstraksi berlangsung lebih sempurna.
yang terkandung dalam ekstrak batang brotowali. Ekstrak pekat kemudian disimpan di dalam lemari pendingin (kulkas).
Hasil perkolasi batang brotowali yang didapat adalah ekstrak kental berwarna coklat kehitaman dengan bau khas dan rasa yang pahit, serta diperoleh nilai rendemen sebesar 11 % (diperoleh berat ekstrak 43,5 gram dari total berat simplisia awal 400 gram). Untuk uji selanjutnya, ekstrak batang brotowali ini disuspensikan ke dalam larutan CMC Na 0,5%.
C. Uji Pendahuluan
1. Penetapan kriteria geliat
Penetapan kriteria geliat ini dilakukan agar geliat yang teramati hampir sama sehingga pengamatan yang dilakukan menjadi lebih mudah dan spesifik. Pedoman gerakan mencit yang dianggap sebagai geliat adalah ketika mencit menarik kedua kaki ke belakang dengan mengempiskan perutnya sehingga permukaan perut menempel pada alas tempat berpijak mencit tersebut, yaitu pada alas kotak tempat pengamatan. Pemberian asam asetat yang bersifat mengiritasi jaringan dapat menimbulkan nyeri pada mencit sehingga mencit akan meresponnya dalam bentuk geliat. Rangsangan kimia dari asam asetat ini diberikan secara intraperitoneal.
2. Penetapan dosis asam asetat
Pengujian ini dilakukan dengan metode rangsang kimia, dimana zat rangsang yang berupa asam asetat diberikan secara intraperitoneal. Ion H+ yang terdapat pada asam asetat dapat menyebabkan iritasi pada jaringan lokal sehingga menimbulkan rasa nyeri. Penetapan dosis asam asetat bertujuan untuk mendapatkan dosis efektif asam asetat yang dapat menimbulkan geliat yang tidak terlalu banyak ataupun terlalu sedikit pada waktu pengamatan selama 60 menit. Geliat yang terlalu banyak ataupun terlalu sedikit akan menyulitkan pada waktu proses pengamatan.
sehingga rasa nyeri yang timbul akan semakin meningkat dan jumlah geliat mencit semakin banyak.
Pengujian dilakukan pada masing-masing dosis dengan menggunakan 3 ekor hewan uji dengan rute pemberian intraperitoneal dan diamati jumlah geliat yang muncul selama 60 menit. Rata-rata kumulatif geliat hewan uji pada penetapan dosis efektif asam asetat dapat dilihat pada tabel I.
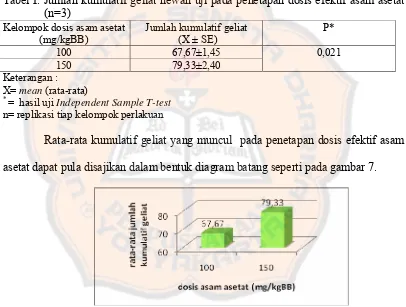
Tabel I. Jumlah kumulatif geliat hewan uji pada penetapan dosis efektif asam asetat (n=3)
Kelompok dosis asam asetat (mg/kgBB)
Jumlah kumulatif geliat (X ± SE)
P* 100 67,67±1,45
150 79,33±2,40
0,021 Keterangan :
X= mean (rata-rata)
*
= hasil uji Independent Sample T-test n= replikasi tiap kelompok perlakuan
Rata-rata kumulatif geliat yang muncul pada penetapan dosis efektif asam asetat dapat pula disajikan dalam bentuk diagram batang seperti pada gambar 7.
Gambar 7 . Diagram batang rata-rata jumlah kumulatif geliat pada penetapan dosis efektif asam asetat
Jumlah geliat yang dihasilkan pada 2 kelompok dosis asam asetat dianalisis
atau tidaknya perbedaan diantara kedua kelompok tersebut. Data jumlah geliat dan hasil analisis statistiknya dapat dilihat pada lampiran 3.
Dari hasil analisis statistik tersebut diperoleh probabilitas lebih kecil dari 0,05 ( p < 0,05), yaitu 0,021, yang menunjukkan adanya perbedaan yang bermakna diantara kedua kelompok dosis asam asetat. Dari hasil tersebut, juga dapat disimpulkan bahwa dosis asam asetat 100 mg/kgBB sudah dapat memberikan rangsang nyeri yang cukup baik, dapat dilihat dari jumlah respon geliat yang tidak terlalu banyak maupun terlalu sedikit sehingga lebih memudahkan pengamatan. Oleh karena itu, kelompok dosis asam asetat 100 mg/kgBB dipilih untuk digunakan pada uji selanjutnya.
3. Penetapan kontrol negatif
Uji pendahuluan selanjutnya adalah penetapan kontrol negatif. Uji ini bertujuan untuk membuktikan bahwa pelarut yang digunakan, yaitu larutan CMC-Na 0,5% benar-benar tidak memiliki efek analgetik dan efek analgetik yang nanti muncul benar-benar berasal dari zat uji. Penetapan ini dilakukan dengan membandingkan jumlah respon geliat yang dihasilkan pada kelompok kontrol negatif CMC Na 0,5% yang diberi rangsang kimia berupa asam asetat 100mg/kgBB dengan kelompok yang hanya diberi asam asetat 100 mg/kgBB secara intraperitoneal.