SINTESIS TURUNAN ARILAMIDA-1 DAN UJI AKTIVITAS IN VITRO TERHADAP ENZIM MATRIX METALLOPROTEINASE-9 (MMP-9)
SEBAGAI KANDIDAT ANTI-KANKER PAYUDARA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Yohanes Krisna Wisnumurti NIM: 158114093
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
SINTESIS TURUNAN ARILAMIDA-1 DAN UJI AKTIVITAS IN VITRO TERHADAP ENZIM MATRIX METALLOPROTEINASE-9 (MMP-9)
SEBAGAI KANDIDAT ANTI-KANKER PAYUDARA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Yohanes Krisna Wisnumurti NIM: 158114093
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
“
Kepuasan terletak pada usaha, bukan pada hasil. Berusaha
dengan keras adalah kemenangan yang hakiki”
~Mahatma Gandhi~
Karya ini saya persembahkan kepada, Tuhan Yesus Kristus Bapak dan Ibu Tercinta Sahabat-sahabat Tersayang dan Almamater Universitas Sanata Dharma
vii PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa, karena atas berkat serta cinta kasih-Nya, skripsi yang berjudul “Sintesis Turunan Arilamida-1 dan Uji Aktivitas In Vitro terhadap Enzim Matrix Metalloproteinase-9 (MMP-9) sebagai Kandidat Anti-kanker Payudara” dapat diselesaikan dengan baik dan tepat waktu. Penelitian ini merupakan bagian dari penelitian Maywan Hariono, Ph.D., Apt. yang didanai oleh Indonesia Toray Science Foundation 2017/2018 dengan judul “Synthesis, Enzymatic Assay, and Molecular Modelling of Purin Derivatives Targeting Hemopexin Domain of Matrix
Metalloproteinase-9 (PEX-Metalloproteinase-9) in the Discovery of Novel Anti-Breast Cancer”. Skripsi ini disusun sebagai syarat untuk memperoleh gelar sarjana Farmasi (S. Farm) di Universitas Sanata Dharma Yogyakarta.
Penyelesaian naskah skrispi ini tidak lepas dari dukungan berbagai pihak, baik langsung ataupun tidak langsung. Oleh karena itu, penulis hendak menyampaikan ungkapan terima kasih pada kesempatan ini. Ungkapan terima kasih ini disampaikan kepada:
1. Ibu Dr. Yustina Sri Hartini, Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Bapak Maywan Hariono, Ph.D., Apt. selaku dosen pembimbing skripsi yang telah membimbing tim penelitian dengan sabar, selalu memberikan semangat, dukungan, motivasi, kritik dan saran dari awal hingga akhir penyusunan skripsi ini.
3. Ibu Phebe Hendra, M.Si., Ph.D., Apt. dan Ibu Dr. Erna Tri Wulandari, M.Si., Apt. selaku dosen penguji yang telah memberikan masukan dan saran yang sangat berharga dalam penulisan skripsi ini.
4. Bapak Albertus Hartoyo dan Ibu Margaretha Wartini yang selalu memberikan doa, motivasi, semangat dan dukungan sehingga penulis dapat menyelesaikan tugas akhir ini.
viii
6. Kelompok penelitian “Skripsi Analog” Kevin, Wisnu, Ervan, Aldo, dan Sangga yang senantiasa bekerja sama dan selalu merasakan suka-duka bersama selama mengerjakan penelitian ini.
7. Sahabat-sahabatku di Farmasi “Dolan Squad” Wisnu, Aldo, Retha, Bulin, Inge, dan MasRud selalu memberikan dukungan selama kuliah di Farmasi. 8. Temen-temen Drug Discovery Research Group yang selalu mendukung dan terima kasih atas kerjasamanya selama ini serta Divisi Penelitian dan Pengembangan BEMF Farmasi 2018 yang mendukung kegiatan grup kami. 9. Pak Parlan, Mas Kunto, Pak Wagiran, dan Mas Bimo yang telah membantu
penulis dalam melaksanakan penelitian.
10.Lacto-B (Vincent, Wanda, Tiqoh, Midi, Iva, dan Reni) yang selalu ada sejak SMA untuk bermain, belajar, bercanda bersama. Semoga persahabatan kita akan tetap terjalin selamanya dan sukses untuk kita semua.
11.Teman-teman FSM C 2015 serta Farmasi Angkatan 2015 yang telah memberikan banyak kenangan dalam masa perkuliahan.
12.Semua pihak yang tidak dapat disebutkan satu persatu yang telah mendukung dalam penyelesaian penyusunan naskah ini.
Penulis menyadari bahwa naskah penelitan ini masih jauh dalam kesempurnaan dan masih memiliki banyak kekurangan. Penulis sangat mengharapkan kritik dan saran yang dapat membangun naskah penelitian agar dapat bermanfaat dalam pengembangan ilmu pengetahuan.
Yogyakarta, 30 Januari 2019
ix DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
PERNYATAAN PERSETUJUAN PUBLIKASI ... vi
x
DAFTAR TABEL
Tabel I. Hasil Uji Kelarutan Senyawa Turunan Arilamida-1 ... 8
Tabel II. Hasil spektrum 1H-NMR senyawa turunan arilamida-1 ... 9
Tabel III. Hasil spektrum 13C-NMR senyawa turunan arilamida-1 ... 12
xi
DAFTAR GAMBAR
Gambar 1. Struktur senyawa 2 (Dufour, et al. 2011) ... 2
Gambar 2. Struktur senyawa 3c (Alford, et al. 2017) ... 3
Gambar 3. Struktur senyawa turunan arilamida-1 ... 3
Gambar 4. Reaksi SNA sulfanilamida dan 3-bromopropionil klorida ... 7
Gambar 5. Hasil spektrum 1H-NMR senyawa turunan arilamida-1 ... 9
Gambar 6. Hasil spektrum 13C-NMR senyawa turunan arilamida-1 ... 12
Gambar 7. Hasil spektrum inframerah senyawa turunan arilamida-1 ... 13
Gambar 8. Spektrum inframerah sulfanilamida ... 13
Gambar 9. Kromatogram hasil GC senyawa turunan arilamida-1 ... 14
xii
DAFTAR LAMPIRAN
Lampiran 1. Tahap sintesis senyawa turunan arilamida-1 ... 19
Lampiran 2. Hasil sintesis senyawa turunan arilamida-1 ... 19
Lampiran 3. Hasil KLT sintesis senyawa turunan arilamida-1 ... 20
Lampiran 4. Mekanisme reaksi sulfanilamida dengan DAB-HCl ... 20
Lampiran 5. Hasil uji DAB-HCl ... 21
Lampiran 6. Perhitungan bahan dan rendemen ... 21
Lampiran 7. Perbesaran sinyal 2,87 ppm dan 3,00 ppm ... 22
Lampiran 8. Perbesaran sinyal 3,74 ppm dan 3,88 ppm ... 22
Lampiran 9. Perbesaran sinyal 7,75 dan 7,76 ppm serta 7,26 ppm ... 23
Lampiran 10. Mekanisme penataan ulang dan fragmentasi senyawa ... 23
xiii ABSTRAK
Ekspresi MMP-9 yang tinggi berkorelasi dengan tingkat keparahan kanker payudara pada jenis triple-negative dan HER2 positif. Beberapa senyawa sudah dilaporkan sebagai MMP inhibitors sebagai anti-kanker. Namun, MMP
inhibitors tersebutgagal pada uji klinis karena menunjukkan efek samping yang merugikan. Penelitian ini telah mensintesis turunan arilamida-1 sebagai penghambat MMP-9 yang dirancang lebih selektif dengan menghambat
hemopexin domain MMP-9 (PEX-9). Sintesis dilakukan dengan mereaksikan sulfanilamida dan 3-bromopropionil klorida menggunakan katalisator piridin melalui reaksi substitusi nukleofilik asil (SNA). Senyawa hasil sintesis dilakukan
uji organoleptis, titik lebur, kelarutan, dan DAB-HCl. Produk yang terbentuk berupa serbuk berwarna putih yang larut dalam DMSO. Titik lebur senyawa hasil sintesis 222-235oC dan menunjukkan hasil negatif pada uji DAB-HCl memastikan bahwa gugus amina primer sudah tersubstitusi. Struktur hasil sintesis dielusidasi dengan FTIR, 1H-NMR dan 13C-NMR, serta GC-MS. Hasil elusidasi struktur dengan FTIR menunjukkan gugus fungsi C=O amida pada 1589 cm-1. Proton etilen terletak pada geseran kimia 2-4 ppm berdasarkan 1H-NMR dan 10-60 ppm
pada 13C-NMR, serta hasil GC-MS yang memastikan bobot molekul senyawa hasil sintesis dengan m/z 307. Uji in vitro dengan fluorogenic assay terhadap MMP-9 menunjukkan persentase penghambatan sebesar 13% pada konsentrasi 200 µg/mL yang berasosiasi pada aktivitas yang rendah pada arilamida-1 sebagai penghambat MMP-9.
xiv ABSTRACT
MMP-9 expression was highly correlated with triple-negative and HER2 breast cancer. Some compounds have been reported as MMP inhibitors, however, most of them fail in clinical trials due to the adverse side effects. This is because the drugs are designed to target catalytic domains that are structurally similar to all MMPs, so that they are not specific. This study synthesized arylamide-1 derivative which is designed to be selective to hemopexin MMP-9 (PEX-9). This was carried out by reacting sulfanilamide and 3-bromopropionyl chloride using pyridine as the catalyst through acyl nucleophilic substitution. Synthesized compound were carried out by an organoleptic test, melting point, solubility, and DAB-HCl. The product was determined its physical appearance as a white powder which is soluble in DMSO. The melting point is 222-253ºC and negatively reacting with DAB-HCl confirming the substituted primary amine group at sulfanilamide. Structure elucidation using FTIR indicates the presence of carbonyl group at 1589 cm-1. The ethylene proton is assigned using 1H-NMR which is showed at 2-4 ppm whereas its carbon appears at 10-60 ppm based on 13C-NMR. The molecular weight of the product is confirmed using GC-MS showing m/z 307. The in vitro fluorogenic assay is applied to determine the inhibition of MMP-9 by arylamide-1. The results show 13% of inhibition of MMP-9 at 200 µg/mL associating with a low activity of arylamide-1 as an MMP-9 inhibitor.
1 PENDAHULUAN
Pada tahun 2018 terdapat 18,1 juta kasus baru mengenai kanker di seluruh
dunia yang dilaporkan oleh WHO. Kanker merupakan penyakit kedua paling
banyak yang menyebabkan kematian, dan di kalangan wanita, kanker payudara
mempunyai angka kejadian paling tinggi (WHO, 2018). Pada tahun 2013, kanker
serviks dan kanker payudara merupakan penyakit kanker dengan prevalensi
tertinggi di Indonesia yaitu sebesar 0,8% dan 0,5% (Kementrian Kesehatan RI,
2016).
Kanker merupakan penyakit yang ditandai dengan pertumbuhan sel yang
tidak normal disebabkan adanya mutasi gen yang menghasilkan potensi replikasi
sel tidak terbatas serta ketidakmampuan sistem imun dalam menghancurkan sel
kanker. Sel kanker akan bermigrasi ke bagian tubuh lain yang jauh dari daerah
asalnya dan proses ini disebut dengan metastasis. Tahap metastasis inilah penyebab
utama kematian akibat kanker (Pecorino, 2012).
Proses metastasis melibatkan enzim matrix metalloproteinase (MMP)
yang merupakan golongan protease yang memiliki fungsi mendegradasi komponen
dari matriks ekstraseluler (ECM). Selain itu, enzim ini juga berperan dalam
beberapa proses seluler termasuk proliferasi, angiogenesis, migrasi, pertahanan
tubuh, dan invasi sel kanker (Dufour et al., 2010). Menurut Yousef et al. (2014),
enzim matrix metalloproteinase-9 (MMP-9) diekspresikan dalam jumlah yang
lebih banyak pada sel kanker payudara dibandingkan pada sel payudara normal.
Ekspresi MMP-9 yang tinggi berkorelasi dengan tingkat keparahan kanker
payudara terutama pada jenis triple-negativedan HER2 positif.
MMP berperan penting dalam perkembangan kanker sehingga telah
dirancang beberapa obat yang bersifat menghambat MMP (MMP inhibitors)
sebagai terapi kanker. Namun, hampir semua obat tersebut gagal saat uji klinis
karena tidak selektif terhadap satu jenis MMP sehingga menimbulkan efek samping
yang tidak diinginkan. Salah satu contohnya yaitu marimastat yang menyebabkan
inflamasi dan nyeri muskuloskeletal (Cathcart et al., 2015). Semua kelompok MMP
memiliki kemiripan struktur yang terdiri dari pro-peptide region, catalytic domain,
2
asam amino yang tinggi (43-65%) pada semua MMP, sedangkan hemopexin domain hanya mempunyai kemiripan sebanyak 25-35% (Dufour et al., 2011). Kurang efektifnya MMP inhibitors diduga karena obat-obat tersebut dirancang
dengan menargetkan catalytic domain yang secara struktural mirip pada semua
jenis MMP sehingga bersifat tidak spesifik (Vandenbroucke dan Libert, 2014).
Studi mengenai hemopexin domain pada MMP-9 (PEX-9) masih
diperlukan untuk pengembangan senyawa-senyawa yang lebih selektif karena
mempunyai peran penting dalam proses migrasi sel dengan pembentukan dimer PEX-9. Pembentukan dimer akan mengubah konformasi dan potensi elektrostatik PEX-9 sehingga dapat berinteraksi dengan CD44 (salah satu onkogenik) yang akan mengaktivasi epidermal growth factor receptor (EGFR) untuk melakukan sinyal transduksi yang memerintahkan sel bermigrasi dan bermetastasis (Dufour et al., 2010). Salah satu studi tersebut dilakukan oleh Dufour et al. (2011) yang menemukan lima senyawa aktif berdasarkan penapisan virtual dengan metode
molecular docking. Senyawa yang paling aktif adalah CID135415473
(www.pubchem.ncbi.nlm.nih.gov) atau dinamakan senyawa 2 dengan Kd = 2,2 μM.
Struktur senyawa tersebut relatif sederhana untuk disintesis sehingga dapat
dikembangkan lebih lanjut sebagai inhibitor yang selektif terhadap hemopexin
MMP-9. Aktivitas senyawa tersebut diduga karena memiliki cincin planar yang
berinteraksi dengan kantung aktif pada struktur blade PEX-9 yang dihubungkan
oleh rantai alkil yang memberikan efek fleksibel bagi cincin arilamida untuk
berinteraksi di permukaan kantung aktif. Alford et al. (2017) juga telah menemukan
14 senyawa aktif dan selektif terhadap hemopexin MMP-9 yang dilatarbelakangi
penelitian Dufour et al. (2011). Hasil penelitian Alford et al. (2017) menunjukkan
senyawa yang paling aktif adalah senyawa 3c dengan Kd = 320 nM.
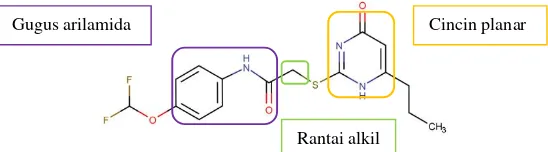
Gambar 1. Struktur senyawa 2 (Dufour, et al. 2011) dengan
ditunjukkan gugus fungsi yang penting
Gugus arilamida
Rantai alkil
3
Gambar 2. Struktur senyawa 3c (Alford, et al. 2017) dengan
ditunjukkan gugus fungsi yang penting
Pada penelitian ini telah disintesis fragmen dari senyawa 2 dengan
mengambil sebagian farmakofor yaitu gugus arilamida dan rantai alkil dengan
tambahan gugus sulfonamida pada posisi para cincin arilamida. Struktur senyawa
turunan arilamida-1 dapat dilihat pada Gambar 3.
Gambar 3. Struktur senyawa turunan arilamida-1dan ditunjukkan kemiripan
gugus fungsinya dengan senyawa 2 dengan tambahan gugus sulfonamida
Senyawa turunan arilamida-1 disintesis dari sulfanilamida dan
3-bromopropionil klorida dengan katalisator piridin melalui reaksi substitusi nukleofilik asil (SNA). Setelah dipastikan strukturnya kemudian dilakukan uji in
vitro melalui fluorogenic assay untuk mengetahui aktivitas penghambatannya
terhadap MMP-9. Penelitian ini diharapkan dapat menambah jumlah senyawa penghambat MMP-9 yang aktif sebagai kandidat obat kanker payudara.
METODE PENELITIAN Bahan
Semua bahan kimia yang digunakan bermutu analisis yang disuplai oleh Sigma Aldrich dan Merck. Bahan utama yang digunakan untuk sintesis adalah sulfanilamida (4-aminobenzenesulfonamide), 3-bromopropionil klorida, piridin,
Gugus arilamida Rantai alkil Gugus
sulfonamida
Cincin planar Rantai alkil
4
plat kromatografi lapis tipis (KLT) silika gel GF254, n-heksana, etil asetat,
dimetilaminobenzaldehid HCl (DAB-HCl), dan akuades. Bahan untuk elusidasi struktur yaitu pellet kalium bromida untuk FTIR dan pelarut DMSO-d6 pro analisis untuk NMR. Bahan untuk uji in vitro yaitu kit enzim MMP-9 terdiri dari enzim MMP-9 terliofilisasi, substrat peptida, dapar, peptida NNGH sebagai kontrol positif, gliserol untuk mengencerkan enzim, dan dimetilsulfoksida sebagai pelarut sampel.
Alat
Timbangan analitik (Mettler Toledo®), pompa vakum (GAST model DOA-P504-BN), dan oven (Memmert GmbH+Co.KG), labu alas bulat (pyrex), lempeng panas, pengaduk magnetik, alat uji titik lebur (Mettler Toledo®), lampu UV254 dan alat gelas pada umumnya. Alat untuk elusidasi struktur:
spektrofotometer inframerah (Shimadzu), spektrometer nuclear magnetic resonance (Bruker 700 MHz dan 176 MHz), dan GCMS-QP2010S SHIMADZU. Alat untuk uji in vitro pipet mikro (Eppendorf), micro well plate 96, pipet tips, inkubator, vortex, ELISA microplate reader fluorescence (Tecan Infinite 200 Pro).
Prosedur Penelitian
Sintesis Senyawa Turunan Arilamida-1 (Diadaptasi dari Arifiyanto, 2001) Sulfanilamida sebanyak 0,62 g (3,59 mmol) dimasukkan ke dalam labu alas bulat kemudian ditambahkan piridin sebagai katalisator sebanyak 0,44 mL (5,39 mmol). Pengadukan dilakukan selama 10 menit pada suhu kamar lalu diteteskan secara bertahap 3-bromopropionil klorida sebanyak 0,61 mL (6,00 mmol). Campuran diaduk kembali selama 30 menit. Hasil sintesis disaring kemudian dicuci dengan akuades hingga pH netral.
Uji Organoleptis
Mengidentifikasi bentuk dan warna produk hasil sintesis. Uji Titik Lebur
5 Uji Kelarutan
Sebanyak 5 mg senyawa hasil sintesis dilarutkan dalam sejumlah mL pelarut (polar sampai non polar) tetes demi tetes hingga larut kemudian ditentukan kategori kelarutan tersebut berdasarkan Farmakope Indonesia V.
Rekristalisasi
Rekristalisasi dilakukan dengan cara meneteskan pelarut DMSO ke dalam senyawa hasil sintesis hingga tepat larut dan diuapkan hingga terbentuk kristal. Uji kimiawi dengan DAB-HCl
Sebanyak masing-masing 1 mg sulfanilamida dan senyawa hasil sintesis dimasukkan ke dalam drupple plate. Kemudian diteteskan DAB-HCl dan diamati perubahan warna yang terjadi. Jika berwarna jingga senyawa hasil sintesis masih mengandung amina primer, sedangkan jika tidak berwarna jingga senyawa hasil sintesis sudah tidak mengandung amina primer.
Uji Kromatografi Lapis Tipis
Sejumlah masing-masing 1 mg sulfanilamida dan senyawa hasil sintesis dilarutkan dalam aseton dan DMSO. Kedua larutan tersebut ditotolkan pada plat KLT Silika gel GF254 yang telah diaktifkan pada suhu 100 ºC pada jarak 1 cm dari
arah bawah. Disiapkan fase gerak n-heksana: etil asetat (1:3),(2:2),(3:1) (Adhipandito, 2017) di dalam gelas beker yang dijenuhkan dengan kertas saring selama kurang lebih 15 menit. Plat KLT dimasukkan ke dalam gelas beker kemudian dieluasi hingga 1 cm dari atas plat KLT. Setelah itu plat dikeluarkan, dikeringkan dan dilihat bercaknya di bawah lampu UV 254 nm. Kemudian dihitung nilai Rf.
Elusidasi Struktur
Elusidasi struktur dilakukan dengan metode spektroskopi inframerah, spektroskopi NMR (1H-NMR dan 13C-NMR) dan GC-MS (kromatografi gas-spektrometri massa) di Fakultas MIPA UGM, Sleman D.I.Yogyakarta dan Institut Farmasetikal dan Nutraseutikal Malaysia.
Uji aktivitas secara in vitro
6
Energy Transfer (FRET)-based MMP-9, dapar uji MMP-9 dan NNGH inhibitor
sebagai kontrol positif. Enzim yang terliofilisasi direkonstitusi dengan 110 µL gliserol 30% dalam deionised water. Enzim yang sudah terekonstitusi dilarutkan dalam 550 µL dapar dan siap digunakan untuk pengujian. Senyawa sampel disiapkan dengan cara dilarutkan dalam DMSO dengan konsentrasi akhir 200 µg/mL di dalam 96-microwell plate. Konsentrasi final DMSO dalam wellplate tidak lebih dari 2%. Setiap well mengandung enzim 5 µL, substrat (40 µM) 50 µL, buffer (43 µL untuk kontrol positif, 44 µL untuk sampel, dan 45 µL untuk kontrol negatif), dan larutan uji 1 µL. Rancangan microwell plate secara lengkap dapat dilihat pada Lampiran 11. Sampel dicampurkan dengan dapar dan enzim kemudian diinkubasi pada suhu 37ºC selama 30 menit. Substrat ditambahkan ke dalam campuran tersebut dan diinkubasi kembali pada suhu 37ºC selama 60 menit. Fluorosensi dibaca menggunakan Tecan Infinite 200 Pro Microplate Reader dengan panjang gelombang eksitasi 325 nm dan emisi 393 nm. Jika persen penghambatan mencapai paling tidak 50%, maka senyawa akan dihitung IC50-nya dengan menyiapkan seri
larutan dengan konsentrasi yang berbeda.
Persentase penghambatan = 1 −𝑏𝑎𝑐𝑎𝑎𝑛 𝑓𝑙𝑢𝑜𝑟𝑒𝑠𝑒𝑛𝑠𝑖 𝑠𝑒𝑛𝑦𝑎𝑤𝑎 ℎ𝑎𝑠𝑖𝑙 𝑠𝑖𝑛𝑡𝑒𝑠𝑖𝑠−𝑏𝑙𝑎𝑛𝑘𝑜
𝑏𝑎𝑐𝑎𝑎𝑛 𝑓𝑙𝑢𝑜𝑟𝑒𝑠𝑒𝑛𝑠𝑖 𝑘𝑜𝑛𝑡𝑟𝑜𝑙 𝑛𝑒𝑔𝑎𝑡𝑖𝑓−𝑏𝑙𝑎𝑛𝑘𝑜 𝑥 100%
HASIL DAN PEMBAHASAN
Sintesis Senyawa Turunan Arilamida-1
Senyawa turunan arilamida-1 disintesis berdasarkan farmakofor arilamida dan rantai alkil. Pada posisi para cincin arilamida ditambahkan gugus sulfonamida dengan tujuan mengeksplorasi fungsi gugus OCF2 pada senyawa 2 berdasarkan
karakternya yang bersifat electron withdrawing group (EWG) sekaligus electron donating group (EDG). Pada penelitian ini karakter EWG dan EDG diwakili oleh sulfonamida sehingga diharapkan memiliki kontribusi dalam aktivitas biologinya.
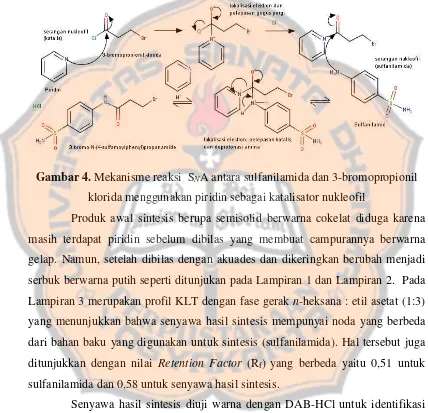
Reaksi yang terjadi saat sintesis senyawa turunan arilamida-1 merupakan reaski substitusi nukleofilik asil (SNA) antara sulfanilamida dan 3-bromopropionil
7
(Smith, 2013). Sulfanilamida berperan sebagai nukleofil yang akan menggantikan gugus klorida pada 3-bromopropionil klorida. Hal ini karena sulfanilamida memiliki gugus amina primer yang mempunyai pasangan elektron bebas sehingga dapat bereaksi dengan propionil klorida untuk menghasilkan senyawa amida (Zhang et al., 2009). Mekanisme reaksinya disajikan pada Gambar 4.
Gambar 4. Mekanisme reaksi SNA antara sulfanilamida dan 3-bromopropionil
klorida menggunakan piridin sebagai katalisator nukleofil
Produk awal sintesis berupa semisolid berwarna cokelat diduga karena masih terdapat piridin sebelum dibilas yang membuat campurannya berwarna gelap. Namun, setelah dibilas dengan akuades dan dikeringkan berubah menjadi serbuk berwarna putih seperti ditunjukan pada Lampiran 1 dan Lampiran 2. Pada Lampiran 3 merupakan profil KLT dengan fase gerak n-heksana : etil asetat (1:3) yang menunjukkan bahwa senyawa hasil sintesis mempunyai noda yang berbeda dari bahan baku yang digunakan untuk sintesis (sulfanilamida). Hal tersebut juga ditunjukkan dengan nilai Retention Factor (Rf) yang berbeda yaitu 0,51 untuk
sulfanilamida dan 0,58 untuk senyawa hasil sintesis.
8
sedangkan hasil reaksinya berupa produk berwarna jingga ditunjukkan pada Lampiran 5.
Rekristalisasi senyawa hasil sintesis tidak berhasil dilakukan karena pelarut DMSO tidak menguap sempurna disebabkan oleh titik didih DMSO yang tinggi yaitu 189ºC (Pubchem, 2019). Hasil rendemen dari senyawa turunan arilamida-1 sebanyak 39,09% menunjukkan bahwa metode sintesis masih perlu dioptimasi. Optimasi yang dapat dilakukan yaitu terkait dengan mol bahan, katalisator, suhu, atau lama pengadukan. Perhitungan rendemen disajikan pada Lampiran 6. Setelah diperoleh senyawa turunan arilamida-1, dilakukan uji titik lebur yang bertujuan untuk mengetahui titik lebur senyawa dan melihat kemurniannya. Suatu senyawa dinyatakan murni apabila memiliki jarak lebur 0,5-1,5ºC (Mohrig et al., 2014). Hasil jarak lebur yang diperoleh adalah rentang 222-235ºC sehingga berbeda dengan sulfanilamida yang memiliki jarak lebur 165-167ºC (Chemspider, 2015). Namun, jarak lebur senyawa hasil sintesis lebih dari 1,5ºC sehingga senyawa tersebut belum murni 100%. Oleh karena itu, senyawa dapat dimurnikan dengan kromatografi kolom, KLT preparatif atau rekristalisasi agar mendapatkan hasil jarak lebur yang sesuai dengan syarat kemurnian. Selain uji organoleptis, reaksi warna dan titik lebur, uji kelarutan juga dilakukan terutama untuk menentukan jenis pelarut yang akan digunakan dalam spektroskopi. Hasil uji kelarutan ditunjukkan pada Tabel I. Berdasarkan hasil uji kelarutan, senyawa hasil sintesis larut dalam DMSO sehingga termasuk dalam kategori semi polar karena DMSO bersifat semi polar.
Tabel I. Hasil Uji Kelarutan Senyawa Turunan Arilamida-1 Pelarut Senyawa Turunan Arilamida-1
n-heksana Tidak larut
Kloroform Tidak larut
Etil asetat Tidak larut
Aseton Agak sukar larut (1:80)
Air Tidak larut
9
Uji pendahuluan yang meliputi organoleptis, titik lebur, dan kelarutan berfungsi untuk memberikan profil senyawa hasil sintesis karena senyawa tersebut merupakan senyawa baru.
Elusidasi Struktur
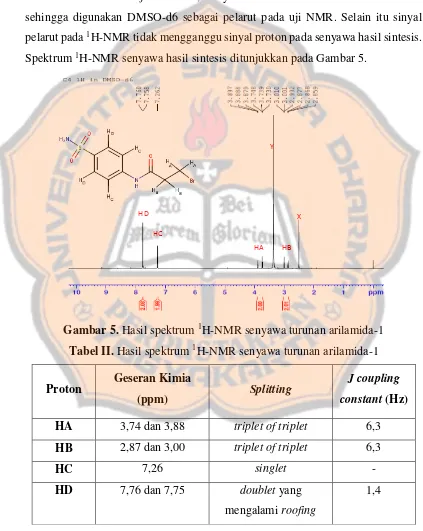
Berdasarkan uji kelarutan, senyawa hasil sintesis larut dalam DMSO sehingga digunakan DMSO-d6 sebagai pelarut pada uji NMR. Selain itu sinyal pelarut pada 1H-NMR tidak mengganggu sinyal proton pada senyawa hasil sintesis.
Spektrum 1H-NMR senyawa hasil sintesis ditunjukkan pada Gambar 5.
Gambar 5. Hasil spektrum 1H-NMR senyawa turunan arilamida-1
Tabel II. Hasil spektrum 1H-NMR senyawa turunan arilamida-1
10
Pada geseran kimia 3,74 ppm (integrasi= 2) (J= 6,3 Hz) dan 3,88 ppm (integrasi= 2) (J= 6,3 Hz) menunjukan sinyal proton HA, sedangkan sinyal yang
terdapat pada geseran kimia 2,87 ppm (integrasi= 2) (J= 6,3 Hz) dan 3,00 ppm (integrasi= 2) (J= 6,3 Hz) menunjukan sinyal proton HB. Proton HA menunjukan
proton pada rantai alkil yang berdekatan dengan gugus halogen (Br), sedangkan proton HB menunjukan proton pada rantai alkil yang berdekatan dengan gugus
karbonil. Proton HA memiliki geseran kimia yang lebih jauh daripada proton HB
karena berdekatan dengan gugus halogen yang bersifat lebih elektronegatif daripada gugus karbonil pada amida sehingga proton HA kurang terlindungi dari
medan magnet luar (de-shielded) (Vollhardt dan Schore, 2014). Kedua sinyal tersebut seharusnya muncul sebagai triplet, tetapi hasil percobaan menunjukan
triplet of triplet. Hal ini kemungkinan disebabkan oleh proton pada etilen bersifat
rotatable sehingga pada sudut tertentu proton yang terikat pada atom C yang sama dapat mempunyai lingkungan kimia yang berbeda. Hal ini menyebabkan setiap proton mengenali tetangganya sebanyak dua kali sehingga muncul dua triplet. Fenomena ini dipastikan dengan jumlah integrasi dua triplet tersebut sebanding dengan dua proton. Perbesaran spektrum proton HB dan proton HA dapat dilihat di
Lampiran 7 dan Lampiran 8.
Geseran kimia 7,00-9,00 ppm menunjukan daerah proton aromatik (Vollhardt dan Schore, 2014). Secara teori, sinyal proton aromatik pada senyawa hasil sintesis berupa dua sinyal doublet pada 7,76 dan 7,26 ppm. Namun, hasil percobaan menunjukkan sinyal doublet pada geseran kimia tersebut mengalami anomali. Sinyal pada 7,76 dan 7,75 ppm (proton HD) nampak sebagai singlet yang
melebar ke bawah karena proton tersebut memiliki lingkungan kimia yang mirip sehingga mempunyai geseran kimia yang identik. Salah satu sinyal akan menjadi lebih tinggi sedangkan sinyal yang lainnya akan mengecil. Peristiwa tersebut dinamakan gejala pemiringan (roofing) yaitu bila geseran kimia sangat dekat maka sinyal akan bergabung menjadi singlet (Dona et al., 2016). Pada geseran kimia 7,26 ppm (proton HC) pemiringan semakin mendekati full singlet kemungkinan
11
dua proton. Perbesaran spektrum proton HC dan proton HD dapat dilihat di Lampiran
9. Sinyal X merupakan sinyal dari DMSO yaitu pada geseran kimia 2,50 ppm sedangkan sinyal Y geseran kimia 3,33 ppm merupakan sinyal dari H2O (Fulmer et al., 2010)
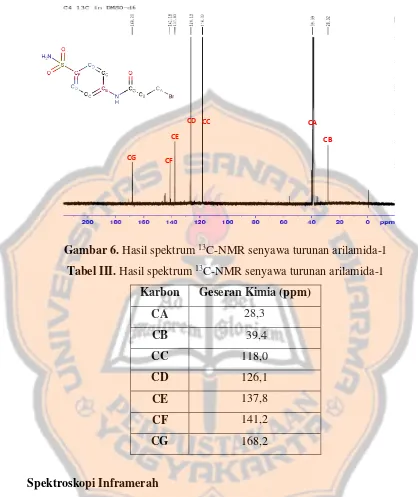
Berdasarkan tabel geseran kimia untuk 13C-NMR, rantai alkil berada pada
rentang geseran kimia 10-60 ppm (Vollhardt dan Schore, 2014). Atom CB berada
pada geseran kimia 28,3 ppm menunjukkan atom C yang berdekatan dengan gugus karbonil pada amida, sedangkan atom CA berada pada geseran kimia 39,4 ppm
menunjukkan atom C yang berikatan dengan atom Br yang bersifat elektronegatif sehingga kurang terlindungi. Pada gugus benzena yang tersubstitusi, geseran kimia berada pada rentang 100-160 ppm (Vollhardt dan Schore, 2014). Atom CC berada
pada geseran kimia 118,0 ppm, sedangkan atom CD pada 126,1 ppm. Atom CD
kurang terlindungi dibandingkan dengan atom CC karena lebih dekat gugus
SO2NH2 yang memiliki elektronegativitas lebih kuat daripada NH yang dekat
dengan CC. Atom CE berada pada geseran kimia 137,8 ppm, sedangkan atom CF
pada 141,2 ppm. Atom CF kurang kurang terlindungi daripada CE juga karena
berdekatan dengan gugus SO2NH2 yang memiliki elektronegativitas lebih kuat.
Geseran kimia untuk C karbonil amida berada pada rentang 160-180 ppm (Mohrig
et al., 2014). Hasil spektra menunjukkan bahwa atom C pada amida berada pada geseran kimia 168,2 ppm yaitu CG sehingga sudah sesuai dengan teori. Pada geseran
kimia 39,5 ppm merupakan sinyal pelarut DMSO yang berhimpit dengan atom CA
12
Gambar 6. Hasil spektrum 13C-NMR senyawa turunan arilamida-1
Tabel III. Hasil spektrum 13C-NMR senyawa turunan arilamida-1 Karbon Geseran Kimia (ppm)
CA 28,3
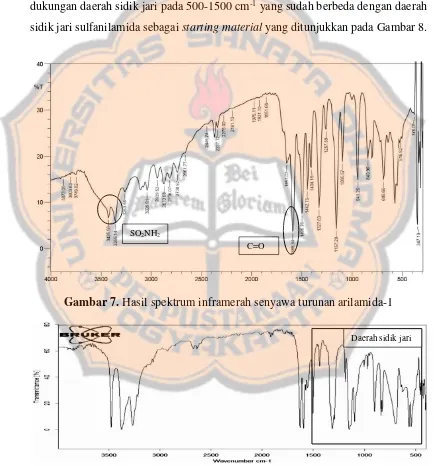
Analisis dengan spektroskopi inframerah bertujuan untuk mengetahui gugus fungsional pada suatu senyawa. Gugus fungsional yang mempunyai momen dipol yang tinggi sangat efektif menyerap radiasi inframerah sehingga menyebabkan ikatannya bervibrasi baik secara mengulur (stretching) dan menekuk (bending) (Vollhardt dan Schore, 2014). Hasil elusidasi struktur senyawa hasil sintesis dengan spektroskopi IR ditunjukan Gambar 7. Berdasarkan spektrum inframerah yang dihasilkan, terdapat pita vibrasi pada daerah sekitar bilangan
13
gelombang (ῡ) 1589 cm-1 yang menunjukan gugus C karbonil (C=O). C=O tersebut merupakan C=O amida karena pada daerah 3000 cm-1 terdapat pita melebar yang diduga sebagai NH amida. Namun, pada daerah tersebut terdapat pita kembar pada 3425 cm-1 dan 3356 cm-1 yang diduga sebagai gugus amina primer yang terikat pada sulfon. Tumpang tindih antara NH amida dan NH2 sulfon ini menyebabkan NH
amida tidak terlihat. Senyawa hasil sintesis diprediksi sudah terbentuk dengan dukungan daerah sidik jari pada 500-1500 cm-1 yang sudah berbeda dengan daerah
sidik jari sulfanilamida sebagai starting material yang ditunjukkan pada Gambar 8.
Gambar 7. Hasil spektrum inframerah senyawa turunan arilamida-1
Gambar 8. Spektrum inframerah sulfanilamida (diadaptasi dari Prajapat et al.,
2018)
SO2NH2
C=O
14
Kromatografi gas-spektrometri massa (GC-MS)
Elusidasi struktur dengan GC-MS bertujuan untuk mengetahui bobot molekul senyawa hasil sintesis yang sudah diketahui pemisahannya dengan kromatografi gas. Hasil percobaan menunjukkan terdapat dua puncak pada kromatogram mengindikasikan bahwa senyawa hasil sintesis tidak 100% murni. Namun demikian, dibandingkan dengan impurities puncak pada waktu retensi 31 menit lebih dominan dan pada Rt tersebut memiliki massa relatif per ion (m/z) yang
sesuai dengan senyawa hasil sintesis yang diharapkan. Kromatogram hasil GC senyawa turunan arilamida-1 ditunjukkan pada Gambar 9.
Gambar 9. Kromatogram hasil GC senyawa turunan arilamida-1
Gambar 10. Hasil spektrum massa senyawa turunan arilamida-1
Gambar 10 menunjukkan spektrum massa senyawa hasil sintesis. Fenomena yang unik dari setiap senyawa yang memiliki gugus sulfonamida selalu terjadi fragmentasi SO2 (m/z 65) diikuti dengan penataan ulang gugus amina pada
15
terdeteksi paling kanan mengalami pengurangan m/z sebanyak 65. Pada percobaan, m/z senyawa hasil sintesis terekam sebanyak 242 yang merupakan hasil pengurangan molekul utuh yaitu (307 dikurangi 65). Mekanisme fragmentasi ini dapat dilihat pada Lampiran 10.
Uji in vitro
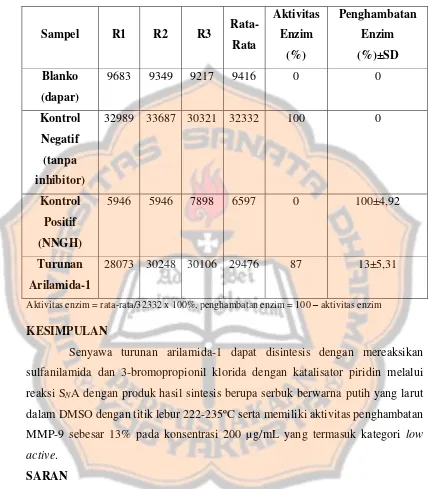
Setelah senyawa turunan arilamida-1 berhasil disintesis, dilakukan uji in vitro untuk melihat aktivitasnya terhadap enzim MMP-9. Dalam uji aktivitas in vitro, MMP-9 direaksikan dengan substratnya untuk melakukan proteolisis. Substrat adalah peptida yang terikat dengan fluorofor yang diputus ikatannya oleh MMP-9 sehingga akan terbaca fluoresensinya ketika diukur dengan spektrofluorometri yang menunjukkan aktivitas enzim. Fluoresensi yang tinggi menunjukkan aktivitas enzim sebanyak 100%, sedangkan fluoresensi yang rendah menunjukkan adanya penghambatan pada aktivitas enzim. Senyawa turunan arilamida-1 menunjukan persentase penghambatan sebesar 13% pada konsentrasi 200 µg/mL. Perhitungan IC50 tidak dapat dilakukan karena persen penghambatan
yang diperoleh dibawah 50%. Berdasarkan persen penghambatan, senyawa turunan arilamida-1 termasuk dalam kategori low active (Aderogba, 2013). Persentase penghambatan yang rendah kemungkinan karena gugus sulfonamida pada para
16
Tabel IV. Hasil uji in vitro
Sampel R1 R2 R3
Rata-Aktivitas enzim = rata-rata/32332 x 100%, penghambatan enzim = 100 – aktivitas enzim
KESIMPULAN
Senyawa turunan arilamida-1 dapat disintesis dengan mereaksikan sulfanilamida dan 3-bromopropionil klorida dengan katalisator piridin melalui reaksi SNA dengan produk hasil sintesis berupa serbuk berwarna putih yang larut
dalam DMSO dengan titik lebur 222-235ºC serta memiliki aktivitas penghambatan MMP-9 sebesar 13% pada konsentrasi 200 µg/mL yang termasuk kategori low active.
SARAN
Penelitian ini masih merupakan skrining awal sehingga perlu dioptimasi struktur senyawanya dan didesain ulang dengan mempertimbangkan hubungan struktur dan aktivitasnya.
UCAPAN TERIMA KASIH
17
DAFTAR PUSTAKA
Adegoke, O.A. 2011. Analytical, Biochemical and Synthetic Applications of Para -Dimethylaminobenzaldehyde. International Journal of Pharmaceutical
Sciences Review and Research, 11 (2): 17-29.
Aderogba, M.A., 2013. Antimicrobial and Selected In Vitro Enzyme Inhibitory Effects of Leaf Extracts, Flavonols and Indole Alkaloids Isolated from
Croton menyharthii. Molecule, 18, 12633-12644.
Adhipandito, C.F. 2017. Sintesis Analog Purin (FFUSD-001) dan Studi In Silico terhadap Matrix Metalloproteinase-9 (MMP-9) Hemopexin Domain Sebagai Kandidat Anti-kanker Payudara. Skripsi. Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta.
Arifiyanto, A. 2001. Pengaruh Penambahan Basa Natrium Hidroksida dan Piridin dalam Sintesis Benzoilanilida. Skripsi. Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta.
Alford, V.M., Kamath, A., Ren, X., Kumar, K., Gan, Q., Awwa, M., et al. 2017. Targeting the Hemopexin-like Domain of Latent Matrix Metalloproteinase-9 (proMMP-9) with a Small Molecule Inhibitor Prevents the Formation of Focal Adhesion Junctions. ACS Chemical
Biology, 1-44.
Bauvois, B. 2012. New facets of matrix metalloproteinases MMP-2 and MMP-9 as cell surface transducers: Outside-in signaling and relationship to tumor progression. Biochimica et Biophysica Acta,1825: 29-36.
Cathcart, J., Pulkoski-Gross, A. dan Cao, J. 2015. Targeting matrix metalloproteinases in cancer: Bringing new life to old ideas. Genes &
Diseases, 2: 26-34.
Chemspider. 2015. Sulfanilamide. http://www.chemspider.com. Diakses pada 25 Januari 2019.
Dirjen POM. 2014. Farmakope Indonesia Edisi V. Jakarta: Kementrian Kesehatan Republik Indonesia.
Dona,A.C., Kyriakides, M., Scottb, F., Shephardb, E.A., Varshavic, D., Veselkov, K., dan Everettc, J.R. 2016. A guide to the identification of metabonomics/metabolomics experiments. Computational and Structural
Biotechnology Journal, 19.
Dufour, A., Zucker, S., Sampson, N.S., Kuscu, C. dan Cao, J., 2010. Role of Matrix Metalloproteinase-9 Dimers in Cell Migration: Design of Inhibitory Peptides. Journal of Biological Chemistry, 285 (46): 35944-35956.
18
Fulmer, G.R., Miller, A.J.M., Sherden, N.H. Gottlieb, H.E., Nudelman, A., Stoltz B. M., Bercaw J.E., dan Goldberg K.I. 2010. NMR Chemical Shifts of Trace Impurities: Common Laboratory Solvents, Organics, and Gases in Deuterated Solvents Relevant to the Organometallic Chemist.
Organometallics. 29: 2176–2179.
Kementerian Kesehatan RI. 2016. Infodatin (Pusat Data dan Informasi
Kementerian Kesehatan RI): Stop Kanker. Jakarta: Kementerian
Kesehatan RI.
Ludji, D.P.K.S., 2017. Sintesis Analog Purin (FUSD-002) dan Studi In Silico Terhadap Matrix Metalloproteinase-9 (MMP-9) Hemopexin Domain sebagai Kandidat Anti-Kanker Payudara. Skripsi. Universitas Sanata Dharma.
Mohrig, J.R., Alberg, D.G., Schatz, P.F., dan Hammond. 2014. Laboratory
Techniques in Organic Chemistry. 4th Edition. USA: W. H. Freeman and
Company.
Montalbetti, C.A.G.N. and Falque, V. 2005. Amide bond formation and peptide coupling. Tetrahedron, 61: 10827-10852.
Pecorino, L. 2012. Molecular Biology of Cancer: Mechanisms, Targets, and
Therapeutics. 3rd Edition. United Kingdom: Oxford University Press.
Prajapat, G., Gupta, R., dan Bhojak, N. 2018. Thermal, Spectroscopic and Antimicrobial Properties of Novel Nickel(II) Complexes with Sulfanilamide and Sulfamerazine Drugs. Chemical Science International
Journal, 24 (2): 1-13.
Pubchem, 2019. Dimethylsulfoxide. https://pubchem.ncbi.nlm.nih.gov. Diakses pada 12 Februari 2019.
Pubchem, 2019. CID135415473. https://pubchem.ncbi.nlm.nih.gov. Diakses pada 20 Januari 2019.
Smith, M.B. 2013. March’s Advanced Organic Chemistry: Reactions, Mechanisms,
and Structure. 7th Edition. New Jersey: John Wiley & Sons, Inc.
Sun, M., Dai, W., dan Liu, Q.D. 2008. Fragmentation of aromatic sulfonamides in electrospray ionization mass spectrometry: elimination of SO2 via
rearrangement. Journal of Mass Spectrometry, 43: 383-393.
Vandenbroucke, R.E. danLibert, C. 2014. Is there new hope for therapeutic matrix metalloproteinase inhibition?. Nature Reviews Drug Discovery. AOP, published online 7 November 2014: 1-24.
Vollhardt, P dan Schore, N. 2014. Organic Chemistry Structure and Function. 7th Edition. USA: W. H. Freeman and Company.
World Health Organization. 2018. Latest global cancer data: Cancer burden rises
to 18.1 million new cases and 9.6 million cancer deaths in 2018. Geneva:
19
Yousef, E.M., Tahir, M.R., St-Pierre, Y. and Gaboury, L.A. 2014. MMP-9 expression varies according to molecular subtypes of breast cancer. BMC
Cancer, 14 (609): 1-12.
20 LAMPIRAN
Lampiran 1. Tahap sintesis senyawa turunan arilamida-1 setelah dilakukan proses pengadukan selama 30 menit
21
Lampiran 3. Hasil KLT sintesis senyawa turunan arilamida-1 yang menunjukkan 2 noda yang berbeda, yaitu A: sulfanilamida dan B: senyawa turunan arilamida-1. Fase gerak yang digunakan adalah n-heksana : etil asetat (1:3)
Lampiran 4. Mekanisme reaksi antara sulfanilamida dengan DAB-HCl membentuk basa Schiff yang berwarna jingga
Rf= 0,51
Rf= 0,58
22
Lampiran 5. Hasil uji DAB-HCl dengan sulfanilamida dan senyawa turunan arilamida-1. Pembentukan basa Schiff ditandai dengan warna jingga. A: Sulfanilamida dan B: senyawa turunan arilamida-1
Lampiran 6. Perhitungan Bahan Sintesis dan Hasil Rendemen Senyawa Turunan Arilamida-1
Perhitungan bahan:
1. Sulfanilamida digunakan 3,59 mmol= 0,00359 mol Berat molekul = 172,2 g/mol
0,00359 mol x 172,2 g/mol = 0,62 g 2. Piridin digunakan 5,39 mmol = 0,00539 mol
Berat molekul = 79,1 g/mol Massa jenis = 0,982 g/mL
0,00539 mol x 79,1 g/mol = 0,43 g atau 0,43 g : 0,982 g/mL = 0,44 mL 3. 3-bromopropionil klorida digunakan 6,00 mmol = 0,006 mol
23 Hasil rendemen:
Senyawa turunan arilamida-1 yang seharusnya (teoritis) = 0,00359 mol x 307,12 g/mol = 1,10 g
Senyawa turunan arilamida-1 = Berat hasil sintesis
Berat teoritis x 100%
= 0,43 g
1,10 g x 100% = 39,09 %
Lampiran 7. Perbesaran pada sinyal 2,87 ppm (integrasi= 2) dan 3,00 ppm (integrasi= 2) menunjukan sinyal triplet of triplet. Integrasi= 2 menandakan bahwa terdapat 2 atom H yang terdeteksi yaitu proton HB dari senyawa turunan
arilamida-1
Lampiran 8. Perbesaran pada sinyal 3,74 ppm (integrasi= 2) dan 3,88 ppm (integrasi= 2) menunjukan sinyal triplet of triplet. Integrasi= 2 menandakan bahwa terdapat 2 atom H yang terdeteksi yaitu proton HA dari senyawa turunan
arilamida-1
HA HA HB
24
Lampiran 9. Perbesaran pada sinyal 7,75 dan 7,76 ppm serta 7,26 ppm.Integrasi= 2 menandakan bahwa terdapat 2 atom H yang terdeteksi yaitu proton HC maupun
HD dari senyawa turunan arilamida-1
Lampiran 10. Mekanisme penataan ulang dan fragmentasi pada senyawa turunan arilamida-1
HD
25 Lampiran 11. Rancangan 96-microwell plate
Keterangan: B : Dapar Sp : Sampel
In : Inhibitor NNGH (kontrol positif) E : Enzim
26
BIOGRAFI PENULIS
Penulis skripsi dengan judul “Sintesis Turunan Arilamida-1 dan Uji Aktivitas In Vitro terhadap Enzim