BAB II
TINJAUAN PUSTAKA
2.1 Etil Akrilat
Etil akrilat merupakan campuran organik yang berbentuk cairan bening berbau sangat menyengat, yang biasa digunakan sebagai bahan preperasi dari jenis-jenis polimer (American Conference, 1991). Etil akrilat pertama kali dibuat oleh Redtenbacher pada tahun 1843, dengan mengoksidasi acrolein dan perak oksida, kemudian mereaksikan garam perak dengan etil ionida. Ini terus diproduksi secara komersial hingga awal tahun 1930. Di USA, proses oksidasi propilen digunakan secara esklusif untuk memproduksi campuran akrilat. Teknik ini terus berkembang hingga tahun 1970 melibatkan oksidasi propilen menjadi
acrolien dan mensubsitusi oksida menjadi asam akrilat. Reaksi dilakukan pada
kondisi uap pada shelland cube exchangers pada tekanan atmosfer. Kobalt oksida digunakan sebagai katalis untuk reaksi pertama, dan molybdium untuk reaksi yang kedua. Asam akrilat keluar dari reaktor yang kedua dengan diserap oleh air, kemudian diekstrak dengan organic solven dan dipisahkan dengan vakum destilasi. Etil ester dibentuk dengan meraksikan asam akrilat dengan etanol (Mannsville Chemicals Products Corp., 1984).
Ada empat perusahaan besar di Amerika serikat yang memproduksi etil akrilat pada tahun 1984 yang memproduksi sebanyak 131 juta kilogram. Di Francis hanya ada satu perusahaan yang memproduksi etil akrilat sebanyak 60 juta kilogram, yang merupakan pusat etil akrilat di eropa barat. Di jepang, membutuhkan 15 juta kilogram etil akrilat yang diproduksi oleh empat perusahaan besar disana pada tahun yang sama, 1984.
Etil akrilat mengalami polimerisasi dengan air yang membentuk emulsi polimer, dan ini merupakan bentuk awal dari monomer akrilat yang akan digunakan. Emulsi polimer digunakan untuk pembentukan kain, benang, kertas, bahan perekat, semir, dan lain-lain (Mannsville Chemicals Products Corp., 1984).
2.2 Sifat Fisis dan Kimia Bahan Baku dan Produk 2.2.1 Bahan Baku
a. Asam Akrilat (AA) Sifat fisis :
- Berat molekul, : 72,064 g/mol
- Titik didih, : 141 oC
- Titik lebur, : 13,5 oC
- Tekanan kritis, : 56,6 bar
- Suhu kritis, : 380 oC
- Densitas (30oC), : 1,040 g/ml
- Viskositas (25oC), : 1,149 mPa.s - Panas penguapan pada 101,3 kPa, : 45,6 kJ/mol
- Panas pembakaran, : 1376 kJ/mol
- Cairan dan tidak berwarna - Bau tajam
- Mudah terbakar
Sifat kimia :
- Reaksi esterifikasi
Reaksi esterifikasi terjadi jika asam akrilat direaksikan dengan suatu alkohol membentuk ester dari asam akrilat dan air.
Reaksi :
CH2 = CHCOOH + ROH CH2 = CHCOOR + H2O
- Reaksi addisi
Asam akrilat dapat diadisi dengan halogen, hydrogen, dan hydrogen sianida.
Reaksi :
CH2 = CHCOOH + HX H2CX-CH2COOR
(Budavari, 1996)
b. Etanol Sifat Fisis :
- Berat molekul : 46,069 g/mol - Titik didih : 78oC
- Titik lebur : -114 oC - Tekanan kritis : 5,95 kPa - Suhu kritis : 243,1oC - Densitas (25 oC) : 0,789 g/ml - Viskositas (20 oC) : 0,2975 cP - Cairan dan tidak berwarna
- Bau sangat halus/khas - Mudah terbakar - Mudah menguap
Sifat kimia :
- Reaksi oksidasi
Reaksi oksidasi etanol dengan bantuan katalis K2Cr2O7, KMnO4,
Na2Cr2O7 menghasilkan formaldehid.
Reaksi :
C2H5OH + O2 CH3COOH + H2O
- Reaksi esterifikasi
Reaksi esterifikasi antara etanol dengan asam organik akan membentuk
ester dan air. Reaksi :
C2H5OH + HCOOH HCOOC2H5 + H2O
- Reaksi subsitusi
Reaksi substitusi antara etanol dengan HCl dengan bantuan katalis ZnCl2
menghasilkan etil klorida. Reaksi :
C2H5OH + HCl C2H5Cl + H2O
2.2.2 Bahan pembantu a. Asam Sulfat Sifat Fisis :
- Bentuk : Cairan bening, tak berbau - Rumus molekul : H2SO4
- Berat molekul : 98,08 g/mol - Titik didih : 253,86 oC - Temperatur kritis : 762,89 oC - Tekanan kritis : 8698,43 kPa - Densitas pada suhu (25 oC) : 1,84 g/ml - Cairan dan tidak berwarna
- Tidak berbau
Sifat Kimia :
- Dengan basa membentuk garam dan air :
H2SO4 + 2 NaOH Na2SO4 + 2 H2O
- Dengan garam membentuk garam dan asam lain H2SO4 + 2 NaCl Na2SO4 + 2HCl
(Baker, 2006)
b. Sodium Hidroksida Sifat Fisis :
- Berat molekul : 39,997 g/mol - Densitas : 2,1 g/cm3 - Titik didih : 1390 oC - Titik leleh : 318 oC - Suhu kritis : 2546,85oC - Tekanan kritis : 253,31 bar - Padat
- Tidak mudah terbakar - Sangat korosif
Sifat kimia :
- Dengan asam membentuk garam dan air :
H2SO4 + 2 NaOH Na2SO4 + 2 H2O
- Dengan etanol akan menghasilkan Na Etoksida : C2H5OH + NaOH NaOC2H5 + H2O
(Othmer Kirk, 1992)
2.2.3 Produk
a. Etil Akrilat
Sifat Fisis :
- Berat molekul : 100,12 g/mol - Titik didih : 99,8oC - Titik lebur : -71,2 oC - Tekanan kritis : 36,80 bar - Suhu kritis : 279,85 oC - Densitas (20oC) : 0,9234 g/ml - Viskositas (25oC) : 0,55 mPa.s - Cairan tidak berwarna
- Bau menusuk - Mudah terbakar
Sifat Kimia :
- Bereaksi secara tak terkendali dengan oksidan kuat yang akan menyebabkan ledakan dan kebakaran.
- Mudah terpolimerisasi pada suhu yang tinggi.
(Weast. C, 1984)
b. Air (H2O)
Sifat Fisis :
- Berat molekul : 18,016 g/mol - Melting point : 0 0C
- Boiling point : 100 0C
- Warna : Tidak Berwarna - Densitas : 998 kg/m3 - Temperatur Kritis : 374,3 0C - Tekanan Kritis : 217,6 Atm
- Panas pembentukan : - 99,972 kkal/mol - Panas penguapan : 9,717 kal/mol
- Cp : 1 kkal/mol0C
(Perry,1999)
Sifat Kimia :
- Merupakan senyawa polar karena memiliki pasangan elektron bebas
- Melarutkan banyak substansi sehingga banyak digunakan sebagai pelarut
- Membentuk ikatan hidrogen yang lemah antara atom hidrogen pada satu molekul dengan atom oksigen pada molekul lain
- Tidak bersifat asam atau basa, tetapi netral dengan pH 7 - Menyebabkan korosi pada logam besi
- Memiliki aktivitas katalitik tertentu seperti oksidasi loga
- Merupakan elektrolit lemah, mengionisasi menjadi H3O+ dan OH
(Perry, 1999)
2.3 Proses Pembuatan Etil Akrilat
Proses pembuatan etil akrilat ada beberapa macam, yaitu dari acetylen, asam sulfat, dan asam akrilat. Dari beberapa proses yang ada, perlu dipertimbangkan kelayakan proses dalam suatu perancangan supaya mempunyai nilai ekonomis yang tinggi. Kriteria yang harus diperhatikan dalam pemilihan suatu proses.
Ada beberapa cara pembuatan etil akrilat, yaitu:
2.3.1 Proses Reppe Tekanan Tinggi
Proses Reppe merupakan proses pembuatan acetylene yang dibuat dengan beberapa reaksi yang di teliti oleh Walter Reppe pada tahun 1920. Maka pada proses Reppe ini secara otomatis bahan baku yang digunakan adalah acetylene. Bahan ini direaksikan dengan karbon monoksida dan
senyawa hidroksil. Reaksi ini berlangsung pada temperatur 150oC, tekanan 15 – 30 atm dengan katalisator nikel.
Reaksi:
C2H2 + CO + CH3OH → CH3 = CHCOOCH3 (Hahn dan Neier,
1998)
Namun proses ini tidak dikembangkan secara industri karena pemakaian katalis yaitu nikel yang tidak baik. Jumlah standar pemakaian katalis tidak pernah diketahui membuat proses ini terus diteliti saja, sehingga memunculkan proses kedua yaitu ester dari acetylene dengan reaksi yang lebih baik (Othmer Kirk, 1992).
2.3.2 Proses Pembuatan Ester Akrilat dari Acetylene.
Pada proses ini ester akrilat diperoleh dengan jalan mereaksikan
acetylene dengan alkohol dalam suasana asam dengan adanya nikel karbonil.
Reaksi berlangsung pada tekanan 1 atm dan suhu 40oC (Hahn dan Neier, 1998).
Reaksi:
4C2=H2 + 4 C2H5OH + HCl + Ni(CO)4 → 4CH2=CHCOOC2H5 + NiCl2 +
H2
Proses ini dikembangkan kembali untuk mendapatkan nikel yang sedikit sehingga dilakukan penambahan karbon monoksida sebagai semikatalis :
4C2=H2 + 4 C2H5OH + 0,1 HCl + 0,05 Ni(CO)4 + 0,8 CO →
4CH2=CHCOOC2H5 + 0,05 NiCl2 + 0,05H2 ( Tedeschi,
1992).
Pada awalnya reaksi dapat berjalan dengan sama, tetapi katalis lebih dominan. Sehingga pada akhirnya, karbon monoksida, acetylene, dan alkohol membentuk reaksi esterifikasi yang membentuk acrylate ester dengan bantuaan katalis. Nikel karbonil yang dihasilkan didaur ulang pada pengolahan nikel. Walaupun demikian, nikel karbonil bersifat volatil dan sangat beracun. Jika diolah kembali akan sangat berbahaya bagi operatornya. Maka biasanya nikel karbonil ini seringkali langsung dibakar di flare (Othmer Kirk, 1992).
Proses ini merupakan oksidasi katalitik terhadap propilena membentuk asam akrilat. Esterifikasi asam akrilat dan methanol dengan katalis asam atau
kation exchange resin akan membentuk etil akrilat.
Reaksi:
• Oksidasi Propilen
CH2 = CHCH3 + O2→ CH2 = CHCHO + H2O
CH2 = CHCHO + ½ O2→ CH2 = CHCOOCH3 + H2O
• Esterifikasi
CH2 = CHCOOH + CH3OH → CH2 = CHCOOCH3 + H2O (Othmer Kirk,
1992)
Proses ini sangat komersial digunakan dalam industri. Proses oksidasi berlangsung pada reaktor tipe fixed bed and tube shell, dengan pendingin didinding reaktor. Suhu operasi sekitar 330-430 oC disesuaikan dengan katalis yang dipakai. Hasil dari reaktor dilanjutkan ke kolom absorpsi untuk mengabsorpsi acrylic dan acetic acid dan gas-gas lain yang terikut didalam yang bersifat impuritis. Proses selanjutnya dilangsungkan di dalam kolom destilasi untuk memurnikan acrylic yang dihasilkan. Pada tahapan ini acrylic yang dapat dimurnikan hanya sekitar 73-83 % (Othmer Kirk, 1992).
2.3.4 Proses ethyl 3-ethoxypropionate
Pada proses ini bahan baku ethyl 3-ethoxypropionate dikondisikan pada suhu150oC dan tekanan atmosferis dengan menggunakan katalis mercury (II). Reaktor yang digunakan Jacketed kettle. Reaksi :
C2H5OCH2CH2COOCH3→ CH2 = CHCOOCH3 + C2H5OH
(U.S. Patent 2,980,730 )
Proses ini dapat menghasilkan 95-97% etil akrilat. Walaupun dapat menghasilkan etil akrilat dengan konpersi yang sangat tinggi, reaksi ini bersifat korosif, sehingga diperlukan penanganan terhadap korosi tersebut dengan biaya yang sangat mahal. Dengan biaya katalis yang sangat mahal dan potensial menghasilkan racun maka proses ini dihentikan (Othmer Kirk, 1992).
2.3.5 Proses Etylen Sianohidrin
Pada awalnya, etilen sianohidrin dihasilkan dari etilen klohidrin dan natrium klorida. Kemudian berkembang, dihasilkan dari ethylene oxide dan
hydrogen cyanide dengan bantuan katalis. Etylen sianohidrin ini kemudian
direaksikan dengan alkohol yang akan membentuk metil akrilat dengan katalis asam sulfat 85%. Reaksi:
CH2 – CH2 + HCN → HOCH2CH2CN
HOCH2CH2CN + CH3OH → CH2 = CHCOOCH3 + NH4HSO4
(Hahn dan Neier,
1998)
Reaksi ini hanya dapat menghasilkan ethil akrilat 60-70%. Selain itu, hasil reaksi ini juga berupa amoniumsulfida dan gas HCN yang sangat susah diolah kembali.
2.3.6 Proses Esterifikasi Asam Akrilat
Pada proses ini Asam akrilat direaksikan dengan Etanol dengan katalis Asam sulfat membentuk Etil akrilat. Reaksi esterifikasi ini berlangsung pada suhu 60-70oC dan tekanan 1 atm (Lee, 2005). Perbandingan mol Asam akrilat dan Etanol yang digunakan adalah 1:1,1 sampai 1,3. Asam sulfat ditambahkan sebesar 4-8% dari jumlah massa umpan. Reaksi tersebut terjadi didalam reaktor alir tangki berpengaduk. Hasil reaktor dilanjutkan dengan proses pemurnian didalam kolom destilasi dengan dua tahapan. Pada tahapan pertama untuk memurnikan etil akrilat dari etanol sekitar 80-90% dan dilanjutkan pada kolom destilasi kedua dengan yield produk etil akrilat sebesar 99,5% (Dougherty, 1989).
Reaksi :
CH2 = CHCOOH + C2H5OH CH2=CHCOOC2H5 + H2O
(Hahn dan Neier, 1985)
Komposisi % alkil akrilat yang tinggi sangatlah penting dalam pembentukan produk-produk polimer. Dengan beberapa proses yang diketahui untuk pembentukan alkil akrilat, reaksi esterifikasi adalah yang terbaik. Dengan harga yang murah, baik dari bahan baku, maupun katalis (Hahn dan Neier, 1985).
Semua proses pembuatan etil akrilat memiliki keuntungan dan kerugian tersendiri. Seperti proses Reppe merupakan proses yang pertama sekali dilakukan untuk memproduksi etil akrilat, namun karena standar pemakaian katalis tidak pernah diketahui, proses ini dihentikan. Proses pembuatan etil akrilat dari
acytilene juga sangat banyak dipakai dalam industri. Dengan proses yang sangat
mudah dan tidak rumit menjadikan proses ini banyak dipakai. Namun, nikel karbonil yang dihasilkan membuat proses ini diganti dengan proses oksidasi propilena.. proses ini sangat baik dan banyak dipakai saat ini. Proses ini merupakan oksidasi katalitik terhadap propilena membentuk asam akrilat. Esterifikasi asam akrilat dan metanol dengan katalis asam atau kation exchange resin akan membentuk etil akrilat. Tetapi proses ini banyak dipakai hanya untuk mendapatkan asam akrilat saja. Esterifikasi asam akrilat dengan etanol merupakan reaksi yang paling sederhana untuk memproduksi etil akrilat. Dari semua proses diatas, tahapan akhir yang dilakukan ialah mengesterifikasi asam akrilat dengan senyawa alkohol. Sehingga, pada perancangan ini dipilih proses pembuatan etil akrilat dengan proses esterifikasi asam akrilat dan katalis asam sulfat dengan keuntungan sebagai berikut:
a) Harga bahan baku dan katalis yang murah.
b) Proses sederhana, sehingga alat yang digunakan untuk proses produksi tidak terlalu banyak dan lebih ekonomis.
c) Menghasilkan produk samping berupa air, yang dapat dibuang secara langsung.
2.4 Deskripsi Proses
Proses pembuatan etil akrilat dari etanol dan asam akrilat dapat dibagi menjadi tiga tahap, yaitu :
1. Penyiapan bahan baku 2. Pengolahan
3. Pemurnian produk
Penjabaran dan uraian tiap-tiap tahap adalah sebagai berikut:
2.4.1 Penyiapan Bahan Baku
Bahan baku asam akrilat dari tangki penyimpan (T-103), dan etanol dari tangki penyimpan (T-101) pada kondisi suhu 30 oC dipompa menuju pemanas untuk menaikkan suhunya menjadi 70oC pada konsdisi 1 atm. Asam sulfat sebagai katalisator juga dipompa dari tangki penyimpan (T-102) pada suhu 30 oC dan tekanan 1 atm menuju menuju pemanas untuk menaikkan suhunya menjadi 70oC. Ketiga bahan ini dialirkan kedalam reaktor (R-201).
2.4.2 Pengolahan
Bahan baku asam akrilat dan etanol dengan perbandingan 1:1,2 diumpankan ke dalam reaktor. Katalis asam sulfat dimasukkan ke dalam reaktor dengan konsentrasi 4% dari bahan baku (Lee, 2005). Reaktor beroperasi secara
isothermal pada suhu 70oC dan tekanan 1 atm. Reaktor yang digunakan adalah reaktor alir tangki berpengaduk (RATB) dengan waktu tinggal selama 3 jam (Dougherty, 1989). Reaksi yang terjadi bersifat eksotermis, sehingga untuk menjaga kondisi isothermal perlu pendingin sebagai penghilang panas yang dihasilkan reaksi. Panas dihilangkan dari dalam reaktor dengan cara mengalirkan air pendingin melalui jaket pendingin yang dibuat melapisi disamping reaktor (Lee, 2005).
2.4.3 Pemurnian Produk
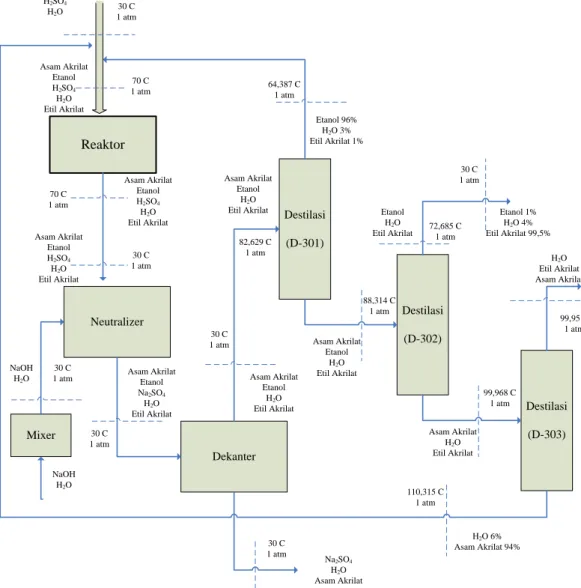
Tahap ini bertujuan untuk memperoleh produk etil akrilat hingga mencapai kemurnian 99,5 %. Produk yang keluar dari reaktor (R-201) didinginkan hingga suhu 30oC kemudian dialirkan menuju neutraliser (N-301) yang beroperasi pada suhu 30 oC dan tekanan 1 atm. Didalam neutraliser asam sulfat dinetralisasi menggunakan sodium hidroksida (NaOH) yang dipompa dari tangki pelarut (M-301). Keluaran dari neutraliser dialirkan menuju dekanter
(Dc-301) yang beroperasi pada suhu 30 oC dan tekanan 1 atm untuk memisahkan Na2SO4 sebelum masuk ke menara distilasi (D-301) (Lee, 2005). Hasil bawah
dekanter berupa Na2SO4, asam akrilat dan air. Hasil atas dekanter berupa asam
akrilat, etanol, air dan etil akrilat masuk ke menara destilasi (D-301) yang beroperasi pada tekanan 1 atm dan pada suhu umpan 82,629oC. Hasil atas D-301 berupa etanol, air dan etil akrilat. Hasil ini dikembalikan kembali kedalam reaktor untuk digunakan kembali sebagai bahan baku. Sedang hasil bawah D-301 masuk ke D-302. Dalam D-302 terjadi pemisahan lebih lanjut yang beroperasi pada suhu umpan 88,314oC sehingga hasil atas dengan kemurnian 99,5 % berat etil akrilat dan impuritas berupa air 0,3% dan etanol 0,1% berat (Dougherty, 1989). Etil akrilat tersebut kemudian dilewatkan ke dalam cooler untuk menurunkan suhunya menjadi 30oC dan selanjutnya disimpan dalam tangki penyimpan produk (T-304). Sedangkan hasil bawah D-302 yaitu asam akrilat, air dan sis etil akrilat dialirkan menuju destilasi (D-303) untuk memperoleh asam akrilat 94% melalui hasil bawah yang dapat dikembalikan kedalam reaktor untuk digunakan kembali (Hahn dan Neier, 1985).
2.5 Diagram Alir Proses Pembuatan Etil Akrilat Dari Etanol Dan Asam Akrilat Reaktor Neutralizer Dekanter Destilasi (D-301) Destilasi (D-303) Destilasi (D-302) Mixer Asam Akrilat Etanol H2SO4 H2O Etil Akrilat 70 C 1 atm Asam Akrilat Etanol H2SO4 H2O Etil Akrilat 70 C 1 atm Asam Akrilat Etanol Na2SO4 H2O Etil Akrilat 30 C 1 atm 30 C 1 atm NaOH H2O NaOH H2O Na2SO4 H2O Asam Akrilat 30 C 1 atm H2O 6% Asam Akrilat 94% 110,315 C 1 atm 30 C 1 atm Asam Akrilat Etanol H2SO4 H2O Etil Akrilat Asam Akrilat Etanol H2O Etil Akrilat Etanol 1% H2O 4% Etil Akrilat 99,5% 30 C 1 atm Etanol H2O
Etil Akrilat 72,685 C1 atm
H2O Etil Akrilat Asam Akrilat 99,95 C 1 atm 88,314 C 1 atm 82,629 C 1 atm Asam Akrilat Etanol H2O Etil Akrilat Asam Akrilat Etanol H2O Etil Akrilat 30 C 1 atm 64,387 C 1 atm Etanol 96% H2O 3% Etil Akrilat 1% Asam Akrilat H2O Etil Akrilat 99,968 C 1 atm Asam Akrilat Etanol H2SO4 H2O 30 C 1 atm