Pembuatan Kurva kalibrasi
Larutan ammonium yang digunakan berasal dari padatan senyawa ammonium klorida (NH4Cl) yang berwarna putih. Setelah dilarutkan dalam aqua demin menjadi bening (tan warna) dan terdisosiasi menjadi:
NH4Cl NH4+ + Cl
-Ion ammonium (NH4+) tersebut yang akan di adsorpsi oleh adsorben abu dasar dan zeolit. Untuk membuat kurva kalibrasi ammonium yaitu dengan menyiapkan larutan ammonium klorida (NH4Cl) standart konsentrasi 2mg/L, 4mg/L, 6mg/L, 8mg/L, 10mg/L yang diharapkan nantinya range tersebut dapat mewakili pengukuran konsentrasi ammonium pada sampel untuk analisa selanjutnya. Metode pengukuran yang digunakan yaitu Colorimetri dengan aalat spektroskopi UV-Vis. Pengukuran absorbansi kelima larutan dilakukan pada panjang gelombang (λ) 630nm. Hasilnya diperoleh persamaan regresi linier y=0,038x+0,015 dengan nilai R2= 0.988 dimana persamaan tersebut telah sesuai dengan hukum Lambert-Beer yang menghubungkan antara absorbansi dengan konsentrasi larutan dimana grafiknya dapat dilihat pada Gambar 3.5.
Gambar 3.5 Kurva kalibrasi larutan ammonium konsentrasi 2-10 mg/L
Penghilangan ammonium (NH4+) menggunakan abu dasar dan zeolit A hasil sintesis.
Abu dasar dan zeolit hasil sintesis yang diperoleh selanjutnya digunakan untuk mengadsorpsi ion ammnium (NH4+) dari larutan sintetis NH4Cl, disini abu dasar dan zeolit berperan sebagai adsorben. Pengaruh variasi waktu kontak, konsentrasi awal, pH, dan suhu digunakan untuk menyelidiki kemampuan daya adsorpsi masing-masing adsorben terhadap ion ammonium dengan menggunakan metode adsorpsi batch.
Pengaruh waktu kontak
Variasi waktu kontak dilakukan untuk mengetahui kapan waktu optimum yang digunakan adsorben abu dasar dan zeolit untuk dapat mengadsorpsi ammonium (NH4+) secara maksimal sehingga pengamatan dilakukan selama 24 jam. Larutan kerja ammonium yang digunakan untuk adsorpsi ini dengan konsentrasi sebesar 10 mg/L. Filtrat dari sampel adsorpsi diambil sebanyak 10ml kemudian ditambah dengan reagen-reagen
colory-method hingga muncul warna biru. Warna biru tersebut muncul menandakan adanya kandungan ammonium yang masih ada dalam filtrat, semakin pekat warna biru yang dihasilkan maka kandungan ammonium dalam filtrat masih tinggi, dengan kata lain yang teradsorp oleh adsorben hanya sedikit. Pengukuran absorbansi dilakukan pada panjang gelombang 630nm menggunakan spektroskopi UV-Vis. Hasilnya diperoleh pada adsorben abu dasar kapasitas adsorpsi (qe) tertinggi sebesar 0,5447mg/g dengan prosentase 54.47% pada menit 480 yang kemudian mencapai waktu konstan di menit 720, sedangkan pada adsorben zeolit kapasitas adsorpsi (qe) tertinggi sebesar 0,75mg/g dengan prosentase 75% pada menit 240 yang kemudian mencapai waktu konstan di menit 240 tersebut. Hal ini ditandai dengan garis grafik yang semakin lurus pada Gambar 3.6 yang artinya adsorpsi telah mencapai waktu yang optimum sehingga adsorben sudah tidak bisa lagi mengadsorp adsorbat ammonium.
Gambar 3.6 Kurva hubungan waktu kontak (menit) dengan qe (mg/g). Kondisi proses: massa adsorben abu dan zeolit= 0,5gr; Co= 10mg/L; pH 6.5; suhu ruang (25°C); volume 50ml
Prosentase kapasitas removal ion ammonium dengan adsorben zeolit lebih tinggi bila dibandingkan dengan adsorben abu dasar, hal ini berdasarkan mekanisme pertukaran ion yang terjadi pada zeolit. Mekanisme penghilangan ammonium menggunakan zeolit termasuk reaksi pertukaran ion. Zeolit ini dapat digunakan sebagai adsorben untuk menghilangkan ammonium dalam larutan karena zeolit mempunyai muatan negatif akibat adanya perbedaan muatan antara Si 4+ dengan Al 3+ (Englert&Rubio, 2005). Pengaruh konsentrasi awal
Perlakuan variasi konsentrasi awal ini bertujuan untuk mengetahui besarnya kapasitas removal maksimum dari masing-masing adsorben seiring dengan semakin tingginya konsentrasi awal ammonium (NH4+). Larutan kerja ammonium klorida yang digunakan ada 13 variasi konsentrasi pada range 5-100mg/L. Prosedur pengukuran filtrate adsorpsi ini sama yaitu dengan metode colorimetric menggunakan spektroskopi UV-Vis. Hasilnya diperoleh kapasitas adsorpsi (qe) dari masing-masing konsentrasi terus naik hingga yang tertinggi sebesar 4.11843 mg/g untuk adsorben abu dasar dan 4.5 mg/g y = 0,038x + 0,015 R² = 0,988 0 0,1 0,2 0,3 0,4 0,5 0 10 20 ab so rb an si konsentrasi (mg/L) ammonium Linear (ammoniu m) 0 0,2 0,4 0,6 0,8 0 250 500 750 10001250 1500 1750 q e ( m g/ g) t (menit)
untuk zeolit pada kosentrasi ammonium 50mg/L. Efisiensi removal dari adsorpsi menunjukan kesetimbangan, yaitu setelah konsentrasi 50mg/L terjadi penurunan grafik hingga akhirnya konstan pada titik konsentrasi 100mg/L. Sekitar 82% ammonium pada konsentrasi 50mg/L dapat teradsorp oleh abu dasar dan 90% oleh zeolit. Hal ini dapat dilihat pada Gambar 3.7.
Gambar 3.7 Kurva hubungan konsentrasi awal (mg/l) dengan qe (mg/g). Co=5-100mg/L. Kondisi proses: massa adsorben= 0,5gr; pH 6.5; suhu ruang (25°C); t kontak= 720 menit untuk abu dan 240 menit untuk zeolit; volume 50ml.
Kemampuan penyerapan ion ammonium (NH4+) meningkat seiring dengan meningkatnya konsentrasi larutan ammonium. Hal ini dikarenakan konsentrasi awal ammonium yang tinggi akan memberikan daya/tenaga dorong yang lebih besar (Demir et al, 2002), sehingga ion ammonium (NH4+) akan berpindah (migrasi) dari permukaan luar ke dalam pori-pori zeolit A yang berukuran mikro dengan adanya kontak waktu (Wang, 2005). Ion ammonium (NH4+) mampu bertukar kation tidak hanya pada permukaan luar zeolit tapi juga pada permukaan dalam zeolit. Kesetimbangan tercapai ketika semua pertukaran ion ammonium (NH4+) dan kation pada permukaan luar dan dalam zeolit A telah tercapai. Semakin tinggi konsentrasi ammonium dalam larutan, semakin banyak ammonium yang dapat tertukar atau teradsorp. Hal ini sesuai dengan penelitian adsorpsi ammonium lainnya yang menggunakan zeolit alam (Rozic et al,2000).
Pengaruh pH awal larutan
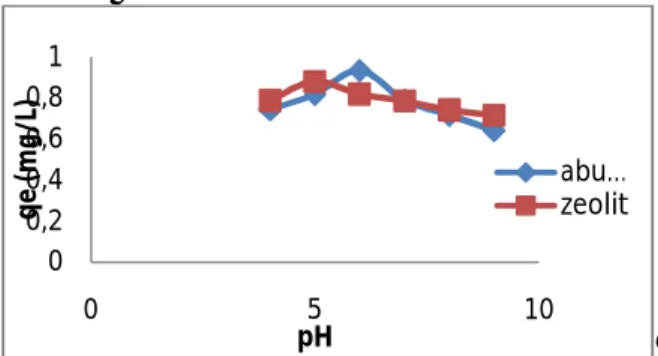
Perlakuan variasi pH ini bertujuan untuk mengetahui pada keadaan pH berapa akan tercapai kondisi kapasitas adsorpsi tertinggi atau optimum. Range pH yang digunakan diambil mulai dari keadaan asam (pH=4) sampai keadaan basa (pH=9), untuk mengatur pH dari larutan ammonium yang dipakai menggunakan larutan HCl 0,1 M dan NaOH 0,1 M. Larutan ammonium (NH4Cl) itu sendiri memiliki pH sekitar ± 6,5. Larutan kerja ammonium klorida konsentrasi 10mg/L disiapkan sebanyak 6 buah yang kemudian masing-masing larutan diatur pH nya menjadi pH 4,5,6,7,8,9 dengan memakai larutan HCl dan NaOH, pengukuran pH larutan menggunakan alat pH meter supaya lebih akurat.
Hasil yang diperoleh untuk kapasitas adsorpsi dari masing-masing pH terus naik hingga
yang tertinggi sebesar 0,93685 pada filtrat ammonium pH 6 lalu kapasitas adsorpsi pada filtrat setelah pH 6 semakin menurun, terlihat pada grafik yang semakin menurun setelah mencapai puncak 0,9368 yang artinya telah terjadi proses adsorpsi paling tinggi karena 93,68% ammonium teradsorp oleh abu dasar. Sedangkan untuk adsorben zeolit diperoleh kapasitas adsorpsi dari masing-masing pH terus naik hingga yang tertinggi sebesar 0,88158 pada filtrat ammonium pH 5 lalu kapasitas adsorpsi pada filtrat setelah pH 5 semakin menurun, hal ini dapat dilihat pada Gambar 3.8. Garisnya semakin menurun setelah mencapai puncak 0,88158 yang artinya telah terjadi proses adsorpsi paling tinggi karena 88,158% ammonium teradsorp oleh zeolit.
Gambar 3.8 Kurva hubungan pH larutan dengan qe (mg/g). Kondisi proses: massa adsorben abu dan zeolit= 0,5gr; Co larutan= 10mg/L; t kontak abu 720 menit; t kontak zeolit 240 menit; suhu ruang (25°C); volume 50ml Besarnya nilai pH sangat memberi pengaruh kuat pada daya adsorpsi atau efisiensi removal dari adsorben abu dasar dan zeolit. Hal ini dapat kita lihat pada Gambar 4.7 dengan besar konsentrasi awal ammonium 10 mg/L. Kompetisi kinerja adsorpsi antara zeolit dengan abu dasar terlihat hampir sama, zeolit mencapai adsorpsi tertinggi pada pH 5 sedangkan abu dasar mencapai adsorpsi tertinggi pada pH 6. Penelitian yang dilakukan oleh Thornton (2007) dan Emerson (2006), juga menujukkan hasil yang cenderung sama bahwa adsorpsi ion ammonium (NH4+) pada zeolit tercapai saat pH<8. Peningkatan adsorpsi secara cepat ini berhubungan dengan pembentukan hidrokso yang berbeda dengan saat terjadi kenaikan pH larutan.
Pengaruh suhu adsorpsi
Perlakuan variasi suhu ini bertujuan untuk melihat kompetisi antara suhu dengan konsentrasi awal, semakin naik suhu dari larutan ternyata efisiensi removal semakin rendah atau hasil prosentase efisiensinya semakin turun. Perlakuan proses adsorpsinya sama dengan saat perlakuan untuk variasi konsentrasi awal, larutan ammonium yang digunakan dengan konsentrasi 10-50 mg/L, adsorben yang digunakan juga ada dua yaitu abu dasar dan zeolit, hanya saja saat melakukan proses adsorpsi larutan diatur suhunya menjadi 25°C, 35°C, dan 45°C. Hasil untuk adsorben abu dasar besarnya kapasitas adsorpsi pada suhu 25°C lebih tinggi bila 0 1 2 3 4 5 0 50 100 150 q e (m g/ L) Co (mg/L) abu zeolit 0 0,2 0,4 0,6 0,8 1 0 5 10 q e ( m g/ L) pH abu … zeolit
dibandingkan dengan suhu 35°C, dan 45°C. Hasilnya dapat dilihat pada Gambar 3.9.
Gambar 3.9 Kurva hubungan konsentrasi (mg/L) dengan qe (mg/L) pada T= 25, 35, 450C. Kondisi proses: massa adsorben abu dasar= 0,5gr; Co= 10-50 mg/L; t kontak abu 720 menit; pH 6,5; volume 50ml.
Prosentase kapasitas adsorpsi tertinggi pada suhu 45°C ini sama dengan yang memakai suhu 35°C tetapi lebih rendah bila dibandingkan yang suhu ruang (25°C), hal ini membuktikan bahwa apabila pada suhu tinggi proses adsorpsi tidak berjalan secara maksimal. Untuk adsorben zeolit hal yang sama juga terjadi, yaitu besarnya kapasitas adsorpsi pada suhu 25°C lebih tinggi bila dibandingkan pada suhu 35°C, dan 45°C. Hasilnya dapat kita lihat pada Gambar 3.10
Gambar 3.10 Kurva hubungan konsentrasi (mg/L) dengan qe (mg/L) pada T= 25, 35, 450 C. Kondisi proses: massa adsorben zeolit= 0,5gr; Co= 10-50 mg/L; t kontak abu 240 menit; pH 6,5; volume 50ml.
Efisiensi penghilangan ion ammonium (NH4+) meningkat dengan naiknya suhu, dimana suhu tersebut dibawah suhu ruang (25°C) sedangkan efisiensi penghilangan ammonium menurun seiring dengan meningkatnya suhu saat suhu tersebut melebihi suhu ruang. Hal ini disebabkan oleh adanya adsorpsi kimia saat proses adsorpsi berlangsung. Laju adsorpsi melambat saat proses adsorpsi kimia, dan suhu tinggi dapat membantu meningkatkan laju adsorpsi. Tetapi bagaimanapun juga suhu yang tinggi tidak bagus untuk reaksi eksotermis saat kesetimbangan pertama tercapai. Oleh karena itu ada kecenderungan ion ammonium terdesorpsi dari fase padat ke fase bulk saat suhu dalam larutan meningkat (Karadag, 2006).
Kinetika adsorpsi
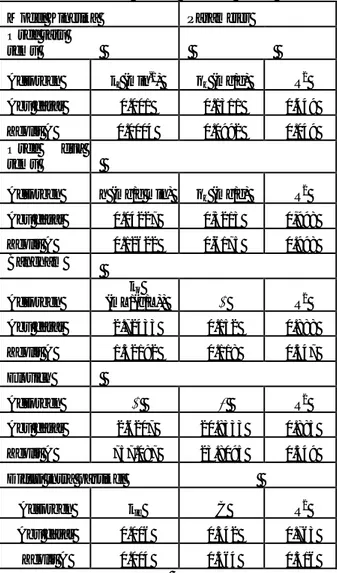
Kinetika dari adsorpsi ion ammonium (NH4+) bertujuan untuk mengetahui model mana yang akan digunakan dalam sistem eksperimen. Model kinetika tersebut untuk menjelaskan mekanisme dari adsorpsi yang berlangsung, yang tergantung pada karakteristik fisika atau kimia dari adsorben seperti halnya proses transport massa. Model-model kinetika yang digunakan untuk dicocokan dengan data hasil eksperimen meliputi model orde satu semu, model orde dua semu, model Elovich, model Bangham, dan model difusi intra partikel.Nilai parameter adsorpsi kinetik dari kelima model telah dirangkum dalam Tabel 3.2.
Tabel 3.2 Parameter kinetika untuk adsorpsi ammonium dengan berbagai model
Model Kinetika Parameter Orde satu semu Adsorben kf (min-1) qe (mg/g) R2 Abu dasar 0.001 0.1311 0.449 Zeolit A 0.0004 0.0992 0.049 Orde dua semu Adsorben h (mg/g min) qe (mg/g) R 2 Abu dasar 0.04227 0,5213 0,998 Zeolit A 0.12622 0,6175 0.998 Bangham Adsorben ko (mL/(g/L)) R2 Abu dasar 2.72433 0.152 0.888 Zeolit A 1.32192 0.118 0.547 Elovich Adsorben R2 Abu dasar 2.6207 20.8333 0.885 Zeolit A 757.087 23.8095 0.549 Difusi intra partikel
Adsorben kid C R
2
Abu dasar 0.006 0.342 0.763
Zeolit A 0.004 0.564 0.316
Model Orde satu semu
Persamaan model orde satu semu (3.4) digunakan untuk menganalisa data eksperimen kinetika orde satu semu. Pada Gambar 3.11 memperlihatkan plot garis kinetika orde satu semu dari adsorpsi ammonium menggunakan adsorben abu dasar dan zeolit. Nilai Kf dapat dilihat pada Tabel 3.2. 0 1 2 3 4 5 6 0 20 40 60 q e ( m g/ L) Co (mg/L) suhu 35 suhu 45 suhu 25
Gambar 3.11 Kurva adsorpsi kinetik model orde satu semu. Kondisi proses: massa adsorben 0,5 gram, Co= 10 mg/L, volume 50 ml, suhu 25°C, waktu kontak 12 jam untuk adsoben abu dasar dan 4 jam untuk adsorben zeolit A.
Model Orde dua semu
Persamaan model orde dua semu (3.6) dan (3.7) digunakan untuk menganalisa data eksperimen kinetika orde dua semu hingga mendapatkan konstanta laju penyerapan awal (h). Nilai laju adsorpsi awal (h), konstanta laju orde dua semu (Ks) terdapat dalam Tabel 3.2. Pada Gambar 3.12 memperlihatkan plot garis kinetik orde dua semu dari adsorpsi ammonium menggunakan adsorben abu dasar dan zeolit.
Gambar 3.12 Kurva adsorpsi kinetik model orde dua semu. Kondisi proses: massa adsorben 0,5 gram, konsentrasi awal 10 mg/L, volume 50 ml, suhu 25°C, waktu kontak 12 jam untuk adsoben abu dasar dan 4 jam untuk adsorben zeolit A.
Nilai koefisien korelatif (R2= 0.998) yang didapat menandakan adsorpsi ammonium menggunakan adsorben zeolit dan abu dasar sesuai dengan model kinetik orde dua semu. Zeolit A yang mengikut kinetika orde dua semu menandakan penyerapan yang terjadi secara kimia (Mc Kay,1999). Hasil ini sama dengan eksperimen yang dilakukan Karadag, (2006) menggunakan zeolit Turkish clinoptilolite dan Zheng (2008) menggunakan zeolit 13X.
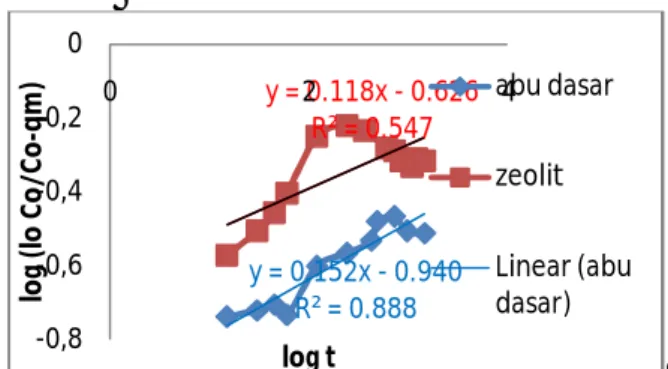
Model Bangham
Persamaan model Bangham (3.8) digunakan untuk mempelajari tahap-tahap pada sistem adsorpsi yang telah berlangsung. Nilai dari laju adsorpsi awal (α) dan konstanta bangham (Ko) dapat dilihat pada Tabel 3.2. Pada Gambar 3.13 memperlihatkan plot
garis kinetik model bangham dari adsorpsi ammonium menggunakan adsorben abu dasar dan zeolit.
Gambar 3.13 Kurva adsorpsi kinetik model bangham. Kondisi proses: massa adsorben 0,5 gram, konsentrasi awal 10 mg/L, volume 50 ml, suhu 25°C, waktu kontak 12 jam untuk adsoben abu dasar dan 4 jam untuk adsorben zeolit A.
Model difusi intra partikel
Model orde dua semu tidak dapat mengidentifikasi mekanisme difusi yang terjadi selama proses adsorpsi. Oleh karena itu dilakukan pengolahan data kinetik untuk model difusi intra partikel menggunakan persamaan (3.9). Nilai konstanta laju difusi intra partikel (Kid), kapasitas adsorpsi pada waktu t (qt), dan ketebalan dari batas lapisan (C) dapat dilihat pada Tabel 3.2. Pada Gambar 3.14 memperlihatkan plot garis kinetik difusi intra partikel dari adsorpsi ammonium menggunakan adsorben zeolit dan abu dasar.
Gambar 3.14 Kurva adsorpsi kinetik model difusi intra partikel. Kondisi proses: massa adsorben 0,5 gram, konsentrasi awal 10 mg/L, volume 50 ml, suhu 25°C, waktu kontak 12 jam untuk adsoben abu dasar dan 4 jam untuk adsorben zeolit A.
Berdasarkan model kinetik ini, beberapa mekanisme adsorpsi yang berbeda terlibat dan prosesnya dapat terbagi menjadi dua tahap atau lebih. Tahap yang pertama yaitu adsorpsi di luar permukaan atau disebut juga difusi makro-porous dan tahap yang kedua yaitu adsorpsi di dalam permukaan atau disebut difusi mikro-porous (Widiastuti, 1987). Menurut Lei (2007) prosesnya ada tiga tahap, tahap pertama yaitu adsorpsi diluar permukaan, tahap kedua yaitu adsorpsi berkelanjutan dimana proses adsorpsi dibawah y = -0,001x - 2,032 R² = 0,449 y = -0,000x - 2,311 R² = 0,049 -5 -4 -3 -2 -1 0 0 1000 2000 ln ( q e-q t) t(menit) abu dasar zeolit Linear (abu dasar) y = 1.918x + 27.49 R² = 0.998 y = 1.489x - 7.922 R² = 0.998 0 500 1000 1500 2000 2500 3000 0 1000 2000 t/ q t t (menit) abu dasar y = 0.152x - 0.940 R² = 0.888 y = 0.118x - 0.626 R² = 0.547 -0,8 -0,6 -0,4 -0,2 0 0 2 4 lo g (l o C o /C o -q m ) log t abu dasar zeolit Linear (abu dasar) y = 0.006x + 0.342 R² = 0.763 y = 0.004x + 0.564 R² = 0.316 0 0,2 0,4 0,6 0,8 0 20 40 q t (m g/ L) t½ abu dasar zeolit Linear (zeolit)
kontrol difusi intra partikel, tahap ketiga yaitu kesetimbangan akhir dimana difusi intra partikel mulai melambat seiring dengan berkurangnya konsentrasi ammonium dalam larutan. Oleh karena itu pada Gambar 3.14 menyiratkan bahwa selama proses adsorpsi berlangsung terdapat difusi adsorpsi yang cepat di permukaan luar yang diikuti difusi adsorpsi yang lambat di permukaan dalam.
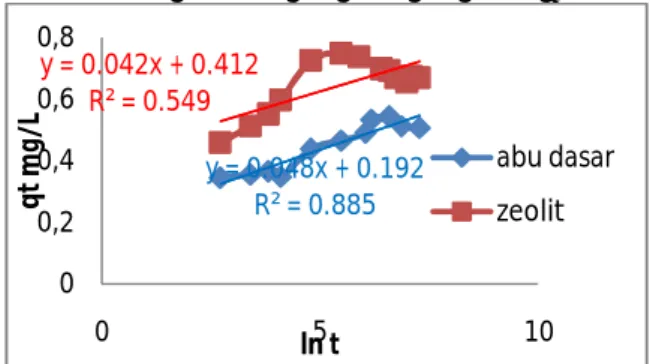
Model Elovich
Persamaan model elovich (3.11) digunakan untuk mengetahui luas permukaan adsorben yang tertutupi oleh adsorbat ion ammonium (NH4+) selama proses adsorpsi. Nilai laju adsorpsi awal (α) dan luas permukaan yang tertutupi (β) dapat dilihat pada Tabel 3.2. Pada Gambar 3.15 memperlihatkan plot garis kinetik model elovich dari adsorpsi ammonium menggunakan adsorben abu dasar dan zeolit.
Gambar 3.15 Kurva adsorpsi kinetik model elovich. Kondisi proses: massa adsorben 0,5 gram, konsentrasi awal 10 mg/L, volume 50 ml, suhu 25°C, waktu kontak 12 jam untuk adsoben abu dasar dan 4 jam untuk adsorben zeolit A.
Seperti yang terlihat pada Tabel 3.2 bahwa nilai dari laju adsorpsi awal (α) dan luas permukaan yang tertutupi (β) untuk adsorben zeolit lebih besar bila dibandingkan adsorben abu dasar yang artinya permukaan adsorben zeolit yang dapat mengadsorp ammonium lebih baik karena luas permukaannya tertutupi sekitar 23,80 gram/mg.
Isotherm adsorpsi
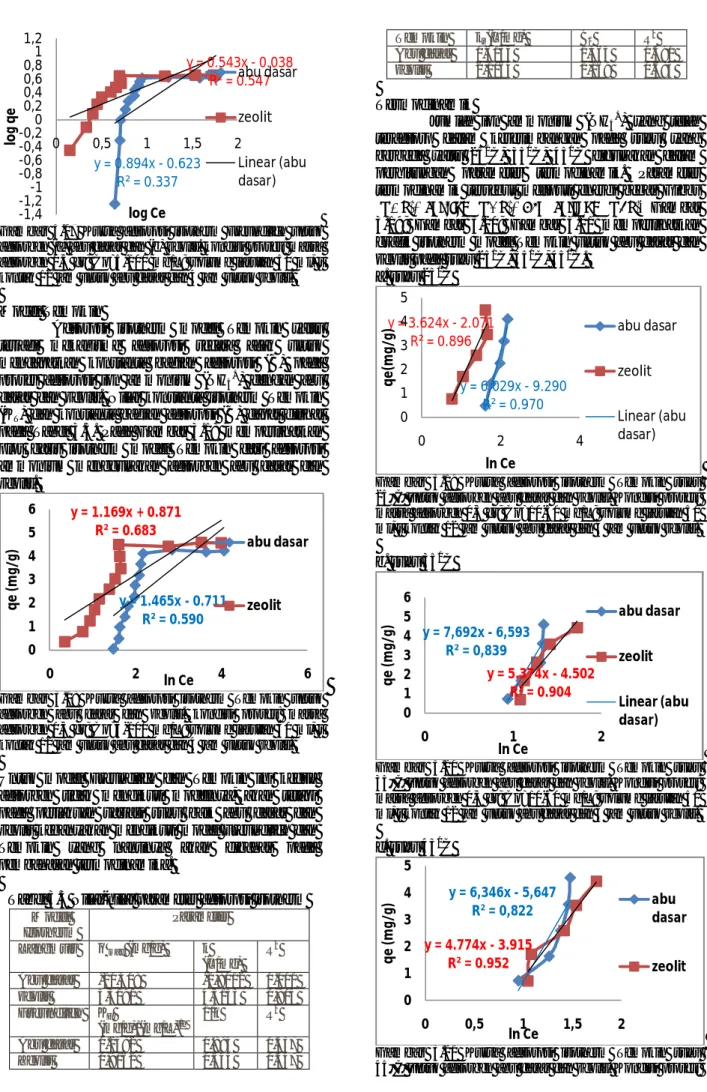
Isotherm adsorpsi dapat dianalisa dengan 3 model yaitu Langmuir, Freundlich, dan Tempkin. Model adsorpsi isotherm dari ammonium penting diolah untuk menggambarkan kesetimbangan adsorpsi ammonium dengan abu dasar dan zeolit. Model-model isotherm adsorpsi ini dilihat pada 3 kondisi keadaan suhu, fungsinya untuk membandingkan hasil pada saat temperature berapa akan terjadi adsorpsi ammonium secara optimum dan lebih baik. Isotherm adsorpsi terkarakterisasi oleh nilai konstanta tertentu yang menggambarkan karakteristik permukaan, afinitas dari adsorben dan kapasitas adsorpsi dari adsorben. Nilai-nilai parameter adsorpsi isotherm langmuir secara keseluruhan dapat kita lihat pada Tabel 3.3
Model Langmuir
Adsorpsi isotherm model Langmuir untuk mengetahui apakah terjadi adsorpsi satu lapis (monolayer) pada proses adsorpsi ion ammonium (NH4+) dengan abu dasar dan zeolit. Nilai konstanta langmuir (KL) dan kapasitas adsorpsi maksimum (qmax) dapat dilihat pada Tabel 3.3. Pada Gambar 3.16 memperlihatkan plot garis isotherm model langmuir dari adsorpsi ammonium menggunakan adsorben abu dasar dan zeolit. Adsorpsi Langmuir berasumsi bahwa pada permukaan adsorben terdapat sejumlah tertentu situs aktif (active sites) yang sebanding dengan luas permukaan adsorben. Pada keadaan situs aktif adsorben belum jenuh dengan adsorbat maka peningkatan konsentrasi adsorbat yang dipaparkan akan meningkat secara linier dengan jumlah adsorbat yang teradsorpsi. Selanjutnya, jika situs aktif adsorben telah jenuh dengan adsorbat, maka peningkatan konsentrasi adsorbat yang dipaparkan tidak akan meningkatkan jumlah adsorbat yang teradsorps (Mc Kay, 1999).
Gambar 3.16 Kurva adsorpsi isotherm Langmuir untuk adsorben abu dasar dan zeolit. Kondisi proses: massa adsorben 0,5 gr; Co=5-100 mg/L; volume larutan 50 ml, t kontak 12 jam untuk abu dasar dan 4 jam untuk zeolit. Berdasarkan nilai koefisien korelasi (R2) dari grafik diatas maka disimpulkan bahwa yang mengikuti isotherm model Langmuir yaitu adsorben zeolit. Model Freundlich
Adsorpsi isotherm model Freundlich yaitu terjadi mekanisme adsorpsi berlapis (double layer) pada proses adsorpsi ion ammonium (NH4+) dengan abu dasar dan zeolit. Nilai faktor kapasitas freundlich (KF) dan parameter intensitas freundlich (1/n) dapat dilihat pada Tabel 3.3. Pada Gambar 3.17 memperlihatkan plot garis isotherm model freundlich dari adsorpsi ammonium menggunakan adsorben abu dasar dan zeolit.
y = 0.048x + 0.192 R² = 0.885 y = 0.042x + 0.412 R² = 0.549 0 0,2 0,4 0,6 0,8 0 5 10 q t m g/ L ln t abu dasar zeolit y = -0.049x + 11.33 R² = 0.001 y = 0.188x + 1.178 R² = 0.904 0 5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 0 5 10 152025 3035 4045 5055 6065 C e/ q e Ce (mg/L) abu zeolit Linear (abu) Linear (zeolit)
Gambar 3.17 Kurva adsorpsi isotherm Freundlich untuk adsorben (a) abu dasar dan (b) zeolit. kondisi proses: massa adsorben 0,5 gr; Co=5-100 mg/L; volume larutan 50 ml, t kontak 12 jam untuk abu dasar dan 4 jam untuk zeolit. Model Tempkin
Adsorpsi isotherm model Tempkin yaitu terjadi mekanisme adsorpsi secara acak untuk mendapatkan konstanta bagian adsorpsi (B) pada proses adsorpsi ion ammonium (NH4+) dengan abu dasar dan zeolit. Nilai konstanta isotherm Tempkin (KT) dan konstanta bagian adsorpsi (B) dapat dilihat pada Tabel 3.3. Pada Gambar 3.18 memperlihatkan plot garis isotherm model Tempkin dari adsorpsi ammonium menggunakan adsorben abu dasar dan zeolit.
Gambar 3.18 Kurva adsorpsi isotherm Tempkin untuk adsorben abu dasar dan zeolit. kondisi proses: massa adsorben 0,5 gr; Co=5-100 mg/L; volume larutan 50 ml, t kontak 12 jam untuk abu dasar dan 4 jam untuk zeolit. Untuk model Freundlich dan Tempkin ini kedua adsorben tidak mengikuti modelnya, akan tetapi pada perlakuan variasi suhu baik abu dasar dan zeolit kebanyakan mengikuti model Freundlich dan Tempkin yang nantinya akan dibahas pada pembahasan termodinamika.
Tabel 3.3 Nilai-nilai parameter adsorpsi isotherm Model Isotherm Parameter Langmuir q max (mg/g) k (L/mg) R2 Abu dasar -20,408 -1,8012 0.001 zeolit 5,3191 4,5153 0,904 Freundlich KF (mg/g)/(mg/L)i/n 1/n R2 Abu dasar 0.2382 0.894 0.337 Zeolit 0,9162 0,543 0.547 Tempkin kt (L/mg) B1 R2 Abu dasar 0,6155 1,465 0.590 zeolit 2,1064 1,169 0.683 Termodinamik
Jumlah ion ammonium (NH4+) yang telah teradsorp dalam kesetimbangan pada suhu yang berbeda yaitu 250C, 350C, 450C digunakan dalam perhitungan parameter termodinamik. Parameter termodinamik tersebut meliputi energi bebas Gibbs (ΔG°), entalpi (ΔH°), dan entropi (ΔS°). Gambar 3.19; Gambar 3.20; Gambar 3.21 memperlihatkan grafik isotherm model Tempkin untuk abu dasar dan zeolit pada suhu 250C, 350C, 450C.
a. suhu 250C
Gambar 3.19 Kurva adsorpsi isotherm Tempkin suhu 25°C untuk adsorben abu dasar dan zeolit. Kondisi proses: massa adsorben 0,5 gr; Co=10-50 mg/L; volume larutan 50 ml, t kontak 12 jam untuk abu dasar dan 4 jam untuk zeolit. b. suhu 350C
Gambar 3.20 Kurva adsorpsi isotherm Tempkin suhu 35°C untuk adsorben abu dasar dan zeolit. Kondisi proses: massa adsorben 0,5 gr; Co=10-50 mg/L; volume larutan 50 ml, t kontak 12 jam untuk abu dasar dan 4 jam untuk zeolit. c. suhu 450C
Gambar 3.21 Kurva adsorpsi isotherm Tempkin suhu 45°C untuk adsorben abu dasar dan zeolit. Kondisi proses: y = 0.894x - 0.623 R² = 0.337 y = 0.543x - 0.038 R² = 0.547 -1,4 -1,2-1 -0,8 -0,6 -0,4 -0,20 0,2 0,4 0,6 0,81 1,2 0 0,5 1 1,5 2 lo g q e log Ce abu dasar zeolit Linear (abu dasar) y = 1.465x - 0.711 R² = 0.590 y = 1.169x + 0.871 R² = 0.683 0 1 2 3 4 5 6 0 2 4 6 q e ( m g/ g) ln Ce abu dasar zeolit y = 6.029x - 9.290 R² = 0.970 y = 3.624x - 2.071 R² = 0.896 0 1 2 3 4 5 0 2 4 q e (m g/ g) ln Ce abu dasar zeolit Linear (abu dasar) y = 7,692x - 6,593 R² = 0,839 y = 5.374x - 4.502 R² = 0.904 0 1 2 3 4 5 6 0 1 2 q e ( m g/ g) ln Ce abu dasar zeolit Linear (abu dasar) y = 6,346x - 5,647 R² = 0,822 y = 4.774x - 3.915 R² = 0.952 0 1 2 3 4 5 0 0,5 1 1,5 2 q e ( m g/ g) ln Ce abu dasar zeolit
massa adsorben 0,5 gr; Co=10-50 mg/L; volume larutan 50 ml, t kontak 12 jam untuk abu dasar dan 4 jam untuk zeolit. Harga entalpi (ΔH°) perhitungan persamaan sumbu x dan ln K pada sumbu y. Hasil dapat dilihat pada Gambar 3.22 untuk adsorben abu dasar dan zeolit.
Gambar 3.22 Kurva konstanta kesetimbangan (KT) sebagai fungsi suhu (C larutan NH4+ = 10-50 mg/L), (a) abu dasar; (b) zeolit
Nilai-nilai hasil perhitungan dari parameter termodinamik dirangkum dalam Tabel 3.4
Tabel 3.4 Nilai Parameter termodinamik untuk suhu 25,35,450C Adsorbent T (K) ΔH (KJ/ mol) ΔS (KJ/ mol) ΔG (KJ/ mol) Abu dasar 298 13884.38 1338.879 -385101.56 308 2124.022 -619074.18 318 2204.543 -643069.43 Zeolit 298 9951.858 1415.684 -411921.97 308 2075.462 -608535.82 318 2034.086 -596205.77 Berdasarkan data tabel diatas, nilai energy bebas Gibbs (ΔG°) negatif yang artinya mengindikasikan bahwa adsorpsi ammonium menggunakan zeolit A berjalan spontan. Pertukaran ammonium memiliki karakteristik fisik saat nilai energi bebas Gibbs berkisar antara 0 dan -20 kJ/mol (Zhuang, 2001).
Kesimpulan
Kesimpulan dari penelitian ini adalah bahwa zeolit A telah berhasil di sintesis dari abu dasar dengan metode peleburan alkali yang diikuti proses reaksi hidrotermal. Zeolit hasil sintesis digunakan sebagai adsorben dalam penghilangan ion ammonium (NH4+) dalam larutan dengan variasi waktu kontak, konsentrasi awal, pH larutan, dan suhu. Abu dasar dan zeolit mampu mengadsorp ion ammonium (NH4+) sekitar 93% pada variasi pH larutan dan 90% pada variasi konsentrasi. Variasi konsentrasi awal ammonium dalam larutan memberikan hasil berbeda
pada kapasitas adsorpsi. Kapasitas adsorpsi ammonium meningkat seiring dengan kenaikan konsentrasi larutan. Kinetika adsorpsi yang pas untuk proses adsorpsi ammonium dengan abu dasar dan zeolit yaitu model orde dua semu. Adsorpsi isothermnya mengindikasikan bahwa model Freundlich lebih baik dan banyak diikuti. Hal ini membuktikan adsorpsi ammonium terjadi pada permukaan zeolit yang heterogen. Untuk parameter termodinamika, harga negative pada nilai energy bebas Gibbs (Go
) menunjukan bahwa proses adsorpsi berjalan spontan. Nilai positif pada entalpi (Go) menunjukkan bahwa proses adsorpsi secara endotermis dan nilai entropi (So
) positif mengindikasikan adanya keacakan antara padatan dan larutan selama proses adsorpsi.
UCAPAN TERIMA KASIH
1. Nurul Widiastuti Ph.D, selaku dosen pembimbing atas segala diskusi, bimbingan, arahan dan semua ilmu yang bermanfaat.
2. Dra. Yulfi Zetra MSi, selaku koordinator Tugas Akhir
3. Lukman Atmaja Ph.D, selaku Ketua Jurusan Kimia FMIPA ITS
4. Teman-teman kelompok Tugas Akhir dan semua mahasiswa kimia yang telah banyak membantu.
Daftar Pustaka
Chang, H.L. dan Shih, W.H., (2000) , “Synthesis of Zeolites A and X from Fly Ashes and Their Ion-Exchange Behavior with Cobalt Ions” Ind. Eng. Chem. Res., 39, 4185-4191 Dursun, G., Cicek, H. & Dursun, A.Y. (2005),
“Adsorption of phenol from aqueous solution by using carbonised beet pulp”, Journal of Hazardous Materials, vol. 125, no. 1-3, pp. 175-182
Englert, A.H. & Rubio, J, (2005), ”Characterization and environmental application of a Chilean natural zeolite”, International Journal of Mineral Processing, vol. 75, no. 1-2, pp. 21-29.
Herlina, (2009), “Sintesis Zeolit dari Bahan Dasar Abu Dasar Batubara dengan Metode Hidrotermal Langsung”, Tesis S2, FMIPA-ITS.
Inada M, Eguchi Y, Enomoto N, Hojo J, (2005), “Synthesis of zeolite from coal fly ashes with different silica-alumina composition”, Fuel, 84(2-3), P. 299–304.
Lei, Lecheng, (2007), “Ammonium Removal from Aqueous Solutions Using Microwave-treated Natural Chinese Zeolite”, Zhejiang University, China.
Mall, I.D., Srivastava, V.C. & Agarwal, N.K. (2006), 'Removal of orange-G and methyl violet dyes by adsorption onto bagasse fly ash-kinetic
y = 1670.x -6.189 R² = 0.833y = 1197.x -4.633 R² = 0.717 -1 -0,8 -0,6 -0,4 -0,2 0 0,00310,00320,00330,0034 ln K 1/T (K) abu dasar zeolit
study and equilibrium isotherm analysis', Dyes and Pigments, vol. 69, pp. 210-223.
Molina, A. dan Poole, C. (2004) “A Comparative Study Using Two Methods To Produce Zeolites from Fly Ash”, Minerals Engineering, 17, p. 167–173
Moreno, N et all, (2002), “Synthesis of Zeolites from Coal Fly ash”, International Journal Of Coal, vol 50, hal.413-423.
Murayama, N. (2002), “Mechanisme of Zeolite Synthesis from Coal Fly ash by Alkali Hydrothermal Reaction”, Int. Journal Miner. Process, vol 64.
Nikmah, Syukuri R.A., (2009), “Sintesis Zeolit A dari abu dasar bebas sisa karbon dari PLTU PT. IPMOMI dengan metode hidrotermal langsung”, Kimia FMIPA ITS, Surabaya. Nguyen, M.L. & Tanner, C.C. (1998), “Ammonium
removal from wastewaters using natural New Zealand zeolites”, New Zealand Journal of Agricultural Research, vol. 41, pp. 427-446.
Panayotova, M.I. (2001),”'Kinetics and thermodynamics of copper ions removal from wastewater by use of zeolite”, Waste Management, vol. 21, pp. 671-676.
Panias, D.IP Giannopoulou and Perraki, (2006), Effect of Synthesis Parameters on mechanical properties of fly ash based geopolymers”, Colloids and surfaces: Physicochem. Eng. Aspects. Accepted Manuscript.
Rayalu, S.S., et al, (1999), “Estimation of Crystasallity in Fly Ash- Based Zeolit-A Using XRD and IR Spectroscopy”, National Env Eng Res Institut, Nagpur, India.
Reynolds, (1982), “ Unit Operation and Process in Enviromental Engineering”, Brooks / Cole Engineering Division, Monterey, California. Rozic, M., Cerjan-Stefanovic, S., Kurajica, S.,
Vancina, V. & Hodzic, E. 2000, 'Ammoniacal Nitrogen Removal from Water by Treatment with Clays and Zeolites', Water Research, vol. 34, no. 14, pp. 3675-3681.
Sawyer, Clair N., McCarty, Perry L. and Parkin, Gene F, (1994). Chemistry for Environmental Engineering. 4th edition. McGraw-Hill Inc : New York.
Tanaka, H. et al., (2002), “Formation of Na-A an –X Zeolites from waste solutions in conversion of coal fly ash to zeolites”, Materials Research Buletin, 37,1873-1884.
Thomas, J.M. & Thomas, W.J. 1997, Principles and Practice of Heterogeneous Catalysis, VCH, Weiheim.
Widiastuti, N. dkk (2009), “Removal of Ammonium from Greywater Using Natural Zeolite”, Centre for Fuels and Energy, Curtin University of Technology, Australia
Yanti, Yuli, (2009), “Sintesis zeolit A dan zeolit A-karbon dari abu dasar PT.IPMOMI PAITON dengan metode fusi”, Kimia FMIPA ITS, Surabaya.
Zeng, L., Li, X. & Liu, J. (2004), “Adsorptive removal of phosphate from aqueous solutions using iron oxide tailings”, Water Research, vol. 38, no. 5, pp. 1318-1326.
RIWAYAT PENULIS
Penulis dilahirkan di Surabaya pada tanggal 26 Desember 1986, sebagai anak pertama dari dua bersaudara.
Penulis telah
menempuh pendidikan formal yaitu di SDN Dr. Soetomo VI (1993-1999), SLTPN 1 Kota Kediri (1999-2002), SMUN 2 Kota Kediri (2002-2005). Penulis diterima di jurusan Kimia-FMIPA ITS melalui jalur PMDK Reguler. Penulis pernah menjadi asisten praktikum Kimia Dasar dan asisten praktikum Kimia Polimer. Penulis sempat aktif dalam organisasi kemahasiswaan Himpunan mahasiswa kimia. Penulis menamatkan studi di Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Teknologi Sepuluh Nopember Surabaya dengan mengambil Tugas Akhir pada bidang Kimia Fisik.