PAPER
LITIUM SEBAGAI OBAT GANGGUAN AFEKTIF
BIPOLAR
Disusun untuk memenuhi salah satu tugas mata kuliah Kimia
Anorganik I
Oleh:
Aini Rizka
3315122110
Program Studi Pendidikan Kimia Reguler
Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Negeri Jakarta
Halaman 2 dari 27 Litium ditemukan pertama kali pada tahun 1817 oleh seorang kimiawan asal “ edia, Joha August Arf edso . Litiu erasal dari ahasa yu a i lithos ya g arti ya atu , kare a litiu dite uka dari i eral atau bijih tidak seperti
natrium dan kalium yang ditemukan di tanaman.
Bijih petalite ditemukan pada tahun 1800 oleh kimiawan Brazil José Bonifácio de Andrada e Silva di dalam tambang di Pulau Utö, Swedia yang lalu pada tahun 1817, litium ditemukan Arfvedson dengan penelitian pada bijih petalite yang mengandung silika, alumina, dan alkali. Logam alkali baru di
petalite memiliki sifat unik. Alkali baru itu berbeda dari kalium karena tidak memberikan endapan dengan asam tartaric.
Arfvedson mencoba untuk menghasilkan sampel murni dari logam baru dengan elektrolisis, tetapi ia tidak berhasil karena baterai yang digunakan tidak cukup kuat. Arfverdson juga menemukan litium pada bijih spodumene dan lepidolite.
Pada tahun 1818, Christian Gmelin merupakan orang pertama yang meneliti warna garam litium apabila dibakar, yaitu warna merah terang. Arfvendson dan Gmelin mencoba untuk memisahkan unsur tersebut dari garamnya namun kedua duanya belum berhasil.
Logam murni berhasil diisolasi pertama kali oleh W.T. Brande dan Sir Humphrey Davy. Tetapi Davy dan Brande memperoleh sejumlah kecil dari logam litium dengan elektrolisis litium dioksida.
Pada tahun 1855, Bunsen Robert dan Augustus Mattiessen memproduksi logam litium dalam jumlah yang banyak dengan elektrolisis menggunakan litium klorida.
Keberadaan dan Kelimpahan Litium
Halaman 3 dari 27 Litium merupakan unsur logam alkali yang sangat reaktif. Akibat sifat reaktifnya, logam litium di alam tidak terdapat secara bebas sehingga logam ini harus dipisahkan terlebih dahulu dari sumber-sumber yang mengandung logam litium (Chen, 1973). Litium dapat diperoleh dari lautan garam, pegmatit, dan batuan sedimen. Lautan garam mempunyai kandungan litium sebesar 66% dari sumber litium di alam, pegmatit mengandung 26%, dan batuan sedimen mengandung 8% (Gruber, Paul dan Medina, Pablo, 2010).
Lautan garam adalah air asin yang mengandung garam di bawah
permukaan tanah akibat pengeboran panas bumi (Alfianto, Ronald, dkk., 2012). Dataran garam Salar de Uyuni di Bolivia, mencakup lebih dari 10000 km2, adalah lautan yang paling luas di dunia dan tercatat sebagai lautan garam yang kaya litium dengan potensi komersial yang besar. Menurut laporan terbaru IS Geological Survey, Salar de Uyuni mengandung 9 juta ton litium.
Salar de Uyuni
(Sumber: http://www.faktailmiah.com/2011/06/26/sumber-lithium-terbesar-di-dunia-salar-de-uyuni.html)
Halaman 4 dari 27 1. Metamorfis: metamorfisme regional menyebabkan batuan menuju fase granitisasi. Magma tidak terbentuk sehingga granite dan pegmatite merupakan produk akhir dari metamorfisme regional ini
2. Aktivitas Igneous: magma terbentuk, sehingga terjadi differensiasi, kandungan volatil tinggi dan terinjeksikan pada batuan sekitar sehingga terbentuk pegmatite.
Material yang diinjeksikan pada sistem tertutup (sistem kimia) sehingga terbentuk simple pegmatite. Simple pegmatite mengandung albite, kuarsa, microcline dan kemungkinan muskovit minor.
Ada interaksi dengan dapur magma sehingga terjadi pergantian membentuk pegmatite kompleks. Pegmatit kompleks membawa mineral-mineral jarang seperti columbite, beryl, zircon, monazite, polycrase dan uraninite.
Beberapa pegmatite yang mengandung unsur litium adalah spodumene, petalite, lepidolite, tourmaline, amblygonite, hectorite, elbaite, eucryptite, jadarite, lithiophilite, pezzottaite, saliotite, sugilite, tourmaline, zabuyelite, dan zinnwaldite. Masih banyak pegmatite yang mengandung unsur litium tetapi masih dalam penelitian.
Dari sekian banyak pegmatite, berikut persentase keberadaan unsur litium pada beberapa pegmatite:
Spodumene: LiAl(SiO3)2 mengandung 8,03% litium
Petalite: LiAlSi4O10 mengandung 4,88% litium
Lepidolite: K(Li,Al)3(Si,Al)4O10(F,OH)2 (komposisi bervariasi) mengandung 3–4%
litium
Amblygonite: LiAlFPO4 mengandung >8% litium
Hectorite: Na0.33(Mg,Li)3Si4O10(F,OH)2 mengandung 0,7%–1,3% litium
Halaman 5 dari 27
Dari kiri ke kanan: spodumene, petalite, lepidolite, amblygonite, hectorite
(Sumber: http://en.wikipedia.org/)
Kelimpahan spodumene terletak di Amerika Utara, Brazil, Spanyol, beberapa bagian di Afrika, Argentina, dan Uni Soviet. Kelimpahan lepidolite berada di kanada dan beberapa bagian di Afrika.Untuk kelimpahan petalite berada di Africa and Sweden. Sedangkan amblygonite dan hectorite memiliki kelimpahan yang tidak terlalu banyak (webelements.com).
Kelimpahan unsur litium juga berada di alam semesta beserta isinya. Berikut penyajian tabel kelimpahan unsur litium di alam semesta:
Location ppb by weight ppb by atoms
Universe 6 1
Sun 0,06 0,01
Meteorite (carbonaceous) 1700 4600
Crustal rocks 17000 50000
Sea water 180 160
Stream 3000 430
Human 30 27
(Sumber: www.webelements.com)
Cara Memperoleh Unsur Litium
Ada banyak cara untuk memperoleh litium. Metode-metode yang dianggap utama, beberapa diantaranya adalah:
Ekstraksi menggunakan pelarut (solvent), Teknik deposisi-elektro,
Metode pertukaran ion,
Halaman 6 dari 27 Lautan garam/brine
Metode ekstraksi litium dari lautan garam dengan menggunakan pelarut merupakan salah satu metode yang efektif dan sederhana, tetapi membutuhkan energi yang besar dalam proses recovery pelarut. Sedangkan untuk teknik deposisi-elektro dan metode pertukaran ion digunakan jika unsur yang akan diambil dalam larutan yang konsentrasinya kecil. Metode presipitasi merupakan metode sederhana dan ekonomis. Kandungan litium pada air garam dapat diendapkan dengan reagen pengendap dan hasilnya berupa padatan litium
aluminat (Shevla, 1961). Namun, kelemahan metode presipitasi ini kurang efisien menghasilkan logam litium mengingat ion magnesium susah dilepaskan dari ion litium (Hamzaoui et al., 2003).
Proses pemisahan litium dari lautan garam tersebut mungkin memerlukan langkah-langkah tambahan tergantung pada magnesium dan kalsium yang terkandung pada air garam tersebut. Proses ini melibatkan penguapan air garam, diikuti dengan penghilangan natrium klorida dan ion seperti kalsium dan magnesium. Kalsium dihilangkan dengan mengendapankannya sebagai sulfat sedangkan magnesium dihilangkan dengan mereaksikan larutan dengan kapur sehingga magnesium hidroksida yang tidak larut akan terpisah. Penambahan natrium karbonat ke dalam filtrat mengendapkan litium karbonat (Patnaik, Pradyot, 2002).
Pegmatite
Halaman 7 dari 27 Tanur dicuci dengan air untuk memisahkan air dari litium sulfat yang terlarut dari beberapa logam yang tidak murni. Larutan yang mengandung asam sulfat berlebih kemudian dinetralisir dengan kalsium karbonat (kapur) berlebih. Larutan kemudian disaring untuk menghilangkan batu kapur yang tidak dapat bereaksi bersama dengan kalsium sulfat dan sulfat dari aluminium dan besi. Larutan yang mengandung kalsium sulfat jenuh dan ion-ion magnesium dari batu kapur ini kemudian diberi perlakuan dengan kalsium hidroksida untuk mengendapkan magnesium hidroksida. Magnesium hidroksida disaring dari
larutan. Penambahan natrium karbonat ke filtrat mengendapkan kalsium karbonat sedangkan litium sulfat tertinggal di dalam larutan. pH larutan ini kemudian disesuaikan menjadi antara 7 dan 8 dengan menambahkan asam sulfat. Larutan kemudian dipekatkan dengan penguapan setelah itu diperlakukan dengan larutan natrium karbonat 28%. Setelah pemanasan pada suhu 90oC sampai 100°C, litium karbonat akan mengendap. Endapan kemudian dipisahkan dengan metode sentrifugasi dan dicuci lalu dikeringkan untuk perlakuan lebih lanjut (Patnaik, Pradyot,2002).
Cara lain untuk mendapatkan litium adalah kapur dapat digunakan sebagai pengganti asam sulfat untuk memisahkankan lithium dari spodumene. Proses pemisahan ini dikenal sebagai metode alkali, yang dilakukan dengan memanaskan bijih dengan campuran kapur tanah dan kalsium sulfat atau klorida untuk membentuk litium sulfat atau litium klorida. Pencucian tanur dengan air menghasilkan larutan sulfat atau litium klorida (Patnaik, Pradyot,2002).
Halaman 8 dari 27 Elektrolisis LiCl
Logam litium diproduksi secara komersil dengan elektrolisis dari suatu campuran eutektik litium klorida-kalium klorida (45% LiCl) pada suhu 400°C sampai 450°C. Campuran eutektik ini meleleh pada suhu 352°C dibandingkan dengan pelelehan LiCl murni pada suhu 606°C. Dan juga, lelehan eutektik merupakan elektrolit yang baik untuk mencairkan LiCl (Landolt, PE and CA Hampel, 1968). Elektrolisis dilakukan dengan menggunakan grafit sebagai anoda dan baja sebagai katoda. Setiap kotoran natrium klorida dalam litium klorida
dapat dihilangkan dengan penguapan natrium di bawah kondisi vakum pada suhu yang tinggi. Semua proses komersial saat ini didasarkan pada pemisahan elektrolitik dari logam. Proses reduksi kimia tidak menghasilkan logam litium dengan kemurnian yang tinggi (Patnaik, Pradyot, 2002).
Sifat Fisik dan Kimia Litium
Halaman 9 dari 27 (http://www.americanelements.com/li.html)
Konfigurasi elektron atom litium
(sumber:
www.chemwiki.ucdavis.edu/Inorganic_Chemistry/Descriptive_Chemistry/Main_G roup_Elements/Group__1:_The_Alkali_Metals/Chemistry_of_Lithium)
Halaman 10 dari 27 Litium memiliki densitas setengah dari densitas air sehingga litium merupakan unsur yang paling kecil rapatan massanya daripada semua unsur padatan pada temperatur dan tekanan kamar. Biasanya litium dan semua logam alkali disimpan dalam minyak sebab jika terjadi kontak dengan udara akan terjadi sangat cepat produk oksida yang tebal melapisi permukaan yang mengkilat dari litium (Sugiyarto, Kristian H, 2003). Bila terkena udara lembab, litium segera tertutup oleh lapisan tebal hitam sebagai akibat reaksinya dengan oksigen yang diikuti reaksi lanjut dengan gas karbon dioksida membentuk litium karbonat,
maka dari itu litium tidak pernah ditemukan dalam keadaan bebas atau murni di alam karena litium bereaksi dengan cepat dengan udara dan air. Ketika dimurnikan, litium memiliki warna putih-perak yang indah.
Dalam kondisi normal, semua unsur golongan 1 (logam alkali) didasarkan pada struktur bcc. Jarak antara Li-Li yang terdekat adalah 304pm menyiratkan radius logam litium sebesar 152pm. Ini berarti bahwa litium lebih kecil dari kalium. Dalam kisi bcc, setiap atom litium dikelilingi oleh delapan atom tetangga terdekatnya lithium diatur dalam array kubik.
(sumber: www.webelements.com/lithium/crystal_structure.html)
Isotop-isotop Litium
Litium-4
Halaman 11 dari 27 emisi proton menjadi helium-3 dengan waktu paruh sekitar 9.1×10− detik. Litium-4 dapat dibentuk sebagai perantara dalam beberapa reaksi fusi nuklir.
Litium-6
Litium-6 adalah sumber material yang berharga untuk menghasilkan tritium (hidrogen-3) dan sebagai penyerap neutron dalam reaksi fusi nuklir. Litium alami mengandung 7,5% litium-6 dan sisanya litium-7. Sejumlah besar litium-6 telah dipisahkan keluar untuk ditempatkan ke dalam bom hidrogen.
Pemisahan lithium-6 sekarang telah diberhentikan sebagai termonuklir di negara maju, namun stok itu masih tetap ada di beberapa negara. Lithium-6 bertindak sebagai fermion dalam interaksi dengan partikel lain karena memiliki tiga proton, tiga neutron, dan tiga elektron, dan ini memberikan atom suatu atom total "spin" plus atau minus 1/2 dan bukan spin integral boson a
Litium-7
Litium-7 adalah isotop paling stabil dari litium. Litium alami mengandung sekitar 92,5% litium-7. Setiap atom litium-7 berisi tiga proton, empat neutron, dan tiga elektron, dan itu adalah boson a, yang berarti bahwa spin total atom integral biasanya nol. Di alam semesta, karena sifat intinya, litium-7 kurang terkenal daripada helium, berilium, karbon, nitrogen, atau oksigen, meskipun helium, berilium, karbon, nitrogen, atau oksigen memiliki inti yang lebih berat daripada litium.
Litium-7 adalah isotop yang telah dijual secara komersial. Karena itulah litium-7 tersebar luas di lingkungan. Kelimpahan relatif litium-7 setinggi 35% lebih besar dari nilai alami telah diukur dalam air tanah dalam akuifer karbonat bawah West Valley Creek di Pennsylvania, yang merupakan hilir dari sebuah pabrik pengolahan litium.
Halaman 12 dari 27 dengan luas penampang melintang penyerapan neutron pada litium-7 sekitar 45millibarns membuat litium-7 sangat efektif untuk penggunaan dalam reaktor lithium-fluoride.
Litium-7 hidroksida digunakan untuk alkalizing dari pendingin di reaktor air bertekanan. Beberapa lithium-7 telah diproduksi, selama beberapa picosekon, yang berisi partikel lambda pada intinya, sedangkan inti atom umumnya dianggap hanya berisi neutron, proton, dan pion (Emsley, John. 2001).
Peran Litium
Sumber daya litium merupakan salah satu elemen yang sangat penting peranannya terutama dalam bidang energi, industri, farmasi, manufaktur, dan sektor ekonomi (Hamzaoui et al., 2003). Litium juga digunakan dalam berbagai aplikasi teknologi seperti pada baterai untuk kendaraan dan berbagai anoda pada baterai ion litium isi ulang (Bardi, 2010).
Dalam tahun-tahun terakhir abad ke-20 lithium menjadi penting sebagai bahan anoda. Digunakan dalam baterai litium-ion karena potensi tinggi elektrokimia, sebuah sel yang khas dapat menghasilkan sekitar 3volt, dibandingkan dengan 2,1volt untuk volt timbal / asam atau 1,5 untuk seng-karbon sel. Karena massa yang rendah atom, ia juga memiliki muatan-dan tinggi power-to-weight ratio. Baterai litium baterai sekali pakai (primer) dengan lithium atau senyawa sebagai anoda. Baterai Lithium tidak menjadi bingung dengan baterai lithium ion, yang tinggi energi kepadatan baterai isi ulang. Baterai isi ulang lainnya termasuk lithium-ion polimer baterai, baterai litium besi fosfat, dan baterai nanowire.
Selain itu, manfaat litium telah semakin luas pada berbagai macam aplikasi industri seperti:
Halaman 13 dari 27 Lithium-6 merupakan sumber bahan untuk produksi tritium dan sebagai penyerap neutron dalam fusi nuklir. Litium alami mengandung sekitar 7,5% litium-6 yang mana sejumlah besar litium-6 yang telah diproduksi oleh pemisahan isotop untuk digunakan dalam senjata nuklir. Berikut persamaan reaksinya:
2. Pelindung materi dalam reaktor fusi (Hawash et al., 2010).
3. Sebagai bahan baku utama produksi senyawa organolitium terutama butillitium dan hidrida litium (Wietelmann, 2005).
Senyawa organolitium banyak digunakan dalam produksi polimer kimia. Untuk produksi bahan kimia, senyawa organolitium berfungsi sebagai basa kuat dan sebagai reagen untuk pembentukan ikatan karbon-karbon. Organolitium senyawa yang dibuat dari logam lithium dan alkil halida. Banyak senyawa lithium lain digunakan sebagai pereaksi untuk mempersiapkan senyawa organik. Beberapa senyawa populer termasuk lithium hidrida aluminium (LiAlH4), triethylborohydride lithium (LiBH(C2H5)3).
4. Dalam aplikasi perpindahan panas digunakan sebagai media pendingin pada alat penukar panas karena panas spesifiknya yang terbesar dari padatan yang ada (Hawash et al., 2010).
5. Sebagai reduktor pada aplikasi kimia organik, yaitu sebagai larutan dalam amonia cair untuk reduksi Birch dan dalam sintesis vitamin (Hawash et al., 2010).
6. Sebagai deoxidizing dan desulfuring agent terutama untuk tembaga, nikel, dan paduan baja (Wietelmann, 2005).
LiCl digunakan sebagai fluks untuk las atau solder, logam lithium mempromosikan fusing logam selama proses dan menghilangkan
Halaman 14 dari 27 digunakan untuk membuat bagian-bagian pesawat kinerja tinggi. Senyawa litium juga digunakan sebagai pewarna piroteknik dan oksidasi dalam kembang api merah dan flare.
7. Pemurnian alumunium (Yoshinaga et al., 1985)
8. Dalam bidang medis dan geologi (Yoshinaga et al.,2003)
9. Manufaktur kaca dan keramik jenis-jenis tertentu (Joyce, 2006)
LiF adalah fluks yang paling banyak digunakan untuk pengolahan silika, mengurangi titik leleh dan viskositas material dan menyebabkan glasir,
memperbaiki sifat fisik termasuk koefisien rendah untuk ekspansi termal.
Berikut ini tabel persentase kegunaan litium:
(Sumber: http://minerals.usgs.gov/minerals/pubs/commodity/lithium/)
Peran Litium dalam Bidang Medis
Mania merupakan gangguan mood atau perasaan ditandai dengan aktivitas fisik yang berlebihan dan perasaan gembira yang luar biasa yang secara keseluruhan tidak sebanding dengan peristiwa positif yang terjadi. Hal ini terjadi dalam jangka waktu paling sedikit satu minggu hampir setiap hari terdapat keadaan afek (mood, suasana perasaan) yang meningkat ekspresif atau iritabel (Support Hope Inc.,2009).
Halaman 15 dari 27 Bentuk mania yang lebih ringan adalah hipomania. Mania seringkali merupakan bagian dari kelainan bipolar (penyakit manik-depresif). Beberapa orang yang tampaknya hanya menderita mania, mungkin sesungguhnya mengalami episode depresi yang ringan atau singkat. Baik mania maupun hipomania lebih jarang terjadi dibandingkan dengan depresi. Mania dan hipomania agak sulit dikenali, kesedihan yang berat dan berkelanjutan akan mendorong seseorang untuk berobat ke dokter, sedangkan kegembiraan jarang mendorong seseorang untuk berobat ke dokter karena penderita mania tidak
menyadari adanya sesuatu yang salah dalam keadaan maupun perilaku mentalnya (Support Hope Inc., 2009).
Penggunaan litium dalam pengobatan gangguan afektif bipolar diperkenalkan oleh John Cade (1949), yang kemudian menjadi dasar pengobatan litium selanjutnya. John Cade dalam penelitiannya menggunakan marmut sebagai kelinci percobaan yang disuntikkan dengan berbagai zat kimia, diantara zat kimia tersebut adalah litium. Pada penyuntikkan dengan litium dia mendapatkan pengaruh litium pada marmut tersebut berupa keadaan yang menjadi tenang dan kehilangan respon terhadap rangsang, tapi tidak menjadi tidur (Cade, John, 1949).
Litium Karbonat
Dengan formula Li2CO3 dengan nama dagang Frimania (Mersifarma)
memiliki massa molekul sebesar 73.89 gram/mol, senyawa ini digunakan dalam pengobatan sebagai antidepresan. Komposisi unsurnya: Li 18,78%, C 16,25%, 64,96% O.
Halaman 16 dari 27 harus dilakukan tes darah secara teratur untuk menentukan kadar lithium mengingat dosis terapeutik lithium berdekatan dengan dosis toksik. Bagaimana kerja litium sebenarnya dalam mengatasi mania belum diketahui secara pasti, diduga ion litium menimbulkan efek menstabilkan mood dengan menghambat inositol monophosphatase (IMPase) dengan subsitusi satu dari dua ion magnesium pada sisi aktif IMPase. IMPase merupakan enzim yang diyakini sebagai penyebab beberapa gangguan bipolar (Santoso SO, Wiria MSS., 2001).
Pendapat lain mengatakan bahwa efek antimania lithium disebabkan oleh
kemampuannya mengurangi dopamine receptor supersensitivity dengan meningkatkan cholinergic-muscarinic activity dan menghambat Cyclic AMP (Support Hope Inc.,2009).
Sifat Fisik:
Kristal monoklinik putih, indeks bias 1,428, densitas 2,11 g/cm3, meleleh pada 723°C, terurai pada 1.310°C, kelarutan yang rendah dalam air (1,54 g/100g) pada 0°C, 1,32g/100g pada 20°C), kelarutan penurunan dengan suhu (0.72g/100g pada 100°C), larut dalam aseton dan etanol.
Pembuatan:
Litium karbonat diperoleh sebagai produk antara dalam pemulihan logam lithium dari bijih, spodumene. Hal ini dibuat dengan mencampurkan larutan natrium karbonat dalam keadaan panas dan pekat dengan lithium klorida atau larutan sulfat.
Indikasi:
Halaman 17 dari 27 (Sumber: Santoso SO, Wiria MSS., 2001).
Dosis:
Dosis lithium tergantung pada kebutuhan medis pasien, umur, berat badan dan fungsi ginjal. Dosis dari lithium berkisar antara 600mg-2400mg per hari, meskipun sebagian besar pasien akan stabil pada 600mg-1200mg per hari. Untuk tablet atau kapsul immediate release biasa diberikan 3 dan 4 kali sehari. Sedangkan tablet controlled release diberikan dua kali sehari, interval 12 jam. Pemberian dosis litium harus dilakukan hati-hati dan individual, yakni berdasarkan kadar dalam serum dan respon klinis.
Pada mania akut, pasien biasanya memberikan respon optimal terhadap lithium karbonat jika diberikan dosis 1800 mg per hari, dengan dosis terbagi. Dosis ini secara normal akan menghasilkan kadar lithium serum yang diinginkan berkisar antara 1 dan 1,5 mEq/l. Kontrol jangka panjang, kadar serum litium yang diinginkan adalah 0,6 -1,2 mEq/l. Dosis bervariasi per individu, tapi biasanya berkisar 900 - 1200 mg per hari dalam dosis terbagi. Monitor serum dilakukan setiap dua bulan. Pada pasien yang sangat sensitif biasanya memperlihatkan tanda toksik pada kadar litium serum dibawah 1,0 mEq/l
Efek Samping:
Halaman 18 dari 27 mengkonsumsi dua pil perhari sementara pada pasien lainnya perlu dua belas pil per hari. Jika kita dapat mengukur kadar obat dalam darah pada semua jenis obat serupa, kemungkinan kita dapat menemukan perbedaan individual.
Gejala intoksikasi (kadar serum lithium > 1,5 mEq/L) dapat berupa:
Gejala dini : muntah, diare, tremor kasar, mengantuk, konsentrasi pikiran menurun, bicara sulit, pengucapan kata tidak jelas, dan gaya berjalan tidak stabil.
Dengan semakin beratnya intoksikasi terdapat gejala : kesadaran menurun dapat sampai koma dengan hipertoni otot dan kedutan, oliguria, dan kejangkejang.
Interaksi Obat:
Penggunaan diuretik bersama litium harus dilakukan hati-hati. Hal ini dikarenakan diuretik yang menginduksi pengeluaran natrium, bisa mengurangi klirens renal litium yang akan menyebabkan kadar litium serum meningkat dan risiko toksisitas juga meningkat. Begitu juga pada pemberian bersamaan dengan beberapa obat lain seperti NSAID dan ACE inhibitor (Arnita, 2009).
Halaman 19 dari 27
Penelitian Risa Devina Manao, Ronald Alfianto, Sumarno: Recovery Garam
Lithium Pada Air Tua (Bittern) dengan Metode Presipitasi
Litium merupakan salah satu logam yang memiliki nilai jual yang tinggi dan banyak digunakan dalam berbagai aplikasi industri, seperti sebagai anoda pada baterai ion Litium isi ulang. Kandungan Litium yang terdapat dalam air tua berpotensi untuk direcovery dalam bentuk LiH(AlO2)2.5H2O dengan metode
presipitasi. Tujuan dari penelitian ini adalah untuk merecovery Litium dari air tua (bittern) dengan metode presipitasi, serta mengetahui pengaruh konsentrasi reagen pengendap, pH, dan waktu reaksi terhadap persentase kadar Litium yang dihasilkan. Penelitian dilakukan dengan variasi konsentrasi larutan pengendap NaAlO2 250, 500, 750, mg/L Al3+, pH pencampuran 11, 12, 13, dan waktu reaksi 1,
2, 3 jam. Respon pada penelitian ini adalah persen recovery Litium pada air tua. Penelitian ini dilakukan dengan mencampur 250 mL air tua dan reagen pengendap NaAlO2 dengan konsentrasi sesuai variabel dalam reaktor
berpengaduk. pH larutan disesuaikan dengan penambahan NaOH dan larutan diaduk selama waktu yang telah ditentukan. Endapan yang terbentuk disaring, dicuci dengan air suling dan dilarutkan dengan HF 0,25N. Larutan ditentukan kadar Litiumnya dengan metode gravimetri. Hasil penelitian menunjukkan bahwa variabel konsentrasi larutan pengendap NaAlO2, pH, dan waktu reaksi
berpengaruh secara signifikan terhadap % recovery Litium dalam air tua. Kondisi optimum diperoleh pada konsentrasi pengendap NaAlO2 500 mg/L Al3+, pH 13,
dan waktu reaksi 3 jam, dimana berat Litium yang dihasilkan 0,11 gr ion Li+ dan % recovery litium sebesar 96,875%.
Bahan dan Metode Penelitian Material:
Bahan yang digunakan adalah bittern, KAl(SO4)2·12(H2O) (potash alum/
tawas), NaOH 1M, HF 0,25N, dan aquadest. Alat yang digunakan adalah reaktor berpengaduk dan filter sintered glass.
Halaman 20 dari 27 Pada penelitian ini digunakan variabel kendali, yaitu suhu pada suhu kamar, tekanan atmosfer, dan sumber litium berasal dari air tua (bittern) yang berasal dari air laut yang diuapkan sampai (30-33)⁰B. Sedangkan variabel bebas yang digunakan adalah konsentrasi pengendap NaAlO2 250, 500, 750 mg/L Al3+ ;
pH 11, 12, 13 ; dan waktu reaksi 1, 2, 3 jam.
Analisis Bahan Baku.
Analisis bahan baku meliputi a alisis pH, de sitas, ⁰Bau e, TD“, dan kadar litium menggunakan metode gravimetri. Analisa pendahuluan ini dilakukan untuk
mengetahui kadar litium awal di dalam sampel sehingga dapat diketahui berapa litium yang berhasil direcovery pada akhirnya.
Presipitasi Litium.
Proses presipitasi litium dilakukan dengan tahapan sebagai berikut, pertama-tama bittern dengan masing-masing volume 250 ml ditambahkan reagen pengendap natrium aluminat sebanyak 100 ml dan pH campuran disesuaikan dengan masing-masing variabel dengan penambahan NaOH 1M. Larutan tersebut kemudian diaduk pada reaktor berpengaduk sesuai dengan waktu yang telah ditentukan. Kemudian, endapan yang terbentuk oleh proses presipitasi disaring dengan kertas saring Whatman dan filter sintered glass. Endapan yang diperoleh kemudian dilarutkan dengan HF 0,25N hingga volume 100ml dan endapan larut. Berat Li+ yang diperoleh kemudian ditentukan dengan metode gravimetri.
Halaman 21 dari 27 Hasil dan Pembahasan
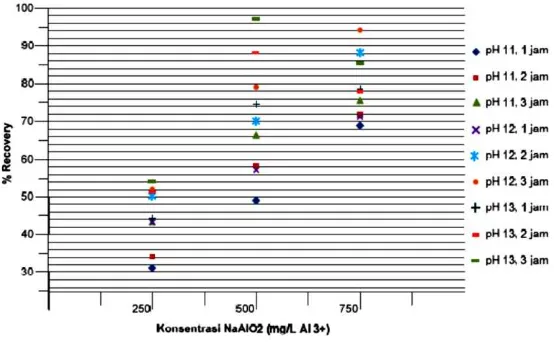
Pengaruh Konsentrasi NaAlO2 Terhadap % Recovery:
Besarnya konsentrasi pengendap dalam reaksi presipitasi litium sangat berpengaruh terhadap litium yang mampu terendapkan. Dalam hal ini reagen pengendap yang digunakan adalah natrium aluminat (NaAlO2). Dari ketiga
variabel yang digunakan (konsentrasi NaAlO2, pH, dan waktu pengadukan),
variabel konsentrasi NaAlO2 merupakan variabel yang paling berpengaruh
terhadap besarnya litium yang dapat diperoleh. Pada konsentrasi NaAlO2 yang
tepat, maka reaksi pengendapan dapat berjalan dengan baik dan litium yang diperoleh juga optimum.
Grafik di atas menunjukkan pengaruh konsentrasi NaAlO2 terhadap %
recovery pada berbagai variasi pH dan waktu. Dari grafik tersebut terlihat kecenderungan bahwa semakin besar konsentrasi NaAlO2 maka persen recovery
litium juga semakin meningkat. Hasil recovery litium maksimum diperoleh pada konsentrasi pengendap NaAlO2 500 mg/L Al3+, pH 13, dan waktu reaksi 3 jam,
dimana berat litium aluminat yang dihasilkan adalah 2,17 gr (0,11 gr ion Li+ dan 96,875% recovery). Pada kondisi ini litium yang terendapkan mencapai kadar yang paling optimum. Sedangkan peningkatan konsentrasi pengendap pada NaAlO2 750 mg/L Al3+, pH 13, dan waktu reaksi 3 jam menunjukkan bahwa hasil
Halaman 22 dari 27 Hal ini dikarenakan pada konsentrasi pengendap NaAlO2 tersebut telah excess
dan reaksi dianggap telah berjalan sempurna sehingga ion-ion litium yang terendapkan dapat dikatakan telah mencapai maksimal sehingga penambahan konsentrasi reagen pengendap sudah tidak akan meningkatkan produk.
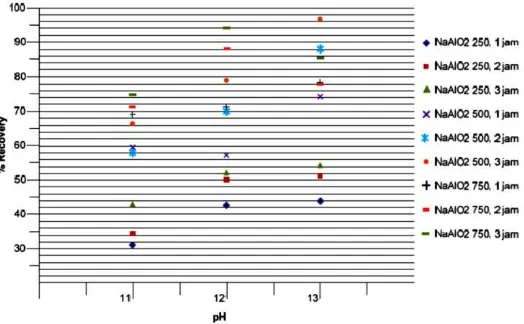
Pengaruh pH terhadap % Recovery:
Tingkat keasaman (pH) sangat mempengaruhi reaksi presipitasi karena proses presipitasi sangat bergantung pada pH reaksi. pH yang optimum dalam suatu reaksi akan memberi hasil yang optimum pula karena reaksi akan dapat
berjalan secara sempurna. Pada reaksi presipitasi litium oleh pengendap natrium aluminat, pH optimum berkisar antara 12 sampai 13,5. Namun, variabel pH juga berhubungan erat dengan konsentrasi reagen pengendap dan waktu pengadukan, sehingga recovery litium yang diperoleh memberikan berbagai variasi bergantung hubungannya dengan variabel yang lain.
Grafik diatas menunjukkan pengaruh pH terhadap % recovery pada berbagai variasi konsentrasi NaAlO2 dan waktu. Dari grafik tersebut terlihat
kecenderungan bahwa semakin besar pH maka persen recovery litium juga semakin meningkat. Namun, pada beberapa variabel menunjukkan turunnya hasil recovery setelah pH dinaikkan menjadi 13. Hal ini terjadi karena pada pH yang terlalu basa, endapan Li+ dapat melarut kembali dalam NaAlO2 dan H2O
sebagai LiOH sesuai reaksi sebagai berikut:
Halaman 23 dari 27 Hasil recovery litium maksimum diperoleh pada pH 13, konsentrasi pengendap NaAlO2 500 mg/L Al3+ dan waktu reaksi 3 jam, dimana berat litium
aluminat yang dihasilkan adalah 2,17 gr (0,11 gr ion Li+ dan 96,875 % recovery). Hal ini berarti bahwa pH optimum pada reaksi presipitasi litium ini berlangsung pada pH 13.
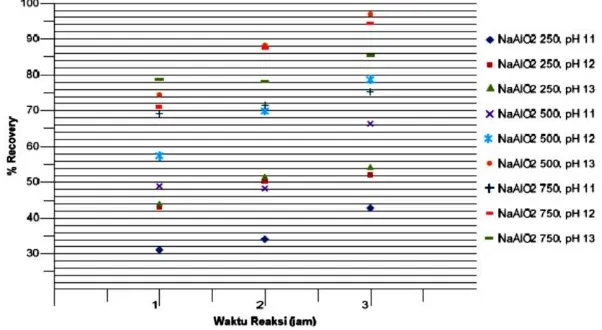
Pengaruh Waktu Reaksi terhadap % Recovery:
Pada proses presipitasi litium dibutuhkan waktu untuk mengendapkan ion-ion litium. Semakin lama waktu reaksi, maka litium yang terendapkan akan
semakin banyak. Namun saat reaksi telah berjalan dengan sempurna, tidak akan ada penambahan ion litium yang mengendap dan litium yang diperoleh telah optimum, sehingga memperpanjang waktu reaksi sudah tidak akan menambah hasil litium yang diperoleh.
Grafik di atas menunjukkan pengaruh waktu reaksi terhadap % recovery pada berbagai variasi konsentrasi NaAlO2 dan pH. Dari grafik tersebut terlihat
kecenderungan bahwa semakin lama waktu reaksi maka persen recovery litium juga semakin meningkat. Hal ini berarti pada saat waktu reaksi hanya satu jam, reaksi belum berjalan sempurna dan ion-ion litium belum terendapkan sepenuhnya sehingga memperpanjang waktu reaksi masih dapat menambah jumlah persen recovery. Hasil recovery litium maksimum diperoleh pada waktu reaksi 3 jam, konsentrasi pengendap NaAlO2 500 mg/L Al3+ dan pH 13, dimana
Halaman 24 dari 27 recovery). Hasil ini sesuai dengan teori pada penelitian yang telah dilakukan sebelumnya, bahwa ion litium dapat teradsorbsi maksimum setelah mencapai waktu pengadukan selama tiga jam.
Kesimpulan
Dari hasil penelitian ini diperoleh kesimpulan bahwa recovery litium pada bittern menggunakan metode presipitasi dapat menghasilkan % recovery sebesar 96,875% dan ketiga variabel (konsentrasi NaAlO2, pH, dan waktu reaksi)
berpengaruh terhadap recovery litium. Kondisi optimum diperoleh pada
Halaman 25 dari 27
Referensi
Alfianto, Ronald, dkk. 2012. Recovery Garam Lithium pada Air Tua (Bittern) dengan Metode Presipitasi. Jurnal Teknologi Kimia dan Industri Vol. 1 , No. 1 , Tahun 2012, Halaman 292-297. Dari http://ejournal-s1.undip.ac.id/index.php/jtki, diakses tanggal 30 Maret 2014 pukul 14.00WIB
Anonim. Dari http://en.wikipedia.org/, diakses pada tanggal 10 April 2014 pukul 18.42WIB
Anonim. Dari http://webelements.com/, diakses pada 8 April 2014 pukul 19.19WIB
Anonim. Dari http://www.americanelements.com/li.html, diakses pada 8 April 2014 pukul 19.30WIB
Arnita. 2009. Antidepresan untuk Gangguan Bipolar. Dari http://www.majalah-faramacia.com., diakses pada tanggal 10 April 2014 pukul 20.30WIB
Bardi, Ugo. 2010. Extracting Minerals from Seawater: An Energy Analysis. Sustainability Article. Italy. ISSN 2071-1050
Cade, John. 1949. Lithium Salts in the Treatment of Psychotic Excitement. The Medical Journal of Australia Vol.II , No.10 , Tahun 1949, Halaman 349
Chen, David T. Y.. 1973. Solubility Products of Aluminium Hidroxide in Various Ionic Solutions. Can. J . Chem. Vol 51; pp. 3528-3533
Cotton dan Wilkinson. 1989. Kimia Anorganik Dasar. Jakarta: UI Press
Emsley, John. 2001. Nature's Building Blocks: An A-Z Guide to the Elements. United Kingdom: Oxford University Press
http://www.faktailmiah.com/2011/06/26/sumber-lithium-terbesar-di-Halaman 26 dari 27 dunia-salar-de-uyuni.html, diakses pada tanggal 10 April 2014 pukul 19.00WIB
Fan, Kevin dan Szelong, Katherine (UCD). Dari http://chemwiki.ucdavis.edu/, diakses pada tanggal 8 April 2014 pukul 06.19WIB
Gruber, Paul dan Medina, Pablo. 2010. Global Lithium Availability: A Constraint For Electric Vehicles?. USA: University of Michigan
Ha zaoui, A.H., A. M’ if, H. Ha i, da R. Rok a i. 00 . Contribution to the Lithum Recovery from Brine. Tunisia. Desalination 158. pp. 221-224. Dari http://sciencedirect.com/, diakses pada tanggal 30 Maret 2014 pukul 14.45WIB
Hawash, S., E. Abd El Kader, dan G. El Diwani. 2010. Methodology for Selective Adsorption of Lithium Ions onto Polymeric Aluminium (III) Hydroxide. Egypt. Journal of American Science. Vol. 6(11). pp. 301-309. Dari http://www.jofamericanscience.org/, diakses pada tanggal 30 Maret 2014 pukul 14.42WIB
Jaskula, Brian W. Dari
http://minerals.usgs.gov/minerals/pubs/commodity/lithium/, diakses pada tanggal 10 April pukul 21.30WIB
Joyce A. Ober. 2006. U.S. Geological Survey, Mineral Commodity Summaries. United States
Landolt, PE and CA Hampel. 1968. Lithium: In Encyclopedia of Chemical Elements. New York: C. A. Hampel, Ed. Reinhold Book Corp
Maslim R. 2007. Panduan Praktis : Penggunaan Obat Psikotropik (Psychotropic Medication). Jakarta : Bagian Ilmu Kedokteran Jiwa FK-Unika Ama Jaya
Halaman 27 dari 27 Santoso SO, Wiria MSS. 2001. Psikotropik. Dalam : Farmakologi dan Terapi, Edisi keempat. Jakarta: Bagian Farmakologi Fakultas Kedokteran Universitas Indonesia
Shevla G. 1961. Textbook of Macro and Semimicro Qualitative Inorganic Analysis, atau Buku Teks Analisis Anorganik Kualitatif Makro dan Semimikro, Terj. Pudjaatmaka, Handyana dkk. Jakarta: PT Kalman Media Pustaka
Sugiyarto, Kristian H. 2003. Common Textbook (edisi revisi) Kimia Anorganik II. Yogyakarta: FMIPA UNY
Support Hope Inc. 2009. Antipsychotic : Haloperidol, Haldol. Dari http://www.supporthope.com/medication/anti_anxiety/index.html., diakses pada tanggal 10 April 2014 pukul 20.00WIB
Wietelmann, Ulrich. 2005. Encyclopedia of Industrial Chemistry. Wiley-VCH VerlagGmbH & Co. KgaA