FERMENTABILITAS DAN KECERNAAN in vitro
PAKAN SUMBER SERAT OLEH ISOLAT
BAKTERI RAYAP
SKRIPSI
RAHAJENG NURWIDYASTUTI
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR 2009
RINGKASAN
RAHAJENG NURWIDYASTUTI. D24051670. 2009. Fermentabilitas dan Kecernaan in vitro Pakan Sumber Serat oleh Isolat Bakteri Rayap. Skripsi. Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Ir. Anita S. Tjakradidjaja, MRur.Sc. Pembimbing Anggota : Prof. Dr. Ir. Komang G. Wiryawan
Pakan merupakan faktor yang dapat menjamin keberhasilan pemeliharaan ternak. Permasalahan yang umum terjadi adalah ketersediaan pakan yang tidak kontinyu, terutama pada musim kemarau. Salah satu upaya untuk mengatasi masalah tersebut adalah dengan memanfaatkan limbah pertanian dan perkebunan sebagai alternatif pakan sumber serat. Pemanfaatan limbah pertanian dan perkebunan ini sebagai pakan ternak masih terbatas, karena kandungan serat kasar yang tinggi. Oleh karena itu, perlu dilakukan suatu cara untuk meningkatkan kecernaan kedua bahan pakan tersebut, salah satunya adalah dengan cara biologis. Rayap merupakan serangga yang makanan utamanya adalah kayu, karena dalam saluran pencernaannya terdapat mikroorganisme pendegradasi serat kasar. Penelitian ini bertujuan untuk mendapatkan taraf inokulum isolat bakteri rayap terbaik (A (SB 53 5(3) 1) dan D (SC 51 5 (2)) berdasarkan fermentabilitas dan kecernaan in vitro pakan sumber serat.
Penelitian ini menggunakan Rancangan Acak Kelompok (RAK) dengan pola faktorial 2×3×3 dengan 3 periode pengambilan cairan rumen sebagai kelompok. Faktor A adalah isolat bakteri rayap, yaitu A1= isolat bakteri rayap Coptotermes
curvignathus Holmgren (isolat A (SB 53 5(3)1)) dan A2= isolat bakteri rayap Microtermes inspiratus Kemner (isolat D (SC 51 5 (2)). Faktor B adalah taraf
inokulum isolat bakteri, yaitu B1= 106 CFU/ml, B2= 108 CFU/ml, B3= 1010CFU/ml. Faktor C adalah jenis pakan sumber serat, yaitu C1= rumput gajah, C2= jerami padi dan C3= serat sawit. Peubah yang diamati adalah produksi VFA total dan konsentrasi NH3, Koefisien Cerna Bahan Kering (KCBK) dan Bahan Organik (KCBO), serta
populasi bakteri rayap total. Sidik ragam (ANOVA) digunakan untuk membandingkan rataan peubah yang diamati dan perbedaan diantara perlakuan diuji dengan ortogonal kontras dan polinomial. Perhitungan populasi bakteri rayap total dianalisis secara deskriptif.
Hasil penelitian menunjukkan bahwa kedua isolat bakteri rayap dapat tumbuh dalam kondisi rumen dengan baik. Jenis pakan sumber serat mempengaruhi konsentrasi NH3, KCBK dan KCBO (P<0,01), tetapi tidak nyata berpengaruh
terhadap konsentrasi VFA. Rumput gajah menghasilkan konsentrasi NH3, KCBK dan
KCBO tertinggi (P<0,01) dibandingkan dengan jerami padi dan serat sawit. Interaksi antara faktor taraf inokulum dengan jenis pakan mempengaruhi nilai KCBO (P<0,05). Interaksi ketiga faktor (isolat bakteri rayap, taraf inokulum bakteri dan jenis pakan) nyata mempengaruhi nilai KCBK (P<0,05). Hasil perhitungan populasi bakteri rayap total menunjukkan bahwa isolat bakteri rayap dapat bertahan dalam kondisi rumen. Populasi isolat bakteri rayap D (SC 51 5 (2)) lebih tinggi dibandingkan dengan isolat bakteri rayap A (SB 53 5(3)1). Hal ini menunjukkan bahwa kemampuan adaptasi isolat bakteri rayap D (SC 51 5 (2)) dalam kondisi
isolat bakteri rayap A (SB 53 5(3)1) yang terbaik untuk mencerna jerami padi adalah sebesar 106 CFU/ml, sedangkan untuk mencerna rumput gajah dan serat sawit sebesar 1010 CFU/ml. Taraf inokulum yang dibutuhkan isolat bakteri rayap D (SC 51 5 (2)) untuk mencerna jerami padi dan serat sawit adalah sebesar 108 CFU/ml, sedangkan untuk mencerna rumput gajah dibutuhkan taraf inokulum yang lebih rendah, yaitu sebesar 106 CFU/ml.
ABSTRACT
In vitro Fermentability and Digestibility of Fibrous Feedstuff by Termite
Bacterial Isolates
R. Nurwidyastuti, A. S. Tjakradidjaja and K. G. Wiryawan
The objective of this experiment was to evaluate inoculum level of termite bacteria upon the in vitro fermentability and digestibility of fibrous feedstuff. The experimental design was Factorial Randomized Block Design 2×3×3 with 3 replications. The first factor was the species of termite bacteria from Coptotermes
curvignathus Holmgren (A (SB 53 5(3)1)) and Microtermes inspiratus Kemner (D
(SC 51 5 (2)). The second factor was the inoculum level of termite bacteria (106 CFU/ml, 108 CFU/ml and1010 CFU/ml). The third factor was the fibrous feedstuff (napier grass, rice straw and palm press fibre). The rumen liquid was used as replications. Data were analyzed by using analysis of variance (ANOVA) and the difference between treatments were determined by contrast and polinomial orthogonals. The results showed that the fibrous feedstuff affected significantly (P<0.01) ammonia concentration, digestibilities of dry matter (DM) and organic matter (OM), but did not affect VFA concentrations. Napier grass had higher (P<0.01) ammonia concentration and digestibilities of DM and OM than rice straw and palm press fibre. The interaction between inoculum level and fibrous feedstuff affected significantly (P<0.05) digestibility of OM. The interaction of three factors (the species of termite-inoculum level-fibrous feedstuff) produced significant (P<0.05) effect on digestibility of DM. The result of total bacterial populations showed that termite bacterial isolate D (SC 51 5 (2)) had higher population than the isolate A (SB 53 5(3)1). It can be concluded that termite bacterial isolate D (SC 51 5 (2)) has a better capability of surviving in rumen condition than the isolate A (SB 53 5(3)1). The optimum inoculum level of termite bacterial isolate A (SB 53 5(3)1) to degrade rice straw is 106 CFU/ml, and to degrade napier grass and palm press fibre is 1010 CFU/ml. Termite bacterial isolate D (SC 51 5 (2)) needs inoculum level 108 CFU/ml to degrade rice straw and palm press fibre, and 106 CFU/ml to degrade napier grass.
FERMENTABILITAS DAN KECERNAAN in vitro PAKAN
SUMBER SERAT OLEH ISOLAT BAKTERI RAYAP
RAHAJENG NURWIDYASTUTI D24051670
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR 2009
Judul Skripsi : Fermentabilitas dan Kecernaan in vitro Pakan Sumber Serat Oleh Isolat Bakteri Rayap
Nama : Rahajeng Nurwidyastuti NIM : D24051670
Menyetujui:
Pembimbing Utama Pembimbing Anggota
Ir. Anita S. Tjakradidjaja, MRur. Sc. Prof. Dr. Ir. Komang G. Wiryawan NIP. 19610930 198603 2 003 NIP. 19610914 198703 1 002
Mengetahui : Ketua Departemen
Ilmu Nutrisi dan Teknologi Pakan Fakultas Peternakan IPB
Dr. Ir. Idat G. Permana, MSc. NIP. 19670506 199103 1 001
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 24 Juni 1987 di Bogor, Jawa Barat. Penulis merupakan anak dari pasangan Bapak Budi Nurtama dan Ibu Etty Nining Haryanti.
Penulis menempuh pendidikan dasar di SDN Panaragan 2 Bogor pada tahun 1993 hingga tahun 1999. Pendidikan lanjutan tingkat menengah pertama dimulai oleh penulis pada tahun 1999 dan diselesaikan pada tahun 2002 di SLTPN 4 Bogor. Penulis kemudian melanjutkan pendidikan menengah umum ke SMUN 3 Bogor pada tahun 2002 dan lulus pada tahun 2005.
Penulis diterima sebagai mahasiswa Institut Pertanian Bogor pada tahun 2005 melalui program USMI (Undangan Seleksi Masuk Institut Pertanian Bogor) dan terdaftar pada mayor Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, dan minor Pengembangan Usaha Agribisnis, Departemen Agribisnis, Fakultas Ekonomi dan Manajemen pada tahun 2006. Penulis menjadi asisten praktikum mata kuliah Mikrobiologi Nutrisi pada tahun 2009.
KATA PENGANTAR
Penulis mengucapkan syukur Alhamdulillah kepada Allah SWT atas rahmat, karunia, serta berkah-Nya yang telah diberikan kepada penulis sehingga penulis dapat menyelesaikan skripsi yang berjudul Fermentabilitas dan Kecernaan in vitro Pakan Sumber Serat Oleh Isolat Bakteri Rayap. Skripsi ini ditulis berdasarkan hasil penelitian dari bulan September 2008 sampai dengan Maret 2009 di Laboratorium Biokimia, Fisiologi, dan Mikrobiologi Nutrisi dan Laboratorium Ilmu Nutrisi Ternak Perah, Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor. Penelitian ini bertujuan untuk mencari taraf inokulum isolat yang diperlukan agar isolat bakteri rayap dapat bertahan dalam kondisi rumen.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh karena itu, besar harapan penulis adanya sumbangan pemikiran dari berbagai kalangan untuk perbaikan skripsi ini. Penulis pun mengucapkan terima kasih kepada seluruh pihak yang telah ikut berperan sehingga penulisan skripsi ini dapat terselesaikan. Semoga skripsi ini bermanfaat bagi pembaca.
Bogor, Oktober 2009
Penulis
DAFTAR ISI
Halaman
RINGKASAN ... ii
ABSTRACT ... iv
RIWAYAT HIDUP ... vii
KATA PENGANTAR ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xi
DAFTAR GAMBAR... xii
DAFTAR LAMPIRAN... xiii
PENDAHULUAN ... 1 Latar Belakang... 1 Perumusan Masalah ... 2 Tujuan ... 3 TINJAUAN PUSTAKA ... 4 Serat Kasar ... 4 Selulosa... 4 Hemiselulosa... 5 Lignin ... 6
Rumput Gajah (Pennisetum purpureum) ... 7
Jerami Padi (Oryza sativa) ... 8
Serat Sawit (Elaeis guineensis Jacq.)... 8
Sistem Pencernaan Ruminansia... 9
Rayap... 13
Sistem Pencernaan Rayap ... 14
Kemampuan Bakteri Rayap dalam Mendegradasi Pakan Sumber Serat 16 METODE ... 18
Lokasi dan Waktu ... 18
Materi ... 18
Bahan ... 18
Alat ... 18
Rancangan ... 18
Perlakuan ... 18
Peubah yang Diamati... 19
Rancangan Percobaan... 19
Prosedur ... 20
Peremajaan Bakteri ... 20
Pencernaan Fermentatif (Anaerob) ... 20
Pengukuran Konsentrasi NH3 ... 21
Perhitungan Populasi Bakteri Total ... 22
Pencernaan Hidrolisis (Aerob)... 23
Koefisien Cerna Bahan Kering (KCBK) ... 23
Koefisien Cerna Bahan Organik (KCBO) ... 23
HASIL DAN PEMBAHASAN ... 25
Konsentrasi VFA Total ... 25
Konsentrasi Amonia (NH3) ... 27
Populasi Bakteri Total... 29
Koefisien Cerna Bahan Kering (KCBK)... 31
Koefisien Cerna Bahan Organik (KCBO)... 34
KESIMPULAN DAN SARAN ... 37
Kesimpulan ... 37
Saran ... 37
UCAPAN TERIMA KASIH ... 38
DAFTAR PUSTAKA ... 39
DAFTAR TABEL
Nomor Halaman 1. Konsentrasi VFA Total dari Pakan Sumber Serat yang Dihasilkan
oleh Isolat Bakteri Rayap pada Taraf Inokulum yang Berbeda (mM) 25 2. Konsentrasi NH3 dari Pakan Sumber Serat yang Dihasilkan oleh
Isolat Bakteri Rayap pada Taraf Inokulum yang Berbeda (mM) ... 27 3. Perhitungan Populasi Bakteri Total Sebelum Inokulasi ... 29 4. Populasi Isolat Bakteri Rayap Total Setelah Fermentasi ... 30 5. Rataan KCBK dari Pakan Sumber Serat yang Dihasilkan oleh Isolat
Bakteri Rayap pada Taraf Inokulum yang Berbeda (%) ... 32 6. Rataan KCBK dari Pakan Sumber Serat yang Dihasilkan oleh Isolat
DAFTAR GAMBAR
Nomor Halaman
1. Struktur Selulosa... 5
2. Struktur Hemiselulosa ... 5
3. Struktur Lignin... 6
4. Saluran Pencernaan Ruminansia... 10
5. Proses Metabolisme Karbohidrat di dalam Rumen Ternak Ruminansia ... 11
6. Proses Metabolisme Protein di dalam Rumen Ternak Ruminansia... 12
7. Saluran Pencernaan Rayap Reticulitermes flavipes ... 16
8. Pengaruh Taraf Inokulum Isolat Bakteri Rayap A dan D terhadap Persentase KCBK... 33
9. Pengaruh Taraf Inokulum Isolat Bakteri Rayap A dan D terhadap Persentase KCBO... 35
DAFTAR LAMPIRAN
Nomor Halaman
1. Kandungan Nutrien Rumput Gajah, Jerami Padi dan Serat Sawit ... 44
2. Sidik Ragam Konsentrasi VFA... 44
3. Sidik Ragam dan Ortogonal Kontras NH3... 45
4. Sidik Ragam dan Ortogonal Kontras KCBK... 46
PENDAHULUAN
Latar Belakang
Ternak merupakan salah satu aspek penting dalam pemenuhan kebutuhan protein manusia, terutama protein hewani. Pakan merupakan salah satu faktor penentu keberhasilan pemeliharaan ternak. Pakan yang baik adalah pakan yang mampu memenuhi kebutuhan hidup pokok, pertumbuhan dan produktivitas ternak. Permasalahan yang umum terjadi adalah ketersediaan pakan yang tidak kontinyu. Ketersediaan hijauan pada musim hujan akan melimpah, namun pada musim kemarau peternak akan mengalami kesulitan mendapatkan hijauan. Produksi pakan hijauan juga semakin menurun karena tidak adanya lahan untuk menanam. Di sisi lain, limbah pertanian dan limbah perkebunan memiliki potensi untuk digunakan sebagai pakan sumber serat, karena ketersediaannya yang melimpah. Limbah pertanian dan limbah perkebunan yang berpotensi sebagai pakan sumber serat adalah jerami padi dan serat sawit. Pemanfaatan jerami padi dan serat sawit masih terkendala oleh tingginya kandungan serat yang sulit dicerna mikroba rumen.
Kandungan serat kasar yang tinggi dapat menghambat mikroba rumen dalam mencerna pakan. Secara biologis, bahan pakan sumber serat dapat dirusak ikatan kimianya dengan bantuan enzim dan mikroorganisme tertentu (Selly, 1994). Rayap merupakan serangga yang makanan utamanya adalah kayu atau bahan yang mengandung selulosa (Tarumingkeng, 2001). Rayap memiliki kesamaan aktivitas dengan ruminansia dalam proses pencernaannya, antara lain sumber pakan berupa selulosa dan adanya mikroorganisme pendegradasi serat kasar dalam saluran pencernaannya (Oldeson and Breznak, 1983). Hal ini menunjukkan potensi mikroba saluran pencernaan rayap sebagai pendegradasi pakan sumber serat.
Setianegoro (2004) mempelajari kemampuan mikroba simbion rayap
Macrotermes gilvus Hagen, Coptotermes curvignathus Holmgren dan Microtermes inspiratus Kemner serta gabungan ketiganya dalam mencerna jerami padi, serat sawit
dan rumput gajah. Widyastuti (2005) mendapatkan 13 isolat murni bakteri rayap maupun rumen yang mempunyai kemampuan mendegradasi serat kasar jerami padi dan serat sawit. Dari hasil penelitian tersebut dipilih lima isolat terbaik yang diteliti oleh Sulistiani (2005) untuk menguji kecernaan dan fermentabilitasnya. Penelitian
kemampuan isolat bakteri rayap dalam kondisi rumen, hingga diperoleh tiga isolat terbaik yang memiliki kemampuan mendegradasi pakan sumber serat dalam kondisi rumen pada saat ketiga isolat ini ditumbuhkan secara tunggal. Ketiga isolat tersebut adalah isolat A (SB 53 5(3) 1) dan isolat C (SB 53 1 (3)) yang berasal dari rayap
Coptotermes curvignathus Holmgren, dan isolat D (SC 51 5 (2)) yang berasal dari
rayap Microtermes inspiratus Kemner. Sopandi (2007) meneliti kemampuan isolat campuran dari ketiga isolat bakteri rayap terbaik. Hasil penelitiannya menunjukkan bahwa isolat campuran AD mempunyai kemampuan mendegradasai pakan sumber serat lebih baik dibandingkan isolat campuran AC dan CD. Proses pencernaan serat di dalam rumen melibatkan aktivitas mikroba rumen yang jumlahnya sangat banyak, selain itu isolat bakteri rayap tersebut harus dapat beradaptasi dalam kondisi rumen. Oleh karena itu, perlu diketahui taraf inokulum isolat bakteri rayap yang tepat agar bakteri dapat beradaptasi dengan baik dalam kondisi rumen.
Perumusan Masalah
Salah satu masalah yang dihadapi dalam pengembangan ternak ruminansia terutama pada musim kemarau adalah kesulitan untuk mendapatkan pakan baik dari segi kuantitas, kualitas dan ketersediaannya. Pemanfaatan limbah tanaman merupakan salah satu alternatif untuk mengatasi masalah pakan. Limbah tanaman yang berpotensi untuk digunakan sebagai pakan ternak adalah jerami padi dan serat sawit. Namun, penggunaan jerami padi dan serat sawit sebagai pakan ternak masih terbatas karena rendahnya kecernaan kedua bahan pakan tersebut.
Limbah tanaman biasanya memiliki kandungan serat kasar yang tinggi, dan hal ini dapat menghambat mikroba rumen dalam mencerna pakan. Oleh karena itu, perlu dilakukan suatu cara agar kecernaan kedua bahan pakan tersebut dapat meningkat, salah satunya adalah dengan cara biologis. Di sisi lain, rayap merupakan serangga yang makanan utamanya adalah kayu atau bahan yang mengandung selulosa. Hal ini menunjukkan potensi mikroba saluran pencernaan rayap sebagai pendegradasi pakan sumber serat, terutama rumput gajah, jerami padi dan serat sawit. Serangkaian penelitian telah dilakukan berkaitan dengan kemampuan mikroba saluran pencernaan rayap ini. Setianegoro (2004) menerangkan bahwa bakteri simbion pada rayap
Macrotermes gilvus Hagen, Microtermes inspiratus Kemner dan Coptotermes curvignathus Holmgren serta gabungan ketiganya memiliki kemampuan mencerna
pakan sumber serat. Selanjutnya Widyastuti (2005) mendapatkan 13 isolat murni bakteri rayap maupun bakteri rumen domba yang memiliki kemampuan selulolitik terbaik, kemudian lima isolat terbaik dipilih berdasarkan uji kecernaan dan fermentabilitas pakan sumber serat (Sulistiani, 2005). Pradana (2006) dan Solihat (2006) menguji kemampuan kelima isolat bakteri rayap dalam kondisi rumen, hingga diperoleh tiga isolat yang memiliki kemampuan mendegradasi pakan sumber serat dalam kondisi rumen dan kemampuan selulolitik terbaik. Sopandi (2007) mengkaji kemampuan kombinasi dari ketiga isolat bakteri rayap dalam mendegradasi pakan sumber serat. Hasil yang diperoleh dari penelitian tersebut perlu dikaji kembali kemampuan mencerna pakan sumber seratnya jika ditumbuhkan secara tunggal dengan taraf inokulasi tertentu, agar isolat bakteri rayap tersebut dapat beradaptasi dengan baik dalam kondisi rumen.
Tujuan
Tujuan penelitian ini adalah untuk mendapatkan taraf inokulum isolat bakteri rayap terbaik (A (SB 53 5(3) 1) dan D (SC 51 5 (2)) berdasarkan fermentabilitas dan kecernaan in vitro pakan sumber serat.
TINJAUAN PUSTAKA
Serat Kasar
Serat kasar adalah bagian dari karbohidrat yang telah dipisahkan dengan bahan ekstrak tanpa nitrogen (BETN) yang terutama terdiri dari pati, dengan cara analisis kimia sederhana (Tillman et al., 1989). Serat kasar terdiri atas selulosa, hemiselulosa dan lignin. Fraksi serat kasar dapat diukur berdasarkan kelarutannya dalam larutan-larutan detergen, yaitu menggunakan analisis Van Soest (Tillman et
al., 1989). Menurut Sutardi (1980), analisa Van Soest merupakan sistem analisis
bahan makanan yang lebih relevan manfaatnya bagi ternak, khususnya sistem evaluasi nilai gizi hijauan.
Serat kasar terdiri dari selulosa, hemiselulosa dan lignin (Tillman et al., 1989). Bagi hewan ruminansia, selulosa merupakan sumber energi bagi mikroorganisme dalam rumen dan sebagai bahan pengisi rumen, sedangkan bagi hewan-hewan monogastrik selulosa adalah komponen yang tidak dapat dicerna. Meskipun bagi hewan non-ruminansia selulosa tidak memiliki peran spesifik, namun keberadaannya penting dalam meningkatkan gerak peristaltik. Setiap pertambahan 1% serat kasar dalam tanaman menyebabkan penurunan daya cerna bahan organiknya sekitar 0,7-1,0 unit pada ruminansia (Tillman et al., 1989).
Selulosa
Selulosa adalah zat penyusun tanaman yang jumlahnya banyak, sebagai material struktur dinding sel semua tanaman (Tillman et al., 1989). Selulosa mempunyai bobot molekul tinggi dan terdapat dalam jaringan tanaman pada dinding sel sebagai mikrofibril (Suparjo et al., 2008a). Kandungan selulosa pada dinding sel tanaman tingkat tinggi sekitar 35-50% dari berat kering tanaman (Suparjo et al., 2008b).
Selulosa dicerna dalam tubuh ternak dalam saluran pencernaan oleh selulase hasil jasad renik dan menghasilkan selubiosa, yang kemudian dihidrolisis lebih lanjut untuk menghasilkan glukosa. Hasil pencernaan oleh jasad renik terhadap selulosa adalah asam-asam lemak terbang (VFA) yang terdiri dari campuran asam asetat, asam propionat dan asam butirat, dan sebagai hasil sampingan adalah gas metan dan CO2 (Tillman et al., 1989). Struktur selulosa dapat dilihat pada Gambar 1.
Gambar 1. Struktur Selulosa (American Fiber Manufacturers Association, 2008) Hemiselulosa
Hemiselulosa adalah polisakarida pada dinding sel tanaman yang larut dalam alkali dan menyatu dengan selulosa. Hemiselulosa terdiri atas unit glukosa, D-galaktosa, D-manosa, D-xylosa, dan L-arabinosa yang terbentuk bersamaan dalam kombinasi dan ikatan glikosilik yang bermacam-macam (McDonald et al., 2002).
Hemiselulosa terdapat bersama-sama dengan selulosa dalam struktur daun dan kayu dari semua bagian tanaman dan juga dalam biji tanaman tertentu. Hemiselulosa yang terhidrolisis akan menghasilkan heksosa, pentosa dan asam uronat. Hemiselulosa dihidrolisa oleh jasad renik dalam saluran pencernaan dengan enzim hemiselulase, hasil akhir fermentasinya adalah VFA (Tillman et al., 1989).
Jumlah hemiselulosa biasanya antara 15-30% dari berat kering bahan lignoselulosa. Hemiselulosa mengikat lembaran serat selulosa membentuk mikrofibril yang meningkatkan stabilitas dinding sel. Hemiselulosa juga berikatan silang dengan lignin membentuk jaringan kompleks dan memberikan struktur yang kuat (Suparjo et al., 2008b). Berikut ini merupakan struktur hemiselulosa (Gambar 2)
Lignin
Lignin merupakan komponen yang tidak memiliki hasil akhir dari proses pencernaan dan keberadaannya dapat menghambat proses pencernaan pada ternak. Pada tanaman kandungan lignin akan bertambah seiring bertambahnya umur tanaman dan mencapai level tertinggi pada saat tanaman sudah dewasa (Tillman et
al., 1989). Lignin merupakan komponen dinding sel yang sulit dicerna oleh bakteri,
sehingga dengan kadar lignin yang lebih rendah bakteri akan lebih mudah mendegradasi zat-zat makanan yang terdapat dalam isi sel (McDonald et al., 1988).
Lignin adalah gabungan beberapa senyawa yang hubungannya erat satu sama lain, mengandung karbon, hidrogen dan oksigen, namun proporsi karbonnya lebih tinggi dibanding senyawa karbohidrat. Lignin sangat tahan terhadap degradasi kimia, termasuk degradasi enzimatik (Tillman et al., 1989). Struktur lignin dapat dilihat pada Gambar 3. Lignin sering digolongkan sebagai karbohidrat karena hubungannya dengan selulosa dan hemiselulosa dalam menyusun dinding sel, namun lignin bukan karbohidrat. Hal ini ditunjukkan oleh proporsi karbon yang lebih tinggi pada lignin (Suparjo et al., 2008a).
Pengerasan dinding sel kulit tanaman yang disebabkan oleh lignin menghambat enzim untuk mencerna serat dengan normal. Hal ini merupakan bukti bahwa adanya ikatan kimia yang kuat antara lignin, polisakarida tanaman dan protein dinding sel yang menjadikan komponen-komponen ini tidak dapat dicerna oleh ternak (McDonald et al., 2002).
Rumput Gajah (Pennisetum purpureum)
Rumput gajah (Pennisetum purpureum) merupakan keluarga rumput rumputan (Graminae) yang telah dikenal manfaatnya sebagai pakan ternak pemamah biak (ruminansia) yang alamiah di Asia Tenggara. Rumput ini berasal dari Afrika tropika, kemudian menyebar dan diperkenalkan ke daerah-daerah tropika di dunia (Manglayang, 2005). Beberapa sifat rumput gajah yang menguntungkan adalah mudah ditanam, cepat tumbuh dan menjadi besar, perakarannya relatif dalam sehingga mampu menahan partikel-partikel tanah yang mudah terbawa aliran permukaan, serta mempunyai gizi tinggi sebagai bahan makanan ternak (Soeyono, 1986). Sutardi (1980) menyatakan bahwa hijauan segar dari jenis rerumputan unggul seperti rumput gajah nilai gizinya cukup terjamin, volumenya lebih banyak dan daya cernanya lebih tinggi dibandingkan dengan rerumputan liar.
Tanaman ini berdiri tegak, berakar dalam dan tinggi dengan rimpang yang pendek, memiliki tulang daun yang tampak jelas sepanjang permukaan bawah (Prosea, 2000). Rumput gajah dapat dibiakkan secara vegetatif dengan stek batang atau sobekan rumput. Tinggi tanaman ini dapat mencapai lebih dari 4,5 m, terdapat pada tanah lembab di daerah dengan curah hujan lebih dari 1000 mm. Hasil panennya memiliki kandungan bahan kering yang jumlahnya banyak, namun rendah kandungan proteinnya jika tidak dipotong pada saat masih muda (FAO, 2007). Rumput ini biasanya dipanen dengan cara membabat seluruh pohonnya lalu diberikan langsung (cut and carry) sebagai pakan hijauan untuk kerbau dan sapi, atau dapat juga dijadikan persediaan pakan melalui proses pengawetan pakan hijauan dengan cara silase dan hay. Selain itu rumput gajah juga dapat dimanfaatkan sebagai mulsa tanah yang baik (Manglayang, 2005).
Nilai pakan rumput gajah dipengaruhi oleh perbandingan jumlah daun terhadap batang dan umurnya. Kandungan nitrogen dari hasil panen yang diadakan secara teratur berkisar antara 2-4% protein kasar, semakin tua umur tanaman kandungan protein kasar akan semakin menurun. Pada daun muda nilai kecernaan (TDN) diperkirakan mencapai 70%, tetapi angka ini menurun cukup drastis pada usia tua hingga 55%. Batang-batangnya kurang begitu disukai ternak (karena keras) kecuali yang masih muda dan mengandung cukup banyak air (Manglayang, 2005). Kandungan bahan kering rumput gajah umumnya berkisar antara 12-18%, tetapi
seiring dengan meningkatnya umur tanaman kandungan bahan kering juga akan meningkat. Kandungan serat kasar berkisar dari 26,0-40,5%, Beta-N sekitar 30,4-49,6% dengan kandungan lemak kasar 1,0-3,6%. Kandungan phosphornya cukup tinggi yaitu 0,28-0,39% dan pada batang 0,38-0,52%. Sedangkan Ca masing-masing 0,43-0,48% dan 0,14-0,23% pada daun dan batang (Sofyan et al., 2000).
Jerami Padi (Oryza sativa)
Jerami padi adalah batang padi yang ditinggalkan termasuk daun sesudah diambil buahnya yang masak (Arinong, 2008). Jerami padi merupakan limbah pertanian yang sangat potensial untuk digunakan sebagai sumber energi bagi ternak ruminansia. Tahun 2008 produksi padi sebanyak 60.325.925 ton, hal ini menunjukkan melimpahnya produksi jerami padi (Biro Pusat Statistik, 2008). Ruminansia yang terdapat di daerah Asia Tenggara sudah umum menggunakan jerami padi sebagai pakan sumber energi (Dixon, 1988).
Limbah hasil pertanian biasanya memiliki kelemahan, beberapa diantaranya adalah limbah pertanian umumnya mengandung kadar serat yang tinggi, kecernaannya yang rendah, limbah pertanian biasanya rendah kadar nutrisi seperti nitrogen (N), sulfur dan mineral penting lainnya yang berguna untuk mikroorganisme yang memiliki peran pada fermentasi serat dan hewan inang (Dixon, 1988). Rendahnya daya cerna ini disebabkan oleh adanya lignin dan silika yang mengikat selulosa dan hemiselulosa dalam bentuk ikatan rangkap, sehingga sukar dicerna oleh enzim dari mikroorganisme dalam rumen (Arinong, 2008). Menurut Sutardi (1980), jerami padi sebagai makanan ternak masih terbatas sekali pemanfaatannya, karena hanya berperan sebagai bulk dan menggantikan tidak lebih dari 25% kebutuhan ternak akan rumput.
Jerami padi sebagai hasil sisa dari tanaman padi mengandung protein kasar 3,6%, lemak 1,3%, BETN 41,6%, abu 16,4%, lignin 4,9%, serat kasar 32,0%, silika 13,5%, kalsium 0,24%, kalium 1,20%, magnesium 0,11%, dan posphor 0,10% (Arinong, 2008). Doyle et al. (1986) menerangkan bahwa nilai koefisien cerna bahan organik jerami padi berkisar antara 31-59%.
Serat Sawit (Elaeis guineensis Jacq.)
Berdasarkan taksonominya, kelapa sawit digolongkan ke dalam divisi
Monocotyledonae, ordo Cocoideae, famili Palmae, subfamili Cocoideae, genus Elaeis dan spesies Elaeis guenensis Jacq (Lubis, 1992). Serat sawit (palm press fibre)
adalah hasil ikutan pengolahan kelapa sawit yang dipisahkan dari buah setelah pengutipan (pengambilan) minyak dan biji sawit dalam proses pemerasan (Agustin, 1991).
Limbah kelapa sawit semakin melimpah seiring dengan banyaknya pabrik pengolahan kelapa sawit yang kini mencapai 470 pabrik. Sebuah pabrik kelapa sawit (PKS) berkapasitas 60 ton tandan/jam menghasilkan limbah 100 ton/hari. Itu artinya, total limbah 470 pabrik itu mencapai 28,7 juta ton dalam bentuk cair dan 15,2-juta ton limbah padat per tahun (Trubus, 2008). Terdapat tiga jenis limbah industri kelapa sawit yang dapat dimanfaatkan oleh ternak adalah bungkil kelapa sawit, lumpur kelapa sawit dan serat kelapa sawit. Angka konversi dari lumpur sawit adalah 30% dan serat 20%, sedangkan bungkil inti sawit 40-60% dari inti (Sofyan et al., 2000).
Produksi serat sawit tinggi, namun tidak diikuti dengan kualitasnya. Serat sawit memiliki kandungan protein kasar yang rendah dan xylosa yang tinggi, namun memiliki kandungan lignin yang tinggi (Vadiveloo and Fadel, 1992). Serat kelapa sawit dapat diberikan pada ruminansia sebanyak 15-35% dari ransum (Sofyan et al., 2000). Kandungan serat sawit adalah BK 93,2 %, abu 6,46 %, protein kasar 5,93 %, lemak kasar 5,19 %, serat kasar 40,80 % dan beta-N 41,62 % (Agustin,1991).
Sistem Pencernaan Ruminansia
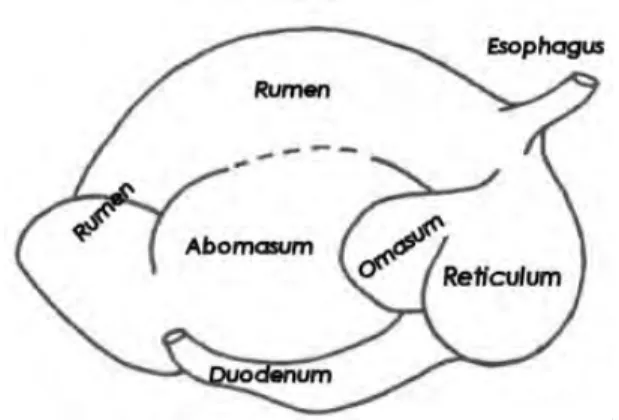
Lambung ruminansia terletak pada bagian kiri dari rongga abdomen, menempati ¾ bagian dari total isi rongga perut. Lambung ruminansia terdiri atas 4 bagian, yaitu rumen, retikulum, omasum, dan abomasum (Dehority, 2004). Bagian-bagian dari lambung ruminansia ini dapat dilihat pada Gambar 4. Proses pencernaan pada ternak ruminansia terjadi secara mekanis (di dalam mulut), secara fermentatif (oleh enzim-enzim yang berasal dari mikroba rumen) dan secara hidrolitis (oleh enzim-enzim pencernaan hewan induk semang). Lokasi proses pencernaan fermentatif bervariasi antar jenis ternak (Sutardi, 1980). Ruminansia berkembang untuk memfermentasi makanannya dengan bantuan mikroorganisme (∅rskov, 2001). Rumen dihuni oleh tidak kurang dari empat jenis mikroorganisme anaerob, yaitu bakteri, protozoa, fungi atau jamur dan virus (Preston and Leng, 1987).
Gambar 4. Saluran Pencernaan Ruminansia (Raczykowski, 1995)
Di dalam rumen terdapat berbagai tipe bakteri, yang masing-masing mempunyai fungsi yang berbeda sehingga karbohidrat kompleks dapat dikonversikan menjadi asam organik yang dapat dimanfaatkan ternak. Bakteri bekerja dengan cara menempel pada partikel hijauan dan perlahan mengikis bahan yang dapat dicerna (∅rskov, 2001). Mikroba rumen menghasilkan enzim selulase. Enzim ini ada dua macam, yaitu selulase I dan selulase II. Selulase I bersifat non hidrolitik dan fungsi utamanya untuk memecah ikatan hidrogen antar molekul glukosa dalam selulosa. Selulase II bersifat hidrolitik, yaitu memecah ikatan β-1,4 (Sutardi, 1980). Jumlah bakteri di dalam rumen adalah 109-1010 per ml dari isi rumen. Sedangkan jumlah protozoa lebih kecil dari bakteri (106 per ml), namun akan lebih besar dari bakteri dalam massa total (McDonald et al., 2002).
Spesies bakteri selulolitik yang utama di dalam rumen adalah Ruminococcus
albus, R. flavefaciens, dan Bacteriodes succinogens. Populasi bakteri bervariasi
tergantung dari jenis hijauan. Enzim yang bekerja dalam rumen hanya dapat mendegradasi beberapa komponen dinding sel, komponen keras dinding sel lainnya akan dicerna oleh bakteri (Caroline et al., 2003).
Pemecahan makanan secara kimia di dalam retikulo-rumen diakibatkan oleh sekresi enzim, tidak hanya oleh ternak itu sendiri, tetapi juga oleh bakteri dan protozoa. Makanan dan air masuk ke dalam rumen dan difermentasi untuk menghasilkan volatile fatty acids (VFA), sel mikroba, gas metan, dan CO2. Gas
metan akan dikeluarkan dengan cara eruktasi dan VFA diserap melalui dinding rumen. Sel mikroba bersama dengan komponen makanan yang tidak terdegradasi,
masuk ke abomasum dan usus halus yang kemudian dicerna oleh enzim yang disekresikan oleh ternak inang (McDonald et al., 2002).
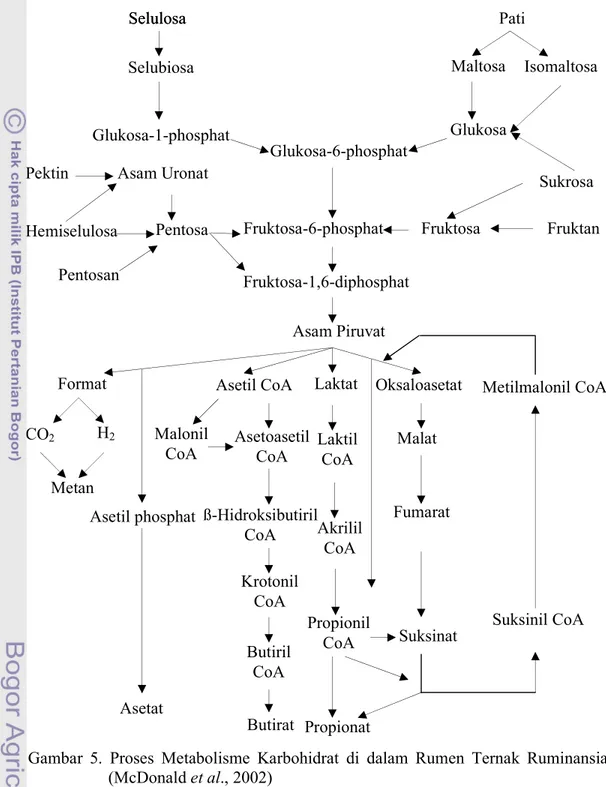
Gambar 5. Proses Metabolisme Karbohidrat di dalam Rumen Ternak Ruminansia (McDonald et al., 2002)
Pakan ruminansia umumnya mengandung selulosa, hemiselulosa, pati dan karbohidrat larut air yang sebagian besar berupa fruktan. Pemecahan karbohidrat di
Selulosa Selulosa Selubiosa Glukosa-1-phosphat Glukosa-6-phosphat Glukosa Maltosa Isomaltosa Pati Sukrosa Fruktan Fruktosa Fruktosa-6-phosphat Pektin Asam Uronat
Hemiselulosa Pentosa
Pentosan Fruktosa-1,6-diphosphat
Asam Piruvat
Format
CO2 H2
Asetil CoA Laktat Oksaloasetat Metilmalonil CoA
Metan Malonil CoA Asetoasetil CoA ß-Hidroksibutiril CoA Asetil phosphat Krotonil CoA Butiril CoA Asetat Butirat Laktil CoA Akrilil CoA Propionil CoA Propionat Malat Fumarat Suksinat Suksinil CoA
menjadi gula sederhana. Gula sederhana yang dihasilkan pada tahap pertama jarang terdeteksi di dalam cairan rumen karena gula-gula tersebut diambil dan dimetabolis intraseluler oleh mikroorganisme. Tahap kedua merupakan proses pemecahan piruvat menjadi produk akhir pencernaan karbohidrat pada ruminansia, yaitu asam asetat, asam propionat, asam butirat, CO2, dan gas metan (McDonald et al., 2002). Proses
pemecahan karbohidrat pada ruminansia ini dapat dilihat pada Gambar 5.
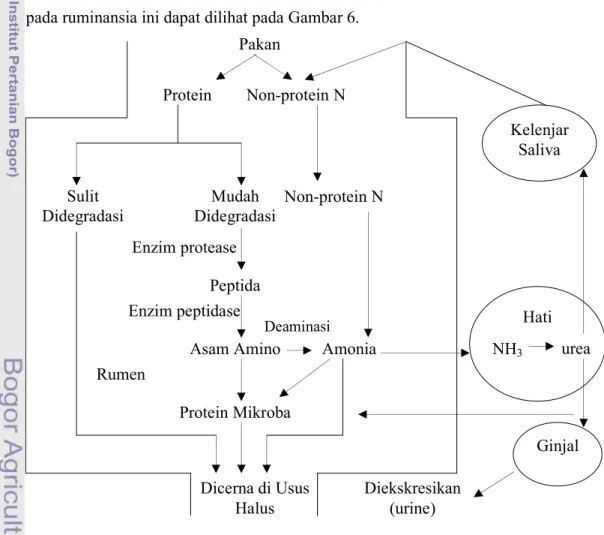
Protein pakan dihidrolisis menjadi peptida dan asam amino oleh mikroorganisme rumen, tetapi beberapa asam amino didegradasi menjadi asam organik, amonia dan CO2. Produk amonia bersama dengan peptida sederhana dan
asam amino bebas digunakan mikroorganisme rumen untuk sintesis protein mikroba. Mikroorganisme yang terbawa dan berada di abomasum dan usus halus, protein selnya akan dicerna dan diserap (McDonald et al., 2002). Proses pemecahan protein pada ruminansia ini dapat dilihat pada Gambar 6.
Gambar 6. Proses Metabolisme Protein di dalam Rumen Ternak Ruminansia (McDonald et al., 2002) Pakan Protein Non-protein N Sulit Didegradasi Mudah Didegradasi Peptida Enzim protease Asam Amino Protein Mikroba Rumen Dicerna di Usus Halus Non-protein N Amonia Kelenjar Saliva Hati Enzim peptidase Diekskresikan (urine) NH3 urea Ginjal Deaminasi
Rayap
Di seluruh dunia jenis-jenis rayap yang telah dikenal ada sekitar 2000 spesies dan sekitar 120 spesies diantaranya merupakan hama. Sedangkan di Indonesia kurang lebih terdapat 200 spesies yang telah dikenal dan sekitar 20 spesies yang diketahui berperan sebagai hama perusak kayu dan hama hutan atau pertanian (Tarumingkeng, 2001). Rayap adalah serangga sosial yang termasuk ordo Isoptera. Rayap berbeda dengan serangga sosial seperti semut dan lebah, namun struktur rayap lebih mirip dengan kecoa (Krishna, 1969).
Rayap pada dasarnya adalah serangga daerah tropik dan subtropik. Di daerah tropik rayap ditemukan mulai dari pantai sampai ketinggian 3000 m di atas permukaan laut. Makanan utamanya adalah kayu atau bahan yang terutama terdiri atas selulosa. Berdasarkan perilaku makan rayap, dapat dikatakan bahwa rayap termasuk golongan makhluk hidup perombak bahan mati yang sebenarnya sangat bermanfaat bagi kelangsungan kehidupan dalam ekosistem. Rayap merupakan konsumen primer dalam rantai makanan yang berperan dalam kelangsungan siklus beberapa unsur penting seperti karbon dan nitrogen (Tarumingkeng, 2001).
Sebagian masyarakat juga sudah mengetahui bahwa dalam koloni setiap jenis rayap, terdapat beberapa kasta individu yang wujudnya berbeda, yaitu:
1. Kasta prajurit
Kasta ini ditandai dengan bentuk tubuh yang kekar karena penebalan (sklerotisasi) kulitnya agar mampu melawan musuh dalam rangka tugasnya mempertahankan kelangsungan hidup koloninya.
2. Kasta pekerja
Kasta ini membentuk sebagian besar koloni rayap. Tidak kurang dari 80 % populasi dalam koloni merupakan individu-individu pekerja. Peran dari kasta pekerja adalah mencari makanan dan membawanya ke sarang, memelihara telur dan rayap dari kasta lain, membunuh dan memakan rayap-rayap yang sudah tidak produktif lagi baik dari kasta reproduktif, prajurit maupun kasta pekerja sendiri.
3. Kasta reproduktif
Kasta reproduktif terdiri atas individu-individu seksual yaitu betina (yang abdomennya biasanya sangat membesar) yang tugasnya bertelur dan jantan (raja) yang tugasnya membuahi betina. Jika koloni rayap masih relatif muda biasanya kasta
reproduktif berukuran besar sehingga disebut ratu. Kasta ini dibedakan menjadi kasta reprodukif primer dan reproduktif suplementer atau neoten.
Rayap mempunyai sifat-sifat yang penting untuk diketahui antara lain sifat kanibal dan trofolaksis. Sifat kanibal terutama menonjol pada keadaan yang sulit misalnya kekurangan air dan makanan, sehingga hanya individu yang kuat saja yang dipertahankan. Kanibalisme berfungsi untuk mempertahankan prinsip efisiensi dan konservasi energi, dan berperan dalam pengaturan homeostatika (keseimbangan kehidupan) koloni rayap. Trofalaksis adalah perilaku berkerumun di antara anggota-anggota koloni, dan saling "menjilat" anus dan mulut. Dengan perilaku ini protozoa dapat ditularkan kepada individu-individu yang memerlukannya. Penyebaran feromon dasar juga diduga terlaksana melalui perilaku trofalaksis (Tarumingkeng, 2001).
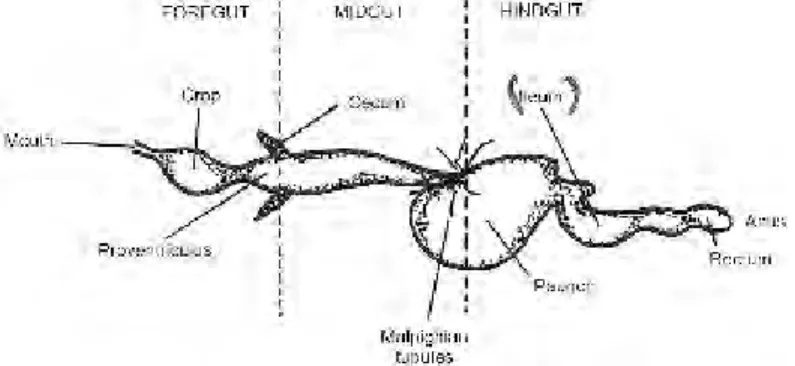
Sistem Pencernaan Rayap
Rayap penting dalam degradasi bagian tanaman termasuk selulosa, hemiselulosa, lignin dan flavonoid (Ramin et al., 2008b). Sistem pencernaan rayap terdiri dari usus depan, usus tengah dan usus belakang. Usus belakang terbagi menjadi lima segmen, yaitu proctodeal, katup yang mengontrol masuknya makanan, perut sebagai tempat absorpsi dan banyak terdapat mikroorganisme simbion, usus besar dan rektum (Varma et al., 1994). Mikroba yang terdapat di dalam saluran pencernaan rayap terdiri dari protozoa, bakteri, spirochetes, dan fungi (Ramin et al., 2008b).
Rayap memiliki kesamaan aktivitas dengan ruminansia dalam proses pencernaannya, diantaranya adalah sumber pakan berupa selulosa, adanya mikroorganisme pendegradasi serat kasar dalam saluran pencernaannya, produk fermentasi yang dihasilkan dari proses pencernaan pakan, dan kondisi dalam alat pencernaannya yaitu rumen pada ruminansia dan usus pada rayap sama-sama dalam kondisi anaerob. Selain itu, terdapat perbedaan aktivitas pencernaan makanan antara ruminansia dan rayap, yaitu pada rumen didominasi oleh bakteri, sedangkan pada rayap lebih didominasi oleh protozoa. Pada rayap, produk fermentasinya tidak selengkap pada ruminansia (Odelson and Breznak, 1983).
Enzim endo-β-1,4 glukanase yang dihasilkan rayap memegang peranan penting dalam pencernaan selulosa. Metabolisme selulosa oleh flora rayap
menghasilkan asetat, CO2 dan hidrogen sebagai produk akhir (Varma et al., 1994).
Pada rayap tingkat rendah, pada saluran pencernaannya kaya akan protozoa. Paling tidak, beberapa flagelata protozoa memiliki hubungan simbiosis mutualisme dengan rayap inangnya. Beberapa penelitian menunjukkan bahwa rayap bergantung pada protozoa untuk menyediakan enzim penting untuk mencerna selulosa. Pada rayap tingkat tinggi (Termitidae), diduga bahwa bakteri mengambil alih tugas protozoa dalam membantu pencernaan selulosa (Krishna, 1969).
Microtermes inspiratus Kemner terdapat di daerah Jawa dan hidup di bawah
tanah. Rayap ini merupakan hama perusak kayu yang serius dan menyerang bagian tanaman yang mati dari pohon. Rayap ini memiliki ukuran tubuh yang sangat bervariasi. Microtermes inspiratus Kemner merupakan rayap tingkat tinggi dari family Termitidae dan subfamily Macrotermitinae (Roonwal, 1970).
Coptotermes curvignathus Holmgren terdapat di Asia Tenggara, seperti
Malaysia, Singapura, Indonesia (Jawa, Sumatra dan Kalimantan), Thailand, Vietnam, dan Kamboja, serta kemungkinan di Filipina dan Cina selatan. Rayap ini merupakan hama yang ganas untuk pohon karet di Asia Tenggara dan menyerang kulit pohon serta bagian lain, bahkan terkadang mematikan pohon yang diserang. Untuk mencapai makanannya, rayap ini membuat saluran dari kayu yang sudah termakan hingga ke bawah tanah (Roonwal, 1970). Coptotermes curvignathus Holmgren merupakan rayap tingkat rendah dalam family Rhinotermitidae dan subfamily
Coptotermitinae (Ramin et al., 2008a). Hasil penelitian Ramin et al. (2008a) menunjukkan bahwa dari hasil isolasi tiga spesies bakteri yang berasal dari
Coptotermes curvignathus Holmgren, dapat diidentifikasi jenis bakteri ketiga isolat
tersebut, yaitu Enterobacter aerogenes, Enterobacter cloacae dan Clavibacter
Gambar 7. Saluran Pencernaan Rayap Reticulitermes flavipes (Kane, 1997 Dalam Dehority, 2004)
Kemampuan Bakteri Rayap dalam Mendegradasi Pakan Sumber Serat Penelitian Adawiah (2000) dan Setianingsih (2001) menunjukkan bahwa rayap Coptotermes curvignathus Holmgren dapat mengkonsumsi pakan sumber serat. Penelitian Adawiah menunjukkan bahwa rayap Coptotermes curvignathus Holmgren lebih menyukai pod coklat dan bagas tebu. Hasil yang berbeda diperoleh Setianingsih (2001), Coptotermes curvignathus Holmgren lebih menyukai mengkonsumsi rumput gajah, serat sawit dan kayu pinus dibandingkan pod coklat. Perbedaan ini disebabkan oleh komposisi dan kandungan zat makanan terutama komponen serat kasar dalam pakan (Adawiah, 2000), adanya zat antinutrisi pada pod coklat (Setianingsih, 2001) dan perbedaan prosedur penelitian.
Bakteri simbion rayap yang digunakan pada penelitian ini diperoleh dari hasil pemurnian dari penelitian-penelitian sebelumnya. Setianegoro (2004) dalam penelitiannya menyatakan bahwa bakteri simbion rayap Macrotermes gilvus Hagen,
Coptotermes curvignathus Holmgren dan Microtermes inspiratus Kemner serta
gabungan ketiganya mempunyai kemampuan dalam mencerna pakan sumber serat seperti jerami padi, serat sawit dan rumput gajah. Namun kemampuan bakteri simbion rayap tersebut masih lebih rendah bila dibandingkan dengan isolat bakteri rumen. Penelitian selanjutnya yang dilakukan oleh Widyastuti (2005) menghasilkan 28 isolat bakteri rayap maupun rumen, kemudian diseleksi hingga diperoleh 13 isolat murni bakteri rayap dan rumen yang mempunyai kemampuan selulolitik tertinggi. Sulistiani (2005) mendapatkan lima isolat terbaik untuk diteliti lagi kemampuannya dalam fermentabilitas dan kecernaan pakan berserat.
Penelitian selanjutanya dilakukan oleh Pradana (2006) dan Solihat (2006) yang menunjukkan bahwa bakteri simbion rayap dapat hidup dalam kondisi rumen dan mendapatkan tiga isolat terbaik yaitu isolat A (SB 53 5(3)1), D (SC 51 5 (2)) dan C (SB 53 1(3)2) karena memiliki daya cerna yang tinggi. Sopandi (2007) mengkaji kemampuan ketiga isolat bakteri tersebut bila dikombinasikan dan diperoleh hasil dua isolat bakteri simbion rayap yang terbaik yaitu isolat A (SB 53 5(3)1) yang berasal dari rayap Coptotermes curvignathus Holmgren dan isolat D (SC 51 5 (2)) yang berasal dari rayap Microtermes inspiratus Kemner. Novianto (2009) dan Puspitasari (2009) mengkaji kemampuan kombinasi dua isolat bakteri rayap terbaik dengan isolat bakteri rumen. Penelitian keduanya menunjukkan bahwa isolat bakteri rayap dapat berinteraksi dengan baik dengan isolat bakteri rumen dalam mendegradasikan pakan sumber serat.
METODE
Lokasi dan Waktu
Penelitian ini telah dilaksanakan di Laboratorium Biokimia, Fisiologi dan Mikrobiologi Nutrisi, dan Laboratorium Nutrisi Ternak Perah, Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor. Waktu penelitian dilaksanakan dari bulan September 2008 sampai Maret 2009.
Materi
Bahan
Bahan pakan sumber serat yang digunakan yaitu rumput gajah, jerami padi dan serat sawit yang sudah digiling halus. Sumber inokulum yaitu isolat bakteri simbion rayap yang berasal dari rayap Coptotermes curvignathus Holmgren yaitu isolat A (SB 53 5(3)1) dan rayap Microtermes inspiratus Kemner yaitu isolat D (SC 51 5 (2)). Cairan rumen yang digunakan sebagai bahan adalah cairan rumen sapi yang diotoklaf, dengan tujuan cairan rumen otoklaf dapat dimanfaatkan sebagai makanan bagi isolat bakteri rayap. Bahan kimia yang digunakan yaitu larutan McDougall, gas CO2, larutan pepsin HCl 0,2 %, larutan asam borat, larutan HgCl2,
larutan Na2CO3 jenuh, larutan H2SO4 0,005 N, vaselin, larutan H2SO4 15 %, larutan
NaOH 0,5 N, larutan HCl 0,5 N, indikator phenolphtalein (PP), dan aquades. Alat
Peralatan yang digunakan adalah tabung fermentor, shaker waterbath, cawan Conway, cawan porselin, sentrifuse, pompa vakum, Buret, labu Erlenmeyer, tabung Hungate, inkubator, kertas saring Whatman No. 41, seperangkat alat destilasi, otoklaf, probe karet, pipet, tanur 600oC, dan oven 105oC.
Rancangan
Perlakuan
Perlakuan bakteri yang dilakukan dalam penelitian ini terdiri atas 3 faktor dengan 3 ulangan. Adapun ketiga faktor tersebut adalah:
Faktor A : isolat bakteri rayap, yaitu A1= isolat bakteri rayap Coptotermes
curvignathus Holmgren (isolat A (SB 53 5(3)1) dan A2= isolat bakteri
Faktor B : taraf inokulum isolat bakteri, yaitu B1= 106 CFU/ml, B2= 108 CFU/ml, B3 = 1010 CFU/ml.
Faktor C : jenis pakan sumber serat, yaitu C1= rumput gajah (RG), C2= jerami padi (JP) dan C3= serat sawit (SS).
Peubah yang diamati
Peubah-peubah yang diamati dalam penelitian in vitro ini adalah: 1. Konsentrasi VFA total (mM)
Konsentrasi VFA total dianalisis dengan menggunakan teknik destilasi uap (General Laboratory Procedures, 1966).
2. Konsentrasi NH3 (Amonia) (mM)
Konsentrasi ammonia dianalisis dengan menggunakan metode mikrodifusi Conway (General Laboratory Procedures, 1966).
3. KCBK (Koefisien Cerna Bahan Kering) dan KCBO (Koefisien Cerna Bahan Organik) (%)
KCBK dan KCBO diukur dengan menggunakan metode Tilley and Terry (1963) 4. Populasi bakteri total yang dihitung dengan metode pengenceran berseri yang
dijelaskan oleh Ogimoto and Imai (1981). Rancangan Percobaan
Rancangan percobaan yang digunakan dalam penelitian ini adalah rancangan acak kelompok dengan pola faktorial 2×3×3 dengan 3 periode pengambilan cairan rumen sebagai kelompok. Faktor A adalah isolat bakteri rayap, yaitu A1= isolat bakteri rayap Coptotermes curvignathus Holmgren (isolat A (SB 53 5(3)1) dan A2= isolat bakteri rayap Microtermes inspiratus Kemner (isolat D (SC 51 5 (2)). Faktor B adalah taraf inokulum isolat bakteri, yaitu B1= 106 CFU/ml, B2= 108 CFU/ml, B3 = 1010 CFU/ml. Faktor C adalah jenis pakan sumber serat, yaitu C1= rumput gajah (RG), C2= jerami padi (JP) dan C3= serat sawit (SS).
Adapun model matematik yang digunakan dalam penelitian adalah : ijkl l k j i k j k i j i k j i ijkl Y =µ+α +β +γ +α β +α γ +β γ +α β γ +δ +ε Keterangan : ijkl
µ : Nilai rataan umum i
α : Efek utama isolat bakteri rayap ke-i, i = 1 dan 2 j
β : Efek utama taraf inokulum ke-j, j = 1, 2 dan 3 k
γ : Efek utama bahan pakan sumber serat ke-k, k = 1, 2 dan 3 j
iβ
α : Efek interaksi antara isolat bakteri rayap ke-i dan taraf inokulum ke-j k
iγ
α : Efek interaksi antara isolat bakteri rayap ke-i dan bahan pakan sumber serat ke-k
k jγ
β : Efek interaksi antara taraf inokulum ke-j faktor II dan bahan pakan sumber serat ke-k
k j iβ γ
α : Efek interaksi antara isolat bakteri rayap ke-i, taraf inokulum ke-j dan bahan pakan sumber serat ke-k
l
δ : Efek blok ke-l, l = 1, 2 dan 3 ijkl
ε : Error (galat) dari isolat bakteri rayap ke-i, taraf inokulum ke-j, pakan sumber serat ke-k, dan blok ke -l
Data yang diperoleh dianalisis menggunakan sidik ragam (ANOVA), jika terdapat pengaruh yang nyata terhadap peubah yang diamati, perbedaan antar perlakuan diuji dengan ortogonal kontras dan polinomial (Steel dan Torrie, 1993). Populasi bakteri total dianalisis secara deskriptif.
Prosedur
Peremajaan Bakteri
Media basal (BHI) sebanyak 10 ml dimasukkan ke dalam tabung reaksi dengan dialiri gas, kemudian tabung ditutup dengan probe karet dan diselotip agar keadaan media tumbuh bakteri tetap dalam kondisi anaerob. Kemudian sumber inokulum bakteri dimasukkan ke dalam tabung tersebut. Tabung lalu dimasukkan ke dalam inkubator (suhu 39oC) selama 24 jam. Mikroba ini selanjutnya digunakan sebagai inokulum pada uji fermentasi dan kecernaan in vitro.
Pencernaan Fermentatif (Anaerob)
Bahan pakan ditimbang sebanyak satu gram, kemudian dimasukkan ke dalam tabung fermentor yang telah diberi label. Larutan McDougall diturunkan pH-nya hingga 6,5-6,8, kemudian sebanyak 12 ml dimasukkan ke dalam tabung fermentor tersebut disertai dengan penambahan gas CO2. Cairan rumen yang telah diotoklaf
dimasukkan ke dalam tabung tersebut sebanyak 6 ml, kemudian sumber inokulum dimasukkan sebanyak 2 ml. Larutan dialiri gas CO2 selama 30 detik, kemudian
tabung ditutup dengan probe karet yang berventilasi. Setelah dialiri gas CO2, tabung
fermentor dimasukkan ke dalam shaker waterbath dengan suhu 39oC dan difermentasi selama 6 jam. Setelah 6 jam, tutup karet dibuka kemudian ditambahkan 0,2 ml larutan HgCl2 jenuh untuk mematikan mikroba. Cairan dalam tabung
fermentor diambil dengan menggunakan pipet dan dipindahkan ke dalam tabung sentrifuse. Tabung sentrifuse tersebut disentrifuse pada kecepatan 3000 rpm selama 15 menit dan supernatannya ditampung dalam tabung film untuk analisa konsentrasi VFA dan NH3.
Pengukuran Konsentrasi NH3
Pengukuran ini dilakukan dengan metode mikrodifusi Conway. Supernatan dari pencernaan fermentatif diambil sebanyak 1 ml dan ditempatkan pada salah satu ujung alur cawan, sedangkan Na2CO3 jenuh ditempatkan pada ujung alur cawan
sebelahnya (kedua bahan tersebut tidak boleh bercampur sebelum tutup cawan ditutup rapat). Larutan asam borat berindikator sebanyak 1 ml ditempatkan dalam cawan kecil yang terletak di tengah cawan Conway. Selanjutnya cawan Conway yang sebelumnya telah diolesi vaselin pada bibir dan tutupnya ditutup rapat agar tidak ada NH3 yang keluar. Larutan Na2CO3 jenuh dicampurkan dengan supernatan
sampel hingga merata dengan cara menggoyang-goyangkan dan memiringkannya. Sebelum titrasi, cawan Conway dibiarkan selama 24 jam pada suhu kamar. Setelah 24 jam, tutup cawan dibuka dan asam borat dititrasi dengan H2SO4 0,005 N sampai
warnanya berubah dari biru menjadi kemerah-merahan. Saat titrasi, asam borat tidak boleh terkontaminasi oleh supernatan karena warna asam borat tidak akan berubah menjadi merah. Konsentrasi NH3 dihitung dengan rumus :
Konsentrasi NH3 (mM) = sampel BK x sampel berat 1000 x SO H N x SO H ml 2 4 2 4
Pengukuran Konsentrasi VFA
Konsentrasi VFA diukur dengan menggunakan teknik destilasi uap (steam destilation). Sebanyak 5 ml supernatan (berasal dari tabung yang sama dengan
ditambahkan 1 ml H2SO4 15 %. Dinding tabung dibilas dengan aquades dan
secepatnya ditutup dengan sumbat karet yang telah dihubungkan dengan pipa destilasi berdiameter ± 0,5 cm. Kemudian ujung pipa yang lain dihubungkan dengan alat pendingin Leibig. Tabung destilasi dimasukkan ke dalam labu didih yang telah
berisi air mendidih tanpa menyentuh permukaan air tersebut. Uap air panas akan mendesak VFA dan akan terkondensasi di dalam pendingin.
Hasil destilasi ditampung dengan labu Erlenmeyer 300 ml yang telah diisi 5 ml NaOH 0,5 N. Proses destilasi selesai pada saat jumlah destilat yang tertampung mencapai ± 250 ml. Destilat yang tertampung ditambah indikator phenolphthalein (PP) sebanyak 2-3 tetes, lalu dititrasi dengan HCl 0,5 N sampai terjadi perubahan dari warna merah jambu menjadi tidak berwarna (bening). Konsentrasi VFA total diukur dengan rumus :
VFA Total (mM) =
(
)
sampel BK x sampel berat ml 5 / 1000 x HCl N x b -a Keterangan :a = volume titran blanko b = volume titran sampel
Perhitungan Populasi Bakteri Total
Populasi bakteri dihitung dengan metode pencacah koloni bakteri hidup. Hal pertama yang harus dilakukan adalah membuat media tumbuh yaitu dengan cara: bahan-bahan media dicampur, kemudian dimasukkan ke dalam botol yang telah diotoklaf, kemudian diukur pHnya sekitar pH 6,8. Media pembiakan yang digunakan adalah non selektif media untuk total bakteri. Kemudian media dimasukkan ke dalam tabung Hungate masing-masing sebanyak 4,9 ml yang sebelumnya telah diisi agar bacto sebanyak 0,150 g. Media lalu disterilkan dalam otoklaf pada suhu 121°C selama 15 menit dengan tekanan 1,2 Kg/cm3. Setelah siap digunakan untuk pembiakan bakteri, media agar dimasukkan ke dalam penangas air pada suhu 47°C.
Contoh cairan yang akan dikulturkan diencerkan terlebih dahulu, dengan media pengenceran. Pengenceran dilakukan sebagai berikut: 0,05 ml kultur bakteri dimasukkan ke dalam 4,95 ml media pengencer. Selanjutnya dari media pengencer diambil kembali sebanyak 0,05 ml, lalu dimasukkan ke dalam 4,95 ml media pengencer berikutnya. Perlakuan tersebut dilakukan sampai tabung ke-5. Kemudian
dari masing-masing seri tabung pengenceran diambil sebanyak 0,1 ml, kemudian dimasukkan ke media agar dan diputar sambil dialiri air pada roller tube, agar media
dapat menjadi padat secara merata. Selanjutnya bakteri diinkubasi selama 24 jam di dalam inkubator. Perhitungan jumlah bakteri dilakukan dengan cara sebagai berikut :
Populasi bakteri = 0,1 10 x 0,05 koloni Jumlah x× Keterangan :
x : tabung seri pengenceran ke-x
Pencernaan Hidrolisis (Aerob)
Produk fermentasi yang telah dipisahkan supernatannya pada percobaan fermentabilitas (24 jam), ditambah larutan enzim pepsin HCl 0,2 % (20 ml), kemudian dilakukan proses inkubasi lanjutan secara aerob sampai 24 jam dalam
shaker waterbath. Setelah 24 jam campuran tersebut disaring dengan kertas saring
Whatman No. 41 menggunakan pompa vakum untuk mendapatkan residunya.
Koefisien Cerna Bahan Kering (KCBK)
Residu yang telah dipisahkan dari supernatannya, kemudian dimasukkan ke dalam cawan porselin untuk diuapkan airnya di dalam oven 105 oC selama 24 jam. Dari penguapan dengan oven 105 oC tersebut didapatkan bahan kering. Bobot kering sampel dalam cawan porselin kemudian ditimbang. Selanjutnya, untuk menentukan besaran koefisien kecernaan bahan kering dapat dihitung menggunakan cara berikut ini : Persentase KCBK = 100% BK ) BK BK ( BK asal blanko residu asal− − ×
Adapun bahan kering blanko diperoleh dari penguapan residu asal fermentasi tanpa bahan pakan dengan oven 105 oC, sedangkan bahan kering asal diperoleh dari penguapan oven 105 oC pada bahan pakan percobaan yang mendapat perlakuan yang sama, tetapi tidak difermentasikan (tidak ditambahkan inokulum).
Koefisien Cerna Bahan Organik (KCBO)
Besaran koefisien cerna bahan organik pakan diperoleh dari perhitungan bobot abu residu. Untuk mengetahui bobot abu residu, sampel dalam cawan porselin
yang telah diuapkan pada analisa KCBK, kemudian dimasukkan ke dalam tanur suhu 600 oC selama 6 jam. Setelah 6 jam, cawan porselin tersebut diangkat dan ditimbang bobot abunya setelah terlebih dahulu didinginkan di dalam eksikator. Bobot bahan organik diperoleh dengan mengurangi bobot kering dengan bobot abu residu. Besaran koefisien cerna bahan organik dihitung dengan cara berikut ini :
Persentase KCBO = 100% BO ) BO BO ( BO asal blanko residu asal− − ×
Penentuan bahan organik blanko (BO blanko) diperoleh dari pengabuan residu asal fermentasi tanpa bahan pakan dengan tanur 600 oC. Sedangkan bahan organik asal (BO asal) diperoleh dari pengabuan dengan tanur 600 oC pada bahan pakan percobaan yang mendapat perlakuan yang sama, tetapi tidak difermentasikan (tidak ditambahkan inokulum).
HASIL DAN PEMBAHASAN
Konsentrasi VFA Total
McDonald et al. (2002) menyatakan bahwa pakan yang masuk ke dalam
rumen difermentasi untuk menghasilkan produk utama berupa VFA (Volatile Fatty Acid), sel-sel mikroba, gas metan, dan CO2. VFA dalam rumen utamanya diproduksi
dari hasil perombakan karbohidrat oleh mikroba rumen. VFA digunakan sebagai kerangka karbon untuk pertumbuhan mikroba rumen dan sebagai sumber energi bagi ternak (Arora, 1989).
Hasil sidik ragam menunjukkan bahwa kelompok berpengaruh sangat nyata (P<0,01) terhadap konsentrasi VFA total, sedangkan jenis isolat bakteri rayap, taraf inokulum, jenis pakan, dan interaksi berbagai faktor tidak berpengaruh terhadap konsentrasi VFA total (Tabel 1). Perbedaan yang sangat nyata pada kelompok menunjukkan bahwa perbedaan cairan rumen yang digunakan berpengaruh terhadap konsentrasi VFA total. Hal ini disebabkan oleh perbedaan kandungan nutrisi yang terdapat dalam cairan rumen. Kandungan nutrisi ini akibat dari variasi individu dan pakan yang dikonsumsi oleh ternak (Patriana, 1993).
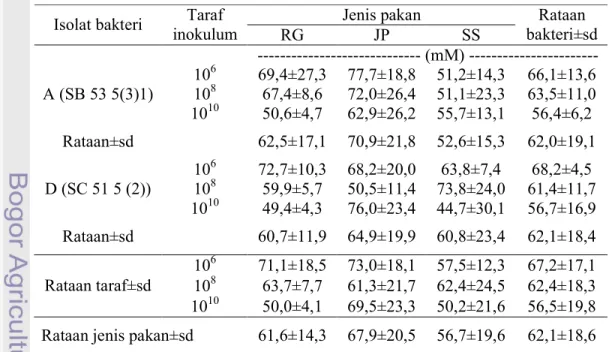
Tabel 1. Konsentrasi VFA Total dari Pakan Sumber Serat yang Dihasilkan oleh Isolat Bakteri Rayap pada Taraf Inokulum yang Berbeda
Jenis pakan Isolat bakteri Taraf
inokulum RG JP SS Rataan bakteri±sd --- (mM) --- 106 69,4±27,3 77,7±18,8 51,2±14,3 66,1±13,6 108 67,4±8,6 72,0±26,4 51,1±23,3 63,5±11,0 A (SB 53 5(3)1) 1010 50,6±4,7 62,9±26,2 55,7±13,1 56,4±6,2 Rataan±sd 62,5±17,1 70,9±21,8 52,6±15,3 62,0±19,1 106 72,7±10,3 68,2±20,0 63,8±7,4 68,2±4,5 108 59,9±5,7 50,5±11,4 73,8±24,0 61,4±11,7 D (SC 51 5 (2)) 1010 49,4±4,3 76,0±23,4 44,7±30,1 56,7±16,9 Rataan±sd 60,7±11,9 64,9±19,9 60,8±23,4 62,1±18,4 106 71,1±18,5 73,0±18,1 57,5±12,3 67,2±17,1 108 63,7±7,7 61,3±21,7 62,4±24,5 62,4±18,3 Rataan taraf±sd 1010 50,0±4,1 69,5±23,3 50,2±21,6 56,5±19,8 Rataan jenis pakan±sd 61,6±14,3 67,9±20,5 56,7±19,6 62,1±18,6
Rataan produksi VFA yang dihasilkan berkisar antara 44,7-77,7 mM. Kisaran rataan ini dapat dikatakan rendah jika dibandingkan dengan kisaran konsentrasi VFA cairan rumen yang mendukung pertumbuhan mikroba rumen menurut McDonald et al. (2002) yaitu antara 70-150 mM. Hal ini disebabkan oleh kandungan karbohidrat
dan protein yang mudah dicerna dalam pakan sumber serat yang digunakan rendah. Walaupun perbedaan antar perlakuan secara statistik tidak berbeda nyata, rataan tertinggi konsentrasi VFA dicapai oleh jerami padi. Hasil ini didukung oleh Ramin et al. (2008b) yang menyatakan bahwa bakteri rayap dapat meningkatkan kecernaan dan produksi VFA (terutama asam asetat) jerami padi dan daun kelapa sawit. Jerami padi memiliki kandungan selulosa yang lebih tinggi (59,35%) daripada rumput gajah (40,34%) dan serat sawit (45,62%) (Sopandi, 2007). Tingginya kandungan selulosa pada jerami padi disebabkan oleh proporsi kandungan ADF yang tinggi dan kadar lignin yang lebih rendah. McDonald et al. (1988) menyatakan
bahwa lignin merupakan komponen dinding sel yang sulit dicerna oleh bakteri, sehingga dengan kadar lignin yang lebih rendah, bakteri akan lebih mudah mendegradasi zat-zat makanan yang terdapat dalam isi sel.
Hasil ini sejalan dengan penelitian Novianto (2009), bahwa konsentrasi VFA total tertinggi diperoleh pada pakan sumber serat jerami padi. Adanya silika pada jerami padi kemungkinan akan menghambat fermentasi selulosa, sehingga produksi VFA yang tinggi baru dapat dicapai pada saat 6 jam inkubasi (Novianto, 2009). Sementara itu, rumput gajah memiliki kandungan selulosa dan lignin yang lebih rendah. Hal ini menyebabkan rumput gajah lebih mudah difermentasi oleh bakteri rayap, sehingga dalam waktu inkubasi yang sama (6 jam) bakteri rayap telah menggunakan sebagian produksi VFA untuk pembentukan protein mikroba (Novianto, 2009). Serat sawit menghasilkan konsentrasi VFA total yang paling rendah dari ketiga bahan pakan. Hal ini disebabkan lignin yang terkandung pada serat sawit lebih tinggi daripada rumput gajah dan jerami padi, sehingga serat sawit membutuhkan waktu inkubasi yang lebih lama untuk mencapai konsentrasi VFA total yang optimum.
Pada penelitian ini, rataan konsentrasi VFA yang dihasilkan oleh isolat bakteri rayap A lebih tinggi dibandingkan dengan hasil penelitian sebelumnya yaitu 62,0±19,1 vs 46,5±34,7 mM, sebaliknya rataan konsentrasi yang dihasilkan isolat
bakteri rayap D lebih rendah, yaitu 62,1±18,4 vs 68,8±33,9 mM (Pradana, 2006). Perbedaan taraf inokulum bakteri dalam penelitian diduga menyebabkan konsentrasi VFA yang dihasilkan oleh isolat bakteri rayap A dan D pada penelitian ini dan penelitian Pradana (2006) berbeda.
Konsentrasi Amonia (NH3)
Kadar amonia dalam rumen merupakan petunjuk antara proses degradasi dan proses sintesis protein oleh mikroba rumen (McDonald et al., 2002). NH3 sangat
penting dalam proses pencernaan ternak ruminansia karena ammonia merupakan sumber nitrogen utama dan penting untuk pertumbuhan mikroba rumen dalam mensintesis protein selnya (Sutardi, 1980).
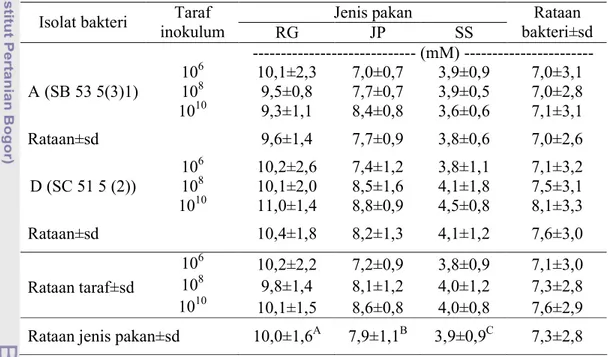
Tabel 2. Konsentrasi NH3 dari Pakan Sumber Serat yang Dihasilkan oleh
Isolat Bakteri Rayap pada Taraf Inokulum yang Berbeda Jenis pakan
Isolat bakteri Taraf
inokulum RG JP SS Rataan bakteri±sd --- (mM) --- 106 10,1±2,3 7,0±0,7 3,9±0,9 7,0±3,1 108 9,5±0,8 7,7±0,7 3,9±0,5 7,0±2,8 A (SB 53 5(3)1) 1010 9,3±1,1 8,4±0,8 3,6±0,6 7,1±3,1 Rataan±sd 9,6±1,4 7,7±0,9 3,8±0,6 7,0±2,6 106 10,2±2,6 7,4±1,2 3,8±1,1 7,1±3,2 108 10,1±2,0 8,5±1,6 4,1±1,8 7,5±3,1 D (SC 51 5 (2)) 1010 11,0±1,4 8,8±0,9 4,5±0,8 8,1±3,3 Rataan±sd 10,4±1,8 8,2±1,3 4,1±1,2 7,6±3,0 106 10,2±2,2 7,2±0,9 3,8±0,9 7,1±3,0 108 9,8±1,4 8,1±1,2 4,0±1,2 7,3±2,8 Rataan taraf±sd 1010 10,1±1,5 8,6±0,8 4,0±0,8 7,6±2,9
Rataan jenis pakan±sd 10,0±1,6A 7,9±1,1B 3,9±0,9C 7,3±2,8 Keterangan : RG = Rumput gajah, JP = Jerami padi, SS = Serat sawit
Superskrip huruf kapital berbeda pada baris yang sama menunjukkan perbedaan yang sangat nyata (P<0,01)
Hasil sidik ragam menunjukkan bahwa jenis pakan sumber serat berpengaruh sangat nyata (P<0,01) terhadap konsentrasi NH3. Cairan rumen dari sapi yang
berbeda tidak berpengaruh terhadap konsentrasi NH3, sama seperti faktor isolat
bakteri, taraf inokulum dan interaksi berbagai faktor. Berdasarkan uji ortogonal kontras, konsentrasi NH3 tertinggi dihasilkan pada pakan rumput gajah, kemudian
rayap berkisar antara 3,6-11,0 mM. Hal ini sejalan dengan konsentrasi NH3 cairan
rumen yang sesuai untuk pertumbuhan mikroba rumen berkisar antara 4-12 mM (Sutardi, 1980). Rataan konsentrasi NH3 yang dihasilkan dapat dilihat pada Tabel 2.
Konsentrasi NH3 yang dihasilkan berkaitan dengan kandungan protein pakan.
Rumput gajah (7,75%) dan jerami padi (7,72%) memiliki kandungan protein kasar lebih besar dibandingkan serat sawit (5,93%) (Selly, 1994). Menurut McDonald et al.
(2002), jika pakan defisien akan protein atau proteinnya tahan degradasi maka konsentrasi amonia dalam rumen akan rendah dan pertumbuhan mikroba rumen akan lambat yang menyebabkan turunnya kecernaan pakan. Kondisi ini juga dipengaruhi oleh kelarutan protein. Tingkat kelarutan protein suatu bahan makanan ternak berhubungan erat dengan kemudahannya terdegradasi dalam rumen (Sudiyati, 1994). Menurut Sutardi (1979), protein rumput gajah lebih mudah didegradasi oleh mikroba rumen. Jerami padi sulit dicerna karena telah mengalami lignifikasi bertaraf lanjut, sehingga sebagian besar karbohidratnya telah membentuk ikatan kokoh dengan lignin yang sulit dicerna (Sutardi, 1980). Kadar lignin pada jerami padi dan serat sawit lebih tinggi daripada kadar lignin rumput gajah. Rumput gajah memiliki kandungan lignin yang lebih rendah (10,51%) daripada jerami padi (13,16%) dan serat sawit (25,90%) (Sopandi, 2007). Kadar lignin ini cukup menghambat bakteri rayap dalam mendegradasi pakan, terutama dalam mengubah protein menjadi NH3.
Rataan konsentrasi NH3 rumput gajah, jerami padi dan serat sawit dalam
percobaan ini lebih rendah jika dibandingkan dengan hasil Pradana (2006) yaitu 10,0±1,6 vs 12,8±3,4 mM, 7,9±1,1 vs 14,3±2,5 mM dan 3,9±0,9 vs 10,1±1,8 mM. Hal ini disebabkan oleh perbedaan taraf inokulum isolat bakteri rayap yang digunakan. Pada penelitian ini taraf inokulum dibatasi pada kisaran 106 CFU/ml hingga 1010 CFU/ml, sedangkan pada penelitian Pradana (2006) tidak dibatasi taraf inokulum yang digunakan. Tidak adanya interaksi antara jenis pakan dengan faktor isolat bakteri rayap dalam penelitian ini sejalan dengan penelitian Sulistiani (2005), Pradana (2006) dan Sopandi (2007). Hal ini menunjukkan bahwa baik dikulturkan secara tunggal ataupun kombinasi, tidak berpengaruh terhadap aktifitas isolat bakteri dalam mencerna jenis pakan yang berbeda.
Konsentrasi NH3 pada penelitian ini tidak jauh berbeda dengan penelitian
rumen. Namun, hasil penelitian Puspitasari (2009) menunjukkan rataan konsentrasi NH3 yang lebih tinggi dari hasil penelitian ini. Hal ini disebabkan oleh kombinasi
bakteri pada penelitian Puspitasari merupakan kombinasi tri kultur, tetra kultur, dan penta kultur, sehingga interaksi antar bakteri yang saling menguntungkan dari kombinasi tersebut dapat meningkatkan konsentrasi NH3 yang dihasilkan.
Populasi Bakteri Total
Pola pertumbuhan bakteri dan protozoa rumen dipengaruhi oleh pola fermentasi yang ditunjukkan oleh proporsi molar VFA dan pH rumen (Hungate, 1966). Perkembangan populasi mikroba rumen terutama bakteri akan dibatasi oleh kadar amonia cairan rumen yang rendah, karena ini sangat diperlukan oleh bakteri sebagai sumber N untuk membangun sel tubuhnya (Preston and Leng, 1987). Rataan populasi bakteri total sebelum inokulasi pada percobaan in vitro dapat dilihat pada
Tabel 3. Populasi isolat bakteri rayap total setelah fermentasi in vitro berkisar antara
22,6×106 CFU/ml sampai dengan 313,8×106 CFU/ml (Tabel 4). Tabel 3. Perhitungan Populasi Bakteri Total Sebelum Inokulasi
Isolat bakteri Taraf inokulum Populasi bakteri (× 107 CFU/ml) 106 210 108 270 A (SB 53 5(3)1) 1010 5100 106 4,8 108 95 D (SC 51 5 (2)) 1010 4800
Populasi bakteri rayap total setelah fermentasi menunjukkan bahwa populasi bakteri rayap D lebih tinggi daripada populasi bakteri rayap A. Hasil ini bertentangan jika dilihat dari populasi bakteri total sebelum inokulasi, karena isolat bakteri rayap A diinokulasikan lebih banyak daripada isolat bakteri rayap D (Tabel 3). Hal ini diduga disebabkan oleh kemampuan isolat bakteri rayap D yang dapat beradaptasi dengan baik dalam kondisi rumen. Daya adaptasi yang baik ini juga didukung dari konsentrasi VFA total dan NH3 yang dihasilkan. Isolat bakteri rayap D dapat
menghasilkan konsentrasi VFA dan NH3 yang lebih tinggi daripada isolat bakteri