PEMBENIHAN UDANG VANNAMEI (Litopenaeus vannamei) DI BALAI BUDIDAYA AIR PAYAU SITUBONDO
Abdul Muqsith1) Farid Hidayat2)
1)
Program Studi Budidaya Perikanan Akademi Perikanan Ibrahimy
2)
Program Studi Budidaya Perikanan Akademi Perikanan Ibrahimy Abstrak
Perkembangan budidaya udang vannamei, di tambak dari tahun ketahun mengalami perkembangan yang sangat pesat, terutama perkembangan benih vannamei yang berkualitas. Untuk mendapatkan benih udang vannamei yang berkualitas harus memperhatikan dan menerapkan sistim pengelolaan induk, pengelolaan kualitas air, pemberian pakan, ablasi mata, pemijahan, pemanenan nauplius, penebaran nauplius, pemeliharaan larva, pemberian pakan, pengelolaan kualitas air, dan kultur pakan alami, dan proses pemanenan yang sesuai dengan teori dan kondisi lapangan. Sistim tersebut, dilakukan karena benih atau benur merupakan ujung tombak dari keberhasilan pembenihan dan pembesaran udang vannamei.Tujuan penelitian adalah untuk menjelaskan tentang Pembenihan
Udang Vannamei Litopenaeus vannamei pada sistim pengelolaan induk,
pengelolaan kualitas air, pemberian pakan, ablasi mata, pemijahan, pemanenan nauplius, penebaran nauplius, pemeliharaan larva, pemberian pakan, pengelolaan kualitas air, dan kultur pakan alami, dan proses pemanenan. Induk udang vannamei dari Balai Budidaya Air Payau (BBAP) Situbondo merupakan induk hasil
domestika (IHD) atau hasil inbreeding (kawin kekerabatan) yang telah
dikembangkan oleh BBAP Situbondo dan telah memenuhi persyaratan kualitas dan kuantitas yang baik dalam SNI induk udang vannamei, 2006. Metode ablasi mata digunakan untuk merangsang perkembangan gonad induk udang vannamei. Metode ablasi mata adalah memotong salah satu tangkai mata pada induk udang vannamei. Pemberian pakan induk udang vannamei, berupa pakan segar (tiram dan cacing laut) untuk merangsang perkembangan gonad. Dosis pemberian pakan segar 30 % per hari dari biomas udang. Pengelolaan kualitas air yang dilakukan dengan sistem flow trough sebanyak 200 % perhari. Pemijahan dilakukan dengan menggunakan metode bak maturasi terpisah untuk memudahkan dalam pengontrolan induk yang mating/kawin dan dapat menunjukkan hasil yang baik dengan tingkat persentase induk yang mating 27 % sampai dengan 34,9 % dari sampling induk yang matang gonad, serta hasil produksi nauplius menunjukkan angka cukup tinggi walaupun angka yang mating/kawin masih kurang.
Penebaran nauplius dilakukan dengan cara aklimatisasi dengan padat tebar 100 sampai 125 ekor/liter. Pakan larva yang diberikan berupa pakan alami dan pakan buatan. Pakan alami yang diberikan berupa Chaetoceros sp dan Artemia dengan frekuensi 2 kali pemberian pada sore dan malam hari, sedangkan pakan buatan yang diberikan berupa pakan komersial dengan jumlah dan frekuensi 8 kali pemberian pakan buatan. Pengendalian penyakit yang dilakukan
yaitu dengan pergantian air sebanyak 30 % pada stadia Mysis2sampai PL2 dan
PL3sampai panen sebanyak 40-50 % dari volume total air bak pemeliharaan larva,
dan penggunaan obat-obatan berupa treflan, formalin, aplikasi probiotik berupa sanuleve, serta penerapan biosecurity disetiap pintu masuk, sebelum dan sesudah memasuki ruangan. Pemanenan yang dilakukan telah menunjukkan kelangsungan hidup (SR) dengan angka yang relatife tinggi yaitu 24 % sampai 40 % dari hasil yang diperoleh. Dengan demikian, komponen kegiatan-kegiatan diatas saling terkait untuk menentukan keberhasilan panen ditambak.
Kata kunci : ablasi,kawin kekerabatan (inbreeding),air masuk dan keluar (flow trough)
PENDAHULUAN
Udang vannamei (Litopenaeus vannamei) masuk ke Indonesia pada tahun 2001 dan secara resmi pemerintah menetapkan udang vannamei sebagai varietas unggulan melalui SK Menteri KP No. 41/2001, dengan syarat induk udang vannamei yang digunakan adalah induk yang bebas dari spesifik pathogen free (SPF) dan spesifik pathogen resistens (SPR). Selanjutnya Oktiandi, (2009) menyatakan “bahwa keunggulan udang vannamei adalah resistensinya terhadap beberapa penyakit yang biasa menyerang udang, seperti WSSV (White Spote Syndrome Virus), TSV
(Taura Syndrome Virus) dan IHHNV (Infectious Hypodermal and
Hematopoietie Necrosis Virus)”. Dengan demikian induk udang vannamei dikembangkan oleh hatchery sampai sekarang untuk menghasilkan benur yang berkualitas. Untuk mempertahankan kualitas induk udang vannamei di pembenihan sedikitnya ada beberapa komponen yang mempengaruhi produksi diantaranya pemilihan induk, kualitas air, penanganan penyakit, pakan dan penerapan bio scurity di setiap pintu masuk, sebelum dan sesudah masuk ruangan.
Pemeliharaan larva juga sangat penting dalam menentukan produksi benur. Kegiatan pemeliharaan larva dimulai dari stadia naupli sampai post larva (PL) 12 yang dikenal dengan benih atau benur. Termasuk didalamnya kegiatan-kegiatan seperti persiapan bak, penebaran nauplius, penyediaan dan pemberian pakan, pengelolaan kualitas air, pengendalian penyakit dan proses pemanenan. (Wibowo, 2009). Komponen produksi tersebut saling terkait dan menentukan kualitas benur atau benih yang dihasilkan. Pada akhirnya akan menentukan keberhasilan dan optimasi panen dalam kegiataan pembesaran.
Kegiatan pembenihan udang vannamei (Litopenaeus vannamei) meliputi pengelolaan induk, perawatan telur, pengelolaan kualitas air, pemberian pakan, ablasi mata, pemijahan, pemanenan nauplius, penebaran nauplius, pemeliharaan larva pemberian pakan, pengelolaan kualitas air, dan kultur pakan alami, dan proses pemanenan yang sesuai dengan teori dan kondisi lapangan. utama dalam pembenihan udang vannamei adalah memproduksi benur yang berkualitas, yang dapat
mengatasi permasalahan dalam penyediaan benur untuk kegiatan
budidaya udang di tambak.
Penelitian ini bertujuan untuk menjelaskan Pembenihan Udang
Vannamei Litopenaeus vannamei pada sistim pengelolaan induk,
pengelolaan kualitas air, pemberian pakan, ablasi mata, pemijahan, pemanenan nauplius, penebaran nauplius, pemeliharaan larva, pemberian pakan, pengelolaan kualitas air, dan kultur pakan alami, dan proses pemanenan.Hasil penelitian diharapkan dapat memberikan penjelasan menegenai pembenihan Udang Vannamei Litopenaeus vannamei pada sistim pengelolaan induk, pengelolaan kualitas air, pemberian pakan, ablasi mata, pemijahan, pemanenan nauplius, penebaran nauplius, pemeliharaan larva, pemberian pakan, pengelolaan kualitas air, dan kultur pakan alami, dan proses pemanenan
METODE PENELITIAN
Penelitian ini dilaksanakan di Unit Pembenihan Udang Balai Budidaya Air Payau Situbondo pada bulan Februari sampai dengan April 2011. Metode yang digunakan dalam penelitian ini adalah deskriptif. Data primer
dikumpulkan melalui observasi dan wawancara langsung di lapangan. Data sekunder dikumpulkan melalui penelusuran berbagai pustaka yang terkait dengan meteri penelitian
HASIL DAN PEMBAHASAN Persiapan wadah dan air media
Bak induk berukuran 8 x 4x 1,2 m yang dilapisi dengan cat U-poxy berwarna biru muda dan dilengkapi dengan pipa saluran udara (instalasi aerasi), instalasi air laut, dan saluran pengeluaran yang dilengkapi saringan sirkulasi dan pipa goyang. Adapun sistem aerasi pada bak pemeliharaan induk menggunakan aerasi gantung dengan jarak antara titik 1m dan jarak dari dasar bak adalah 15 cm agar sisa pakan dan kotoran teraduk sehingga lumut tidak mudah tumbuh dan menempel pada dinding dan dasar bak.
Pencucian bak dilakukan dengan menggunakan kaporit 60% sebanyak 100 ppm yang dicampur dengan diterjen 5 ppm dan dilarutkan dengan air tawar pada wadah berupa ember kemudian dinding dan dasar bak digosok-gosok dengan menggunakan scoring pad dan dibilas dengan air tawar hingga bersih, kemudian dilakukan pengeringan selama 2 hari. Pencucian dan pengeringan bak ini bertujuan untuk menghilangkan dan mematikan mikroorganisme pembawa penyakit.
Pengisian air laut ke dalam bak induk dilakukan dengan menggunakan filter bag. Air laut langsung di transfer dari tandon yang sebelumnya telah dilakukan penyaringan dengan menggunakan filter fisik dan disinari UV dan ditampung pada bak tandon yang ditutup rapat serta dilakukan pemompaan ke tower yang dilengkapi UV pula.
Penebaran induk
Induk vannamei yang digunakan adalah dari hasil budidaya (domestika) yang telah dikembangkan dan mengikuti kaidah pemuliaan dan terpantau. (SNI induk udang vannamei, 2006 dalam Oktiandi, 2009). Sebelum induk vannamei dimasukkan ke dalam bak maturasi terlebih dahulu dilakukan seleksi induk. Adapun syarat kuantitatif induk udang vannamei yang baik yaitu umur minimal 12 bulan, panjang tubuh total induk betina minimal 18 cm dan jantan 17 cm sedangkan berat tubuh induk betina minimal 40 g dan jantan 35 g, periode peneluran setelah ablasi maksimal 6 bulan dan produksi nauplius minimal 100.000 ekor/individu. (Anonymous, 2006).
Selanjutnya menurut Oktiandi, (2009) mengatakan “ organ produksi induk udang vannamei dalam kondisi baik dan terbukti bebas virus WSSV (White Spote Syndrome Virus), TSV (Taura Syndrome Virus) dan IHHNV (Infectious Hypodermal and Hematopoietie Necrosis Virus) agar diketahui maka dilakukan uji dengan PCR (Polymerase Chain Reaction ). Apabila ditemukan penyakit atau pathogen yang dapat disembuhkan, maka induk harus diberi perlakuan pengobatan dengan cara dan bahan yang direkomendasikan, sedangkan apabila ditemukan penyakit atau pathogen yang tidak dapat disembuhkan maka induk udang harus dimusnahkan”. Persyaratan dimaksud dapat dilihat pada tabel.1
Tabel 1. Persyaratan kualitatif
Warna Punggung bening kecoklatan, transparan,
uropoda transparan
Bentuk Tubuh Anggota tubuh lengkap, punggung tidak
patah/retak Kesehatan
Tubuh tidak ditempeli parasit, tidak ada bercak hitam, tidak berlumut, tidak ada luka, insang bersih, tidak bengkak, lendir tidak berlebihan
Kekenyalan Tubuh Tidak lembek, tidak keropos
Gerakan Aktif normal, kaki, ekor membuka di dalam air
Sumber : BBAP Situbondo
Pengelolaan kualitas air
Pengelolaan kualitas air pada pemeliharaan induk dilakukan dengan cara pergantian air sistem flow trough yakni sebanyak 200 % dalam empat kali sehari dengan pergantian air masing-masing 50 % yaitu pukul 06.00, 12.00, 17.00, dan 21.00 WIB, jumlah ini bisa lebih apabila kondisi air dalam bak pemeliharaan induk jelek.
Mekanisme perawatan air dan bak pemeliharaan berlangsung sebagai berikut. Pipa goyang dibuka untuk mempercepat pergantian air, agar kotoran atau feses serta pakan yang tersisa jelas dan tidak tersuspensi ketika disiphon maka aerasi dimatikan. Setelah dasar bak kembali terlihat bersih maka penyiponan diberhentikan, kotoran berukuran besar diserok dan aerasi dihidupkan kembali, jika kotoran cukup banyak yang melekat dan sulit dihilangkan maka digosok menggunakan scoring pad dan pisau dengan cara turun langsung ke dalam bak pemeliharaan induk dan penggosokan tidak boleh terlalu lama, karena untuk mencegah stress. Peralatan yang telah digunakan kemudian dicuci dengan larutan kaporit.
Pengelolaan pakan
Pakan yang diberikan adalah pakan yang mengandung nutrisi yang baik untuk perkembangan gonad udang vannamei. Pakan segar yang dapat memacu perkembangan gonad udang vannamei adalah cacing laut (Nereis sp) atau cacing tanah (Lumbricus sp), juga diberikan tiram/kerang-kerangan dengan jumlah untuk cacing 9 % dan kerang-tiram/kerang-kerangan 16 % dari total biomas per hari (Subaidah et. al. 2009). Jenis pakan yang diberikan berupa pakan segar yaitu tiram (Gambar 2.1) dan cacing laut (Gambar 2.2). Pemberian pakan dilakukan 4 kali dalam sehari, yaitu jam 06.00, jam 12.00, jam 17.00, dan jam 21.00 WIB. Agar pakan tetap segar maka pakan harus disimpan dalam freezer. Pakan yang beku dicairkan dulu beberapa jam sebelum pakan diberikan. Pakan yang diberikan sebanyak 30 % dari biomass udang vannamei. Pemberian vitamin juga dapat mempercepat pertumbuhan induk udang vannamei. Untuk lebih jelasnya jenis pakan yang diberikan dapat dilihat pada gambar 1 dan gambar 2 adalah sebagai berikut :
Gambar 1: tiram Gambar .2 : cacing laut Tabel 2. : jenis, dosis dan waktu pemberian pakan
Jenis pakan
Dosis (%) dan waktu pemberian pakan buatan Jumlah dosis (%) 06.0 0 12.00 17.00 21.00 Tiram 25 % 25 % 50 % Cacing Laut 25 % 25 % 50 %
Sumber : BBAP Situbondo
Pada data tabel 2 diatas terlihat bahwa pemberian tiram dan cacing laut mempunyai kandungan protein yang tinggi sehingga menjadikan daya tahan tubuh induk udang vannamei terhadap penyakit meningkat dan mempercepat perkembangan gonad. Selanjutnya menurut Kokarkin, et. al. (1986) dalam Jabarullah, (2007), bahwa pakan yang banyak mengandung protein hewani diperkirakan cukup mengandung vitamin sehingga dapat menjaga daya tahan tubuh terhadap penyakit dan cacing mempunyai kandungan yang tinggi. Cara penghitungan pemberian pakan dalam satu hari digunakan rumus:
∑ Pakan = ∑ Udang x BB x 30 %.
Ablasi
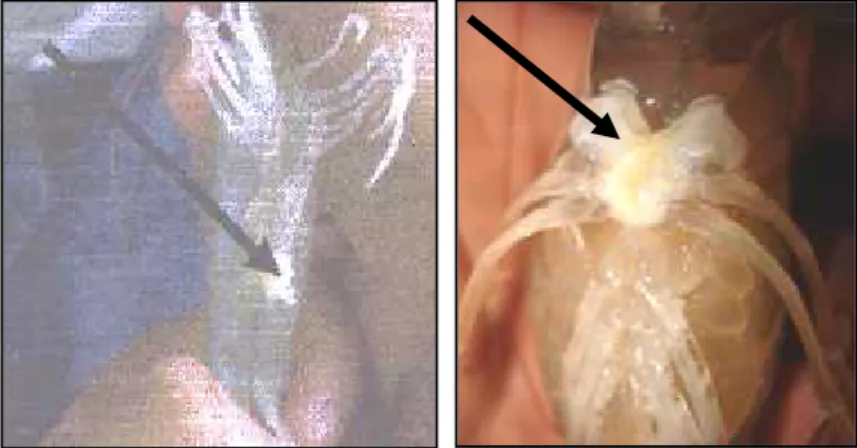
Ablasi merupakan salah satu cara untuk mempercepat perkembangan gonad pada induk betina udang vannamei dengan cara memotong salah satu tangkai matanya. Hormone pengontrol reproduksi atau organ X pada udang vannamei terletak pada tangkai mata, sehingga untuk mendorong berkembangnya ovary maka hormone penghambat (Gonadropin Inhibiting Hormone) yang terletak di organ X harus dihilangkan dengan cara ablasi salah satu tangkai mata, karena dengan ablasi diharapkan GSH (Gonadropin Stimulating Hormone) segera terjadi sehingga dapat merangsang perkembangan ovary induk udang. Hal ini senada dengan Kokarkin, et. al. (1986) dalam Suprianto (2008), berpendapat bahwa ablasi pada prinsipnya adalah menghilangkan fungsi kelenjar sinus dan organ X yang ada pada mata. Kelenjar tersebut berfungsi menghasilkan hormone Gonadropin Inhibiting Hormone (GIH). Fungsi dari GIH dapat secara langsung menghambat perkembangan ovary pada induk betina.
satu tangkai mata dengan penjepit panas. Adapun teknik ablasi mata adalah dengan cara induk betina yang akan diablasi di tangkap menggunakan seser, kemudian satu persatu dilakukan ablasi dengan posisi induk dipegang dengan tangan kiri, kemudian lengkungkan badan udang dengan ibu jari di atas carapace, dan ketiga jari lainnya memegang perut dan kaki, sedangkan jari kelingking dibagian ekor dalam keadaan melengkung. Karet yang ada di lengan tangan kiri menarik salah satu tangkai mata induk udang sampai bola matanya keluar, kemudian salah satu tangkai matanya digunting yang dipanaskan. Setelah ablasi, induk betina tersebut di letakkan pada tempatnya. Setelah 4-7 hari pasca ablasi induk udang vannamei akan matang gonad, kemudian dilakukan sampling matang gonad untuk dikawinkan. Untuk lebih jelasnya teknik ablasi mata dapat dilihat pada gambar 3 sebagai berikut :
Gambar 3 : teknik ablasi mata.
Sampling kematangan gonad
Sampling kematangan gonad dilakukan dua kali dalam sehari semalam yaitu pada siang hari dan sore hari jam 12.00 dan 17.00 WIB dengan menggunakan seser. Induk betina yang sudah matang gonad ditandai dengan perkembangan ovary yang nampak tebal di bagian dorsal (punggung) sampai kepala, melebar dari ruas abdomen dengan warna orange, sedangkan pada induk jantan kematangan gonad terlihat jelas pada kantong sperma (spermatophore) yang berwarna putih terisi sperma.Untuk lebih jelasnya induk jantan dan betina yang matang gonad dapat dilihat pada gambar 4 dan 5 dibawah ini :
Perkawinan
Bak pematang, antara bak induk betina dengan bak induk jantan dipisah bertujuan untuk memudahkan perkawinan terkontrol. Induk betina yang matang gonad dipindah ke bak pematang induk jantan yang sudah matang gonad pada siang hari dan sore hari yaitu pada jam 12.00 dan 17.00 WIB untuk dikawinkan, setelah kawin induk betina dipindah ke bak penetasan pada jam 21.00 WIB dengan ditandai induk betina pada permukaan telycum yang ditempeli sperma secara sempurna dan utuh dengan berbentuk V. Apabila penempelan kurang sempurna dan tidak utuh dinyatakan kurang matangnya induk betina atau rusaknya kantung sperma yang disebabkan kerasnya sentakan udang pada saat diambil atau dipegang. Untuk lebih jelasnya dapat dilihat pada gambar 6 dibawah ini :
(a) (b)
Gambar 6 : a. sperma yang menempel pada kaki renang (salah) b. sperma yang menempel pada telycum (benar)
Perkawinan terjadi pada setiap waktu karena kondisi gelap yang menyerupai malam hari. Proses perkawinan dimulai dengan berenangnya induk betina yang kemudian diikuti salah satu atau beberapa induk jantan. Induk jantan mengikuti induk betina dikarenakan pada saat itu induk betina mengeluarkan feromone. Hal ini senada dengan Wyban and Sweeney, (1991) dalam Subaidah, et. al. (2006), bahwa pada saat induk betina yang matang gonad akan mengeluarkan feromene sehingga menarik induk jantan akan berenang sejajar di bawah induk betina. Dengan feromene inilah induk jantan terangsang mengikuti induk betina dan mating serta sperma yang dikeluarkan/ditempeli pada telycum bagian luar, sehingga 1-2 jam kemudian udang betina akan segera mengeluarkan telur dan terjadi pembuahan. (Wyban and Sweeney, 1991 dalam Oktiandi, 2009). Adapun persentase mating pada induk udang vannamei betina dapat dilihat pada tabel 3 dibawah ini :
Tabel 3. Persentase mating induk udang vannamei betina
No Sampling Mating SR (%) Naupli
1 106 29 27 1.600.000 2 96 23 23 1.800.000 3 68 18 26 1.900.000 4 119 39 32 3.300.000 5 66 22 33 2.100.000 6 99 40 40 4.000.000 7 109 38 34.9 4.100.000
Sumber : BBAP Situbondo
Dari data tabel 3 menunjukkan tingkat persentase induk yang kawin/mating masih kurang, akan tetapi naupli yang diperoleh sudah menunjukkan angka yang relatif tinggi.
Peneluran dan penetasan telur
Derajat pembuahan dan penetasan sangat ditentukan oleh kualitas
sperma dan kemampuan penempelan pada telycum serta media
penetasan dengan temperatur 31 0C. Telur menetas dalam jangka waktu
16-18 jam dan di panen ke esokan harinya, hal ini sesuai dengan pendapat Oktiandi, (2009). Kepadatan induk yang matang gonad pada saat
peneluran berkisar 4-5 ekor/m2dari kapasitas bak peneluran 3 x 4 x 1,25
m. Untuk lebih jelasnya dapat dilihat pada tabel 4.5 di atas. Dari tabel 4.5 menunjukkan bahwa tingkat kematangan gonad induk udang vannamei sudah mencapai angka yang relatif sedang.
Bak peneluran sekaligus bak penetasan telur diisi air laut sebanyak 10 ton melalui saringan filter bag ukuran 10 mikron, lalu ditraitmen dengan EDTA sebanyak 5 ppm kemudian diaerasi. Induk yang mating/kawin dipindah ke bak peneluran/penetasan telur pada malam hari jam 21.00 WIB, 10-12 jam kemudian induk akan melepaskan telurnya, dan ke esokan harinya induk diangkat dan dikembalikan ke bak pematangnya pada jam 06.00 pagi hari, kemudian aerasi dinyalakan dan heacter (pemanas)
dinyalakan hingga suhu mencapai 310C.
Pemanenan nauplius
Pemanenan nauplius dilakukan pada sore hari dengan menyeser naupli yang berkumpul di dalam waring. Adapun mekanisme pemanenan ialah waring disambung pada pompa pengeluaran air yang ditempatkan disamping bak penetasan telur yang telah diisi air laut sebanyak 3 ton dari kapasitas volume 8 ton, kemudian pipa pengeluaran pada bak penetasan dibuka, sehingga naupli akan berkumpul di waring, apabila jumlah naupli di waring padat maka di seser pelan-pelan kemudian di tampung dalam ember 30 liter yang
berisi air laut bersih, kemudian di aerasi) dan pemanenan nauplius dilakukan pada sore hari.
Pengamatan nauplius
Sampel naupli diambil dengan beaker glass volume 10 ml di dalam ember plastik volume 30 liter, kemudian dituang ke dalam petri dish bergaris yang ditambah dengan air tawar supaya naupli tidak terlalu bergerak/mati serta dialasi kertas berwarna hitam agar lebih jelas, kemudian dilakukan perhitungan. Jumlah naupli (tabel 3.5) yang ada didalam wadah tersebut di hitung dengan alat Bantu “Hand Counter” dengan rumus :
∑ Naupli sampling
∑ Total Naupli = x ∑ Vol. total air (ember) ∑ Vol. air sampling
∑ Naupli yang dihasilkan
HR = x 100 %
∑ Total telur yang dihasilkan.
Pemeliharaan Larva Persiapan bak
Bak pemeliharaan larva udang vannamei dilapisi dengan cat U-Poxy berwarna hijau kebiruan dan dilengkapi dengan pipa saluran udara (instalasi aerasi), instalasi air laut, dan saluran pengeluaran yang dilengkapi saringan sirkulasi dan pipa goyang sesuai dengan pendapat (Wibowo, 2009). Bak dengan bentuk bulat dengan ukuran Ø 4,25 x 1,15 m yang memudahkan dalam pengelolaan dan bagus bagi larva karena tidak ada titik matinya.
Bak pemeliharaan larva ditutup dengan terpal plastik trasparan tembus cahaya supaya suhu tetap stabil selama proses pemeliharaan larva. Hal ini
sesuai dengan Ditjenkan (1991) dalam Jabarullah (2007), yang
menyatakan untuk mengatasi penurunan suhu air pada malam hari bak larva perlu diberi penutup dari terpal plastik. Adapun sistem aerasi pada bak pemeliharaan larva menggunakan aerasi gantung dengan jarak antar titik 40 cm dan jarak dari dasar bak adalah 5 cm agar sisa pakan dan kotoran teraduk sehingga lumut tidak mudah tumbuh dan menempel pada dinding dan dasar bak.
Bak yang telah selesai digunakan dalam proses pemeliharan larva dicuci dengan menggunkan deterjen, seluruh permukaan dinding dan dasar bak di gosok-gosok dengan menggunakan scoring pad atau spon bertujuan untuk menghilangkan kotoran atau lumut yang menempel di bak, kemudian dibilas dengan air tawar sampai bersih setelah itu disiram dengan larutan kaporit 25 ppm keseluruh permukaan bak dan biarkan hingga kering selama 2-3 hari dan bila kotoran atau lumut terlalu tebal, maka disiram dengan larutan kaporit dengan dosis ± 50 ppm. Apabila bak akan digunakan maka bak dan perlengkapan lainnya dicuci dengan deterjen, kemudian bak diisi air laut sebanyak 8 ton dari total volume bak 9 ton dengan menggunakan filter bag kemudian aerasi dihidupkan dan air ditreatmen dengan treflan 0,5 ppm.
Penebaran nauplius
Penebaran nauplius ke bak pemeliharaan larva dilakukan dengan hati-hati dan tidak langsung dimasukkan, tetapi melalui proses aklimatisasi atau penyesuain diri terhadap lingkungan dengan tujuan untuk menghindari
perubahan temperatur air yang drastis pada bak pemeliharaan larva. Hal ini senada dengan Wibowo (2009) yang menyatakan bahwa aklimatisasi bertujuan untuk menyesuaikan naupli dengan perubahan kondisi lingkungan air di bak pemeliharaan larva.
Proses aklimatisasi dilakukan dengan cara baskom/ember yang sudah terisi naupli diapungkan di dalam bak pemeliharaan sambil memasukkan air laut sedikit demi sedikit sampai penuh dengan menggunakan selang kecil dan biarkan naupli keluar dengan sendirinya yang ditandai dengan mengumpulya naupli kepermukaan air kemudian secara perlahan-lahan dituangkan dalam bak pemeliharaan agar tidak setres. Selesai penebaran, maka bak pemeliharaan ditutup dengan terpal plastik berwarna putih trasparan agar suhu tetap stabil.
Sumber naupli yang diperoleh adalah naupli dari BBAP IPU Gelung
Situbondo dengan naupli yang ditebar adalah naupli muda (N3-4), hal ini
bertujuan agar menekan ganguan proses metamorfosis sekecil mungkin dari stadia naupli ke stadia protozoea 1, karena pada proses pemeliharaan larva udang putih vannamei sering dikenal dengan istilah zoea syndrome atau zoea lemah. Dimana pada fase ini larva kelihatan lemah dan tubuh kotor yang dapat menyebabkan kematian hingga 90% (Elovaara, 2001) dalam (Wibowo, 2009). Hal ini berbeda dengan Wyban (1991) dalam Wibowo (2009) yang menyatakan naupli yang baik untuk dilakukan
pemanenan adalah N5-6. Pada stadia ini belum diberi pakan tambahan
karena mulut larva muda ini belum berkembang dan makanan masih tergantung pada kuning telur. Pada keesokan harinya baru dimulai diberikan Chaetoceros sp. Untuk lebih jelasnya penebaran dan aklimatisasi dapat dilihat pada gambar 7 sebagai berikut :
Gambar 7 : penebaran nauplius dan aklimatisasi suhu
Pengelolaan kualitas air
Pengelolaan kualitas air pada pemeliharan larva udang vannamei di IPU Gelung Situbondo dilakukan dengan cara pengukuran kualitas air dan pergantian air. Pengelolaan kualitas air dimaksudkan untuk meningkatkan atau menjaga kualitas air agar tetap dalam kondisi stabil.
Pergantian air
Pergantian air mulai dilakukan pada stadia Mysis2 sebanyak 30 %
sampai PL2, dan PL3 sampai panen 40-50 % dari total volume bak
bahan organik yang terkandung dalam media pemeliharaan dengan terlihatnya warna air dan banyaknya busa. Hal ini sesuai dengan pendapat Wibowo (2009), yang menyatakan bahwa pergantian air dilakukan setelah
mencapai stadia Mysis3 sampai dengan PL5 berkisar 10-30 % dan PL5
sampai panen 30-50 % dari volume bak pemeliharaan yang terisi. Hal ini juga dilakukan berdasarkan pengamatan warna perairan secara visual bila terjadi blooming plankton atau banyak larva yang mati. Pergantian air ini dimaksudkan untuk mengurangi kepadatan protozoa tersebut sehingga tidak menimbulkan gangguan pada larva.
Penyiponan dilakukan pada pagi hari saat dasar bak pemeliharaan terlihat banyak kotoran yang disebabkan adanya feces, moulting serta sisa pakan yang tidak termakan dengan cara pipa sipon berbentuk T diturunkan ke dalam air bak pemeliharaan yang ujungnya disambung dengan selang plastik kemudian dikeluarkan dan ditadah pada baskom/ember yang bersaring. Hal ini senada dengan Wibowo (2009) yang menyatakan penyiponan dilakukan dengan menggunakan pipa PVC yang berdiameter ½ inchi dan ujungnya diberi ujung penghisap berupa T yang telah dimodifikasi dengan dasar bak pemeliharaan larva. Setelah penurunan selesai, pipa goyang dinaikkan dan penambahan volume air sesuai yang dikehendaki melalui filter bag. Untuk lebih jelasnya pergantian air pada bak pemeliharaan larva dapat dilihat pada gambar 8 dan tabel 4 di bawah ini :
Gambar 8 : pergantian air
Tabel .4 : pergantian air dan ukuran saringan pada pemeliharaan larva
No Stadia Volume Bak Pergantian air Ukuran saringan
1 N 5 2 N6 5,5 3 Z1 6 4 Z2 6,5 5 Z3 7 6 M1 7,5 7 M2 8 30 250-300 8 M3 8 30 250-300 9 PL1 8 30 300 10 PL2 8 40 300 11 PL3 8 50 300 12 PL4 8 50 300 13 PL5 8 50 300
Pengukuran Kualitas Air Temperatur
Pengamatan temperatur selama pemeliharaan larva udang vannamei
yang ada di IPU Gelung Situbondo berkisar 32 - 33 0C. Tingginya
temperatur disebabkan oleh penempatan bak di dalam (indoor) ruangan dengan menggunakan atap dari asbes transparan sehingga temperatur ruangan cepat mengalami fluktuasi sehingga panas dalam air mengikuti perubahan temperatur ruangan hal ini sesuai dengan Subaidah et. al. (2006), yang menyatakan bahwa suhu untuk pemeliharaan larva berkisar
pada 29 - 32 0C. Peningkatan suhu akan menyebabkan peningkatan
kegiatan metabolisme udang itu sendiri. Suhu dapat mempengaruhi kelarutan oksigen di dalam air dan juga mempengaruhi fisiologis seperti efesiensi pakan, tingkah laku, pertumbuhan dan reproduksi. Oleh karena itu, bila kondisi suhu tinggi, maka dilakukan penurunan suhu dengan cara menempeli pelepah pohon kelapa, membuka jendela atau perlakuan lainnya.
Salinitas
Hasil pengukuran salinitas pada bak pemeliharaan larva menunjukkan angka yang stabil yaitu 28 - 34 ppt. Hal ini senada dengan Subaidah et. al. (2006), yang menyatakan bahwa kisaran salinitas untuk pemeliharaan larva 35 ppt yang sesuai dengan kondisi di alamnya. Jika permintaan konsumen pada salinitas rendah untuk benih/benur yang siap tebar di tambak maka perlu dilakukan penurunan salinitas di panti pembenihan. Pengamatan di lapangan menunjukkan salinitas lebih rendah dengan kisaran 5 ppt. Penurunan salinitas dilakukan disaat beberapa hari menjelang akan dipindah ke tambak untuk pembesaran. Salinitas diturunkan dimaksudkan untuk menyesuaikan benur dengan media yang digunakan untuk pemeliharaan yaitu air tambak. Mekanisme yang dilakukan yaitu mencampur air tawar pada saat pergantian air dengan 3 ppt/hari. Adapun alat yang digunakan yaitu refraktometer.
Derajat keasaman (pH)
Berdasarkan hasil pengukuran pH di bak pemeliharaan larva dari penebaran nauplius sampai pemanenan berkisar 7 - 8. Kisaran pH ini masih dalam batas optimal untuk pemeliharaan larva udang vannamei hal ini juga diungkapkan oleh Elovaara (2001) dalam Jabarullah (2007), yang menyatakan bahwa udang vannamei mempunyai kisaran pH yang ideal adalah 6,5 - 9. Bila pH air dibawah 6,5 dapat menurunkan laju pertumbuhan larva. Adapun alat yang digunakan yaitu kertas lakmus.
Pengelolaan pakan
Jenis pakan yang diberikan pada larva udang vannamei selama proses pemeliharaan ada dua jenis yaitu pakan alami dan pakan buatan. Masing-masing pakan tersebut diberikan dengan jumlah dan frekuensi tertentu sesuai dengan stadia larva. Jenis pakan alami yang dikultur adalah Chaetoceros sp dan Artemia.
Pemberian algae (Chaetoceros sp) dimulai dari stadia naupli5-6sampai
PL2-4 dengan cara memompa algae ke bak pemeliharaan melalui selang
kotoran yang masuk dan sebelum dimasukkan ke bak pemeliharaan, selang plastik dibiarkan 2-3 menit untuk mengeluarkan sisa algae atau kotoran yang sebelumnya dilakukan pemanenan. Pada saat memasuki
stadia mysis3pemberian pakan alami dari jenis zooplankton berupa artemia
mulai diberikan sampai panen dengan cara mengambil artemia yang telah dikultur sebelumnya. Sedangkan pakan buatan diberikan mulai stadia
zoea2 sampai panen dengan cara menimbang pakan padatan sedangkan
pakan cair ditakar dengan menggunakan sendok plastik ukuran 10 ml, kemudian dimasukkan ke beaker plastik volume 2 liter kemudian diaduk dan di tebar merata ke bak pemeliharaan. Untuk lebih jelasnya jenis dan cara pemberian pakan buatan dapat dilihat pada gambar 9 dan 10 juga tabel 5 sebagai berikut :
Gambar 9 : pakan buatan Gambar 10: pemberian pakan Tabel 5 : dosis, jenis dan waktu pemberian pakan buatan
Stadia Dosis (gr) Jenis dan Waktu Pemberian Pakan Buatan
01.00 04.00 07.00 10.00 13.00 16.00 19.00 22.00 N6 Z1 Z2 5 RL* CAR EP1 NS1 RL CAR EP1 NS1 Z3 5 RL CAR EP1 NS1 RL CAR EP1 NS1 M1 10 RL CAR EP1 NS1 RL CAR EP1 NS1 M2 10 RL CAR EP1 NS1 RL CAR EP1 NS1 M3 10 RL ** CD2 EP2 NS2 RL CD2 EP2 NS2 PL1 10 RL CD2 EP2 NS2 RL CD2 EP2 NS2 PL2 10 RL CD2 EP2 NS2 RL CD2 EP2 NS2 PL3 15 RL CD2 EP2 NS2 RL CD2 EP2 NS2 PL4 15 RL *** CD2 EP2 NS2 RL CD2 EP2 NS2 PL5 15 RL CD2 EP2 NS2 RL CD2 EP2 NS2 PL6 15 RL CD2 EP2 NS2 RL CD2 EP2 NS2 PL7 15 RL CD2 EP2 NS2 RL CD2 EP2 NS2 PL8 20 RL CD2 LZ CD2 RL CD2 LZ CD2 PL9 20 RL CD2 LZ CD2 RL CD2 LZ CD2 PL10 20 RL CD2 LZ CD2 RL CD2 LZ CD2
Sumber : seksi IP Gelung Situbondo Ket :
REALL* : Zoea CAR : Frippak 1
**
: M-PL CD : Frippak 2
***
: PL EP : EPIFEED LHF 1, LHF 2 NS : Nosan R-1, R-2 LZ : Lanzy
Kultur pakan alami (Chaetoceros sp) Kultur skala intermediate dan massal Persiapan wadah air media
Untuk bak kultur intermediate dan massal dicuci dengan larutan kaporit
yang dicampur deterjen, kemudian dibilas dengan air tawar dan
dikeringkan selama 1 hari, jka ingin dipakai maka dibilas kembali dengan air tawar. Sedangkan air laut untuk kultur intermediate dan massal disaring dengan filter bag ukuran 10 µ, kemudian air media kultur intermediate di treatment dengan kaporit 1 g/100 liter air laut dan untuk kultur massal ditreatment dengan kaporit 1 ppm, kemudian dinetralkan dengan thio sulfat dengan dosis seperdua dari dosis kaporit.
Kultur intermediate
Bak dicuci dengan air tawar kemudian diisi air laut sebanyak 250 liter dari kapasitas bak kultur 300 liter dengan menggunakan filter bag ukuran 10 µ dan air media ditreatment dengan kaporit sebanyak 1 g/100 liter air laut yang dilarutkan dalam beaker glass volume 250 ml yang diaduk sampai larut dan keesokan harinya dinetralkan/chlorinisasi kandungan kaporit yang tersisa dengan menggunakan thio sulfat dengan dosis seperdua dari kaporit yang diberikan, kemudian cek dengan chlorine test, jika masih berwarna kuning berarti kandungan kaporitnya masih ada dan perlu diberikan atau dinetralkan kembali dengan thio sulfat, tetapi jika sudah bening berarti sudah netral. Setelah air media netral maka diberikan pupuk Nitrat Posfat (NP) dan Silikat masing-masing dosis 10 ml/100 liter pada air media kultur dan vitamin 1 ml/100 liter serta epyzim 5 ml/100 liter, kemudian starter dari carboy volume 10 liter dipindahkan ke bak fiber glass (300 liter) atau bak kultur, setelah 3 hari kelihatan blooming maka siap ditrasfer ke bak kultur massal. Untuk lebih jelasnya kultur intermediate dapat dilihat pada gambar 11 dibawah ini :
Kultur massal
Bak dicuci dengan air tawar kemudian diisi air laut 6,5 ton dari kapasitas bak kultur 10 ton dengan menggunakan filter bag ukuran 10 µ, dan air media ditreatment dengan kaporit sebanyak 10 g/ton yang dilarutkan dalam beaker glass volume 2 liter yang diaduk sampai larut dan keesokan harinya dinetralkan/chlorinisasi kandungan kaporit yang tersisa dengan menggunakan thio sulfat dengan dosis seperdua dari dosis pemberian kaporit, kemudian cek dengan chlorine test, jika masih kuning berarti kandungan kaporitnya masih ada dan perlu diberikan atau dinetralkan kembali dengan thio sulfat, tetapi jika sudah bening berarti sudah netral. Setelah air media netral maka pemberian pupuk Nitral Posfat (NP) dan Silikat masing-masing 100 ml/ton air media kultur dan vitamin 1 ml/ton serta epyzim 50 ml, kemudian starter dari kultur intermediate dipindahkan ke bak fiber glass volume 10 ton setelah 3 hari kemudian maka siap untuk ditrasfer ke bak pemeliharaan larva. Untuk lebih jelasnya kultur massal dapat dilihat pada gambar 12 dibawah ini :
Gambar 12 : kultur massal
Pengamatan algae
Sampel algae diambil dengan menggunakan pipet dan tuangkan dalam beaker plastik 5 ml, kemudian diteteskan pada haemocytometer lalu ditutup dengan kover glass, haemocytometer diletakkan dibawah mikroskop dan dilakukan pengamatan dan perhitungan kepadatan sel algae. Kepadatan sel algae dapat dihitung dengan rumus :
Jumlah sel pada haemocytometer
Ka = ──────────────────── X 104sel/ml
4 Keterangan : Ka = Kepadatan Algae
Dekapsulasi artemia
Cyste artemia yang baru dibuka dari kaleng dituang dalam ember volume 16 liter dan dicuci dengan air tawar, kemudian artemia direndam dalam ember yang berisi air tawar ± 6 liter dan diberi chlorine dan soda api
dengan perbandingan 2 : 1 serta diaerasi kuat selama ± 10-15 menit,
setelah didekapsulasi cyste artemia dimasukkan ke dalam ember
berlubang dengan saringan 100 µ dan dibilas hingga bersih dengan air tawar sambil menggosok-gosok kelantai atau pada ember. Proses dekapsulasi diakhiri dengan perubahan warna artemia menjadi merah bata dan pada biasanya dilakukan 2-3 kali, kemudian dibilas dengan air tawar sampai bau chlorine hilang. Telur artemia yang telah didekapsulasi di masukkan ke dalam fiber glass yang berisi air laut 200 liter dengan kapasitas volume fiber glass 250 liter dan diaerasi kuat, telur menetas 24 jam dikultur. Setelah menetas, artemia dipanen dengan cara aerasi dimatikan terlebih dahulu biarkan 10-15 menit supaya cyste artemia yang tidak menetas mengendap di dasar bak, setelah waktu yang diinginkan tercapai maka artemia disipon dengan menggunakan selang plastik lalu ditampung ke dalam ember berlubang yang dilengkapi saringan 100 µ, kemudian artemia dicuci dengan air laut sampai bersih dan dimasukkan ke dalam ember yang berisi air laut 12 liter dan ditebar rata pada bak pemeliharaan larva.
Pengamatan kondisi dan perkembangan larva
Pengamatan kondisi larva merupakan cara untuk melihat
perkembangan dari setiap larva. Pengamatan yang dilakukan selama pemeliharaan larva yaitu ada dua (2). Pertama pengamatan secara visual yaitu mengamati secara kasat mata dengan cara mengambil sampel langsung dari bak pemeliharaan sebanyak 500 ml dengan besker glass kemudian diarahkan ke cahaya untuk melihat kondisi tubuh larva, pigmentasi, usus, sisa pakan atau feces dan butiran-butiran yang dapat membahayakan larva (a). Sedangkan pengamatan kedua yaitu mengamati secara mikroskopis dengan cara mengambil beberapa ekor larva dan diletakkan diatas objek glass kemudian diamati (b). Pengamatan ini dilakukan untuk melihat dan mengamati morfologi tubuh larva, keberadaan parasit, pathogen yang menyebabkan larva terserang penyakit, selain itu dilakukan pula sampling yang berfungsi untuk mengetahui tingkat kelangsungan larva udang vannamei (tabel 2.6). Sampling dilakukan pada setiap stadia dengan mengambil larva sampling di bak pemeliharaan menggunakan beaker glass volume 500 ml pada 4 - 5 tempat, kemudian dituangkan ke mangkok plastik dan dihitung secara perlahan-lahan.
(a) (b) Gambar 13(a.) pengamatan visual ; 13(b). pengamatan mikroskop
Tabel 6 : tingkat kelangsungan larva udang vannamei Stadia Bak Jenis Bak Volume Jumlah ∑Larva
Sampling SR (%) Zoea3 A1 Beton 7 1.250.000 1.008.000 80,64 A2 Beton 7 1.250.000 1.078.000 86,24 A3 Beton 7 1.250.000 1.148.000 91,84 A4 Beton 7 1.250.000 1.218.000 97,44 Mysis3 A1 Beton 8 1.250.000 848.000 67,84 A2 Beton 8 1.250.000 992.000 79,36 A3 Beton 8 1.250.000 1.072.000 85,76 A4 Beton 8 1.250.000 1.152.000 92,16 PL5 A1 Beton 8 1.250.000 352.000 28,16 A2 Beton 8 1.250.000 512.000 40,94 A3 Beton 8 1.250.000 768.000 61,44 A4 Beton 8 1.250.000 928.000 74,36
Sumber : BBAP IPU Gelung Situbondo
Dari data tabel 6 diatas menunjukkan bahwa tingkat kelangsungan hidup larva setiap pergantian sub stadia mengalami penurunan karena setiap pergantian stadia akan mengalami kematian yang disebabkan oleh ketahanan tubuh, menangkap pakan, pengeolaan kualitas air dan lain sebagainya. adapun rumus yang digunakan dalam perhitungan tingkat kelangsungan larva adalah sebagai berikut :
∑ Larva Sampling
∑ Larva = ──────────── X ∑ Vol. Air Bak Pemeliharaan ∑ Vol. Air Sampel
Stadia nauplius
Pada stadia ini belum diberi pakan tambahan karena mulut larva pada stadia ini belum berkembang dan makanan masih tergantung pada kuning telur. Dan pada keesokan harinya baru dimulai diberikan Chaetoceros sp.
Secara visual stadia ini terlihat seperti laba-laba yang kecil dengan gerakan renang yang tersendat-sendat, berhenti sebentar kemudian melanjutkan renang setelah sampai permukaan akan turun perlahan-lahan dan sebelum mencapai kepermukaan dasar berenang kembali seperti semula. Pembagian tubuh atas karapas dan abdomennya belum terlihat jelas dimana naupli-1 badan berbentuk bulat telur dengan tiga pasang anggota tubuh ; naupli-2 pada ujung antenna pertama terdapat setae yang satu panjang dan dua buah yang pendek; naupli-3 dua buah furctel mulai tampak jelas dengan masing-masing tiga duri, tunas maxilliped mulai tampak; naupli-4 masing-masing furctel terdapat empat buah duri, antenna kedua beruas-ruas; naupli-5 struktur tonjolan pada pangkal maxilliped mulai tampak jelas; naupli-6 perkembangna setae makin sempurna dan duri pada furctel tumbuh makin panjang (Subaidah, et. al. 2006).
Stadia zoea
Pada stadia ini selain diberi pakan alami yaitu Chaetoceros sp juga sudah diberi pakan buatan. Pemberian pakan buatan dengan frekuensi pemberian 8 kali sehari. Pakan yang diberikan terlebih dahulu disaring dengan saringan pakan mesh 250 µ. Penyaringan dilakukan dengan menggunakan air tawar agar pakan tersebut larut.
Pemberian pakan buatan dan alami harus sesuai dengan kebutuhan larva. Hal ini dimaksudkan untuk menjaga agar tidak terjadi penimbunan pakan di dasar bak, karena tidak termakan oleh larva yang dapat menghambat aktifitas larva. Hal ini sesuai dengan Nurdjana, et. al. (1983) dalam Subaidah, et. al. (2006), yang menyatakan bila terlalu padat pada bak pemeliharaan larva dapat menyebabkan feces yang dikeluarkan pada stadia zoea panjang-panjang yang dapat menyulitkan gerakan pada lava dan dapat menyebabkan kematian.
Secara visual stadia zoea memiliki ciri-ciri yang khas yaitu gerakannya maju dan terlihat adanya kotoran yang menempel pada ekornya. Pada stadia zoea-1 kotoran terlihat pendek dengan gerakan naik kepermukaan air. Zoea-2 memiliki kotoran lebih panjang dari zoea-1 namun gerakannya sudah mulai berputar-putar dan naik kepermukaan air. Dan zoea-3 memiliki kotoran panjang dengan gerakan naik kepermukaan air. Jika diamati menggunakan beaker glass perbedaan panjang kotoran tiap stadia dikarenakan dosis serta banyaknya makanan yang dikonsumsi oleh larva.
Perkembangan stadia zoea terdiri dari tiga sub stadia dengan ciri-ciri pada zoea-1 badan pipih dan karapak mulai jelas, mata mulai tampak
namun belum bertangkai, maxilla pertama dan kedua serta alat
pencernaan mulai berfungsi. Zoea-2 mata bertangkai, rostrum mulai tampak dan spine orbital bercabang dan zoea-3 sepasang uropoda biramous mulai berkembang dan duri pada ruas-ruas tubuh mulai tampak. (Subaidah, et. al. 2006).
Stadia mysis
Pada stadia ini komposisi pakan yang diberikan lebih tinggi dari pada stadia zoea, namun pemberian pakannya tetap 8 kali sehari, karena ukuran larva semakin besar maka dosis pakan yang diberikan ditingkatkan dan pakan alami diberikan dengan komposisi Chaetoceros sp dan Artemia dua kali sehari.
Perkembangan stadia mysis terbagi menjadi tiga sub stadia yaitu mysis-1 badan berbentuk bengkok seperti udang dewasa; mysis-2 tunas pleopoda mulai tampak dan mysis-3 tunas pleopoda bertambah panjang dan berus-ruas. Secara visual gerakan khusus dari stadia ini adalah berjalan mundur dengan sesekali melentikkan tubuhnya kebelakang.
Stadia post larva (PL)
Pada stadia ini larva sudah tampak seperti udang dewasa. Pada stadia PL ini tidak lagi mengalami perubahan morfologi tubuh dan sudah mulai aktif bergerak lurus kedepan dan mulai menentang arus serta mulai menempel pada dinding bak.
Stadia post larva (PL) ini jumlah pakan yang diberikan disesuaikan dengan kebutuhan benur itu sendiri yang dapat diketahui dengan jalan melakukan pemerikasaan terhadap jumlah artemia yang tidak termakan, maka jumlah artemia yang akan diberikan dikurangi, demikian pula sebaliknya.
Pengendalian penyakit Sanitasi
Sanitasi merupakan segala daya upaya untuk mencegah timbulnya penyakit dan meningkatkan kesehatan. Selama Praktek Kerja Lapangan (PKL) di IPU Gelung Situbondo perlakuan sanitasi diberikan kaporit sebanyak 10 gr yang dilarutkan dalam bak fiber glass volume 250 liter sebagai tempat perendaman peralatan sebelum dan sesudah pemakain dan dibilas dengan air tawar bila ingin digunakan. Selain digunakan sanitasi penerapan bio security dengan menggunakan PK (kalium permanganat) sebanyak 1,5 ppm yang ditempatkan pada awal pintu masuk sebelum dan akan memasuki ruangan. Hal ini senada dengan (Subaidah, et. al. 2006). Secara ringkas, bio security adalah tindakan yang dapat menurunkan kemungkinan masuk dan menyebarnya penyakit dari suatu tempat ke tempat lain. Dan pada setiap bak pemeliharaan larva disiapkan masing-masing gayung untuk pengamatan larva agar tidak terkontaminasi antara bak yang satu dengan lainnya. Untuk lebih jelasnya dapat dilihatkan pada gambar 14 dan 15 dibawah ini :
Gambar 14 : sanitasi peralatan Gambar 15 : bak cuci kaki
Selain sanitasi dan penerapan bio scurity juga dilakukan pemberian obat-obatan berupa treflan dengan dosis 0,5-4 ppm dan pemberian probiotik. Aplikasi probiotik pada media pemeliharaan larva udang vannamei dapat meningkatkan produksi larva karena probiotik diartikan sebagai pendukung biota kehidupan dan mempunyai beberapa fungsi antara lain : mengurangi kandungan bahan organik pada media pemeliharaan, menetralkan/mengurangi senyawa gas beracun, tidak menghasilkan antibiotik yang dilarang, meningkatkan kekebalan tubuh udang, mempercepat pertumbuhan.
Pemanenan
Proses pemanenan
Panen merupakan proses akhir dari usaha pembenihan. Agar proses panen dapat berjalan lancar, perlu mempersiapkan alat-alat yang akan digunakan pada saat panen berlangsung seperti seser, saringan panen, fiber glass 500 liter, ember bersaring, air laut untuk media pengangkutan, dan ember untuk pengangkutan.
Pemanenan dapat dilakukan kapan saja tergantung pada pesanan. Panen dilakukan dengan mengurangi volume air bak sebanyak 50 % dari volume total bak pemeliharaan sehingga benur dalam keadaan kepadatan tinggi dan mudah dalam melakukan pemanenan. Hal ini senada dengan
Sutaman, (1993) dalam Jabarullah, (2007) bahwa pemanenan dilakukan dengan menurunkan air bak terlebih dahulu hingga air bak tinggal 50% dari total volume bak.
Pemanenan dilakukan dengan cara air diturunkan melalui pipa goyang atau pipa pengeluaran, air yang keluar ditampung dengan menggunakan ember bersaring ukuran 400 µ, setelah air yang dimaksud mencapai 50 %, pipa saringan dalam dilepaskan untuk panen total. Benur yang berkumpul pada saringan panen diseser dan ditampung dalam baskom/ember yang berisi air laut ± 2 liter, kemudian ditampung kembali pada fiber glass 500 liter atau langsung ditampung pada ember bersaring, setelah selesai panen maka dilakukan sampling dengan menggunakan takaran yang sudah diperhitungkan kepadatannya. Hasil sampling dimasukkan dalam baskom yang berisi air laut ± 10 liter kemudian dihitung jumlahnya dan benur dikemas dari hasil sampling yang disepakati oleh konsumen.
Benur yang telah dipanen, ditakar dan dimasukkan ke dalam beaker plastik yang terisi air laut 2000 ml, kemudian dikemas dengan kantong plastik rangkap dua yang berisi karbon dan diberi oksigen, lalu dikemas dengan stereform yang cukup untuk diisi 10 kantong atau karton yang cukup untuk diisi 14 kantong, kemudian ditutup rapat dan diisolasi. Untuk pengangkutan jarak jauh diberi es batu sebanyak 2-3 buah yang bertujuan untuk menjaga suhu air pengemasan supaya tetap stabil. Kepadatan benur 1.500-2.300 ekor PL-12 dengan volume air 2 liter. Hal ini senada dengan Wibowo, (2009) untuk kantong dengan volume air 2 liter kepadatan 2.000-3.000 ekor PL-10.
Dari hasil panen yang dilakukan diatas maka dapat diketahui sintasan larva atau biasa dikenal dengan SR (Suvivel Rate) dari hasil pemeliharaan larva udang vannamei (Litopenaeus vannamei) yang telah dilakukan. Menurut Haliman dan Adijaya, (2006) menyatakan bahwa Survivel Rate menunjukkan persentase benur yang hidup, berkembang, dan berproduksi hingga saat dipanen. Perhitungan SR dilakukan dengan rumus sebagai berikut :
∑ Larva yang dipanen
SR = ───────────── X 100 %
∑ Larva yang ditebar
KESIMPULAN DAN SARAN Kesimpulan
Dari hasil penelitian yang telah dilaksanakan dapat disimpulkan adalah sebagai berikut:
− Pengelolaan induk yang dibudidayakan ialah induk hasil domestika (IHD) atau hasil inbreeding (kawin kekerabatan) yang telah memenuhi persyaratan induk yang kualitas dan kuantitas baik.
− Pengelolaan kualitas air yang dilakukan yaitu dengan cara pergantian air dengan system flow trough sebanyak 200 % sehari semalam dengan masing-masing pergantian air 50 % dalam empat kali pergantian.
− Pengelolaan pakan yang dilakukan ialah dengan pemberian pakan segar berupa tiram dan cacing laut dengan dosis 30 % per hari dari biomass udang vannamei serta pemberian vitamin guna untuk mempercepat kematangan gonad.
− Ablasi yang dilakukan cukup berhasil dengan penjepit panas guna untuk mempercepat kematangan gonad udang vannamei
− Bak perkawinan antara induk jantan dan betina dipisah dengan tujuan memudahkan perkawinan terkontrol. Hal ini cukup berhasil dibandingkan dengan pencampuran induk jantan dan betina sekaligus, kemudian induk yang kawin/mating masih kurang tapi naupli yang diperoleh menunjukkan angka yang tinggi.
− Sumber naupli yang diperoleh ialah dari IPU Gelung Situbondo dengan padat tebar 100-125 ekor/liter dan penebaran nauplius yang dilakukan yaitu dengan cara aklimatisasi guna untuk menyesuaikan suhu air yang drastis pada bak pemeliharaan larva.
− Pengelolaan kualitas air yang digunakan yaitu dengan cara pergantian air dan pengecekan kualitas air. Pergantian air dilakukan pada saat
Mysis2 sampai dengan PL2 sebanyak 30 % dan PL3 sampai panen
sebanyak 40-50 %, sedangkan pengecekan kualitas air untuk
pemeliharaan larva yaitu dengan suhu 32-330C, salinitas 28-34 ppt, dan
pH berkisar 7-8.
− Pakan yang diberikan pada larva udang vannamei ada dua jenis yaitu pakan alami dan pakan buatan. Pakan yang dikultur adalah Chaetoceros sp dan Artemia dengan frekuensi pemberian dua kali sehari pada sore dan malam hari, sedangkan pakan buatan yang diberikan dengan jumlah dan frekuensi delapan kali sehari semalam. − Perkembangan naupli secara visual terlihat seperti laba-laba dengan
gerakan tersendat-sendat, perkembangan zoea ditandai dengan
gerakan maju dan terlihat adanya kotoran yang menempel pada ekor, perkembangan mysis ditandai dengan ciri-ciri gerakan mundur karena ruas-ruas tubuh mulai tampak dengan sesekali melentikkan tubuhnya kebelakang, dan perkembangan post larva tidak mengalami perubahan morfologi karena sudah menyerupai udang dewasa.
− Panen yang dilakukan pada saat PL-12 dengan kepadatan satu kantong plastik 1.500-2.300 ekor yang telah diperhitungkan sebelumnya dan disepakati oleh konsumen. Sedangkan kelangsungan hidup atau dikenal dengan Survivel Rate (SR) menunjukkan angka yang relative tinggi yaitu 24 % sampai dengan 40 %.
Contoh :
∑ Larva yang dipanen
SR = ───────────── X 100 %
∑ Larva yang ditebar ∑ 500.000
SR = ───────────── X 100 %
∑ 1.250.000 SR = 0,4 X 100 %
Saran
Salah satu kendala dalam kegiatan pembenihan udang vannamei adalah dari segi pemberian pakan, pengecekan kualitas air yang kurang konsisten. Hal ini perlu penanganan yang baik agar kegiatan pembenihan udang vannamei yang kita inginkan berhasil. Serta penerapan bio scurity perlu yang intensif untuk menjaga kualitas pembenihan yang baik.
DAFTAR PUSTAKA
Anonymous, 2006, SNI (Standar Nasional Indonesia) Udang Vannamei. Balai Budidaya Air Payau (BBAP) Situbondo.
Anonymous, 2009, Teknik Pembenihan Udang Vannamei (Litopenaeus vannamei). Direktorat Jenderal Kelautan dan Perikanan. Pelatihan Pembenihan dan Pembesaran Udang Politeknik Pertanian Negeri Pangkep di BBAP Situbondo.
Haliman, R.W & D. Adijaya, S. 2006, Udang Vannamei. Seri Agribisnis. Pembudidayaan dan Prospek Pasar Udang Putih yang Tahan Penyakit. Penebar Swadaya. Jakarta.
Isnansetyo, Ir. Alim dan Kurniastuty, Ir., 1995, Teknik Kultur Phytoplankton dan Zooplankton. Pakan Alami Untuk Pembenihan Organisme Laut. Kanisius.
Jabarullah, 2007, Kajian Teknik Pembenihan Udang Vannamei
(Litopenaeus vannamei) Florida Hawai di BBAP Situbondo. Laporan Integrasi Sekolah Tinggi Perikanan Jakarta.
Oktiandi, D. 2009, SNI Perbenihan Perikanan (Pengelolaan Induk Udang). Pelatihan MPM-CPIB untuk Pembenihan Udang di BBAP Situbondo. Sahidir, I. 2005, Teknik Pembenihan Udang Vannamei (Litopenaeus
vannamei) di Balai Budidaya Air Payau Situbondo. Laporan Praktek Kerja Lapangan. Fakultas Perikanan dan Kelautan, Universitas Diponegora. Semarang.
Subaidah, et. al. 2006, Teknik Pemeliharaan Larva Udang Vannamei (Litopenaeus vannamei). Pembenihan Udang Vannamei. Direktorat Jenderal Perikanan Budidaya BBAP Situbondo.
Suprianto, 2008, Teknik Pembenihan Udang Vannamei (Litopenaeus vannamei) di Instalasi Pembenihan Udang Gelung Situbondo. Tugas Akhir. Jurusan Budidaya Perikanan, Politeknik Pertanian Negeri Pangkajene dan Kepulauan, Pangkep.
Wibowo, H. 2009, SNI Perbenihan Perikanan (Produksi Benih Udang).