UNTUK MENDEGRADASI ZAT WARNA METILEN BIRU
SECARA FOTOKATALITIK
SKRIPSI
AYU EPRILITA FITRI IKA CAHYANI
DEPARTEMEN KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS AIRLANGGA
IMPREGNASI ZEOLIT ALAM DENGAN TiO
2UNTUK MENDEGRADASI ZAT WARNA METILEN BIRU
SECARA FOTOKATALITIK
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh
Gelar Sarjana Sains Bidang Kimia
Pada Fakultas Sains dan Teknologi
Universitas Airlangga Surabaya
Disetujui oleh :
Pembimbing I,
Pembimbing II,
Drs. Yusuf Syah, M.S
Alfa Akustia Widati, S.Si, M.Si
NIP. 19490502 198403 1 001
NIK. 139 080 770
LEMBAR PENGESAHAN NASKAH SKRIPSI
Judul
: Impregnasi Zeolit Alam dengan TiO
2untuk Mendegradasi
Zat Warna Metilen Biru Secara Fotokatalitik
Penyusun
: Ayu Eprilita Fitri Ika Cahyani
NIM
: 080810526
Pembimbing I
: Drs. Yusuf Syah, M.S
Pembimbing II
: Alfa Akustia Widati, S.Si, M.Si
Tanggal Seminar
: 17 Juli 2012
Disetujui oleh:
Pembimbing I,
Pembimbing II,
Drs. Yusuf Syah, M.S
Alfa Akustia Widati, S.Si, M.Si
NIP. 19490502 198403 1 001
NIK. 139 080 770
Mengetahui,
Ketua Departemen Kimia
Fakultas Sains dan Teknologi, Universitas Airlangga
Dr. Alfinda Novi Kristanti, DEA
PEDOMAN PENGGUNAAN SKRIPSI
Skripsi ini tidak dipublikasikan, namun tersedia di perpustakaan dalam
lingkungan Universitas Airlangga. Diperkenankan untuk dipakai sebagai referensi
perpustakaan, tetapi pengutipan seijin penulis dan harus menyebutkan sumbernya
sesuai kebiasaan ilmiah.
KATA PENGANTAR
Puji syukur ke hadirat Allah SWT yang telah melimpahkan rahmat dan
hidayah-Nya sehingga penyusun dapat menyelesaikan penulisan naskah skripsi
dengan judul “ Impregnasi Zeolit Alam dengan TiO
2untuk Mendegradasi Zat
Warna Metilen Biru Secara Fotokatalitik” dengan lancar dan tepat waktu.
Sholawat serta salam tetap tercurah kepada junjungan kita Nabi besar Rasulullah
Muhammad SAW.
Pada kesempatan ini penyusun ingin menyampaikan ucapan terima kasih
kepada:
1.
Bapak Drs. Yusuf Syah, M.S selaku dosen Pembimbing I atas bimbingan dan
nasehatnya selama penyelesaian skripsi ini di tengah kesibukannya.
2.
Ibu Alfa Akustia Widati, S.Si, M.Si selaku dosen Pembimbing II atas
bimbingan dan nasehatnya selama penyelesaian skripsi ini di tengah
kesibukannya.
3.
Ibu Dra. Usreg Sri Handajani, M.Si dan Ibu Dr. Sri Sumarsih, M.Si selaku
dosen Penguji I dan Penguji II atas saran dan bimbingannya agar skripsi ini
menjadi lebih baik.
4.
Kedua orang tua yang selalu memberikan dukungan dan semangat selama
penyelesaian skripsi ini.
5.
Bapak Drs. Hamami, M.Si selaku dosen pendamping yang telah
mendampingi, menasehati, dan memberikan semangat yang tidak ada
habisnya. Selain itu, beliau merupakan inspirator bagi penyusun dalam
penyelesaian skripsi ini.
6.
Ibu Dr. Alfinda Novi Kristanti, DEA selaku Ketua Program Studi S-1 Kimia
yang banyak memberikan informasi dan saran dalam penyusunan naskah
skripsi ini.
7.
Teman – teman “Keluarga Besar” (Aci, Anggi, Sari, Nadya, Tari, Devan,
Jemmy, Ryan) atas saran dan dukungan selama penyelesaian skripsi ini.
8.
Teman – teman Kimia angkatan 2008 selaku penyemangat dalam
penyelesaian skripsi ini.
9.
Semua pihak yang membantu dalam penyelesaian skripsi ini.
Skripsi ini jauh dari sempurna, untuk itu saran dan kritik yang membangun
sangat diharapkan untuk kesempurnaan skripsi ini.
Surabaya, Juli 2012
Penyusun,
Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga,
Surabaya.
ABSTRAK
Telah dilakukan degradasi zat warna metilen biru secara fotokatalitik oleh
TiO
2/zeolit. Proses degradasi dilakukan dalam suatu reaktor tertutup yang
diiradiasi dengan 3 buah lampu UV 8 watt. Larutan metilen biru diiradiasi dengan
lampu UV selama waktu optimum 45 menit dengan menggunakan TiO
2/zeolit.
Hasil penelitian menunjukkan bahwa dengan hanya menggunakan sinar UV,
larutan metilen biru dapat didegradasi namun sangat lambat dengan persen
degradasi sebesar 4,68 %. Ketika menggunakan H
2O
2, persen degradasi
meningkat yaitu sebesar 13,05 %. Saat diberi penambahan TiO
2dan zeolit proses
degradasi lebih efektif, yaitu diperoleh persen degradasi masing – masing 14,53 %
dan 96,84 %. Ketika menggunakan TiO
2/zeolit, menghasilkan persen degradasi
sebesar 98,08 %. Kondisi optimum degradasi metilen biru dengan TiO
2/zeolit
diperoleh pada waktu 45 menit dan pH larutan sebesar 5 dengan persen degradasi
masing – masing 98,16 % dan 98,20 %. TiO
2/zeolit memiliki efektivitas lebih
tinggi dibandingkan TiO
2, tetapi tidak lebih tinggi dibandingkan dengan zeolit
dalam mengadsorpsi zat warna metilen biru pada waktu dan pH optimum. Dalam
hal ini zeolit berperan sebagai adsorben, dan TiO
2mendegradasi metilen biru
secara fotokatalitik.
of Science and Technology of Universitas Airlangga.
ABSTRACT
Methylene blue dye degradation in photocatalytic by TiO
2/zeolit has been
studied. Degradation process carried out in a closed reactor is irradiated with 3
pieces 8 watt UV lamp. Methylene blue solution was irradiated with UV light for
45 minutes with the optimum use the TiO
2/zeolit. The result showed that the
presence of UV light, methylene blue dye solution can be degraded but very slow
with the percent degradation of 4,68 %. The degradation percent increase in the
amount of 13,05 % when added by H
2O
2. When given the addition of TiO
2and
zeolit is more effective degradation processes, namely the percentage degradation
of each – respectively 14,53 % and 96,84 %. When done adding TiO
2/zeolit as
catalyst, resulting in degradation of 98,08 %. Optimum conditions the degradation
of methylene blue with TiO
2/zeolit obtained at the time of 45 minutes and the pH
at 5 by the percent degradation of each respectively 98,16 % and 98,20 %.
TiO
2/zeolit have a higher effectiveness than TiO
2, but no higher than the zeolite in
methylene blue dye adsorbed at time and pH optimum. In this case zeolite acts as
absorbent, and TiO
2degrade methylene blue in photocatalytic.
Key words : methylene blue, photodegradation, TiO
2,natural zeolite and
DAFTAR ISI
Halaman
LEMBAR JUDUL ……….………...
i
LEMBAR PERNYATAAN .……….… ii
LEMBAR PENGESAHAN ……….. iii
LEMBAR PEDOMAN PENGGUNAAN SKRIPSI ……….. iv
KATA PENGANTAR ….………. v
ABSTRAK ………. vii
ABSTRACT ………. viii
DAFTAR ISI ……….. ix
DAFTAR TABEL ………. xi
DAFTAR GAMBAR ……… xii
DAFTAR LAMPIRAN ……… xiii
BAB I PENDAHULUAN ……….
1
1.1
Latar Belakang ……….…...
1
1.2
Rumusan Masalah ………...………
4
1.3
Tujuan Penelitian ………
4
1.4
Manfaat Penelitian ………..
4
BAB II TINJAUAN PUSTAKA ………..
5
2.1
Zeolit Alam………..
5
2.1.1 Struktur zeolit alam………
7
2.1.2 Sifat zeolit………...
9
2.2
Aktivasi Zeolit………. 11
2.3
Fotokatalisis………. 12
2.4
Semikonduktor TiO
2……… 14
2.5
Metilen Biru………. 15
2.6
Difraksi Sinar – X……… 16
2.7
Spektrofotometri UV – Vis……….. 18
2.8
Spektroskopi Inframerah……….. 20
BAB III METODE PENELITIAN………...
23
3.1
Waktu dan Tempat Penelitian ……….
23
3.2
Bahan dan Alat Penelitian ………...
23
3.2.1 Bahan penelitian ………..
23
3.2.2 Alat penelitian ………...
23
3.3
Diagram Alir Penelitian ………...
25
3.4
Prosedur Kerja ……….
26
3.4.1 Pembuatan larutan HCl 0,10 M ………...
26
3.4.3 Pembuatan larutan H
2O
215% ………...
26
3.4.4 Pembuatan larutan induk metilen biru 1000 ppm ……..
26
3.4.5 Pembuatan larutan standar metilen biru………..
26
3.4.6 Pembuatan larutan sampel metilen biru ……….
27
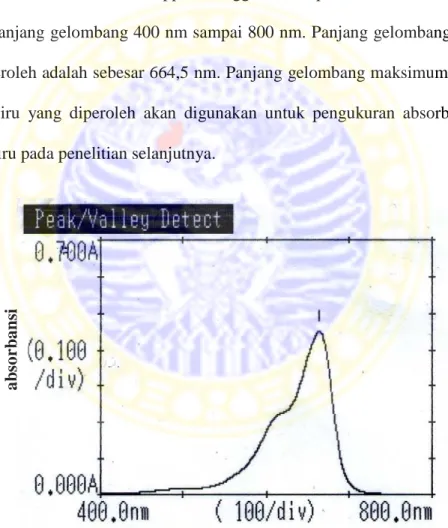
3.4.7 Penentuan panjang gelombang maksimum ………
27
3.4.8 Pembuatan kurva standar metilen biru ………...
27
3.4.9 Preparasi zeolit alam ………...
27
3.4.10 Preparasi TiO
2terimpregnasi zeolit alam ………
28
3.4.11 Penentuan waktu dan pH optimum degradasi metilen
biru ………...
28
3.4.11.1 Penentuan waktu optimum degradasi metilen
biru ……….
28
3.4.11.2 Penentuan pH optimum degradasi metilen
biru ………..
29
3.4.12 Degradasi metilen biru ……….
30
3.4.12.1 Degradasi metilen biru dengan sinar UV…….
30
3.4.12.2 Degradasi metilen biru dengan TiO
2/Zeolit
pada kondisi optimum ……….
30
3.4.12.3 Degradasi metilen biru dengan TiO
2pada
kondisi optimum ………..
31
3.4.12.4 Degradasi metilen biru dengan zeolit pada
kondisi optimum ………..
31
3.4.12.5 Degradasi metilen biru dengan H
2O
2pada
kondisi optimum………
32
BAB IV HASIL DAN PEMBAHASAN
4.1
Panjang Gelombang Maksimum Larutan Metilen Biru ………… 33
4.2
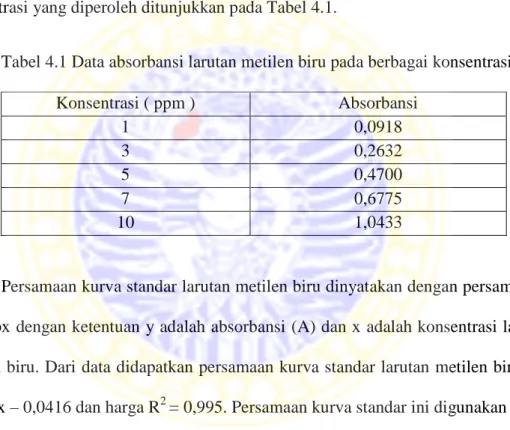
Penentuan Kurva Standar Metilen Biru ……… 34
4.3
Preparasi Zeolit Alam ………. 35
4.4
Preparasi TiO
2Terimpregnasi Zeolit Alam ………. 37
4.5
Penentuan Waktu Optimum Degradasi Larutan Metilen Biru ….
40
4.6
Penentuan pH Optimum Degradasi Larutan Metilen Biru ……...
43
4.7
Degradasi Metilen Biru dengan TiO
2/Zeolit pada Kondisi
Optimum ………...
45
BAB V KESIMPULAN DAN SARAN
5.1
Kesimpulan ……… 48
5.2
Saran………... 48
DAFTAR PUSTAKA ………... 49
LAMPIRAN
Tabel
Judul Tabel
Halaman
2.1
4.1
4.2
4.3
4.4
Komposisi unsur pada zeolit alam Turen, Malang, Jawa
Timur……….
Data absorbansi larutan metilen biru pada berbagai
konsentrasi ………
Data penentuan waktu optimum degradasi metilen biru……
Data pengukuran pH optimum degradasi metilen biru……..
Data pengukuran degradasi metilen biru dengan TiO
2/zeolit
pada waktu dan kondisi pH optimum………...
6
34
41
43
Gambar
Judul Gambar
Halaman
2.1
Struktur bangun primer zeolit ... 8
2.2
Struktur bangun sekunder zeolit ………
9
2.3
Struktur pori pada zeolit ………... 10
2.4
Struktur molekul metilen biru ……… 15
2.5
Skema alat difraktometer sinar – X ………... 18
. 4.1
Kurva panjang gelombang maksimum metilen biru………… 33
4.2
Kurva standar larutan metilen biru ...
35
4.3
Difraktogram zeolit alam dan zeolit setelah kalsinasi...
36
4.4
Difraktogram TiO
2, TiO
2/zeolit, dan zeolit sesudah kalsinasi 38
4.5
Spektra IR zeolit sesudah kalsinasi dan TiO
2/zeolit………...
39
4.6 Grafik hubungan antara persen degradasi terhadap waktu
degradasi ……….
41
4.7 Grafik hubungan antara pH dengan persen degradasi …….
44
4.8 Diagram batang perbandingan persen degradasi metilen
biru pada kondisi optimum ………..
46
Lampiran
Judul Lampiran
1
2
3
4
5
6
7
8
9
Panjang gelombang maksimum metilen biru
Difraktogram zeolit alam
Difraktogram zeolit setelah kalsinasi
Difraktogram TiO
2Difraktogram TiO
2/zeolit
Spektra IR zeolit sebelum dan setelah impregnasi
Optimasi waktu degradasi larutan metilen biru
Optimasi pH degradasi larutan metilen biru
Degradasi metilen biru pada kondisi optimum
1
BAB I
PENDAHULUAN
1.1
Latar Belakang
Keberadaan zeolit alam cukup melimpah di Indonesia namun pemanfaatannya
masih belum banyak dilakukan. Mineral zeolit didefinisikan sebagai suatu
aluminosilikat yang mempunyai struktur berongga dan biasanya rongga ini diisi oleh
air dan kation yang dapat dipertukarkan, serta memiliki ukuran pori tertentu
(Muliasari, 2006). Berdasarkan potensi yang dimiliki zeolit, maka cukup banyak
aplikasi yang sebenarnya dapat digunakan, antara lain kemampuannya sebagai
katalis, senyawa pengemban ataupun adsorben. Untuk dapat memiliki aktivitas yang
baik, zeolit alam harus dimodifikasi terlebih dahulu. Telah banyak diteliti berbagai
cara modifikasi zeolit alam. Modifikasi zeolit alam yang telah dilakukan yaitu dengan
kalsinasi atau pengembanan logam (Suyanti, 2000); modifikasi dengan larutan asam
dan surfaktan (Wang dan Peng, 2009); dan modifikasi dengan TiO
2melalui metode
sol gel (Slamet dkk, 2008). Penelitian lain tentang modifikasi zeolit alam yaitu
dengan melakukan pemanasan pada suhu 300⁰C selama kurang lebih tiga jam
(Aritonang, 2009); aktivasi zeolit alam dengan larutan HCl (Srihapsari, 2006);
aktivasi zeolit alam menggunakan larutan H
2SO
4(Muliasari, 2006); dan modifikasi
Indonesia merupakan negara yang sedang berkembang. Hal ini ditunjukkan
dengan adanya industri yang terus tumbuh dan berkembang. Dengan didukung
potensi sumber daya alam dan lingkungan yang dimiliki Indonesia, pemerintah
menitikberatkan program pembangunan jangka panjang pada sektor industri
(Wijayani, 2004). Dewasa ini perkembangan industri tekstil di Indonesia telah maju
pesat, namun kemajuan dalam bidang industri ini tidak diiringi oleh kesadaran yang
baik dalam pengelolaan lingkungan. Industri tekstil mengambil peranan penting
dalam pencemaran lingkungan, khususnya lingkungan perairan. Apabila air limbah
industri yang umumnya mengandung zat pewarna dibuang ke selokan atau sungai
tanpa mengalami pengolahan terlebih dahulu, dapat merubah air selokan atau air
sungai menjadi tidak sesuai dengan peruntukannya (Suwarsa, 1998). Metilen biru
merupakan salah satu dari zat pewarna. Metilen biru paling sering digunakan untuk
zat pewarna kapas, kayu, dan kain sutra (Wang dkk, 2011).
Pencemaran lingkungan yang disebabkan oleh zat pewarna sangat
memprihatinkan sehingga diperlukan penanganan serius untuk mengatasi masalah
tersebut. Berbagai upaya dan metode untuk mengatasi pencemaran zat pewarna telah
dilakukan, antara lain dengan metode koagulasi, oksidasi, dan elektrokimia. Namun,
metode – metode ini dirasa kurang memadai untuk mengatasi masalah pencemaran
zat pewarna. Karena metode ini pada dasarnya hanya penciptaan fase yang
mengandung polutan yang lebih terkonsentrasi (Fatimah dkk, 2006). Di antara
metode moderen penanggulangan limbah, metode fotokatalisis merupakan metode
yang relatif murah serta mudah diterapkan. Metode fotokatalisis memerlukan bahan
semikonduktor seperti TiO
2, CdS, atau Fe
2O
3serta radiasi sinar ultraviolet dengan
panjang gelombang sesuai dengan energi celah yang dimiliki oleh bahan
semikonduktor tersebut (Nogueria dan Jardim, 1993). Dari sekian banyak jenis
semikonduktor, TiO
2banyak dipilih untuk aplikasi secara luas karena TiO
2bersifat
inert dan stabil terhadap fotokorosi dan fotokimia. Selain itu, TiO
2bersifat tidak
beracun dan dalam pasaran mudah ditemukan dengan harga yang relatif murah
(Pristantho, 2011).
Pada penelitian yang dilakukan oleh Sumatera, dkk (2002), konsentrasi
metilen biru berkurang setelah suspensi disinari dengan sinar UV dan dikatalisis
dengan TiO
2/montmorilonit. Penelitian lain menyebutkan bahwa metilen biru
terdegradasi oleh ZnO/TiO
2sebesar 81,42% dan 77,75% pada panjang gelombang
590 nm dan 286 nm (Ali dan Siew, 2006).
Dalam rangka mengatasi pencemaran lingkungan yang disebabkan oleh
metilen biru, pada penelitian ini digunakan zeolit alam yang akan diimpregnasi
dengan TiO
2. Impregnasi adalah proses pemasukan prekursor logam dengan sejumlah
penyangga dan dibiarkan bereaksi, di mana prekursor TiO
2dimasukkan ke dalam
zeolit alam sebagai penyangga. Selanjutnya zeolit yang telah diimpregnasi dengan
TiO
2diaplikasikan untuk degradasi zat pewarna tekstil metilen biru secara
1.2
Rumusan Masalah
Berdasarkan latar belakang di atas dapat dirumuskan permasalahan sebagai
berikut.
1.
Berapa waktu dan pH optimum proses degradasi zat warna metilen biru
menggunakan zeolit terimpregnasi TiO
2(TiO
2/zeolit)?
2.
Apakah TiO
2/zeolit memiliki efektivitas lebih tinggi dibandingkan TiO
2atau
zeolit saja dalam mendegradasi zat warna metilen biru pada waktu dan pH
optimum?
1.3
Tujuan Penelitian
Tujuan dari penelitian ini adalah sebagai berikut.
1.
Menentukan waktu dan pH optimum proses degradasi zat warna metilen biru
menggunakan zeolit terimpregnasi TiO
2(TiO
2/zeolit).
2.
Mengetahui efektivitas TiO
2/zeolit dibandingkan TiO
2atau zeolit saja dalam
mendegradasi zat warna metilen biru pada waktu dan pH optimum.
1.4
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi tentang
impregnasi TiO
2dalam zeolit untuk degradasi zat pewarna tekstil dalam limbah
secara fotokatalitik. Selain itu, sebagai metode alternatif dari berbagai metode
fotokatalisis yang telah dilakukan.
BAB II
TINJAUAN PUSTAKA
2.1
Zeolit Alam
Seorang ahli mineralogi berkebangsaan Swedia bernama Baron Axel Fredick
Cronsedt menemukan zeolit pertama kali pada tahun 1756. Zeolit ditemukan dalam
bentuk kristal yang mempunyai struktur berongga. Nama zeolit berasal dari bahasa
Yunani, zeo yang memiliki arti membuih dan lithos yang memiliki arti batu.
Pemberian nama zeolit dikarenakan sesuai dengan karakter zeolit yang membuih dan
mengeluarkan air apabila dipanaskan (Mumpton dan Fishman, 1977). Para ahli
geokimia dan mineralogi memperkirakan bahwa zeolit merupakan produk dari
gunung berapi yang berupa lava yang membeku menjadi batuan vulkanik, sedimen,
dan batuan metamorfosa. Melalui proses pelapukan karena adanya pengaruh panas
dan dingin yang terjadi di dalam tanah, maka batuan tersebut akan membentuk
mineral zeolit (Barrer, 1982). Zeolit juga ditemukan sebagai batuan endapan pada
bagian tanah jenis basalt dan komposisi kimianya tergantung pada kondisi
hidrotermal lingkungan lokal seperti suhu, tekanan uap, dan komposisi air tanah. Hal
itu menjadikan zeolit dengan warna dan tekstur yang sama mungkin berbeda
komposisi kimianya bila diambil dari lokasi yang berbeda, disebabkan karena
kombinasi mineral dengan pengotor lainnya.
Di Indonesia, potensi sumber daya alam mineral zeolit alam cukup besar dan
kemurniannya cukup tinggi. Daerah – daerah yang mempunyai tambang zeolit di
antaranya adalah Lampung Selatan, Bayah, Cikembar, Cipatujah, Jawa Barat
Nangapada, Kabupaten Ende di NTT, Kabupaten Malang, dan Kabupaten Gunung
Kidul (Maygasari, 2010). Cadangan zeolit alam di Indonesia sebagian besar berada di
deret pegunungan karst, sehingga kadar CaO dalam zeolit Indonesia cukup besar
(lebih dari 5%). Sedangkan zeolit alam dari luar Indonesia mengandung CaO kurang
dari 3%, sesuai dengan jumlah Ca pada zeolit komersial (Nais dan Wibawa, 2011).
Tabel 2.1 Komposisi unsur pada zeolit alam Turen, Malang, Jawa Timur (Ismuyanto,
2008)
Unsur
Komposisi (%)
Al
14
Si
48
Na
0
Ca
2,76
Cr
0,0054
Mn
1,93
Fe
25,1
Ni
0
Sr
0
Zr
0
Ag
0
Yb
0
P
0
S
0,74
K
4,93
Ti
1,28
V
0,04
Cu
0,12
Zn
0,795
Zeolit alam merupakan senyawa aluminosilikat yang terhidrasi dengan
kation-kation terutama kation-kation alkali dan alkali tanah. Di samping itu, zeolit mempunyai
rongga dan mempunyai struktur sangkar tiga dimensi (framework). Rongga di dalam
zeolit ditempati oleh kation-kation dari golongan alkali dan alkali tanah, selain itu
juga terdapat molekul air. Kation dan molekul air tersebut dapat digantikan dengan
kation atau molekul lain secara reversibel tanpa merusak strukturnya (Mumpton,
1977). Secara empiris, zeolit memiliki rumus empiris sebagai berikut:
M
x/n[(AlO
2)
x(SiO
2)] zH
2O
dengan ketentuan:
M
x/n: kation logam alkali atau alkali tanah
n
: valensi logam alkali atau alkali tanah
x
: bilangan tertentu alumina dari 2 – 10
y
: bilangan tertentu silika dari 2 – 7
z
: jumlah molekul air kristal
Mineral zeolit dikenal sebagai bahan alam dan umumnya dalam bentuk
batuan clinoptilolite, mordenit, barrerite, chabazite, stilbite, analcime, dan
laumonlite. Sedangkan mineral zeolit dalam bentuk offerite, paulingite, dan mazzite
hanya sedikit dan jarang dijumpai (Sunarti, 2010).
2.1.1 Struktur zeolit
Seperti halnya mineral kwarsa dan felspar, zeolit termasuk golongan senyawa
tektosilikat, yaitu kristal yang terbentuk oleh sambungan bersama dari tetrahedral –
tetrahedral memberikan jaringan anionik dimensi tiga dan setiap oksigen dari suatu
tetrahedral disumbangkan antara tetrahedral yang satu dengan tetrahedral yang lain
(Rakhmatullah dkk, 2007). Struktur zeolit terdiri dari unit – unit pembangun, yang
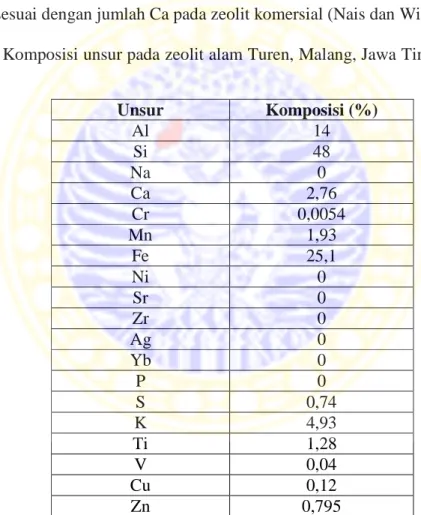
secara garis besar dibagi menjadi tiga bagian utama sebagai berikut (Butar, 2011) :
1.
unit bangun primer, yang tak lain adalah bentuk tetrahedral silika (SiO
4)
4-dan
alumina (AlO
4)
5-; bentuk tetrahedral ini bergabung menjadi satu dengan yang
lainnya membentuk kerangka tiga dimensi dengan rumusan ideal (TO
4)
n.
Gambar 2.1 Struktur bangun primer zeolit (Butar, 2011)
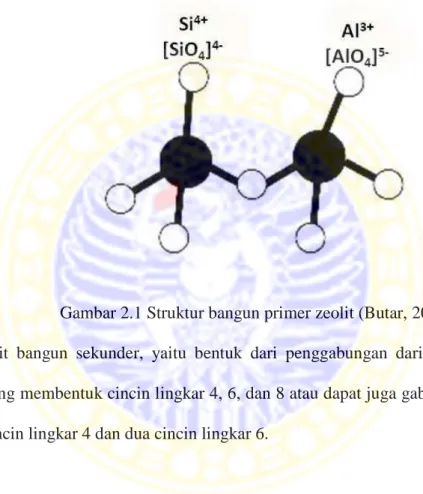
2.
unit bangun sekunder, yaitu bentuk dari penggabungan dari beberapa TO
4yang membentuk cincin lingkar 4, 6, dan 8 atau dapat juga gabungan dari dua
cincin lingkar 4 dan dua cincin lingkar 6.
Gambar 2.2 Struktur bangun sekunder zeolit (Butar, 2011)
3.
unit bangun tersier, bentuk polihedral yang tersusun dalam pengulangan unit –
unit bangun sekunder yang dihubungkan oleh jendela – jendela atau saluran –
saluran membentuk suatu bangunan yang besar yaitu zeolit.
2.1.2 Sifat zeolit
Zeolit mempunyai struktur berongga yang biasanya diisi oleh kation – kation
dan air yang bisa dipertukarkan dan memiliki ukuran pori tertentu (Srihapsari, 2006).
Beberapa hal yang perlu diperhatikan dalam mineral zeolit adalah perbandingan Si
dan Al. Kerapatan muatan di dalam struktur kristal zeolit ditentukan oleh
perbandingan Si dan Al. Jika perbandingan Si dan Al besar maka kerapatan
muatannya tinggi dan molekulnya lebih besar. Dengan kata lain, zeolit dengan
perbandingan Si dan Al yang tinggi mempunyai kapasitas pertukaran kationnya tinggi
(Muliasari, 2006).
Gambar 2.3 Struktur pori pada zeolit (Muliasari, 2006)
Berbagai sifat dari zeolit alam adalah :
1.
Dehidrasi
Sifat dehidrasi zeolit berpengaruh terhadap sifat penyerapannya. Keunikan
zeolit terletak pada struktur porinya yang spesifik. Pada zeolit alam, di dalam
pori – porinya terdapat kation – kation atau molekul air. Apabila kation –
kation atau molekul air tersebut dikeluarkan dari dalam pori dengan suatu
perlakuan tertentu maka zeolit memiliki pori yang kosong (Barrer, 1982).
2.
Adsorpsi
Dalam keadaan normal, ruang dalam kristal zeolit terisi oleh molekul air yang
berada di sekitar kation. Bila zeolit dipanaskan maka air tersebut akan keluar,
dengan demikian luas permukaan dari pori – pori mineral zeolit bertambah.
Zeolit yang telah dipanaskan dapat berfungsi sebagai penyerap gas atau
cairan. Penggunaan zeolit sebagai adsorben lebih dikenal sebelumnya, karena
zeolit bersifat selektif dan mempunyai kapasitas yang cukup tinggi, di mana
pori – pori kristal ini mampu mengadsorpsi sejumlah besar molekul atau ion
yang ukurannya cukup atau sesuai dengan bentuk atau ukuran saluran untuk
selanjutnya masuk ke dalam saluran intrakristal sehingga dapat bertindak
sebagai penyaring ion atau molekul (Butar, 2011).
3.
Katalis
Zeolit merupakan katalisator yang baik karena mempunyai pori – pori yang
besar dan permukaan yang maksimum (Imansyah, 2011). Keasaman zeolit
juga merupakan salah satu faktor penting dalam penggunaan zeolit sebagai
pengemban dan sebagai katalis. Zeolit digunakan secara luas sebagai katalis
karena adanya situs – situs asam, baik situs asam Bronsted maupun Lewis
(Tarigan, 2007). Penggunaan zeolit sebagai katalis dapat dioptimalkan dengan
cara perlakuan asam, hidrotermal, kalsinasi, dan oksidasi (Imansyah, 2011).
2.2
Aktivasi Zeolit
Peningkatan mutu zeolit alam melalui proses aktivasi dan modifikasi
dimaksudkan untuk memperbesar kemampuan zeolit baik dari segi daya katalisis,
adsorben, maupun pertukaran ion. Beberapa teknik dilakukan untuk meningkatkan
mutu zeolit alam, yaitu dengan cara aktivasi dan modifikasi. Proses aktivasi zeolit
alam dapat dikelompokkan menjadi dua cara, yakni aktivasi secara kimiawi dan
aktivasi secara fisik (Fatimah, 2000).
Aktivasi secara kimiawi memiliki tujuan untuk membersihkan permukaan
pori, membuang senyawa pengotor, dan mengatur kembali letak atom yang
dipertukarkan. Prinsip aktivasi secara kimiawi adalah penambahan pereaksi tertentu
sehingga didapatkan pori – pori zeolit yang bersih (aktif). Sedangkan proses aktivasi
secara fisika dilakukan dengan cara pemanasan baik secara kontak langsung maupun
tak langsung (sistem vakum). Hal ini bertujuan untuk menguapkan air kristal yang
terperangkap di dalam pori – pori zeolit sehingga luas permukaan internal pori
meningkat (Fatimah, 2000).
2.3
Fotokatalisis
Fotokatalisis merupakan suatu proses kombinasi antara proses fotokimia dan
katalis, yakni suatu proses degradasi secara kimiawi dengan melibatkan cahaya
sebagai pemicu dan katalis berfungsi untuk mempercepat proses transformasi.
Transformasi atau reaksi yang diinduksi oleh sinar tersebut terjadi pada permukaan
suatu katalis (Sopyan, 1998). Induksi oleh sinar menyebabkan terjadinya eksitasi
elektron, dalam proses ini menghasilkan hole. Hole memiliki peranan yang sangat
besar dalam hampir semua reaksi fotokatalitik. Induksi oleh sinar menyebabkan
terjadinya eksitasi elektron dari pita valensi ke pita konduksi. Jika suatu semi
konduktor dikenai cahaya (hv) dengan energi yang sesuai, maka elektron (e
-) pada
pita valensi akan tereksitasi ke pita konduksi dan meninggalkan hole (h
+) pada pita
valensi (Gunlazuardi, 2001).
Berdasarkan fasanya, fotokatalisis digolongkan menjadi dua macam, yaitu
fotokatalisis homogen dan fotokatalisis heterogen. Fotokatalisis homogen adalah
proses katalisis satu fase antara substrat dengan katalis. Umumnya katalis berupa
suatu oksidator seperti ozon dan hidrogen peroksida. Fotokatalisis heterogen adalah
proses fotokatalisis dua fase yang dilakukan dengan bantuan semikonduktor sebagai
katalis (Otmer dan Kirk, 1994).
Proses degradasi fotokatalisis merupakan suatu teknologi alternatif yang dapat
digunakan untuk menghancurkan berbagai macam polutan hasil dari limbah industri
dan rumah tangga seperti asam, detergen, sabun, dan impuritis – impuritis organik.
Menurut Lu (1999), metode degradasi fotokatalitik ini mempunyai beberapa
keuntungan sebagai berikut. Kontaminan organik dapat terdekomposisi secara
keseluruhan dengan cepat. Degradasi fotokatalitik dapat menggunakan matahari
sebagai sumber sinar. Proses ini dapat digabungkan dengan proses biologis. Sifat
toksik dari logam berat dapat dikurangi dengan metode degradasi fotokatalitik. Selain
itu, metode ini bersifat soft sehingga dapat diikuti dengan temperatur dan tekanan
rendah.
2.4
Semikonduktor TiO
2Oksida logam titanium (TiO
2) merupakan material semikonduktor yang aktif
sebagai fotokatalis. Semikonduktor TiO
2ditemukan di alam dalam bentuk kristal
dengan tiga macam bentuk, yaitu brokit, anatase dan rutil. Di samping memiliki
aktivitas yang cukup besar dan efektif sebagai fotokatalis, TiO
2merupakan senyawa
yang mudah didapatkan dan bersifat tidak beracun (Fatimah dan Wijaya, 2005).
Menurut Hoffman (1995), semikonduktor TiO
2dalam air yang disinari oleh
sinar UV akan membentuk hole positif pada pita valensi (vb) dan elektron pada pita
konduksi (cb), yang dapat menginisiasi reaksi redoks bahan kimia yang kontak
dengan semikonduktor tersebut. Dalam media air, sistem tersebut mampu
menghasilkan radikal hidroksil (•OH). Radikal hidroksil adalah spesi pengoksidasi
kuat pada pH = 1 dan memiliki potensial oksidasi sebesar 2,8 Volt. Dengan potensial
sebesar itu, kebanyakan senyawa organik di dalam air dapat dioksidasi.
Pada permukaan semikonduktor, hole positif dapat bereaksi dengan baik
dengan H
2O yang teradsorpsi secara fisika maupun dengan gugus OH
-yang
teradsorpsi secara kimia untuk membentuk radikal hidroksil sebagaimana pada reaksi
berikut :
TiO
2+ hv
TiO
2(h
+vb+ e
-cb)
h
+vb +H
2O
•OH + H
+e
-cb +O
2O
2-2 O
2-+ 2 H
2O
2 •OH + 2 OH
-+ O
2Elektron – elektron pada pita konduksi kemungkinan bereaksi dengan
molekul oksigen untuk membentuk ion superoksida yang selanjutnya membentuk
radikal hidroksil. Radikal hidroksil sangat reaktif menyerang molekul – molekul
organik dan mendegradasinya menjadi CO
2, H
2O, dan ion – ion halida jika molekul
organik mengandung atom – atom halogen (Hoffman, 1995).
2.5
Metilen Biru
Metilen biru merupakan senyawa kimia aromatik heterosiklik dengan rumus
molekul C
16H
18ClN
3S dengan nama IUPAC
3,7-Bis-dimetylamino-phenothiazin-5-yilum chloride. Metilen biru memiliki massa molekul relatif 319,85 g/mol dan
memiliki titik leleh sebesar 100⁰C. Pada suhu ruang, metilen biru berbentuk serbuk
berwarna hijau tua, tidak berbau, menjadi warna biru ketika dilarutkan di dalam air
(Budavari dkk, 1989). Selain digunakan sebagai zat pewarna tekstil, metilen biru
merupakan zat pewarna yang kerap digunakan sebagai bakterisida dan fungisida
dalam akuarium.
Zat pewarna metilen biru merupakan zat pewarna berbahaya. Efek berbahaya
yang ditimbulkan oleh zat pewarna metilen biru antara lain seperti detak jantung
mengalami peningkatan, mual, muntah, dan shock (Zendehdel dkk, 2011).
2.6
Difraksi Sinar-X ( X-ray Difraction )
Difraksi sinar-X merupakan suatu metode analisis yang didasarkan pada
interaksi antara materi dengan radiasi elektromagnetik sinar-X, yakni pengukuran
radiasi sinar-X yang terdifraksi oleh bidang kristal dimana pengukuran ini
menggunakan instrumen yang bernama difraktometer sinar-X (Wahyuni, 2003).
Sinar-X adalah gelombang elektromagnetik yang memiliki panjang gelombang sangat
pendek, jauh lebih pendek dari panjang gelombang sinar tampak (Glusker, 1985).
Penghamburan sinar-X oleh unit – unit padatan kristalin akan menghasilkan pola –
pola difraksi yang digunakan untuk menentukan struktur partikel pada kisi padatan
(Chang, 1998).
Menurut Srihapsari (2006), kegunaan dari metode difraksi sinar-X ini adalah:
1.
penentuan struktur kristal yakni bentuk dan ukuran sel satuan kristal,
pengindeksan bidang kristal, dan jumlah atom per sel satuan ;
2.
analisis kimia, yakni identifikasi kristal, penentuan kemurnian hasil sintesis dan
deteksi senyawa baru.
Pola difraksi pada setiap materi akan berbeda satu sama lain sehingga dapat
digunakan untuk identifikasi dan memberikan informasi mengenai kesimetrian serta
ukuran unit – unit molekuler (Atkins, 1998).
Proses difraksi sinar-X dipelajari oleh Bragg, yakni jika dua berkas sinar yang
parallel mengenai bidang – bidang kristal yang sama dengan jarak antar bidang, maka
perbedaan jarak yang ditempuh oleh kedua sinar tersebut berbanding langsung
dengan panjang gelombangnya. Persamaan Bragg dinyatakan sebagai berikut:
n λ = 2 d sin θ………(2.1)
dengan λ = panjang gelombang sinar-X, d = jarak antar bidang (interplanar
distances), dan θ = sudut difraksi.
Metode difraksi pada sampel berbentuk serbuk halus digunakan secara luas,
karena semua bidang kristal yang ada dapat terorientasi sedemikian rupa sehingga
dapat mendifraksi sinar-X. Pada metode ini, susunan alat difraksi sinar-X sebagai
berikut (Birkholz, 2006).
1.
Tabung sinar-X, merupakan tempat produksi sinar-X, berisi katoda filamen
tungsen (W) sebagai sumber elektron dan anoda yang berupa logam target.
2.
Ganiometer, bergerak memutar selama alat dioperasikan. Alat ini satu unit dengan
tempat sampel dan detektor.
3.
Tempat sampel, berupa lempeng logam atau plat kaca yang cekung atau
berlubang ditengahnya, di mana sampel serbuk diisikan. Sampel akan berputar
bersama ganiometer dan membentuk sudut terhadap sinar-X yang datang.
4.
Detektor gas, berisi gas yang sensitif terhadap sinar-X, katoda, dan anoda. Atom –
atom gas terionisasi saat terkena sinar-X membentuk elektron yang menuju
katoda dan kation yang menuju anoda sehingga menghasilkan arus listrik yang
diubah menjadi pulsa yang dihitung oleh scaler and counter.
5.
Difraktometer (scaler and counter), berfungsi mendeteksi posisi sudut difraksi
dan intensitasnya.
6.
Rekorder, berfungsi menampilkan keluaran berupa pola difraksi atau
difraktogram yang menyatakan hubungan antara intensitas dengan sudut difraksi.
Gambar 2.5 Skema alat difraktometer sinar – X (Birkholz, 2006)
2.7
Spektrofotometri UV – Vis
Spektrofotometri adalah ilmu yang mempelajari tentang penggunaan
spektrofotometer. Spektrofotometer adalah alat yang digunakan untuk mengukur
energi secara relatif jika energi tersebut ditransmisikan, direfleksikan, atau diemisikan
sebagai fungsi dari panjang gelombang. Spektrofotometer menghasilkan sinar dari
spektrum dengan panjang gelombang tertentu dan fotometer adalah alat pengukur
intensitas cahaya yang ditransmisikan atau yang diabsorbsi. Spektrofotometri UV –
Vis adalah salah satu teknik analisis spektroskopik yang menggunakan sumber radiasi
elektromagnetik ultraviolet dekat dengan daerah panjang gelombang antara 190 – 380
nm dan sinar tampak dengan daerah panjang gelombang 380 – 780 nm, teknik
analisis ini menggunakan instrumen spektrofotometer. Spektrofotometri UV – Vis
melibatkan energi elektronik yang cukup besar pada molekul yang dianalisis,
sehingga spektrofotometri UV – Vis lebih banyak dipakai untuk analisis kuantitatif
dibandingkan kualitatif (Fessenden dan Fessenden, 1995).
Panjang gelombang yang lebih pendek terserap oleh molekul – molekul yang
memerlukan lebih banyak energi untuk promosi elektron, sedangkan panjang
gelombang yang lebih panjang akan terserap oleh molekul – molekul yang
memerlukan energi lebih sedikit untuk promosi elektron. Senyawa yang menyerap
pada daerah sinar tampak yakni senyawa berwarna merupakan senyawa yang
memiliki elektron yang lebih mudah dipromosikan daripada senyawa yang menyerap
pada daerah sinar ultraviolet (Fessenden dan Fessenden, 1995).
Absorpsi sinar ultraviolet atau sinar tampak mengakibatkan transisi
elektronik, yaitu promosi elektron – elektron dari orbital keadaan dasar yang
berenergi rendah ke orbital keadaan tereksitasi yang berenergi lebih tinggi.
Selanjutnya energi yang diserap terbuang sebagai kalor, sebagai cahaya, atau
tersalurkan dalam reaksi kimia. Panjang gelombang sinar ultraviolet atau sinar
tampak tergantung pada mudahnya promosi elektron. Absorpsi energi direkam
sebagai absorbansi. Absorbansi suatu senyawa pada suatu panjang gelombang
tertentu bertambah dengan banyaknya molekul yang mengalami transisi. Oleh karena
itu, absorbansi tergantung pada struktur elektronik senyawa dan juga pada kepekatan
sampel dan panjang sel sampel (Fessenden dan Fessenden, 1995).
2.8
Spektroskopi Inframerah
Spektroskopi adalah ilmu yang mempelajari tentang analisis senyawa kimia
berdasarkan suatu fenomena, yaitu adanya interaksi antara materi dengan sinar.
Spektroskopi inframerah merupakan suatu metode yang mengamati interaksi molekul
dengan radiasi elektromagnetik yang berada pada daerah panjang gelombang 0,75 –
1.000 µm atau pada bilangan gelombang 13.000 – 10 cm
-1dengan menggunakan
suatu alat yaitu Spektrofotometer Inframerah. Spektroskopi inframerah sangat baik
digunakan untuk mengumpulkan informasi tentang struktur suatu senyawa dan
sebagai alat analisis untuk menilai kemurnian suatu senyawa (Mulja, 1995).
Menurut Fessenden (1995), energi yang dipancarkan (radiasi elektromagnetik)
menembus ruang dalam bentuk gelombang – gelombang. Tiap tipe radiasi
elektromagnetik dicirikan dengan panjang gelombang (λ), yakni jarak antara puncak
panjang gelombang yang satu ke puncak panjang gelombang berikutnya. Selain
dicirikan dengan panjang gelombang, radiasi elektromagnetik juga dapat dicirikan
dengan frekuensi (v) yang didefinisikan sebagai banyaknya gelombang tiap detik.
Hubungan antara panjang gelombang dan frekuensi berbanding terbalik, sehingga
dapat dirumuskan sebagai :
= ……….…………..…(2.2)
dimana:
v
: frekuensi (Hz)
c
: kecepatan rambat cahaya ( 3 x 10
10cm/det)
λ
: panjang gelombang (cm)
Didalam spektroskopi inframerah juga dikenal istilah bilangan gelombang, dimana
dirumuskan sebagai :
̅ = ………(2.3)
Menurut Silverstein dkk (2005), molekul organik menyerap energi pada daerah
inframerah untuk melakukan vibrasi. Dalam spektroskopi inframerah terdapat dua
macam vibrasi, yaitu stretching dan bending. Ritme gerakan di sepanjang sumbu x
ikatan disebut stretching, sedangkan bending merupakan vibrasi yang memungkinkan
sudut ikatan berubah. Kedua vibrasi ini terjadi pada daerah 4000 – 400 cm
-1. Panjang
gelombang atau frekuensi absorbsi suatu senyawa tergantung pada massa atom relatif,
konstanta energi ikatan, dan geometri atom – atom. Penentuan frekuensi stretching
dirumuskan dengan Hukum Hooke sebagai berikut :
̅
=
……….………..(2.5)
Dengan M merupakan massa atom (g) dan k merupakan konstanta energi ikatan
tunggal, ikatan rangkap dua, dan ikatan rangkap tiga yang masing – masing 5 x 10
5,
10 x 10
5, dan 15 x 10
5.
23
BAB III
METODE PENELITIAN
3.1
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Februari hingga Juni 2012 di
Laboratorium Kimia Analitik dan Laboratorium Penelitian Departemen Kimia
Fakultas Sains dan Teknologi Universitas Airlangga Surabaya.
3.2
Bahan dan Alat Penelitian
3.2.1 Bahan penelitian
Bahan – bahan yang digunakan pada penelitian ini adalah zeolit alam dari
Turen Malang – Jawa Timur, TiO
2, HCl 37 % (Merck), NaOH p.a (Merck), H
2O
230% (Merck), etanol absolut 98 % (Merck), metilen biru, akuadem, kertas
aluminium, kertas saring.
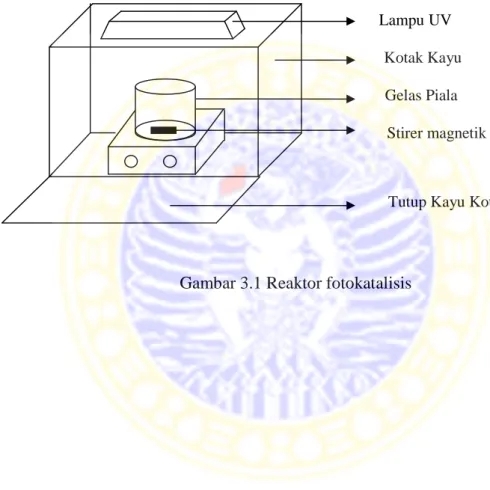
3.2.2 Alat penelitian
Alat – alat yang akan digunakan dalam penelitian ini adalah pengaduk
magnet, pH meter, centrifuge (Fisher Scientific), tabung centrifuge, oven, furnace,
pipet mikro, timbangan analit (Mettler), difraktometer sinar – X (Philips),
spektrofotometer UV-Vis (Shimadzu), spektrofotometer inframerah (Shimadzu),
reaktor fotokatalitik yang terdiri dari kotak pelindung reaktor yang terbuat dari kayu
berukuran 50 cm x 50 cm x 50 cm ; sumber sinar UV (lampu UV 3 x 8 Watt) ; wadah
berupa gelas piala 1000 mL, dan beberapa peralatan gelas yang biasanya dipakai di
laboratorium.
Gambar 3.1 Reaktor fotokatalisis
Lampu UV Kotak Kayu
Stirer magnetik Gelas Piala