ix INTISARI
Berdasarkan AMA (American Medical Association) dan USP (795), untuk semua produk obat yang diracik ulang harus mencantumkan beyond use date
(masa edar). Selama ini pencantuman beyond use date (masa edar) di rumah sakit X adalah dengan pencantuman expired date sediaan tabletnya secara langsung tanpa didukung oleh data stabilitas. Oleh karena itu, perlu dilakukan uji stabilitas langsung untuk evaluasi cara penentuan beyond use date (masa edar) sediaan racikan pulveres campuran parasetamol dan fenobarbital dari rumah sakit X.
Penelitian ini menggunakan metode uji stabilitas dipercepat yang dilakukan dengan pema nasan sampel racikan pulveres selama 7 hari pada 3 peringkat suhu yaitu 40oC, 50oC dan 60oC ± 2 oC. Dengan menggunakan persamaan Arrhenius dapat diketahui energi aktivasi, kecepatan degradasi pada suhu kamar (25°C), dan waktu kadaluarsa (t90) dari parasetamol dan fenobarbital.
Hasil penelitian menunjukkan waktu kadaluarsa (t90) dari parasetamol
adalah 12 hari dan waktu kadalua rsa (t90) fenobarbital tidak bisa ditentukan
sehingga beyond use date (masa edar) racikan pulveres rumah sakit X tidak bisa ditentukan. Berdasarkan ketentuan USP (795), beyond use date (masa edar) sediaan racikan pulveres campuran parasetamol dan fenobarbital dari rumah sakit X hanya boleh selama 6 bulan. Disimpulkan bahwa penggunaan expired date
secara langsung untuk penentuan beyond use date (masa edar) di rumah sakit X adalah kurang tepat.
x
ABSTRACT
According to AMA (American Medical Association) and USP(795), for removing drug product into different container or for repackaging, its recommended to place label for beyond use date on the new package. So far, X hospital place beyond use date on the new package powder combination label exactly the same as the original expired date of tablet dosage from the manufacture without doing appropriate research. Therefore, the new powder combination needs direct stability testing to evaluate the determination of beyond use date of powder combination of paracetamol and phenobarbital take from X hospital.
This study uses accelerated stability testing method by heating the powder combination for 7 days in 3 levels of temperature there are 40oC, 50oC, dan 60oC ± 2 oC. Activation energy, rate of degradation at room temperature (25oC) and shelf life (t90) can be determined by implementing Arrhenius equation.
The result shows that shelf life (t90) of paracetamol is 12 days and the
shelf life (t90) of phenobarbital can`t determined. Thus, beyond use date of powder
combination from X hospital can`t determined. Based on USP (795), the beyond use date of powder combination paracetamol and pehobarbital from X hospital is valid only for 6 months. As the conclusion the use of expired date to label the new package as beyond use date in X hospital is inappropriate.
EVALUASI CARA PENENTUAN BEYOND USE DATE (MASA EDAR) SEDIAAN RACIKAN PULVERES CAMPURAN PARASETAMOL DAN
FENOBARBITAL DARI RUMAH SAKIT X
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh:
Cin Frengky Cuwondo NIM : 048114151
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
EVALUASI CARA PENENTUAN BEYOND USE DATE (MASA EDAR) SEDIAAN RACIKAN PULVERES CAMPURAN PARASETAMOL DAN
FENOBARBITAL DARI RUMAH SAKIT X
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh:
Cin Frengky Cuwondo NIM : 048114151
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
iv
Hal yang benar-benar diyakini, akan selalu terjadi dan
keyakinan akan suatu hal akan membuat nya
benar-benar terjadi
(Frank L lyod Wright)
Kupersembahkan karya ini untuk
Papa dan mamaku tercinta, atas kasih sayang, doa dan
dukungan
yang terus menyertaiku.
Kakak dan Abangku yang terbaik dan selalu mendukungku
adik-adikku terkasih
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma : Nama : Cin Frengky Cuwondo
Nomor Mahasiswa : 048114151
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul :
EVALUASI CARA PENENTUAN BEYOND USE DATE (MASA EDAR) SEDIAAN RACIKAN PULVERES CAMPURAN PARASETAMOL DAN FENOBARBITAL DARI RUMAH SAKIT X
beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya di Internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya maupaun memberikan roya lty kepada saya selamA tetap mencantumkan nama saya sebagai penulis.
Demikian pernyatan ini yang saya buat dengan sebenarnya. Dibuat di Yogyakarta
Pada tanggal : 28 Maret 2008 Yang menyatakan
v PRAKATA
Puji syukur kepada Tuhan Yang Maha Esa atas segala anugerah-Nya sehingga penulis dapat menyelesaikan skripsi dengan judul “Evaluasi Cara Penentuan Beyond Use Date (Masa Edar) Sediaan Racikan Pulveres Campuran Parasetamol dan Fenobarbital dari Rumah Sakit X”. Skripsi ini dibuat untuk memenuhi salah satu syarat memperoleh gelar Sarjana Farmasi (S.Farm) pada Program Studi Farmasi di Universitas Sanata Dharma.
Penulisan skripsi ini tidak mungkin terwujud tanpa adanya bimbingan, bantuan dan dukungan dari berbagai pihak, maka pada kesempatan ini, penulis mengucapkan terima kasih kepada:
1. Rita Suhadi, M.Si., Apt., selaku Dekan Fakultas Farmasi Universitas Sanata Dharma dan ketua penelitian patient safety, terima kasih atas segala dukungannya.
2. Christine Patramurti, M.Si., Apt., selaku Kaprodi Fakultas Farmasi Universitas Sanata Dharma dan sebagai dosen pembimbing yang telah banyak meluangkan waktu, tenaga dan atas segala masukan serta sarannya dalam penyusunan skripsi ini.
3. Agatha Budi Susiana, M.Si., Apt., selaku dosen penguji yang telah berkenan menguji dan memberikan masukan.
vi
5. C.M. Ratna Rini Nastiti, S.Si., Apt yang telah membantu dalam mendapatkan literatur untuk metodologi penelitian.
6. Yunita Linawati, S.Si, Apt., yang telah memberikan masukan, dukungan dan sarannya.
7. Segenap dosen di Fakultas Farmasi Universitas Sanata Dharma, terima kasih atas bantuannya selama ini.
8. Segenap karyawan dan laboran Laboratorium Fakultas Farmasi Universitas Sanata Dharma yang telah banyak membantu dan menemani dalam penelitian skripsi ini.
9. Orang tua dan adik-adikku, atas segala dukungan dan doa yang selalu menyertaiku.
10.Kakak dan Abang-abangku tercinta yang sudah mendukungku dalam segala hal dari kuliah sampai selesainya skripsi ini.
11.Buat Wee Selvy yang selalu memberikan semangat dan selalu mendukungku sampai selesainya skripsi ini.
12.Lidia Kristalia, Ryan, Novi, Tika dan Ismiyati, atas kerjasama, lembur bersama, canda tawa dan keluh kesah selama di laboratorium dan penyusunan skripsi ini.
13.Brian, Tintus, Andrew dan semua teman-teman angkatan 2004, terima kasih atas segala semangat, persahabatan dan kebersamaan kita yang indah.
vii
15.Semua pihak yang telah banyak membantu penyusunan skripsi ini.
Atas segala bantuan yang telah diberikan selama ini, penulis mengucapkan banyak terima kasih. Penulis juga menyadari sepenuhnya penulisan skripsi ini tidak terlepas dari keterbatasan dan kekurangan penulis. Oleh karena itu, diharapkan kritik dan saran yang membangun demi penyempurnaan skripsi ini. Besar harapan penulis bahwa skripsi ini dapat bermanfaat bagi perbendaharaan dan perkembangan ilmu pengetahuan.
viii
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 21 Februari 2008 Penulis,
ix INTISARI
Berdasarkan AMA (American Medical Association) dan USP (795), untuk semua produk obat yang diracik ulang harus mencantumkan beyond use date
(masa edar). Selama ini pencantuman beyond use date (masa edar) di rumah sakit X adalah dengan pencantuman expired date sediaan tabletnya secara langsung tanpa didukung oleh data stabilitas. Oleh karena itu, perlu dilakukan uji stabilitas langsung untuk evaluasi cara penentuan beyond use date (masa edar) sediaan racikan pulveres campuran parasetamol dan fenobarbital dari rumah sakit X.
Penelitian ini menggunakan metode uji stabilitas dipercepat yang dilakukan dengan pema nasan sampel racikan pulveres selama 7 hari pada 3 peringkat suhu yaitu 40oC, 50oC dan 60oC ± 2 oC. Dengan menggunakan persamaan Arrhenius dapat diketahui energi aktivasi, kecepatan degradasi pada suhu kamar (25°C), dan waktu kadaluarsa (t90) dari parasetamol dan fenobarbital.
Hasil penelitian menunjukkan waktu kadaluarsa (t90) dari parasetamol
adalah 12 hari dan waktu kadalua rsa (t90) fenobarbital tidak bisa ditentukan
sehingga beyond use date (masa edar) racikan pulveres rumah sakit X tidak bisa ditentukan. Berdasarkan ketentuan USP (795), beyond use date (masa edar) sediaan racikan pulveres campuran parasetamol dan fenobarbital dari rumah sakit X hanya boleh selama 6 bulan. Disimpulkan bahwa penggunaan expired date
secara langsung untuk penentuan beyond use date (masa edar) di rumah sakit X adalah kurang tepat.
x
ABSTRACT
According to AMA (American Medical Association) and USP(795), for removing drug product into different container or for repackaging, its recommended to place label for beyond use date on the new package. So far, X hospital place beyond use date on the new package powder combination label exactly the same as the original expired date of tablet dosage from the manufacture without doing appropriate research. Therefore, the new powder combination needs direct stability testing to evaluate the determination of beyond use date of powder combination of paracetamol and phenobarbital take from X hospital.
This study uses accelerated stability testing method by heating the powder combination for 7 days in 3 levels of temperature there are 40oC, 50oC, dan 60oC ± 2 oC. Activation energy, rate of degradation at room temperature (25oC) and shelf life (t90) can be determined by implementing Arrhenius equation.
The result shows that shelf life (t90) of paracetamol is 12 days and the
shelf life (t90) of phenobarbital can`t determined. Thus, beyond use date of powder
combination from X hospital can`t determined. Based on USP (795), the beyond use date of powder combination paracetamol and pehobarbital from X hospital is valid only for 6 months. As the conclusion the use of expired date to label the new package as beyond use date in X hospital is inappropriate.
xii
C. Fenobarbital... 8
D. Stabilitas dan Masa Edar Sediaan ………. ... 10
E. Stabilitas Sediaan Padat……… ... 11
F. Teori Status Transisi ... 12
G. Beyond Use Date... 13
H. Penentuan Beyond Use Date... 14
1. Berdasarkan sumber literatur yang cocok ... 14
2. Tes langsung ... 14
3. Berdasarkan ketentuan USP (795)... 15
I. Uji Stabilitas... 16
1. Uji stabilitas waktu lama ... 16
2. Uji stabilitas dipercepat... 17
J. Uji Stabilitas Dipercepat ... 17
K. Orde Reaksi Kimia... 19
L. Pengaruh Temperatur Terhadap Laju Reaksi... 20
M. Analisis Kestabilan Yang Dipercepat ... 21
N. Kromatografi Cair Kinerja Tinggi (KCKT)... 22
O. Keterangan Empiris ... 24
BAB III METODOLOGI PENELITIAN ... 25
A. Jenis dan Rancangan Penelitian... 25
xiii
2. Pembuatan larutan baku parasetamol dan natrium fenobarbital.. 27
3. Pengambilan sampel racikan pulveres ... 28
4. Uji stabilitas kimia ... 28
F. Analisis Data... 30
BAB IV HASIL DAN PEMBAHASAN ... 31
A. Optimasi Penetapan Kadar Parasetamol dan Fenobarbital Dengan menggunakan Metode KCKT... 31
1. Sistem KCKT... 31
2. Kurva baku parasetamol... 33
3. Kurva baku fenobarbital... 36
B. Penentuan Masa Edar Sediaan Racikan Pulveres ... 38
1. Pemilihan sampel racikan pulveres... 38
2. Preparasi sampel ... 39
xiv
dengan menggunakan 1 peringkat suhu... 52
5. Penentuan beyond use date (masa edar) sediaan racikan pulveres dengan menggunakan 25 % sisa expired date sediaan tabletnya... 55
BAB V. KESIMPULAN DAN SARAN ... 57
A. Kesimpulan ... 57
B. Saran... 57
C. Keterbatasan... 58
DAFTAR PUSTAKA ... 59
LAMPIRAN ... 61
xv
DAFTAR TABEL
Halaman Tabel I. Kondisi dan periode waktu penyimpanan untuk uji stabilitas jangka lama dan dipercepat berdasarkan ICH (International
Conference on Harmonization) ... 18 Tabel II. Persamaan reaksi, waktu-paruh, dan shself life masing- masing orde reaksi... 20 Tabel III. Hasil pengukuran AUC masing- masing seri kurva baku
parasetamol... 35 Tabel IV. Hasil pengukuran AUC masing- masing seri kurva baku
fenobarbital... 37 Tabel V. Hasil penetapan kadar parasetamol dalam sampel racikan
pulveres pada suhu 40oC selama 7 hari... 42 Tabel VI. Hasil penetapan kadar parasetamol dalam sampel racikan
pulveres pada suhu 50oC selama 7 hari... 42 Tabel VII. Hasil penetapan kadar parasetamol dalam sampel racikan
pulveres pada suhu 60oC selama 7 hari... 43 Tabel VIII. Hasil penetapan kadar fenobarbital dalam sampel racikan
pulveres pada suhu 40oC selama 7 hari... 45 Tabel IX. Hasil penetapan kadar fenobarbital dalam sampel racikan
xvi
pulveres pada suhu 60oC selama 7 hari... 45 Tabel XI. Hasil perhitungan regresi linier dari parasetamol masing-
masing orde reaksi pada suhu 40oC, 50 oC dan 60 oC
selama 7 hari... 47 Tabel XII. Hasil perhitungan regresi linier dari fenobarbital masing-
masing orde reaksi pada suhu 40oC, 50 oC dan 60 oC
selama 7 hari ... 47 Tabel XIII. Kecepatan degradasi parasetamol pada berbagai
suhu percobaan... 49 Tabel XIV. Hasil perhitungan 1/T(10-3) dan log k parasetamol... 49 Tabel XV. Hasil regresi linear hubungan antara 1/T dan log k
parasetamol... 49 Tabel XVI. Kecepatan degradasi fenobarbital pada berbagai suhu
percobaan... 51 Tabel XVII. Kadar parasetamol dan fenobarbital sampel racikan pulveres
xvii
Gambar 5. Penguraian obat dalam larutan air pada temperatur yang dinaikkan... 22
Gambar 6. Plot Arrhenius... 22
Gambar 7. Kromatogram senyawa baku parasetamol... 35
Gambar 8. Kromatogram senyawa baku fenobarbital... 37
Gambar 9. Kromatogram parasetamol sampel racikan pulveres setelah pemanasan selama 7 hari pada suhu 40oC... 41
Gambar 10. Kromatogram parasetamol sampel racikan pulveres setelah pemanasan selama 7 hari pada suhu 50oC... 41
Gambar 11. Kromatogram parasetamol sampel racikan pulveres setelah pemanasan selama 7 hari pada suhu 60oC... 42
Gambar 12. Grafik kadar parasetamol dalam sampel racikan pulveres selama 7 hari pada masing- masing peringkat suhu... 43
Gambar 13. Kromatogram fenobarbital sampel racikan pulveres setelah pemanasan selama7 hari pada suhu 40oC... 44
xviii
Gambar 15. Kromatogram fenobarbital sampel racikan pulveres setelah
pemanasan selama7 hari pada suhu 60oC... 44 Gambar 16. Grafik kadar fenobarbital dalam sampel racikan pulveres
xix
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Sertifikat analisis parasetamol... 61 Lampiran 2. Sertifikat analisis fenobarbital... 62 Lampiran 3. Data penimbangan bahan baku... 63 Lampiran 4. Kromatogram baku parasetamol... 64 Lampiran 5. Kromatogram baku natrium fenobarbital... 69 Lampiran 6. Perhitungan kadar larutan baku parasetamol... 74 Lampiran 7. Perhitungan kadar larutan baku fenobarbital... 76 Lampiran 8. Perhitungan pemilihan sampel racikan pulveres... 77 Lampiran 9. Kromatogram parasetamol sampel racikan pulveres... 78 Lampiran 10. Kromatogram fenobarbital sampel racikan pulveres... 82 Lampiran 11. Hasil uji stabilitas sampel racikan pulveres dengan
menggunakan 3 peringkat suhu... 86 Lampiran 12. Hasil uji stabilitas sampel racikan pulveres dengan
1
BAB I
PENGANTAR
A. Latar Belakang
Sediaan racikan pulveres (serbuk terbagi) masih digunakan secara luas di apotik-apotik maupun rumah sakit di Indonesia. Pembuatan sediaan racikan pulveres ini pada dasarnya mempunyai tujuan dan kegunaan untuk memberikan kemudahan dan kenyamanan kepada pasien terutama pasien anak-anak. Pasien anak pada umumnya mengalami kesulitan untuk menerima obat dalam bentuk sediaan padat (misalnya tablet), oleh karena itu biasanya dilakukan peracikan ulang dari bentuk sediaan padat tersebut menjadi bentuk sediaan pulveres (serbuk terbagi).
Berdasarkan Anonim (2001) dan Anonim (2005), untuk produk hasil pembuatan dari pabrik harus mencantumkan expired date sedangkan untuk semua produk obat yang diracik ulang harus mencantumkan beyond use date pada kemasan dan biasanya lebih singkat dari produk awalnya. Tujuan dari pencantuman beyond use date pada kemasan racikan ulang adalah untuk memberikan batasan waktu dimana sediaan racikan tersebut seharusnya sudah tidak boleh digunakan lagi.
dengan cara penggerusan dari bentuk sediaan tabletnya dan dibuat dalam jumlah yang banyak dalam sekali pembuatan. Adanya perubahan bentuk sediaan tablet menjadi pulveres (serbuk terbagi) dan wadah kemasan dapat menyebabkan perubahan stabilitas dari obat tersebut sehingga perlu dilakukan uji stabilitas sediaan racikan pulveres tersebut sebagai jaminan mutu dan keamanan. Salah satu cara untuk menjamin mutu dan keamanannya yaitu dengan pencantuman masa edar pada kemasan sediaan racikan pulveres.
Selama ini pencantuman beyond use date (masa edar) dari sediaan racikan pulveres campuran parasetamol dan fenobarbital di rumah sakit X adalah dengan pencantuman secara langsung expired date tablet parasetamol atau tablet fenobarbital yang memiliki expired date lebih singkat tanpa didukung oleh data stabilitas. Oleh karena itu diperlukan uji stabilitas langsung untuk mengevaluasi cara penentuan beyond use date (masa edar) sediaan racikan pulveres campuran parasetamol dan fenobarbital dari rumah sakit X.
1. Perumusan masalah
Apakah cara penentuan beyond use date (masa edar) dari sediaan racikan pulveres campuran obat parasetamol dan fenobarbital dari rumah sakit X sudah tepat?
2. Keaslian penelitian
Sejauh pengetahuan penulis, penelitian mengenai evaluasi cara penentuan beyond use date (masa edar) sediaan racikan pulveres campuran parasetamol dan fenobarbital hasil racikan rumah sakit X dengan metode uji stabilitas dipercepat belum pernah dilakukan.
3. Manfaat Penelitian
a. Manfaat teoritis. Penelitian ini dapat digunakan sebagai informasi tambahan tentang cara penentuan beyond use date (masa edar) dari sediaan racikan pulveres.
b. Manfaat metodologis. Penelitian ini dapat digunakan sebagai metode untuk penentuan beyond use date (masa edar) sediaan racikan pulveres.
B. Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengevaluasi cara penentuan
5 BAB II
PENELAAHAN PUSTAKA
A. Sediaan Serbuk dan Pulveres
Sediaan serbuk adalah campuran kering bahan obat atau zat kimia yang dihaluskan, ditujukan untuk pemakaian oral atau untuk pemakaian luar. Serbuk yang terbagi adalah serbuk bertakaran tunggal, yang umumnya diisikan ke dalam kapsul terlipat terbuat dari kertas, kertas malam atau dalam material lainnya yang cocok (Anonim, 1995).
Komponen dari campuran serbuk harus memiliki tingkat penghalusan yang sama dan terbagi rata. Penyimpanan dari serbuk harus sangat hati- hati dan terlindung cahaya (Voigt, 1995).
B. Parasetamol
N H C
O
C H3
O H
Gambar 1. Struktur parasetamol
Nama kimia : 4’- Hidroksiasetanilida (C8H9NO2)
BM : 151,16
Sinonim : parasetanolum, asetaminofen, p-asetanilid, dan p- asetamidofenol (Connors, Arnedon, Stella, 1986).
Tablet parasetamol mengandung parasetamol tidak kurang dari 90,0 % dan tidak lebih dari 110,0 % dari jumlah yang tertera pada etiket.Pemerian serbuk hablur, putih, tidak berbau, dan rasa sedikit pahit (Anonim, 1995).
1. Fisik
Putih kristal, tidak berbau atau serbuk kristal dengan rasa pahit. Titik lebur 169oC-172oC. Kelarutan: 1 gram larut dalam 70 ml air pada suhu 25oC, 20 ml air mendidih, 7 ml alkohol, 13 ml aseton, 50 ml kloroform, 40 ml glicerin dan 9 ml propilen glikol. Parasetamol larut dalam metanol dan dalam larutan alkali hidroksida tetapi tidak larut dalam benzena dan eter. Solutio saturasi mempunyai pH kira-kira 6 dan pKa = 9,51. Parasetamol mempunyai serapan maksimum di daerah ultraviolet. Serapan jenis parasetamol dalam etanol pada 250,0 nm (Connors dkk, 1986).
2. Stabilitas
Parasetamol sangat stabil dalam larutan air dengan stabilitas maksimal pada pH antara 5 sampai 7 (Connors dkk, 1986). Preparasi dari parasetamol seharusnya disimpan pada suhu di bawah 40°C, lebih cocok pada suhu 15 – 30°C (Anonim, 2005(a)).
3. Kinetika obat
4. Metode stabilisasi
Dalam preparasi liquid, pH seharusnya disesuaikan kira-kira pada pH 6 untuk stabilitas maksimum. Kombinasi dengan aspirin dan kodein fosfat, moisture, dan alkali stearat harus dihindari (Connors dkk, 1986).
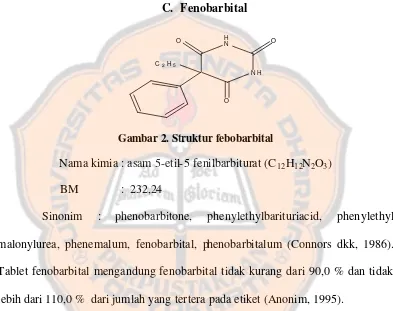
C. Fenobarbital
Gambar 2. Struktur febobarbital
Nama kimia : asam 5-etil-5 fenilbarbiturat (C12H12N2O3)
BM : 232,24
Sinonim : phenobarbitone, phenylethylbarituriacid, phenylethyl malonylurea, phenemalum, fenobarbital, phenobarbitalum (Connors dkk, 1986). Tablet fenobarbital mengandung fenobarbital tidak kurang dari 90,0 % dan tidak lebih dari 110,0 % dari jumlah yang tertera pada etiket (Anonim, 1995).
1. Fisik
Pemerian hablur kecil atau serbuk hablur putih berkilat, tidak berbau, tidak berasa dan dapat menjadi polimorfisma (Anonim, 1995). Titik lebur 174o C-178 oC. pKa = 7,6 pada suhu 25 oC. Kelarutan : 1 gram larut dalam 1000 ml air, 10 ml alkohol, 40 ml kloroform dan 15 ml eter. Garam sodium bersifat higroskopis dan sangat larut dalam air, mudah larut dalam propilena glikol dan larut dalam metanol. Obat tidak berbau dan terasa pahit serta bersifat higroskopis (Connors dkk, 1986).
2. Stabilitas
Fenobarbital stabil terhadap udara tetapi relatif tidak stabil terhadap hidrolisis. Dari profil pH-kecepatan reaksi menunjukkan spesifik hidrolisis katalis basa antara unionik dan spesies monoionik dari barbiturat menjadi diamida dan ureida. Larutan solutio dari garam fenobarbital pada umumnya tidak stabil. Obat lebih stabil dalam polyethylena glycol atau propilena glycol (Connors dkk, 1986). 3. Kinetika obat
D. Stabilitas dan Masa Edar Sedíaan
Stabilitas didefinisikan sebagai kemampuan suatu produk untuk bertahan dalam batas yang ditetapkan dan sepanjang periode penyimpanan dan penggunaan, sifat dan karakteristiknya sama dengan yang dimilikinya pada saat produk dibuat (Anonim,1995). Pengujian stabilitas pada sediaan merupakan faktor penting untuk mengetahui sifat stabilitas dari sediaan dan untuk menentukan kondisi penyimpanan yang cocok serta tanggal kadaluarsa (Anonim, 2001(a)).
Pengujian terhadap stabilitas sediaan meliputi : uji organoleptis, kimia-fisika, kimiawi dan mikrobiologi. Tujuan dari uji stabilitas adalah untuk memastikan kualitas, keamanan dan efikasi dari produk obat sampai pada waktu kadaluarsa (Carstensen dan Rhodes, 2000). Bentuk sediaan obat yang diubah (seperti disolusi, pulveres, dan penambahan material lain) atau ketika tempat penyimpanan diubah maka stabilitas dari obat juga akan terpengaruh (Connors dkk, 1986).
Hal-hal yang harus diperhatikan dalam uji stabilitas, antara lain :
1. Jumlah contoh dan jadwal pengujian berdasarkan kriteria statistik tiap sifat yang diuji untuk menjamin kebenaran perkiraan stabilitas.
2. Kondisi penyimpanan.
3. Metode pengujian yang spesifik, bermakna dan dapat diandalkan.
4. Pengujian produk dalam kemasan yang sama dengan kemasan yang dipasarkan.
Faktor yang menyebabkan ketidakstabilan sediaan obat dapat dikelompokkan menjadi dua. Pertama adalah labilitas bahan obat dan bahan pembantunya sendiri yang dihasilkan oleh bangun kimiawi dan kimia fisikanya. Kedua adalah faktor luar seperti suhu, kelembapan udara dan cahaya yang dapat menginduksi atau mempercepat jalanya reaksi. Hal penting lainnya adalah kemasan, khususnya jika digunakan wadah yang terbuat dari bahan sintetis (Voigt, 1995).
Masa edar didefinisikan sebagai periode waktu yang ditetapkan pada tingkat konfidensi 95% bahwa dalam periode waktu tersebut produk tetap mengandung zat aktif tidak kurang dari batas spesifikasi (Anonim, 2001(b)). Untuk sediaan obat yang dibuat pada skala industri, penyimpanan yang dilakukan dalam waktu lama, dibatasi dengan jangka waktu daya tahan selama 5 tahun. Dalam kasus-kasus tertentu bahkan hanya 3 tahun. Sediaan obat yang dibuat melalui peracikan dan segera diberikan kepada pasien, harus memiliki stabilitas paling tidak beberapa bulan. Akan tetapi untuk preparatif semacam itu umumnya dilakukan pembatasan waktu penyimpanannya (Voigt, 1995).
E. Stabilitas Sediaan Padat
Degradasi dari sediaan padat dapat terjadi dengan adanya pelarut. Sumber pelarut kemungkinan dapat berasal dari :
1. Solvat atau hidrat yang terbebas karena waktu dan suhu yang tidak stabil. 2. Lelehan dari obat atau bahan tambahan dalam formulasi yang mempunyai titik
3. Sisa lembab atau pelarut dari granulasi basah.
4. Lembab yang terabsorbsi oleh bahan tambahan dari udara seperti tepung, laktosa atau mikrokristalin selulosa (Connors dkk, 1986).
Dekomposisi kimia dari obat sediaan padat dapat dibedakan menjadi 4 kategori yaitu solvolisis, oksidasi, fotolisis dan pirolisis. Degradasi dari sediaan padat mempunyai bentuk kurva sigmoid (gambar 3) dengan lag fase yang kemudian dilanjutkan pada fase akselerasi dan deakselerasi (Connors dkk, 1986).
Gambar 3. Kinetika dari dekomposisi sediaan padat (Connors dkk, 1986)
F. Teori Status Transisi
Suatu reaksi dari reaktan menjadi produk akan melewati suatu tahap dimana energi lebih tinggi dari awalnya sehingga akan mencegah pembentukan produk secara tiba-tiba atau yang disebut energi aktivasi. Kecepatan reaksi dari produk membentuk reaktan berdasarkan 2 asumsi yaitu:
2. Kecepatan reaksi berbanding lurus dengan kadar molekul di status transisi (Connors dkk, 1986).
Gambar 4. Teori status transisi (Connors dkk, 1986)
G. Beyond Use Date
Definisi dari beyond use date berdasarkan USP adalah tangga l dimana sediaan racikan tersebut seharusnya tidak digunakan lagi dan ditentukan dari waktu dimana sediaan tersebut dibuat, karena ditujukan untuk penyaluran segera atau masa penyimpanan yang singkat. Berdasarkan USP (795), label pada wadah dan kemasan sediaan racikan ulang harus mencantumkan beyond use date.
H. Penentuan Beyond Use Date
Berdasarkan USP, ada beberapa cara untuk menentukan beyond use date, yaitu: sumber literatur yang cocok, tes langsung, dan berdasarkan ketentuan
USP (795) (Kupiec, 2003).
1. Sumber literatur yang cocok
USP menunjukkan bahwa apoteker dapat menggunakan publikasi untuk mendapatkan informasi mengenai stabilitas, kompatibilitas dan degradasi dari formulasi obat. Ketika menentukan beyond use date apoteker seharusnya menggunakan dokumentasi dan literatur obat yang spesifik (Kupiec, 2003).
Prediksi beyond use date berdasarkan bukti seperti publikasi, diagram, tabel dan seterusnya akan menghasilkan beyond use date teoritis. Beyond use date
teoritis menyelipkan variasi asumsi dan kemungkinan error atau tidak akurat, tingkat dari error dan inakurasi ini tergantung pada batas perbedaan antara karakteristik dari produk seperti komposisi, konsentrasi, volume, tipe kemasan, material kemasan dan karakteristik dari data stabilitas produk. Besarnya ketidakpastian dari peramalan beyond use date ini menyebabkan semakin besarnya keperluan untuk menentukan beyond use date secara eksperimental (Kupiec, 2003).
2. Tes langsung
3. Berdasarkan ketentuan USP (795)
Apabila kedua sumber tidak tersedia maka untuk mendapatkan beyond use date dapat mengacu ke USP (795). Berdasarkan USP (795) untuk sediaan liquid nonaqueous dan sediaan padat non steril (dimana produk obat pabrik adalah sumber dari bahan aktif), beyond use date tidak lebih lama dari 25% sisa dari
expired date produk atau 6 bulan tergantung mana yang lebih singkat. Untuk sediaan yang mengandung air (penyiapan dari bentuk padat) beyond use date tidak lebih lama dari 14 hari ketika disimpan pada temperatur dingin (Kupiec, 2003).
Data stabilitas primer adala h data dari produk obat yang disimpan pada kemasan untuk pemasaran di bawah kondisi penyimpanan untuk merencanakan
shelf life. Data ini diperoleh dari akumulasi dari tes pada waktu ke nol (setelah produksi) dan pada titik waktu penetapan sebelumnya dari beyond use date yang diinginkan. Untuk mendapatkan beyond use date selama 6 bulan, tes produk pada waktu ke-0 dan kemudian lagi pada bulan ke-3 dan bulan ke-6, dengan kondisi penyimpanan 25oC ± 2oC/ RH 60% ± 5%. Dengan uji dipercepat, stabilitas 6 bulan dapat ditentukan setelah produk dites 1 bulan untuk beyond use date lebih cepat (Kupiec, 2003).
Untuk beyond use date selama 1 tahun maka ada 2 kondisi yang harus dipenuhi yaitu:
1. Harus mempertahankan fasilitas dimana temperatur kinetik rata-rata tidak lebih dari 25 oC.
Ketentuan FDA tentang peracikan ulang yaitu :
1. Waktu kadaluarsa tidak lebih dari 1 tahun dari tanggal pembuatan atau lebih singkat dari produk awalnya tanpa adanya data stabilitas dan petunjuk dari label produk awal.
2. Jika bentuk sediaan racikan adalah oral solid maka kemasan yang digunakan harus sesuai dengan standard kelas A USP.
3. Kemasan produk awal tidak terbuka sebelumnya dan keseluruhan peracikan dilakukan dalam satu kali operasi.
4. Peracikan dan penyimpan harus sesuai dengan kondisi lingkungan yang terdapat pada label kemasan produk awal. Apabila tidak ada petunjuk dari label produk awal maka temperatur ruangan harus dikendalikan selama peracikan dan penyimpanan antara bentuk sediaan solid dan liquid oral. Apabila tidak ada kelembapan spesifik pada label produk awal maka kelembapan relatif seharusnya tidak lebih dari 75% pada suhu 23oC untuk peracikan dan penyimpanan dari bentuk sediaan solid oral (Anonim, 2005(b)).
I. Uji Stabilitas 1. Uji stabilitas waktu lama
efektivitasnya. Sifat mikrobiologis serta sensoriknya dan kondisi galenik sediaan yang dideteksi dengan metode fisika (Voigt, 1995).
2. Uji stabilitas dipercepat
Dalam hal ini peraturan kinetika reaksi digunakan, dimana penguraian diperlajari pada suhu tinggi dan tidak pada suhu kamar, yang selanjutnya diekstrapolasikan kepada suhu penyimpanannya. Pada tes paksaan isotermik
biasa, bahan obat disimpan dalam berbagai suhu yang tinggi tetapi selama percobaan masing- masing suhu dibuat tetap, dan dalam jangka waktu tertentu, konsentrasi produk penguraian atau kandungan bahan aktif ditentukan (Voigt, 1995).
J. Uji Stabilitas Dipercepat
Yang menjadi sasaran dari uji stabilitas dipercepat ini adalah :
1. Kecepatan deteksi dari deterionisasi pada awal formulasi yang berbeda tapi pada produk yang sama untuk mendapatkan formulasi yang paling baik.
2. Untuk memprediksi shelf life, merupakan waktu dimana produk tetap stabil ketika disimpan di bawah kondisi normal atau kondisi yang seharusnya.
3. Merupakan syarat dari kontrol kualitas untuk memastikan tidak ada perubahan yang tidak diharapkan ketika penyimpanan (Aulton, 2002).
Studi degradasi mempunyai beberapa karakteristik : 1. Bentuk solid atau larutan.
2. Melibatkan kondisi dimana lebih tinggi dari tes akselerasi misalnya > 40oC ; kelembapan relatif =75%, pH tinggi atau rendah dan oksidasi.
3. Termasuk kondisi untuk analisis degradasi secara termolisis, hidrolisis, oksidasi, fotolisis dari bahan obat dan produk obat.
4. Diambil dari 1 batch material (Reynolds, Facchine, Mullaney, Alsante, Hatajik, Motto, 2002).
Tabel I. Kondisi dan periode waktu penyimpanan untuk uji stabilitas jangka lama dan dipercepat
K. Orde Reaksi Kimia
Orde reaksi kimia dapat menunjukkan bentuk dari profil konsentrasi-waktu dari obat atau produk obat, dimana tetapan kecepatan reaksi dapat ditentukan dari slopenya (Connors dkk, 1986).
Orde reaksi dapat ditentukan dengan beberapa metode, yaitu : 1. Metode substitusi
Data [D] dan T disubstitusikan ke dalam persamaan orde reaksi (orde 0, 1, 2). Jika harga k yang tetap konstan dalam batas-batas variasi percobaan, maka reaksi dianggap berjalan sesuai dengan orde tersebut (Martin, Swarbrick, Cammarata, 1993).
2. Metode grafik
Pada metode ini diplot dari berbagai fungsi konsentrasi (ordinat) terhadap waktu (absis). Reaksi mengikuti orde-nol jika konsentrasi diplot terhadap
t dan didapatkan garis lurus, reaksi adalah orde-pertama bila log (a – x) terhadap t
menghasilkan garis lurus, reaksi adalah orde-kedua bila 1/(a – x) diplot terhadap t
(jika konsentrasi mula-mula sama) akan memberikan garis lurus (Martin dkk, 1993).
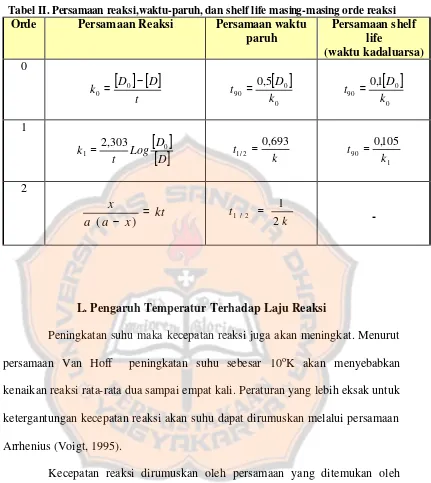
Tabel II. Persamaan reaksi,waktu-paruh, dan shelf life masing-masing orde reaksi
Orde Persamaan Reaksi Persamaan waktu paruh
L. Pengaruh Temperatur Terhadap Laju Reaksi
Peningkatan suhu maka kecepatan reaksi juga akan meningkat. Menurut persamaan Van Hoff peningkatan suhu sebesar 10oK akan menyebabkan kenaikan reaksi rata-rata dua sampai empat kali. Peraturan yang lebih eksak untuk ketergantungan kecepatan reaksi akan suhu dapat dirumuskan melalui persamaan Arrhenius (Voigt, 1995).
Kecepatan reaksi dirumuskan oleh persamaan yang ditemukan oleh Arrhenius.
A= Faktor Frekuensi, Faktor jumlah tumbukan R = Konstanta gas universal
T = Suhu mutlak (K)
e = Basis logaritmik naturalis (2,718)
k = Konstanta kecepatan reaksi (Voigt, 1995).
Untuk menentukan ketergantungan kecepatan reaksi terhadap suhu maka harga k dapat ditentukan dari berbagai suhu dimana minimal tiga peringkat suhu (Voigt, 1995). Kecepatan reaksi kimia tergantung pada jumlah terjadinya tumbukan dua molekul atau atom yang kemudian menghasilkan produk. Peningkatan temperatur akan menyebabkan peningkatan tumbukan sehingga terjadi peningkatan kecepatan reaksi (Connors dkk, 1986).
M. Analisis Kestabilan Yang Dipercepat
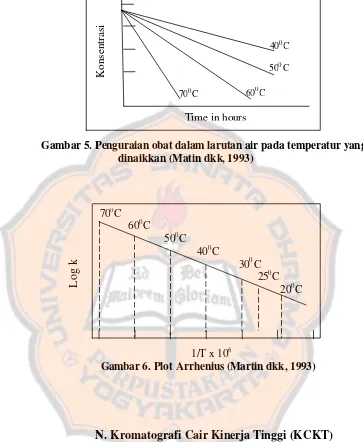
Nilai k untuk penguraian obat dalam larutan pada berbagai temperatur yang dinaikkan diperoleh dengan memplot beberapa fungsi konsentrasi terhadap waktu, seperti yang terlihat pada gambar 5. Logaritma laju penguraian kemudian diplot terhadap kebalikan dari temperatur mutlak seperti yang terlihat pada gambar 6 dan hasil berupa garis lurus diekstrapolasi sampai temperatur ruang, dimana k25ºC digunakan untuk memperoleh kestabilan obat pada kondisi
Gambar 5. Penguraian obat dalam larutan air pada temperatur yang dinaikkan (Matin dkk, 1993)
1/T x 106
Gambar 6. Plot Arrhenius (Martin dkk, 1993)
N. Kromatografi Cair Kinerja Tinggi (KCKT)
Teori yang mendasari KCKT adalah teori kromatografi cair. Prinsip kerja dari kromatografi cair kinerja tinggi adalah pemisahan komponen-komponen sampel dengan cara melewatkan sampel pada suatu kolom, sehingga ada komponen yang ditahan lebih kuat dan ada yang ditahan lebih lemah oleh kolom atau fase diam. Untuk yang ditahan lebih lemah maka akan keluar dari kolom
lebih cepat dan yang ditahan lebih kuat akan keluar lebih akhir. Setelah sampel terpisah dan keluar dari kolom maka komponen sampel akan masuk ke dalam suatu detektor. Detektor akan mengukur kadar masing- masing komponen yang responnya diolah oleh prosesor dan ditampilkan oleh detektor dalam suatu kromatogram. Pada dasarnya adalah membandingkan respon dari komponen sampel dengan respon dari larutan standar. Analisis dengan menggunakan KCKT diperlukan standar yang benar-benar murni atau disebut HPLC grade (Khopkar, 1990).
Detektor yang digunakan untuk sesuai dengan zat yang dianalisis. Salah satu detektor dari KCKT adalah detektor UV (ultraviolet), prinsip kerja dari detektor ini adalah spektrofotometri ultraviolet dan sampel yang dianalis harus menyerap sinar UV setelah sampel melewati kolom lalu melewati flow cell. Intensitas sinar yang keluar akan lebih kecil dari sinar yang masuk karena ada yang diabsorbsi oleh sampel. Besarnya absorbsi yang dinyatakan dengan ukuran absorban sebanding dengan kadar zat yang dianalisis. Detektor ini sifatnya spesifik yang artinya hanya dapat digunakan untuk zat- zat yang menyerap sinar UV (Mulja dan Suharman, 1995).
Proses pemisahan dalam kolom untuk kromatografi partisi yaitu fase diam yang digunakan adalah fase terikat yang berupa lapisan tipis menyerupai film yang dilapisi silika. Fase terikat yang paling banyak digunakan adalah C18
pemisahannya adalah partisi zat terlarut (sampel) diantara fase gerak dan fase diam (Mulj a dan Suharman, 1995).
O. Keterangan Empiris
Perubahan bentuk sediaan dan kemasan akan mempengaruhi stabilitas dari obat dan sediaan obat. Perlu dilakukan uji stabilitas terhadap sediaan obat untuk menentukan kondisi penyimpanan yang cocok dan pencantuman tanggal kadaluarsa sebagai kontrol terhadap kualitas dan keamanan.
Untuk sediaan yang diracik atau dikemas ulang harus mencantumkan
25 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian tentang uji stabilitas sediaan racikan pulveres campuran parasetamol dan fenobarbital ini termasuk penelitian non eksperimental.
B. Variabel dan Definisi Operasional 1. Variabe l terkendali
Suhu oven yang digunakan untuk menyimpan racikan pulveres parasetamol dan fenobarbital.
2. Variabel tidak terkendali
Kelembapan dari kondisi penyimpanan, homogenitas campuran dan komposisi eksipien.
3. Definisi operasional
a. Sediaan racikan pulveres adalah sediaan racikan pulveres campuran parasetamol dan fenobarbital dari rumah sakit X .
b. Beyond use date adalah masa edar yang tercantum pada kemasan sediaan racikan ulang.
c. Expired date adalah masa edar yang tercantum pada kemasan sediaan awalnya atau dari pabrik.
d. Shelf life (t90) adalah waktu dimana kadar zat aktif dari suatu sediaan obat
C. Bahan atau Materi Penelitian
Parasetamol standar (baku pembanding), fenobarbital standar (baku pembanding), racikan pulveres dari rumah sakit X yang berisi 1/3 tablet parasetamol (Indofarma (500 mg parasetamol)) dan 15 mg fenobarbital (Kimia Farma (30 mg fenobarbital)), metanol pro analisis (E.Merck), aqua bidestilata (laboratorium kimia organik, Fakultas Farmasi Universitas Sanata Dharma), dinatrium hidroksi fosfat, asam asetat glassial.
D. Alat-alat Penelitian
Sistem KCKT merk Shimadzu, kolom oktadesilsilan merk Waters BondapacT M C18 (panjang 30 cm), seperangkat komputer merk COMPAQ, syringe, alat degassing, vakum, penyaring Whatman, membrane Filter Holder, penyaring milipore, mikropipet Socorex, neraca analitik merk Scaltec, alat-alat gelas, oven, termometer.
E. Tata Cara Penelitian 1. Pembuatan fase gerak dan buffer
Fase gerak yang digunakan dalam penelitian ini menggunakan campuran metanol p.a dan buffer fosfat pH 3,20 dengan perbandingan 10 : 90 v/v. Untuk pembuatan buffer, dilarutkan 7,50 gram Na2HPO4 dalam 500,0 mL aquabidest
Masing- masing perbandingan fase gerak dibuat dalam labu takar 1000,0 ml kemudian digojog dan disaring dengan penyaring Whatman anorganik dengan bantuan pompa vakum. Fase gerak kemudian didegassing selama 15 menit.
2. Pembuatan larutan baku parasetamol dan natrium fenobarbital
a. Pembuatan larutan stok parasetamol. Ditimbang kurang lebih seksama 50 mg serbuk parasetamol dan dilarutkan dengan 3,0 ml metanol p.a kemudian ditambah buffer fosfat pH 3,20 dalam labu ukur 10,00 ml sampai tanda.
b. Pembuatan larutan intermediet parasetamol. Diambil 5,0 ml larutan stok dalam labu ukur 10,00 ml dan diencerkan dengan buffer fosfat pH 3,20 sampai tanda.
c. Pembuatan larutan stok natrium fenobarbital. Ditimbang kurang lebih seksama 55 mg serbuk natrium fenobarbital dan dilarutkan dengan 5,0 ml metanol p.a kemudian ditambah dengan buffer fosfat pH 3,20 dalam labu ukur 25,00 ml sampai tanda.
e. Pembuatan seri kurva baku fenobarbital. Dipipet sebanyak 2,30; 2,80; 3,40 dan 4,00 ml larutan stok natrium fenobarbital. Larutan stok fenobarbital digunakan sebagai seri kurva baku ke-5. Masing- masing larutan tersebut kemudian diencerkan dengan buffer fosfat pH 3,20 dalam labu takar 5,00 ml sampai tanda, sehingga diperoleh 5 seri larutan baku natrium fenobarbital (1,01; 1,25; 1,5; 1,75 dan 2,2mg/ml). Disaring dengan milipore dan didegassing selama 15 menit. Replikasi dilakukan sebanyak 3 kali.
3. Pengambilan Sampel Racikan Pulveres
Pemilihan sampel racikan pulveres campuran parasetamol dan fenobarbitaldari rumah sakit X dengan dosis 1/3 tablet parasetamol dan 15 mg fenobarbital berdasarkan pada nomor batch yang sama.
4. Uji Stabilitas Kimia
a. Kondisi uji. Uji stabilitas kimia sediaan racikan pulveres campuran parasetamol dan fenobarbital dilakukan dengan uji stabilitas dipercepat pada 3 peringkat suhu berbeda. Sampel racikan pulveres disimpan dalam oven pada suhu 40°C, 50°C dan 60°C ± 2°C dan dilakukan pemeriksaan stabilitas kimia dengan cara penetapan kadar fenobarbital dan parasetamol selama 7 hari.
minggu). Sebanyak 3 sampel (3 bungkus pulveres) dari 3 peringkat suhu berbeda yaitu suhu 40°C, 50°C dan 60°C ± 2°C diukur kadar fenobarbital dan parasetamol tiap hari.
1) Penetapan kadar fenobarbital
Setiap bungkus pulveres ditimbang, digerus dan dilarutkan dengan metanol p.a sebanyak 3,0 ml dan ditambahkan buffer fosfat pH 3,20 dalam labu takar 10,00 ml. Kemudian dipindahkan ke dalam tabung sentrifuge dan disentrifuge dengan kecepatan 3000 rpm selama 20 menit. Cairan yang bening diambil, disaring dengan milipore dan didegassing selama 15 menit. Kemudian sebanyak 50,0 µl larutan disuntikkan ke dalam sistem KCKT dengan kolom ODS (5 mm x 30 cm) menggunakan fase gerak dan kecepatan alir hasil optimasi. Kemudian mengamati kromatogram fenobarbital yang terjadi pada panjang gelombang pengamatan.
2) Penetapan kadar parasetamol
F. Analisis Data
Untuk penentuan beyond use date dengan menggunakan 3 peringkat suhu, data hasil penetapan kadar parasetamol dan fenobarbital dari sampel racikan pulveres kemudian digunakan untuk mengetahui orde reaksi dan kecepatan degradasi parasetamol dan fenobarbital pada berbagai suhu percobaan yaitu 40°C, 50°C dan 60°C. Dengan menggunakan persamaan Arrhenius dapat diketahui kecepatan degradasi pada suhu kamar (25°C) dan besarnya energi aktivasi yang menyertai proses degradasi tersebut. Selanjut nya dapat dihitung waktu kadaluarsa (t90) parasetamol dan fenobarbital masing- masing. Beyond use date (masa edar)
dari racikan pulveres ditentukan berdasarkan waktu kadaluarsa (t90) yang lebih
singkat.
Untuk penentuan beyond use date dengan menggunakan 1 peringkat suhu, hanya digunakan data kadar parasetamol dan fenobarbital dalam racikan pulveres pada suhu 40°C. Racikan pulveres dinyatakan stabil jika tidak terjadi penurunan kadar parasetamol dan fenobarbital lebih dari 10% (Anonim, 1995).
Untuk penentuan beyond use date berdasarkan sisa 25 % expired date
31 BAB IV
HASIL DAN PEMBAHASAN
A. Optimasi Penetapan Kadar Parasetamol dan Fenobarbital dengan Menggunakan Metode Kromatografi Cair Kinerja Tinggi (KCKT)
1. Sistem KCKT
Penetapan kadar parasetamol dan fenobarbital dalam sampel racikan pulveres untuk penentuan kurva baku dan uji stabilitas kimia menggunakan metode kromatografi cair kinerja tinggi (KCKT). Optimasi penetapan kadar parasetamol dan fenobarbital dalam sampel racikan pulveres untuk penelitian ini adalah mengacu ke hasil penelitian yang sudah dilakukan oleh Lissanta (2007) tentang optimasi dan validasi pemisahan dan penetapan kadar campuran parasetamol dan natrium fenobarbital dengan metode kromatografi cair kinerja tinggi (KCKT).
Sistem KCKT yang digunakan untuk optimasi penetapan kadar parasetamol dan fenobarbital pada penelitian tersebut adalah sistem KCKT Shimadzu dengan fase terbalik yaitu dengan menggunakan fase diam kolom ODS C18 Waters BondapacT M
panjang 30 cm yang bersifat non polar dan fase gerak campuran buffer fosfat pH 3,2 dan metanol p.a dengan perbandingan masing- masing 90 : 10 v/v yang bersifat polar. Flow rate yang digunakan dengan kecepatan 1,5 ml/menit, detektor UV-Vis
Berdasarkan hasil penelitian tersebut (Lissanta, 2007) disimpulkan bahwa sistem KCKT tersebut sudah memenuhi parameter validitas metode analisis untuk untuk penetapan kadar campuran parasetamol dan fenobarbital.
Fase gerak yang digunakan adalah campuran buffer fosfat pH 3,2 dan metanol p.a dengan perbandingan masing- masing- masing 90 : 10 v/v. Penggunaan perbandingan tersebut karena berdasarkan hasil optimasi dengan perbandingan yang lain diperoleh perbandingan 90 : 10 v/v antara buffer fosfat pH 3,2 dan metanol p.a mempunyai resolusi pemisahan yang paling baik yaitu = 1,5. Dimana resolusi merupakan suatu pemisahan yang nyata antara dua kromatogram yang berdekatan. Suatu pemisahan yang baik jika memiliki resolusi yang lebih dari atau sama dengan 1,5.
penyimpanan sehingga kemungkinan akan mempengaruhi hasil dan kualitas kromatografi dan larutan buffer sendiri yang mudah ditumbuhi oleh mikroba.
Penggunaan flow rate 1,5 ml/menit karena dari hasil optimasi pada kecepatan alir tersebut diperoleh tingkat reprodusibilitas resolusi pemisahan paling baik dan waktu retensi natrium fenobarbital yang lebih singkat.
Pada sistem KCKT tersebut digunakan detektor UV-Vis karena parasetamol dan fenobarbital mempunyai gugus kromofor yang bisa menyerap radiasi ultraviolet. Penggunaan panjang gelombang pengamatan 236 nm berdasarkan hasil overlapping antara panjang gelombang maksimum parasetamol dan panjang gelombang maksimum natrium fenobarbital. Panjang gelombang maksimum dari parsetamol adalah 245 nm dan panjang gelombang maksimum dari natrium fenobarbital adalah 236 nm. Akan tetapi karena panjang gelombang hasil
overlapping lebih besar dari panjang gelombang maksimum natrium fenobarbital maka panjang gelombang pengamatan yang digunakan adalah 236 nm supaya kadar fenobarbital dalam sampel tetap terbaca mengingat sampel yang digunakan mempunyai perbandingan fenobarbital yang lebih kecil dari parasetamol yaitu 1 : 11.
2. Kurva baku parasetamol
tersebut, parasetamol memiliki konsentrasi yang terlalu besar maka dilakukan pengenceran sebanyak 80 kali. Dengan demikian konsentrasi sampel parasetamol merupakan konsentrasi tengah dari kurva baku supaya persamaan kurva baku yang diperoleh nantinya dapat digunakan untuk menetapkan kadar sampel.
Larutan baku parasetamol dilarutkan dengan menggunakan pelarut metanol p.a dan ditambahkan buffer fosfat pH 3,2. Penggunaan pelarut tersebut memenuhi syarat pelarut yang dapat digunakan dalam sistem KCKT yaitu dapat bercampur dengan fase gerak, memiliki kemurnian yang tinggi, serta mudah terelusi. Parasetamol dilarutkan terlebih dahulu menggunakan metanol p.a karena parasetamol bersifat mudah larut dalam metanol.
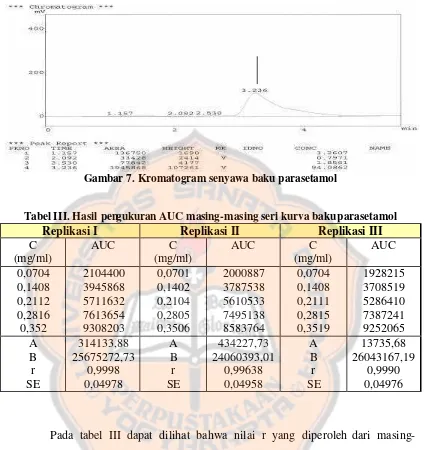
Dari kromatogram baku parasetamol (gambar 7) dapat dilihat bahwa waktu retensi dari parasetamol adalah sekitar 3,236 menit. Waktu retensi adalah waktu yang diperlukan oleh suatu senyawa untuk melintasi sepanjang kolom. Waktu retensi dari parasetamol lebih singkat dari waktu retensi fenobarbital karena parasetamol mempunyai gugus non polar yang lebih sedikit dibandingkan dengan fenobarbital sehingga tidak tertahan lebih lama oleh fase diam yang bersifat non polar dan akan lebih cepat keluar dari kolom.
Gambar 7. Kromatogram senyawa baku parasetamol
Tabel III. Hasil pengukuran AUC masing-masing seri kurva baku parasetamol
Replikasi I Replikasi II Replikasi III C
kurva baku yang dibuat menyatakan hubungan linier antara konsentrasi dan luas area di bawah kurva (AUC) yang dihasilkan. Dari kurva baku replikasi I didapatkan persamaan kurva baku yaitu : y = 25675272,73 x + 314133,88.
3. Kurva baku fenobarbital
Kurva baku fenobarbital sebanyak 5 seri dan replikasi 3 kali dengan konsentrasi masing- masing 1,01 mg/ml; 1,23 mg/ml; 1,50 mg/ml; 1,76 mg/ml; dan 2,2 mg/ml. Pembuatan seri larutan baku ini karena konsentrasi fenobarbital dalam sampel racikan pulveres adalah 1,5 mg/ml, sehingga konsentrasi sampel fenobarbital merupakan konsentrasi tengah dari kurva baku supaya persamaan kurva baku yang diperoleh nantinya dapat digunakan untuk menetapkan kadar sampel. Larutan baku fenobarbital juga dilarutkan dengan menggunakan pelarut metanol p.a dan ditambahkan buffer fosfat pH 3,2.
Dari kromatogram baku fenobarbital (Gambar 8) dapat dilihat bahwa waktu retensi dari fenobarbital adalah sekitar 8,525 menit. Waktu retensi dari fenobarbital lebih lama dari parasetamol karena fenobarbital mempunyai gugus non polar yang lebih banyak sehingga akan tertahan lebih lama oleh fase diam yang bersifat non polar.
Gambar 8. Kromatogram senyawa baku fenobarbital
Tabel IV. Hasil pengukuran AUC masing -masing seri kurva baku fenobarbital
Replikasi I Replikasi II Replikasi III C
B. Penentuan Beyond Use Date (Masa Edar) Sediaan Racikan Pulveres
1. Pemilihan Sampel racikan pulveres
Sampel racikan pulveres yang digunakan adalah campuran parasetamol dan fenobarbital dengan dosis 1/3 tablet parasetamol (Indofarma, (500 mg)) dan 15 mg fenobarbital (Kimia Farma, (30 mg)) hasil racikan dari rumah sakit X. Sampel racikan pulveres tersebut tidak dilakukan penambahan zat tambahan lain lagi. Sampel yang digunakan adalah sampel yang berasal dari batch yang sama dengan tujuan untuk mendapatkan kondisi yang sama dari semua sampel dan pengambilan sampel langsung pada hari pembuatan racikan pulveres tersebut di rumah sakit X. Jumlah racikan pulveres dalam 1 batch pembuatan di rumah sakit X adalah sebanyak 120 bungkus pulveres.
2. Preparasi sampel
Sampel racikan pulveres sebelum dilakukan penetapan kadar parasetamol dan fenobarbital digerus terlebih dahulu dengan menggunakan mortir untuk memperkecil ukuran serbuk pulveres yang belum halus sehingga lebih cepat larut. Serbuk pulveres yang sudah digerus kemudian dilarutkan dengan menggunakan metanol p.a karena parasetamol dan fenobarbital mempunyai sifat yang mudah larut dalam metanol. Setelah dilarutkan dengan metanol p.a selanjutnya ditambahkan buffer fosfat pH 3,2 sampai tanda. Larutan sampel kemudian disentifuge dengan kecepatan 3000 rpm selama 20 menit untuk mempercepat pengendapan serbuk yang tidak larut yang akan mempermudah dalam penyaringan sampel sebelum dilakukan penyuntikan dalam sistem KCKT.
Untuk penetapan kadar parasetamol dari sampel racikan pulveres hanya diambil 0,1250 ml dari sampel yang disentrifuge. Hal ini dilakukan untuk menghindari peak dari parasetamol yang terlalu besar sehingga tidak terbaca di kromatogramnya.
3. Penentuan beyond use date (masa edar) sediaan racikan pulveres dengan menggunakan 3 peringkat suhu
perbedaan suhunya tidak boleh terlalu ekstrim (Reynolds dkk, 2002). Suhu penyimpanan tidak boleh terlalu ekstrim supaya tetap mencerminkan kondisi penyimpanan pada umumnya dan mencegah hilangnya lembab karena suhu terlalu tinggi sehingga membuat obat seolah-olah stabil. Selain itu untuk uji stabilitas sediaan padat dengan menggunakan uji stabilitas dipercepat (peningkatan suhu) biasanya digunakan peringkat suhu 40oC, 50oC dan 60oC (Lieberman, 1990). Dengan menggunakan 3 peringkat suhu ini akan diperoleh hubungan linear antara kecepatan degradasi dan suhu sehingga dapat digunakan untuk menentukan kecepatan degradasi pada suhu kamar (25oC).
Lama pemanasan sampel racikan pulveres untuk penentuan beyond use date (masa edar) selama 7 hari karena untuk memprediksi stabilitas suatu sediaan selama 6 bulan ke depan maka pemanasan sampel dilakukan selama 1 bulan dengan metode uji stabiltas dipercepat (K upiec, 2003), maka untuk memprediksi stabilitas dari sediaan racikan pulveres selama 1 bulan ke depan dapat dilakukan uji stabilitas dipercepat selama 7 hari. Stabilitas/beyond use date yang diprediksi hanya untuk selama 1 bulan ke depan karena sampel racikan pulveres campuran obat parasetamol dan fenobarbital tersebut di rumah sakit X diresepkan paling lama digunakan selama 1 bulan.
a. Hasil penetapan kadar parasetamol dalam sampel racikan pulveres. Hasil penetapan kadar parasetamol dalam sampel racikan pulveres yang dilakukan untuk masing- masing suhu percobaan dapat dilihat dalam tabel V, VI dan VII. Kromatogram parasetamol dari sampel racikan pulveres setelah pemanasan selama 7 hari pada suhu 40oC, 50oC dan 60oC dapat dilihat di gambar 9, 10 dan 11. Berdasarkan kromatogram tersebut dapat dilihat waktu retensi parasetamol sampel racikan pulveres hampir sama dengan waktu retensi dari baku parasetamol.
Gambar 9. Kromatogram parasetamol sampel racikan pulveres setelah pemanasan selama 7 hari pada suhu 40oC
Gambar 11. Kromatogram parasetamol sampel racikan pulveres setelah pemanasan selama 7 hari pada suhu 60oC
Tabel V. Hasil penetapan kadar parasetamol dalam sampel racikan pulveres pada suhu 40oC selama 7 hari
Tabel VII. Hasil penetapan kadar parasetamol dalam sampel racikan pulveres pada
Gambar 12. Grafik kadar parasetamol dalam sampel racikan pulveres selama 7 hari pada masing-masing peringkat suhu
Gambar 13. Kromatogram fenobarbital sampel racikan pulveres setelah pemanasan selama 7 hari pada suhu 40oC
Gambar 14. Kromatogram fenobarbital sampel racikan pulveres setelah pemanasan selama 7 hari pada suhu 50oC
Tabel VIII. Hasil penetapan kadar fenobarbital dalam sampel racikan pulveres pada suhu 40oC selama 7 hari
Kadar fenobarbital (%B/B) Hari
Tabel IX. Hasil penetapan kadar fenobarbital dalam sampel racikan pulveres pada suhu 50oC selama 7 hari
Kadar fenobarbital (%B/B) Hari
0.00
Gambar 16. Grafik kadar fenobarbital dalam sampel X selama 7 hari pada masing-masing peringkat suhu
c. Penentuan orde reaksi parasetamol dan fenobarbital. Pada umumnya stabilitas diperhitungkan dengan mengolah data kinetika reaksi degradasi dari obat/sediaan obat yang dikenal dengan istilah orde reaksi. Kinetika reaksi dapat memprediksi kemungkinan terjadinya perubahan efek terapi dari suatu obat karena adanya perubahan kadar obat. Penentuan tanggal kadaluarsa terhadap produk obat umumnya berdasarkan asumsi kinetika orde 0 atau orde 1 (Connors dkk,1986). Dalam kinetika reaksi orde 0, kecepatan degradasi obat tidak tergantung kepada konsentrasi reaktan. Untuk kinetika orde 1, kecepatan degradasi obat tergantung pada konsentrasi 1 reaktan. Oleh karena itu perlu dilakukan penentuan kinetika reaksi degradasi dari parasetamol dan fenobarbital dalam sampel racikan pulveres. Untuk mengetahui parasetamol dan fenobarbital mengikuti kinetika orde reaksi yang mana maka dilakukan penentuan orde reaksi dari parasetamol dan fenobarbital dengan menggunakan metode grafik.
dilakukan dengan memplotkan fungsi waktu dan kadar, dimana harga slope dari plot tersebut menujukkan kecepatan degradasi dari obat. Selanjutnya membandingkan parameter nilai r hasil regresi linear dari masing- masing persamaan orde reaksi yaitu orde 0 dengan plot fungsi waktu vs kadar, orde 1 dengan plot fungsi waktu vs ln kadar dan orde 2 dengan plot fungsi waktu vs 1/kadar.
Hasil perhitungan regresi linear parasetamol dan fenobarbital masing-masing orde reaksi pada suhu 40oC, 50oC dan 60oC dapat dilihat di tabel XI dan XII.
Tabel XI. Hasil perhitungan regresi linier dari parasetamol masing -masing orde reaksi pada suhu 40oC, 50 oC dan 60 oC selama 7 hari
Tabel XII. Hasil perhitungan regresi linier dari fenobarbital masing-masing orde reaksi pada suhu 40 oC, 50 oC dan 60 oC selama 7 hari
dalam sampel racikan pulveres setelah mengalami pemanasan selama 7 hari mengikuti kinetika orde reaksi 1 karena nilai r dari orde 1 (waktu vs ln kadar) lebih mendekati ±1. Laju degradasi fenobarbital dalam sampel racikan pulveres setelah mengalami pemasan selama 7 hari mengikuti kinetika reaksi orde 0 karena nilai r dari orde 0 (waktu vs kadar) lebih mendekati ±1. Oleh karena itu kecepatan degradasi dari parasetamol masing- masing peringkat suhu ditentukan berdasarkan nilai slope kinetika reaksi pada orde 1 sedangkan kecepatan degradasi dari fenobarbital masing- masing peringkat suhu ditentukan berdasarkan nilai slope kinetika reaksi pada orde 0. Akan tetapi nilai r dari waktu vs ln kadar parasetamol dan nilai r dari waktu vs kadar fenobarbital lebih kecil dari r tabel (0,707 dengan tingkat signifikansi 95%). Hal ini mungkin terjadi karena parasetamol dan fenobarbital dalam sampel racikan pulveres dengan pemanasan selama 7 hari masih di lag fase dan belum mencapai fase akselerasi sehingga belum memberikan hubungan yang linear antara lama pemanasan dan kadar. Faktor lain yang mungkin menjadi penyebab nilai r lebih kecil dari r tabel karena adanya pengaruh dari variabel yang tidak terkendali.
Tabel XIII. Kecepatan degradasi parasetamol pada berbagai suhu percobaan
Suhu (oC) Kecepatan degradasi(/hari)
40 -0,0129
50 -0,0131
60 -0,0193
Berdasarkan data kecepatan degradasi parasetamol pada masing- masing peringkat suhu dilakukan perhitungan dengan menggunakan persamaan Arrhenius yaitu log k = log A – Ea/2,303.R.T, dimana dari perhitungan tersebut dapat diketahui energi aktivasi yang diperlukan untuk terjadinya degradasi dan kecepatan degradasi pada suhu kamar (25oC).
Tabel XIV. Hasil perhitungan 1/T(10-3) (oK) dan log k parasetamol
Suhu (oK) 1/T(10-3) (oK) k(/hari) Log k
313 3,1949 0,0129 -1,8894
323 3,0959 0,0131 -1,8827
333 3,0030 0,0193 -1,7144
1). Kecepatan degradasi parasetamol pada suhu 25oC
Ekstrapolasi persamaan garis regresi linier hubungan antara 1/T(10-3) dan log k (plot Arrhenius) parasetamol dapat digunakan untuk menentukan kecepatan degradasi parasetamol pada suhu kamar (25oC).
Tabel XV. Hasil regresi linear hubungan antara 1/T dan log k parasetamol
A = 0,9677 B = -902,7064 r = -0,8736
Y = Bx + A
= -902,7064x + 0,9677
= -0,9027. 0,003356 + 0,9677 = -2,0618
Kecepatan degradasi parasetamol pada suhu 25oC (anti log k) yaitu : 8,6739x10-3/hari.
2). Penentuan energi aktivasi parasetamol
Suatu reaksi dari reaktan sebelum membentuk produk maka akan melalui suatu tahap yaitu tahap transisi yang mempunyai energi lebih besar dari awalnya sehingga produk tidak terbentuk secara langsung. Oleh karena itu diperlukan penghitungan besarnya energi aktivasi untuk mencapai tahap transisi tersebut.
Penentuan energi aktivasi dengan menggunakan plot Arrhenius yaitu dimana harga slope dari ekstrapolasi persamaan garis linear hubungan antara 1/T(10-3) dan log k dari masing- masing peringkat suhu menggambarkan fungsi –Ea/2,303.R.
Hasil perhitungan ene rgi aktivasi parasetamol yaitu : Slope = - Ea / 2,303 x R
Ea = -902,7064 x 2,303 x 1,987 = -4,1308 kkal/mol
3). Perhitungan waktu kadaluarsa (t90) dari parasetamol
Untuk menentukan beyond use date (masa edar) parasetamol dalam sampel racikan pulveres dilakukan pendekatan dengan melakukan perhitungan waktu kadaluarsa (t90) sesuai dengan orde reaksi yang sudah diketahui yaitu orde 1.
Dari kecepatan degradasi parasetamol pada suhu kamar (25oC) dilakukan perhitungan waktu kadaluarsa (t90) parasetamol pada suhu kamar (25oC). Waktu
kadaluarsa (t90) dari parasetamol dihitung dengan berdasarkan kinetika orde reaksi 1.
Hasil perhitungan waktu kadaluarsa (t90) dari parasetamol :
t90 = 0,105 / k25oC
= 0,105/8,6739 x 10-3 = 12,10 hari atau 12 hari
Sesuai dengan hasil perhitungan dapat disimpulkan bahwa waktu kadaluarsa dari parasetamol adalah 12 hari.
e. Analisis data obat fenobarbital dengan menggunakan persamaan Arrhenius. Kecepatan degradasi fenobarbital pada masing- masing peringkat suhu berdasarkan harga slope dari kinetika orde 0 yaitu hubungan antara waktu vs kadar. Kecepatan degradasi fenobarbital pada masing- masing peringkat suhu dapat dilihat ditabel XVI.
Dari data kecepatan degradasi fenobarbital pada masing- masing peringkat suhu (Tabel XVI) dapat dilihat bahwa kecepatan degradasi fenobarbital pada suhu 60oC lebih kecil dari kecepatan degradasi fenobarbital pada suhu 50oC. Menurut persamaan Arrhenius semakin tinggi suhu seharusnya kecepatan degradasi semakin meningkat. Oleh karena itu untuk fenobarbital tidak bisa ditentukan kecepatan degradasinya pada suhu kamar (250C), energi aktivasi dan waktu kadaluarsa (t90).
f. Penentuan beyond use date (masa edar) sampel racikan pulveres. Penentuan beyond use date (masa edar) racikan pulveres ditentukan dengan pendekatan pada waktu kadaluarsa (t90) dari parasetamol dan fenobarbital sesuai
dengan hasil perhitungan. Penentuan beyond use date (masa edar) dari sampel racikan pulveres adalah dengan memilih waktu kadaluarsa (t90) antara parasetamol
dan fenobarbital yang lebih singkat. Dari hasil perhitungan diperoleh waktu kadaluarsa parasetamol adalah 12 hari sedangkan untuk fenobarbital tidak bisa ditentukan waktu kadaluarsanya. Dengan demikian disimpulkan bahwa beyond use date (masa edar) dari sampel racikan pulveres campuran parasetamol dan fenobarbital hasil racikan rumah sakit X tidak bisa ditentukan karena waktu kaluarsa dari fenobarbital tidak bisa ditentukan.
4. Penentuan beyond use date (masa edar) sediaan racikan pulveres dengan menggunakan 1 peringkat suhu
kadaluarsa dari fenobarbital tidak bisa ditentukan, oleh karena itu digunakan 1 peringkat suhu untuk memprediksi kestabilan dari parasetamol dan fenobarbital dalam sampel racikan pulveres dari rumah sakit X.
Untuk memprediksi stabilitas kimia dari suatu sediaan obat dapat menggunakan uji stabilitas dipercepat yaitu pada suhu 40oC ± 2oC (Kupiec, 2003). Dengan pemanasan sampel racikan pulveres pada suhu 40oC ± 2oC selama 7 hari maka dapat dilakukan prediksi kestabilan parasetamol dan fenobarbital dalam sampel racikan pulveres selama 1 bulan. Secara umum suatu sediaan obat dikatakan stabil apabila tidak terjadi perubaha n kadar lebih besar dari 10% akan tetapi perlu diperhatikan lagi masing- masing monografi obat.
Tabel XVII. Kadar parasetamol dan fenobarbital dalam sampel racikan pulveres terhadap kadar awal selama 7 hari pada suhu 400C
Waktu (Hari) Kadar rata-rata parasetamol
setelah pemanasan pada suhu 40oC selama 7 hari tidak kurang dari 90% terhadap kadar awal.
Berdasarkan hasil penetapan kadar parasetamol dalam sampel racikan pulveres selama 7 hari pada suhu 40oC (tabel XVII) diperoleh range kadar rata-rata 83,09% - 110,74% dari konsentrasi awal (hari ke-0). Berdasarkan hasil tersebut terdapat kadar rata-rata dari parasetamol yang mengalami penurunan kadar lebih besar dari 10% terhadap kadar awal akan tetapi belum bisa disimpulkan bahwa parasetamol tidak stabil selama 1 bulan ke depan karena pada hari ke-2 justru terjadi peningkatan kadar lebih besar dari kadar pada hari ke-0. Peningkatan kadar ini terjadi mungkin karena kondisi dari sampel racikan pulveres yang tidak homogen. Dari hasil uji one way Annova dengan tingkat kepercayaan 95 % didapatkan hasil berbeda bermakna dari kadar parasetamol hari ke-0 sampai hari ke-7 sehingga tidak bisa disimpulkan kestabilan dari parasetamol
b. Stabilitas fenobarbital. Menurut Farmakope Indonesia Edisi IV, range kadar dari fenobarbital adalah 90% - 110%, jadi fenobarbital dalam sampel racikan pulveres dikatakan stabil apabila kadar fenobabital dalam sediaan racikan pulveres setelah pemanasan pada suhu 40oC selama 7 hari tidak kurang dari 90% terhadap kadar awal. Berdasarkan hasil penetapan kadar fenobarbital dalam sampel racikan pulveres selama 7 hari pada suhu 40oC diperoleh range konsentrasi rata-rata 73,87% - 95,40% dari kadar awal (hari ke-0).
hari ke-1 kadar fenobarbital justru turun paling besar. Penurunan kadar yang besar ini terjadi mungkin karena kondisi dari sampel racikan pulveres yang tidak homogen. Dari hasil uji one way Annova dengan tingkat kepercayaan 95% didapatkan hasil perbedaan bermakna dari kadar fenobarbital hari ke-0 sampai hari ke-7 sehingga tidak bisa disimpulkan kestabilan dari fenobarbital.
5. Penentuan beyond use date (masa edar) sediaan racikan pulveres dengan menggunakan 25% sisa expired date sediaan tabletnya atau 6 bulan
Apabila dalam penentuan beyond use date tidak terdapat data stabilitas dengan tes langsung dan tidak adanya literatur yang cocok dan spesifik maka penentuan beyond use date untuk sediaan nonaqueous liquids dan sediaan padat bisa selama 6 bulan atau 25% dari sisa expired date sediaan aslinya tergantung mana yang lebih singkat (Anonim, 2005(c)).
Beyond use date (masa edar) sediaan racikan pulveres tidak bisa ditentukan dengan menggunakan 3 peringkat suhu dan 1 peringkat suhu. Oleh karena itu dapat dilakukan penentuan beyond use date (masa edar) dari sampel racikan pulveres dengan perhitungan 25% dari sisa expired date sediaan aslinya atau selama 6 bulan tergantung mana yang lebih singkat. Expired date dari tablet fenobarbital (Kimia Farma (30 mg fenobarbital)) adalah sampai maret 2012 dan expired date dari tablet parasetamol (Indofarma(500 mg parasetamol)) adalah sampai April 2011. Sisa 25%